鲍鱼肌肉酶解产物对秀丽隐杆线虫的抗衰老作用研究
方案详情

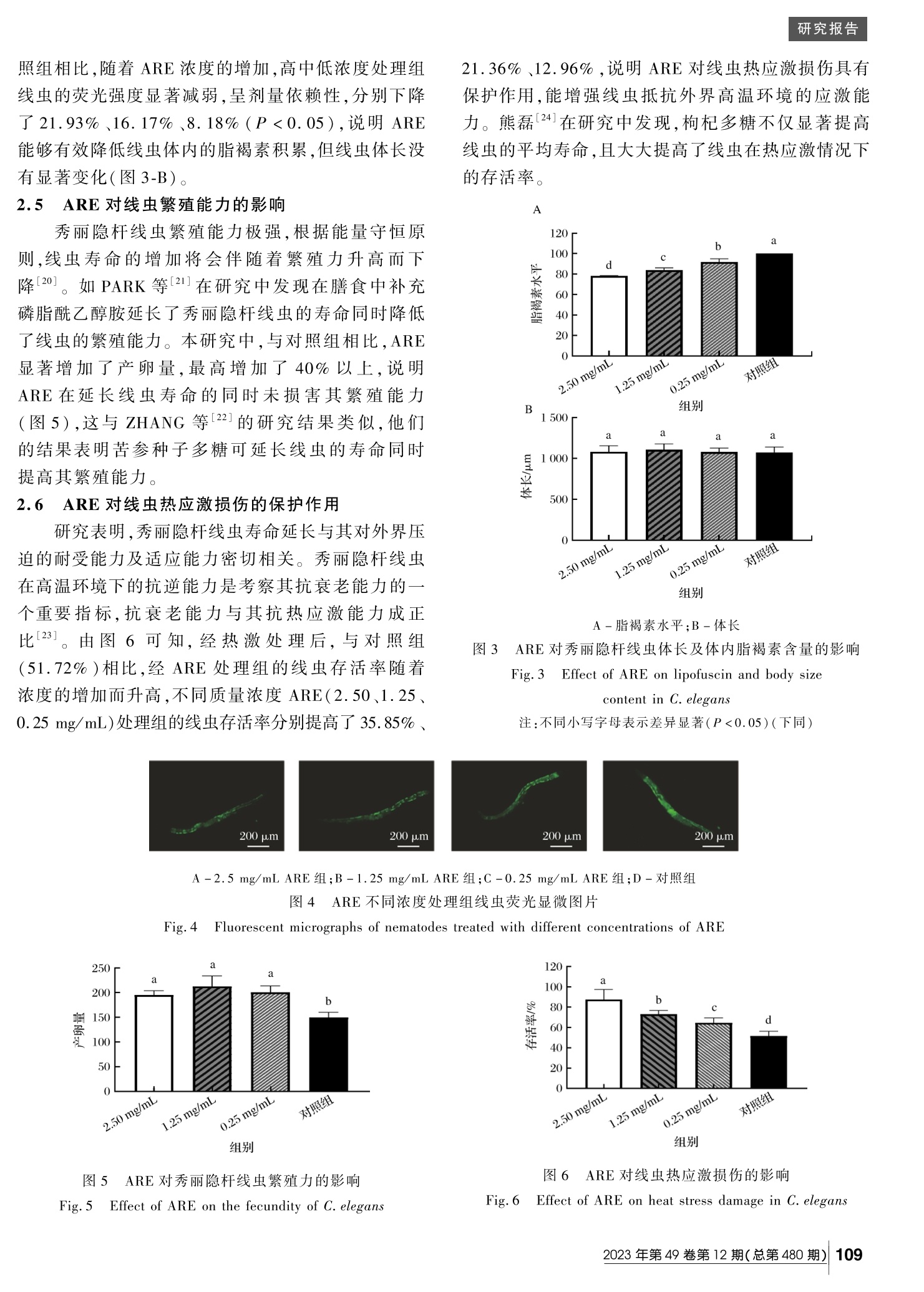
鲍鱼肌肉酶解产物对秀丽隐杆线虫的抗衰老作用研究食品与发酵工业 FOOD AND FERMENTATION INDUSTRIES 研究报告 DOI:10. 13995 / j. cnki. 11 - 1802 / ts. 035128 引用格式 :蔡佳琦 ,秦小明 ,卢虹玉 ,等 .鲍鱼肌肉酶解产物对秀丽隐杆线虫的抗衰老作用研究 [ J].食品与发酵工业 ,2023,49(12):106 - 112. CAI Jiaqi,QIN Xiaoming, LU Hongyu, et al. Anti-aging effect of Abalone muscle enzymatic hydrolysate on Caenorhabditis elegans [J]. Food and Fermentation Industries,2023,49(12):106 - 112. 鲍鱼肌肉酶解产物对秀丽隐杆线虫的抗衰老作用研究 蔡佳琦 1,秦小明 1,2∗,卢虹玉 1,2∗,叶琬祺 1,张桂芳 1,林海生 1,2,郑惠娜 1,2 1(广东海洋大学食品科技学院 ,广东省水产品加工与安全重点实验室 ,广东省海洋生物制品工程实验室 ,广东省海洋食品工程技术研究中心 ,水产品深加工广东普通高等学校重点实验室 ,广东湛江 ,524088)2(海洋食品精深加工关键技术省部共建协同创新中心 ,大连工业大学 ,辽宁大连 ,116034) 摘 要 该研究以鲍鱼为原料 ,制备鲍鱼肌肉酶解产物 (Abalone muscle water extract residue enzymatic product , ARE )并进行成分分析 。通过对秀丽隐杆线虫寿命 、运动能力 、体内脂褐素水平 、繁殖能力 、抗应激能力等的分析 测定 ,评价 ARE 抗衰老活性 。结果表明 ,ARE 主要成分为蛋白质 ;与对照组相比 ,高中低剂量的 ARE 均能显著 延长秀丽隐杆线虫的寿命 、提高线虫的运动能力 (A 型运动比例增加 )、降低体内脂褐素水平 ,其中最高剂量 ARE 处理组 (2. 50 mg/mL )的作用最强 ,上述指标水平分别改变了 17. 36% 、56. 66%和 21. 93% (P < 0. 05)。 ARE 能够提高线虫的抗应激能力 ,与对照组相比 ,2. 50 mg/mL ARE 处理组能够提高线虫热应激损伤存活率 35. 85% ,增加了百草枯氧化应激损伤线虫的平均寿命 25. 73% 。 ARE 提高了线虫体内抗氧化酶超氧化物岐化酶和谷胱 甘肽的水平 ,显著降低了线虫体内丙二醛含量 。另外 ,ARE 在延长寿命的同时提高了繁殖能力 。这些结果表明 ARE 具有较好的抗衰老活性 ,为开发鲍鱼功能性食品奠定了良好的基础 。 关键词 鲍鱼 ;酶解产物 ;秀丽隐杆线虫 ;抗衰老 ;氧化应激 鲍鱼又称 “腹鱼 ”、“海耳 ”,是一种原始的海洋贝 类 ,是海味八珍之一 ,因其肉质细嫩 ,味泽鲜美 ,被称 为海味之冠 。主要分布在我国福建 、山东 、广东海 域 [1],养殖产量逐年上升 ,传统的简单加工已不能满 足当前社会的需求 。鲍鱼营养价值极高 ,富含丰富的 氨基酸 、矿物质 [2],且种类齐全 ,是典型的高蛋白低 脂肪海洋食品 [3],同时也具有药用价值 ,《本草纲目 》中记载 ,鲍鱼性平 ,味甘 、咸 ,可明目补虚 、清热滋阴 、养血益胃 、补肝肾 [4]。现代食品药品领域研究发现 ,鲍鱼是开发海洋生物活性物质的重要生物来源 ,具有 抗炎 [4]、抗氧化 [5]、抗菌 [6]、抗肿瘤 [7]、降血脂 [8]、抗 动脉粥样硬化 [8]、免疫调节 [9]等多种活性 ,其活性成 分主要为多糖和多肽 ,本课题组前期研究中 ,以多种 海洋贝类为原料进行酶解工艺优化 [10],其中任鼎鼎 等 [9]以斑马鱼为动物模型验证了鲍鱼肌肉酶解产物 的抗氧化和免疫活性 。 衰老也称为老化 ,是一种随着年龄增长的自然退 行性变化 。随着科学的发展 ,人类寿命上升的同时也 伴随着老龄化社会问题的加剧 。因此抗衰老产品的 开发已大势所趋 。目前常见的抗衰老产品开发的原 料多来源于食品及药食用源植物食材 ,如苹果 、蓝莓 、铁皮石斛 、枸杞 、党参等 [11]。海洋生物由于其特殊的 生存环境 ,常具有高活性 、低毒性的特点 ,受到大量关 注 ,成为抗衰老研究与开发的重要资源 ,如牡蛎 、海参 等 [12 1 13]。目前虽未见鲍鱼抗衰老的相关研究报道 ,但其传统的保健功效及很多生物活性均与抗衰老密 切相关 ,如抗氧化和免疫调节等功效 。因此 ,深入系 统地研究鲍鱼的抗衰老作用为新型海洋抗衰老产品 的研发提供依据 。 本研究在前期研究基础上 ,以秀丽隐杆线虫为动 物模型 ,对鲍鱼肌肉酶解产物影响线虫应激损伤和寿 命等进行研究 ,并确定其抗衰老的作用浓度 ,对鲍鱼 的精深加工和新型产品的开发具有重要意义 。 1 材料与方法 1.1 材料 、试剂与仪器 材料 :生鲜皱纹盘鲍 ,购于湛江市场 ;N2型秀丽 隐杆线虫和 OP50大肠杆菌 ,购于福建上源生物科学 技术有限公司 ; 试剂 :动物蛋白酶 、风味蛋白酶 (食品级 ),广西南 第一作者 :硕士研究生 (秦小明教授和卢虹玉副教授为共同通信作者 ,E-mail:qinxm@ gdou. edu. cn;irislhy@ 126. com) 基金项目 :财政部和农业农村部国家现代农业产业技术体系资助 ( CARS-49) 收稿日期 :2023-02-14,改回日期 :2023-03-15 宁庞博生物工程有限公司 ;次氯酸钠 ,上海易恩化学技 术有限公司 ;NGM 培养基 ,山东拓普生物工程有限公 司 ;LB 肉汤 ,青岛海博生物技术有限公司 ;LB 琼脂 ,广 东环凯微生物科技有限公司 ;盐酸左旋咪唑 ,上海麦克 林生化科技有限公司 ;琼脂糖 ,翌圣生物科技有限公司 。 仪器与设备 :Thermo Lynx 6000高速落地离心 机 ,美国 Thermo Fisher Scientific 公司 ;HH-8CJ 恒温 磁力搅拌水浴锅 ,常州市金坛友联仪器研究所 ;EYE-LA 旋转蒸发仪 ,日本 EYELA 公司 ;SRL-7045体式显 微镜 ,北京天诺翔科学仪器有限公司 ;B60F 生物正置 显微镜 ,广州道一科学技术有限公司 。 1.2 实验方法 1.2.1 鲍鱼肌肉酶解产物 (Abalone muscle waterex-tractresidue enzymatic product ,ARE )制备 将新鲜鲍鱼去壳去内脏 ,去除表面黑渍 ,洗净后 沥干水分分装 , -80 ℃贮存备用 。酶解方法根据参 考文献稍作修改 [9],主要步骤如下 :鲍鱼解冻后吸干 表面水分 ,切粒 ,加入超纯水 (1∶4,g∶mL)打浆 ,100 ℃蒸煮 1 h,200目纱布过滤后取滤渣 ,各加入 0.3%(质 量分数 )的动物蛋白酶和风味蛋白酶 ,于 53 ℃恒温 水浴锅中酶解 4 h,100 ℃灭酶 10 min,迅速冷却后 ,4 ℃离心 (8 000 r / min)20 min,取上清液 ,过滤收集 上清液 ,45 ℃真空旋转蒸发浓缩 ,冷冻干燥得鲍鱼肌 肉酶解提取物 ,即 ARE, -80 ℃贮存 。 1.2.2 一般营养成分分析 对 ARE 进行一般营养成分分析 ,蛋白质测定参 考 GB 5009.5—2016采用凯氏定氮法 ;总糖测定参考 GB/T 9695.31—2008采用硫酸 -苯酚法 ;脂肪测定参 考 GB 5009.6—2016采用索氏抽提法 ;灰分测定参考 GB 5009.4—2016采用高温灼烧法 ;水分测定参考 GB 5009.3—2016采用直接干燥法 。 1.2.3 线虫的培养和同期化 参考试剂说明 ,配制 NGM 培养基 ,高温高压灭 菌后 ,倒入 60 mm 培养皿 ,得到新鲜培养板 ,于培养 板上涂布有 200 μL 的 OP50菌液 ,晾干过夜培养 。次日 ,将线虫转移至新鲜食物板 ,于 20 ℃恒温培养箱 中培养 [14]。同期化采用高氯酸钠裂解法 [15]。用 M9缓冲液冲洗线虫培养基 ,将大量处于产卵期的秀丽隐 杆线虫收集至 EP 管中 ,静置 ,待线虫沉淀完全后 ,去 上清液 ,再加入 1 mL 现配裂解液 [V (H2 O) ∶ V (NaOH)∶V (NaClO) =8∶1∶1],振荡 3 min,离心 ,弃上 清液 ,加入 M9缓冲液清洗 3次 ,将洗涤后的虫卵转 移至含有 OP50的 NGM 培养基上 ,于 20 ℃培养 48 h,即完成同期化 。 1.2.4 ARE 对线虫寿命的影响 将同期化培养至 L4时期的线虫随机挑入涂布有 3种不同质量浓度的 ARE(与 OP50菌液以体积比 1∶1混合 ,终质量浓度分别为 2.50、1.25、0.25 mg / mL)培养 基中 ,以 LB 肉汤组作为空白对照 。期间若缺少食物或 者生长环境不佳 ,及时更换至新鲜 NGM 培养基板 ,每 个浓度设置 3个平行 ,每个平板不少于 30只线虫 ,置 于 20 ℃恒温培养箱中培养 ,每隔 24 h 记录线虫的存活 数 ,死亡数 ,消失数 ,直至线虫全部死亡 ,绘制生存曲线 。 1.2.5 ARE 对线虫运动能力的影响 收集同期化培养至 L4时期的线虫 ,实验分组及 处理同方法 1. 2. 4。在第 5、10、15天观察线虫的运 动能力 ,按分类标准记录每组线虫的运动情况 ,实验 重复 3次 。线虫的运动能力被分为 3个等级标准 ,分 别为 A,线虫自发而平稳地运动 ;B,线虫在受到刺激 时可运动 ;C,线虫在受到刺激时仅头部和尾部摆动 。 1.2.6 ARE 对线虫的体长及脂褐素的影响 收集同期化培养至 L4时期的线虫 ,按照方法 1.2.4处理 72 h 后 ,将各组线虫分别转移至准备好的琼脂糖 垫片上 ,滴加左旋盐酸咪唑碱溶液进行麻醉处理 ,每组 线虫不少于 15只 ,荧光显微镜观察并采集线虫图片 ,通 过 ImageJ 软件分析线虫体内脂褐素相对含量和体长 。 1.2.7 ARE 对线虫繁殖力的影响 将同期化培养至 L4时期的线虫随机挑入涂有不同 浓度 ARE 食物的培养板中 ,每个板放置 1只线虫 ,每组 数量不少于 10个 ,置于 20 ℃恒温培养 。每隔 24 h 将线 虫转移至新鲜培养板 ,同时统计旧板上的产卵数及幼 虫数量 ,直至线虫产卵期结束 ,统计产卵量总和 。 1.2.8 ARE 对线虫热应激损伤的影响 将同方法 1.2.4处理 72 h 的线虫转移至不含任何 食物的新鲜培养板中 ,每个板 30只 ,每组 3个平行 ,于 35 ℃培养箱中培养 8 h,再将线虫转移至 20 ℃培养箱 中恢复 12 h 后 ,统计每组存活数 ,并计算存活率 。 1.2.9 ARE 对百草枯氧化应激损伤线虫的影响 收集同期化至 L4时期的线虫 ,将线虫随机挑入 涂有不同浓度 ARE 和 5 mmol / L 百草枯的培养板中 进行培养 ,以不含 ARE 的培养板作为空白对照 ,每隔 24 h 记录线虫的存活数 ,死亡数 ,消失数 ,直至线虫 全部死亡 ,绘制生存曲线 。 1.2.10 ARE 对线虫体内抗氧化酶活力的影响 收集同期化培养至 L4时期的线虫 ,按照方法 1.2.4处理 72 h 后 ,收集各处理组与对照组的线虫于 EP 管中 ,用 M9缓冲液洗涤数次 ,加入提取液冰浴超 声破碎 ,4 ℃离心 (3 000 r / min)10 min,取上清液 ,按 照试剂盒所述方法测定超氧化物歧化酶 (superoxide dismutase,SOD)、谷胱甘肽 (glutathione,GSH)活力和 丙二醛 (malondialdehyde,MDA)含量 。 1.2.11 数据分析 试验均独立重复 3次 ,结果以平均数 ±标准差 (Mean ±SD)表示 ,采用 JMP Pro 16软件通过单因素 方差分析法进行显著性分析 (P < 0. 05)。采用 Graphpad prism 9.2.0对实验结果进行绘图 。 2 结果与分析 2.1 ARE 基本成分分析结果 成分分析结果显示 ,ARE 中蛋白含量最高 ,达 86.94%,总糖含量为 8%,脂肪含量最低 ,约占 0.05%(均为质量分数 )(表 1),表明 ARE 的主要成分为蛋白 质 。鲍鱼肌肉中的大部分碳水化合物水溶性较强 [2],且与课题组前期研究相比 [9],该处理方法获得的鲍鱼 肌肉酶解产物蛋白含量提高 ,总糖含量降低 ,表明 ARE 是一种高蛋白 ,低脂肪的优质海洋食品来源 。 表 1 ARE 基本成分分析 单位 :%Table 1 Analysis of the basic components of ARE 蛋白质 碳水化合物 脂肪 灰分 水分 86. 94 ± 1. 93 8. 00 ± 0. 70 0. 05 ± 0. 01 2. 7 ± 0. 05 4. 61 ± 0. 30 注 :数据以干基计 (质量分数 ) 2.2 ARE 对线虫寿命的影响 秀丽隐杆线虫的寿命实验是评价 ARE 抗衰老效 果最为直观的一个指标 。本研究参考文献 [16]并通过 预实验设置多个浓度进行寿命实验 ,最终筛选出 0.25、1.25、2.50 mg / mL 3个浓度进行后续实验 。如表 2所 示 ,与空白对照相比 ,低中高浓度的 ARE 均能够显著 延长秀丽隐杆线虫的寿命 (P <0. 05),分别延长了 10.36%、14.13%和 17.36%,其寿命曲线均明显右移 ,并呈现浓度梯度依赖式的增长 (图 1)。王力等 [17]在 牡蛎多肽组分的抗衰老作用研究结果中表明高剂量浓 度处理组线虫平均寿命 (19.67 d)与空白组 (14.53 d)相比显著延长 ,其趋势与本研究结果较为接近 。 表 2 ARE 对线虫寿命的影响 (n = 3) Table 2 Effect of ARE on the lifespan of C. elegans 质量浓度 / (mg·mL ' 1)数量 平均寿命 / d 百分比 /%最长寿命 / d 2. 50 103 17. 78 ± 0. 38 a 117. 36 22 1. 25 94 17. 29 ± 0. 05 ab 114. 13 21 0. 25 102 16. 73 ± 0. 32 c 110. 36 20 对照组 96 15. 15 ± 0. 08 d 100. 00 19 注 :同一列不同字母表示各组间存在显著性差异 (P <0. 05)(下同 ) 图 1 ARE 对线虫寿命的影响 Fig. 1 Effect of ARE on the lifespan of C. elegans 2.3 ARE 对线虫运动能力的影响 与人类一样 ,线虫的衰老往往伴随着运动能力的 退化 ,线虫运动能力直观反映了其生长的健康状态 ,是评价抗衰老的重要指标之一 [18]。由图 2可知 ,与 对照组相比 ,ARE 处理组明显改善了线虫的运动能 力 ,在生命中后期尤为显著 。第 5天 ,ARE 处理组及 对照组的线虫无须刺激便可自发运动 ,均处于 A 级 运动 ;第 10天 ,处于 BC 级运动的线虫占比均增加 ,其中 2.50 mg / mL 处理组仍有 85%的线虫处于 A 级 运动 ,与对照组相比处于 A 级运动的占比明显升高 。第 15天 ,对照组中处于 A 级运动的线虫约占 33.33%, ARE 3个质量浓度 (2.50、1.25、0.25 mg / mL)处理组 中处于 A 级运动的线虫分别占 56. 66%、50.00%、40.00%。表明 ARE 显著提高了线虫的运动能力 ,且 呈明显的剂量效应 。 A 级 -线虫可自主运动 ;B 级 -线虫受到刺激可运动 ; C 级 -线虫受到刺激仅头尾运动 图 2 ARE 对线虫运动能力的影响 Fig. 2 Effect of ARE on the motility of C. elegans 2.4 ARE 对线虫体内脂褐素积累以及体长的影响 脂褐素是线虫肠道内自带荧光的一种老年色素 ,是由细胞内溶酶体消化产物和脂肪残积组成 ,不可通 过胞吐作用排除 ,也无法降解 ,因此会随着年龄的增 长在体内不断积累 [19]。如图 3-A 和图 4所示 ,与对 照组相比 ,随着 ARE 浓度的增加 ,高中低浓度处理组 线虫的荧光强度显著减弱 ,呈剂量依赖性 ,分别下降 了 21.93%、16. 17%、8. 18% (P <0. 05),说明 ARE 能够有效降低线虫体内的脂褐素积累 ,但线虫体长没 有显著变化 (图 3-B)。 2.5 ARE 对线虫繁殖能力的影响 秀丽隐杆线虫繁殖能力极强 ,根据能量守恒原 则 ,线虫寿命的增加将会伴随着繁殖力升高而下 降 [20]。如 PARK 等 [21]在研究中发现在膳食中补充 磷脂酰乙醇胺延长了秀丽隐杆线虫的寿命同时降低 了线虫的繁殖能力 。本研究中 ,与对照组相比 ,ARE 显著增加了产卵量 ,最高增加了 40%以上 ,说明 ARE 在延长线虫寿命的同时未损害其繁殖能力 (图 5),这与 ZHANG 等 [22]的研究结果类似 ,他们 的结果表明苦参种子多糖可延长线虫的寿命同时 提高其繁殖能力 。 2.6 ARE 对线虫热应激损伤的保护作用 研究表明 ,秀丽隐杆线虫寿命延长与其对外界压 迫的耐受能力及适应能力密切相关 。秀丽隐杆线虫 在高温环境下的抗逆能力是考察其抗衰老能力的一 个重要指标 ,抗衰老能力与其抗热应激能力成正 比 [23]。由图 6可知 ,经热激处理后 ,与对照组 (51.72%)相比 ,经 ARE 处理组的线虫存活率随着 浓度的增加而升高 ,不同质量浓度 ARE(2. 50、1. 25、0.25 mg / mL)处理组的线虫存活率分别提高了 35.85%、 21.36%、12.96%,说明 ARE 对线虫热应激损伤具有 保护作用 ,能增强线虫抵抗外界高温环境的应激能 力 。熊磊 [24]在研究中发现 ,枸杞多糖不仅显著提高 线虫的平均寿命 ,且大大提高了线虫在热应激情况下 的存活率 。 A A -脂褐素水平 ;B -体长 图 3 ARE 对秀丽隐杆线虫体长及体内脂褐素含量的影响 Fig. 3 Effect of ARE on lipofuscin and body size content in C. elegans 注 :不同小写字母表示差异显著 ( P < 0. 05) (下同 ) A - 2. 5 mg/mL ARE 组 ;B - 1. 25 mg/mL ARE 组 ;C - 0. 25 mg/mL ARE 组 ;D -对照组 图 4 ARE 不同浓度处理组线虫荧光显微图片 Fig. 4 Fluorescent micrographs of nematodes treated with different concentrations of ARE 图 5 ARE 对秀丽隐杆线虫繁殖力的影响 Fig. 5 Effect of ARE on the fecundity of C. elegans 图 6 ARE 对线虫热应激损伤的影响 Fig. 6 Effect of ARE on heat stress damage in C. elegans 2.7 ARE 对线虫氧化应激损伤的影响 过量诱导的氧化应激会导致生物体细胞结构及 分子功能损伤 ,具有抗氧化性物质可缓解氧化应激 。百草枯作为氧化应激胁迫实验模型建立的诱导物质 ,是众所周知的线粒体毒物 ,而线粒体参与生物体的发 育 、寿命和繁殖 [25]。由表 3可知 ,在百草枯氧化应激处 理下 ,空白组线虫平均寿命 (9.25 ±0.69) d。与对照组 相比 ,ARE 处理线虫寿命显著延长 ,在 0 ~2.50 mg / mL,从 (9.25 ±0. 69) d 延长到 (11. 63 ±0. 53) d。与空 白对照组相比分别延长了 9. 51%、15. 78%、25. 73%,如图 7所示 ,ARE 处理组寿命曲线明显右移 ,呈现一 定的剂量依赖性 。说明 ,ARE 对线虫百草枯氧化应 激损伤具有明显的保护作用 (表 3)。林春秀等 [26]以 秀丽隐杆线虫为模型 ,分析了苦瓜青钱复合茶在不同 氧化应激模型中的存活率 ,结果表明在百草枯胁迫 下 ,复合茶对线虫有明显的保护作用 ,其平均寿命显 著延长 。 表 3 ARE 对百草枯氧化应激损伤线虫寿命的影响 (n > 3) Table 3 Effect of ARE on life span damaged by paraquat in C. elegans 质量浓度 / (mg·mL / 1 )数量 平均寿命 / d 百分比 / % 最大寿命 / d 2. 50 97 11. 63 ± 0. 34 a 125. 73 17 1. 25 97 10. 71 ± 0. 15 b 115. 78 15 0. 25 99 10. 13 ± 0. 73 b 109. 51 14 对照组 96 9. 25 ± 0. 69 c 100. 00 14 图 7 ARE 对百草枯氧化应激损伤线虫寿命的影响 Fig. 7 Effect of ARE on life span damaged by paraquat in C. elegans 2.8 ARE 对线虫体内抗氧化酶活力的影响 随着年龄的增加 ,线虫体内抗氧化酶活力会随之 降低 ,且在前期的研究中发现 ARE 能够减少年龄色 素的积累 ,这表明 ARE 具有抑制体内氧化副产物产 生的潜力 。 SOD、GSH 是线虫体内主要的抗氧化酶 ,是抗氧化防御系统研究的重要指标 。而 MDA 含量 是细胞中多不饱和脂肪酸过氧化的重要产物之一 ,通 常被认为是脂质过氧化和氧化应激最常用的指 标 [27]。如图 8-A 所示 ,与对照组相比 ,ARE 高中低处 理组中 ,SOD 活性分别提高了 33. 33%、18. 73%、11.06%;如图 8-B 所示 , GSH 活性分别提高了 135.18%、40.16%、1.31%。 MDA 含量显著降低 ,与 对照组相比 ,ARE 高中低处理组 MDA 含量分别降低 了 73. 39%、54. 59%、51. 83% (图 9)。综上所述 , ARE 可有效提高线虫体内抗氧化酶活性 ,降低 MDA 含量 ,增强线虫体内氧化应激能力 ,进而延缓衰老 。 A - SOD;B -GSH 图 8 ARE 对线虫体内 SOD、GSH 活力的影响 Fig. 8 Effect of ARE on SOD and GSH activities in C. elegans 图 9 ARE 对线虫体内 MDA 含量的影响 Fig. 9 Effect of ARE on MDA content in C. elegans 3 结论 本实验以秀丽隐杆线虫作为动物实验模型 ,研究 了 ARE 对秀丽隐杆线虫抗衰老作用的影响 。结果发 现 ,ARE 可显著提高线虫的寿命 ,并且优化其生命健 康体征 ,提高了线虫的运动能力 ,降低了线虫体内脂 褐素水平 ,且不影响线虫的生殖能力 ,同时提高了线 虫在急性应激损伤下的耐受力 ,提高了线虫体内抗氧 化酶 SOD 和 GSH 的活力并降低线虫体内 MDA 含 量 ,表明 ARE 具有延缓衰老的功效 ,为之后以鲍鱼为 原料开发功能性食品奠定了基础 。 参考文献 [1] 王丹 ,吴反修 .中国渔业统计年鉴 [M].北京 :中国农业出版 社 ,2022. WANG D, WU F X. China Fishery Statistical Yearbook[M]. Bei-jing:China Agriculture Press, 2022. [2] SHI L F, HAOGX, CHEN J, et al. Nutritional evaluation of Japa-nese abalone (Haliotis discus hannai Ino) muscle:Mineral content, amino acid profile and protein digestibility[ J] . Food Research Inter-national, 2020,129:108876. [3] 刘先进 ,陈胜军 ,李来好 ,等 .四种鲍鱼肌肉营养成分分析与品 质评价 [ J] .食品与发酵工业 , 2018,44(5) :227 - 231. LIU X J, CHEN S J, LI L H, et al. Nutritional analysis and quality evaluation of four kinds of abalone muscle[ J] . Food and Fermenta-tion Industries, 2018,44(5) :227 - 231. [4] 王敏 ,卢赛 ,张曾亮 ,等 .鲍鱼水解肽的抗氧化 、抗炎及免疫调 节作用 [ J] .食品工业科技 , 2021,42(5) :282 - 288. WANG M, LU S, ZHANG Z L, et al. Antioxidant, anti-inflammato-ry and immunomodulatory effects of abalone hydrolytic peptide[ J] . Science and Technology of Food Industry, 2021,42(5) :282 - 288. [5] ZHENG P S, HAO G X, WENG W Y, et al. Antioxidant activities of hydrolysates from abalone viscera using subcritical water-assisted enzymatic hydrolysis[ J] . Food and Bioprocess Technology, 2019,12(6) :910 - 918. [6] 张瑞娟 ,柯莉娜 ,郑静 ,等 .鲍鱼内脏多糖的提取 、纯化及其抗 氧化和抑菌活性 [ J] .厦门大学学报 (自然科学版 ) , 2018,57(1) :58 - 64. ZHANGR J, KE L N, ZHENG J, et al. Extraction,purification and antioxidant and antibacterial activity analysis of polysaccharides from abalone viscera [ J ] .Journal of Xiamen University ( Natural Sci-ence) , 2018,57(1) :58 - 64. [7] GONG F, CHEN M F, CHEN J L, et al. Boiled abalone byproduct peptide exhibits anti-tumor activity in HT1080 cells and HUVECs by suppressing the metastasis and angiogenesis in vitro [ J] . Journal of Agricultural and Food Chemistry, 2019,67(32) :8 855 - 8 867. [8] LIU B X, JIA Z, LI C C, et al. Hypolipidemic and anti-atherogenic activities ofcrudepolysaccharidesfrom abalone viscera [ J] . Food Science & Nutrition, 2020,8(5) :2 524 - 2 534. [9] 任鼎鼎 ,黄梦怡 ,郑惠娜 ,等 .皱纹盘鲍 (Haliotis discus hannai Ino)肌肉酶解产物制备及其免疫活性研究 [ J] .食品与发酵工 业 , 2020,46(23) :21 - 28. REN D D, HUANG M Y, ZHENG HN, et al. Preparation and im-munoactivity of enzymatically hydrolyzed products of abalone (Hali-otis discus hannai Ino) muscle[ J] . FoodandFermentationIndus-tries, 2020,46(23) :21 - 28. [10] 张雪妍 ,秦小明 ,高加龙 ,等 .牡蛎酶解工艺优化及其酶解产 物对小鼠睾酮分泌的影响 [ J] .广东海洋大学学报 , 2019,39(3) :96 - 102. ZHANGXY,QIN XM,GAO J L, et al. Optimization of enzymatic hydrolysis from crassostrea gigas and effects of its enzymatic hydrol-ysate on TM3 leydig cells[ J] . Journal of Guangdong Ocean Univer-sity, 2019,39(3) :96 - 102. [11] 李敏 ,王德民 ,李峰 ,等 .药食同源中药抗衰老研究进展 [ J] .食 品与药品 ,2019,21(5) :414 - 418. LI M, WANG D M, LI F, et al. Progress in anti-aging function of traditional Chinese medicinewith characteristicsof medicineand food[ J] . Food and Drug, 2019,21(5) :414 - 418. [12] 李鹏程 .海洋生物资源高值利用研究进展 [ J] .海洋与湖沼 ,2020,51(4) :750 - 758. LI P C. Research progress in high-value utilization of marine biolog-ical resources [ J ] . Oceanologia et Limnologia Sinica, 2020, 51(4) :750 - 758. [13] 王力 ,肖嵋方 ,刘斌 ,等 .海洋生物活性物质抗衰老作用研究 进展 [ J] .食品工业科技 , 2021,42(22) :433 - 441. WANG L, XIAOM F, LIU B, et al. Research progress on the anti-aging effect of marine bioactive substances[ J] . Science and Tech-nology of Food Industry, 2021,42(22) :433 - 441. [14] MUDD N, LICEAGA A M. Caenorhabditiselegans as an in vivo model for food bioactives:A review[ J] . Current Research in Food Science,2022,5:845 - 846. [15] 迟东泽 ,何源 ,刘芳芳 ,等 .鹿鞭醇提物对秀丽隐杆线虫衰老 的影响 [ J] .食品工业科技 , 2021,42(10) :327 - 335. CHI D Z, HE Y,LIU F F, et al. Effect of ethanol extracts of penis cervi on anti-aging in caenorhabditis elegans [ J] . Science and Tech-nology of Food Industry, 2021,42(10) :327 - 335. [16] 王雪 .鹿茸醇提物对秀丽隐杆线虫抗衰老机制的研究 [D].长 春 :吉林农业大学 , 2020. WANG X Anti-aging mechanism of velvetantlerextracton Cae-norhabditis elegans [D]. Changchun:Jilin Agricultural University,2020. [17] 王力 ,肖嵋方 ,陈弘培 ,等 .牡蛎多肽组分 OE-I 抗氧化活性及 其对秀丽隐杆线虫抗衰老作用 [ J] .食品科学 , 2022,43 (3 ) :152 - 160. WANG L, XIAO M F, CHEN H P, et al. Antioxidant activity of oyster peptide fraction OE-I and its anti-aging effect on caenorhab-ditis elegans[ J] . Food Science, 2022,43(3) :152 - 160. [18] YANG XY,WANGH, LI T, et al. Nobiletin delays aging and en-hances stress resistance of Caenorhabditis elegans [ J] . International Journal of Molecular Sciences, 2020,21(1) :341. [19] ZHANG M H, YANG X, XU W, et al. Evaluation of the effects of three sulfa sweeteners on the lifespan and intestinal fat deposition in C. elegans [J]. Food Research International, 2019,122:66 - 76. [20] 宋兵兵 .蓝莓和苹果皮提取物联合抗衰老活性及作用机制研 究 [D].广州 :华南理工大学 , 2020. SONG B B. Antiaging activity of combination of blueberry and ap-ple peel extracts:Mechanisms of action[D].Guangzhou:South Chi-na University of Technology, 2020. [21] PARK S, KIM B, PARK S K. Supplementationwith phosphati-dylethanolamine confers anti-oxidant and anti-aging effects via hormesis and reduced insulin / IGF-1-like signaling in C. elegans [ J] . Mechanisms of Ageing and Development, 2021,197:111498. [22] ZHANG Y, MI D Y, WANG J, et al. Constituent and effects of polysaccharides isolated from Sophora moorcroftiana seeds on lifes-pan, reproduction, stress resistance, and antimicrobial capacity in Caenorhabditis elegans [ J] . Chinese Journal of Natural Medicines,2018,16(4) :252 - 260. [23] HUI H, XIN A Y, CUI H Y, et al. Anti-agingeffectson Cae-norhabditiselegans of a polysaccharide, O-acetyl glucomannan, from roots of Lilium davidii var. unicolor Cotton [ J] . International Journal of Biological Macromolecules, 2020,155:846 - 852. [24] 熊磊 .枸杞多酚提取物抗衰老活性及其作用机制研究 [D].广 州 :华南理工大学 , 2021. XIONG L. Study on anti-aging activity and mechanism of Lycium barbarum polyphenol extract[D].Guangzhou: South China Univer-sity of Technology, 2021. [25] BORA S,VARDHAN G S H,DEKA N,et al. Paraquat exposure o- ver generation affects lifespan and reproduction through mitochon-drial disruption in C. elegans [ J] . Toxicology,2021,447:152632. [26] 林春秀 ,林伊梓 ,沈少丹 ,等 .苦瓜青钱柳复合茶对秀丽线虫 的抗氧化作用 [ J] .食品与发酵工业 , 2020,46(23) :178 - 183. LIN C X, LIN Y Z, SHEN S D, et al. Antioxidant effect of a com-pound Momordicacharantiaand Cyclocarya paliurusteaon Cae-norhabditis elegans[ J] . Food and Fermentation Industries, 2020,46(23) :178 - 183. [27] LIN C X, CHENY, LINY Z, et al.Antistress and anti-aging activ-ities of Caenorhabditis elegans were enhanced by Momordica saponin extract[J]. European Journal of Nutrition, 2021,60 (4):1 819 -1 832. Anti-aging effect of Abalone muscle enzymatic hydrolysate on Caenorhabditis elegans CAI Jiaqi1,QIN Xiaoming1,2∗,LU Hongyu1,2∗,YE Wanqi1,ZHANG Guifang1, LIN Haisheng1,2,ZHENG Huina1,2 1(College of Food Science and Technology, Guangdong Ocean University, National Research and Development Branch Center for Shellfish Processing (Zhanjiang), Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety, Guangdong Province Engineering Laboratory for Marine Biological Products, Key Laboratory of Advanced Processing of Aquatic Product of Guangdong Higher Education Institution, Zhanjiang 524088, China) 2(Collaborative Innovation Center of Seafood Deep Processing, Dalian Polytechnic University,Dalian 116034, China) ABSTRACT In present study, the Abalone muscle water extract residue enzymatic product (ARE) was prepared and analyzed. To eval-uate the anti-aging activity of ARE, longevity, exercise ability, lipofuscin level, reproductive ability, and anti-stress ability of Caenorhab-ditis elegans were detected respectively. The results showed that the main component of ARE was protein. Compared with the control group, the high, middle, and low dose of ARE could significantly prolong the life span of C. elegans , improve the movement ability of C. elegans (the proportion of type A movement increased), and reduce the level of lipofuscin in vivo . Among them, the highest dose of ARE treat-ment group (2. 50 mg/mL) had the strongest effect. The levels of the above indicators changed by 17. 36% , 56. 66% , and 21. 93% re-spectively (P < 0. 05). ARE improved the anti-stress ability of C. elegans . Specifically, the 2. 5 mg/mL ARE treatment group compared with the control group improved the survival rate of heat-damaged C. elegans by 35. 85% , and increased the average life span of C. elegans by 25. 73% under paraquat induced stress condition. Meanwhile, ARE increased the levels of superoxide dismutase (SOD) and glutathi-one (GSH) in C. elegans and significantly reduced malondialdehyde (MDA) level. In addition, ARE increased reproductive capacity ac-companied with prolonged life span of C. elegans . In conclusion, ARE exhibits good anti-aging activity, which lays a good foundation for the development of abalone functional food. Key words Abalone; enzymatic hydrolysate; Caenorhabditis elegans ; anti-aging; oxidative stress
确定





还剩5页未读,是否继续阅读?
中国格哈特为您提供《鲍鱼肌肉酶解产物ARE中蛋白质和脂肪含量的检测》,该方案主要用于水产品中营养成分检测,参考标准《GB 5009.5 食品安全国家标准 食品中蛋白质的测定》,《鲍鱼肌肉酶解产物ARE中蛋白质和脂肪含量的检测》用到的仪器有格哈特全自动凯氏定氮仪VAPODEST 450、格哈特快速干燥仪STL56、格哈特红外加热消解快速消化系统TTs625、格哈特全自动超级总脂肪测定系统HT6+SOX416、格哈特维克松废气实验室废物处理系统涤气VS、德国移液器MM、凯氏定氮催化剂5.0g K2SO4+0.5g CuSO4 x 5H2O
相关方案
更多
该厂商其他方案
更多

































