方案详情
文
在过去十年中,对电感耦合等离子体质谱最重要的改良之一在于引入碰撞/反应池 (CRC) 去除多原子干扰。但使用 CRC-ICP-MS 精确测定血液或尿液等复杂基质中的某些金属元素仍面临诸多挑战。
NIST 曾发布使用同位素稀释质谱 (IDMS) 测定未知基质中铅含量的方法。IDMS 因其排除了血液的基质效应,被认为是用于分析血液中金属含量的最精确方法 [2, 3]。但 IDMS 方法相对昂贵,并且不能用于测定如锰、砷等单一同位素元素。作为替代,可以使用内标法根据 ISTD 响应变化适当校正分析物响应来补偿基质效应。但是,与同位素稀释不同,因不同基质中 ISTD 的电离行为不同,校准标样和血液溶液中化学组分的差异仍会造成分析误差。在本简报中,我们论证了通过将校准标样的离子强度与血液样品相匹配( 基质匹配),排除内标技术中的误差,并得到和 IDMS 精度相当的结果。
我们目前的方法采用正丁醇、NH4OH、H4EDTA 和 Triton X-100 溶液,加入 ISTD 作为血液稀释液。该稀释液是非常好的血液溶剂。另外,我们在相同的溶液中加入氯化钠和氯化钙进行基质匹配,制备校准标样。进行基质匹配时,使用合成基质比广泛应用的全血在操作上更为简便,可信度也更高。
方案详情

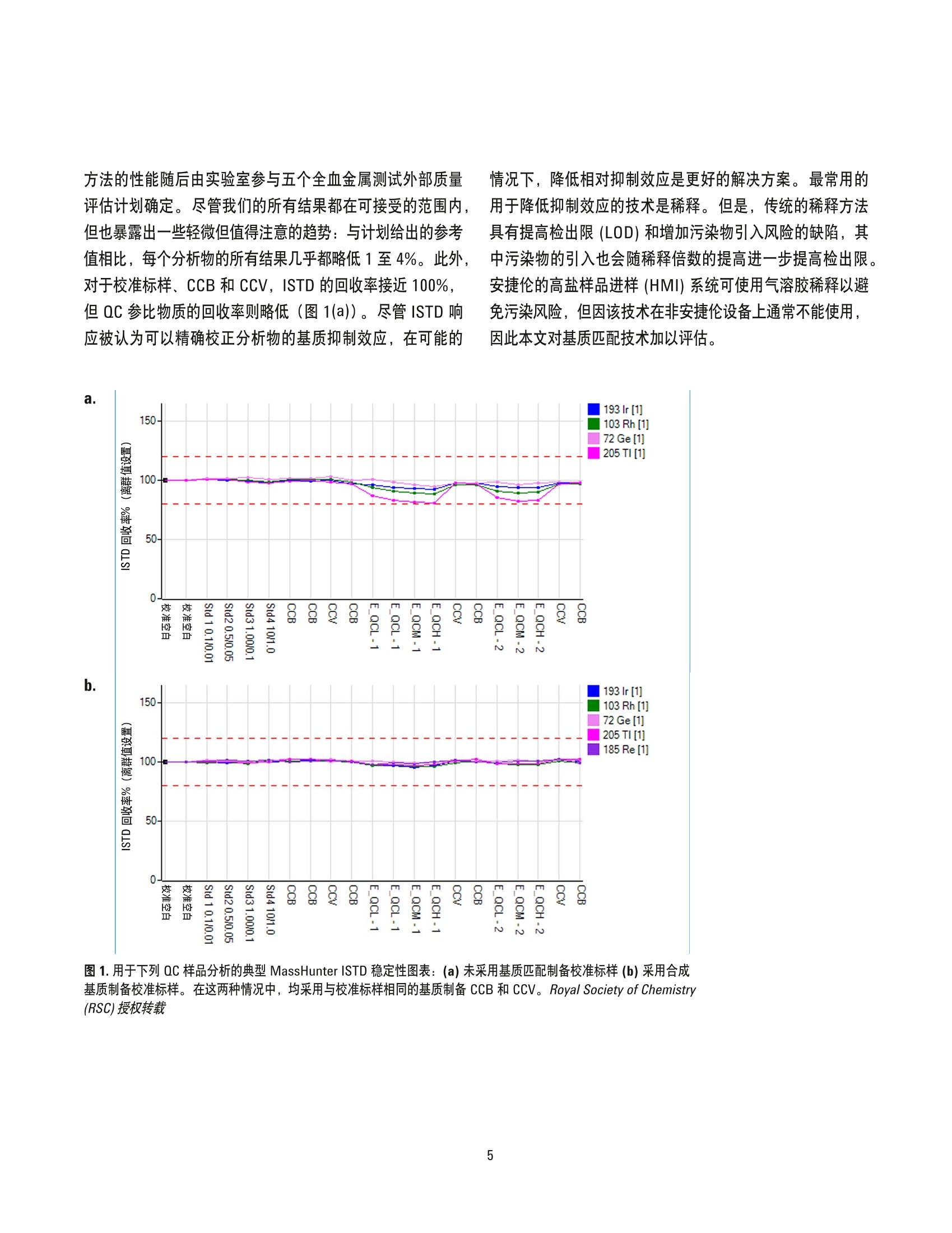
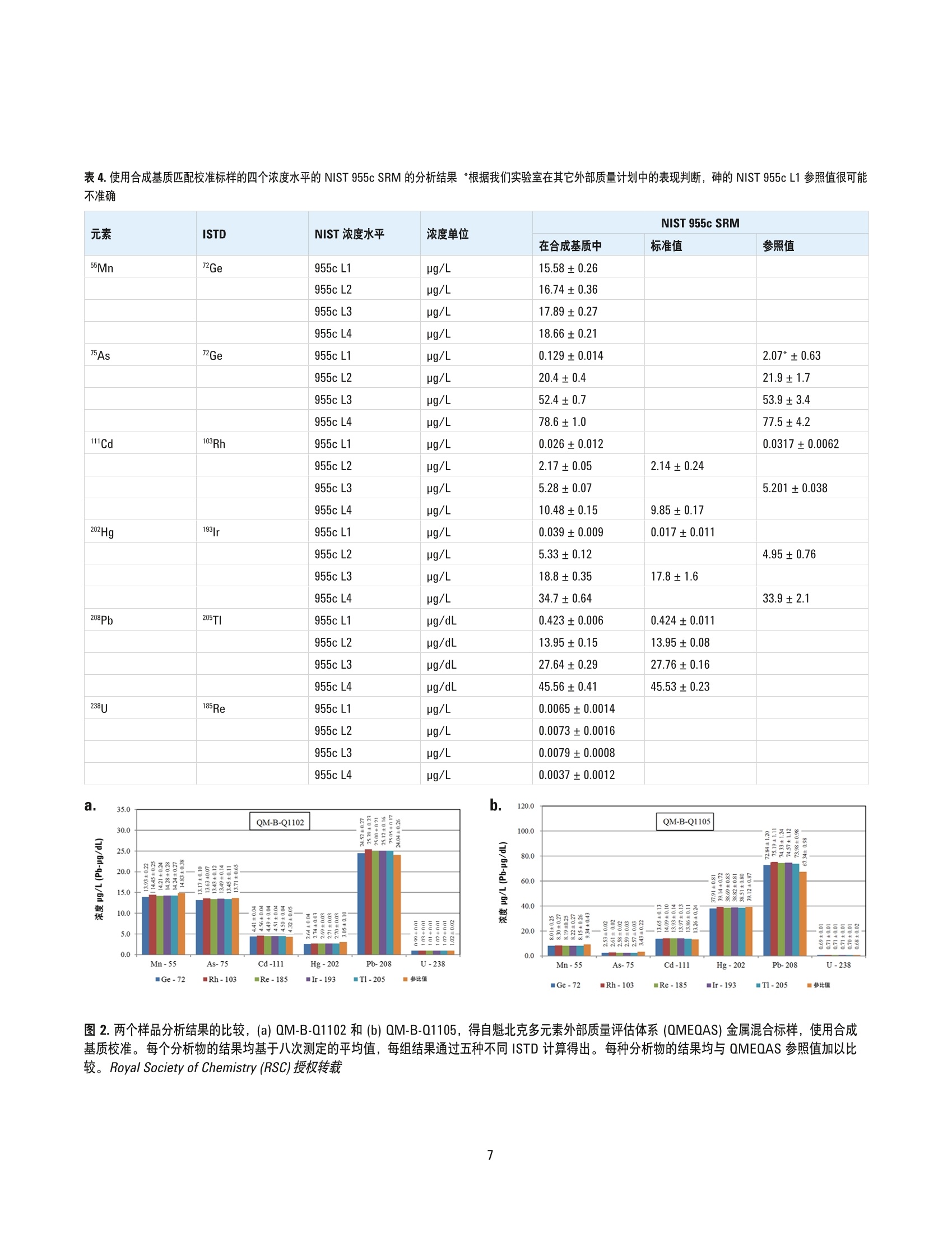
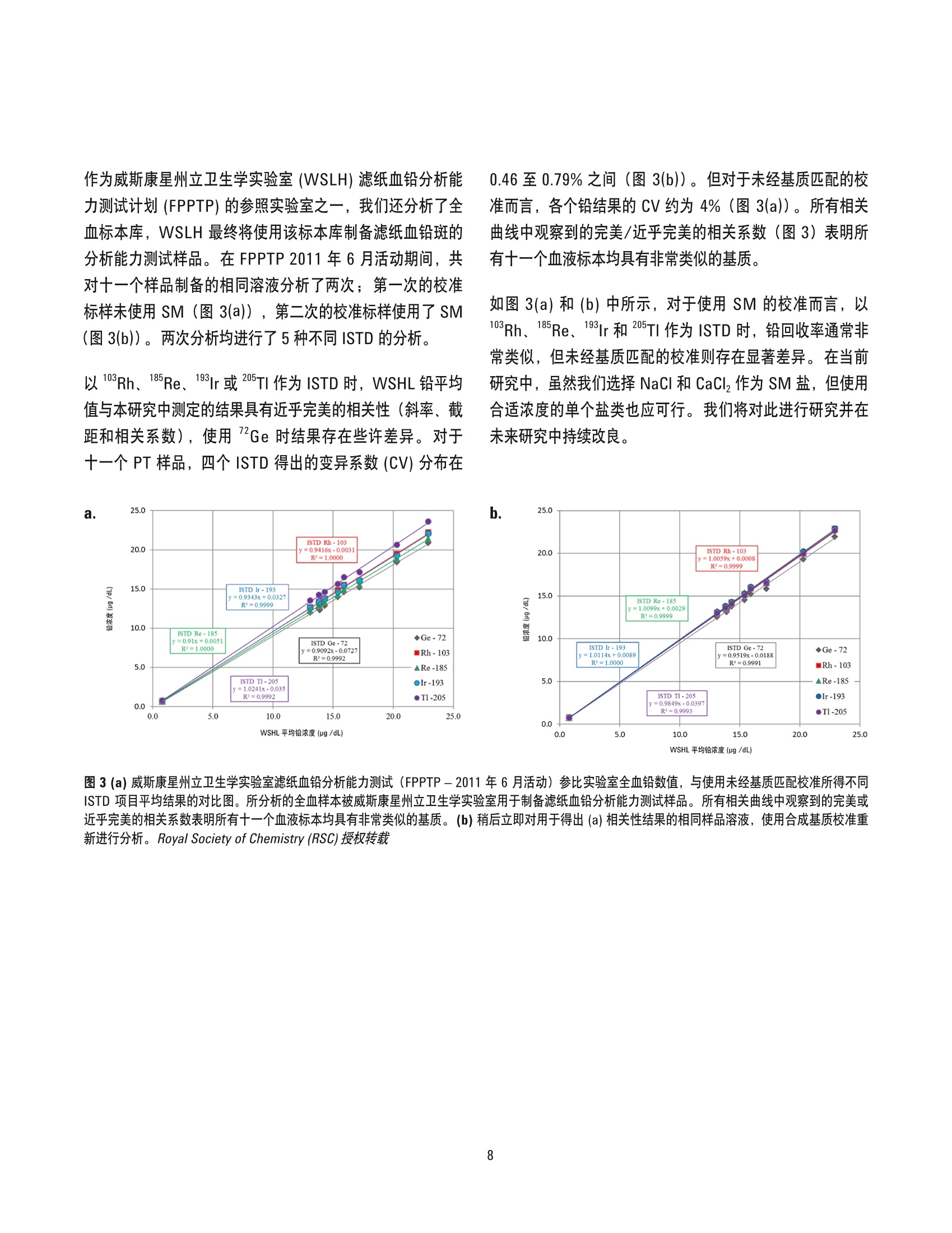
采用合成基基校正方法以 ICP-MS测定血液中的必需及有毒微量金属元素 应用简报临床 作者 Ryszard Gajek 加利福尼亚州公共健康部,环境健康实验室分部, 美国加州里士满 前言 在过去十年中,对电感耦合等离子体质谱最重要的改良之一在于引入碰撞/反应池 (CRC)去除多原子干扰。但使用 CRC-ICP-MS 精确测定血液或尿液等复杂基质中的某些金属元素仍面临诸多挑战。 NIST 曾发布使用同位素稀释质谱 (IDMS) 测定未知基质中铅含量的方法。IDMS因其排除了血液的基质效应,被认为是用于分析血液中金属含量的最精确方法[2,3]。但 IDMS 方法相对昂贵,并且不能用于测定如锰、砷等单一同位素元素。作为替代,可以使用内标法根据 ISTD 响应变化适当校正分析物响应来补偿基质效应。但是,与同位素稀释不同,因不同基质中 ISTD 的电离行为不同,校准标样和血 液溶液中化学组分的差异仍会造成分析误差。在本简报中,我们论证了通过将校准标样的离子强度与血液样品相匹配(基质匹配),排除内标技术中的误差,并得到和IDMS 精度相当的结果。 我们目前的方法采用正丁醇、NHOH、HEDTA 和 TritonX-100溶液,加入 ISTD 作为血液稀释液。该稀释液是非常好的血液溶剂。另外,我们在相同的溶液中加入氯化钠和氯化钙进行基质匹配,制备校准标样。进行基质匹配时,使用合成基质比广泛应用的全血在操作上更为简便,可信度也更高。 实验部分 仪器 在接下来的研究中,将使用带有 ISIS-DS 不连续采样系统的 Agilent 7700x 并采用氦气碰撞模式。该仪器配备 表1. Agilent 7700x ICP-MS 和 ISIS-DS操作参数 ICP-MS 设置 RF功率 1550 W 每个峰的采集点数量 6 载气 1.05 L/min 稀释模式 打开 稀释气体 0.1 L/min He 气 4.3mL/min ISIS-DS 设置 加载时间 10 s 加载速度 1.0 rps 针头冲洗时间 23s 后冲洗时间 10 s 后冲洗速度 1.0 rps 定量环长度 120 cm 定量环管线内径 0.8 mm MassHunter工作站修订版 B.01.01软件进行仪器控制和数据处理。ICP-MS 采用镍采样锥和截取锥, MicroMist 玻璃同心雾化器和石英 Scott 型雾化室。仪器设置和参数列于表1和表2中。 试剂 使用1型去离子(DI)水制备所有水溶液。砷、镉、锰、铅、汞和铀的标准储备溶液,浓度为1000mg/L,以及锑、徕、铱、铑和锗的标准储备溶液 (ISTD) 浓度为 1000mg/L, 均购自 SPEX CertiPrep(美国新泽西州墨图根)。第二来源自定义标准溶液得自 Inorganic Ventures (美国弗吉尼亚州克里斯琴斯堡),含有砷、镉、锰和铅,浓度为1000 mg/L,还有汞和铀,浓度为100 mg/L。高纯度氯化钠、氯化钙、Triton X-100 和 HEDTA 购自西格玛奥德里奇公司(美国威斯康星州密尔沃基),氢氧化铵和正丁醇购自赛默飞世尔科技公司(美国宾夕法尼亚州匹兹堡)。 表2.质谱采集参数 质谱元素 *每个质量数的积分时间 55Mn 1.5 s Ge 0.70 s 75As 2.1s 103Rh 0.70 s 111Cd 2.6 s 185Re 0.70 s 193Ir 0.70 s 202Hg 3.2 s 205TI 0.70 s 206(Pb) 1.1 s 207(Pb) 1.1 s 208Pb 1.1 s 238U 1.2 s 采集时间: 20.02s,3次重复,总采集时间: 60.06s, Pb (208)=(208)*1+(206)*1+(207)*1 ( *采用独立研究测定的优化积分时间见[4],但在大多数情况下,积分时 间可以四舍五入至小数点后一位(0.1秒)。 ) 载体溶液用于在测定样品时将样品从 ISIS-DS系统定量管推至喷雾器。载体溶液和空白校准溶液相同,以实现干扰最小化,避免当样品在喷雾器中与载体溶液汇合时,可能发生的各种化学变化-NHOH-2%w/v, HEDTA-0.25% w/v,7.5 g/L NaCI 和 0.5 g/L CaClz。 ISIS 清洗溶液 在每两个分析循环之间,可以使用 ISIS 清洗溶液对自动进样器针头、连接管路和 ISIS 回路/阀门再次进行清洗。清洗溶液为 NHOH-2% w/v、HEDTA-0.1% w/v和 TritonX-100 - 0.1% w/v 溶液。 分析方案 制备合成基质中间标样 用于制备中间标样的合成基质溶液为 NH0H-2% w/v、HEDTA-0.25 % w/v、7.5 g/L NaCI 和 0.5 g/L CaCI的水溶液。中间标样中金属的最终浓度如表3中所示。中间标样在4°℃下可稳定保存至少一周。 表3.中间标样中的金属浓度 浓度水平 As、Mn、Cd、Pb (pg/L) Hg、U(pg/L) 1 0.00 0.00 2 5.00 0.50 3 25.0 2.50 4 250 25.0 5 500 50.0 制备未经基质匹配的校准用中间标样 未经基质匹配的校准用中间标样的制备方法与合成基质(SM) 中间标样的制备方法相同,但不含 NaCl 和 CaClz。 制备质量控制 (QC)样品 QC 样品的制备方法为:在得自 Hemostat Laboratories(美国加利福尼亚州狄克逊)的去纤维蛋白绵羊血液中以三个浓度水平加入无机标准储备溶液(QCLow、QCMed 和QCHigh)。标液加入~1.5 mg/mL NazH2EDTA以进行保存。使用约1mL QC等分溶液制备 QC工作溶液,用于进行四到五次分析运行,丢弃多余的部分。 将血液标本、QC样品和中间标样用稀释剂稀释50倍,该稀释剂与载体溶液相同,但需添加 ISTD:锗、、铱、锑,浓度为 20 ug/L, 以及铑,浓度为 10 pg/L。在进行分析前,将溶液在 10 rpm 下旋转约 20 min, 以确保血液和QC样品完全溶解。分别手动移取 100 pL 四个浓度水平的中间标样(表3) 至4900pL稀释剂中以制备工作标样。空白溶液用100 uL 合成基容溶液以相同方法制备。 制备后, QC物质和血液标本通常立即溶解于碱性稀释剂中。一些含有小到中等凝块的血液标本可能不容易或无法精确移取。在这种情况中,将1至2mL含凝疑的血液夜至2mL冻存管中,超声匀浆处理10至20s。匀浆过程不仅可以有效分散凝块,还可改善分析结果的可重复性,特别是对于锰和镉。虽然有可能在经过匀浆处理后,血液标本中仍然存在微型凝块,但是可以观察到对于所有分析物而言,重复检测间的相对差异百分比稳定在较低值(小于20%)。这表明微型凝块对测量精确度没有显著的影响。 仪器和准备工作 仪器操作条件列于表1中。在此配置下,仪器的蠕动泵以0.1 mL/min 速度泵出载体溶液。将 ISIS-DS 和 ASX-500自动进样器配置为执行以下操作: a. 预冲洗(阀处于“加载”位置):自动进样器针头移动至位置1(清洗溶液),泵吸取清洗溶液 10 s在此模式下,可冲洗包括样品环在内的整个进样管路 b.采样:自动进样器针头移动至样品瓶, ISIS 泵吸取样品溶液 10 s 使其充满样品环 C.ISIS 阀切换至进样位置,将样品从样品环引入雾化器。在此期间,使用去离子水在冲洗池中冲洗自动进样器针头和管路30s, 之后移动至自动进样器“还原”位置直至分析结束 d. 等待23s,样品到达雾化器且信号稳定,开始采集数据并持续60s e.之后以相同步骤处理下一个样品 每个样品的总分析时间计算如下:10s采样, 10 s 预冲洗,23 s 稳定时间, 60 s采集数据时间和2-5s针头移动位置,总分析时间即为每为样品105-108 s。 一次标准的分析运行通常包括对每个血液样本和QC样品的两次重复测试。在每次血液样本序列测试的开始前和结束后进行 QC样品测试。另外,每测试20个血液样本应至少分析一个 QC样品。所有报告的 QC 和分析结果皆为两次重复测量结果的平均值。 结果和讨论 不进行基质匹配的校正 血液是多种有机组分(红细胞和白细胞,血小板等)和无机离子(钠、钾、钙、氯及其它)组成的复杂溶液,具有独特的物理性质。为使用 ICP-MS分析金属含量,通常要将血液样本稀释10至50倍。但是在进行分析时,特别是当需要分析的血液样本中存在未完全溶解的凝块时,有机组分仍会影响流速和雾化。此类波动可以通过溶液中所有目标分析物的分析响应同时发生变化进行观察,而添加 ISTD 是可以抵消此类响应变化的方式之一。但是,分析物和内标的响应不仅取决于它们的浓度,还取决于元素的第一电离能(IP)。具有较高第一电离能的元素,在存在浓度相对较高的易电离基质元素如钠、钾和钙时,其电离将受到抑制。我们的实验室方法需要使用经过大量稀释(50倍)的血液样品,目的是将校准标样(未经基质匹配的原始组分)和血液样品之间的基质效应最小化。 Agilent MassHunter 软件具有一项极为有用的功能,即跟踪 ISTD 稳定性:在校准空白分析时设定每个 ISTD 的基本信号,用于随后的分析结果计算 ISTD 回收率并用作判定分析是否合格的标准。 方法的性能随后由实验室参与五个全血金属测试外部质量评估计划确定。尽管我们的所有结果都在可接受的范围内,但也暴露出一些轻微但值得注意的趋势:与计划给出的参考值相比,每个分析物的所有结果几乎都略低1至4%。此外,对于校准标样、CCB 和 CCV, ISTD 的回收率接近100%,但QC 参比物质的回收率则率低(图1(a))。尽管 ISTD 响应被认为可以精确校正分析物的基质抑制效应,在可能的 情况下, 降低相对抑制效应是更好的解决方案。最常用的用于降低抑制效应的技术是稀释。但是,传统的稀释方法具有提高检出限(LOD)和增加污染物引入风险的缺陷,其中污染物的引入也会随稀释倍数的提高进一步提高检出限。安捷伦的高盐样品进样(HMI)系统可使用气溶胶稀释以避免污染风险,但因该技术在非安捷伦设备上通常不能使用,因此本文对基质匹配技术加以评估。 图 1.用于下列 QC样品分析的典型 MassHunter ISTD 稳定性图表:(a)未采用基质匹配制备校准标样(b)采用合成基质制备校准标样。在这两种情况中,均采用与校准标样相同的基质制备 CCB 和 CCV。 Royal Society of Chemistry(RSC)授权转载 基质匹配校准 校准标样和样品的基质匹配方法,是基于校准标样和样品溶液中可影响所有被分析物和 ISTD 响应的因素非常相似这一原理。理论上,如果空白和校准标样中存在的所有非分析组分和与样品溶液都相同或非常类似,分析结果也不会出现偏差。获得基质匹配溶液的通常方法是将动物血液加入校准标样[5.6]。动物和人类血液通常同时含有必需和有毒的微量金属元素,使用该基质匹配方法时,需要针对动物血液校准空白中金属的含量对每种金属的校准曲线进行修正。通常,血液中有毒金属的浓度较低,不会影响相应元素的校准,但必需金属(如锰)在血液中的浓度较高,使用较高的空白值通常会导致校准结果不准确。 为了改善初步研究的结果,我们选择另一种方案解决基质匹配问题:对空白和校准标样使用合成基质(SM), 并观察其对血液中无机组分分析结果的影响。该设想能否成功取决于以下假设是否正确:在样品传输效率和离子化效率等方面,分析物和 ISTD 在合成基质中的行为与在全血中非常类似。该 SM 方法之前只测试过铅[7],结果如图1(b)中所示。使用 SM制备校准标样时,所有样品包括校准标样、CCB、CCV和 QC参比物质的 ISTD 回收率均非常接近 100%。本研究通过分析稀释50倍的300个样品评估此方法的长期稳定性(259 min)。在所有分析运行期间, ISTD (铱和铑)保持一致的稳定性,没有观察到显著波动[7]。 在我们当前的研究中,所有稀释剂组分的浓度为:2%NH,OH w/v、 0.1% HEDTA w/v、4%正丁醇 w/v 和0.1%Triton X-100w/v。中间标准溶液中 HEDTA 的浓度为 0.25%(或2.5g/L), 足以完全络合 Ca*?和校准金属。在制备溶液时使用一定量的 NH OH (2% w/v) 溶解 HEDTA。在本研究中,可以使用高浓度稀度剂组分侧面反映出 ICP-MS 技术在近十年来所取得的进步,特别是在等离子体稳定性方面,现在可以耐受如此高浓度的有机和挥发性溶液组分,并通过碰撞/反应池将多原子干扰去除。 高浓度正丁醇将整体灵敏度提高了约两倍。氧化铯比例(156Ce0/"ce)保持不变(约1%),所有金属在本研究中均未发现同质异位素干扰。 表4中所示为 NIST 955c 在四个浓度水平上的分析结果。 内标选择 在本研究中按照常规方法为分析物选择 ISTD, 即第一电离能和原子量尽可能与分析物匹配。但是,图2表明在采用合成基质校准时,无论为分析物选择何种 ISTD, 分析结果都十分相似。另外,在本研究中还对锗加以评估,其通常用作多种元素包括砷和硒的内标,值得关注的是,有报道指出锗在血液中的浓度较高[9]。 表4.使用合成基质匹配校准标样的四个浓度水平的 NIST 955c SRM 的分析结果*根据我们实验室在其它外部质量计划中的表现判断, 砷的 NIST 955c L1参照值很可能不准确 元素 ISTD NIST 浓度水平 浓度单位 NIST 955c SRM 在合成基质中 标准值 参照值 55Mn 72Ge 955c L1 pg/L 15.58±0.26 955c L2 pg/L 16.74±0.36 955c L3 ng/L 17.89±0.27 955c L4 pg/L 18.66±0.21 75As 72Ge 955c L1 pg/L 0.129±0.014 2.07*±0.63 955c L2 ug/L 20.4±0.4 21.9±1.7 955c L3 pg/L 52.4±0.7 53.9±3.4 955c L4 pg/L 78.6±1.0 77.5±4.2 111Cd 103Rh 955c L1 pg/L 0.026±0.012 0.0317±0.0062 955c L2 pg/L 2.17±0.05 2.14±0.24 955c L3 ug/L 5.28±0.07 5.201±0.038 955c L4 pg/L 10.48±0.15 9.85±0.17 202Hg 193|r 955c L1 ug/L 0.039±0.009 0.017±0.011 955c L2 pg/L 5.33±0.12 4.95±0.76 955c L3 pg/L 18.8±0.35 17.8±1.6 955c L4 pg/L 34.7±0.64 33.9±2.1 208Pb 205TI 955c L1 pg/dL 0.423±0.006 0.424±0.011 955c L2 pg/dL 13.95±0.15 13.95±0.08 955c L3 ug/dL 27.64±0.29 27.76±0.16 955c L4 ug/dL 45.56±0.41 45.53±0.23 238U 185Re 955c L1 pg/L 0.0065±0.0014 955c L2 pg/L 0.0073±0.0016 955c L3 pg/L 0.0079±0.0008 955c L4 pg/L 0.0037±0.0012 a. 120.0 35.0· 图2.两个样品分析结果的比较, (a)QM-B-Q1102 和(b) QM-B-Q1105,得自魁北克多元素外部质量评估体系 (QMEQAS) 金属混合标样,使用合成基质校准。每个分析物的结果均基于八次测定的平均值,每组结果通过五种不同 ISTD 计算得出。每种分析物的结果均与 QMEQAS 参照值加以比较。 Royal Society of Chemistry (RSC)授权转载 作为威斯康星州立卫生学实验室 (WSLH)滤纸血铅分析能力测试计划 (FPPTP) 的参照实验室之一,我们还分析了全血标本库, WSLH 最终将使用该标本库制备滤纸血铅斑的分析能力测试样品。在 FPPTP 2011年6月活动期间,共对十一个样品制备的相同溶液分析了两次;第一次的校准标样未使用 SM (图3(a)),第二次的校准标样使用了 SM(图3(b))。两次分析均进行了5种不同 ISTD 的分析。 以103Rh、185Re、1931r或 205TI作为 ISTD时, WSHL铅平均值与本研究中测定的结果具有近乎完美的相关性(斜率、截距和相关系数),使用"Ge时结果存在些许差异。对于十一个 PT样品, 四个 ISTD 得出的变异系数 (CV)分布在 0.46至0.79%之间(图3(b))。但对于未经基质匹配的校准而言,各个铅结果的 CV约为 4%(图3(a))。所有相关曲线中观察到的完美/近乎完美的相关系数(图3)表明所有十一个血液标本均具有非常类似的基质。 如图3(a)和(b)中所示,对于使用 SM的校准而言,以103Rh、185Re、191931r和 205TI 作为 ISTD 时, 铅回收率通常非常类似,但未经基质匹配的校准则存在显著差异。在当前研究中,虽然我们选择 NaCl 和 CaCl 作为 SM盐,但使用合适浓度的单个盐类也应可行。我们将对此进行研究并在未来研究中持续改良。 图3(a)威斯康星州立卫生学实验室滤纸血铅分析能力测试(FPPTP-2011年6月活动)参比实验室全血铅数值,与使用未经基质匹配校准所得不同ISTD 项目平均结果的对比图。所分析的全血样本被威斯康星州立卫生学实验室用于制备滤纸血铅分析能力测试样品。所有相关曲线中观察到的完美或近乎完美的相关系数表明所有十一个血液标本均具有非常类似的基质。(b)稍后立即对用于得出(a)相关性结果的相同样品溶液,使用合成基质校准重新进行分析。 Royal Society of Chemistry (RSC) 授权转载 对血液样本进行大量稀释(50倍)并不足以完全去除在血液金属分析中观察到的基质效应。向校准标样中加入 NaCl和 CaCl,以制备合成基质(SM),可以大幅提高研究中所有金属元素结果的准确度,使其可与同位素稀释技术媲美。我们的研究表明在基质匹配条件下,可对给定分析物使用一系列 ISTD,而无需考虑第一电离能或原子量。此 SM 方法不必使用多种 ISTD 去校正仪器测定时的不稳定因素,并且可能成为对复杂基质中金属元素进行分析时,可提高 ICP-MS结果准确度的通用技术。 本文所开发的方法是生物监测研究的必备手段,在该领域内,为从各种研究人群结果中获得有价值的关联和比较信息,分析结果的准确度和精确度显得尤为关键。在2011年8月,使用 SM制备校准标样成为加利福尼亚州生物监测项目中测定血液中必需和有毒金属元素的认可方法,并用于铅中毒患者进行治疗时的常规血铅监测。自2009年3月对该方法进行验证之后,我们的实验室已为下列生物监测研究提供过血液金属分析: CYGNET (对青春期少女的营养、环境和转变的队列研究)、FOX(消防员职业暴露)和MIEEP (孕妇和婴幼儿环境暴露项目)。 CYGNET人口统计学研究的结果近期已发表[4,8]。随着基质匹配技术的进步,该方法也得以不断改进,经过改良的方法目前应用于 BEST (生物监测暴露研究)中。 对于 Josephine Alvaran、 Linda Nguyen (CDPH)、StevenWilbur、 Emmett Soffey 和 Craig Jones (安捷伦科技)的重要贡献,我们在此表示感谢。 本出版物部分受疾病控制与预防中心的合作协议编号5U38EH000481-03支持。 免责声明 本简报中的结果和结论属于作者,而不代表加利福尼亚公共健康部观点。 更多信息 ( 关于本应用的完整记述,请参见出版物: Determination of essential and toxic metals i n blood b y ICP-MS withcalibration in synthetic matrix, Ryszard Gajek, Frank Barley and Jianwen She, Anal. Methods,2013,5,2193 ) 1. R. Watters, K. Eberhardt, E.S. Beary, J.D. Fassett,Protocol for isotope dilution using inductivelycoupled-plasma spectrometry (ICP-MS) for thedetermination of inorganic elements, Metrologia, 34(1997) 87-96. 2. K.E. Murphy, W.F. Guthrie, T.W. Vetter, G.C. Turk, C.D.Palmer, J.M.E. Lewis, C.M. Geraghty, P.J. Parsons,Comparison of clinical methods with isotope dilutioninductively coupled plasma mass spectrometryfor the new standard reference material 955c leadin caprine blood, Journal of Analytical AtomicSpectrometry, 24 (2009)1170-1178. 3. C.E. Bryan, W.C. Davis, S.E. Long, E.A. Mackey, J.Molloy, K.E. Murphy, Development of SRM 955cToxic Elements in Caprine Blood, in, http://www.nist.gov/mml/analytical/inorganic/caprineblood.cfm, 2007. 4. R. Gajek, Optimization of Rapid Heavy Metals BloodAnalysis for Ultra Low Detection Limits by ICP-MSwith ISIS, Mass Spectrometry Applications to theClinical Lab (MSACL), San Diego CA (2011). 5. C.D. Palmer, J.M.E. Lewis, C.M. Geraghty, J.F.Barbosa, P.J. Parsons, Determination of lead,cadmium and mercury in blood for assessment ofenvironmental exposure: A comparison betweeninductively coupled plasma-mass spectrometry andatomic absorption spectrometry, SpectrochimicaActa Part B: Atomic Spectroscopy, 61 (2006)980-990. 6. M.L. Praamsma,J.G. Arnason, P.J. Parsons,Monitoring Mn in whole blood and urine: acomparison between electrothermal atomicabsorption and inorganic mass spectrometry,Journal of Analytical Atomic Spectrometry,26(2011)1224-1232. 7. A. Liba, C. Jones, S. Wilbur, R. Gajek, F. Wong, HighThroughput Analysis of Lead in Whole Blood usingICP-MS with ISIS-DS, Agilent ICP-MS Journal, (2010)4-5. 8. G.C. Windham, R. Voss, R. Gajek, F.Barley, C.Aldsworth, D. Dobraca, L. Kushi, Heavy Metals inBlood of Pre- and Peri-Pubertal Girls in California.by Demographic Characteristics, in: InternationalSociety for Environmental Epidemiology,BarcelonaSpain,2011. 9. Jean-Pierre Goulle, Loic Mahieu, Julien Castermant,Nicolas Neveu, Laurent Bonneau, Gilbert Laine,Daniel Bouige, Christian Lacroix, Metal andmetalloid multi-elementary ICP-MS validation inwholeblood, plasma, urine and hair referencevalues, Forensic Science International 153 (2005)39-44. www.agilent.com/chem/cn 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 本文中的信息、说明和技术指标如有变更,恕不另行通知。 @安捷伦科技(中国)有限公司,2013 2013年8月26日出版 出版号:5991-2991CHCN Agilent Technologies Agilent Technologies 在过去十年中,对电感耦合等离子体质谱最重要的改良之一在于引入碰撞/反应池 (CRC) 去除多原子干扰。但使用 CRC-ICP-MS 精确测定血液或尿液等复杂基质中的某些金属元素仍面临诸多挑战。NIST 曾发布使用同位素稀释质谱 (IDMS) 测定未知基质中铅含量的方法。IDMS 因其排除了血液的基质效应,被认为是用于分析血液中金属含量的最精确方法 [2, 3]。但 IDMS 方法相对昂贵,并且不能用于测定如锰、砷等单一同位素元素。作为替代,可以使用内标法根据 ISTD 响应变化适当校正分析物响应来补偿基质效应。但是,与同位素稀释不同,因不同基质中 ISTD 的电离行为不同,校准标样和血液溶液中化学组分的差异仍会造成分析误差。在本简报中,我们论证了通过将校准标样的离子强度与血液样品相匹配( 基质匹配),排除内标技术中的误差,并得到和 IDMS 精度相当的结果。我们目前的方法采用正丁醇、NH4OH、H4EDTA 和 Triton X-100 溶液,加入 ISTD 作为血液稀释液。该稀释液是非常好的血液溶剂。另外,我们在相同的溶液中加入氯化钠和氯化钙进行基质匹配,制备校准标样。进行基质匹配时,使用合成基质比广泛应用的全血在操作上更为简便,可信度也更高。
确定







还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《血液中微量镉元素检测方案(等离子体质谱)》,该方案主要用于全血/血清/血浆中微量镉元素检测,参考标准--,《血液中微量镉元素检测方案(等离子体质谱)》用到的仪器有Agilent 7900 电感耦合等离子体质谱仪
推荐专场
相关方案
更多
该厂商其他方案
更多
















