Agilent Captiva 增强型脂质去除产品 EMR-Lipid (Captiva EMR—Lipid) 是一款在 SPE 小柱或 96 孔板中使用的直通式净化产品。本研究展示了采用 Captiva EMR—Lipid 96 孔板对人血清中九种代表性药物化合物进行 LC/MS/MS 定量测定。样品的前处理方法为:采用原位蛋白质沉淀 (PPT) 去除蛋白质,然后采用 Captiva EMR—Lipid 净化去除油脂。整项研究是在 96 孔板上进行批处理。使用同位素或内标类似物对血清中所有九种药物化合物在 0.5–200 ng/mL校准动态范围建立了定量分析方法。采用为期三天的准确度和精度运行来验证方法。结果显示此方法具有出色的校准曲线线性 R2 > 0.99,QC 的所有五个水平都具有优异的准确性(定量下限 (LLOQ) < 20%,其他水平的 < 15%)以及精度 (RSD < 15%)。本文也对方法的选择性和交叉污染进行了评估。结果表明,采用原位 PPT 和 Captiva EMR—Lipid 净化包确立的方案显著改善了生物基质中药物化合物定量分析结果的可靠性。
方案详情

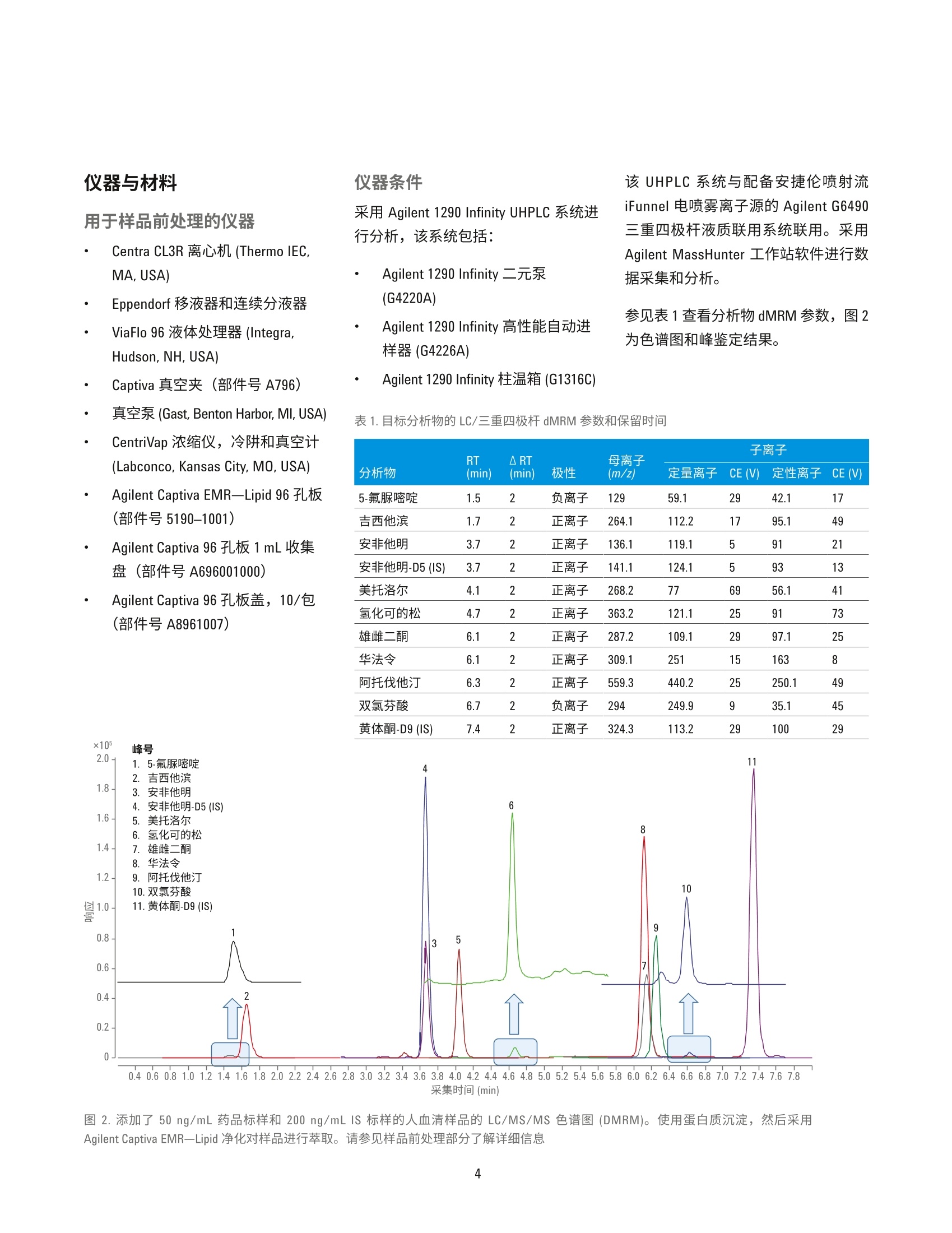
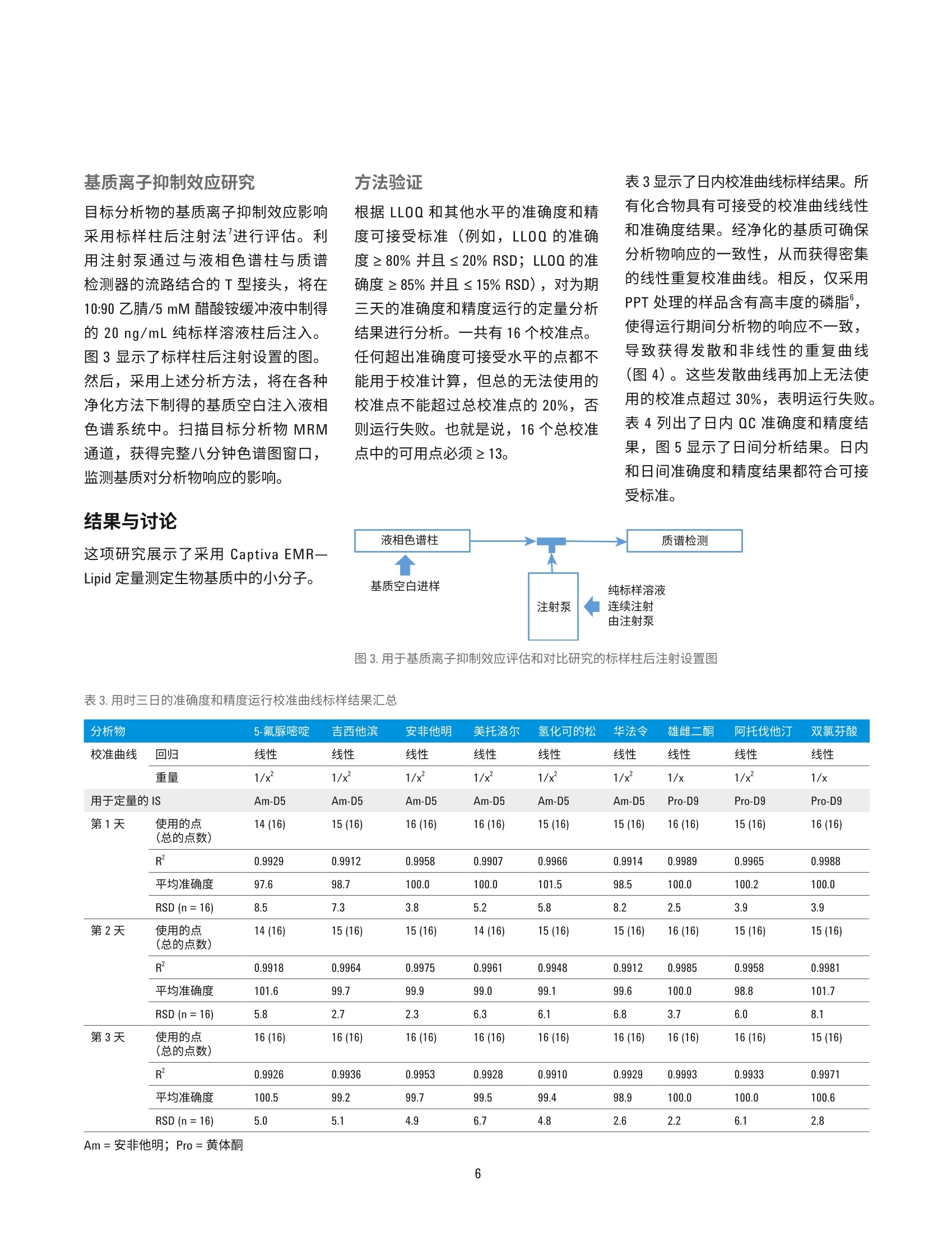
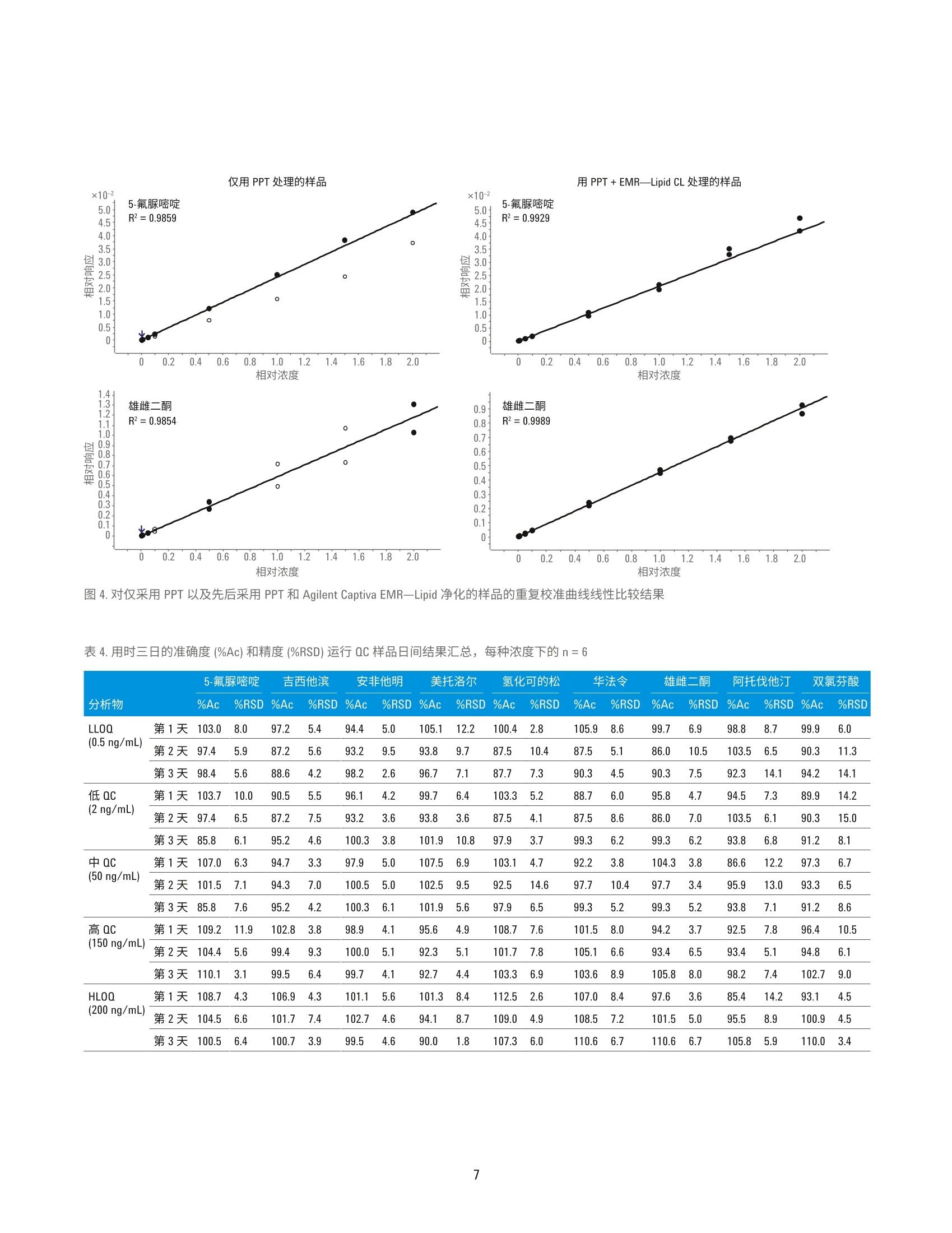
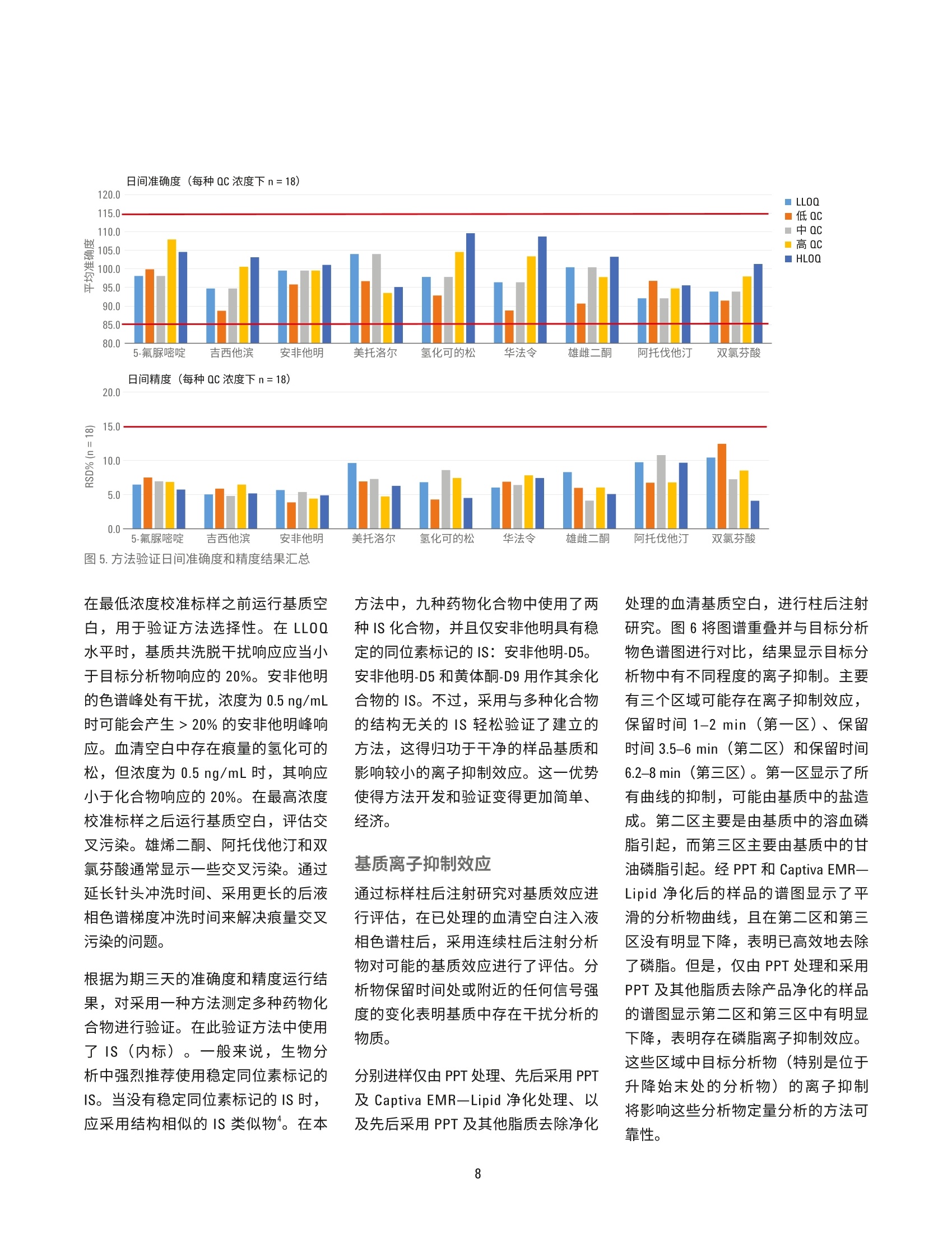
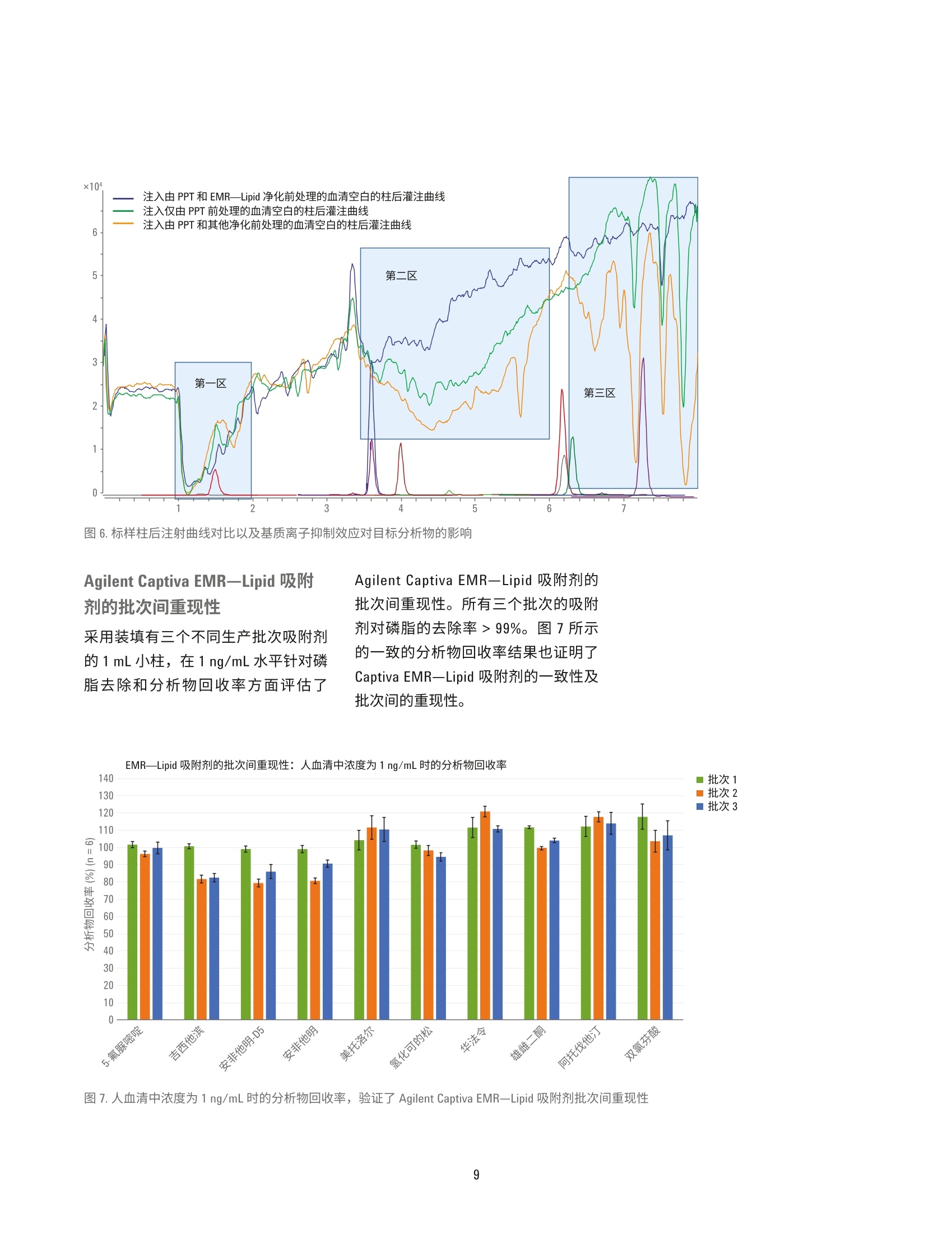
HPLC 条件 使用 Agilent Captiva EMR-Lipid净化对人血清中的药物进行 LC/MS/MS定量分析 应用简报 临床研究 作者 摘要 Limian Zhao 和 Derick Lucas 安捷伦科技公司 Agilent Captiva 增强型脂质去除产品 EMR-Lipid (Captiva EMR-Lipid) 是一款在 SPE 小柱或 96孔板中使用的直通式净化产品。本研究展示了采用Captiva EMR-Lipid 96 孔板对人血清中九种代表性药物化合物进行 LC/MS/MS定量测定。样品的前处理方法为:采用原位蛋白质沉淀 (PPT)去除蛋白质,然后采用 Captiva EMR-Lipid 净化去除油脂。整项研究是在96孔板上进行批处理。使用同位素或内标类似物对血清中所有九种药物化合物在 0.5-200 ng/mL校准动态范围建立了定量分析方法。采用为期三天的准确度和精度运行来验证方法。结果显示此方法具有出色的校准曲线线性R>0.99, QC 的所有五个水平都具有优异的准确性(定量下限(LLOQ)<20%,其他水平的<15%)以及精度 (RSD<15%)。本文也对方法的选择性和交叉污染进行了评估。结果表明,采用原位 PPT 和 Captiva EMR-Lipid 净化包确立的方案显著改善了生物基质中药物化合物定量分析结果的可靠性。 Agilent Technologies 前言 定量测定生物基质中目标药物和代谢化合物的生物分析方法通常采用基于96孔板的高通量样品前处理方法。将样品直接等量加入96孔板,分析物萃取和基质净化的所有的样品前处理操作都在96孔板中进行。该流程具有较高的效率和生产力,广泛用于生物分析行业。生物定量分析的方法验证通常涉及严格、全面的要求,包括重复曲线的校准曲线线性、校准标样准确度、动态范围内强化质量控制(QC)样品的准确度和精度、方法的选择性、交叉污染和样品处理中分析物稳定性试验。严格的可接受标准为定量下限(LLOQ) 为 100%±20%准确度、其他水平为100%±15%准确度, LLOQ 为≤20%RSD, 其他水平为≤15%RSD。 基于96孔板的样品前处理技术通常包括固相萃取(SPE)、液液萃取 (LLE)、固相支持液相萃取 (SLE)以及蛋白质沉淀 (PPT)。 SPE 应用广泛,可用于生物体液中小分子的 LC/MS/MS 定量分析,能够高效完成基质净化。但是,SPE 需要进行更多的方法开发研究,还需要采用多个步骤来进行捕集,然后再洗脱目标分析物。相比 SPE, LLE或 SLE 有时能够更高效地去除磷脂,但强极性分析物的回收率通常又是一大难题。PPT 是生物体液样品前处理方法中最简单、最经济的一种,因此被广泛采用。有机溶剂如乙腈或甲醇用于解离生物体液样品,去除蛋白质。该方法并不会去除磷脂,因此会为定量分析方法和仪器维护带来很多问题。 Agilent Captiva 增强型脂去去除EMR-Lipid (Captiva EMR-Lipid) 产品系列是一种新型吸附材料,能够选择性去除样品基质中的主要脂类且不会造成分析物意外损失。脂质去除作用机制是利用体积排阻以及脂类的长脂肪链与 EMR-Lipid 吸附剂之间的疏水作用。选择性相互作用机制可以在 PPT后有效地从生物体液中去除磷脂和其他种类的脂质。 Captiva EMR-LipidSPE 小柱/多孔板可以在直通净化后进行原位 PPT。其他应用简报对生物体液中磷脂去除效率进行了全面评估和对比,证实了在 PPT处理后,Captiva EMR-Lipid 具有出色的磷脂去除效率。在本项研究中,采用CaptivaEMR-Lipid 96 孔案方案对生物体液中的代表性小分子药物化合物进行了定量分析,并且获得了出色结果。所选的药物化合物在极性(亲水性和疏水性)和官能性(酸性、中性和碱性)方面差别很大。图1列出了目标分析物的化学性质和结构。根据标准生物分析方法验证指南对方法进行了验证。此外,研究三个样品批次的磷脂去除和分析物回收率,对 CaptivaEMR-Lipid 吸附剂批次间重现性进行了评估。 NH.O NOH HO 0OH11F华法令 吉西他滨Log P=2.7, 弱酸 Log P=-1.4, 酸性//O、H HN NH0雄雌二酮 5-氟脲嘧啶LogP=2.8, 中性 Log P=-0.8, 碱性.CINHNH.CI ·0HCH.双氯芬酸 安非他明Log P=4.51, 酸性 Log P=1.76, 碱性OHCH.H,CO- CH,美托洛尔Log P=1.88,碱性OHHO IIII0HH0氢化可的松Log P=1.6, 中性OHOHOOHNHF阿托伐他汀Log P=5.7, 弱酸 图1.代表性药物化合物的化学结构和属性 实验 试剂与化学品 所有试剂和溶剂均为HPLC 或分析纯级。乙乙(ACN)购自 Honeywell (Muskegon,MI, USA)。试剂级甲酸(FA)购自安捷伦公公(部件号G2453-85060)。化学标准品和其他化学品以纯粉末或标准储备液购自 Sigma (St. Louis, MO,USAI)。人血清购自 Biological SpecialtyCorporation (Colmar, PA, USA)。 标样和溶液 标样和内标 (IS) 储备液用甲醇或 DMSO配制,浓度为2.0mg/ml。混合标样加标溶液分别采用 1:1乙腈/水配制,浓度为 25 pg/mL。添加至等量样品的内标工作溶溶采用 2:8ACN/水配制,浓度为2 pg/mL。 向20mL乙腈中加入200pLFA, 制成1%FA 的乙腈溶液。该溶液用于蛋白质沉淀。 将385.3 mg 醋酸铵溶解到1LMilli-Q水中,然后加入1mL FA, 从而制得0.1%FA的5mM醋酸铵缓冲液(作为流动相A)。向1L乙腈中加入1mLFA,制成0.1% FA的乙腈溶液(作为流动相B)。 将77.06 mg 醋酸铵溶于 200 mL Milli-Q水中,制得5mM 醋酸铵溶液。以 9:1的比例混合缓冲液和乙腈,制成复溶溶液。混合 80mL 乙腈和 20 mL 水,制成 80:20乙腈/水溶液。 停止时间 8 min (部件号699775-902) Agilent InfinityLab Poroshell 120 保护柱, EC-C18,5×2.1 mm, 2.7 pm (部件号821725-911) 后运行时间 3 min 流速 0.3 mL/min 柱温 30°℃ 自动进样器温度 4°C 进样量 8pL 流动相 A)5 mM 醋酸铵缓冲液,含0.1%甲酸的水溶液 B)0.1%甲酸的乙腈溶液 进样针清洗 1:1:1:1 ACN/MeOH/IPA/H,0, 含0.2%FA,冲洗时间: 7.5s MS 条件 参数 值 干燥气温度 120°C 干燥气流速 14L/min 雾化器压力 40 psi 鞘气温度 400°C 鞘气流速 12 L/min 毛细管电压 3000V iFunnel 参数 高压RF: 150V(正离子), 90V(负离子) 低压RF: 60V(正离子),60V(负离子) 仪器与材料 用于样品前处理的仪器 Centra CL3R 离心机 (Thermo IEC,MA, USA) Eppendorf移液器和连续分液器 ViaFlo 96 液体处理器 (Integra,Hudson,NH, USA) Captiva 真空夹(部件号A796) 真空泵 (Gast, Benton Harbor, MI, USA) CentriVap 浓缩仪,冷阱和真空计(Labconco, Kansas City, MO, USA) Agilent Captiva EMR-Lipid 96 孔板(部件号5190-1001) Agilent Captiva 96 孔板 1 mL 收集盘(部件号A696001000) Agilent Captiva 96 孔板盖, 10/包(部件号A8961007) ×105 峰号 2.0- 0.40.60.81.01.21.41.61.82.02.22.42.62.83.03.23.43.63.84.04.24.44.64.8 5.0 5.25.45.65.86.06.26.46.66.87.07.27.4 7.6 7.8采集时间(min) 仪器条件 采用 Agilent 1290 Infinity UHPLC 系统进行分析,该系统包括: Agilent 1290 Infinity 二元泵(G4220A) Agilent 1290 Infinity 高性能自动进样器(G4226A) Agilent 1290 Infinity 柱温箱 (G1316C) 该 UHPLC 系统与配备安捷伦喷射流iFunnel 电喷雾离子源的 Agilent G6490三重四极杆液质联用系统联用。采用Agilent MassHunter 工作站软件进行数据采集和分析。 参见表1查看分析物 dMRM参数,图2为色谱图和峰鉴定结果。 校准标样和QC样品前处理 使用 25 pg/mL 1:1乙腈/水的标样工作溶液在血清中制得标准校准曲线标样。为了减少溶剂加标对基质的影响,每次校准标样加标时新配置250 ng/mL的新鲜血清中间样品。校准曲线的动态范围为 0.5-200 ng/mL, 包括0.5、1、5、10、50、100、150和200ng/mL。将合适体积的新鲜血清中间样品加入空白血清中,然后涡旋混合,从而制得这些标样。运行5个水平的 QC样品,进行准确度和精度方法验证测试。这些水平包括 0.5 ng/mL (LL0Q)、2ng/mL (低QC)、50ng/mL (中QC)、150ng/mL (高QC)和 200 ng/mL (定量上限(HL0Q))。这些 QC样品通过加入合适体积的血清中间样品制得。所有校准标样和 QC都在2mL卡口盖管中制得。然后将其等量加入96孔板中进行萃取。 样品萃取 表2详细描述了样品前处理流程。在Captiva EMR-Lipid 孔板中向蛋白沉淀溶剂加入血清样品之前,先将血清样品等量加至收集盘,然后再加入内标溶液,这点非常重要。首先,这有助于同时传送多个样品至 EMR-Lipid 板中,可在孔板中同时进行 PPT, 还能提高样品重现性。其次,重要的是将内标溶液添加至生物基质中,然后再进行混合,这样使得内标溶液达到平衡,在萃取之前能结合蛋白质,从而确保内标和目标分析物行为一致。 步骤 操作参数 将每个样品等分至1mL 96孔板中。 100 pL 将IS工作溶液添加到除对照空白以外的每个样品中或者将50:50 ACN/水10 pL 将IS工作溶液添加到除对照空白以外的每个样品中或者将50:50 ACN/水 10 pL 添加至对照空白中。 使用孔板盖盖好,然后以2500rpm 速度涡旋。 1 min 将含1%FA的 ACN 溶液加入位于另一个1mL 收集盘的 Agilent Captiva 300 pL EMR-Lipid 板上。 使用96液体处理器将整个样品混合物转移至 EMR-Lipid 板上。 110 pL 使用移液头将样品混合物在 EMR-Lipid 板上混合。 3-5 次 将 CapiVac 真空夹插入 EMR-Lipid 板和收集盘之间。 向每个样品中添加补偿溶液 (80:20 ACN/水) 300 pL 施加适当的真空进行逐步稳定的洗脱。 2-4英寸汞柱 最后,采用较高的真空对柱床进行排液。 8-10英寸汞主 移去收集盘,使用 CentriVap 蒸发干燥。 40 °C 使用 10:90 ACN/5 mM 醋酸铵缓冲液复溶。 100 pL 采用 2500 rpm 速度涡旋、超声,用盘垫盖住。 2 min +5 min 基质空白 第二组校准标样 2-3基质空白 每个验证运行中总共有56到58个样品。 基质离子抑制效应研究 目标分析物的基质离子抑制效应影响采用标样柱后注射法'进行评估。利用注射泵通过与液相色谱柱与质谱检测器的流路结合的T型接头,将在10:90乙腈/5mM醋酸铵缓冲液中制得的 20 ng/mL 纯标样溶液柱后注入。图3显示了标样柱后注射设置的图。然后,采用上述分析方法,将在各种净化方法下制得的基质空白注入液相色谱系统中。扫描目标分析物 MRM通道,获得完整八分钟色谱图窗口,监测基质对分析物响应的影响。 结果与讨论 这项研究展示了采用 Captiva EMR一Lipid 定定测定生物基质中的小分子。 方法验证 根据 LLOQ和其他水平的准确度和精度可接受标准(例如, LLOQ的准确度≥80%并且≤20% RSD; LLOQ的准确度≥85%并且≤15%RSD),对为期三天的准确度和精度运行的定量分析结果进行分析。一共有16个校准点。任何超出准确度可接受水平的点都不能用于校准计算,但总的无法使用的校准点不能超过总校准点的20%,否则运行失败。也就是说,16个总校准点中的可用点必须≥13。 表3显示了日内校准曲线标样结果。所有化合物具有可接受的校准曲线线性和准确度结果。经净化的基质可确保分析物响应的一致性,从而获得密集的线性重复校准曲线。相反,仅采用PPT处理的样品含有高丰度的磷脂,使得运行期间分析物的响应不一致,导致获得发散和非线性的重复曲线(图4)。这些发散曲线再加上无法使用的校准点超过 30%,表明运行失败。表4列出了日内QC准确度和精度结果, 图5显示了日间分析结果。日内和日间准确度和精度结果都符合可接受标准。 表3.用时三日的准确度和精度运行校准曲线标样结果汇总 分析物 5-氟脲嘧啶 吉西他宾 安非他明 美托洛尔 氢化可的松 华法令 雄雌二酮 阿托伐他汀 双氯芬酸 校准曲线 回归 线性 线性 线性 线性 线性 线性 线性 线性 线性 重量 1/x 1/x’ 1/x 1/x² 1/x² 1/x 1/x 1/x 1/x 用于定量的IS Am-D5 Am-D5 Am-D5 Am-D5 Am-D5 Am-D5 Pro-D9 Pro-D9 Pro-D9 第1天 使用的点 (总的点数) 14 (16) 15(16) 16(16) 16(16) 15(16) 15(16) 16(16) 15(16) 16(16) R² 0.9929 0.9912 0.9958 0.9907 0.9966 0.9914 0.9989 0.9965 0.9988 平均准确度 97.6 98.7 100.0 100.0 101.5 98.5 100.0 100.2 100.0 RSD (n=16) 8.5 7.3 3.8 5.2 5.8 8.2 2.5 3.9 3.9 第2天 使用的点 (总的点数) 14(16) 15(16) 15(16) 14(16) 15(16) 15(16) 16(16) 15(16) 15(16) R2 0.9918 0.9964 0.9975 0.9961 0.9948 0.9912 0.9985 0.9958 0.9981 平均准确度 101.6 99.7 99.9 99.0 99.1 99.6 100.0 98.8 101.7 RSD (n=16) 5.8 2.7 2.3 6.3 6.1 6.8 3.7 6.0 8.1 第3天 使用的点 (总的点数) 16(16) 16(16) 16(16) 16(16) 16(16) 16(16) 16(16) 16(16) 15(16) R² 0.9926 0.9936 0.9953 0.9928 0.9910 0.9929 0.9993 0.9933 0.9971 平均准确度 100.5 99.2 99.7 99.5 99.4 98.9 100.0 100.0 100.6 RSD (n=16) 5.0 5.1 4.9 6.7 4.8 2.6 2.2 6.1 2.8 图4.对仅采用 PPT 以及先后采用 PPT 和 Agilent Captiva EMR-Lipid 净化的样品的重复校准曲线线性比较结果 表4.用时三日的准确度(%Ac) 和精度 (%RSD) 运行QC样品日间结果汇总,每种浓度下的n=6 5-氟脲嘧啶 吉西他滨 安非他明 美托洛尔 氢化可的松 华法令 雄雌二酮 阿托伐他汀 双氯芬酸 分析物 %Ac %RSD %Ac %RSD %Ac %RSD %Ac %RSD %Ac %RSD %Ac %RSD %Ac %RSD %Ac %RSD %Ac %RSD LLOQ 第1天103.0 8.0 97.2 5.4 94.4 5.0 105.1 12.2 100.4 2.8 105.9 8.6 99.7 6.9 98.8 8.7 99.9 6.0 (0.5 ng/mL) 第2天97.4 5.9 87.2 5.6 93.2 9.5 93.8 9.7 87.5 10.4 87.5 5.1 86.0 10.5 103.5 6.5 90.3 11.3 第3天98.4 5.6 88.6 4.2 98.2 2.6 96.7 7.1 87.7 7.3 90.3 4.5 90.3 7.5 92.3 14.1 94.2 14.1 低QC 第1天1103.7 10.0 90.5 5.5 96.1 4.2 99.7 6.4 103.3 5.2 88.7 6.0 95.8 4.7 94.5 7.3 89.9 14.2 (2ng/mL) 第2天97.4 6.5 87.2 7.5 93.2 3.6 93.8 3.6 87.5 4.1 87.5 8.6 86.0 7.0 103.5 6.1 90.3 15.0 第3天85.8 6.1 95.2 4.6 100.3 3.8 101.9 10.8 97.9 3.7 99.3 6.2 99.3 6.2 93.8 6.8 91.2 8.1 中QC 第1天107.0 6.3 94.7 3.3 97.9 5.0 107.5 6.9 103.1 4.7 92.2 3.8 104.3 3.8 86.6 12.2 97.3 6.7 (50 ng/mL) 第2天1101.5 7.1 94.3 7.0 100.5 5.0 102.5 9.5 92.5 14.6 97.7 10.4 97.7 3.4 95.9 13.0 93.3 6.5 第3天85.8 7.6 95.2 4.2 100.3 6.1 101.9 5.6 97.9 6.5 99.3 5.2 99.3 5.2 93.8 7.1 91.2 8.6 高QC 第1天109.2 11.9 102.8 3.8 98.9 4.1 95.6 4.9 108.7 7.6 101.5 8.0 94.2 3.7 92.5 7.8 96.4 10.5 (150 ng/mL) 第2天104.4 5.6 99.4 9.3 100.0 5.1 92.3 5.1 101.7 7.8 105.1 6.6 93.4 6.5 93.4 5.1 94.8 6.1 第3天1110.1 3.1 99.5 6.4 99.7 4.1 92.7 4.4 103.3 6.9 103.6 8.9 105.8 8.0 98.2 7.4 LLOQ 低QCM1中QC高QCHLOO 图5.方法验证日间准确度和精度结果汇总 在最低浓度校准标样之前运行基质空白,用于验证方法选择性。在 LLOQ水平时,基质共洗脱干扰响应应当小于目标分析物响应的20%。安非他明的色谱峰处有干扰,浓度为0.5 ng/mL时可能会产生>20%的安非他明峰响应。血清空白中存在痕量的氢化可的松,但浓度为 0.5 ng/mL时, 其响应小于化合物响应的20%。在最高浓度校准标样之后运行基质空白,评估交叉污染。雄烯二酮、阿托伐他汀和双氯芬酸通常显示一些交叉污染。通过延长针头冲洗时间、采用更长的后液相色谱梯度冲洗时间来解决痕量交叉 污染的问题。 根据为期三天的准确度和精度运行结果,对采用一种方法测定多种药物化合物进行验证。在此验证方法中使用了IS(内标)。一般来说,生物分析中强烈推荐使用稳定同位素标记的IS。当没有稳定同位素标记的IS时,应采用结构相似的 IS 类似物。在本 方法中,九种药物化合物中使用了两种IS化合物,并且仅安非他明具有稳定的同位素标记的 IS:安非他明-D5。安非他明-D5和黄体酮-D9用作其余化合物的IS。不过,采用与多种化合物的结构无关的 IS 轻松验证了建立的方法,这得归功于干净的样品基质和影响较小的离子抑制效应。这一优势使得方法开发和验证变得更加简单、经济。 基质离子抑制效应 通过标样柱后注射研究对基质效应进行评估,在已处理的血清空白注入液相色谱柱后,采用连续柱后注射分析物对可能的基质效应进行了评估。分析物保留时间处或附近的任何信号强度的变化表明基质中存在干扰分析的物质。 分别进样仅由 PPT处理、先后采用 PPT及 Captiva EMR-Lipid 净化处理、以及先后采用 PPT 及其他脂质去除净化 处理的血清基质空白,进行柱后注射研究。图6将图谱重叠并与目标分析物色谱图进行对比,结果显示目标分析物中有不同程度的离子抑制。主要有三个区域可能存在离子抑制效应,保留时间1-2 min(第一区)、保留时间3.5-6 min(第二区)和保留时间6.2-8 min(第三区)。第一区显示了所有曲线的抑制,可能由基质中的盐造成。第二区主要是由基质中的溶血磷脂引起,而第三区主要由基质中的甘油磷脂引起。经 PPT 和 Captiva EMR一Lipid 净化后的样品的谱图显示了平滑的分析物曲线,且在第二区和第三区没有明显下降,表明已高效地去除了磷脂。但是,仅由 PPT处理和采用PPT及其他脂质去除产品净化的样品的谱图显示第二区和第三区中有明显下降,表明存在磷脂离子抑制效应。这些区域中目标分析物(特别是位于升降始末处的分析物)的离子抑制将影响这些分析物定量分析的方法可靠性。 图6.标样柱后注射曲线对比以及基质离子抑制效应对目标分析物的影响 Agilent Captiva EMR-Lipid 吸附剂的批次间重现性 采用装填有三个不同生产批次吸附剂的1mL小柱, 在1 ng/mL水平针对磷脂去除和分析物回收率方面评估了 Agilent Captiva EMR-Lipid 吸附剂的批次间重现性。所有三个批次的吸附剂对磷脂的去除率>99%。图7所示的一致的分析物回收率结果也证明了Captiva EMR-Lipid 吸附剂的一致性及批次间的重现性。 图7.人血清中浓度为1 ng/mL 时的分析物回收率,验证了 Agilent Captiva EMR-Lipid 吸附剂批次间重现性 结论 本文验证了用于定量测定人血清中九种代表性药物化合物的样品前处理方法,该方法先后采用 PPT 和 AgilentCaptiva 增强型脂质去除净化。用时三日的准确度和精度运行结果验证了该方法具有较宽的动态范围,重复的校准曲线具有可重现的线性,并且具有出色的日内和日间准确度和精度。标样柱后注射研究表明,与仅 PPT和先后采用 PPT 和其他脂质去除净化相比,本方法显著减少了基质离子抑制效应。从出色的定量结果可以看出,干净的基质使得建立的方法更为可靠。干净的基质允许使用 IS 类似物甚至是结构不相干的IS, 而不必采用昂贵、稳定的同位素标记 IS, 使得方法验证更轻松,样品分析更为经济。 ( 参考文献 ) ( 1. US Food and Drug A d ministration, Guidance for Industry Bioanalytical Method Validation 2001 ) ( 5. M ichopoulos, F.; e t al. E xtraction methods for the removal of phospholipids and other endogenousmaterial from a biological fluid.Bioanalysis 2011, 3, 2747-2755 ) ( 2. B ylda, C.; Thiele , R. Recent advances in sample preparation techniques to overcome difficulties encountered during quantitative analysis of small molecules from biofluids using LC-MS/MS. The Analyst 2014, 139, 2265-2276 ) ( 6. Z hao, L.; Lucas, D. Efficiency ofBiological Fluid Matrix Removal u s ing Captiva EMR-Lipid Clean u p.(使用 Captiva EMR-Lipid 净化去除生物 体液基质的效率)安捷伦科技公司 应用简报,出版号5991-8006EN, 2017 ) ( 3 . L eon,Z.;et al. S olid-phase extractionliquid chromatography-tandem massspectrometry analytical method for the determination o f 2-hydroxy- 4-methoxybenzophenone and its metabolites in both human urine andsemen. Analytical and Bioanalytical Chemistry 2010, 398,831-843 ) ( 7 . B onfiglio, R .; et al. The effects of sample p reparation methods on the variability of the electrospray ionization response f or model drug compounds. Rapid Communications in Mass Spectrometry 1999, 1 3, 1175-1185 ) 4.NMulvana, D.E. Critical topics inensuring data quality in bioanalyticalLC-MS method development.Bioanalysis 2010, 2, 1051-1072 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China _800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com 本文信息如有变更,恕不另行通知 @安捷伦科技(中国)有限公司, 2017 2017年4月27日,中国出版 5991-8007CHCN Agilent Technologies 摘要Agilent Captiva 增强型脂质去除产品 EMR-Lipid (Captiva EMR—Lipid) 是一款在 SPE 小柱或 96 孔板中使用的直通式净化产品。本研究展示了采用 Captiva EMR—Lipid 96 孔板对人血清中九种代表性药物化合物进行 LC/MS/MS 定量测定。样品的前处理方法为:采用原位蛋白质沉淀 (PPT) 去除蛋白质,然后采用 Captiva EMR—Lipid 净化去除油脂。整项研究是在 96 孔板上进行批处理。使用同位素或内标类似物对血清中所有九种药物化合物在 0.5–200 ng/mL校准动态范围建立了定量分析方法。采用为期三天的准确度和精度运行来验证方法。结果显示此方法具有出色的校准曲线线性 R2 > 0.99,QC 的所有五个水平都具有优异的准确性(定量下限 (LLOQ) < 20%,其他水平的 < 15%)以及精度 (RSD < 15%)。本文也对方法的选择性和交叉污染进行了评估。结果表明,采用原位 PPT 和 Captiva EMR—Lipid 净化包确立的方案显著改善了生物基质中药物化合物定量分析结果的可靠性。前言定量测定生物基质中目标药物和代谢化合物的生物分析方法通常采用基于 96 孔板的高通量样品前处理方法。将样品直接等量加入 96 孔板,分析物萃取和基质净化的所有的样品前处理操作都在 96 孔板中进行。该流程具有较高的效率和生产力,广泛用于生物分析行业。生物定量分析的方法验证通常涉及严格、全面的要求,包括重复曲线的校准曲线线性、校准标样准确度、动态范围内强化质量控制 (QC) 样品的准确度和精度、方法的选择性、交叉污染和样品处理中分析物稳定性试验。严格的可接受标准为定量下限 (LLOQ) 为 100%±20% 准确度、其他水平为 100%±15% 准确度,LLOQ 为 ≤ 20% RSD,其他水平为 ≤ 15% RSD。基于 96 孔板的样品前处理技术通常包括固相萃取 (SPE)、液液萃取 (LLE)、固相支持液相萃取 (SLE) 以及蛋白质沉淀 (PPT)。SPE 应用广泛,可用于生物体液中小分子的 LC/MS/MS 定量分析,能够高效完成基质净化。但是,SPE 需要进行更多的方法开发研究,还需要采用多个步骤来进行捕集,然后再洗脱目标分析物。相比 SPE,LLE或 SLE 有时能够更高效地去除磷脂,但强极性分析物的回收率通常又是一大难题。PPT 是生物体液样品前处理方法中最简单、最经济的一种,因此被广泛采用。有机溶剂如乙腈或甲醇用于解离生物体液样品,去除蛋白质。该方法并不会去除磷脂,因此会为定量分析方法和仪器维护带来很多问题。Agilent Captiva 增强型脂质去除 EMRLipid (Captiva EMR—Lipid) 产品系列是一种新型吸附材料,能够选择性去除样品基质中的主要脂类且不会造成分析物意外损失。脂质去除作用机制是利用体积排阻以及脂类的长脂肪链与 EMR—Lipid 吸附剂之间的疏水作用。选择性相互作用机制可以在 PPT 后有效地从生物体液中去除磷脂和其他种类的脂质。Captiva EMR—Lipid SPE 小柱/多孔板可以在直通净化后进行原位 PPT。其他应用简报对生物体液中磷脂去除效率进行了全面评估和对比,证实了在 PPT 处理后,Captiva EMR—Lipid 具有出色的磷脂去除效率。在本项研究中,采用 Captiva EMR—Lipid 96 孔板方案对生物体液中的代表性小分子药物化合物进行了定量分析,并且获得了出色结果。所选的药物化合物在极性(亲水性和疏水性)和官能性(酸性、中性和碱性)方面差别很大。图 1 列出了目标分析物的化学性质和结构。根据标准生物分析方法验证指南对方法进行了验证。此外,研究三个样品批次的磷脂去除和分析物回收率,对 Captiva EMR—Lipid 吸附剂批次间重现性进行了评估。结论本文验证了用于定量测定人血清中九种代表性药物化合物的样品前处理方法,该方法先后采用 PPT 和 Agilent Captiva 增强型脂质去除净化。用时三日的准确度和精度运行结果验证了该方法具有较宽的动态范围,重复的校准曲线具有可重现的线性,并且具有出色的日内和日间准确度和精度。标样柱后注射研究表明,与仅 PPT 和先后采用 PPT 和其他脂质去除净化相比,本方法显著减少了基质离子抑制效应。从出色的定量结果可以看出,干净的基质使得建立的方法更为可靠。干净的基质允许使用 IS 类似物甚至是结构不相干的 IS,而不必采用昂贵、稳定的同位素标记 IS,使得方法验证更轻松,样品分析更为经济。
确定





还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《人血清中药物检测方案(液相色谱仪)》,该方案主要用于全血/血清/血浆中生化检验检测,参考标准--,《人血清中药物检测方案(液相色谱仪)》用到的仪器有Agilent 1290 Infinity II 液相色谱系统、Agilent 6470 三重四极杆液质联用系统、Agilent 1290 Infinity II Multisampler
推荐专场
相关方案
更多
该厂商其他方案
更多
























