方案详情
文
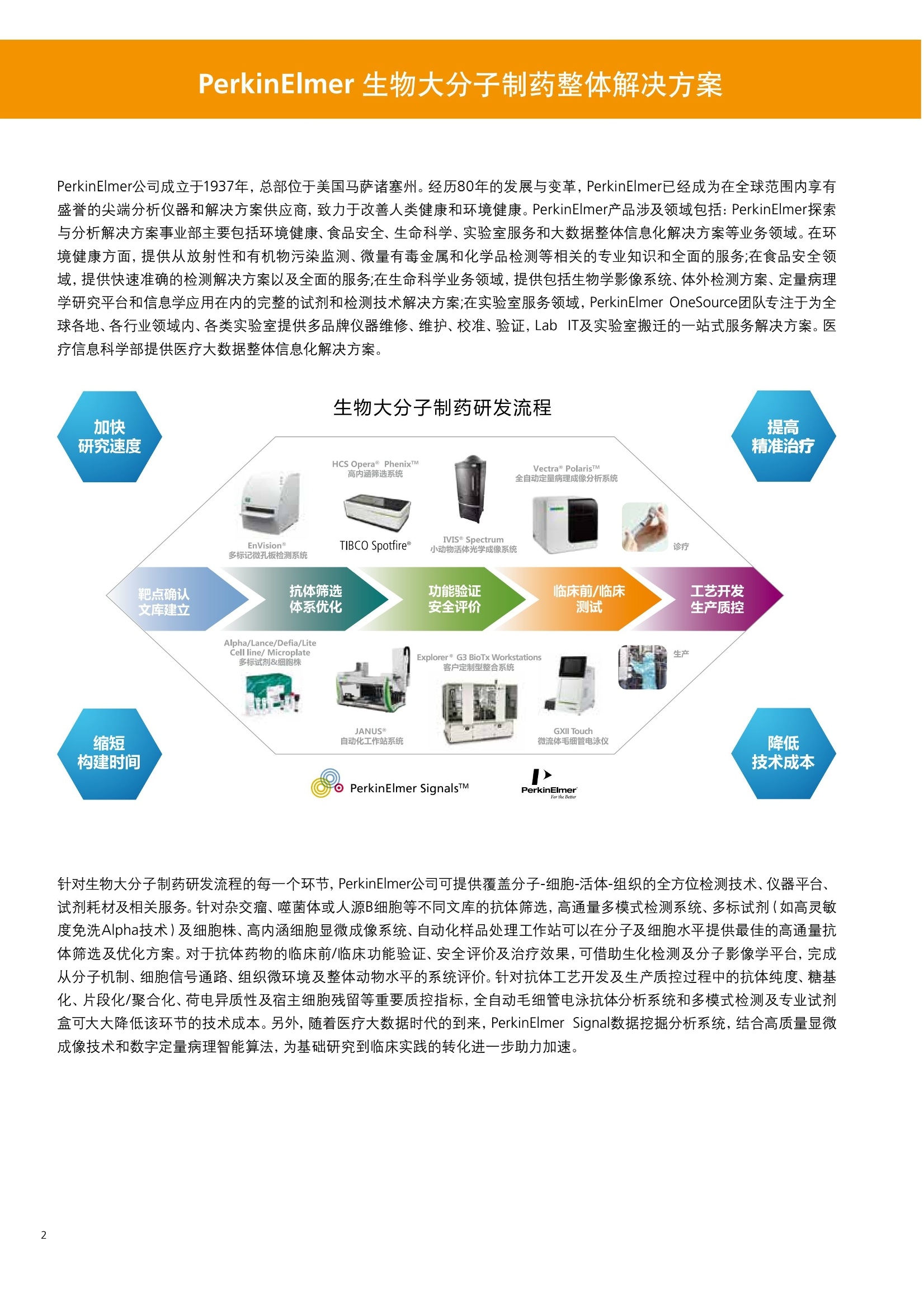
针对生物大分子制药研发流程的每一个环节,PerkinElmer公司可提供覆盖分子-细胞-活体-组织的全方位检测技术、仪器平台、试剂耗材及相关服务。针对杂交瘤、噬菌体或人源B细胞等不同文库的抗体筛选,高通量多模式检测系统、多标试剂(如高灵敏度免洗Alpha技术)及细胞株、高内涵细胞显微成像系统、自动化样品处理工作站可以在分子及细胞水平提供最佳的高通量抗体筛选及优化方案。对于抗体药物的临床前/临床功能验证、安全评价及治疗效果,可借助生化检测及分子影像学平台,完成从分子机制、细胞信号通路、组织微环境及整体动物水平的系统评价。针对抗体工艺开发及生产质控过程中的抗体纯度、糖基化、片段化/聚合化、荷电异质性及宿主细胞残留等重要质控指标,全自动毛细管电泳抗体分析系统和多模式检测及专业试剂盒可大大降低该环节的技术成本。另外,随着医疗大数据时代的到来,PerkinElmer Signal数据挖掘分析系统,结合高质量显微成像技术和数字定量病理智能算法,为基础研究到临床实践的转化进一步助力加速。
方案详情

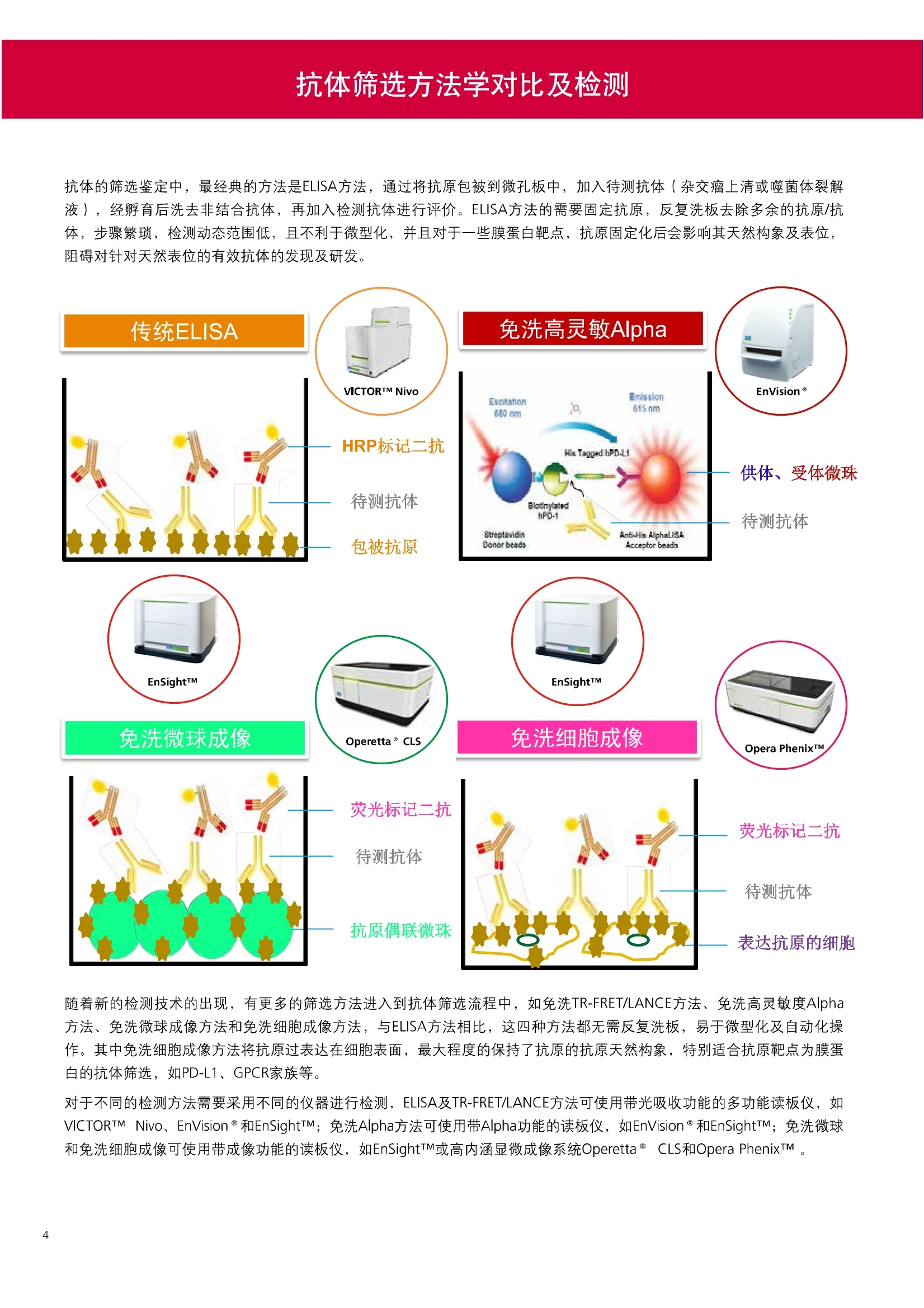
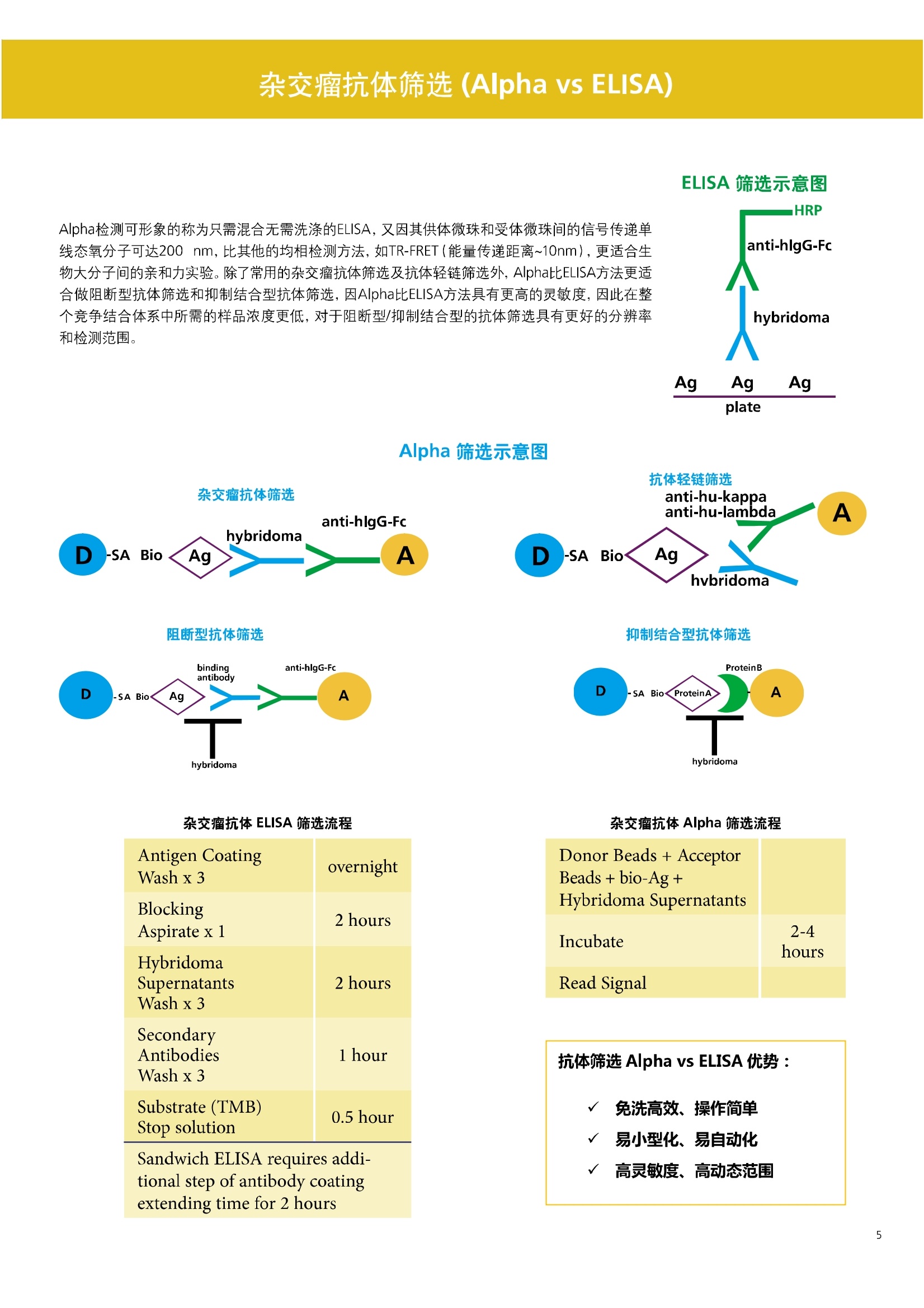
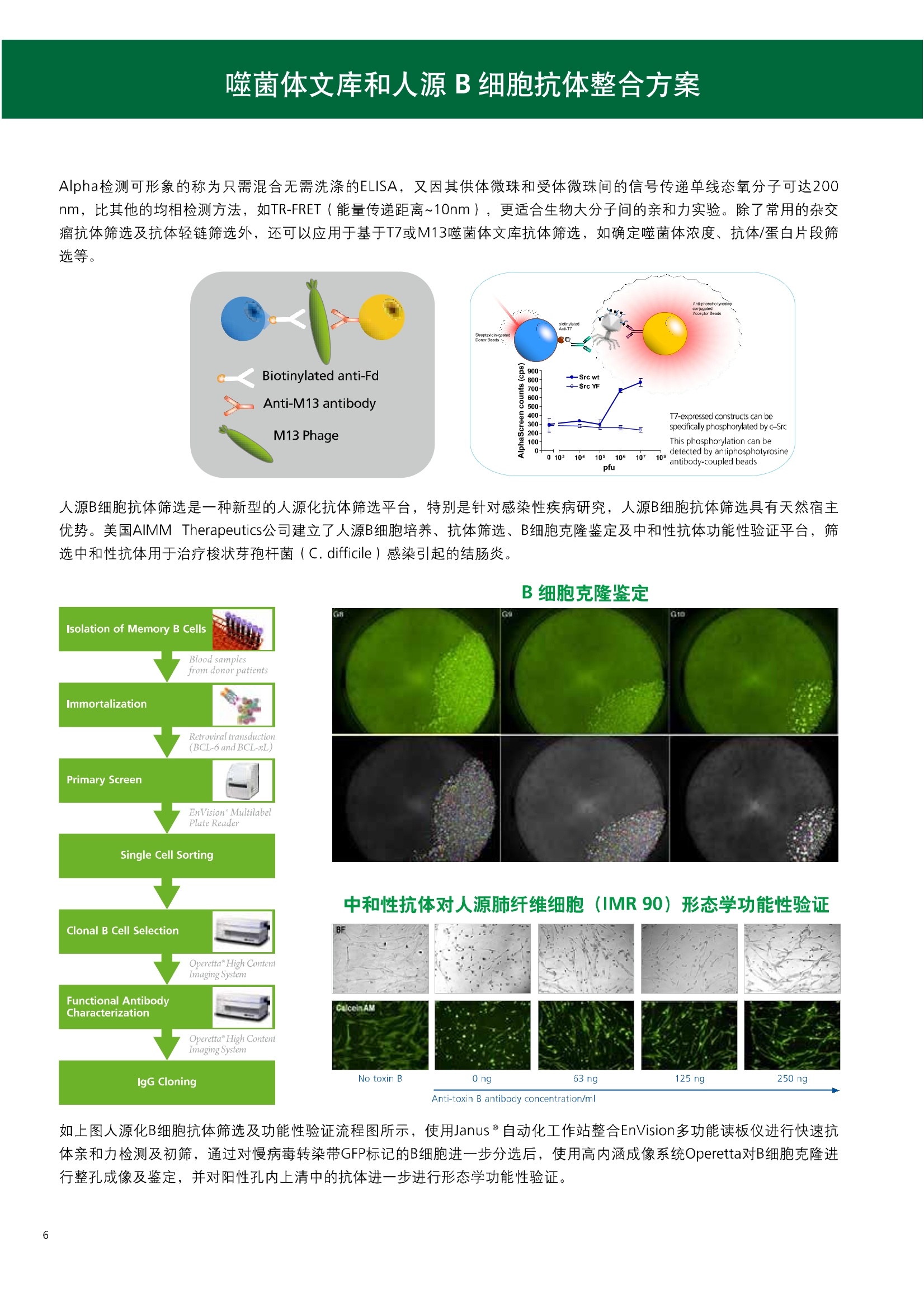
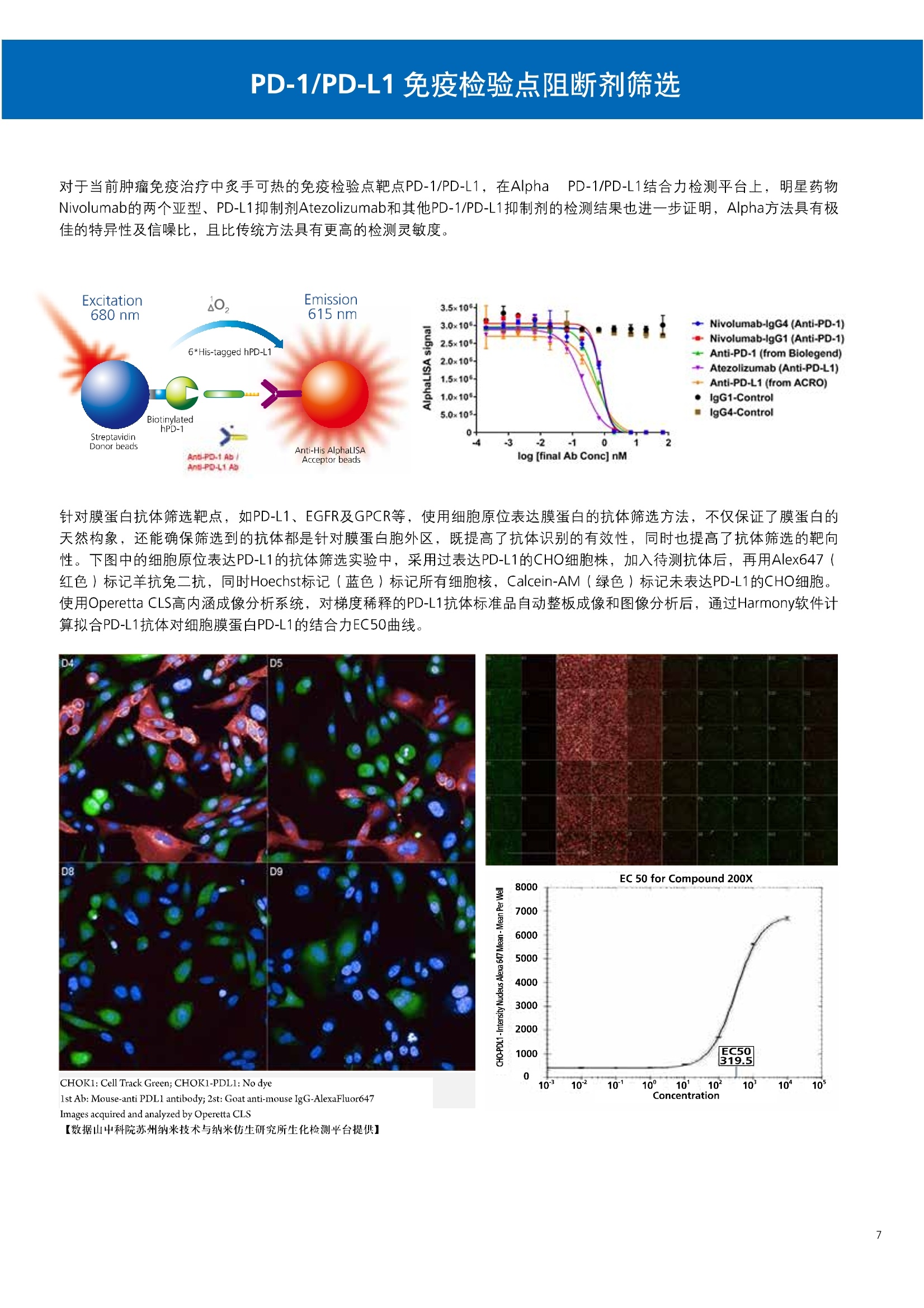
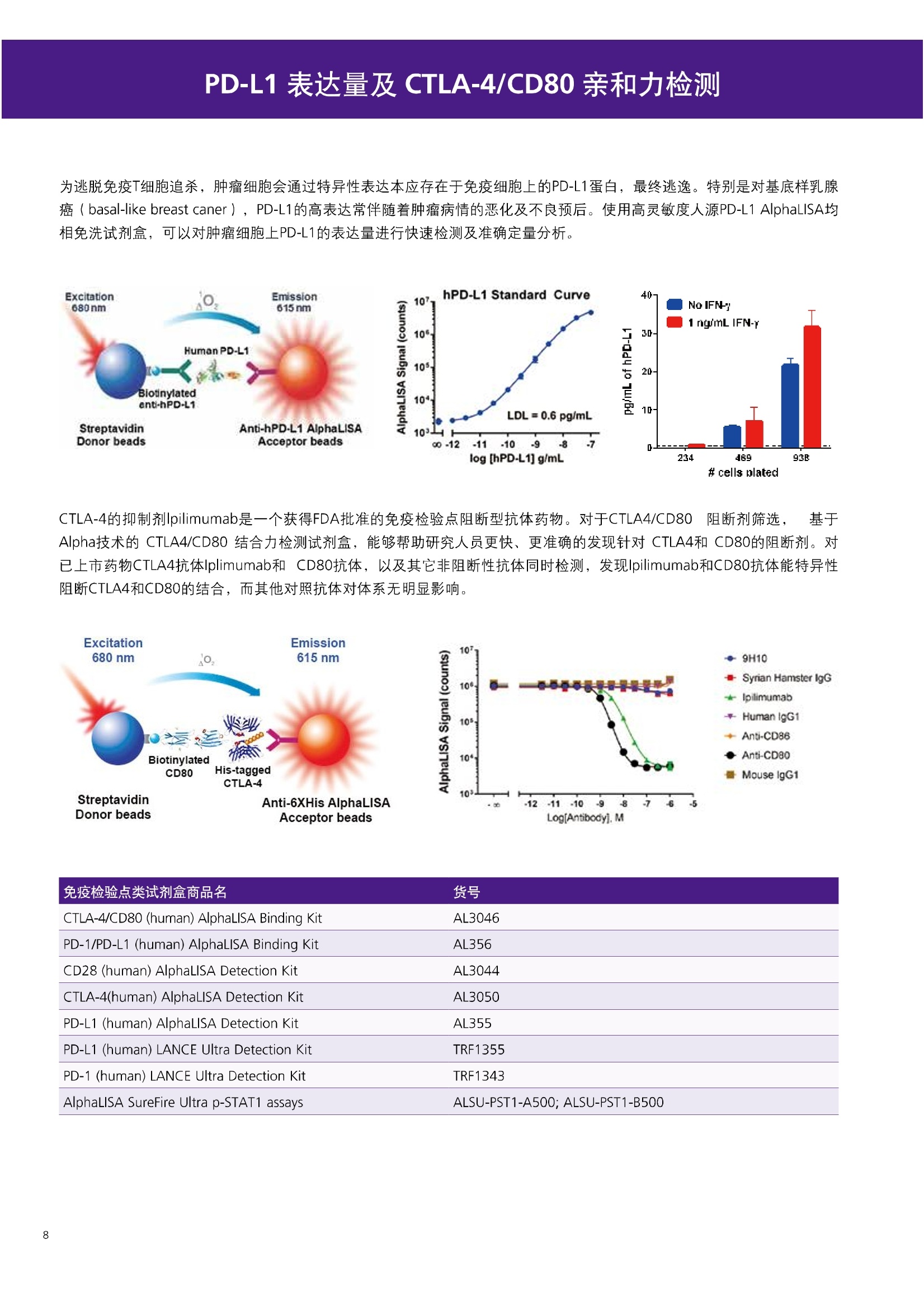
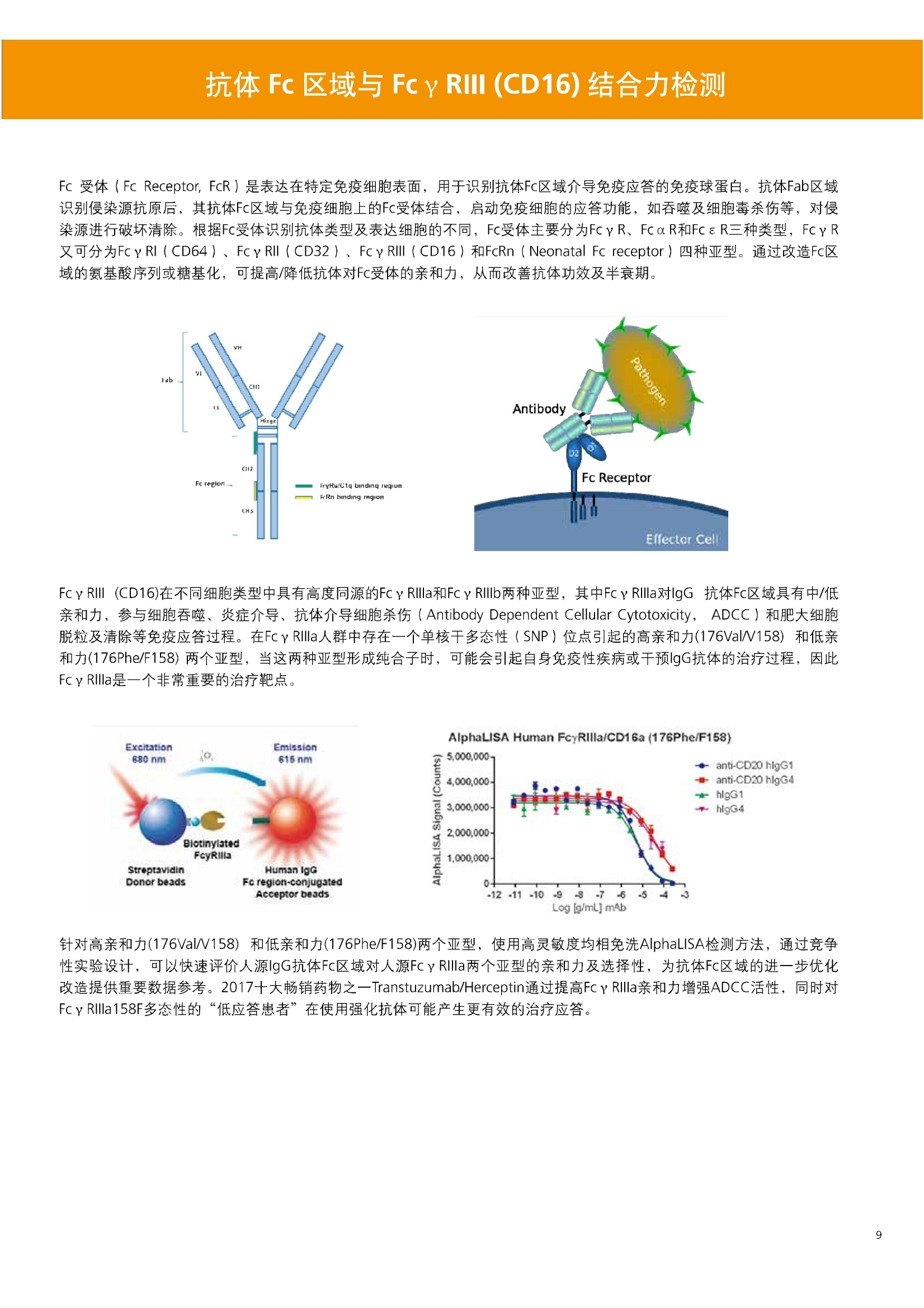
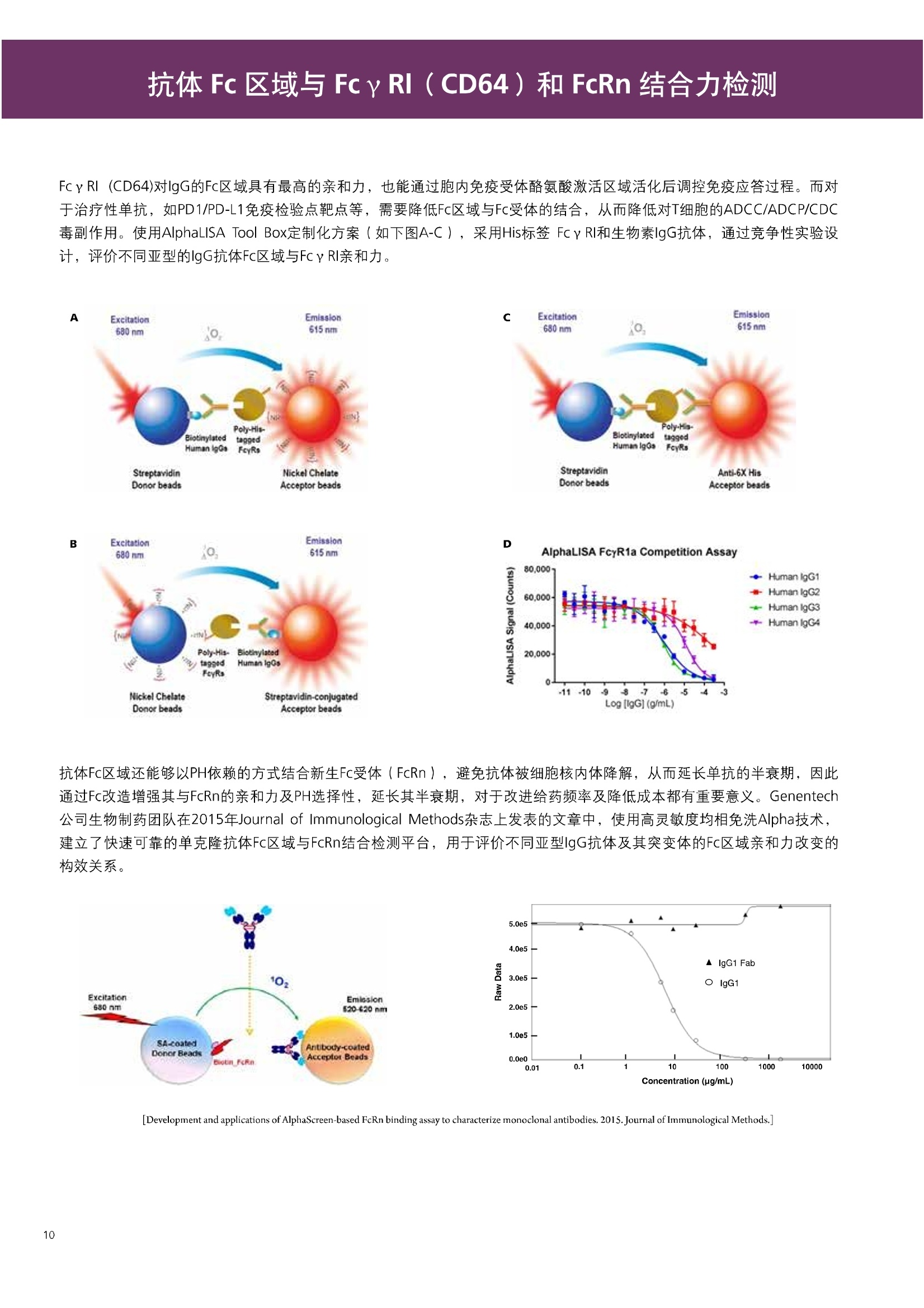
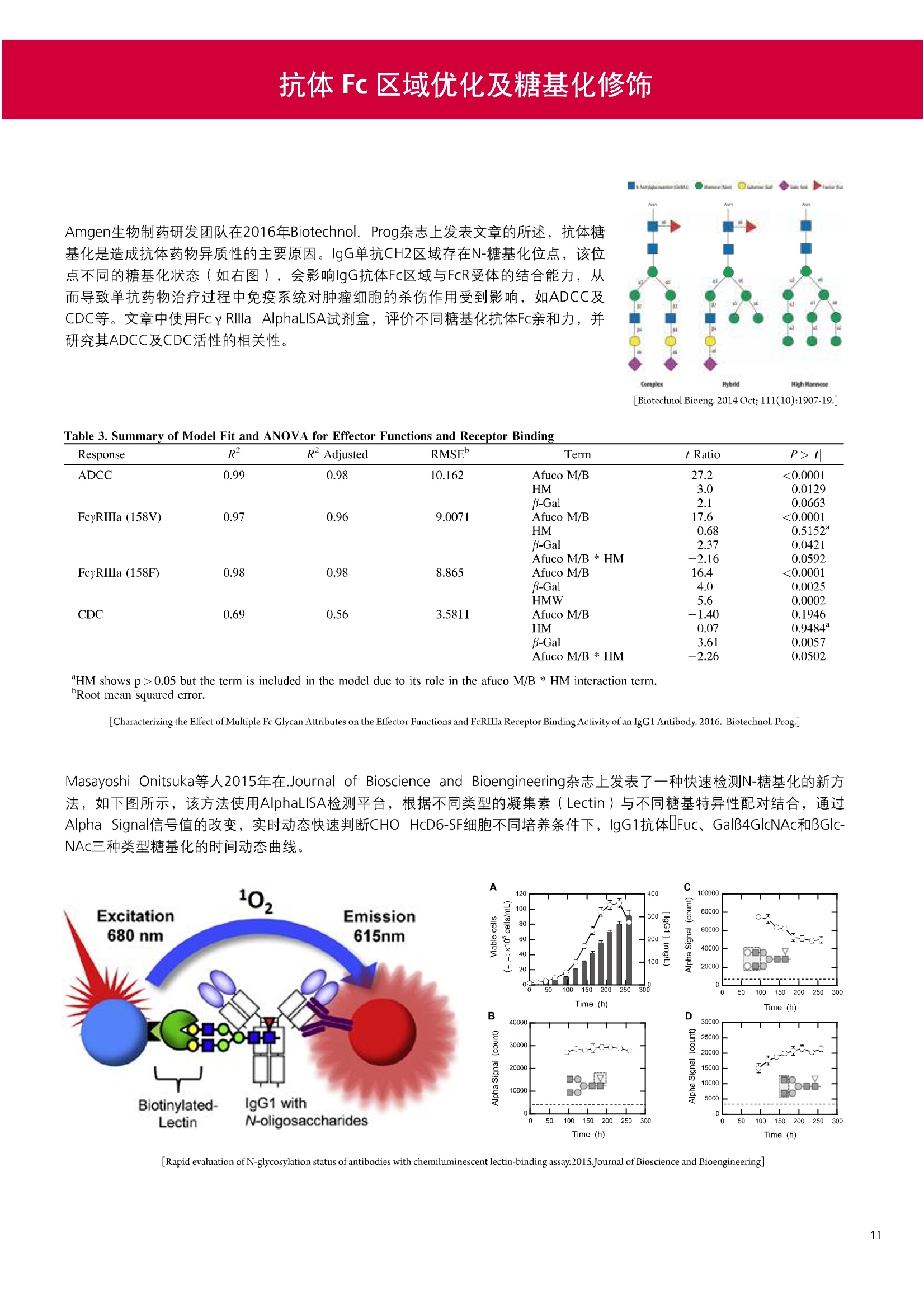
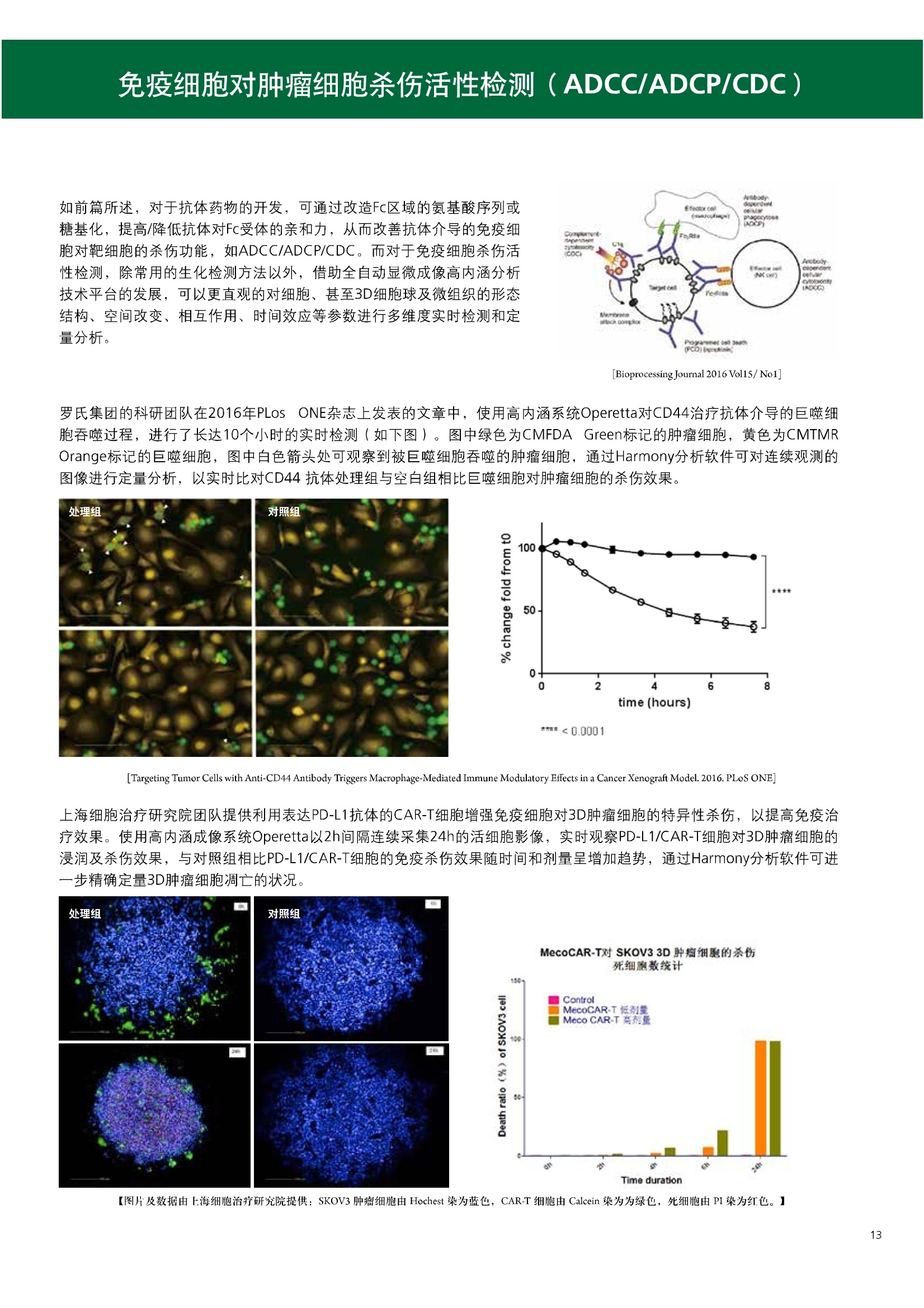
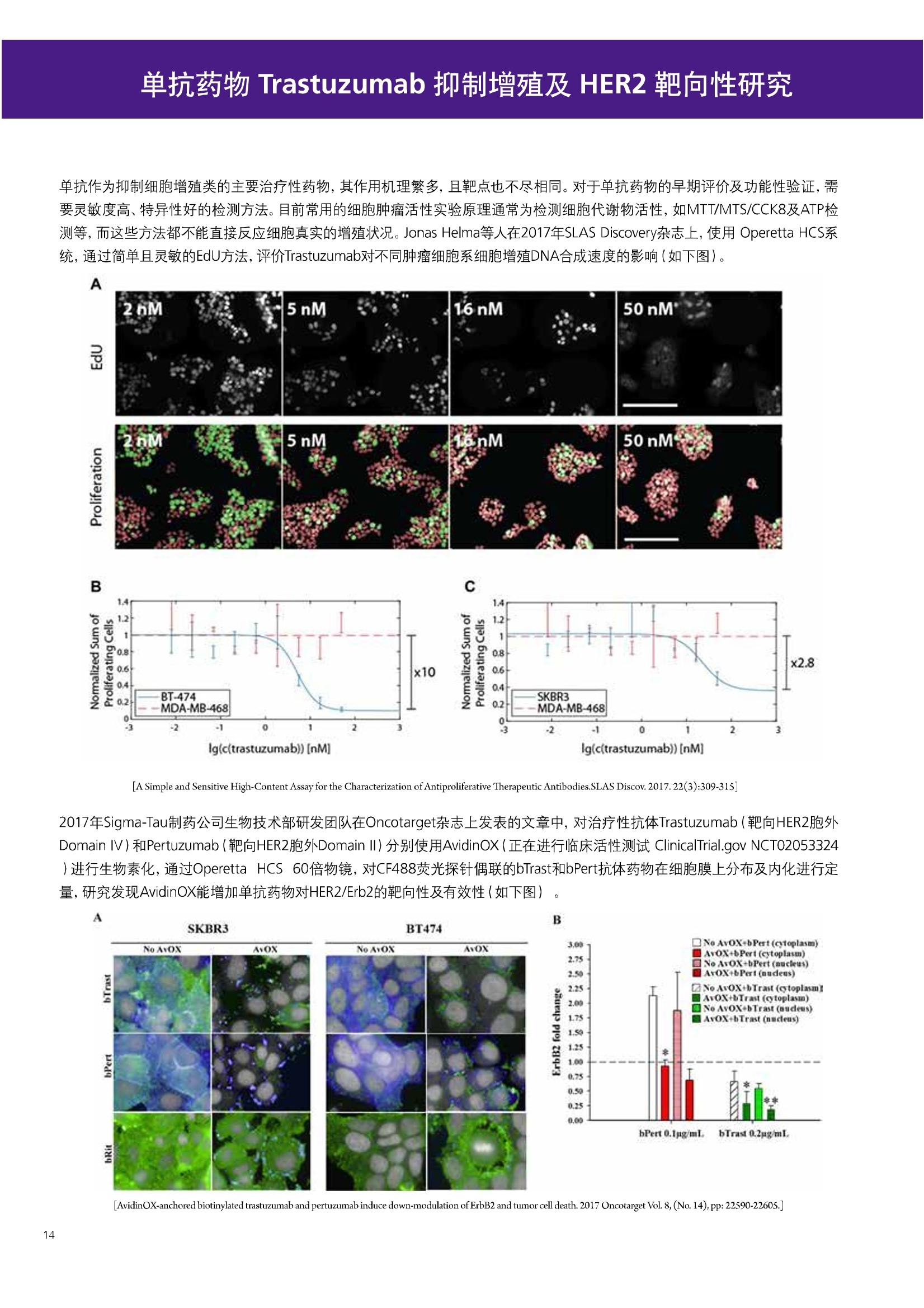
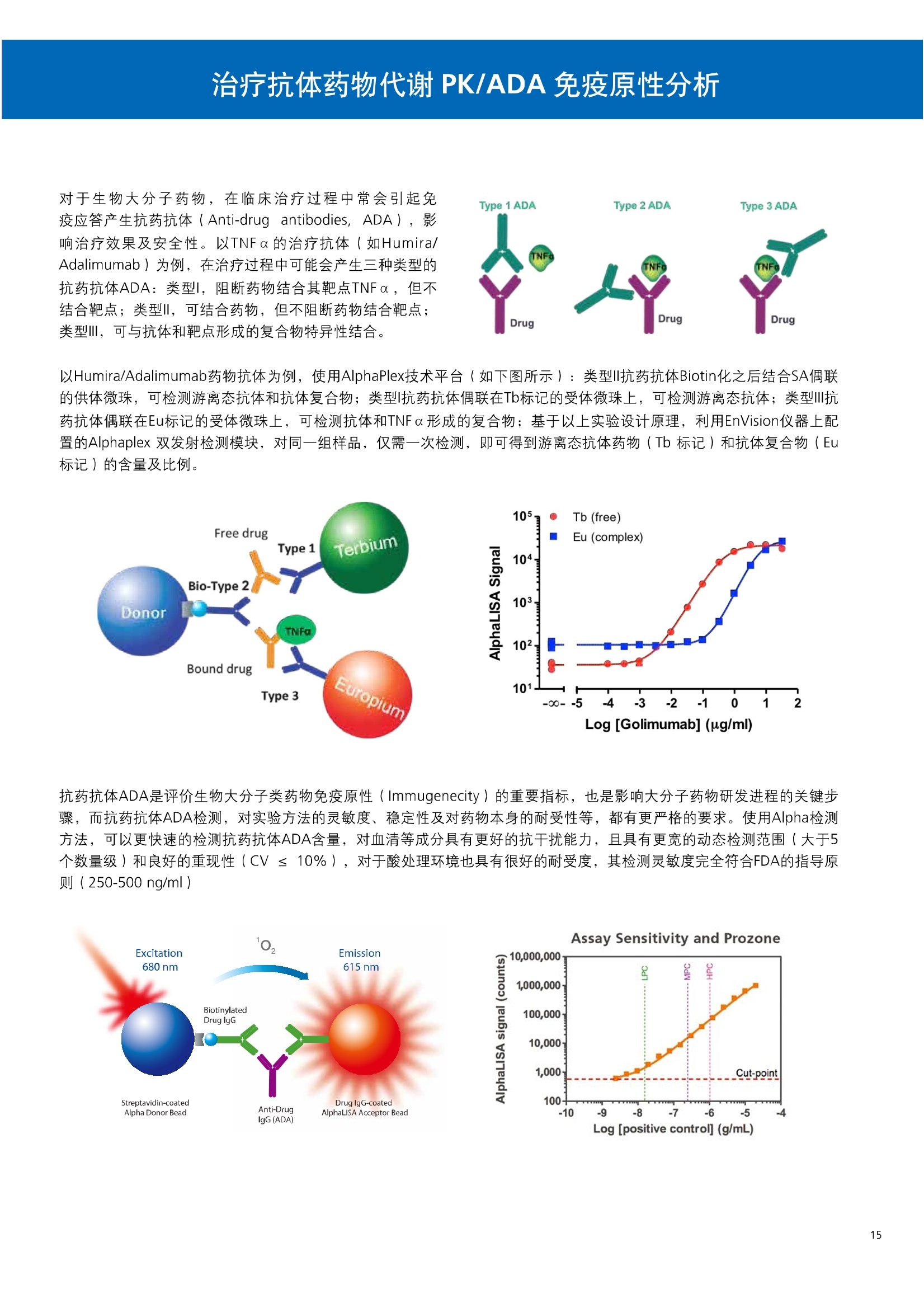
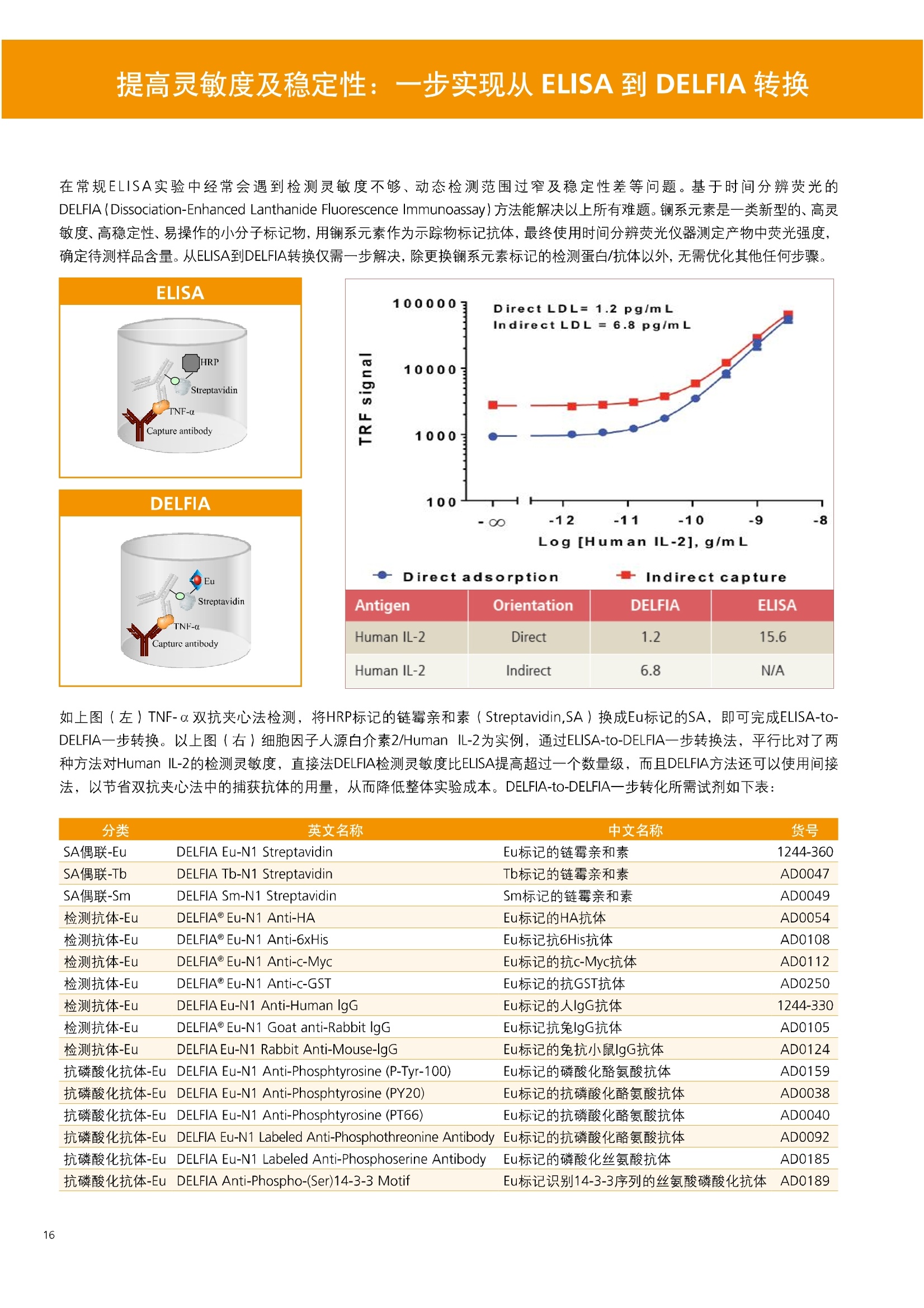
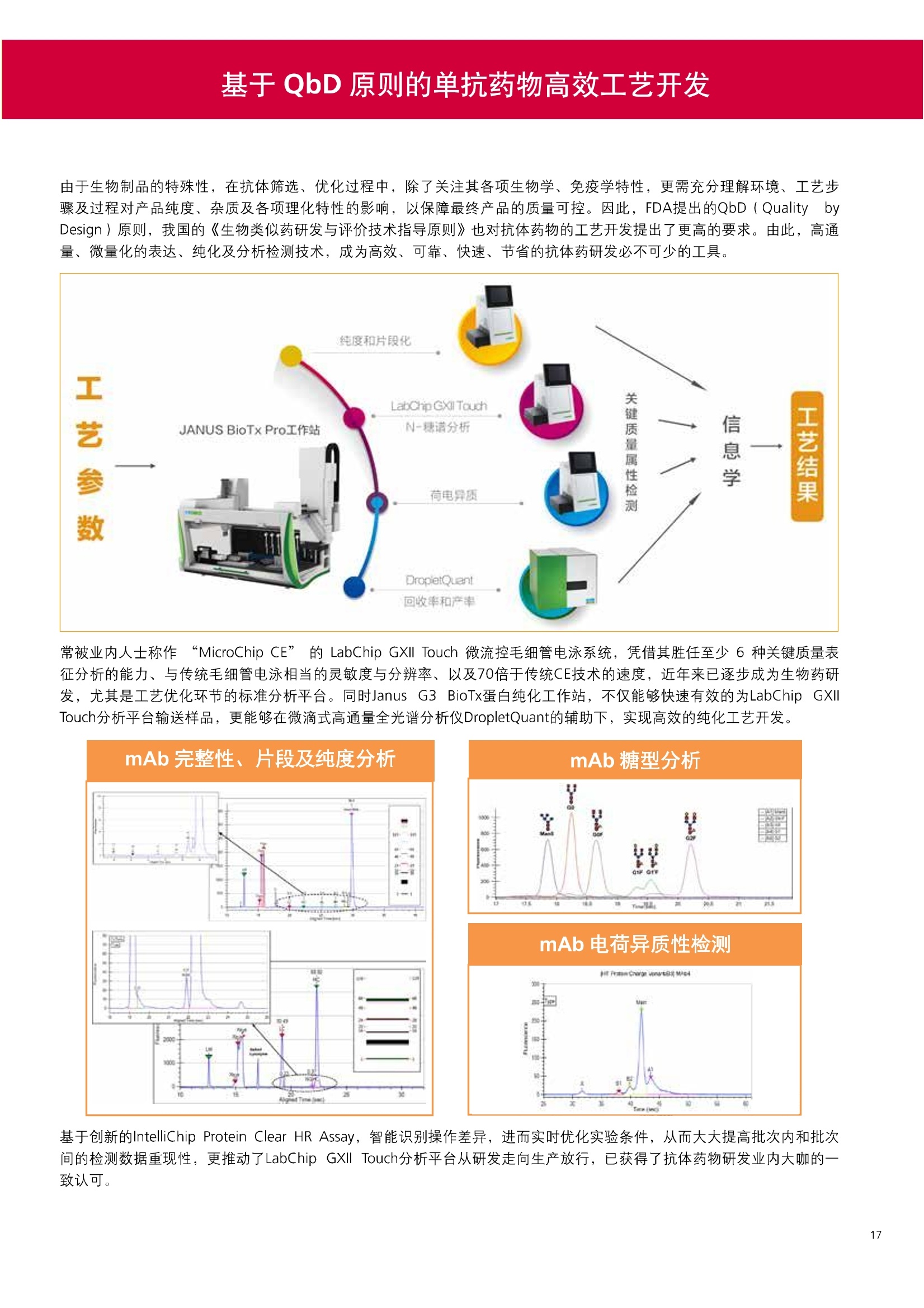
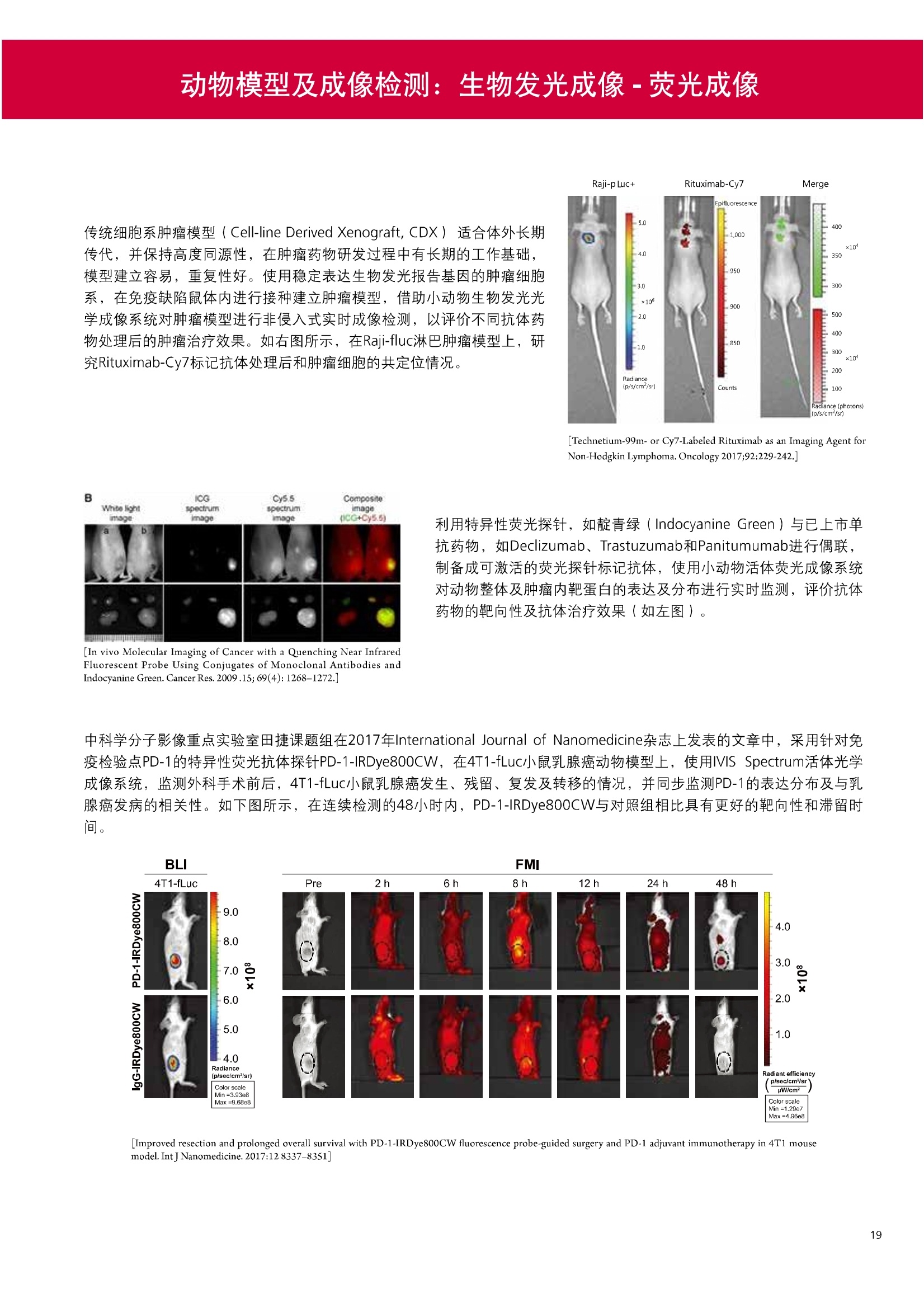
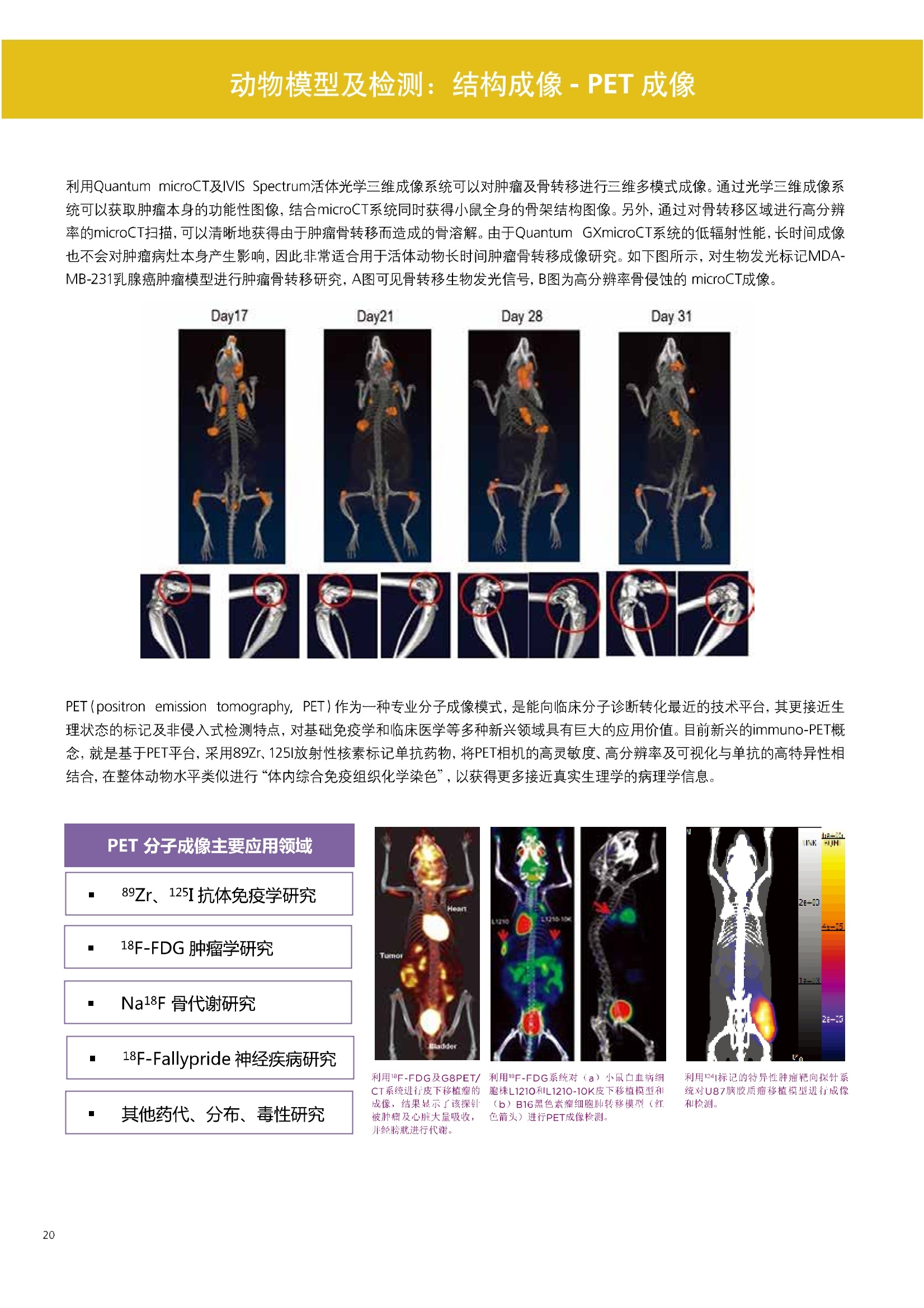
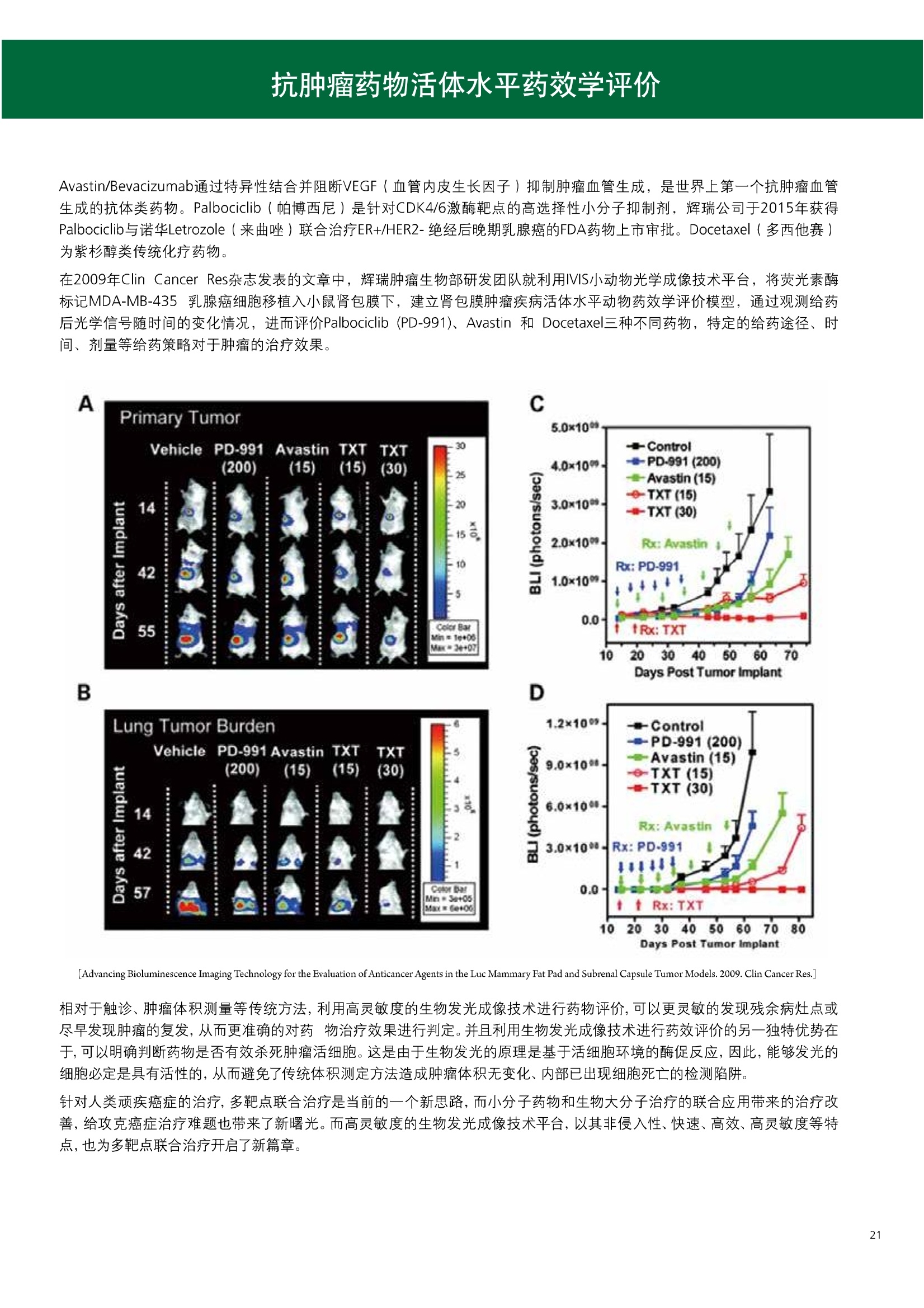
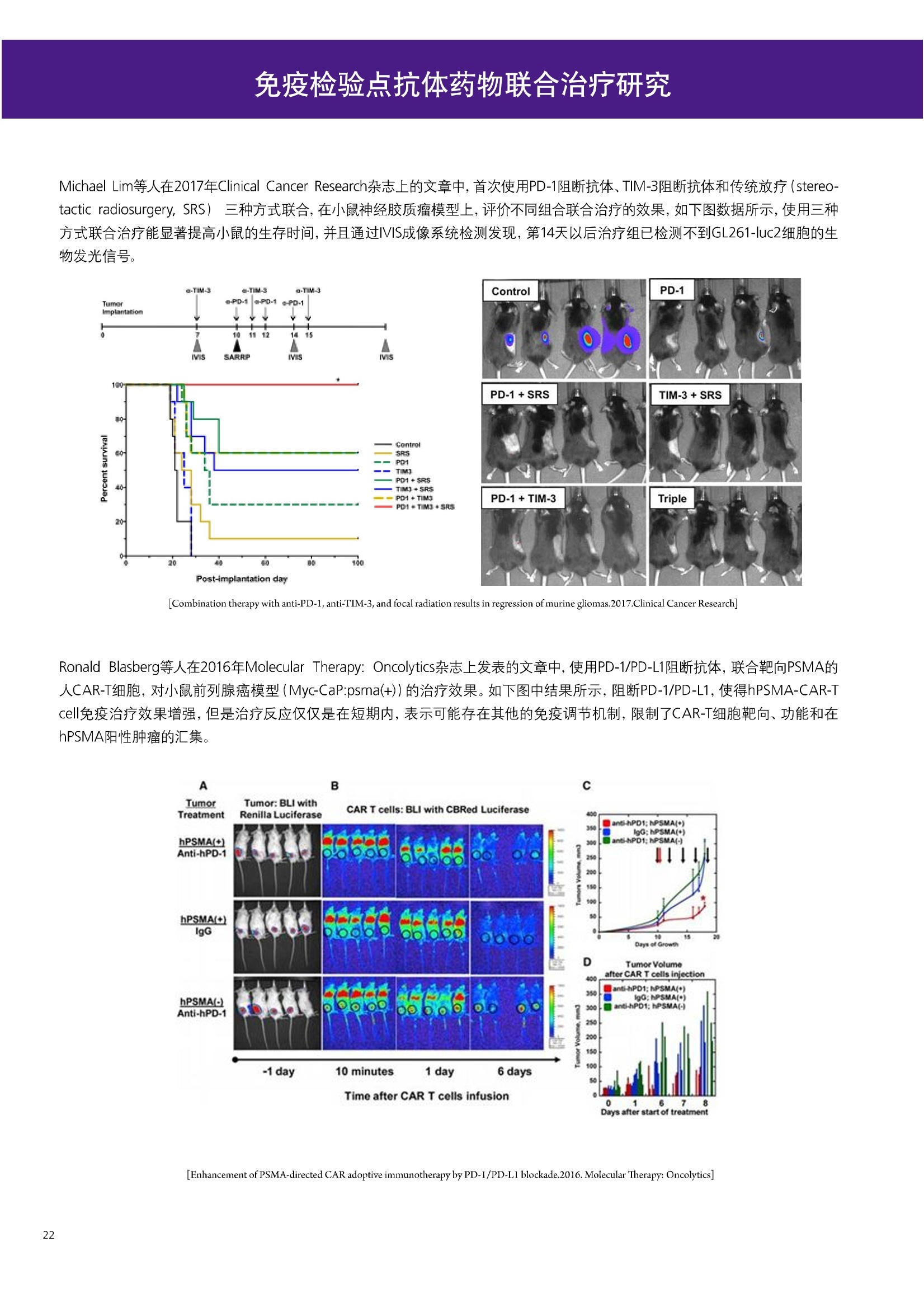
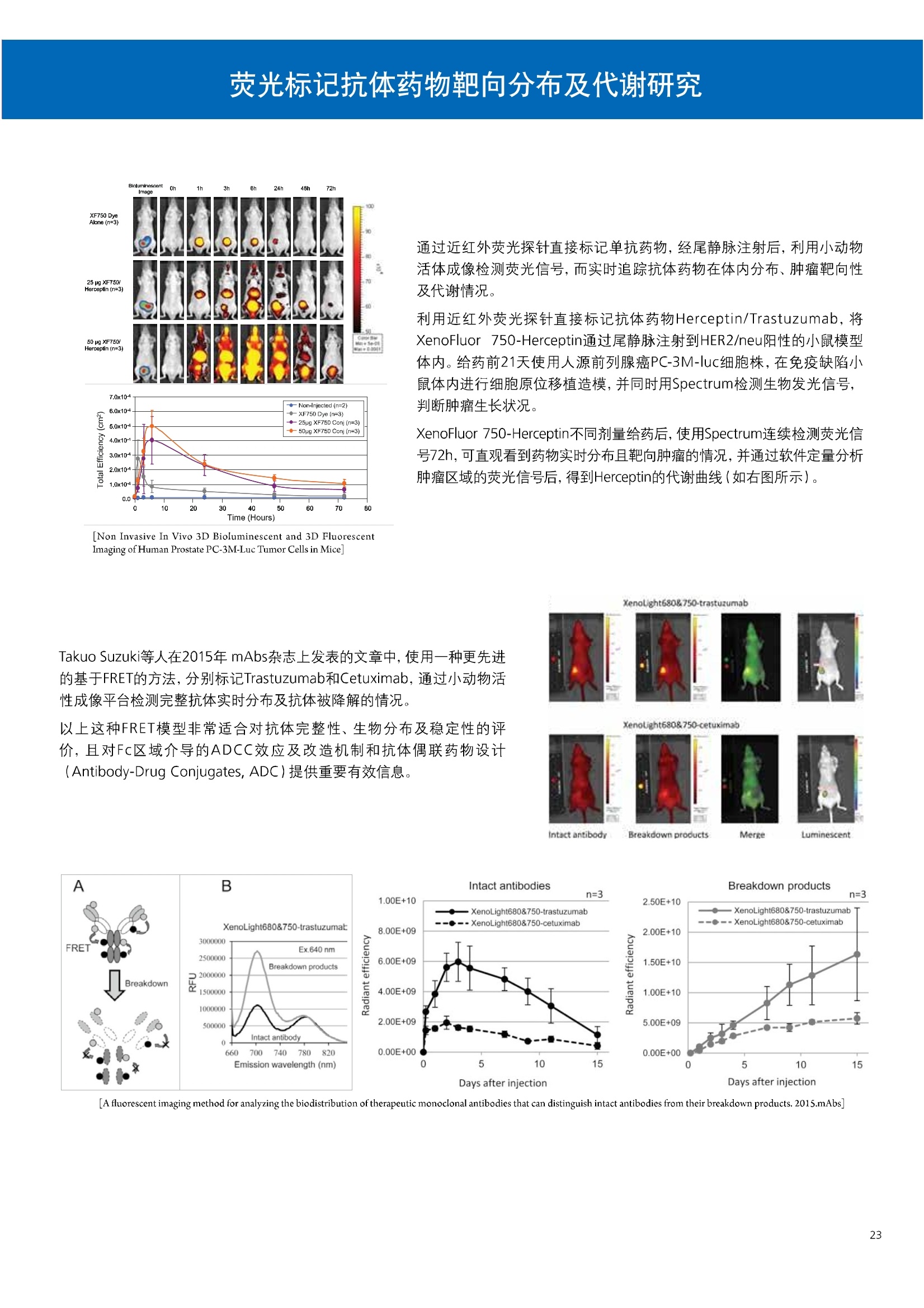
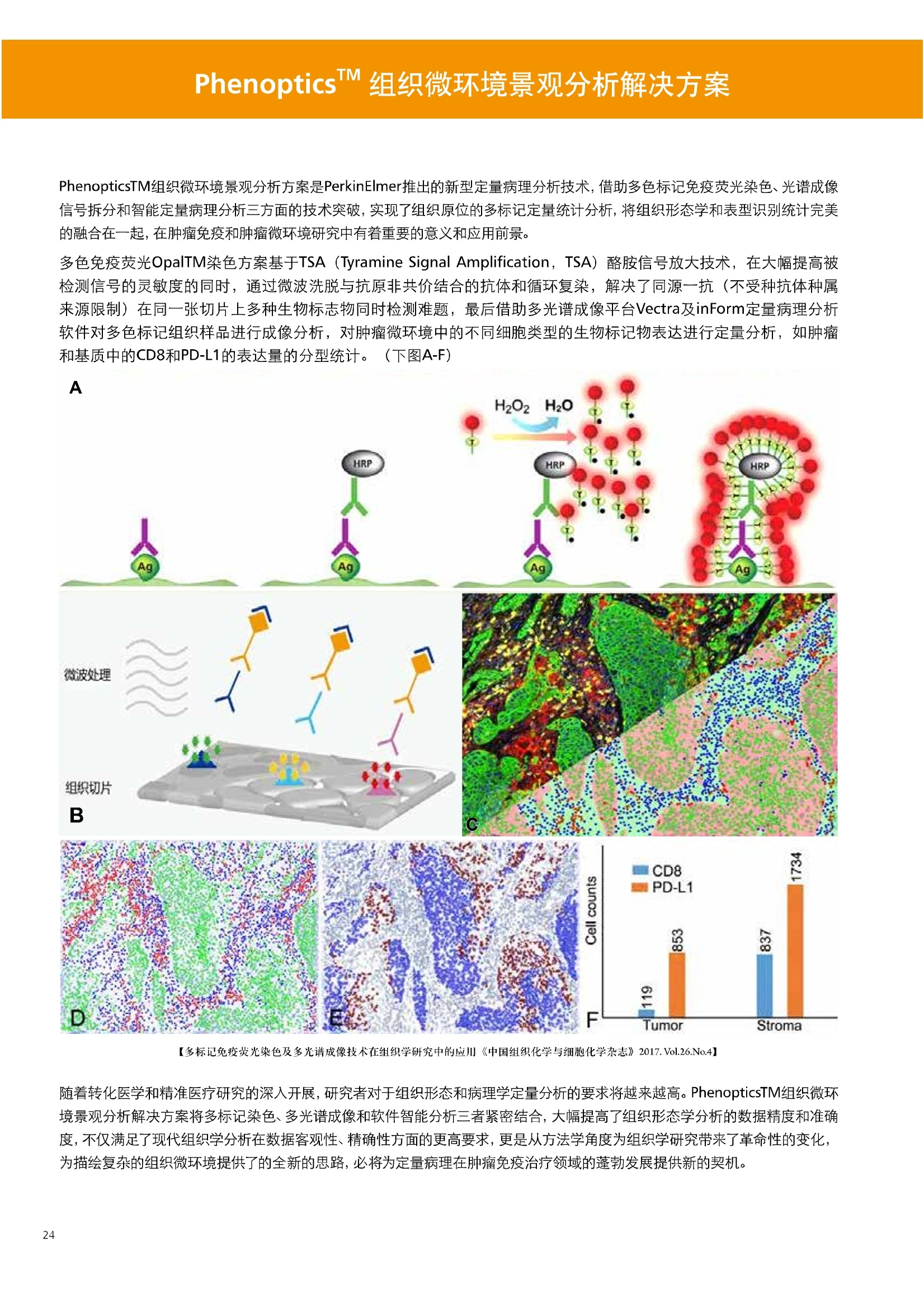
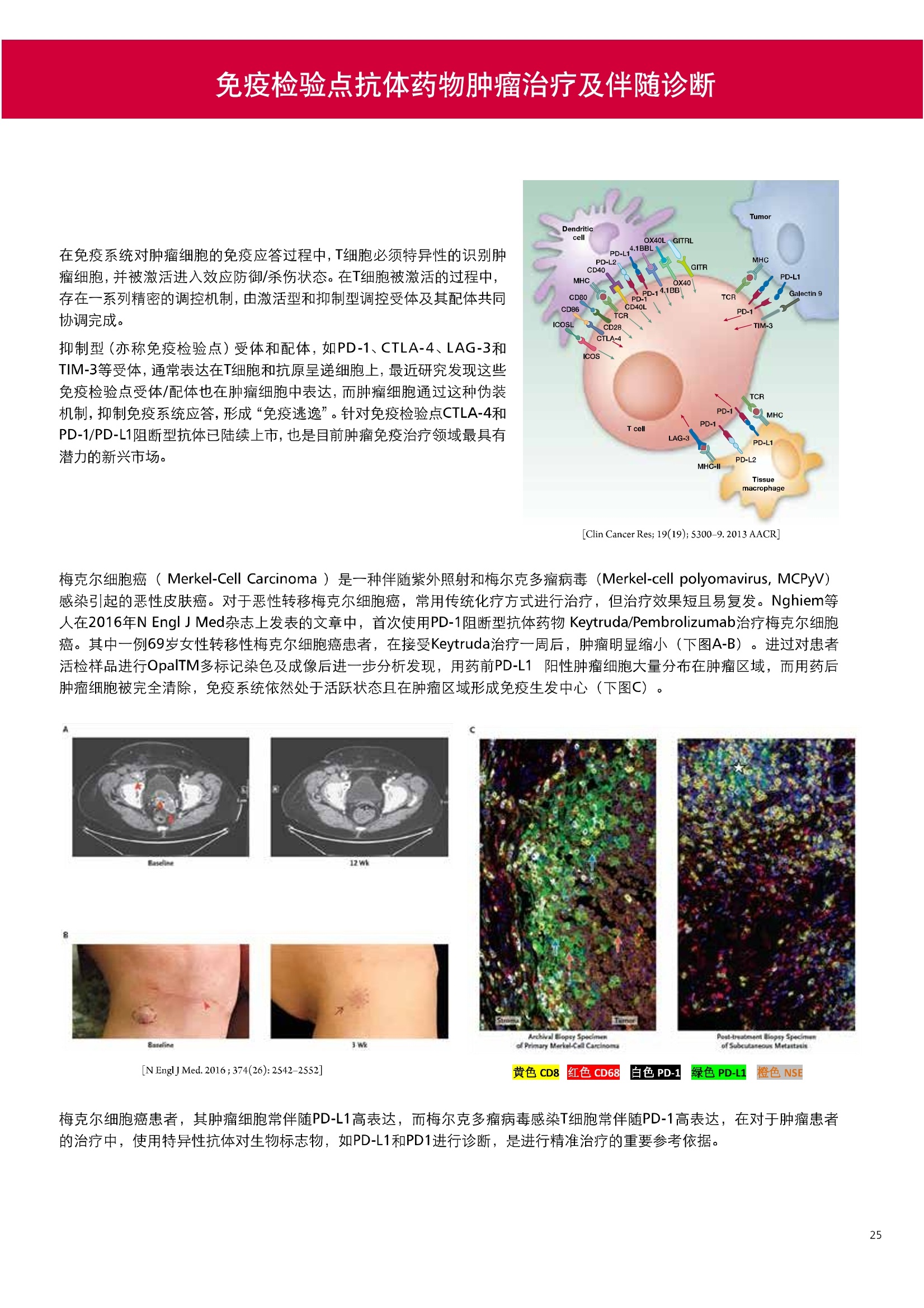
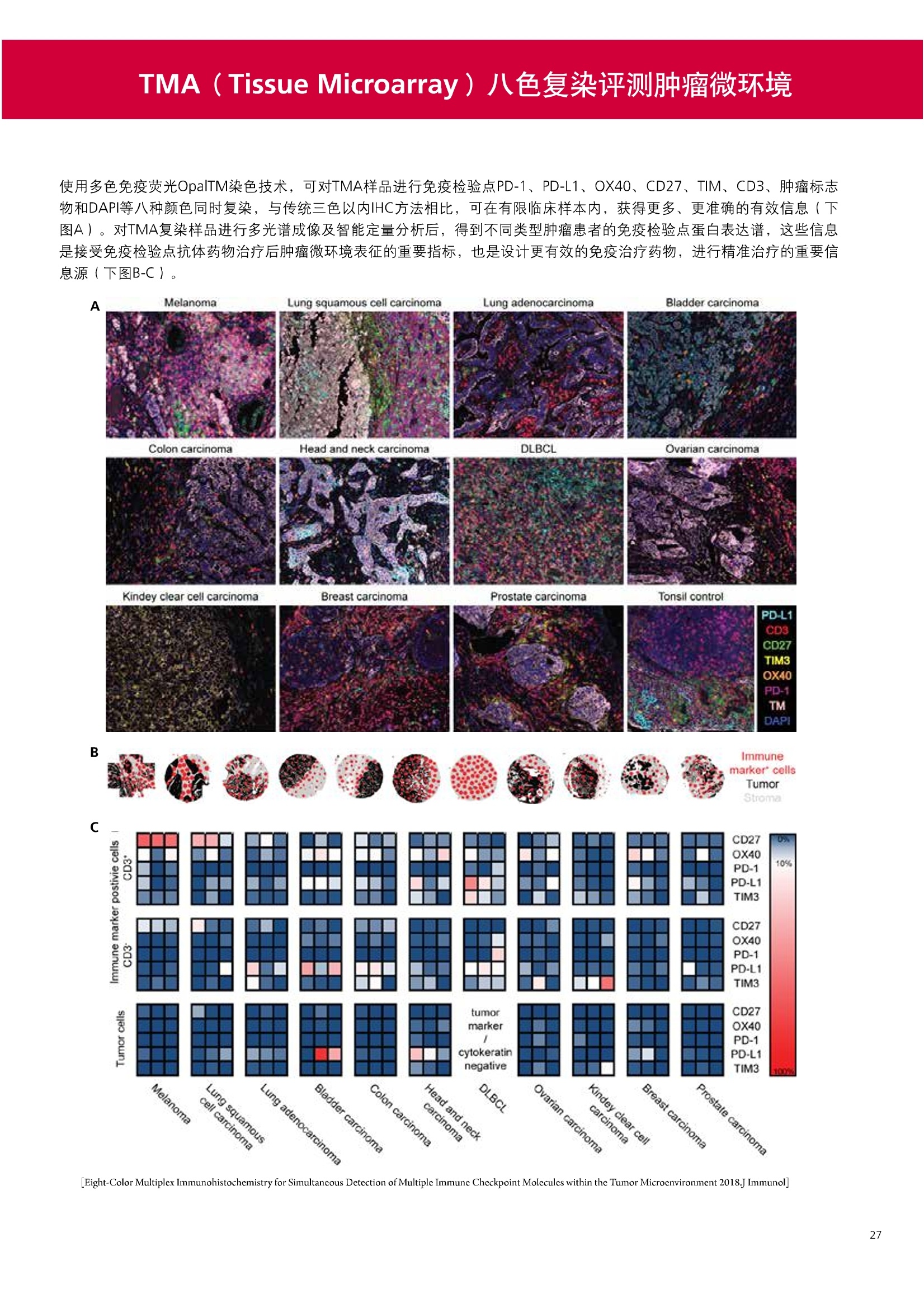
人源化抗体筛选体系建立 杂交瘤抗体筛选 (Alpha vs ELISA) 680 nm 615 nm 6*F s-taaged Ronorbeads PerkinElmer For the Better 体外抗体高通量筛选及优化体外抗体功能性评价及研究动物活体水平抗体治疗评价临床组织病理抗体诊断治疗 抗体是由效应B细胞分泌的大分子免疫球蛋白,参与协助免疫系统鉴别、中和抗原或其他外来物质。抗体由对称的两条重链及两条轻链组成,其重链恒定区决定抗体亚型,而重链和轻链可变区组合形成抗原结合域。 1975年Kohler和Milstein建立了杂交瘤技术(亦称单克隆抗体技术),该技术将体外可持续培养骨髓瘤细胞与可分泌抗体的B淋巴细胞融合,经黄嘌呤氨基蝶呤胸苷筛选及克隆化后,得到可分泌特异性抗体的单克隆细胞株,这一技术为治疗性单克隆抗体药物的发展奠定了基础。自1986年第一个鼠源单克隆抗体药物上市以来,抗体药物的研发经历了从鼠源到全人源化抗体过渡的过程。根据其来源可以分为鼠源单克隆抗体(-omab,莫单抗)、人鼠嵌合型单克隆抗体(-ximab,昔单抗)、人源化单克隆抗体(-zumab,珠单抗)和全人源化单克隆抗体(-umab,人单抗)。 截至2017年底, FDA累计批准上市73个抗体药物。抗体药经过30余年的发展,已成为全球医药市场的重要组成部分,目前大分子生物制药市场(包括重组蛋白类药物)急速增长已突破千万亿美元。从2016年市场表现来看,全球10大最畅销一个融合蛋白和1个重组蛋白。 No. 商品名 通用名 药物分类 主要适应症 企业 2016销售额(亿美元) 1 Humira Adalimumab阿达木单抗 单抗 免疫疾病 艾伯维 160.78 2 Harvoni Ledipasvir/Sofosbuvir索非布/雷地帕市 小分子 病毒感染 古利德 90.81 3 Enbrel Etanercept依那西普 融合蛋白 免疫疾病 安进/辉瑞 88.75 4 Remicade Infliximab英夫利昔单抗 单抗 免疫疾病 强生/默沙东 82.34 5 Rituxan Rituximab利妥昔单抗 单抗 癌症 罗氏 72.27 6 Revimid Lenalidomide米那度胺 小分子 癌症 新基 69.74 7 Avastin Bevacizumab贝伐珠单抗 单抗 癌症 罗氏 67.15 8 Herceptin Trastuzumab曲妥珠单抗 单抗 癌症 罗氏 67.14 9 Lantus Insulin Glargine甘精胰岛素 重组蛋白 糖尿病 赛诺菲 60.57 10 Prevnar Pneumococcal 13-Valent Conjugate白喉CRM197蛋白 疫苗 抗菌 辉瑞 57.18 近年来新型肿瘤免疫调节抗体药物(如PD-1/PD-L1抗体阻断剂)的兴起也带来了新的治疗突破。在药物研发方向,生物大分子药物市场高度集中,巨头垄断地位“超然”,而同时生物制药市场也孕育着诸多新机会和变化,新靶点、新作用机制的抗体药层出不穷,研发企业在生物制药领域大有可为。 PerkinElmer 生物大分子制药整体解决方案 PerkinElmer公司成立于1937年,总部位于美国马萨诸塞州。经历80年的发展与变革, PerkinElmer已经成为在全球范围内享有盛誉的尖端分析仪器和解决方案供应商,致力于改善人类健康和环境健康。PerkinElmer产品涉及领域包括: PerkinElmer探索与分析解决方案事业部主要包括环境健康、食品安全、生命科学、实验室服务和大数据整体信息化解决方案等业务领域。在环境健康方面,提供从放射性和有机物污染监测、微量有毒金属和化学品检测等相关的专业知识和全面的服务;在食品安全领域,提供快速准确的检测解决方案以及全面的服务;在生命科学业务领域,提供包括生物学影像系统、体外检测方案、定量病理学研究平台和信息学应用在内的完整的试剂和检测技术解决方案;在实验室服务领域, PerkinElmer OneSource团队专注于为全球各地、各行业领域内、各类实验室提供多品牌仪器维修、维护、校准、准证, Lab IT及实验室搬的的一站式服务解决方案。医疗信息科学部提供医疗大数据整体信息化解决方案。 针对生物大分子制药研发流程的每一个环节, PerkinElmer公司可提供覆盖分子-细胞-活体-组织的全方位检测技术、仪器平台、试剂耗材及相关服务。针对杂交瘤、噬菌体或人源B细胞等不同文库的抗体筛选,高通量多模式检测系统、多标试剂(如高灵敏度免洗Alpha技术)及细胞株、高内涵细胞显微成像系统、自动化样品处理工作站可以在分子及细胞水平提供最佳的高通量抗体筛选及优化方案。对于抗体药物的临床前/临床功能验证、安全评价及治疗效果,可借助生化检测及分子影像学平台,完成从分子机制、细胞信号通路、组织微环境及整体动物水平的系统评价。针对抗体工艺开发及生产质控过程中的抗体纯度、糖基化、片段化/聚合化、荷电异质性及宿主细胞残留等重要质控指标,全自动毛细管电泳抗体分析系统和多模式检测及专业试剂盒可大大降低该环节的技术成本。另外,随着医疗大数据时代的到来, PerkinElmer Signal数据挖掘分析系统,结合高质量显微成像技术和数字定量病理智能算法,为基础研究到临床实践的转化进一步助力加速。 人源化抗体是治疗性抗体发展的一个重要的里程碑,并伴随着一系列重大的技术革新,如抗体库技术、转基因动物及高通量测序等。人源化抗体的形式也从最初的嵌合抗体、改型抗体等逐步发展为今天的人抗体。抗体人源化已经成为治疗性抗体的发展趋势,同时各种抗体衍生物也不断涌现,它们从不同角度克服抗体本身的应用局限,也为治疗人类疾病提供了更多利器。对单克隆抗体进行改造使之应用于临床治疗,不仅需要对抗体效应机制进行更细致深入的研究,同时还有赖于对人类免疫系统调控机制的全面精确认识。 [Nature Reviews Drug Discovery 2, 52-62」 在噬菌体库筛选体系中,基于噬菌体抗体文库对特定靶标进行大规模筛选,非结合的噬菌体抗体在筛选过程中被排除,特异性噬菌体抗体经大肠杆菌感染后进一步扩增回收,经过重复轮回筛选,直至获得所需的高特异抗体。 基于转基因小鼠的杂交瘤筛选方法中,该小鼠已经过基因工程化改造,适用于人源免疫球蛋白的表达。免疫转基因小鼠后收获到的B细胞与骨髓瘤细胞系融合形成永久化杂交瘤细胞,与传统杂交瘤技术流程一样,对杂交瘤进行特异性抗体筛选。 人源B细胞抗体筛选是一种日益兴起的人源抗体和疫苗研发的新方法,特别是针对感染类疾病的保护性抗体和新型肿瘤疫苗的研发有着天然技术优势。 人源B细胞经分选后以单细胞状态与滋养层细胞共培养产生抗体,经筛选后得到所需功能的天然抗体,回收相应B细胞测序后得到抗体基因序列。随后,一方面通过得到的抗体基因序列在合适的系统中表达改重组抗体,或根据需要对其性质进行微调;另一方面可通过研究抗体和抗原结合,表征定义新的保护性抗原表位,进而对免疫原进行优化,获得更好的免疫新抗原。 new vaccine LJ. Exp. Med. 2016 Vol.213 No. 4 469-481] 无论是抗体文库筛选、基于转基因小鼠的杂交瘤筛选和人源B细胞抗体筛选,都有其各自的技术优势和限速步骤。可根据治疗目的和靶点的不同,选择合适的人源化抗体筛选体系,并配置高通量、自动化的检测方案,以满足抗体筛选中对高效率、微型化的需求,缩短抗体研发周期、提高有效抗体的产出率。 抗体筛选方法学对比及检测 抗体的筛选鉴定中,最经典的方法是ELISA方法,通过将抗原包被到微孔板中,加入待测抗体(杂交瘤上清或噬菌体裂解液),经孵育后洗去非结合抗体,再加入检测抗体进行评价。ELISA方法的需要固定抗原,反复洗板去除多余的抗原/抗体,步骤繁琐,检测动态范围低,且不利于微型化,并且对于一些膜蛋白靶点,抗原固定化后会影响其天然构象及表位阻碍对针对天然表位的有效抗体的发现及及发。 随着新的检测技术的出现,有更多的筛选方法进入到抗体筛选流程中,如免洗TR-FRET/LANCE方法、免洗高灵敏度Alpha方法、免洗微球成像方法和免洗细胞成像方法,与ELISA方法相比,这四种方法都无需反复洗板,易于微型化及自动化操作。其中免洗细胞成像方法将抗原过表达在细胞表面,最大程度的保持了抗原的抗原天然构象,特别适合抗原靶点为膜蛋白的抗体筛选,如PD-L1、GPCR家族等。 对于不同的检测方法需要采用不同的仪器进行检测, ELISA及TR-FRET/LANCE方法可使用带光吸收功能的多功能读板仪,如VICTORTM Nivo、EnVision@和EnSightTM; 免洗Alpha方法可使用带Alpha功能的读板仪,如EnVision@和EnSightTM;免洗微球,和免洗细胞成像可使用带成像功能的读板仪,如EnSightTM或高内涵显微成像系统Operetta@CLS和Opera PhenixTM ELISA 筛选示意图 Alpha检测可形象的称为只需混合无需洗涤的ELISA,又因其供体微珠和受体微珠间的信号传递单线态氧分子可达200 nm,比其他的均相检测方法,如TR-FRET(能量传递距离~10nm),更适合生物大分子间的亲和力实验。除了常用的杂交瘤抗体筛选及抗体轻链筛选外, Alpha比ELISA方法更适合做阻断型抗体筛选和抑制结合型抗体筛选,因Alpha比ELISA方法具有更高的灵敏度,因此在整个竞争结合体系中所需的样品浓度更低,对于阻断型/抑制结合型的抗体筛选具有更好的分辨率和检测范围。 plate Alpha 筛选示意图 抑制结合型抗体筛选 杂交瘤抗体 ELISA 筛选流程 杂交瘤瘤体 Alpha 筛选流程 Antigen Coating Wash x 3 overnight Blocking 2 hours Aspirate x 1 HybridomaSupernatants Wash x3 2 hours Secondary Antibodies l hour Wash x3 Substrate (TMB) 0.5 hour Stop solution Sandwich ELISA requires addi-tional step of antibody coatingextending time for 2 hours 噬菌体文库和人源B细胞抗体整合方案 Alpha检测可形象的称为只需混合无需洗涤的ELISA,又因其供体微珠和受体微珠间的信号传递单线态氧分子可达200nm,比其他的均相检测方法, 如TR-FRET(能量传递距离~10nm),更适合生物大分子间的亲和力实验。除了常用的杂交瘤抗体筛选及抗体轻链筛选外,还可以应用于基于T7或M13噬菌体文库抗体筛选,如确定噬菌体浓度、抗体/蛋白片段筛选等。 人源B细胞抗体筛选是一种新型的人源化抗体筛选平台,特别是针对感染性疾病研究,人源B细胞抗体筛选具有天然宿主优势。美国AIMM Therapeutics公司建立了人源B细胞培养、抗体筛选、B细胞克隆鉴定及中和性抗体功能性验证平台,筛选中和性抗体用于治疗梭状芽孢杆菌(C. difficile)感染引起的结肠炎。 Anti-toxin B antibody concentration/ml 如上图人源化B细胞抗体筛选及功能性验证流程图所示,使用Janus@自动化工作站整合EnVision多功能读板仪进行快速抗体亲和力检测及初筛,通过对慢病毒转染带GFP标记的B细胞进一步分选后,使用高内涵成像系统Operetta对B细胞克隆进行整孔成像及鉴定,并对阳性孔内上清中的抗体进一步进行形态学功能性验证。 PD-1/PD-L1免疫检验点阻断剂筛选 对于当前,瘤免疫治疗中炙手可热的免疫检验点靶点PD-1/PD-L1, 在Alpha PD-1/PD-L1结合力检测平台上,明星药物Nivolumab的两个亚型、PD-L1抑制剂Atezolizumab和其他PD-1/PD-L1抑制剂的检测结果也进一步证明, Alpha方法具有极佳的特异性及信噪比,且比传统方法具有更高的检测灵敏度。 针对膜蛋白抗体筛选靶点,如PD-L1、EGFR及GPCR使,使用细胞原位表达膜蛋白的抗体筛选方法,不仅保证了膜蛋白的天然构象,还能确保筛选到的抗体都是针对膜蛋白胞外区,既提高了抗体识别的有效性,同时也提高了抗体筛选的靶向性。下图中的细胞原位表达PD-L1的抗体筛选实验中,采用过表达PD-L1的CHO细胞株,加入待测抗体后, 再用Alex647(红色)标记羊抗兔二抗,同时Hoechst标记(蓝色)标记所有细胞核, Calcein-AM(绿色)标记未表达PD-L1的CHO细胞。使用Operetta CLS高内涵成像分析系统,对梯度稀释的PD-L1抗体标准品自动整板成像和图像分析后,通过Harmony软件计算拟合PD-L1抗体对细胞膜蛋白PD-L1的结合力EC50曲线。 lst Ab:Mouse-anti PDL1 antibody; 2st: Goat anti-mouse IgG-AlexaFluor647 Concentration Images acquired and analyzed by Operetta CLS 【数据山中科院苏州纳米技术与纳米仿生研究所生化检测平台提供】 PD-L1 表达量及 CTLA-4/CD80 亲和力检测 为逃脱免疫T细胞追杀,肿瘤细胞会通过特异性表达本应存在于免疫细胞上的PD-L1蛋白,最终逃逸。特别是对基底样乳腺癌 ( basal-like breast caner), PD-L1的高表达常伴随着肿瘤病情的恶化及不良预后。使用高灵敏度人源PD-L1 AlphaLISA均相免洗试剂盒,可以对肿瘤细胞上PD-L1的表达量进行快速检测及准确定量分析。 CTLA-4的抑制剂Ipilimumab是一个获得FDA批准的免疫检验点阻断型抗体药物。对于CTLA4/CD80阻断剂筛选, 基于Alpha技术的 CTLA4/CD80结合力检测试剂盒,能够帮助研究人员更快、更准确的发现针对 CTLA4和 CD80的阻断剂。对已上市药物CTLA4抗体Iplimumab和 CD80抗体,以及其它非阻断性抗体同时检测,发现Ipilimumab和CD80抗体能特异性阻断CTLA4和CD80的结合,而其他对照抗体对体系无明显影响。 免疫检验点类试剂盒商品名 货号 CTLA-4/CD80(human) AlphaLISA Binding Kit AL3046 PD-1/PD-L1 (human) AlphaLISA Binding Kit AL356 CD28 (human) AlphaLISA Detection Kit AL3044 CTLA-4(human) AlphaLISA Detection Kit AL3050 PD-L1 (human) AlphaLISA Detection Kit AL355 PD-L1 (human) LANCE Ultra Detection Kit TRF1355 PD-1 (human) LANCE Ultra Detection Kit TRF1343 AlphaLISA SureFire Ultra p-STAT1 assays ALSU-PST1-A500; ALSU-PST1-B500 抗体 Fc 区域与 Fc y RIII (CD16)结合力检测 Fc 受体(Fc Receptor, FcR) 是表达在特定免疫细胞表面,用于识别抗体Fc区域介导免疫应答的免疫球蛋白。抗体Fab区域识别侵染源抗原后,其抗体Fc区域与免疫细胞上的Fc受体结合,启动免疫细胞的应答功能,如吞噬及细胞毒杀伤等,对侵染源进行破坏清除。根据Fc受体识别抗体类型及表达细胞的不同,Fc受体主要分为Fcy R、FcαR和FceR三种类型,FcyR又可分为Fc y RI(CD64)、Fc y RlI (CD32)、Fcy RIII(CD16) 和FcRn (Neonatal Fc receptor) 四种亚型。通过改造Fc区域的氨基酸序列或糖基化,可提高/降低抗体对Fc受体的亲和力,从而改善抗体功效及半衰期。 Fc y RIII (CD16)在不同细胞类型中具有高度同源的FcyRllla和Fc y RllIb两种亚型, 其中FcyRllla对lgG 抗体Fc区域具有中/低亲和力,参与细胞吞噬、炎症介导、抗体介导细胞杀伤 ( Antibody Dependent Cellular Cytotoxicity, ADCC)和肥大细胞脱粒及清除等免疫应答过程。在FcyRllla人群中存在一个单核干多态性(SNP)位点引起的高亲和力(176Val/V158) 和低亲和力(176Phe/F158)两个亚型,当这两种亚型形成纯合子时,,1可能会引起自身免疫性疾病或干预IgG抗体的治疗过程,因此Fc y Rllla是一个非常重要的治疗靶点。 针对高亲和力(176Val/V158) 和低亲和力(176Phe/F158)两个亚型,使用高灵敏度均相免洗AlphaLISA检测方法,通过竞争性实验设计,可以快速评价人源IgG抗体Fc区域对人源Fc y RIlla两个亚型的亲和力及选择性,为抗体Fc区域的进一步优化改造提供重要数据参考。2017十大畅销药物之一Transtuzumab/Herceptin通过提高FcyRllla亲和力增强ADCC活性,同时对Fc y Rllla158F多态性的“低应答患者”在使用强化抗体可能产生更有效的治疗应答。 抗体 Fc 区域与 Fc y Rl (CD64) 和 FcRn 结合力检测 Fc y RI (CD64)对IgG的Fc区域具有最高的亲和力,也能通过胞内免疫受体酪氨酸激活区域活化后调控免疫应答过程。而对于治疗性单抗,如PD1/PD-L1免疫检验点靶点等,需要降低Fc区域区Fc受体的结合,从而降低对T细胞的ADCC/ADCP/CDC毒副作用。使用AlphaLISA Tool Box定制化方案(如下图A-C),采用His标签 Fc y Rl和生物素IgG抗体,通过竞争性实验设计,评价不同亚型的IgG抗体Fc区域与FcyRI亲和力。 抗体Fc区域还能够以PH依赖的方式结合新生Fc受体(FcRn), 避免抗体被细胞核内体降解,从而延长单抗的半衰期,因此通过Fc改造增强其与FcRn的亲和力及PH选择性,延长其半衰期,对于改进给药频率及降低成本都有重要意义。Genentech公司生物制药团队在2015年Journal of Immunological Methods杂志上发表的文章中,使用高灵敏度均相免洗Alpha技术,建立了快速可靠的单克隆抗体Fc区域与FcRn结合检测平台,用于评价不同亚型IgG抗体及其突变体的Fc区域亲和力改变的构效关系。 [Development and applications of AlphaScreen-based FcRn binding assay to characterize monoclonal antibodies. 2015. Journal of Immunological Methods.] 抗体 Fc 区域优化及糖基化修饰 Amgen生物制药研发团队在2016年Biotechnol. Prog杂志上发表文章的所述,抗体糖基化是造成抗体药物异质性的主要原因。IgG单抗CH2区域存在N-糖基化位点,该位点不同的糖基化状态(如右图),会影响IgG抗体Fc区域与FcR受体的结合能力,从而导致单抗药物治疗过程中免疫系统对肿瘤细胞的杀伤作用受到影响,如ADCC及CDC等。文章中使用Fc y RIlla AlphaLISA试剂盒,评价不同糖基化抗体Fc亲和力, 并研究其ADCC及CDC活性的相关性。 [Biotechnol Bioeng. 2014 Oct; 111(10):1907-19.] Table 3. Summary of Model Fit and ANOVA for Effector Functions and Receptor Binding Response R2 R’Adjusted RMSE' Term t Ratio P>t ADCC 0.99 0.98 10.162 Afuco M/B 27.2 <0.0001 HM 0.0129 B-Gal 0.0663 FcyRIIIa (158V) 0.97 0.96 9.0071 Afuco M/B 17.6 <0.0001 HM 0.68 0.5152 B-Gal 2.37 0.0421 Afuco M/B*HM -2.16 0.0592 FcyRIlIa (158F) 0.98 0.98 8.865 Afuco M/B 16.4 <0.0001 B-Gal 4.0 0.0025 HMW 5.6 0.0002 CDC 0.69 0.56 3.5811 Afuco M/B -1.40 0.1946 HM 0.07 0.9484 β-Gal 3.61 0.0057 “HM shows p>0.05 but the term is included in the model due to its role in the afuco M/B * HM interaction term. Root mean squared error. [Characterizing the Effect of Multiple Fc Glycan Attributes on the Effector Functions and FcRIIIa Receptor Binding Activity of an IgG1 Antibody. 2016. Biotechnol.Prog.] Masayoshi Onitsuka等人2015年在.Journal of Bioscience and Bioengineering杂志上发表了一种快速检测N-糖基化的新方法,如下图所示,该方法使用AlphaLISA检测平台,根据不同类型的凝集素(Lectin)与不同糖基特异性配对结合, 通过Alpha Signal信号值的改变,实时动态快速判断CHO HcD6-SF细胞不同培养条件下, IgG1抗体Fuc、GalB4GlcNAc和BGlc-NAc三种类型糖基化的时间动态曲线。 [Rapid evaluation of N-glycosylation status of antibodies with chemiluminescent lectin-binding assay.2015.Journal of Bioscience and Bioengineering 体外用来评价细胞活性的方法种类繁多,每种方法的实验原理、检测技术、检测特点及所用仪器都不尽相同(如下图)。传统的细胞活性评价方法, 如MTT、CCK8及ATP检测等,虽能评价细胞的活性,但无法区别免疫细胞和肿瘤细胞;而LDH检测、 DELFIA BATDA细胞膜通透性检测和基于显微成像的细胞活性检测可以特异性检测免疫细胞对肿瘤细胞的杀伤活性。 检测技术 主要实验方法 灵敏度 背景噪声 特异性 事实验周期 MTT类检测(490 nm) 光吸收 CCK8 (WST-8)检测(450nm) LDH检测(500nm) SRB检测(540 nm) 低 中 中等 1-2小时 荧光强度 阿尔玛蓝 (Alamar Blue ) (530/590nm)Calcein-AM (活细胞荧光染料) 中等 高 中等 >2小时 化学发光法 ATP检测法ATPLite 细胞色素P450酶活检测 高 低 高 <20分钟 时间分辨荧光 DNA片段化检测 (DELFIA DNA fragmentation)DNA复制检测 (DELFIA BrdU Proliferation) 高 低 高 1-2小时 细胞膜通透性检测((DELFIA BATDA Cytotoxicity) Alpha检测 Caspase 等特异性凋亡Marker 高 低 高 1-2小时 细胞荧光成像 通过明场或者细胞特异性染料染色 如Annexin V等特异性凋亡Marker 高 中 高 >2小时 LDH方法是通过细胞裂解后会将乳酸脱氢酶 (Lactate Dehydrogenase, LDH)释放到上清中,吸取上清加入底物四氮唑蓝 (Trazolium Salt),底物在LDH的作用下被还原成在490-520nm波长有特异光吸收的甲瓒产物(Formazan),通过光吸收检测甲瓒产物的含量来评价肿瘤细胞被裂解的效果。但由于除了肿瘤细胞 (Target) 会被裂解释放LDH以外,免疫细胞 (Effector) 也会存在非特异性裂解释放LDH,因此该方法无法精确判断LDH的来源,在特异性方面存在一定的局限性。 DELFIA BATDA细胞膜通透性方法能有效排除LDH方法中免疫细胞非特异性裂解的干扰。BATDA为特异性乙酰酯化探针,可标记肿瘤细胞,酯化酯BATDA可穿透细胞膜随后被乙酰酯酶去乙酰化,去乙酰化的TDA不能再次透过细胞膜而滞留的细胞内。洗去多余染料后加入免疫细胞一起孵育,被裂解的肿瘤细胞将TDA释放到上清中,并与时间分辨荧光探针Eu形成Eu-TDA复合物,最终通过检测Eu-TDA的时间分辨荧光信号,来评价免疫细胞对肿瘤细胞的特异杀伤活性。BATDA检测方法在保证标记特异性的基础上,从可操作性、安全性及数据稳定性等方面也更有优势。 如前篇所述,对于抗体药物的开发,,可通过改造Fc区域的氨基酸序列或糖基化,提高/降低抗体对Fc受体的亲和力,从而改善抗体介导的免疫细胞对靶细胞的杀伤功能,如ADCC/ADCP/CDC。而对于免疫细胞杀伤活性检测,除常用的生化检测方法以外,借助全自动显微成像高内涵分析技术平台的发展,可以更直观的对细胞、甚至3D细胞球及微组织的形态结构、空间改变、相互作用、时间效应等参数进行多维度实时检测和定量分析。 [Bioprocessing Journal 2016 Vol1S/No1] 罗氏集团的科研团队在2016年PLosONE杂志上发表的文章中,使用高内涵系统Operetta对CD44治疗抗体介导的巨噬细胞吞噬过程,进行了长达10个小时的实时检测(如下图)。图中绿色为CMFDA Green标记的肿瘤细胞,黄色为CMTMROrange标记的巨噬细胞,图中白色箭头处可观察到被巨噬细胞包噬的肿瘤细胞,通过Harmony分析软件可对连续观测的图像进行定量分析,以实时比对CD44抗体处理组与空白组相比巨噬细胞对肿瘤细胞的杀伤效果。 **** <0.0001 [Targeting Tumor Cells with Anti-CD44 Antibody Triggers Macrophage-Mediated Immune Modulatory Effects in a Cancer Xenograft Model. 2016. PLoSONE] 上海细胞治疗研究院团队提供利用表达PD-L1抗体的CAR-T细胞增强免疫细胞对3D肿瘤细胞的特异性杀伤,以提高免疫治疗效果。使用高内高成像系统Operetta以2h间隔连续采集24h的活细胞影像,实时观察PD-L1/CAR-T细胞对3D肿瘤细胞的浸润及杀伤效果,与对照组相比PD-L1/CAR-T细胞的免疫杀伤效果随时间和剂量呈增加趋势,通过Harmony分析软件可进一步精确定量3D肿瘤细胞凋亡的状况。 【图片及数据由上海细胞治疗研究院提供: SKOV3肿瘤细胞由 Hochest 染为蓝色, CAR-T细胞由 Calcein 染为为绿色,死细胞由PI染为红色。】 单抗药物 Trastuzumab 抑制增殖及 HER2 靶向性研究 单抗作为抑制细胞增殖类的主要治疗性药物,其作用机理繁多,且靶点也不尽相同。对于单抗药物的早期评价及功能性验证,需要灵敏度高、特异性好的检测方法。目前常用的细胞肿瘤活性实验原理通常为检测细胞代谢物活性,如MTT/MTS/CCK8及ATP检测等,而这些方法都不能直接反应细胞真实的增殖状况。Jonas Helma等人在2017年SLAS Discovery杂志上,使用 Operetta HCS系统,通过简单且灵敏的EdU方法,评价Trastuzumab对不同肿瘤细胞系细胞增殖DNA合成速度的影响(如下图)。 [A Simple and Sensitive High-Content Assay for the Characterization of Antiproliferative Therapeutic Antibodies.SLAS Discov. 2017.22(3):309-315] 2017年Sigma-Tau制药公司生物技术部研发团队在Oncotarget杂志上发表的文章中,对治疗性抗体Trastuzumab(靶向HER2胞外Domain Ⅳ)和Pertuzumab (靶向HER2胞外Domain II)分别使用AvidinOX(正在进行临床活性测试 ClinicalTrial.gov NCT02053324)进行生物素化,通过Operetta HCS 60倍物镜, 对CF488荧光探针偶联的bTrast和bPert抗体药物在细胞膜上分布及内化进行定量,研究发现AvidinOX能增加单抗药物对HER2/Erb2的靶向性及有效性(如下图) [AvidinOX-anchored biotinylated trastuzumab and pertuzumab induce down-modulation of ErbB2 and tumor cell death. 2017 Oncotarget Vol. 8,(No.14),pp:22590-22605.] 对于生物大分子药物,在临床治疗过程中常会引起免疫应答产生抗药抗体(Anti-drug antibodies,ADA),影响治疗效果及安全性。以TNFα的治疗抗体(如Humira/Adalimumab)为例,在治疗过程中可能会产生三种类型的抗药抗体ADA:类型l,阻断药物结合其靶点TNFα,但不结合靶点;类型ⅡI,可结合药物,但不阻断药物结合靶点;类型Ⅲ,可与抗体和靶点形成的复合物特异性结合。 以Humira/Adalimumab药物抗体为例,使用AlphaPlex技术平台(如下图所示):类型Il抗药抗体Biotin化之后结合SA偶联的供体微珠,可检测游离态抗体和抗体复合物;类型l抗药抗体偶禺在Tb标记的受体微珠上,可检测游离态抗体;类型I抗药抗体偶联在Eu标记的受体微珠上,可检测抗体和TNFα形成的复合物;基于以上实验设计原理,利用EnVision仪器上配置的Alphaplex双发射检测模块,对同一组样品,仅需一次检测,即可得到游离态抗体药物(Tb标记)和抗体复合物(Eu标记)的含量及比例。 抗药抗体ADA是评价生物大分子类药物免疫原性(Immugenecity)的重要指标,也是影响大分子药物研发进程的关键步骤,而抗药抗体ADA检测,对实验方法的灵敏度、稳定性及对药物本身的耐受性等,都有更严格的要求。使用Alpha检测方法,可以更快速的检测抗药抗体ADA含量,对血清等成分具有更好的抗干扰能力,且具有更宽的动态检测范围(大于5个数量级)和良好的重现性(CV≤10%),对于酸处理环境也具有很好的耐受度,其检测灵敏度完全符合FDA的指导原则(250-500 ng/ml) 在常规ELISA实验中经常会遇到检测灵敏度不够、动态检测范围过窄及稳定性差等问题。基于时间分辨荧光的DELFIA (Dissociation-Enhanced Lanthanide Fluorescence Immunoassay)方法能解决以上所有难题。镧系元素是一类新型的、高灵敏度、高稳定性、易操作的小分子标记物,用镧系元素作为示踪物标记抗体,最终使用时间分辨荧光仪器测定产物中荧光强度,确定待测样品含量。从ELISA到DELFIA转换仅需一步解决,除更换镧系元素标记的检测蛋白/抗体以外,无需优化其他任何步骤。 ELISA HRP Streptavidin TNF-a Capture antibody DELFIA Log[Human IL-2], g/mL Eu Direct adsorption - Indirect capture Streptavidin Antigen Orientation DELFIA ELISA TNF- Capture antibody Human IL-2 Direct 1.2 15.6 Human IL-2 Indirect 6.8 N/A 如上图(左)TNF-α双抗夹心法检测,将HRP标记的链霉亲和素(Streptavidin,SA) 换成Eu标记的SA,即可完成ELISA-to-DELFIA一步转换。以上图(右)细胞因子人源白介素2/Human IL-2为实例,通过ELISA-to-DELFIA一步转换法,平行比对了两种方法对Human IL-2的检测灵敏度,直接法DELFIA检测灵敏度比ELISA提高超过一个数量级,而且DELFIA方法还可以使用间接法,以节省双抗夹心法中的捕获抗体获用量,从而降低整体实验成本。DELFIA-to-DELFIA一步转化所需试剂如下表: 分类 英文名称 中文名称 货号 SA偶联-Eu DELFIA Eu-N1 Streptavidin Eu标记的链霉亲和素 1244-360 SA偶联-Tb DELFIA Tb-N1 Streptavidin Tb标记的链霉亲和素 AD0047 SA偶联-Sm DELFIA Sm-N1 Streptavidin Sm标记的链霉亲和素 AD0049 检测抗体-Eu DELFIAEu-N1 Anti-HA Eu标记的HA抗体 AD0054 检测抗体-Eu DELFIA@ Eu-N1 Anti-6xHis Eu标记抗6His抗体 AD0108 检测抗体-Eu DELFIA@Eu-N1 Anti-c-Myc Eu示记的抗c-Myc抗体 AD0112 检测抗体-Eu DELFIAEu-N1 Anti-c-GST Eu标记的抗GST抗体 AD0250 检测抗体-Eu DELFIA Eu-N1 Anti-Human lgG Eu标记的人IgG抗体 1244-330 检测抗体-Eu DELFIAEu-N1 Goat anti-Rabbit lgG Eu标记抗兔lgG抗体 AD0105 检测抗体-Eu DELFIAEu-N1 Rabbit Anti-Mouse-lgG Eu标记的兔抗小鼠IgG抗体 AD0124 抗磷酸化抗体-Eu DELFIA Eu-N1 Anti-Phosphtyrosine (P-Tyr-100) Eu标记的磷酸化酪氨酸抗体 AD0159 抗磷酸化抗体-Eu [ DELFIA Eu-N1 Anti-Phosphtyrosine (PY20) Eu标记的抗磷酸化酪氨酸抗体 AD0038 抗磷酸化抗体-Eu DELFIA Eu-N1 Anti-Phosphtyrosine (PT66) Eu标记的抗磷酸化酪氨酸抗体 AD0040 抗磷酸化抗体-Eu DELFIA Eu-N1 Labeled Anti-Phosphothreonine Antibody Eu标记的抗磷酸化酪氨酸抗体 AD0092 抗磷酸化抗体-Eu DELFIA Eu-N1 Labeled Anti-Phosphoserine Antibody Eu标记的磷酸化丝氨酸抗体 AD0185 基于QbD 原则的单抗药物高效工艺开发 由于生物制品的特殊性,在抗体筛选、优化过程中,除了关注其各项生物学、免疫学特性,更需充分理解环境、工艺步骤及过程对产品纯度、杂质及各项理化特性的影响,以保障最终产品的质量可控。因此,FDA提出的QbD (QualitybyDesign)原则,我国的《生物类似药研发与评价技术指导原则》也对抗体药物的工艺开发提出了更高的要求。由此,高通量、微量化的表达、纯化及分析检测技术,成为高效、可靠、快速、节省的抗体药研发必不可少的工具。 常被业内人士称作““MicroChip CE”的 LabChip GXII Touch 微流控毛细管电泳系统,凭借其胜任至少6种关键质量表征分析的能力、与传统毛细管电泳相当的灵敏度与分辨率、以及70倍于传统CE技术的速度,近年来已逐步成为生物药研发,尤其是工艺优化环节的标准分析平台。同时Janus G3 BioTx蛋白纯化工作站,不仅能够快速有效的为LabChip GXIITouch分析平台输送样品,更能够在微滴式高通量全光谱分析仪DropletQuant的辅助下,实现高效的纯化工艺开发。 基于创新的IntelliChip Protein Clear HR Assay, 智能识别操作差异,进而实时优化实验条件,从而大大提高批次内和批次间的检测数据重现性,更推动了LabChip GXII Touch分析平台从研发走向生产放行,已获得了抗体药物研发业内大咖的一致认可。 小动物活体光学成像技术已在生命科学基础研究、临床前医学研究及药物研发等领域得到广泛应用。尤其是在药物研发领域,无论是小分子药物、生物大分子制药和还是日益兴起的细胞治疗等,活体光学成像技术作为整体动物模型药物治疗研究的关键点,对临床前药物研发的进程起着不容忽视推进作用。 利用小动物光学成像技术在活体水平对药物研发的应用,主要可分为以下三个方向:1)建立疾病动物模型,对肿瘤、炎症、感染性疾病、神经性疾病等的治疗药物进行药效学评价;2)对治疗药物在动物体内的靶向分布、组织代谢及降解过程等进行研究;3)对治疗药物进行整体动物毒性及毒理机制研究。 在PerkinElmer, 我们已经为临床前研究开发出业内顶尖的成像技术。我们的技术将三维光学、PET成像与microCT成像进行整合,让研究人员能更全面地了解疾病:更好地监控疾病进展,更早地检测治疗效果,更深入地掌握在病情发展过程中的代谢变化。借助优化的活体荧光、生物发光试剂及放射性探针,研究人员能检测目标信号的深度、体积、浓度和代谢活动,从而为解开疾病之谜提供丰富的信息。 小动物活体光学成像技术已广泛应用于药物的临床前研发阶段,在药物研发中应用已经非常成熟,全球各大制药企业均已采用活体光学成像技术开展抗肿瘤、抗感染等药物的研发。PerkinElmer 的小动物活体光学成像系统的全球装机量已经多达2000台。科学家们使用PerkinElmer的成像系统,已经成功发表上万篇文献。全球各大制药企业均已采用PerkinElmer的活体成像技术开展新药的研发,其中已有6种药物获得美国的FDA认证,另有8种药物处于临床测试阶段。 Drugs Currently In Clinical Trials ·ABT-888 (Abbott): multiple diverse tumor models · Dasatinib (Bristol-Myers Spuibb): chronic myelogenous leukemia ·RANKL Inhibitor (Amgen): denosumab and bone metastasis models ( . · Tasigna (Novartis): leukemia/metastasi s model ) ( · Cubicin (Cubist Pharmaceuticals): bacterial peritoniti s model ) Aflibercept (Sanofi-Aventis): orthotopic renal cancer · Velcade (Millennium Pharmaceuticals): multiple myeloma ( ·P anzem (EntreMed Pharmaceuticals): orthotopic gliosarcoma ) ( A EE788 (Novartis): intrapenitonea l tumor model ) ( ·I T-101/CR L X 101 (Insert Therapeutics, Cerulean Pharma In c .): Ewings sarcoma ) ( ·C HIR-258 (Novartis): orthotopic multiple myeloma model ) ·NPI-0052 (Nereus Pharmaceuticals): subcutaneous tumor model ( ·G G0070 (Cell G e nesys): orthotopic bladder cancer ) 传统细胞系肿瘤模型(Cell-line Derived Xenograft, CDX)适合体外长期传代,并保持高度同源性,在肿瘤药物研发过程中有长期的工作基础,模型建立容易,重复性好。使用稳定表达生物发光报告基因的肿瘤细胞系,在免疫缺陷鼠体内进行接种建立肿瘤模型,借助小动物生物发光光学成像系统对肿瘤模型进行非侵入式实时成像检测,以评价不同抗体药物处理后的肿瘤治疗效果。如右图所示,在Raji-fluc淋巴肿瘤模型上,研究Rituximab-Cy7标记抗体处理后和肿瘤细胞的共定位情况。 [In vivo Molecular Imaging of Cancer with a Quenching Near InfraredFluorescent Probe Using Conjugates of Monoclonal Antibodies andIndocyanine Green. Cancer Res. 2009.15; 69(4):1268-1272.] 利用特异性荧光探针,如靛青绿 (Indocyanine Green) 与已上市单抗药物,如Declizumab、Trastuzumab和Panitumumab进行偶联,制备成可激活的荧光探针标记抗体,使用小动物活体荧光成像系统对动物整体及肿瘤内靶蛋白的表达及分布进行实时监测,评价抗体药物的靶向性及抗体治疗效果(如左图)。 中科学分子影像重点实验室田捷课题组在2017年International Journal of Nanomedicine杂志上发表的文章中,采用针对免疫检验点PD-1的特异性荧光抗体探针PD-1-IRDye800CW, 在4T1-fLuc小鼠乳腺癌动物模型上,使用IVIS Spectrum活体光学成像系统,监测外科手术前后,4T1-fLuc小鼠乳腺癌发生、残留、复发及转移的情况,并同步监测PD-1的表达分布及与乳腺癌发病的相关性。如下图所示,在连续检测的48小时内, PD-1-IRDye800CW与对照组相比具有更好的靶向性和滞留时间。 Min =1.29e7 Max=4.96e8 [Improved resection and prolonged overall survival with PD-1-IRDye800CW fluorescence probe-guided surgery and PD-1 adjuvant immunotherapy in 4T1 mousemodel. Int JNanomedicine. 2017:128337-8351 动物模型及检测:结构成像- PET 成像 利用Quantum microCT及IVIS Spectrum活体光学三维成像系统可以对肿瘤及骨转移进行三维多模式成像。通过光学三维成像系统可以获取肿瘤本身的功能性图像,结合microCT系统同时获得小鼠全身的骨架结构图像。另外,通过对骨转移区域进行高分辨率的microCT扫描,可以清晰地获得由于肿瘤骨转移而造成的骨溶解。由于Quantum GXmicroCT系统的低辐射性能,长时间成像也不会对肿瘤病灶本身产生影响,因此非常适合用于活体动物长时间肿瘤骨转移成像研究。如下图所示,对生物发光标光MDA-MB-231乳腺癌肿瘤模型进行肿瘤骨转移研究,A图可见骨转移生物发光信号,B图为高分辨率骨侵蚀的 microCT成像。 PET (positron emission tomography, PET)作为一种专业分子成像模式,是能向临床分子诊断转化最近的技术平台,其更接近生理状态的标记及非侵入式检测特测,对基础免疫学和临床医学等多种新兴领域具有巨大的应用价值。目前新兴的immuno-PET概念,就是基于PET平台,采用89Zr、125I放射性核素标记单抗药物,将PET相机的高灵敏度、高分辨率及可视化与单抗的高特异性相结合,在整体动物水平类似进行“体内综合免疫组织化学染色”,以获得更多接近真实生理学的病理学信息。 LIE-UJH 2E- -25 1- 22-10 利用18F-FDG及G8PET/ 利用18F-FDG系统对(a)小鼠白血病细CT系统进行皮下移植瘤的胞株L1210和L1210-10K皮下移植模型和成像,结果显示了该探针 (b)B16黑色素瘤细胞肺转移模型(红被肿瘤及心脏大量吸收, 色箭头)进行PET成像检测。并经膀胱进行代谢。 利用124|标记的特异性肿瘤靶向探针系统对U87脑胶质瘤移植模型进行成像和检测。 其他药代、分布、毒性研究 Avastin/Bevacizumab通过特异性结合并阻断VEGF(血管内皮生长因子)抑制肿瘤血管生成,是世界上第一个抗肿瘤血管生成的抗体类药物。Palbociclib (帕博西尼)是针对CDK4/6激酶靶点的高选择性小分子抑制剂,辉瑞公司于2015年获得Palbociclib与诺华Letrozole(来曲唑)联合治疗ER+/HER2-绝经后晚期乳腺癌的FDA药物上市审批。 Docetaxel(多西他赛)为紫杉醇类传统化疗药物。 在2009年Clin Cancer Res杂志发表的文章中,辉瑞肿瘤生物部研发团队就利用IVIS小动物光学成像技术平台,将荧光素酶标记MDA-MB-4355乳腺癌细胞移植入小鼠肾包膜下,建立肾包膜肿瘤疾病活体水平动物药效学评价模型,通过观测给药后光学信号随时间的变化情况,进而评价Palbociclib (PD-991)、Avastin 和 Docetaxel三种不同药物,特定的给药途径、时间、剂量等给药策略对于肿瘤的治疗效果。 相对于触诊、肿瘤体积测量等传统方法,利用高灵敏度的生物发光成像技术进行药物评价,可以更灵敏的发现残余病灶点或尽早发现肿瘤的复发,从而更准确的对药物治疗效果进行判定。并且利用生物发光成像技术进行药效评价的另一独特优势在于,可以明确判断药物是否有效杀死肿瘤活细胞。这是由于生物发光的原理是基于活细胞环境的酶促反应,因此,能够发光的细胞必定是具有活性的,从而避免了传统体积测定方法造成肿瘤体积无变化、内部已出现细胞死亡的检测陷阱。 针对人类顽疾癌症的治疗,多靶点联合治疗是当前的一个新思路,而小分子药物和生物大分子治疗的联合应用带来的治疗改善,给攻克癌症治疗难题也带来了新曙光。而高灵敏度的生物发光成像技术平台,以其非侵入性、快速、高效、高灵敏度等特点,也为多靶点联合治疗开启了新篇章。 免疫检验点抗体药物联合治疗研究 Michael Lim等人在2017年Clinical Cancer Research杂志上的文章中,首次使用PD-1阻扩抗体、TIM-3阻断抗体和传统放疗 (stereo-tactic radiosurgery, SRS)三种方式联合,在小鼠神经胶质瘤模型上,评价不同组合联合治疗的效果,如下图数据所示,使用三种方式联合治疗能显著提高小鼠的生存时间,并且通过IVIS成像系统检测发现,第14天以后治疗组已检测不到GL261-luc2细胞的生物发光信号。 [Combination therapy with anti-PD-1, anti-TIM-3, and focal radiation results in regression of murine gliomas.2017.Clinical Cancer Research] Ronald Blasberg等人在2016年Molecular Therapy: Oncolytics杂志上发表的文章中,使用PD-1/PD-L1阻断抗体,联合靶向PSMA的人CAR-T细胞,对小鼠前列腺癌模型(Myc-CaP:psma(+))的治疗效果。如下图中结果所示, 阻断PD-1/PD-L1, 使得hPSMA-CAR-Tcell免疫治疗效果增强,但是治疗反应仅仅是在短期内,表示可能存在其他的免疫调节机制,限制了CAR-T细胞靶向、功能和在hPSMA阳性肿瘤的汇集。 Non Invasive In Vivo 3D Bioluminescent and 3D FluorescentImaging of Human Prostate PC-3M-Luc Tumor Cells in Mice 通过近红外荧光探针直接标记单抗药物,经尾静脉注射后,利用小动物活体成像检测荧光信号,而实时追踪抗体药物在体内分布、肿瘤靶向性及代谢情况。 利用近红外荧光探针直接标记抗体药物Herceptin/Trastuzumab,将XenoFluor 750-Herceptin通过尾静脉注射到HER2/neu阳性的小鼠模型体内。给药前21天使用人源前列腺癌PC-3M-luc细胞株,在免疫缺陷小鼠体内进行细胞原位移植造模,并同时用Spectrum检测生物发光信号,判断肿瘤生长状况。 XenoFluor 750-Herceptin不同剂量给药后,使用Spectrum连续检测荧光信号72h,可直观看到药实实时分布且靶向肿瘤的情况,并通过软件定量分析肿瘤区域的荧光信号后,得到Herceptin的代谢曲线(如右图所示). Takuo Suzuki等人在2015年mAbs杂志上发表的文章中,使用一种更先进的基于FRET的方法,分别标记Trastuzumab和Cetuximab, 通过小动物活性成像平台检测完整抗体实时分布及抗体被降解的情况。 以上这种FRET模型非常适合对抗体完整性、生物分布及稳定性的评价,且对Fc区域介导的ADCC效应及改造机制和抗体偶联药物设计(Antibody-Drug Conjugates,ADC)提供重要有效信息。 [A fluorescent imaging method for analyzing the biodistribution of therapeutic monoclonal antibodies that can distinguish intact antibodies from their breakdown products.2015.mAbs] PhenopticstsTM组织微环境景观分析解决方案 PhenopticsTM组织微环境景观分析方案是PerkinElmer推出的新型定量病理分析技术,借助多色标记免疫荧光染色、光谱成像信号拆分和智能定量病理分析三方面的技术突破,实现了组织原位的多标记定量统计分析,将组织形态学和表型识别统计完美的融合在一起,在肿瘤免疫和肿瘤微环境研究中有着重要的意义和应用前景。 多色免疫荧光OpalTM染色方案基于TSA (Tyramine Signal Amplification, TSA) 酪胺信号放大技术,在大幅提高被检测信号的灵敏度的同时,通过微波洗脱与抗原非共价结合的抗体和循环复染,解决了同源一抗(不受种抗体种属来源限制)在同一张切片上多种生物标志物同时检测难题,最后借助多光谱成像平台Vectra及inForm定量病理分析软件对多色标记组织样品进行成像分析,对肿瘤微环境中的不同细胞类型的生物标记物表达进行定量分析,如肿瘤和基质中的CD8和PD-L1的表达量的分型统计。 (下图A-F) A 【多标记免疫荧光染色及多光谱成像技术在组织学研究中的应用《中国组织化学与细胞化学杂志》2017.Vol.26.No.4】 随着转化医学和精准医疗研究的深入开展,研究者对于组织形态和病理学定量分析的要求将越来越高。PhenopticsTM组织微环境景观分析解决方案将多标记染色、多光谱成像和软件智能分析三者紧密结合,大幅提高了组织形态学分析的数据精度和准确度,不仅满足了现代组织学分析在数据客观性、精确性方面的更高要求,更是从方法学角度为组织学研究带来了革命性的变化,为描绘复杂的组织微环境提供了的全新的思路,必将为定量病理在肿瘤免疫治疗领域的蓬勃发展提供新的契机。 在免疫系统对肿瘤细胞的免疫应答过程中,T细胞必须特异性的识别肿瘤细胞,并被激活进入效应防御/杀伤状态。在T细胞被激活的过程中,存在一系列精密的调控机制,由激活型和抑制型调控受体及其配体共同协调完成。 抑制型(亦称免疫检验点)受体和配体,如PD-1、CTLA-4、LAG-3和TIM-3等受体,通常表达在T细胞和抗原呈递细胞上,最近研究发现这些免疫检验点受体/配体也在肿瘤细胞中表达,而肿瘤细胞通过这种伪装机制,抑制免疫系统应答,形成“免疫逃逸”。针对免疫检验点CTLA-4和PD-1/PD-L1阻断型抗体已上续上市,也是目前肿瘤免疫治疗领域最具有潜力的新兴市场。 [Clin Cancer Res; 19(19);5300-9.2013 AACR] 梅克尔细胞癌 ( Merkel-Cell Carcinoma) 是一种伴随紫外照射和梅尔克多瘤病毒(Merkel-cell polyomavirus, MCPyV)感染引起的恶性皮肤癌。对于恶性转移梅克尔细胞癌,常用传统化疗方式进行治疗,但治疗效果短且易复发。Nghiem等人在2016年N EnglJ Med杂志上发表的文章中,首次使用PD-1阻断型抗体药物 Keytruda/Pembrolizumab治疗梅克尔细胞癌。其中一例69岁女性转移性梅克尔细胞癌患者,在接受Keytruda治疗一周后,肿瘤明显缩小(下图A-B)。进过对患者活检样品进行OpalTM多标记染色及成像后进一步分析发现,用药前PD-L1 阳性肿瘤细胞大量分布在肿瘤区域,而用药后肿瘤细胞被完全清除,免疫系统依然处于活跃状态且在肿瘤区域形成免疫生发中心(下图C)。 黄色 CD8红色 CD68 白色 PD-1 绿色 PD-L1 橙色 NSE 梅克尔细胞癌患者,其肿瘤细胞常伴随PD-L1高表达,而梅尔克多瘤病毒感染T细胞常伴随PD-1高表达,在对于肿瘤患者的治疗中,使用特异性抗体对生物标志物,如PD-L1和PD1进行诊断,是进行精准治疗的重要参考依据。 免疫检验点抗体药物多靶点联合治疗 针对大多数肿瘤, PD-1抑制剂单独使用有效率约10%-30%,其有效治疗常伴随病人PD-L1的高表达及相关信号通路异常。为进一步提高肿瘤免疫治疗的有效率,联合治疗&精准治疗将是大趋势。目前PD-1抑制剂联合CTLA4抗体已被批准用于恶性黑色素瘤治疗,PD-1抗体联合化疗已被批准用于晚期非鳞非小细胞肺癌癌线治疗,另外PD-1联合放疗、联合靶向药物及联合合瘤疫苗的研发也在进行中。 “三阴性”乳腺癌 (Triple-Negative Breast Cancers, TNBC) 是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体 (HER2) 均阴性的一种特殊类型乳腺癌。 “三阴性”乳腺癌约占所有乳腺癌的10-20%,但因其缺乏内分泌及抗HER2治疗的靶点,目前治疗仍以传统外科切除、化疗及放疗为主。 DAPI1 CCD3CD44 CD8 FOXP33 CCK18PD-L1DAPICD3 (CD44 CCD8 FOXP33CCK18PD-L1 Days [Combined immune checkpoint blockade as a therapeutic strategy for BRCA1-mutated breast cancer. 2017 Sci. Transl. Med] Nolan等人在2017年6月Science Translational Medicine 杂志封面文章中,使用PD-1&CTLA4免疫检验点抑制剂联合化疗药物治疗BRAC1突变型“三阴性”乳腺癌,通过对一系列病人组织样品研究发现, BRAC1突变型“三阴性”乳腺癌病人,常伴随着基质中肿瘤浸润淋巴细胞(TIL)数量增加,同时PD-L1在基质免疫细胞和肿瘤细胞中表达量都分别有提高;这些结果也进一步揭示BRCA1突变型肿瘤会伴随高几率肿瘤特异性新抗原的产生,并招募大量效应T细胞到达肿瘤微环境;但是免疫系统的抗肿瘤活性会同时被高表达的PD-L1和免疫检验点系统激活而消弱补偿(上图A-C)。免疫检验点PD1&CTLA4抗体阻断剂和化疗药物顺铂给药组,不仅对肿瘤的生长大小有明显的抑制作用;同时与对照组和其他组合给药组相比,能显著延长疾病小鼠模型的存活期(上图D)。 TMA (Tissue Microarray) 八色复染评测肿瘤微环境 使用多色免疫荧光OpalTM染色技术,可对TMA样品进行免疫检验点PD-1、PD-L1、OX40、CD27、TIM、CD3、肿瘤标志物和DAPI等八种颜色同时复染,与传统三色以内IHC方法相比,可在有限临床样本内,获得更多、更准确的有效信息(下图A)。对TMA复染样品进行多光谱成像及智能定量分析后,得到不同类型肿瘤患者的免疫检验点蛋白表达谱,这些信息是接受免疫检验点抗体药物治疗后肿瘤微环境表征的重要指标,也是设计更有效的免疫治疗药物,进行精准治疗的重要信息源(下图B-C)。 A Melanoma Lung squamous cell carcinoma Bladder carcinoma B Immune marker cells C [Eight-Color Multiplex Immunohistochemistry for Simultaneous Detection of Multiple Immune Checkpoint Molecules within the Tumor Microenvironment 2018.J Immunol] 代表性文献列表 1.Michael E. et al. Bembenek. Determination of complementary antibody pairs using protein A capture with the AlphaScreen assay format. Anal. Biochem.(2011) 408:321-327.[ALPHA/Complementary antibody screening] 2.Peter Cariuk. et al. Evolution of Biologics Screening Technologies. Pharmaceuticals (2013) 6:681-688.[ALPHA/Antibody screening] 3.Hiroyuki Takeda. et al. Production of monoclonal antibodies against GPCR using cell-free synthesized GPCR antigen and biotinylated liposome-basedinteraction assay. Scientific Reports (2015) 5:11333.[ALPHA/Monoclonal antibodies screening] 4.Florio M. et al. A bispecific antibody targeting sclerostin and DKK-1 promotes bone mass accrual and fracture repair.Nat Commun. (2016) 7:11505[ALPHA/ Bispecific antibody Binding] 5.Desch KC. et al. Probing ADAMTS13 Substrate Specificity using Phage Display. PLoS One. (2015)10(4):e0122931.[ALPHA/Phage display screening] 6.Kotaro Sakamoto. et al. Discovery of an artificial peptide agonist to the fibroblast growth factor receptor 1c/bKlotho complex from random peptide T7phage display. Biochem. Biophys. Res. Commun (2016) 480: 55-60.[ALPHA/Phage display screening] 7.Karen A. Kirby. et al. Structural basis of clade-specific HIV-1 neutralization by humanized anti-V3 monoclonal antibody KD-247. FASEB J. (2015)29(1):70-80. [ALPHA/HIV neutralization antibody Binding] 8.Lin MA. et al. Generation and characterization of a human nanobody against VEGFR-2. Acta Pharmacologica Sinica (2016) 37:857-864.[ALPHA/VEGFR-2Nanobody screening] 9.S. Veugelen. et al. Screening and Characterization Strategies for Nanobodies Targeting Membrane Proteins. Methods Enzymol (2017) 584:59-97.[ALPHA/Nanobody screening and Charaterization] 10.Greg A. Lazar. et al. Engineered antibody Fc variants with enhanced effector function. PNAS (2006)103,4005-4010.[ALPHA/ Fc y Rl Optimization] 11.Wu Q. et al. Development and applications of AlphaScreen-based FcRn binding assay to characterize monoclonal antibodies.J Immunol Methods.(2015) 420:31-7.[ALPHA/FcRn Binding Assay] 12.Onitsuka M. et al. Rapid evaluation of N-glycosylation status of antibodies with chemiluminescent lectin-binding assay. J Biosci Bioeng.(2015)120(1):107-10.[ALPHA/Antibodies N-glycosylation] 13.Kaendler K. et al. Evaluation of dried blood spots for the quantification of therapeutic monoclonal antibodies and detection of anti-drug antibodies.Bioanalysis. (2013) 5(5):613-22.[ALPHA/ Anti-Drug Antibody] 14.ose J. et al. Evaluation of Multiple Immunoassay Technology Platforms to Select the Anti-Drug Antibody Assay Exhibiting the Most Appropriate Drugand Target Tolerance. J Immunol Res. (2016)2016:5069678.[ALPHA /Anti-Drug Antibody] 15.Mikulskis A. et al. Solution ELISA as a platform of choice for development of robust, drug tolerant immunogenicity assays in support of drug develop-ment. J Immunol Methods. (2011) 365(1-2):38-49. [ALPHA /Drug tolerant immunogenicity] 16.Leary BA. et al. Bioanalytical platform comparison using a generic human lgG PK assay format. J Immunol Methods(2013) 397(1-2):28-36.[ALPHA/IgGPK] 17.Dynon K. et al. HtrA3 as an Early Marker for Preeclampsia: Specific Monoclonal Antibodies and Sensitive High-Throughput Assays for Serum Screening.PLoS One.(2012)7(9):e45956.[ALPHA/diagnostic marker] 18.Nagayoshi Y. et al. Profiling of Autoantibodies in Sera of Pancreatic Cancer Patients. Ann Surg Oncol. (2014) 21:S459-65. [ALPHA/ Profiling ofAutoantibodies] 19.Hu Z. et al. Detection of hepatitis B virus PreS1 antigen using a time-resolved fluoroimmunoassay.J Immunoassay Immunochem. 2012;33(2):156-65.[DELFIA/HBV antigen detection] 20. Julia Steinbacher. et al. An Fc-optimized NKG2D-immunoglobulin G fusion protein for induction of natural killer cell reactivity against leukemia. Int. J.Cancer (2015)136:1073-1084. [DELFIA/BATDA cytotoxicity] 代表性文献列表 21.Haen SP. et al. Prognostic relevance of HER2/neu in acute lymphoblastic leukemia and induction of NK cell reactivity against primary ALL blasts by tras-tuzumab. Oncotarget.(2016)7(11):13013-30.[DELFIA/Bispecific antibody cytotoxicity] 22.Han H. et al. High Throughput Profiling of Charge Heterogeneity in Antibodies by Microchip Electrophoresis. Anal Chem. (2011) 83(21):8184-91.[Labchip/Charge Heterogeneity] 23. Primack J. et al. A high-throughput microchip-based glycan screening assay for antibody cell culture samples. Electrophoresis. (2011) 32(10):1129-3.[Labchip/N-glycan profiles] 24. Kim MJ. et al. Author Detection of melanoma using antibody-conjugated quantum dots in a coculture model for high-throughput screening system.Analyst (2012)137:1440-1445. [HCS/ Antibody-conjugated quantum dots] 25. Gillissen M.A. The modified FACS calcein AM retention assay: A high throughput flow cytometer based method to measure cytotoxicity.J ImmunolMethods. (2016)434:16-23.[HCS/Cell cytotoxicity] 26.Maisel D. et al. Targeting Tumor Cells with Anti-CD44 Antibody Triggers Macrophage-Mediated Immune Modulatory Effects in a Cancer XenograftModel. PLoS ONE (2016)11(7):e0159716.[HCS/Kinetic ADCP] 27. Stengl A. et al. A Simple and Sensitive High-Content Assay for the Characterization of Antiproliferative Therapeutic Antibodies. SLAS Discov.(2017)22(3):309-315.[HCS/Cell proliferation] 28. Milazzo FM. et al. AvidinOX-anchored biotinylated trastuzumab and pertuzumab induce down-modulation of ErbB2 and tumor cell death. Oncotarget(2017)8:22590-22605.[HCS/Antibody location and efficiency] 29.Zhang C. et al. Advancing bioluminescence imaging technology for the evaluation of anticancer agents in the MDA-MB-435-HAL-Luc mammary fatpad and subrenal capsule tumor models. Clin Cancer Res. (2009)15(1):238-46.[IVIS/Tumor models] 30.0gawa M. et al. In vivo Molecular Imaging of Cancer with a Quenching Near Infrared Fluorescent Probe Using Conjugates of Monoclonal Antibodiesand Indocyanine Green. Cancer Res. (2009)15:1268-1272.[IVIS/Targeting and efficiency of therapeutic antibodies] 31.JB Kim. et al. Non-Invasive Detection of a Small Number of Bioluminescent Cancer Cells In Vivo. PLoS One. (2010) 5(2): e9364.[IVIS/BioluminecentCancer Models1 32.Du Y. et al. Improved resection and prolonged overall survival with PD-1-IRDye800CW fluorescence probe-guided surgery and PD-1 adjuvant immuno-therapy in 4T1 mouse model. Int J Nanomedicine. (2017) 12:8337-8351.[IVIS/Fluorescence probe] 33. Kim JE. et al. Combination therapy with Anti-PD-1, Anti-TIM-3, and focal radiation results in regression of murine gliomas. Clin Cancer Res. (2017)23(1):124-136.[IVIS/Combination therapy for gliomas] 34. Serganova l. et al. Enhancement of PSMA-directed CAR adoptive immunotherapy by PD-1/PD-L1 blockade. Mol Ther Oncolytics. (2017) 2016:41-54.[IVIS/Combination therapy of CarT and PD-1/PD-L1blockade] 35. Suzuki T. A et al. Fluorescent imaging method for analyzing the biodistribution of therapeutic monoclonal antibodies that can distinguish intact anti-bodies from their breakdown products. MAbs. (2015) 7(4):759-69.[IVIS/Antibody biodistribution] 36.钱邦国,焦磊。多标记免疫荧光染色及多光谱成像技术在组织学研究中的应用《中国组织化学与细胞化学杂志》2017.第26卷第4期【多色标记免疫组织化学;多光谱成像;酪胺信号放大;定量病理学】 37.Paul T. N. et al. PD-1 blockade with pembrolizumab in advanced merkel-cell carcinoma. N Engl J Med.(2016) 374(26):2542-2552.[QPS/Therapy anti-bodies combination] 38.Nolan E et al. Combined immune checkpoint blockade as a therapeutic strategy for BRCA1-mutated breast cancer. Sci. Transl. Med.(2017)9(393):eaal4922.[QPS/Combined therapy of checkpoint blockade] 39.Gorris MAJ. et al. Eight-Color Multiplex Immunohistochemistry for Simultaneous Detection of Multiple Immune Checkpoint Molecules within theTumor Microenvironment.J Immunol. (2018) 200(1):347-354.[QPS/Tumor Microenvironment] 40. Lin H. et al. Host expression of PD-L1 determines efficacy of PD-L1 pathway blockade-mediated tumor regression. J Clin Invest. (2018)16:96113.[QPS/Clinical efficacy of therapeutic antibodies] PerkinElmer始终致力于为您提供最先进的技术和最合适的应用解决方案。我们不仅提生物制药检测仪器,我们还有相应的试剂耗材完全解决方案。我们有强大的仪器&试剂技术支持服务团队,将与您并肩合作克服科学研究中遇到的各种挑战。 珀金埃尔默企业管理(上海)有限公司 上海总公司 地址:上海浦东新区张江高科 技园区张衡路1670号 二环南路西段凯德广广11层 电话:+8621-6064 5888 传真:+8621-6064 5999 邮编:201203 北京分公司 下市直街1号信义会馆12号 电话:+86108434 8999 传真:+86108434 8988 邮编:100015 中文网址: www.perkinelmer.com.cn 客户服务电话:800820 5046 400820 5046 PerkinElmer 要获取我们位于全球的各个办公室的完整列表,请访问 http://www.perkinelmer.com.cn/AboutUs/ContactUs/ContactUs/ 版权所有 C2018, PerkinElmer, Inc. 保留所有权利。PerkinElmer是 PerkinElmer, Inc. 的注册商标。其它所有商标均为其各自持有者或所有者的财产。 本资料中的信息、说明和技术指标如有变更,恕不另行通知。 500001_CHN_01 针对生物大分子制药研发流程的每一个环节,PerkinElmer公司可提供覆盖分子-细胞-活体-组织的全方位检测技术、仪器平台、试剂耗材及相关服务。针对杂交瘤、噬菌体或人源B细胞等不同文库的抗体筛选,高通量多模式检测系统、多标试剂(如高灵敏度免洗Alpha技术)及细胞株、高内涵细胞显微成像系统、自动化样品处理工作站可以在分子及细胞水平提供最佳的高通量抗体筛选及优化方案。对于抗体药物的临床前/临床功能验证、安全评价及治疗效果,可借助生化检测及分子影像学平台,完成从分子机制、细胞信号通路、组织微环境及整体动物水平的系统评价。针对抗体工艺开发及生产质控过程中的抗体纯度、糖基化、片段化/聚合化、荷电异质性及宿主细胞残留等重要质控指标,全自动毛细管电泳抗体分析系统和多模式检测及专业试剂盒可大大降低该环节的技术成本。另外,随着医疗大数据时代的到来,PerkinElmer Signal数据挖掘分析系统,结合高质量显微成像技术和数字定量病理智能算法,为基础研究到临床实践的转化进一步助力加速。 该应用方案将涵盖: 体外抗体高通量筛选及优化体外抗体功能性评价及研究动物活体水平抗体治疗评价临床组织病理抗体诊断治疗
确定










还剩30页未读,是否继续阅读?
珀金埃尔默企业管理(上海)有限公司为您提供《抗体药物中研发过程中技术、仪器、试剂耗材等检测方案(酶标仪)》,该方案主要用于生物药品药物研发中其他检测,参考标准--,《抗体药物中研发过程中技术、仪器、试剂耗材等检测方案(酶标仪)》用到的仪器有
相关方案
更多
该厂商其他方案
更多









