
本文用NexION 350X联合在线自动稀释系统检测药物中的元素杂质,完全满足药物重金属限量的规定,并且其结果数据也能够符合USP中关于QC和Validation的要求。
方案详情

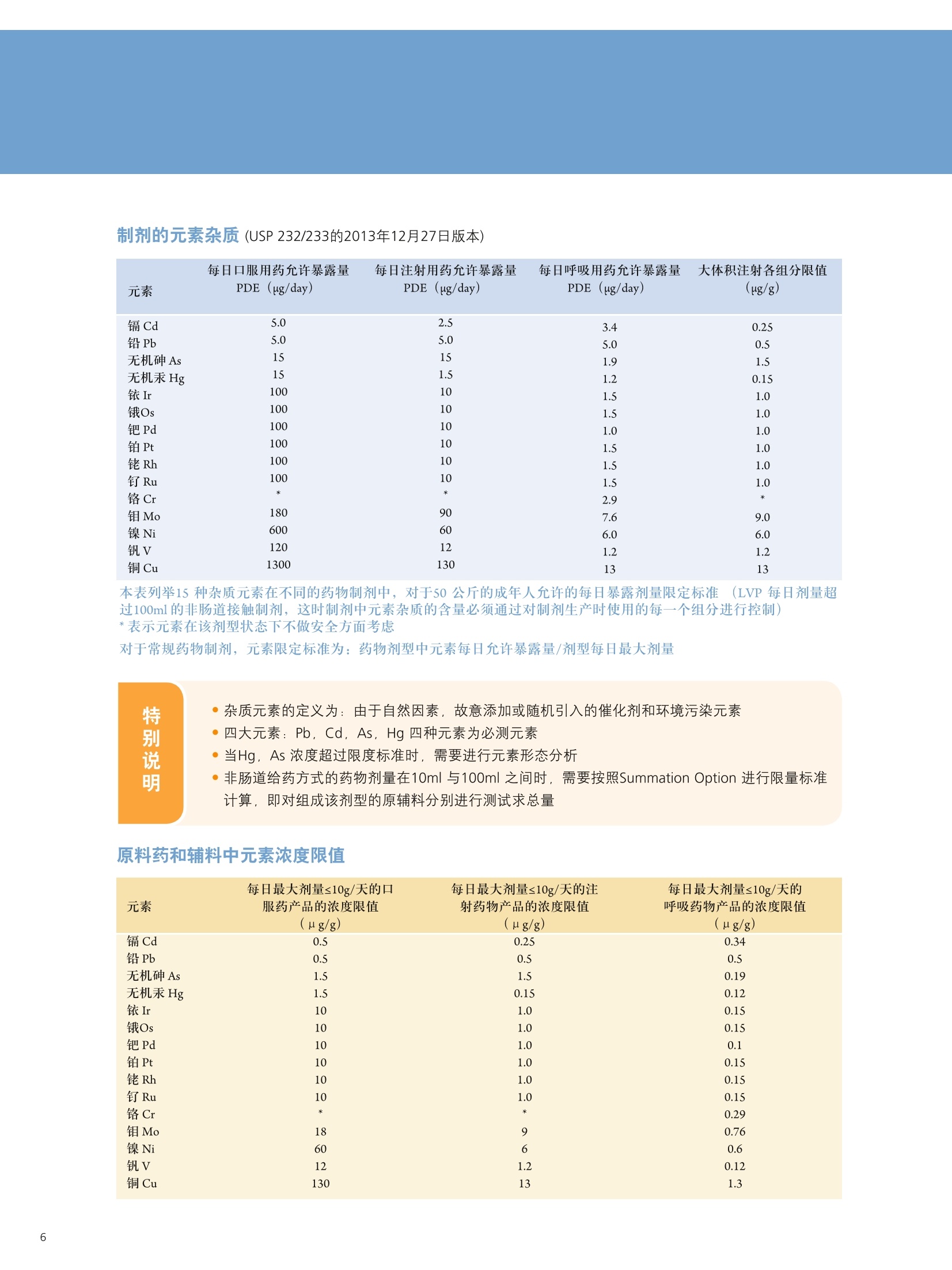
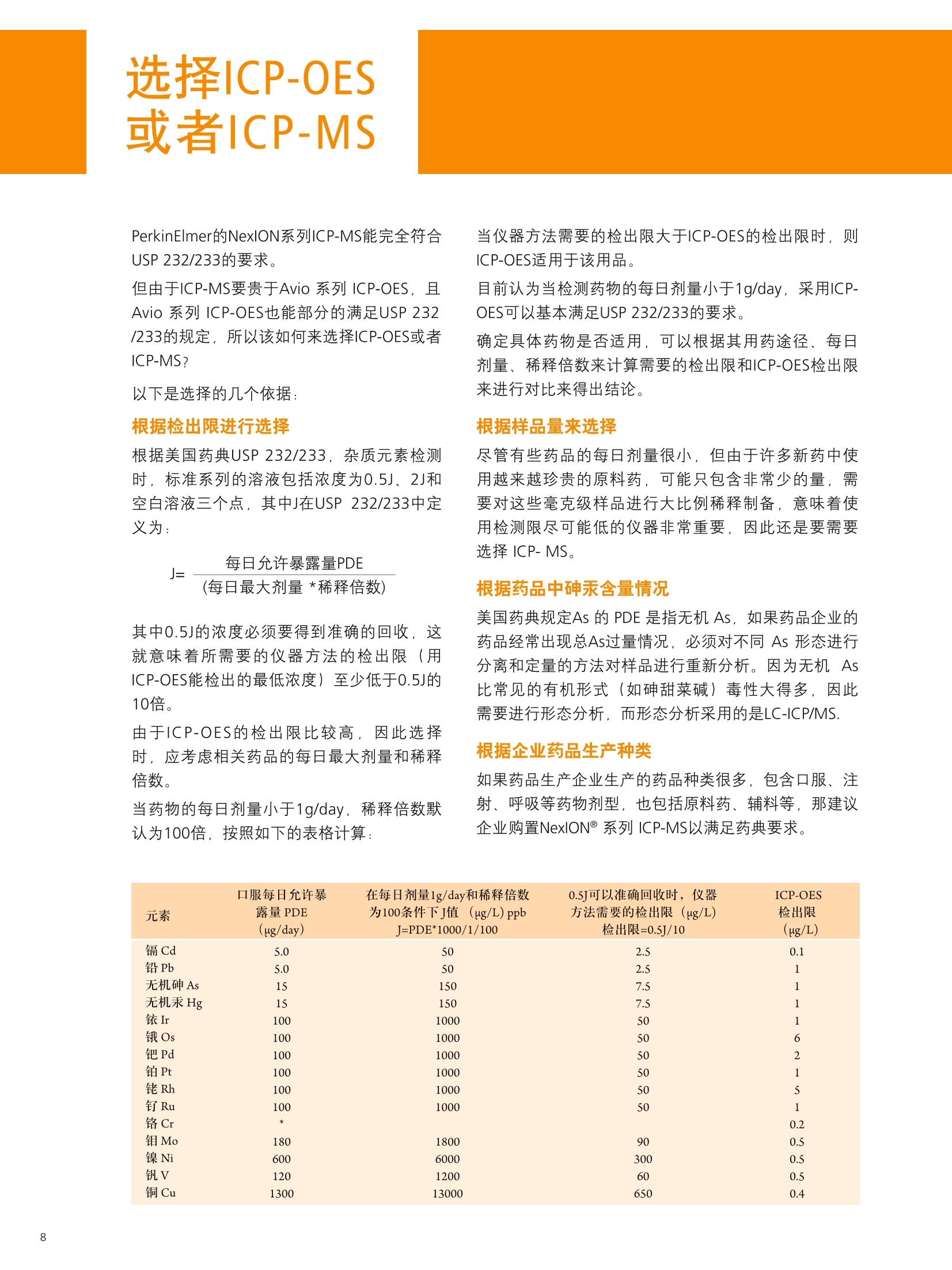
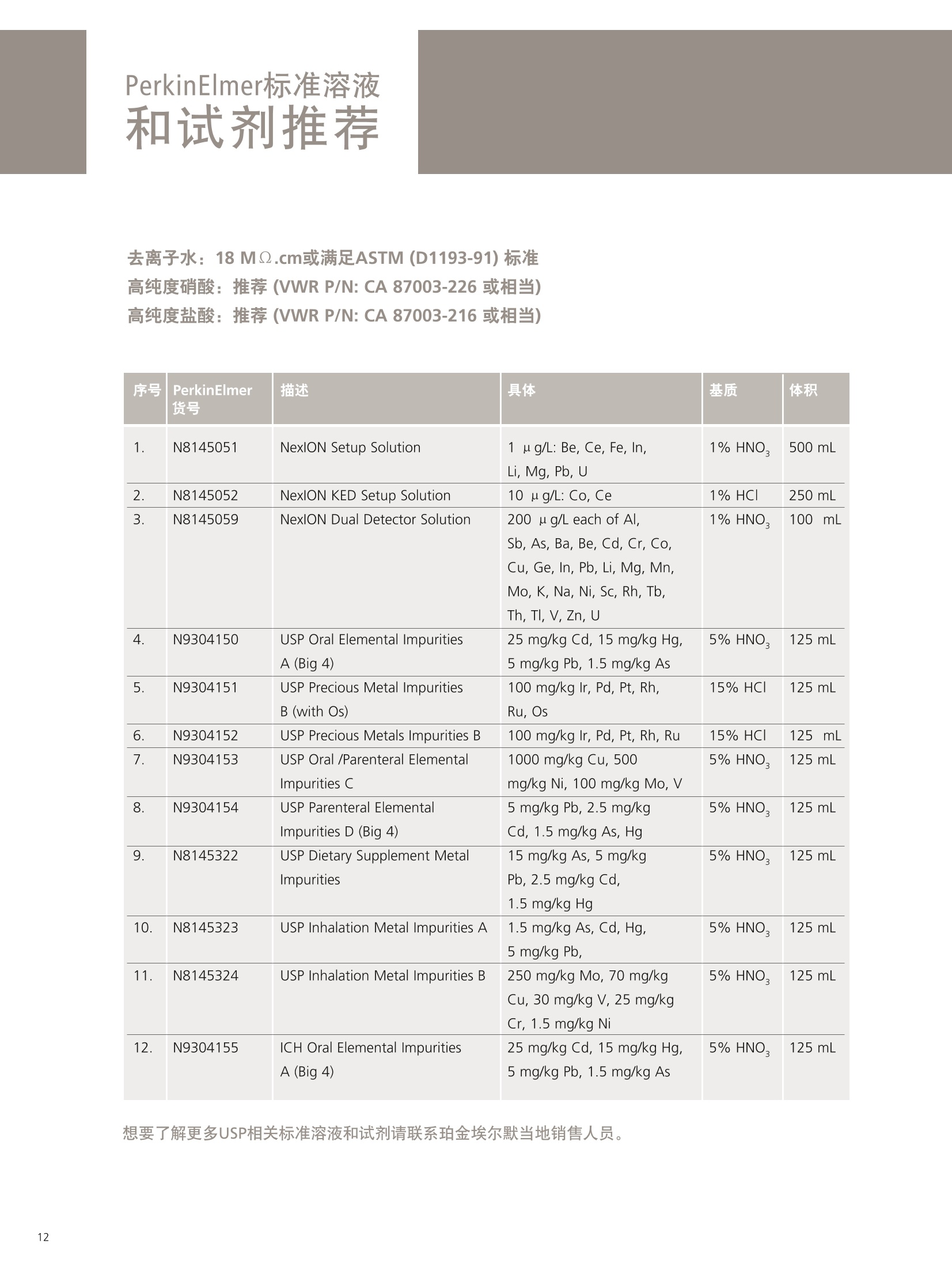
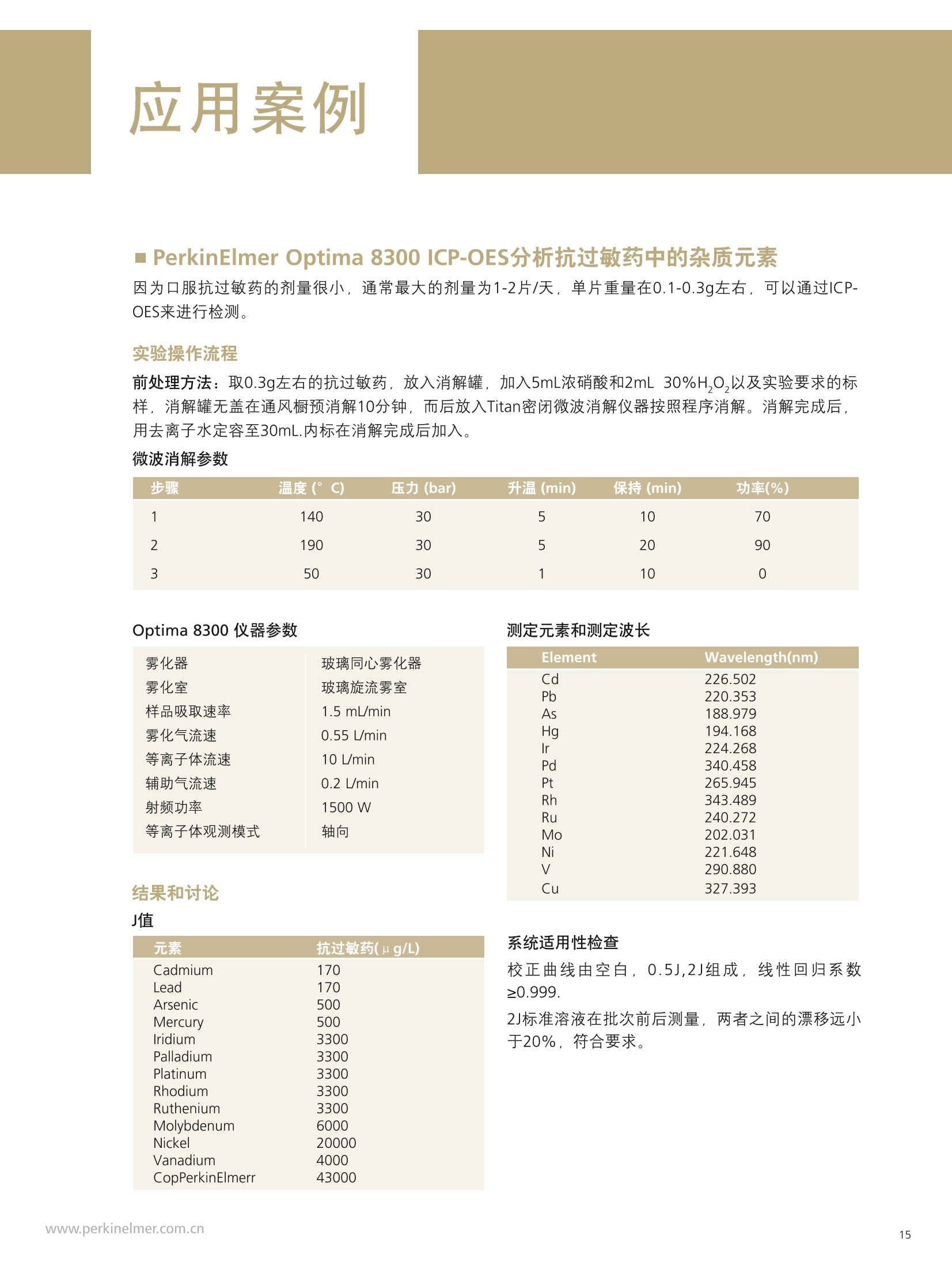
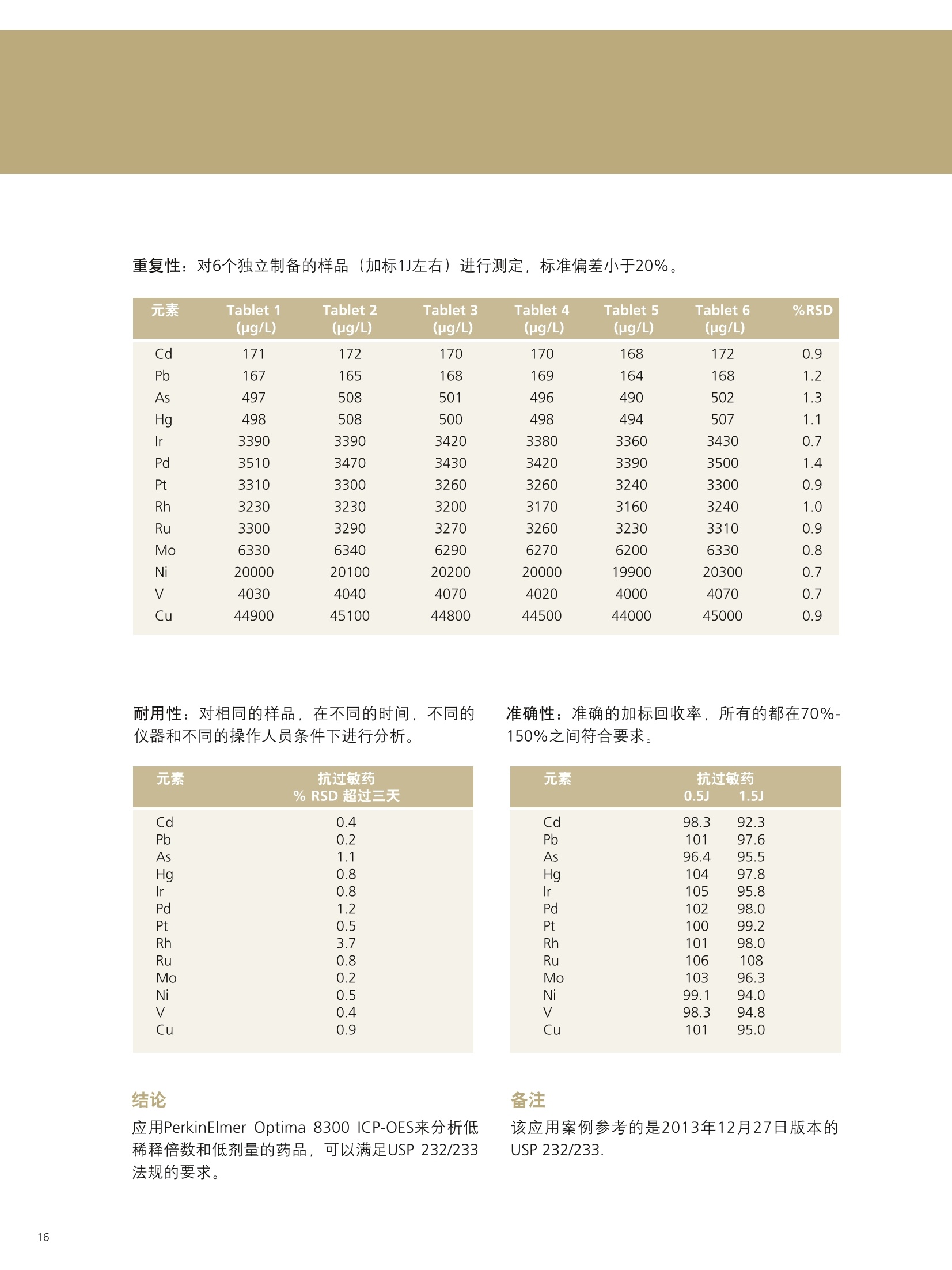
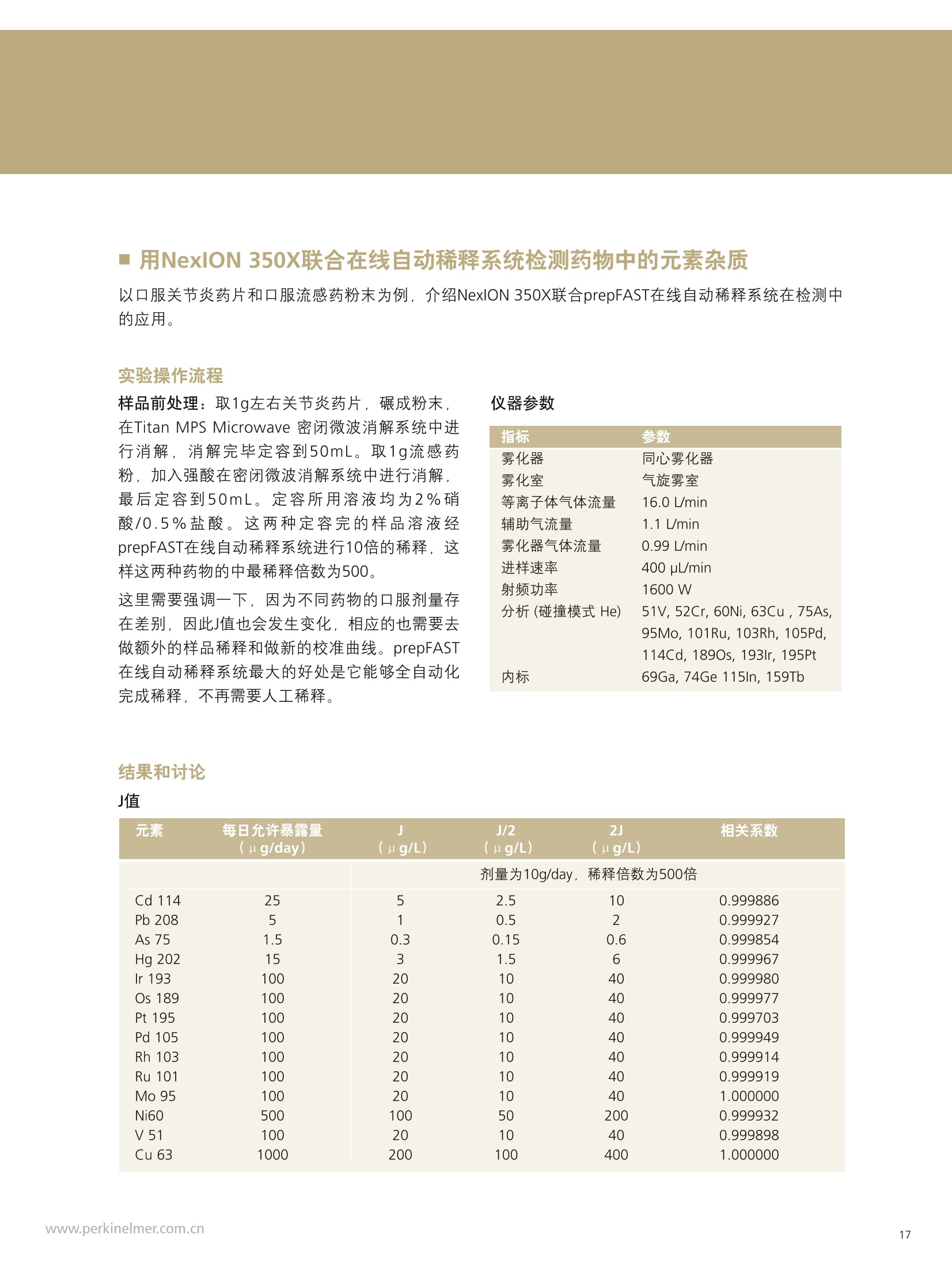
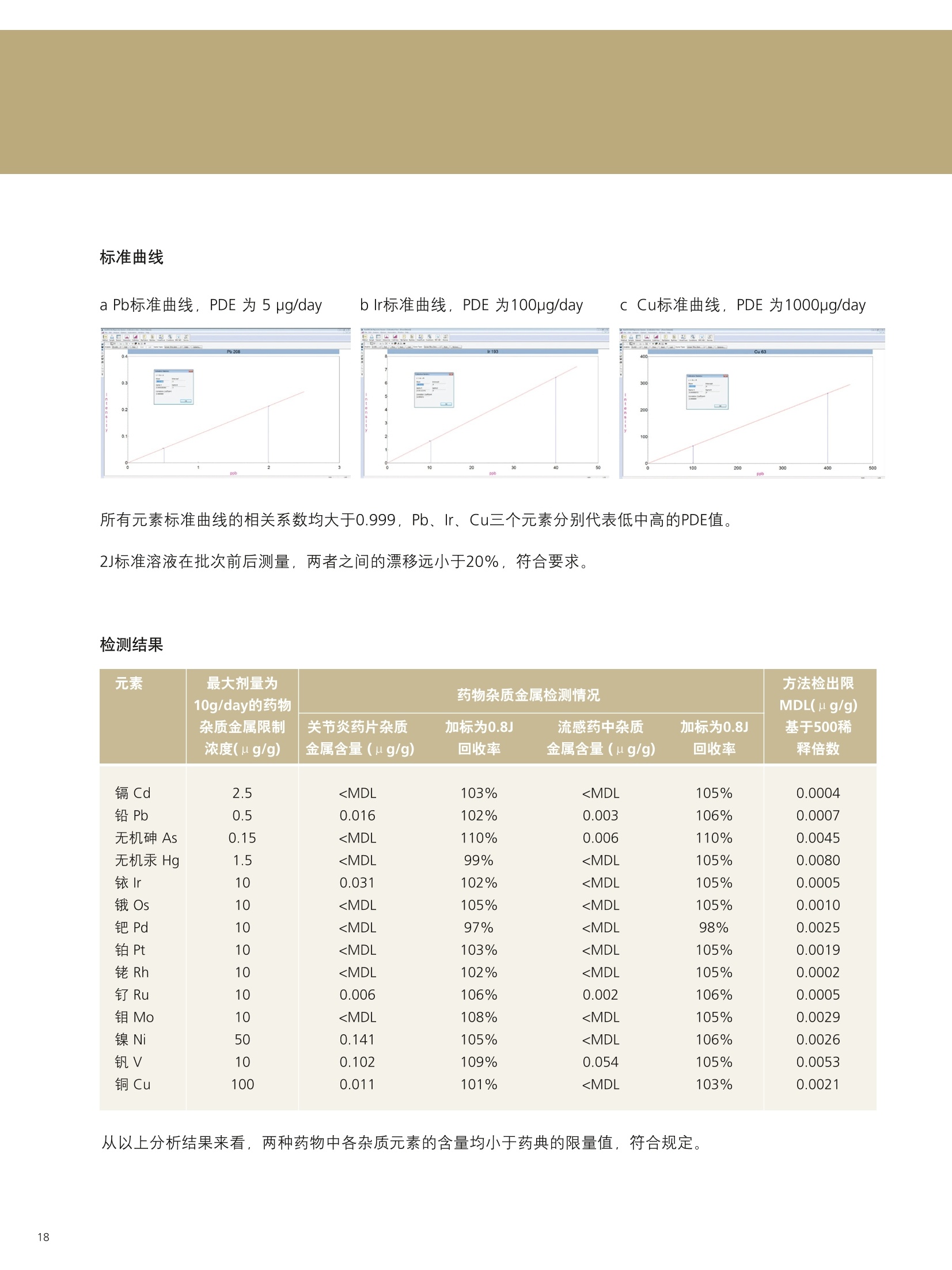
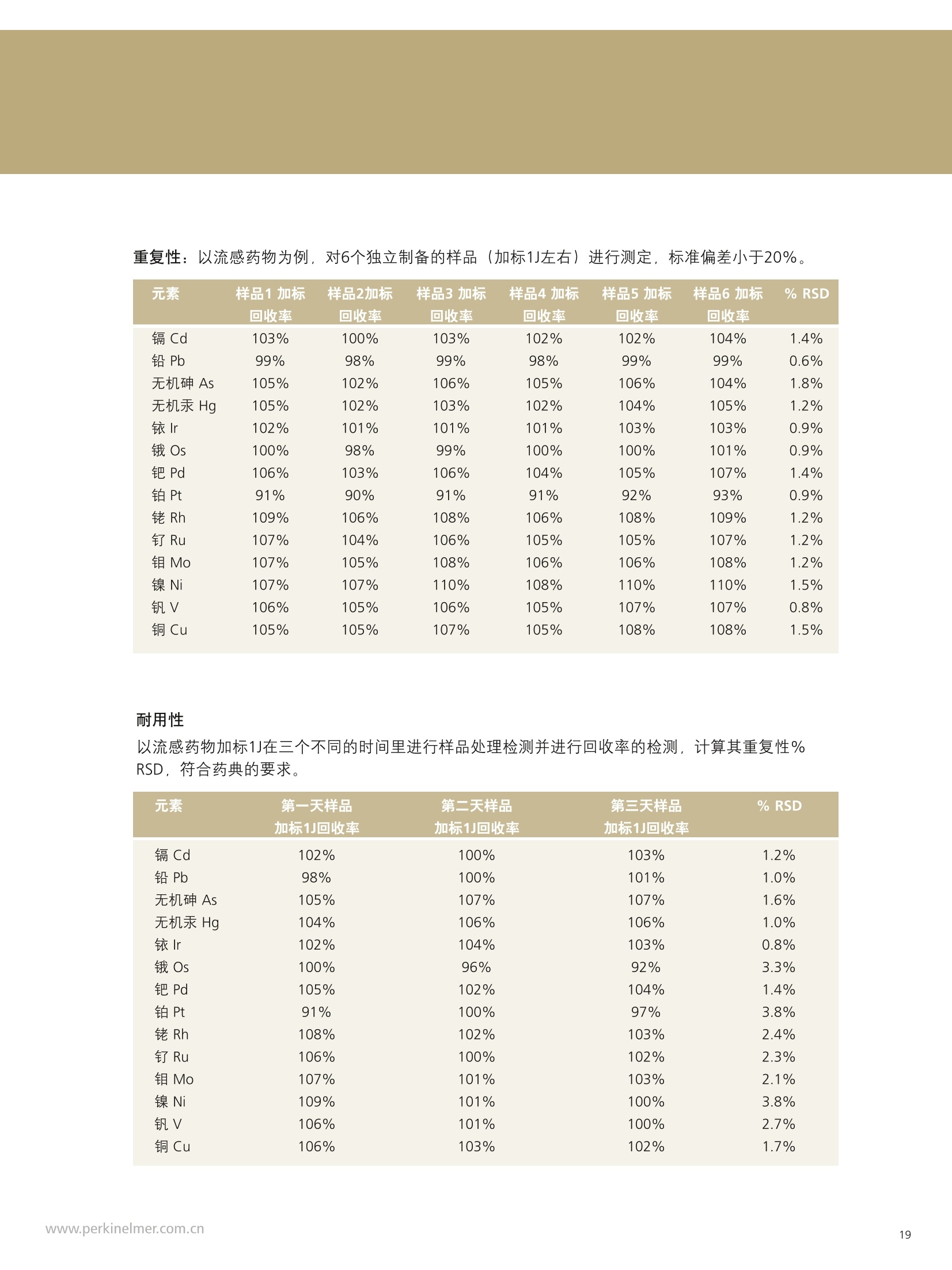
PerkinElmer应对USP232/233的解决方案 美国药典USP 232/233背景 PerkinElmer应对USP 232/233的解决方案 PerkinElmer 应用于药品 检测的仪器家族 药物 研发 IR Imaging 固体制剂均匀 度分析;病理组织分析 DSC 药物热力学分析晶型分析 目录 美国药典USP 232/233背景 4-6 PerkinElmer 提供方案满足美国药典USP 232/233的要求 7 选择ICP-OES或者ICP-MS 8 PerkinElmer 样品处理设备推荐 9 Titan MPSTM Microwave 密闭微波消解系统 prepFAST在线自动稀释系统 PerkinElmer ICP-OES 简介 10 PerkinElmer ICP-MS 简介 11PerkinElmer 标准溶液和试剂推荐 12PerkinElmer USP 232/233法规符合性 13-14 21 CFR Part 11 标准操作规程(SOP) 系统确认Validation IQ/0Q认证 应用案例 15-20 ICP-OES 应用案例 ■ICP-MS应用案例 杂质元素检测的重要性 药品安全是重大的民生和公共安全问题,事关人民群众身体健康和社会和谐稳定,因此国家在2012伊始第一次发布了《国家药品安全“十二五”规划》,对包括化学药,原料药,中成药在内的各种药品提出了更高质量标准和检测需求。国家希望我们化学药和生物制品的生产质控及检测能力在十二五末能够达到国际先进水平符合国际标准,而我们的中药质控标准可以主导国际标准的制定。相信这些期许必将对我国药品检测监管单位和制药企业质控部门提出更高的要求。 USP 美国药典 杂质元素的限度检测对于药物安全至关重要,已经证明这些杂质元素是引起人体癌症,神经系统等疾病的诱因。 制药工业中可能引入杂质元素的途径 ●原料药生产过程中使用的金属催化剂 动植物原材料(植物提取液动物蛋白 rDNA等) 辅料(稳定剂,增溶剂,风味剂,色素等) 药品包装与药品之间杂质元素迁移 制药生产设备 EP欧洲药典 美国药典USP在2008年9月份的药典论坛34期第5卷 (PF34(5))提出对重金属检测进行修改,并于PF36(1)中提议增加三项重金属检测的通则。目前美国,日本和欧盟三方药典机构正通过协调审议这三个新的检测通则,作为未来新版ICH Q3D。USP已于2012年5月份正式将<232>与<233>收录进USP 35-NF 30第二增补版,随后不断推迟生效日期,最终于2018年1月1号正式实施。 USP<231>法案:1905年提出距今超过100年的历史, 一种近似于半定量的药品重金属总量测试方法,样品与二价硫离子形成重金属硫化物通过与标准铅溶液形成的硫化物进行颜色比对完成测试,如右图所示 USP <231> 重金属检测方法的弊端: >需要大量供试样品 (2g左右) >半定量性质的重金属总量检测,不能检测特定元素含量 >重现性差 >非专属性检测方法(检测元素数量有限 Pb, Hg, Bi, As, Sb, Sn, Cd, Ag, Cu, Mo) >对于非直接水溶,酸溶样品,在样品炽灼灰化过程中,造成元素损失 >由人来视觉判断重金属硫化物的颜色,主观因素大 USP <232> 杂质元素限定明确要求对药物制剂,原料药及辅料中的15种杂质元素进行测定,并按照给药方式,药物剂型的不同进行分别限定 USP <232>药品中杂质元素限定 元素杂质的毒性与其暴露程度(生物利用度)有关。每个感兴趣的元素杂质的暴露程度由三种给药途径决定:口服,注射,吸入。这些限值是基于慢性暴露实验得到的数据而得出的。其他两个给药途径,粘膜和外用,对于本标准的目的而言,被认为与口口相同, 制剂的元素杂质 (USP 232/233的2013年12月27日版本) 每日口服用药允许暴露量 每日注射用药允许暴露量 每日呼吸用药允许暴露量 大体积注射各组分限值 元素 PDE (ug/day) PDE (ug/day) PDE (ug/day) (ug/g) 镉Cd 5.0 2.5 3.4 0.25 铅Pb 5.0 5.0 5.0 0.5 无机砷As 15 15 1.9 1.5 无机汞 Hg 15 1.5 1.2 0.15 铱Ir 100 10 1.5 1.0 Os 100 10 1.5 1.0 钯Pd 100 10 1.0 1.0 铂 Pt 100 10 1.5 1.0 铑Rh 100 10 1.5 1.0 钉Ru 100 10 1.5 1.0 铬 Cr * * 2.9 钼 Mo 180 90 7.6 9.0 镍Ni 600 60 6.0 6.0 钒V 120 12 1.2 1.2 铜 cu 1300 130 13 13 本表列举15种杂质元素在不同的药物制剂中,对于50公斤的成年人允许的每日暴露剂量限定标准 (LVP 每日剂量超过100ml 的非肠道接触制剂,这时制剂中元素杂质的含量必须通过对制剂生产时使用的每一个组分进行控制)*表示元素在该剂型状态下不做安全方面考虑 对于常规药物制剂,元素限定标准为:药物剂型中元素每日允许暴露量/剂型每日最大剂量 杂质元素的定义为:由于自然因素,故意添加或随机引入的催化剂和环境污染元素 四大元素: Pb, Cd, As, Hg 四种元素为必测元素 当Hg, As 浓度超过限度标准时,需要进行元素形态分析 非肠道给药方式的药物剂量在10ml 与100ml之间时,需要按照Summation Option 进行限量标准 计算,即对组成该剂型的原辅料分别进行测试求总量 原料药和辅料中元素浓度限值 元素 每日最大剂量≤10g/天的口 每日最大剂量≤10g/天的注 每日最大剂量≤10g/天的 服药产品的浓度限值 射药物产品的浓度限值 呼吸药物产品的浓度限值 (ug/g) (ug/g) (ug/g) 镉 Cd 0.5 0.25 0.34 铅Pb 0.5 0.5 0.5 无机砷As 1.5 1.5 0.19 无机汞Hg 1.5 0.15 0.12 铱Ir 10 1.0 0.15 饿Os 10 1.0 0.15 钯Pd 10 1.0 0.1 铂 Pt 10 1.0 0.15 铑Rh 10 1.0 0.15 钉 Ru 10 1.0 0.15 铬 Cr * * 0.29 钼 Mo 18 9 0.76 镍Ni 60 6 0.6 钒V 12 1.2 0.12 铜Cu 130 1.3 类型 法规要求 PerkinElmer 提供的方案包括 仪器 样品前处理设备 Titan MPS Microwave 密闭微波消解系统 溶液处理系统 prepFAST在线自动 稀释系统 检测仪器 NexlON@系列 ICP-MS Avio 系列 ICP-OES 软件 仪器操作软件 Enhanced Security TM software 试剂 标准溶液 各种溶液试剂标准及货号 法规符合性 符合21CFR Part 11 Enhanced Security TM software符合性介绍 建立标准操作规程文件SOP和系统验证Validation NexlON标准操作规程文件SOP范例、Validation 文件范例、PerkinElmer应用案例 认证包括IQ/OQ认证 相关仪器IQ/OQ认证服务 选择ICP-OES或者ICP-MS PerkinElmer的NexlON系列ICP-MS能完全符合USP 232/233的要求。 但由于ICP-MS要贵于Avio 系列 ICP-OES, 且Avio 系列 ICP-OES也能部分的满足USP 232/233的规定,所以该如何来选择ICP-OES或者ICP-MS? 以下是选择的几个依据: 根据检出限进行选择 根据美国药典USP 232/233,杂质元素检测时,标准系列的溶液包括浓度为0.5J、2J和空白溶液三个点,其中J在USP 232/233中定义为: 其中0.5J的浓度必须要得到准确的回收,这就意味着所需要的仪器方法的检出限(用ICP-OES能检出的最低浓度)至少低于0.5J的10倍。 由于ICP-OES的检出限比较高,因此选择时,应考虑相关药品的每日最大剂量和稀释倍数。 当药物的每日剂量小于1g/day,稀释倍数默认为100倍,按照如下的表格计算: 当仪器方法需要的检出限大于ICP-OES的检出限时,则ICP-OES适用于该用品。 目前认为当检测药物的每日剂量小于1g/day, 采用ICP-OES可以基本满足USP 232/233的要求。 确定具体药物是否适用,可以根据其用药途径、每日剂量、稀释倍数来计算需要的检出限和ICP-OES检出限来进行对比来得出结论。 根据样品量来选择 尽管有些药品的每日剂量很小,但由于许多新药中使用越来越珍贵的原料药,可能只包含非常少的量,需要对这些毫克级样品进行大比例稀释制备,意味着使用检测限尽可能低的仪器非常重要,因此还是要需要选择 ICP-MS。 根据药品中砷汞含量情况 美国药典规定As 的 PDE 是指无机As, 如果药品企业的药品经常出现总As过量情况,必须对不同As 形态进行分离和定量的方法对样品进行重新分析。因为无机 As比常见的有机形式(如砷甜菜碱)毒性大得多,因此需要进行形态分析,而形态分析采用的是LC-ICP/MS. 根据企业药品生产种类 如果药品生产企业生产的药品种类很多,包含口服、注射、呼吸等药物剂型,也包括原料药、辅料等,那建议企业购置NexlON系列 ICP-MS以满足药典要求。 口服每日允许暴 在每日剂量1g/day和稀释倍数 0.5J可以准确回收时,仪器 ICP-OES 元素 露量PDE 为100条件下J值 (ug/L) ppb 方法需要的检出限(ug/L) 检出限 (ug/day) J=PDE*1000/1/100 检出限=0.5J/10 (ug/L) 镉 Cd 5.0 50 2.5 0.1 铅Pb 5.0 50 2.5 1 无机砷As 15 150 7.5 1 无机汞 Hg 15 150 7.5 1 铱Ir 100 1000 50 1 饿Os 100 1000 50 6 钯 Pd 100 1000 50 2 铂 Pt 100 1000 50 1 铑 Rh 100 1000 50 5 钉 Ru 100 1000 50 1 铬 Cr * 0.2 钼Mo 180 1800 90 0.5 镍Ni 600 6000 300 0.5 钒V 120 1200 60 0.5 铜 Cu 1300 13000 650 0.4 USP 232/233对样品的前处理 ·可以溶解于水中的样品,直接水溶处理(例如高盐成份的原料药等) ·可以溶解于有机相中的样品,直接使用有机相溶解(挑选合适的溶剂对原料药或辅料进行溶解) ·鉴于药物类型广泛且基体复杂多变,通常要确保药物样品完全消解,可使用微波消 解,USP<233>针对固体样品给出的首选消解技术是密闭容器微波消解 PerkinElmer Titan 密闭微波消解仪器 PerkinElmer Titan 密闭微波消解仪器优点: 用酸量少:密闭微波消解的优点酸用量少,引入空白少。 避免元素损失:密闭容器还避免了挥发性元素(如Hg)的损失问题。 重复性好:压力反应监控系统可确保得到重复性最好的结果。 操作简便:彩色触屏控制器能够简化编程、数据存储和反应控制的流程。 环境安全:一体化的气体收集系统能够有效保持柱箱内室的通风性, 从而使其免受气体或酸性蒸汽的侵蚀。 prepFAST在线自动稀释系统 特点: 单个多元素标样的自动稀释校正;无缝对接PerkinElmer的ICP-OES 和ICP-MS;在低浓度区域,降低空白改善线性;减少人工劳动和人工误差; 平板等离子体技术 垂直炬管 -更坚实稳定的等离子炬 对任何样品类型都可达到最佳性能一100%的基体耐受力 -最低的氩气消耗-免维护-免冷却 双向观测 -调整方便快速-拆装后可快速方便复位 -最佳的轴向和径向等离子炬观测 -无需工具,易维护 -通过优化径向观测高度可轻松消除易电离元素干扰 -任意波长均可实现一次进样高、低浓度同时测定 等离子炬尾焰切除系统 -无需氩气消除尾焰干扰 免维护设计(没有需要清洗 的锥或提取装置) 彩色等离子炬相机 -简化方法开发 -远程诊断功能实现超长的正常工作时间 -测定过程中实时掌握等离子 炬、中心喷射管和炬管状态 自激式射频等离子体发生器 提供更好的基体耐受性 具有分析最复杂基体或溶剂的样品的能力 创新的无需冷却,无需维护的LumiCoil工作线圈技术 工作线圈 四极杆离子偏转器 (QID) -优化等离子体采样深度和简化有机样品分析 双模同时检测器 最大化仪器运行效率-完全去除未电离成分,免除了全部对于ICP-MS内部碰撞/反应池的清洗和维护需要 更多外围设备,扩大分析性能 从微波消解仪到石墨消解仪,从各类自动进样器到一系列消耗品(包括样品锥、炬管、雾化器和标准溶液),我们提供您全套的外围设备。 去离子水::118MQ.cm或满足ASTM (D1193-91) 标准 高纯度硝酸:推荐 (VWR P/N: CA 87003-226或相当) 高纯度盐酸:推荐 (VWR P/N: CA 87003-216 或相当) 序号 PerkinElmer货号 描述 具体 基质 体积 1. N8145051 NexlON Setup Solution 1 u g/L: Be, Ce, Fe, In, 1%HNO, 500 mL Li, Mg, Pb, U 2. N8145052 NexlON KED Setup Solution 10 ug/L: Co, Ce 1% HCI 250mL 3. N8145059 NexION Dual Detector Solution 200 ug/L each of Al, Sb, As, Ba, Be, Cd, Cr, Co,Cu, Ge, In, Pb, Li,Mg, Mn,Mo, K, Na, Ni, Sc, Rh, Tb, Th, Tl, V, Zn, U 1% HNO, 100 mL 4. N9304150 USP Oral Elemental ImpuritiesA (Big 4) 25 mg/kg Cd, 15 mg/kg Hg,5 mg/kg Pb, 1.5 mg/kg As 5% HNO. 125 mL 5. N9304151 USP Precious Metal ImpuritiesB (with Os) 100 mg/kg Ir, Pd, Pt, Rh,Ru, Os 15% HCI 125 mL 6. N9304152 USP Precious Metals Impurities B 100 mg/kg Ir, Pd, Pt, Rh, Ru 15% HC| 125 mL 7. N9304153 USP Oral /Parenteral Elemental 1000 mg/kg Cu, 500 mg/kg Ni, 100 mg/kg Mo, V 5% HNO. 125mL Impurities C 8. N9304154 USP Parenteral ElementalImpurities D (Big 4) 5 mg/kg Pb, 2.5 mg/kgCd, 1.5 mg/kg As, Hg 5% HNO. 125 mL 9. N8145322 USP Dietary Supplement MetalImpurities 15 mg/kg As, 5 mg/kg Pb, 2.5 mg/kg Cd, 1.5 mg/kg Hg 5% HNO, 125 mL 10. N8145323 USP Inhalation Metal Impurities A 1.5 mg/kg As, Cd, Hg,5 mg/kg Pb, 5% HNO, 125 mL 11. N8145324 USP Inhalation Metal Impurities B 250 mg/kg Mo, 70 mg/kg Cu, 30 mg/kg V, 25 mg/kg Cr, 1.5 mg/kg Ni 5% HNO. 125 mL 12. N9304155 ICH Oral Elemental ImpuritiesA (Big 4) 25 mg/kg Cd, 15 mg/kg Hg,5 mg/kg Pb, 1.5 mg/kg As 5% HNO. 125 mL 想要了解更多USP相关标准溶液和试剂请联系珀金埃尔默当地销售人员。 法规符合性 ■ 21 CFR Part 11 21 CFR Part 11在1997年8月20日颁布实施,适用于FDA监管工作中的电子记录以及在其上的电子签名,基本准则是这些电子记录和电子签名是可信的和可靠的,在这种情况下电子签名等同于手写签名。 为符合21 CFR Part 11的要求,分析仪器软件需要确保系统的安全、确保电子记录的完整性、数据的可追溯性。 PerkinElmer的Enhanced Security software在可配置安装的情况下,会出Select Enhanced Security Features对话框 21 CFR Part 11的要求 PerkinElmer Enhanced Security software 确保系统的安全 选择Rights Checking,权限检查功能。使用者只能根据自己所在的组别执行特定的权限。通过密码保护,账户设置等来限制用户访问 确保电子记录的完整性 选择File Versioning,档案备份功能。关键操作文件的旧的版本会保存到.数据库,这样可以不被新的文件所覆盖 数据的可追溯性 选择Audit Trail,审计追踪功能。使用者绝大多数对于软件的操作行为 都被保存,管理者的操作也会被记录在日志里 Table of Contents PURPOSE/SCOPE. 1.0 .22.0 SUMMARY..... .2 3.0 REFERENCES ....... ........24.0 TERMS AND ACRONYMS.................................................................................................................2 5.0 RESPONSIBILITIES........ ....i .... .3 6.0 GENERAL... 7.0 SUPPLIES.. 48.0 REAGENTS AND STANDARDS .... ...5 9.0 .STANDARD PREPARATION......... ......610.0 SAMPLE ANALYSIS................START SOFTWARE.............................................................................................................................9 CREATE METHOD.......................................................................................................................... SYSTEM CHECK...............................................................................................................................10 PLASMA IGNITION............... .11 DAILY PERFORMANCE OPTIMIZATION AND CHECK.......................... ................. .11 WEEKLY OPTIMIZATION.......... ........ .12 MONTHLY OPTIMIZATION................ .13 BATCH ANALYSIS ................... .........14EXPORT DATA...... ...........1711.0 SYSTEM MAINTENANCE .. .18 TORCH, INJECTOR,AND SPRAY CHAMBER MAINTENANCE.................... m....m...18 INTERFACE CONE MAINTENANCE........... .18NEBULIZER MAINTENANCE....... .19 INSTRUMENT AIR FILTER MAINTENANCE ........ .19 CHILLER/RECIRCULATOR AIR FILTER MAINTENANCE...................... ...........20 12.0TROUBLESHOOTING.... ...........21 POOR PRECISION (HIGH RSDs)................................................................................. .21 PLASMA DOES NOT IGNITE...............................................................................................................22 Low SENSITIVITY.............................................................................................................................22 HIGH OXIDES..... ..........................................................................................23 HIGH BACKGROUND AT MASS 220..... .24 RESULTS TOO HIGH............. +++ .++. ...........24 RESULTS TOO Low.......................... +++...-.24 MEMORYEFFECTS....... .24 CANNOT GET SUGGESTED DETECTION LIMITS.............. .24 AUTOLENS PROFILES ARE SHIFTING........ ....25 .标准操作规程(SOP) 这是PerkinElmer制定的关于NexIONICP-MS在USP 232/233中的标准操作规范 (SOP),主要包括仪器、附件、试剂、样品前处理、样品分析流程、优化检查、系统维护、故障解决等。 系统确认Validation 这是PerkinElmer制定关于系统确认Validation的文件,包含免责声明、药物详细信息、方法验证计划、结果、验证总结报告、附件等。 其中系统确认包含以下五个: 校正:选择0.5J、2.0J保准溶液和空白溶液进行校正 漂移:样品分析前后,测定浓度为2J的标准溶液,两者之间的漂移不得超过20% 重复性:对6个独立制备的样品(加标1J左右)进行测定,标准偏差小于20% 耐用性:对相同的样品,在不同的时间,不同的仪器和不同的操作人员条件下进行分析 准确性:样品前处理前,加标浓度在 (0.5J-1.5J)范围内的3个样品平均值的加标回收率 IQ/OQ认证 因为在制药领域,一致的可重复的药品质量是最重要的,根据FDA和GMP规范药品制造商必须确确生产过程中所有鉴定的方面都是可控的,测量分析设备如ICP-OES和ICP-MS只有成功地通过各种认证步骤后才可以使用. IQ/OQ认证通常由以下方面组成: ·安装确认IQ. ·运行确认OQ. PerkinElmer为您提供相应仪器的IQ/OQ认证服务。 实验操作流程 微波消解参数 步骤 温度(°C) 压力(bar) 升温(min) 保持(min) 功率(%) 1 140 30 5 10 70 2 190 30 5 20 90 3 50 30 1 10 0 O p t i m a 8 3 0 0 仪 器 参 数 测定元素和测定波长 雾化器 玻璃同心雾化器 雾化室 玻璃旋流雾室 样品吸取速率 1.5 mL/min 雾化气流速 0.55 L/min 等离子体流速 10 L/min 辅助气流速 0.2 L/min 射频功率 1500 W 等离子体观测模式 轴向 Rh 343.489 Ru 240.272 Mo 202.031 Ni 221.648 V 290.880 结果和讨论 Cu 327.393 J直 元素 抗过敏药(ug/L) Cadmium 170 Lead 170 Arsenic 500 Mercury 500 Iridium 3300 Palladium 3300 Platinum 3300 Rhodium 3300 Ruthenium 3300 Molybdenum 6000 Nickel 20000 Vanadium 4000 CopPerkinElmerr 43000 系统适用性检查 校正曲线由空白,0.5J,2J组成,线性回归系数≥0.999. 2J标准溶液在批次前后测量,两者之间的漂移远小于20%,符合要求。 ■ PerkinElmer Optima 8300 ICP-OES分析抗过敏药中的杂质元素 因为口服抗过敏药的剂量很小,通常最大的剂量为1-2片/天,单片重量在0.1-0.3g左右,可以通过ICP-OES来进行检测。 前处理方法:取0.3g左右的抗过敏药,放入消解罐,加入5mL浓硝酸和2mL 30%H,O,以及实验要求的标样,消解罐无盖在通风橱预消解10分钟,而后放入Titan密闭微波消解仪器按照程序消解。消解完成后,用去离子水定容至30mL.内标在消解完成后加入。 元素 Tablet 1 Tablet 2 Tablet 3 Tablet 4 Tablet 5 Tablet 6 %RSD (ug/L) (pg/L) (ug/L) (ug/L) (ug/L) (ug/L) Cd 171 172 170 170 168 172 0.9 Pb 167 165 168 169 164 168 1.2 As 497 508 501 496 490 502 1.3 Hg 498 508 500 498 494 507 1.1 Ir 3390 3390 3420 3380 3360 3430 0.7 Pd 3510 3470 3430 3420 3390 3500 1.4 Pt 3310 3300 3260 3260 3240 3300 0.9 Rh 3230 3230 3200 3170 3160 3240 1.0 Ru 3300 3290 3270 3260 3230 3310 0.9 Mo 6330 6340 6290 6270 6200 6330 0.8 Ni 20000 20100 20200 20000 19900 20300 0.7 4030 4040 4070 4020 4000 4070 0.7 Cu 44900 45100 44800 44500 44000 45000 0.9 耐用性:对相同的样品,在不同的时间,不同的仪器和不同的操作人员条件下进行分析。 准确性:准确的加标回收率,所有的都在70%-150%之间符合要求。 元素 抗过敏药 % RSD 超过三天 1.5J Cd 0.4 92.3 Pb 0.2 97.6 As 1. 1 95.5 Hg 0.8 97.8 Ir 0.8 95.8 Pd 1.2 98.0 Pt 0.5 99.2 Rh 3.7 98.0 Ru 0.8 108 Mo 0.2 96.3 Ni 0.5 94.0 0.4 94.8 0.9 95.0 结论 备注 ( 该应用案例参考的是2013年12月27日版本的 USP 232/233. ) 应用PerkinElmer Optima 8300 ICP-OES来分析低稀释倍数和低剂量的药品,可以满足USP 232/233法规的要求。 ■J用NexlON 350X联合在线自动稀释系统检测药物中的元素杂质 以口服关节炎药片和口服流感药粉末为例,介绍NexlON 350X联合prepFAST在线自动稀释系统在检测中的应用。 实验操作流程 样品前处理:取1g左右关节炎药片,碾成粉末,在Titan MPS Microwave 密闭微波消解系统中进行消解,消解完毕定容到50mL。取1g流感药粉,加入强酸在密闭微波消解系统中进行消解,最后定容到50mL。定容所用溶液均为2%硝酸/0.5%盐酸。这两种定容完的样品溶液经prepFAST在线自动稀释系统进行10倍的稀释,这样这两种药物的中最稀释倍数为500。这里需要强调一下,因为不同药物的口服剂量存在差别,因此J值也会发生变化,相应的也需要去做额外的样品稀释和做新的校准曲线。prepFAST在线自动稀释系统最大的好处是它能够全自动化 仪器参数 指标 参数 雾化器 同心雾化器 雾化室 气旋雾室 等离子体气体流量 16.0 L/min 辅助气流量 1.1 L/min 雾化器气体流量 0.99 L/min 进样速率 400 uL/min 射频功率 1600 W 分析(碰撞模式 He) 51V,52Cr, 60Ni, 63Cu, 75As, 95Mo, 101Ru, 103Rh, 105Pd, 114Cd, 1890s, 193lr, 195Pt 内标 69Ga, 74Ge 115In, 159Tb 完成稀释,不再需要人工稀释。 结果和讨论 J值 元素 每日允许暴露量 J J/2 2J 相关系数 (ug/day) (ug/L) (ug/L) (ug/L) 剂量为10g/day,稀释倍数为500倍 Cd114 25 5 2.5 10 0.999886 Pb 208 5 1 0.5 2 0.999927 As 75 1.5 0.3 0.15 0.6 0.999854 Hg 202 15 3 1.5 6 0.999967 lr 193 100 20 10 40 0.999980 Os 189 100 20 10 40 0.999977 Pt 195 100 20 10 40 0.999703 Pd 105 100 20 10 40 0.999949 Rh 103 100 20 10 40 0.999914 Ru 101 100 20 10 40 0.999919 Mo 95 100 20 10 40 1.000000 Ni60 500 100 50 200 0.999932 V 51 100 20 10 40 0.999898 Cu 63 1000 200 100 400 1.000000 a Pb标准曲线, PDE 为 5 pg/day -4 02 400 所有元素标准曲线的相关系数均大于0.999, Pb、Ir、Cu三个元素分别代表低中高的PDE值。2J标准溶液在批次前后测量,两者之间的漂移远小于20%,符合要求。 检测结果 元素 最大剂量为 药物杂质金属检测情况 方法检出限 10g/day的药物 MDL(ug/g) 杂质金属限制 关节炎药片杂质 加标为0.8J 流感药中杂质 加标为0.8J 基于500稀 浓度( ug/g) 金属含量(ug/g) 回收率 金属含量(ug/g) 回收率 释倍数 镉Cd 2.5
确定












还剩18页未读,是否继续阅读?
珀金埃尔默企业管理(上海)有限公司为您提供《药物中杂质元素检测方案(气相色谱仪)》,该方案主要用于原料药中含量测定检测,参考标准--,《药物中杂质元素检测方案(气相色谱仪)》用到的仪器有气相色谱系统PerkinElmer Clarus 590/690 、珀金埃尔默 NexION 5000 多重四极杆ICP-MS、珀金埃尔默电感耦合等离子体发射光谱仪 Avio 200 ICP、珀金埃尔默Spectrum 3™傅立叶变换红外光谱仪、珀金埃尔默原子吸收光谱仪PerkinElmer PinAAcle 900
相关方案
更多
该厂商其他方案
更多































