方案详情
文
单克隆抗体 (mAb) 型药物代表了发展迅速的一类生物药物,对这类药物需要进行深入表征,以便获得临床试验和后续上市的批准。鉴于单克隆抗体具有分子量大及存在翻译后修饰(糖基化)的特征,精确质量数测定是单克隆抗体分析表征中最具挑战性的步骤。这些特性也使得修饰位置的测定更加复杂。
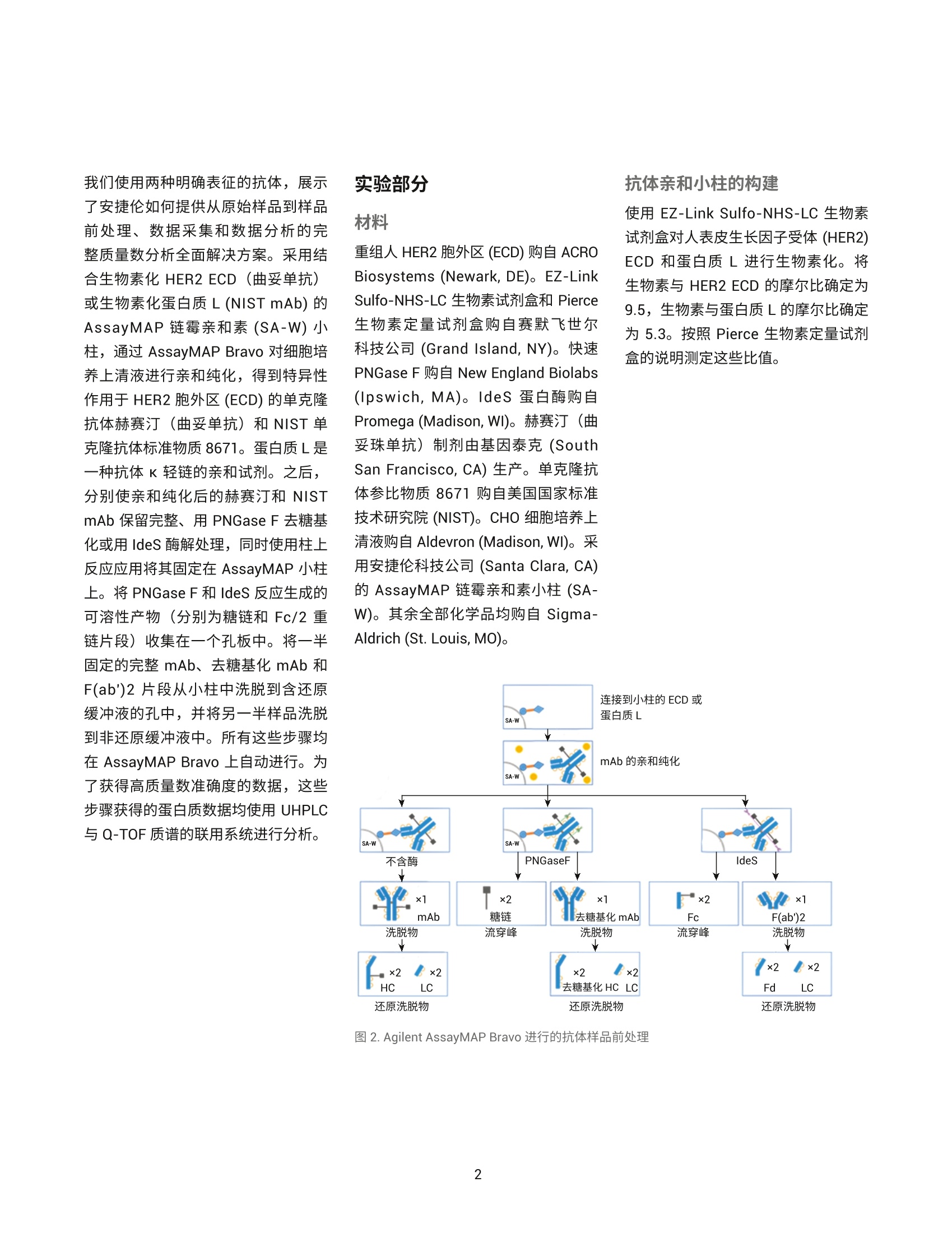
?为了应对抗体质量数测定相关的挑战,人们使用了大量补充方法。可以用 PNGase F 处理抗体去除 N-糖链,后用 IdeS 等蛋白酶酶解获得抗体片段,也可还原单克隆抗体,以生成轻链和重链,随后进行质量数测定。这些技术可以各种组合加以应用。样品前处理可能费时费力,而且重现性不佳。本应用简报展示了如何使用 Agilent AssayMAP Bravo 的自动化功能简化这些方法,减少引入人为误差的可能性,提高重现性,并实现更长的无人值守时间。
方案详情

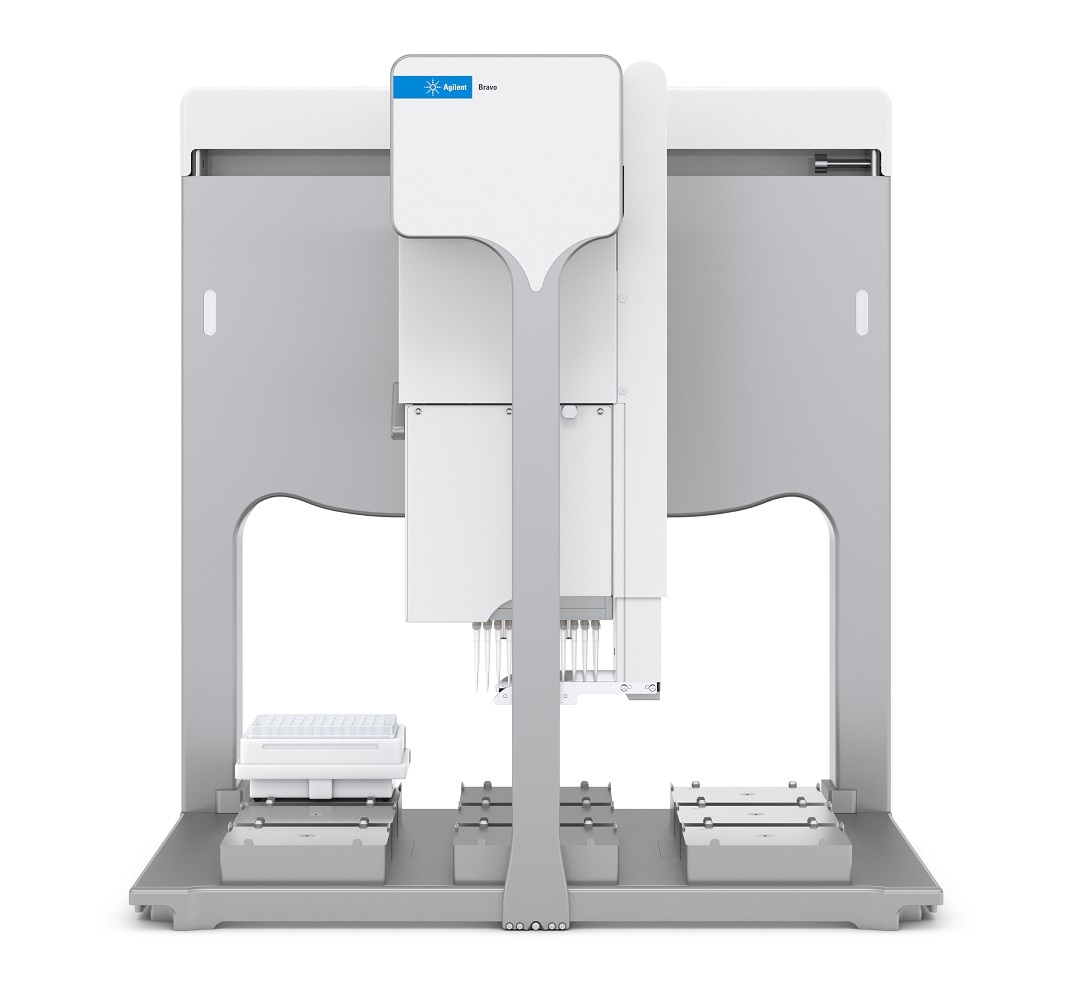
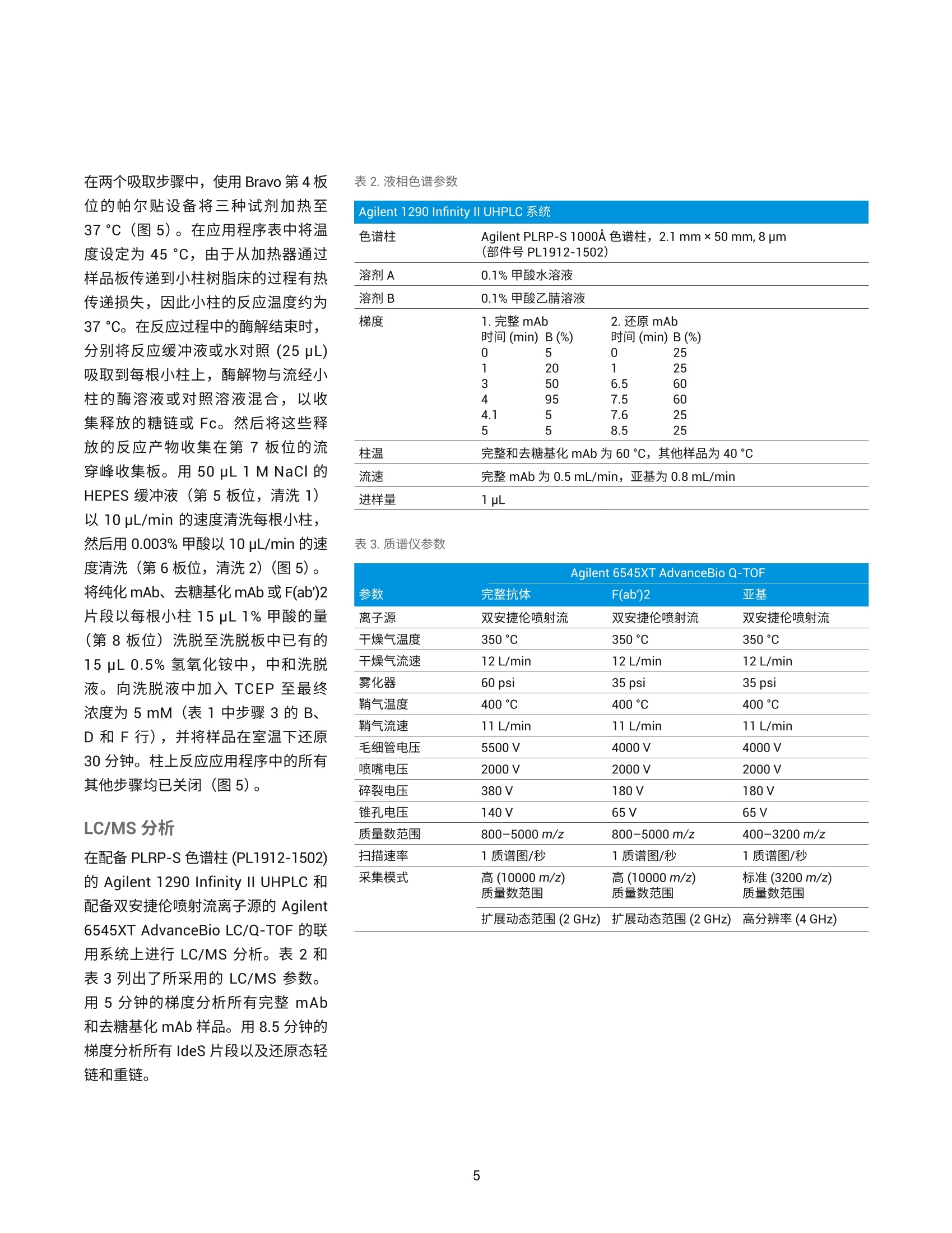
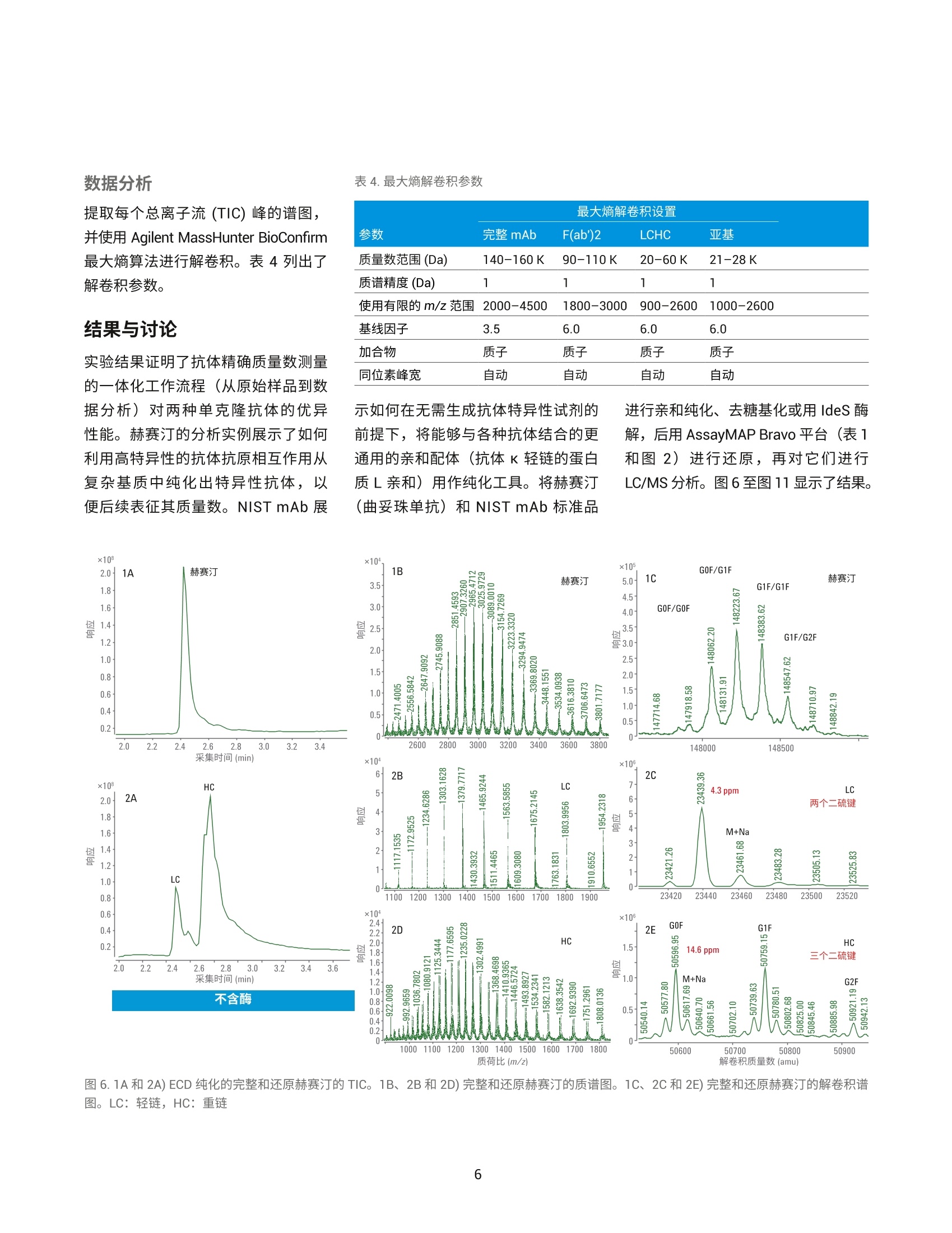
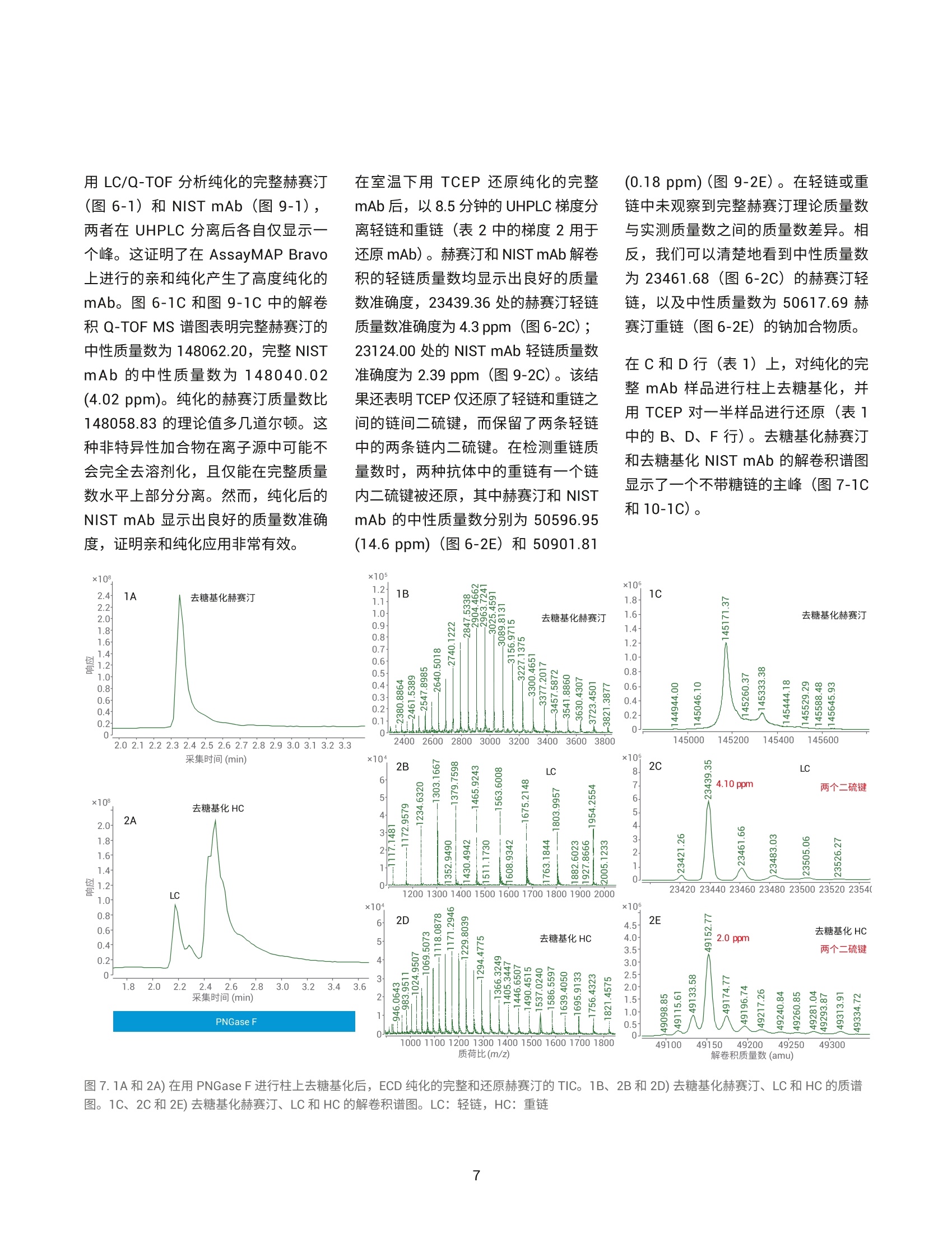
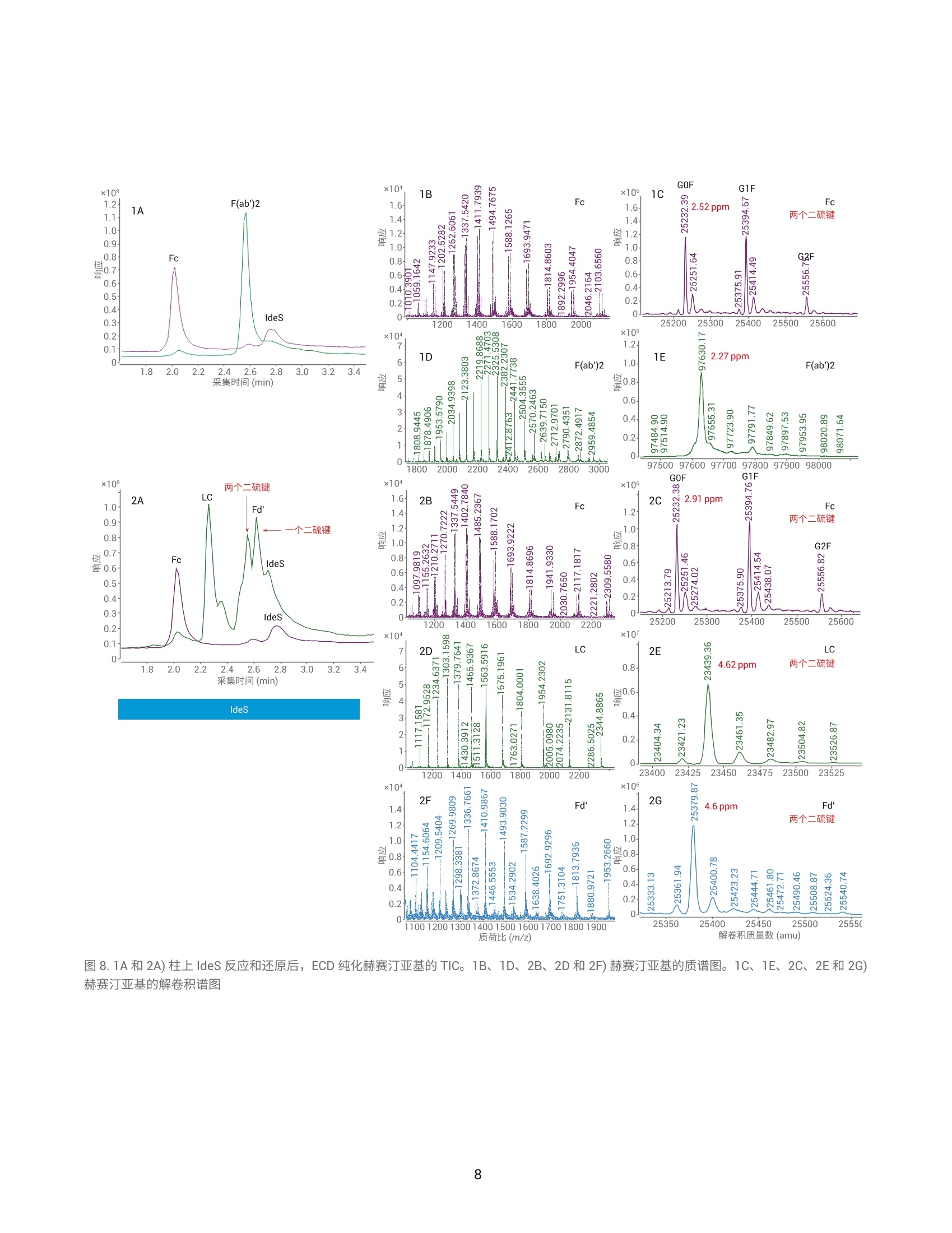
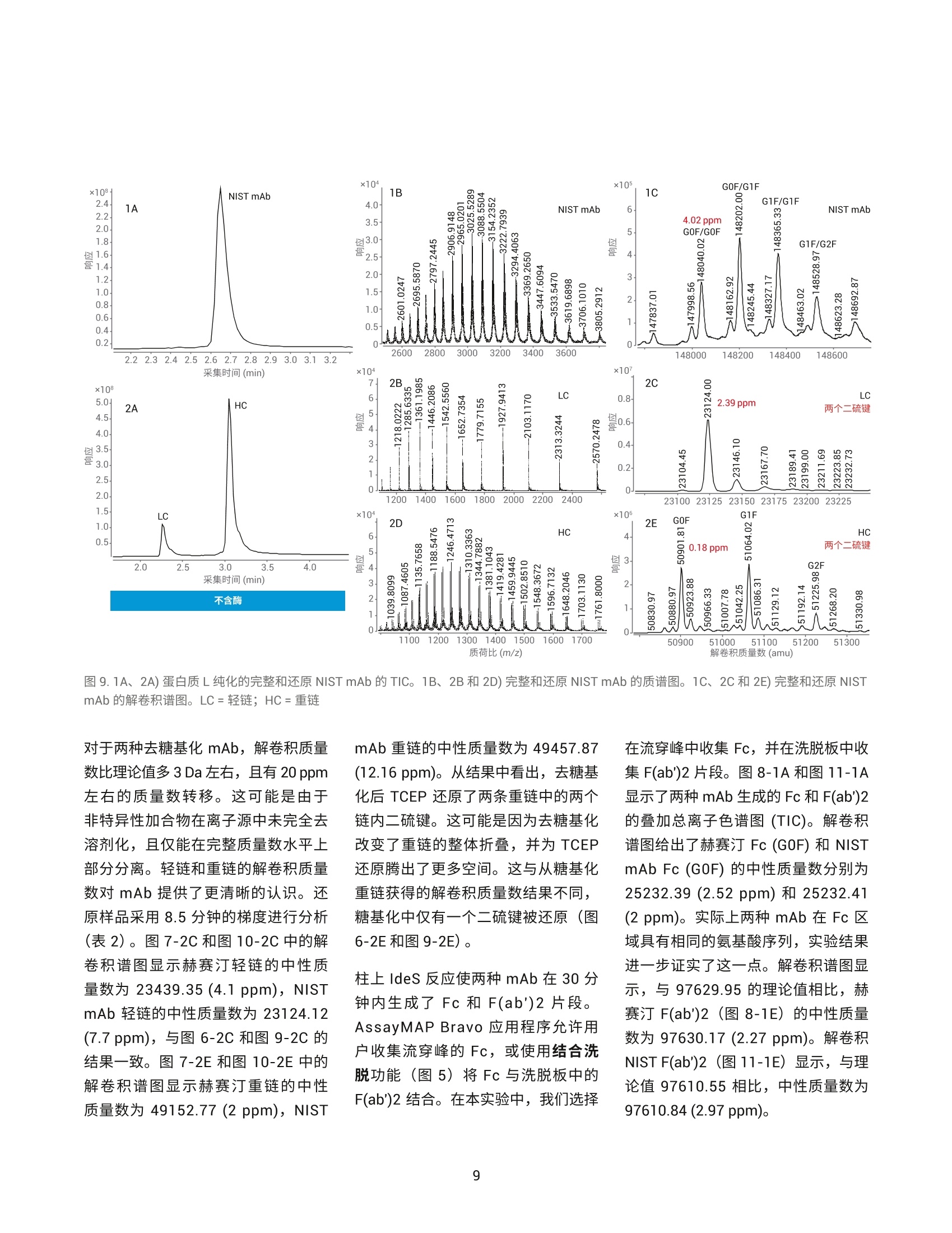
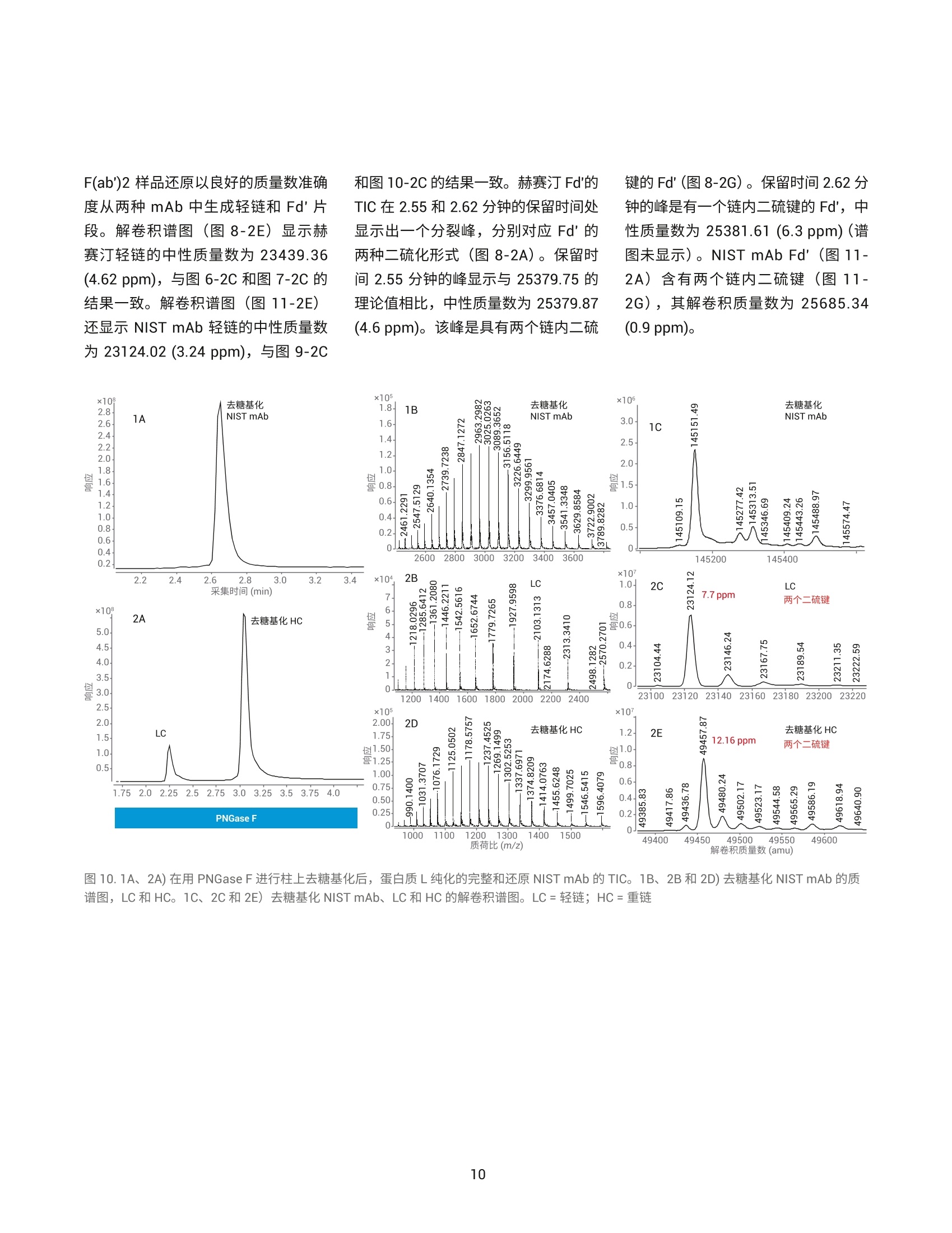
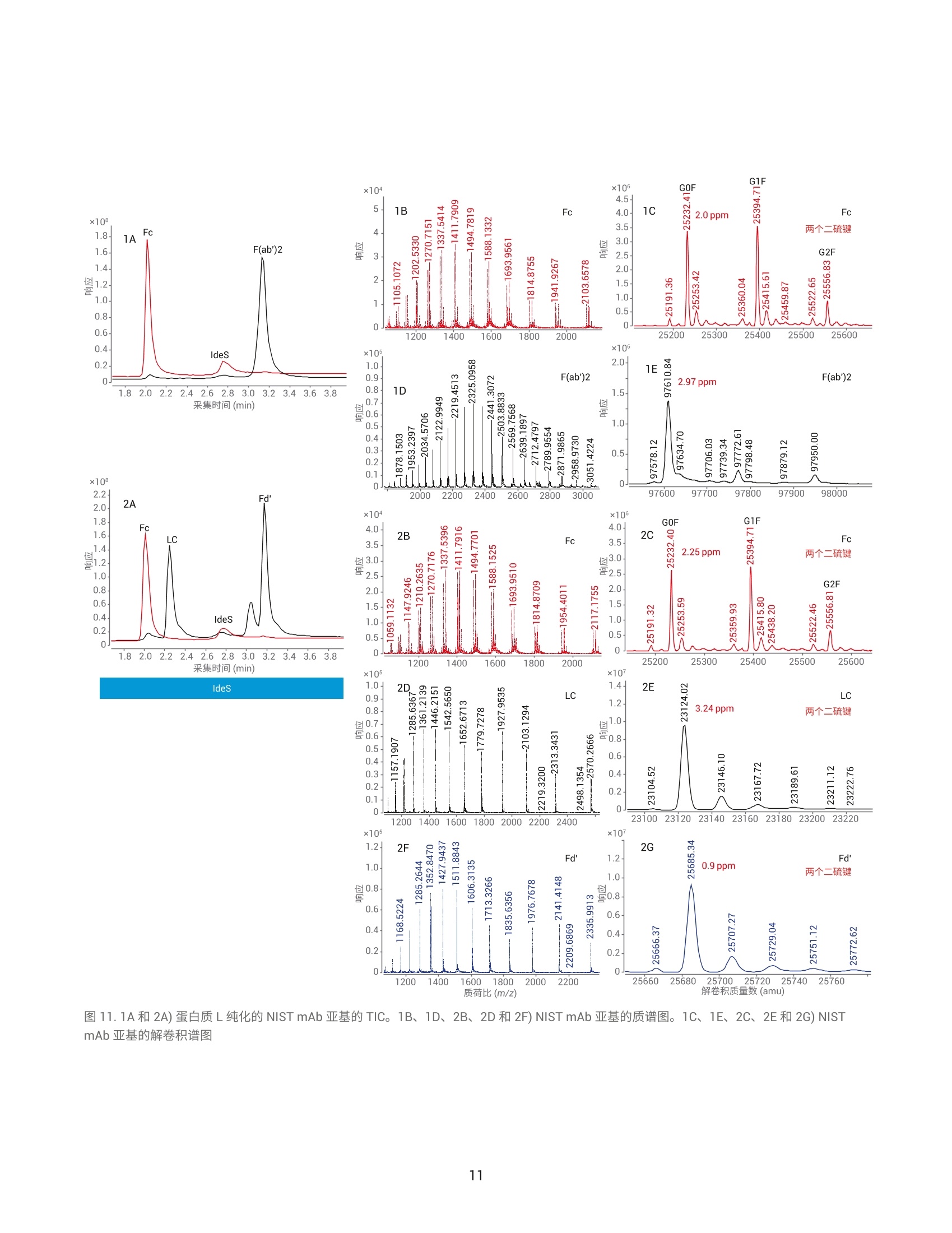
作者 Shuai Wu 和 Maryann Shen 安捷伦科技有限公司 Santa Clara, CA, USA Steve Murphy 和 Zach Van Den Heuvel 安捷伦科技有限公司 Madison, WI, USA 用于单克隆抗体完整结构或亚基精确质量数测定的一体化工作流程 应用简报 生物治疗药物和生物仿制药 前言 单克隆抗体 (mAb) 型药物代表了发展迅速的一类生物药物,对这类药物需要进行深入表征,以便获得临床试验和后续上市的批准。鉴于单克隆抗体具有分子量大及存在翻译后修饰布(糖基化)的特征,精确质量数测定是单克隆抗体分析表征中最具挑战性的步骤。这些特性也使得修饰位置的测定更加复杂。 为了应对抗体质量数测定相关的挑战,人们使用了大量补充方法。可以用PNGase F 处理抗体去除N-糖链,后用 IdeS 等蛋白酶酶解获得抗体片段,也可还原单克隆抗体,以生成轻链和重链,随后进行质量数测定。这些技术可以各种组合加以应用。样品前处理可能费时费力,而且重现性不佳。本应用简报展示了如何使用 Agilent AssayMAP Bravo 的自动化功能简化这些方法,减少引入人为误差的可能性,提高重现性,并实现更长的无人值守时间(图1和图2)。 图1.使用 Agilent AssayMAP Bravo 进行自动化抗体表征的一体化工作流程 我们使用两种明确表征的抗体,展示了安捷伦如何提供从原始样品到样品前处理、数据采集和数据分析的完整质量数分析全面解决方案。采用结合生物素化 HER2 ECD (曲妥单抗)或生物素化蛋白质 L (NIST mAb) 的AssayMAP 链霉亲和素(SA-W) 小柱, 通过 AssayMAP Bravo 对细胞培养上清液进行亲和纯化,得到特异性作用于 HER2 胞外区 (ECD)的单克隆抗体赫赛汀(曲妥单抗)和NIST单克隆抗体标准物质8671。蛋白质L是一种抗体K 轻链的亲和试剂。之后,分别使亲和纯化后的赫赛汀和 NISTmAb 保留完整、用 PNGase F 去糖基化或用 IdeS 酶解处理,同时使用柱上反应应用将其固定在 AssayMAP小柱上。将 PNGase F 和 IdeS 反应生成的可溶性产物(分别为糖链和 Fc/2 重链片段)收集在一个孔板中。将一半固定的完整 mAb、去糖基化 mAb 和F(ab')2片段从小柱中洗脱到含还原缓冲液的孔中,并将另一半样品洗脱到非还原缓冲液中。所有这些步骤均在 AssayMAP Bravo 上自动进行。为了获得高质量数准确度的数据,这些步骤获得的蛋白质数据均使用 UHPLC与 Q-TOF 质谱的联用系统进行分析。 抗体亲和小柱的构建 使用 EZ-Link Sulfo-NHS-LC 生物素试剂盒对人表皮生长因子受体(HER2)ECD 和蛋白质L进行生物素化。将生物素与 HER2 ECD 的摩尔比确定为9.5,生物素与蛋白质L 的摩尔比确定为5.3。按照 Pierce 生物素定量试剂盒的说明测定这些比值。 图 2. Agilent AssayMAP Bravo 进行的抗体样品前处理 利用 AssayMAP Bravo 中的固定化应用程序(图3), 使用 AssayMAPBravo 将 2 pg 生物素化的 HER2 ECD(表1中的色谱柱1和2)以及2pg生物素化蛋白质L(表1中的色谱柱3和4)固定在每根链霉亲和素 (SA-W)小柱上。根据经验确定以缓慢流速有效结合目标分子所需的生物素化配体的最小质量数,并将生物素化捕获配体与目标分子的摩尔比视为5:1左右。简而言之,用1%甲酸对 SA-W小柱进行灌注和平衡(第3板位,图3),然后采用内部小柱清洗1步骤,用50 pL HEPES 缓冲液(10mMHEPES, 150 mM NaCl, pH 7.4, 第5板位,清洗1)清洗。使用1%甲酸进行灌注和平衡可排出小柱内夹带的空气,同时还能严格地清洗小柱,去除其中的链霉亲和素单体,避免它们在低pH条件下从固相载体上解离。用 HEPES 缓冲液重新平衡。这一步骤使缓冲液流到小柱树脂床上,为小柱与 HEPES 缓冲液中的生物素化抗原结合做准备。接下来,用阻断剂上样步骤,在100 uL HEPES缓冲液(第9板位)中,以 5 pL/min 的流速在 SA-W 小柱中上样2pL生物素化的HER2 ECD 或蛋白质L。构建亲和小柱的最后一步是采用内部小柱清洗2,使用 50 pL HEPES 缓冲液清洗一次。固定化应用中的其他步骤均选择关闭并自动跳过。图3显示了用于执行此运行过程的固定化应用程序设置屏幕截图。 表1.实验设计与洗脱板中的最终样品 ECD-生物素(2pg/100pL) 色谱柱1和2 色谱柱3和4 A 完整赫赛汀,含糖链 完整NIST mAb含糖链 B 赫赛汀 LC/HC, 含糖链 NISTmAbLC/HC, 含糖链 C 赫赛汀,不含糖链 NIST mAb,不含糖链 D 赫赛汀 LC/HC NISTmAbLC/HC E 赫赛汀 F(ab')2 NIST F(ab')2 F 赫塞汀 Fd', LC NIST Fd', LC G H Immobilization: Using AssayMAP 图 3. Agilent AssayMAP Bravo 的用户界面,显示 AssayMAP Bravo 上用于构建抗体亲和小柱的固定化应用设置截图 抗体纯化 将商购的赫赛汀(曲妥珠单抗)和NISTmAb在去离子水中复溶为20 mg/mL, 等分,并在-80℃下储存。使用前将赫赛汀和 NIST mAb 用水稀释至1 pg/pL。然后将两种 mAb 加入 CHO细胞上清液,至2 pg/100 pL的浓度。AssayMAP Bravo 中的亲和纯化应用程序可用于从细胞培养物上清液中纯化抗体(图4)。将灌注和平衡步骤关闭,因为这些步骤都是在固定化操作期间完成的。然后,将100pL加入赫赛汀mAb 或 NIST mAb的 CHO细胞上清液分别以3 pL/min上样到每个 HER2 ECD 和蛋白质L亲和小柱上,之后用150 pL HEPES 缓冲液以 10 pL/min 的流速清洗(内部小柱清洗1)。表1(步骤1)显示了如何将小柱应用于不同的样品。A到F的色谱柱1和2(12根小柱)上样生物素化 HER2 ECD。A到F的色谱柱3和4(12根小柱)上样生物素化蛋白质L。 柱上去糖基化和IdeS 酶解 捕获赫赛汀和 NIST mAb 后, 用 50pL水对照或酶缓冲液以 10 pL/min 的流速平衡小柱,为柱上反应做好准备(图5)。表1(步骤2)表明: A行和B行的小柱用水平衡 C行和D行中的小柱用去糖基化缓冲液 (20mM Tris, pH 8.0)平衡 E行和F行中的小柱用 IdeS 蛋白质水解缓冲液 (50 mM Tris,150 mM NaCl, pH 6.6) 平衡 柱上反应(图5)以10 pL/min的速度将4pL 加热的水、快速 PNGase F(1:12) 或 IdeS 酶(4U/pL)吸取到小柱上(图5)。然后再将2pL加热的酶 图4. Agilent AssayMAP Bravo 上用于从细胞培养上清液中纯化抗体的亲和纯化应用设置截图 溶液或水(每种酶使用的总体积均为6pL)在30分钟内吸取到小柱上。 图5.用于 mAb 的去糖基化 (PNGase F) 和蛋白水解 (ldeS) 的柱上反应应用程序设置截图 在两个吸取步骤中, 使用 Bravo 第4板位的帕尔贴设备将三种试剂加热至37℃(图5)。在应用程序表中将温度设定为45°℃,由于从加热器通过样品板传递到小柱树脂床的过程有热传递损失,因此小柱的反应温度约为37℃。在反应过程中的酶解结束时,分别将反应缓冲液或水对照(25pL)吸取到每根小柱上,酶解物与流经小柱的酶溶液或对照溶液混合,以收集释放的糖链或Fc。然后将这些释放的反应产物收集在第7板位的流穿峰收集板。用50pL 1 M NaCl的HEPES缓冲液(第5板位,清洗1)以10 pL/min 的速度清洗每根小柱,然后用0.003%甲酸以 10 pL/min 的速度清洗(第6板位,清洗2)(图5).将纯化mAb、去糖基化mAb或 F(ab')2片段以每根小柱15 pL 1%甲酸的量(第8板位)洗脱至洗脱板中已有的15 pL 0.5%氢氧化铵中,中和洗脱液。向洗脱液中加入 TCEP 至最终浓度为5mM(表1中步骤3的B、D和F行),并将样品在室温下还原30分钟。柱上反应应用程序中的所有其他步骤均已关闭(图5)。 LC/MS分析 在配备 PLRP-S 色谱柱 (PL1912-1502)的 Agilent 1290 Infinity II UHPLC 和配备双安捷伦喷射流离子源的 Agilent6545XT AdvanceBio LC/Q-TOF 的联用系统上进行 LC/MS分析。表2和表3列出了所采用的 LC/MS 参数。用5分钟的梯度分析所有完整 mAb和去糖基化mAb 样品。用8.5分钟的梯度分析所有 IdeS 片段以及还原态轻链和重链。 表2.液相色谱参数 色谱柱 Agilent PLRP-S 1000A 色谱柱, 2.1 mm x50 mm, 8 pm (部件号PL1912-1502) 溶剂 A 0.1%甲酸水溶液 溶剂B 0.1%甲酸乙腈溶液 梯度 1.完整 mAb 2.还原mAb 时间 (min) B(%) 时间(min) B (%) 0 5 0 25 1 20 1 25 3 50 6.5 60 4 95 7.5 60 4.1 5 7.6 25 5 5 8.5 25 柱温 完整和去糖基化 mAb为60C, 其他样品为40℃ 流速 完整 mAb 为 0.5 mL/min,亚基为 0.8 mL/min 进样量 1pL 表3.质谱仪参数 Agilent 6545XT AdvanceBio Q-TOF 参数 完整抗体 F(ab')2 亚基 离子源 双安捷伦喷射流 双安捷伦喷射流 双安捷伦喷射流 干燥气温度 350°C 350°℃ 350°C 干燥气流速 12 L/min 12L/min 12 L/min 雾化器 60 psi 35 psi 35 psi 鞘气温度 400°C 400°C 400°C 鞘气流速 11 L/min 11 L/min 11 L/min 毛细管电压 5500V 4000 V 4000V 喷嘴电压 2000 V 2000 V 2000 V 碎裂电压 380 V 180V 180V 锥孔电压 140 V 65V 65V 质量数范围 800-5000 m/z 800-5000 m/z 400-3200 m/z 扫描速率 1质谱图/秒 1质谱图/秒 1 质谱图/秒 采集模式 高(10000m/z) 高(10000m/z) 标准(3200m/z) 质量数范围 质量数范围 质量数范围 提取每个总离子流(TIC)峰的谱图,并使用 Agilent MassHunter BioConfirm最大熵算法进行解卷积。表4列出了解卷积参数。 结果与讨论 实验结果证明了抗体精确质量数测量的一体化工作流程(从原始样品到数据分析)对两种单克隆抗体的优异性能。赫赛汀的分析实例展示了如何利用高特异性的抗体抗原相互作用从复杂基质中纯化出特异性抗体,以便后续表征其质量数。NIST mAb 展 最大熵解卷积设置 参数 完整mAb F(ab')2 LCHC 亚基 质量数范围(Da) 140-160K 90-110K 20-60K 21-28K 质谱精度 (Da) 1 1 1 1 使用有限的m/z范围 2000-4500 1800-3000 900-2600 1000-2600 基线因子 3.5 6.0 6.0 6.0 加合物 质子 质子 质子 质子 同位素峰宽 自动 自动 自动 自动 示如何在无需生成抗体特异性试剂的前提下,将能够与各种抗体结合的更通用的亲和配体(抗体K轻链的蛋白质L亲和)用作纯化工具。将赫赛汀(曲妥珠单抗)和NIST mAb 标准品 进行亲和纯化、去糖基化或用 IdeS酶解,后用 AssayMAP Bravo 平台(表1和图2)进行还原,再对它们进行LC/MS分析。图6至图11显示了结果。 质荷比(m/z) 图 6.1A和 2A) ECD 纯化的完整和还原赫赛汀的 TIC。1B、2B和2D)完整和还原赫赛汀的质谱图。1C、2C和2E)完整和还原赫赛汀的解卷积谱图。LC:轻链, HC:重链 用 LC/Q-TOF分析纯化的完整赫赛汀(图6-1)和 NIST mAb (图9-1),两者在 UHPLC 分离后各自仅显示一个峰。这证明了在 AssayMAP Bravo上进行的亲和纯化产生了高度纯化的mAb。图6-1C和图9-1C中的解卷积 Q-TOF MS 谱图表明完整赫赛汀的中性质量数为148062.20, 完整 NISTmAb 的中性质量数为148040.02(4.02 ppm)。纯化的赫赛汀质量数比148058.83的理论值多几道尔顿。这种非特异性加合物在离子源中可能不会完全去溶剂化,且仅能在完整质量数水平上部分分离。然而,纯化后的NIST mAb 显示出良好的质量数准确度,证明亲和纯化应用非常有效。 在室温下用 TCEP 还原纯化的完整mAb 后,以8.5分钟的UHPLC 梯度分离轻链和重链(表2中的梯度2用于还原mAb)。赫赛汀和NIST mAb 解卷积的轻链质量数均显示出良好的质量数准确度,23439.36处的赫赛汀轻链质量数准确度为 4.3 ppm(图6-2C);23124.00处的 NIST mAb 轻链质量数准确度为 2.39 ppm (图9-2C)。该结果还表明 TCEP 仅还原了轻链和重链之间的链间二硫键,而保留了两条轻链中的两条链内二硫键。在检测重链质量数时,两种抗体中的重链有一个链内二硫键被还原,其中赫赛汀和 NISTmAb 的中性质量数分别为50596.95(14.6 ppm) (图6-2E)和50901.81 (0.18ppm)(图9-2E)。在轻链或重链中未观察到完整赫赛汀理论质量数与实测质量数之间的质量数差异。相反,我们可以清楚地看到中性质量数为23461.68(图6-2C)的赫赛汀轻链,以及中性质量数为50617.69赫赛汀重链(图6-2E)的钠加合物质。 在C和D行(表1)上,对纯化的完整mAb 样品进行柱上去糖基化,并用 TCEP 对一半样品进行还原(表1中的B、D、F行)。去糖基化赫赛汀和去糖基化 NIST mAb 的解卷积普图显示了一个不带糖链的主峰(图7-1C和10-1C)。 图7.1A和 2A)在用 PNGase F 进行柱上去糖基化后,ECD 纯化的完整和还原赫赛汀的 TIC。1B、2B和2D)去糖基化赫赛汀、LC 和 HC的质谱图。1C、2C和2E)去糖基化赫赛汀、LC和 HC的解卷积谱图。LC:轻链, HC:重链 图9.1A、2A)蛋白质L纯化的完整和还原 NIST mAb 的 TIC。 1B、2B和2D)完整和还原 NIST mAb 的质谱图。1C、2C和2E)完整和还原 NISTmAb 的解卷积谱图。LC=轻链; HC=重链 对于两种去糖基化 mAb, 解卷积质量数比理论值多3 Da 左右, 且有 20 ppm左右的质量数转移。这可能是由于非特异性加合物在离子源中未完全去溶剂化,且仅能在完整质量数水平上部分分离。轻链和重链的解卷积质量数对mAb 提供了更清晰的认识。还原样品采用8.5分钟的梯度进行分析(表2)。图7-2C和图10-2C中的解卷积谱图显示赫赛汀轻链的中性质量数为23439.35(4.1 ppm), NISTmAb 轻链的中性质量数为23124.12(7.7 ppm), 与图6-2C 和图 9-2C勺结果一致。图7-2E和图10-2E中的解卷积谱图显示赫赛汀重链的中性质量数为 49152.77 (2 ppm), NIST mAb 重链的中性质量数为49457.87(12.16 ppm)。从结果中看出,去糖基化后 TCEP 还原了两条重链中的两个链内二硫键。这可能是因为去糖基化改变了重链的整体折叠,并为 TCEP还原腾出了更多空间。这与从糖基化重链获得的解卷积质量数结果不同,糖基化中仅有一个二硫键被还原(图6-2E和图9-2E)。 柱上IdeS 反应使两种 mAb在30分钟内生成了 Fc 和 F(ab')2片段。AssayMAP Bravo 应用程序允许用户收集流穿峰的Fc,或使用结合洗脱功能(图5)将 Fc与洗脱板中的F(ab')2 结合。在本实验中,我们选择 在流穿峰中收集 Fc, 并在洗脱板中收集F(ab')2片段。图8-1A和图11-1A显示了两种 mAb 生成的 Fc 和F(ab')2的叠加总离子色谱图(TIC)。解卷积谱图给出了赫赛汀 Fc (GOF) 和 NISTmAb Fc (GOF) 的中性质量数分别为25232.39(2.52 ppm) 和25232.41(2 ppm)。实际上两种 mAb 在 Fc 区域具有相同的氨基酸序列,实验结果进一步证实了这一点。解卷积谱图显示,与97629.95的理论值相比,赫赛汀F(ab')2 (图8-1E)的中性质量数为97630.17(2.27 ppm)。解卷积NIST F(ab')2(图11-1E)显示,与理论值97610.55相比,中性质量数为97610.84(2.97 ppm)。 键的Fd'(图8-2G)。保留时间2.62分钟的峰是有一个链内二硫键的Fd',中性质量数为25381.61 (6.3ppm)(谱图未显示)。 NIST mAb Fd'(图11-2A)含有两个链内二硫键(图11-2G),其解卷积质量数为25685.34(0.9 ppm)。 和图10-2C的结果一致。赫赛汀 Fd'的TIC在2.55和2.62分钟的保留时间处显示出一个分裂峰,分别对应 Fd' 的两种二硫化形式(图8-2A)。保留时间2.55分钟的峰显示与25379.75的理论值相比,中性质量数为25379.87(4.6 ppm)。该峰是具有两个链内二硫 F(ab')2 样品还原以良好的质量数准确度从两种 mAb 中生成轻链和Fd'片段。解卷积谱图(图8-2E)显示赫赛汀轻链的中性质量数为23439.36(4.62 ppm), 与图6-2C和图7-2C的结果一致。解卷积谱图(图11-2E)还显示 NIST mAb 轻链的中性质量数为23124.02 (3.24 ppm), 与图 9-2C 图10.1A、2A)在用 PNGase F 进行柱上去糖基化后,蛋白质L纯化的完整和还原 NIST mAb 的 TIC。 1B、2B和2D)去糖基化 NIST mAb 的质谱图, LC和 HC。 1C、2C和2E)去糖基化NIST mAb、LC和 HC的解卷积谱图。LC=轻链; HC=重链 图11.1A和2A)蛋白质L纯化的 NIST mAb 亚基的TIC。1B、1D、2B、2D和2F)NIST mAb 亚基的质谱图。1C、1E、2C、2E和 2G) NISTmAb亚基的解卷积谱图 结论 Agilent AssayMAP Bravo 平台是单克隆抗体表征一体化流程(包括全面的完整 mAb 质量数测量)的关键要素。它能够自动进行样品前处理,可减少人为误差,确保重现性,并允许分析人员离开执行其他任务(图1和图2)。目前的研究采用 AssayMAPBravo, 需要 5.5小时的总时间完成四个小柱的样品前处理。而同样数量的样品采用手动前处理需要花费至少1天的时间。如果需要对全部12根小柱进行样品前处理(整个板), AssayMAP Bravo 所需的处理时间仍保持在5-6小时左右。然而,对整个板进行手动样品前处理,则需要超过1天的不间断工作时间。AssayMAP Bravo 提供了一个简便易用的平台,可以实现整个工作流程的自动化,并缩短获得结果的时间。AssayMAP Bravo 经专门设计,能够使用微量色谱柱进行蛋白质和多肽样品的前处理,具有简单可靠的自动化流程和基于应用的用户界面。安捷伦将 AssayMAP Bravo 上的自动亲和纯 查找当地的安捷伦客户中心:www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn 化和酶解与超高效液相色谱、AgilentAdvanceBio Q-TOF 和简单易用的Agilent MassHunter BioConfirm 软件集成,为抗体表征提供完整的解决方案。 这一工作流程功能多样,能够实现完整抗体和亚基蛋白质的质量数分析。为了满足综合表征研究的需要,这一流程还能灵活执行柱上去糖基化,用IdeS 蛋白酶进行蛋白水解,或还原释放亚基,甚至能够将三个步骤结合。ECD 和蛋白质L均可从 CHO 细胞培养上清液中纯化出高纯度 mAb, 这种一体化方法还可进行高通量分析,用于抗体前处理的批次间比较。出色的色谱分离度能够快速有效地分离完整抗体及其轻链和重链亚基,还包括不同的二硫化形式。 AgilentAdvanceBio Q-TOF 可生成高分辨率谱图,以实现高质量数准确度的蛋白质质量数分析。MassHunterBioConfirm 数据分析软件支持完整的蛋白质分析工作流程,包括自动化数据提取、解卷积和序列匹配。 致谢 衷心感谢我们的前同事 Jing Chen 为这个项目做出的贡献。 ( 参考文献 ) ( 1. Chames, P; Baty, D . Bispecificantibodies for cancer therapy. mAbs 2009,1:6,539-547 ) ( 2. Wang, D. L.;等, 利 用 Agilent 6545XT AdvancBio LC/Q-TOF 精 确表征完整单克隆抗体。安捷伦科 技公司,出 版 号5991-7813CHCN ) ( 3. Beck, A.;Wagner-Rousset,E. Characterization of TherapeuticAntibodies and Related Products. Anal. Chem.2013,85(2),715-736 ) ( 4 . Zhang, Q.; Bateman, K. P.Automated DBS microsampling, microscale automation and microflow LC-MS for therapeuticprotein PK. Bioanalysis 2016, 8(7), 649-659 ) www.agilent.com 仅限研究使用。 不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 ( C安捷伦科技(中国)有限公司,2017 ) ( 2017年11月15日,中国出版 ) ( 5991-8445ZHCN ) Agilent Technologies 前言单克隆抗体 (mAb) 型药物代表了发展迅速的一类生物药物,对这类药物需要进行深入表征,以便获得临床试验和后续上市的批准。鉴于单克隆抗体具有分子量大及存在翻译后修饰(糖基化)的特征,精确质量数测定是单克隆抗体分析表征中最具挑战性的步骤。这些特性也使得修饰位置的测定更加复杂。为了应对抗体质量数测定相关的挑战,人们使用了大量补充方法。可以用 PNGase F 处理抗体去除 N-糖链,后用 IdeS 等蛋白酶酶解获得抗体片段,也可还原单克隆抗体,以生成轻链和重链,随后进行质量数测定。这些技术可以各种组合加以应用。样品前处理可能费时费力,而且重现性不佳。本应用简报展示了如何使用 Agilent AssayMAP Bravo 的自动化功能简化这些方法,减少引入人为误差的可能性,提高重现性,并实现更长的无人值守时间。结论Agilent AssayMAP Bravo 平台是单克隆抗体表征一体化流程(包括全面的完整 mAb 质量数测量)的关键要素。它能够自动进行样品前处理,可减少人为误差,确保重现性,并允许分析人员离开执行其他任务。目前的研究采用 AssayMAP Bravo,需要 5.5 小时的总时间完成四个小柱的样品前处理。而同样数量的样品采用手动前处理需要花费至少 1 天的时间。如果需要对全部 12 根小柱进行样品前处理(整个板),AssayMAP Bravo 所需的处理时间仍保持在 5–6 小时左右。然而,对整个板进行手动样品前处理,则需要超过 1 天的不间断工作时间。AssayMAP Bravo 提供了一个简便易用的平台,可以实现整个工作流程的自动化,并缩短获得结果的时间。AssayMAP Bravo 经专门设计,能够使用微量色谱柱进行蛋白质和多肽样品的前处理,具有简单可靠的自动化流程和基于应用的用户界面。安捷伦将 AssayMAP Bravo 上的自动亲和纯化和酶解与超高效液相色谱、Agilent AdvanceBio Q-TOF 和简单易用的 Agilent MassHunter BioConfirm 软件集成,为抗体表征提供完整的解决方案。这一工作流程功能多样,能够实现完整抗体和亚基蛋白质的质量数分析。为了满足综合表征研究的需要,这一流程还能灵活执行柱上去糖基化,用 IdeS 蛋白酶进行蛋白水解,或还原释放亚基,甚至能够将三个步骤结合。ECD 和蛋白质 L 均可从 CHO 细胞培养上清液中纯化出高纯度 mAb。这种一体化方法还可进行高通量分析,用于抗体前处理的批次间比较。出色的色谱分离度能够快速有效地分离完整抗体及其轻链和重链亚基,还包括不同的二硫化形式。Agilent AdvanceBio Q-TOF 可生成高分辨率谱图,以实现高质量数准确度的蛋白质质量数分析。MassHunter BioConfirm 数据分析软件支持完整的蛋白质分析工作流程,包括自动化数据提取、解卷积和序列匹配。
确定




还剩10页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《单克隆抗体中完整结构或亚基精确质量数检测方案(移液工作站)》,该方案主要用于生物药品药物研发中其他检测,参考标准--,《单克隆抗体中完整结构或亚基精确质量数检测方案(移液工作站)》用到的仪器有Agilent AssayMAP Bravo 蛋白质样品前处理平台、Agilent 1290 Infinity II 液相色谱系统、Agilent 6545 Q-TOF 液质联用系统
推荐专场
液体处理工作站(移液工作站)
更多
相关方案
更多
该厂商其他方案
更多