方案详情
文
华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力的影响
方案详情

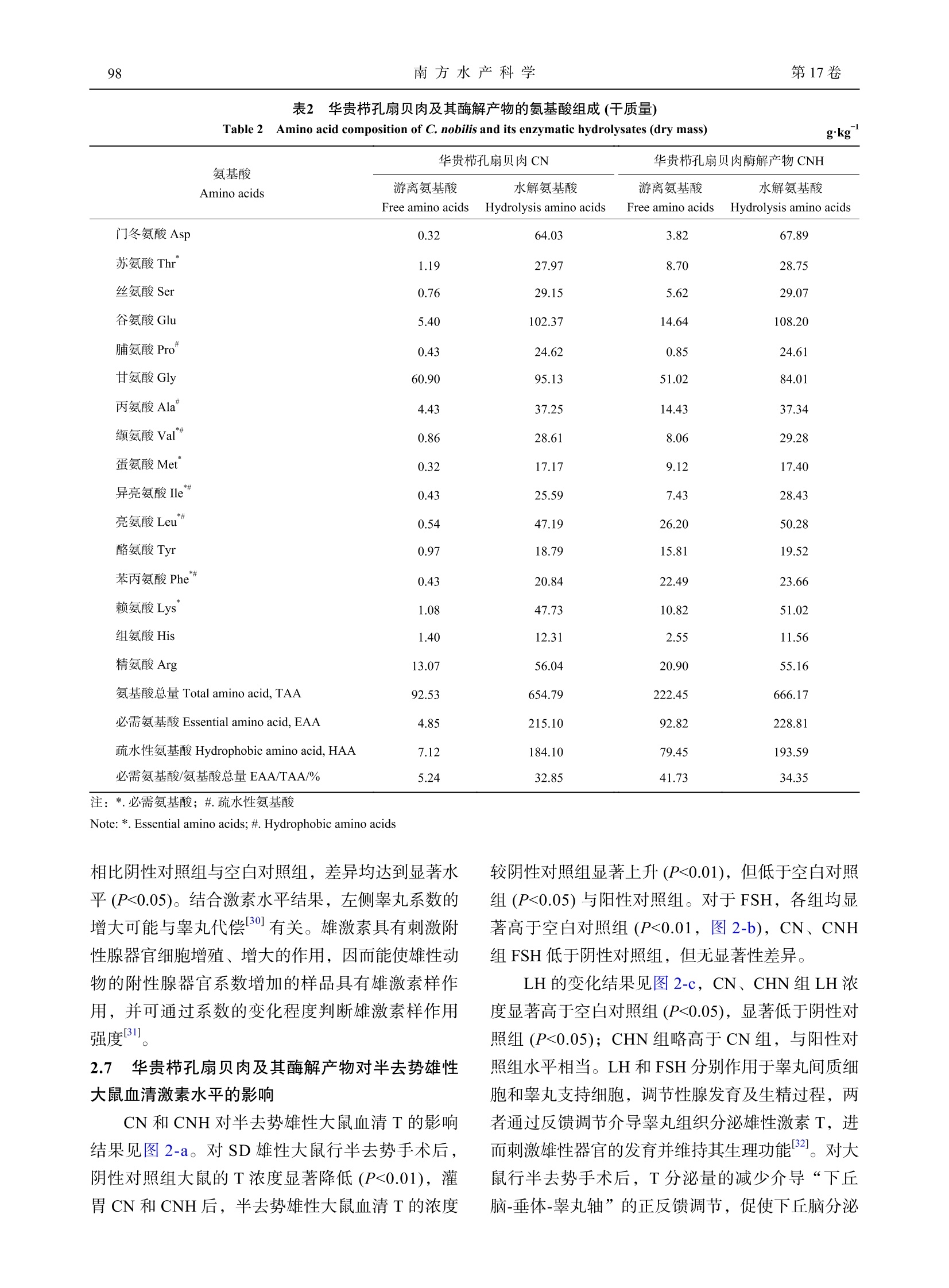
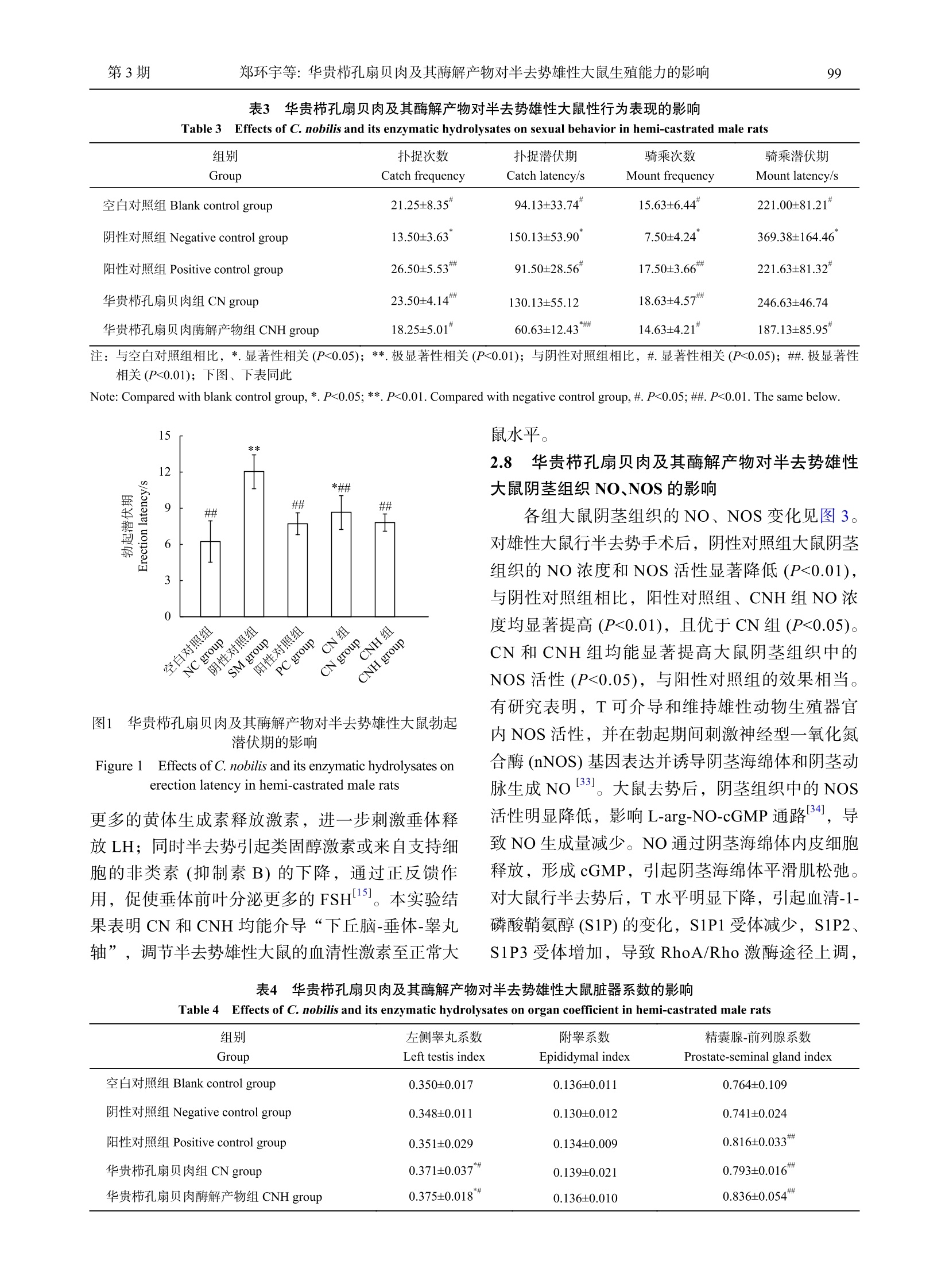
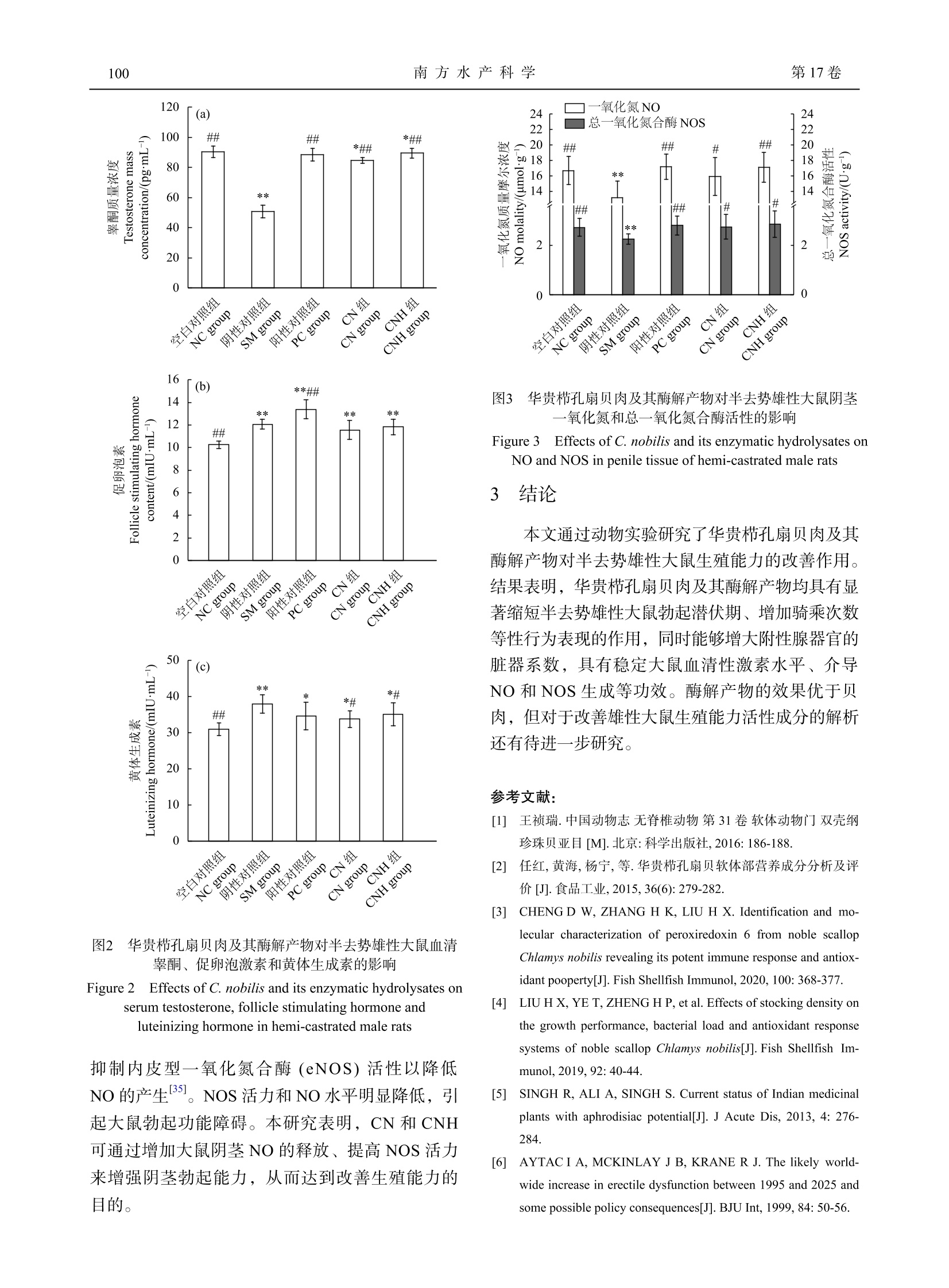
华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力的影响南 方 水 产 科 学South China Fisheries Science第 17卷第 3期2021年 6月Vol.17,No.3Jun. ,2021 郑环宇等: 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力的影响第 3期95 DOI: 10.12131/20200251 文章编号: 2095 − 0780 −(2021)03 − 0094 − 08 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力的影响 郑环宇 1,高加龙 1, 2,章超桦 1, 2,司 蕊 1,郑惠娜 1, 2,曹文红 1, 2,秦小明 1, 2 (1.广东海洋大学食品科技学院 /国家贝类加工技术研发分中心 (湛江 ) /广东省水产品加工与安全重点实验室 / 广东省海洋生物制品工程实验室 /水产品深加工广东普通高等学校重点实验室,广东湛江 524088;2.大连工业大学 /海洋食品精深加工关键技术省部共建协同创新中心,辽宁大连 116034) 摘要:为探究华贵栉孔扇贝 (Chlamys nobilis )肉及其酶解产物对改善男性生殖能力的功效,该研究以半去势 SD 雄性大鼠为动物实验模型,考察华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠的性行为表现、脏器系数、血清性激素水平、阴茎组织一氧化氮 (NO)和总一氧化氮合酶 (NOS)活力等的影响。结果表明,华贵栉孔扇贝肉 及其酶解产物可缩短半去势雄性大鼠的勃起潜伏期 (P <0.01),增加扑捉次数 (P <0.05)、骑乘次数 (P <0.05)等性行 为表现;显著提升半去势雄性大鼠的睾丸、前列腺 -精囊腺系数 (P <0.05),能显著提高半去势大鼠血清睾酮 (T)含量,稳定黄体生成素 (LH)和促卵泡激素 (FSH)水平 (P <0.05);同时能显著介导 NO 和 NOS 的生成。综上,华 贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠的生殖能力有一定改善作用,其改善机制可能与调节半去势雄性 大鼠血清性激素、促进阴茎信号因子的生成有关。 关键词:华贵栉孔扇贝;酶解产物;生殖能力;雄性激素 中图分类号: TS 254.9 文献标志码: A 开放科学(资源服务)标识码(OSID ): Effects of Chlamys nobilis and its enzymatic hydrolysates on reproductive capacity of hemi-castrated male rats ZHENG Huanyu1, GAO Jialong1, 2, ZHANG Chaohua1, 2, SI Rui1, ZHENG Huina1, 2, CAO Wenhong1, 2, QIN Xiaoming1, 2 (1. College of Food Science and Technology , Guangdong Ocean University/National Research and Development Branch Center for Shellfish Processing (Zhanjiang )/Guangdong Provincial Key Laboratory of Advanced Processing of Aquatic Product of Guangdong Higher Education Institution , Zhanjiang 524088, China ; 2. Dalian Polytechnic University/ Collaborative Innovation Center of Seafood Deep Processing , Dalian 116034, China ) Abstract: To explore the ameliorative effect of Chlamys nobilis and its enzymatic hydrolysates on male sexual function, we invest-igated the sexual behaviors, organ coefficient, level of serum sex hormone, NO contents and enzyme activity of NOS in penile tissue of the hemi-castrated male SD rats. The results show that C. nobilis and its enzymatic hydrolysates could increase the sexual behavi-ors of hemi-castrated male rats, such as catching frequency (P <0.05) and mount frequency (P <0.05); decrease the errection latency significantly (P <0.01); and increase the coefficients of testicular and prostate-seminal gland in hemi-castrated male rats significantly (P <0.05). Besides, it could increase the serum testosterone content, stable the levels of luteinizing hormone (LH) and follicle stimulating hor- 资助项目:财政部和农业农村部国家现代农业产业技术体系资助 (CARS-49);广东普通高等学校水产品高值化加工与利用创新团队项目 (GDOU2016030503);海洋贝类营养健康食品关键技术及产业化 (GDOU2017052606)作者简介:郑环宇 (1994—),男,硕士研究生,研究方向为食品加工与安全。E-mail: zheng_0507@126.com 通信作者:高加龙 (1983—),男,博士,副教授,从事水产品精深加工深究。E-mail: Garonne@126.com 章超桦 (1956—),男,博士,教授,从事水产品精深加工研究。E-mail: zhangch2@139.com mone (FSH). Moreover, it could mediate the production of NO and NOS in penile tissue significantly (P <0.05). Therefore, C. nobi -lis and its enzymatic hydrolysates can improve the reproductive capacity of hemi-castrated male rats, and the improvement mechan-ism is probably related to the regulation of serum sex hormones and the promotion of signal factors of penile tissue in hemi-castrated male rats. Key words: Chlamys nobilis ; Enzymatic hydrolysis; Reproductive capacity; Androgen 华贵栉孔扇贝 (Chlamys nobilis )隶属瓣鳃纲、珍珠贝亚目、扇贝科 [1],为暖水性贝类,是我国南 方海域的主要养殖经济贝类之一。其味道鲜美、营 养丰富,富含精氨酸、牛磺酸、硒元素、VE 等营 养物质 [2];该贝类生长快且不易储存,除鲜销及加 工成干制品外,深加工利用价值低。目前,对华贵 栉孔扇贝的研究主要集中在遗传育种 [3]、水产养殖 [4]等方面,利用其进行生物活性方面的研究鲜有报道。 性欲障碍、勃起功能障碍和射精障碍等症状是 男性常见的多发性疾病,其中勃起功能障碍 (Eretile dysfunction, ED)指男子在性刺激下,持续无法维 持足够硬度的阴茎勃起以获得满意的性表现 [5]。目 前,ED 已成为困扰全球男性的重要疾病之一,1995年全世界男性 ED 患者约 1.52亿人,预计到 2025年将增至 3.22亿人 [6]。原发性性腺机能减退 及疾病、创伤等原因造成的睾丸损伤均可导致雄性 性激素水平下降、引发 ED 等性功能障碍问题 [7]。目前,营养药品和膳食补充剂成为治疗性功能障碍 的一种可行选择 [8],随着对性健康认识的提高,男 性群体对改善性功能障碍膳食补充剂的需求也逐渐 增加。研究表明,海洋生物资源如海马 [9]、海参 [10]、贻贝 [11]、牡蛎 [12-13]等均对男性生殖能力具有良好 的保护作用,是制备此类膳食补充剂的良好来源。据《动物本草》记载,扇贝可滋阴补肾、调中,主 治阴虚劳损、肾虚腰痛、遗精等症 [14]。为探究富含 精氨酸、硒 (Se)元素等营养物质的华贵栉孔扇贝 是否有改善男性生殖能力障碍的功效,本研究对 SD 雄性大鼠进行半去势手术,建立雄性大鼠生殖 能力减退模型,考察华贵栉孔扇贝肉及其酶解产 物对半去势雄性大鼠生殖能力及血清性激素水平等 的影响,以期为挖掘扇贝的生理功效及开发扇贝作 为改善男性生殖能力障碍的膳食补充剂提供理论 依据。 1 材料与方法 1.1 材料与实验动物 华贵栉孔扇贝于 2019年 7月采自广东省雷州 市覃斗镇养殖场,开壳取肉并去除内脏团、足丝得 扇贝可食部分,于 −40 ℃冻藏备用。 SPF 级 SD 雄性大鼠 40只,体质量约 (300±20) g ;SPF 级 SD 雌性大鼠 40只,体质量 (280±20) g [使用许可证号 SCXK (鲁 ) 20190003]。于相 对湿度 50%~60%、温度 (24±2) ℃下自由进食饲养。 1.2 试剂与仪器 动物蛋白酶,酶活力 13×104 U·g−1 (广西南宁 庞博生物有限公司 );枸橼酸西地那非 (国药准字 H20020526,辉瑞制药有限公司 );水合氯醛 (上海 源叶生物科技有限公司 );大鼠睾酮 (T)、大鼠促黄 体激素 (LH)、大鼠促卵泡生长激素 (FSH) ELISA 试剂盒 (江苏酶免实业有限公司 );一氧化氮 (NO)测定试剂盒、总一氧化氮合成酶 (NOS)测试盒、考马斯亮蓝总蛋白测定试剂盒 (南京建成生物工程 研究所 )。注射用头孢噻呋钠 (抗生素,艾美科健生 物医药有限公司 );苯甲酸雌二醇注射液、黄体酮 注射液 (宁波第二激素厂 );其余试剂均为分析纯。 FA1004分析天平 (上海舜宇恒平科学仪器有 限公司 );VAPODEST-450全自动凯氏定氮仪 (德 国格哈特分析仪器有限公司 );L-8900全自动氨基 酸分析仪 (株式会社日立制作所 );G50组织研磨仪 (卡尤迪生物科技有限公司 );Thermo Varioskan Flash 多功能全自动酶标仪;Lynx6000高速落地离 心机 (美国 Thermo 公司 );N-4000大型旋转蒸发仪 (东京理化器械株式会社 );FDU-1100型真空冷冻 干燥机 (东京理化器械株式会社 );ZS-YLS-9A 生 理、药理电子刺激仪 (上海众实迪创科技发展有限 公司 );UV-5100紫外分光光度计 (上海元析仪器有 限公司 )。 1.3 方法 1.3.1 贝肉及其酶解产物的制备 根据前期优化 的酶解工艺条件制备华贵栉孔扇贝肉酶解产物。取 冻藏华贵栉孔扇贝肉可食用部位,于 (−18±1) ℃暂 贮 24 h 后转至 (4±1) ℃解冻,洗净沥干匀浆。匀 浆液经冷冻干燥得华贵栉孔扇贝肉试样 (CN);另 取匀浆液加蒸馏水至料液质量体积比为 1∶3,调 节 pH 至 7.0,按 3 000 U·g−1加入动物蛋白酶,于 50 ℃恒温水浴中酶解 4 h ,沸水浴灭酶 15 min ,迅速冷却后经 8 000 r·min−1离心 20 min ,过滤收集 上清液,旋蒸浓缩后经冷冻干燥得华贵栉孔扇贝 肉酶解产物试样 (CNH);测得 CNH 的水解度为 29.87%。 1.3.2 基本成分测定 水分:常压干燥法 (GB 5009.3—2016);粗蛋白:凯氏定氮法 (GB 5009.5—2016);粗脂肪:索氏提取法 (GB 5009.6—2016);灰分:高温灼烧法 (GB 5009.4—2016);总糖:苯 酚 -硫酸法 (GB/T 9695.31—2008)。 1.3.3 氨基酸组成测定 贝肉酶解产物氨基酸按 照食品安全国家标准 GB 5009.124—2016进行测定。 1.3.4 微量元素测定 贝肉酶解产物的铁 (Fe)、锌 (Zn)、Se 、铜 (Cu)、锰 (Mn)按照国家标准 GB 5009.268—2016的微波消解 -电感耦合等离子体 -质 谱法进行测定。 1.3.5 实验动物去势模型构造 对 32只 SD 雄性 大鼠进行半去势手术,经 15%水合氯醛麻醉消毒 后,于大鼠阴囊部右侧作 1 cm 左右切口,分离右 侧睾丸及附睾,在附睾头尾之间结扎,摘除右侧睾 丸;另取 8只 SD 雄性大鼠在阴囊部位作 1 cm 左 右切口,不摘除睾丸,行假手术 [15]。各组大鼠手术 后使用注射用头孢噻呋钠 (抗生素 ) 15 mg·kg−1,注 射 3 d ,同时对伤口进行碘酊消毒,防止感染。 对 SD 雌性大鼠进行全去势手术,经 15 mg·kg−1盐酸赛拉嗪麻醉后,剪除两侧背部手术区毛发并消 毒,以大鼠最后一肋与大腿根部连线的中点皮肤处 行 1 cm 切口,肌肉层行 0.5 cm 的切口,挤压肾脏 后下侧包裹卵巢的脂肪团,结扎后摘除卵巢 [16]。两 侧同法。手术后使用注射用头孢噻呋钠 (抗生素 )30 mg·kg−1,注射 3 d ,同时对伤口进行碘酊消毒,防止感染。 1.3.6 实验动物分组 将恢复性饲养 2周的半去 势 SD 雄性大鼠 32只随机分为 4组,每组 8只,分 别为阳性对照组 (PC)、阴性对照组 (SM)、华贵栉 孔扇贝肉酶解产物组 (CNH)、华贵栉孔扇贝肉组 (CN);另行假手术的 8只 SD 雄性大鼠作为空白对照 组 (NC)。NC 、SM 组灌胃生理盐水 1.5 mL·(kg·d)−1; PC 组灌胃枸橼酸西地那非 1.5 mg·(kg·d)−1;CNH 、CN 组分别灌胃试样 1.3 g·(kg·d)−1。灌胃 7周,期 间大鼠自由进食饮水。 1.3.7 实验动物性行为表现 行为学实验于灌胃 48 d 后进行。实验前 48 h 对雌性去势大鼠皮下注 射苯甲酸雌二醇注射液 200 μg·kg−1,雌雄合笼前 4 h 皮下注射黄体酮注射液 2 mg·kg−1,以获得发情良 好的雌鼠 [17]。实验于 20:00—24:00进行,实验前 将雄鼠放置观察箱 (30 cm × 40 cm × 40 cm)中适应 10 min ,用高清摄像头记录。从放进雌鼠起开始记 录,观察前 30 min ,并记录大鼠的扑捉次数、骑 乘次数、扑捉潜伏期、骑乘潜伏期 [18-19]、勃起潜伏 期。扑捉次数为雄鼠嗅闻雌鼠尾根部后进行扑捉雌 鼠行为的次数;扑捉潜伏期为放入雌鼠后,至发生 第一次扑捉行为的时间;骑乘次数为雄鼠扑捉雌鼠 后进行交配行为的次数 (有无射精都计,即雄性大 鼠发生骑乘行为后舔舐阴茎的表现 );骑乘潜伏期 为放入雌鼠后,至发生第一次骑乘行为的时间;勃 起潜伏期为生理、药理电子刺激仪正负极置于雄性 大鼠阴茎根部,仪器参数为电流强度为 4 mA ,波宽为 100 mS ,电压为 0.2 V ,记录大鼠从电极接 触阴茎开始至阴茎勃起的时间 [20]。 1.3.8 附性腺脏器系数的测定 末次给药后称质 量麻醉,眼球取血后迅速分离出大鼠左侧睾丸、阴 茎、附睾、精囊腺 -前列腺组织,并使用电子天平 称质量 (g),计算脏器系数 [21]。 1.3.9 血清性激素水平测定 眼球取血后室温自 然凝固 15 min ,经 3 000 r·min−1离心 15 min ,收集 上层血清,用于测定血清中的 T 、FSH 和 LH 。 1.3.10 阴茎组织 NO 和 NOS 的测定 分离大鼠 阴茎组织,剪除阴茎的表面皮肤、阴茎头,于冰浴 中剪碎匀浆、离心,取上清液,使用考马斯亮蓝法 测定组织蛋白质含量;硝酸还原法测定 NO 浓度,比色法测定 NOS 活力。 1.4 数据统计分析 采用 JMP 10和 Origin 9.0软件进行数据分析 与绘图。结果以 “平均值 ±标准差 (X ±SD )”表 示。对数据进行组间差异性显著分析,执行最小二 乘均值 student t 检验,P <0.05表示差异显著,P <0.01表示差异极显著。 2 结果 2.1 华贵栉孔扇贝肉及其酶解产物的基本组成 CN 及 CNH 的基本营养成分见 表 1,以干质量 计,CN 与 CNH 蛋白质质量分数较高 (分别为 75.48%与 76.14%);经酶解后 CNH 的脂肪质量分 数较低 (仅 0.77%)。由此可见,华贵栉孔扇贝是一 表 1 华贵栉孔扇贝肉及其酶解产物的基本成分 Table 1 Content of basic component in C. nobilis and its enzymatic hydrolysates % 项目 水分 Moisture 粗蛋白 Crude protein 粗脂肪 Crude fat 总糖 Total sugar 灰分 Ash Item 华贵栉孔扇贝肉 CN 7.39±0.12 69.91±0.07 (75.48) 3.26±0.04 (3.52) 9.47±0.01 (10.22) 9.54±0.02 (10.30) 华贵栉孔扇贝肉酶解产物 CNH 5.73±0.15 71.78±0.09 (76.14) 0.73±0.01 (0.77) 11.34±0.01 (12.03) 8.28±0.05 (8.78) 注:括号内为干质量 Note: Dry mass is in parentheses. 2.2 华贵栉孔扇贝肉及其酶解产物的氨基酸组成 Tan 等 [22]报道华贵栉孔扇贝含有大量易于消 化且符合人类膳食需求的必需氨基酸,可改善生物 体的生长、发育、繁殖等生理机能。本研究测到华 贵栉孔扇贝肉及其酶解产物含 16种氨基酸 (表 2),两者的必需氨基酸有 7种,水解必需氨基酸与总氨 基酸的比值 (EAA/TAA)分别为 32.85%、34.35%,游离 EAA/TAA 分别为 5.24%、41.73%,所含氨基 酸构成较均衡。CNH 的水解支链氨基酸 (缬氨酸、异亮氨酸、亮氨酸 )含量较高,占氨基酸总量的 16.21%,补充适量的支链氨基酸对精子功能和睾 丸激素的产生有促进作用 [23];CN 、CNH 水解氨基 酸中精氨酸质量分数分别为 13.07、20.90 g·kg−1,游 离氨基酸中的精氨酸质量分数分别为 56.04、55.16g·kg−1,其中 L-精氨酸能在 NOS 的催化下合成 NO ,产生瓜氨酸 [24],是促进生殖激素发生的潜在物质。 2.3 华贵栉孔扇贝肉及其酶解产物的微量元素含量 华贵栉孔扇贝肉的微量元素 Zn 、Fe 、Mn 、Cu 、Se 质量分数分别为 114.51、691.76、20.46、5.19、2.87 mg·kg−1;华贵栉孔扇贝肉酶解产物的 Zn 、Fe 、Mn 、Cu 、Se 质量分数分别为 84.13、32.59、8.20、1.28、1.22 mg·kg−1。Se 是人体精子 发生必需的微量元素,由 Se 参与组成的谷胱甘肽 过氧化物酶 4 (GPx4),是人体内唯一可直接降解磷 脂氢肽过氧化物 (PHGPx)的酶,对调控睾丸组织 中的精子发生与成熟起重要作用 [ 2 5 - 2 6 ]。另外, Zn 是维持睾丸生精细胞、促进精子发生并调节精 子活力的必需微量元素 [27]。 2.4 华贵栉孔扇贝肉及其酶解产物对半去势雄性 大鼠性行为表现的影响 扑捉、骑乘等指标可反映雄性大鼠性行为的能 力 [28]。各组大鼠性行为情况见 表 3,对 SD 雄性大 鼠行半去势手术后,阴性对照组扑捉行为、骑乘行 为显著减少 (P <0.05)、潜伏期显著延长 (P <0.05)。与对照组相比,CN 、CNH 两组大鼠扑捉次数和骑 乘次数均有不同程度的增加,扑捉潜伏期和骑乘 潜伏期均有不同程度的缩短。其中,CN 组大鼠的 扑捉次数和骑乘次数相较于阴性对照组显著增加 (P <0.01);CNH 组大鼠的扑捉潜伏期与骑乘潜伏期 相较于阴性对照组显著缩短 (P <0.05),且改善效果 优于阳性对照组。性行为表现结果说明 CN 和 CNH 组均有提高大鼠性欲、改善半去势雄性大鼠性行为 的功效,且 CNH 组的改善作用更佳。 2.5 华贵栉孔扇贝肉及其酶解产物对半去势雄性 大鼠勃起潜伏期的影响 使用微弱电流刺激阴茎勃起,可直观地判断样 品是否能改善大鼠勃起功能障碍。各组大鼠勃起潜 伏期见 图 1,对雄性大鼠行半去势手术后阴茎勃起 潜伏期显著延长 (P <0.01),阳性对照组能明显改善 大鼠的阴茎勃起潜伏期 (P <0.01)。与阴性对照组相 比,CN 和 CNH 组均显著缩短了半去势雄性大鼠 的阴茎勃起潜伏期 (P <0.01),但高于空白对照组。其中,CNH 组的改善效果好于 CN 组,与阳性对 照组的效果相当。 2.6 华贵栉孔扇贝肉及其酶解产物对半去势雄性 大鼠脏器系数的影响 CN 和 CNH 对半去势雄性大鼠脏器系数的影 响见 表 4,不同组大鼠的左侧睾丸、精囊腺 -前列 腺等性腺器官系数显示出不同的变化。与阴性对照 组相比,CN 和 CNH 组大鼠精囊腺 -前列腺的质量 及脏器系数显著增大 (P <0.01)。前列腺和精囊腺的 质量变化可以作为一个良好的、相对快速反映雄激 素水平变化的指标 [29]。各组雄性大鼠的附睾系数均 无显著性变化。CN 和 CNH 组的左侧睾丸系数, 表 2 华贵栉孔扇贝肉及其酶解产物的氨基酸组成 (干质量 ) Table 2 Amino acid composition of C. nobilis and its enzymatic hydrolysates (dry mass) g·kg−1 氨基酸Amino acids 华贵栉孔扇贝肉 CN 水解氨基酸 华贵栉孔扇贝肉酶解产物 CNH 游离氨基酸 Free amino acids Hydrolysis amino acids 游离氨基酸 Free amino acids 水解氨基酸 Hydrolysis amino acids 门冬氨酸 Asp 0.32 64.03 3.82 67.89 苏氨酸 Thr* 1.19 27.97 8.70 28.75 丝氨酸 Ser 0.76 29.15 5.62 29.07 谷氨酸 Glu 5.40 102.37 14.64 108.20 脯氨酸 Pro# 0.43 24.62 0.85 24.61 甘氨酸 Gly 60.90 95.13 51.02 84.01 丙氨酸 Ala# 4.43 37.25 14.43 37.34 缬氨酸 Val*# 0.86 28.61 8.06 29.28 蛋氨酸 Met* 0.32 17.17 9.12 17.40 异亮氨酸 Ile*# 0.43 25.59 7.43 28.43 亮氨酸 Leu*# 0.54 47.19 26.20 50.28 酪氨酸 Tyr 0.97 18.79 15.81 19.52 苯丙氨酸 Phe*# 0.43 20.84 22.49 23.66 赖氨酸 Lys* 1.08 47.73 10.82 51.02 组氨酸 His 1.40 12.31 2.55 11.56 精氨酸 Arg 13.07 56.04 20.90 55.16 氨基酸总量 Total amino acid, TAA 92.53 654.79 222.45 666.17 必需氨基酸 Essential amino acid, EAA 4.85 215.10 92.82 228.81 疏水性氨基酸 Hydrophobic amino acid, HAA 7.12 184.10 79.45 193.59 必需氨基酸/氨基酸总量 EAA/TAA/% 5.24 32.85 41.73 34.35 注:*.必需氨基酸;#.疏水性氨基酸 Note: *. Essential amino acids; #. Hydrophobic amino acids 相比阴性对照组与空白对照组,差异均达到显著水 平 (P <0.05)。结合激素水平结果,左侧睾丸系数的 增大可能与睾丸代偿 [30]有关。雄激素具有刺激附 性腺器官细胞增殖、增大的作用,因而能使雄性动 物的附性腺器官系数增加的样品具有雄激素样作 用,并可通过系数的变化程度判断雄激素样作用 强度 [31]。 2.7 华贵栉孔扇贝肉及其酶解产物对半去势雄性 大鼠血清激素水平的影响 CN 和 CNH 对半去势雄性大鼠血清 T 的影响 结果见 图 2-a 。对 SD 雄性大鼠行半去势手术后,阴性对照组大鼠的 T 浓度显著降低 (P <0.01),灌 胃 CN 和 CNH 后,半去势雄性大鼠血清 T 的浓度 较阴性对照组显著上升 (P <0.01),但低于空白对照 组 (P <0.05)与阳性对照组。对于 FSH ,各组均显 著高于空白对照组 (P <0.01,图 2-b ),CN 、CNH 组 FSH 低于阴性对照组,但无显著性差异。 LH 的变化结果见 图 2-c ,CN 、CHN 组 LH 浓 度显著高于空白对照组 (P <0.05),显著低于阴性对 照组 (P <0.05);CHN 组略高于 CN 组,与阳性对 照组水平相当。LH 和 FSH 分别作用于睾丸间质细 胞和睾丸支持细胞,调节性腺发育及生精过程,两 者通过反馈调节介导睾丸组织分泌雄性激素 T ,进 而刺激雄性器官的发育并维持其生理功能 [32]。对大 鼠行半去势手术后,T 分泌量的减少介导 “下丘 脑 -垂体 -睾丸轴 ”的正反馈调节,促使下丘脑分泌 表 3 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠性行为表现的影响 Table 3 Effects of C. nobilis and its enzymatic hydrolysates on sexual behavior in hemi-castrated male rats 组别 扑捉次数 扑捉潜伏期 骑乘次数 骑乘潜伏期 Group Catch frequency Catch latency/s Mount frequency Mount latency/s 空白对照组 Blank control group 21.25±8.35# 94.13±33.74# 15.63±6.44# 221.00±81.21# 阴性对照组 Negative control group 13.50±3.63* 150.13±53.90* 7.50±4.24* 369.38±164.46* 阳性对照组 Positive control group 26.50±5.53## 91.50±28.56# 17.50±3.66## 221.63±81.32# 华贵栉孔扇贝肉组 CN group 23.50±4.14## 130.13±55.12 18.63±4.57## 246.63±46.74 华贵栉孔扇贝肉酶解产物组 CNH group 18.25±5.01# 60.63±12.43*## 14.63±4.21# 187.13±85.95# 注:与空白对照组相比,*.显著性相关 (P <0.05);**.极显著性相关 (P <0.01);与阴性对照组相比,#.显著性相关 (P <0.05);##.极显著性 相关 (P <0.01);下图、下表同此 图 1 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠勃起 潜伏期的影响 Figure 1 Effects of C. nobilis and its enzymatic hydrolysates on erection latency in hemi-castrated male rats 更多的黄体生成素释放激素,进一步刺激垂体释 放 LH ;同时半去势引起类固醇激素或来自支持细 胞的非类素 (抑制素 B)的下降,通过正反馈作 用,促使垂体前叶分泌更多的 FSH[15]。本实验结 果表明 CN 和 CNH 均能介导 “下丘脑 -垂体 -睾丸 轴 ”,调节半去势雄性大鼠的血清性激素至正常大 鼠水平。 2.8 华贵栉孔扇贝肉及其酶解产物对半去势雄性 大鼠阴茎组织 NO 、NOS 的影响 各组大鼠阴茎组织的 NO 、NOS 变化见 图 3。对雄性大鼠行半去势手术后,阴性对照组大鼠阴茎 组织的 NO 浓度和 NOS 活性显著降低 (P <0.01),与阴性对照组相比,阳性对照组、CNH 组 NO 浓 度均显著提高 (P <0.01),且优于 CN 组 (P <0.05)。 CN 和 CNH 组均能显著提高大鼠阴茎组织中的 NOS 活性 (P <0.05),与阳性对照组的效果相当。有研究表明,T 可介导和维持雄性动物生殖器官 内 NOS 活性,并在勃起期间刺激神经型一氧化氮 合酶 (nNOS)基因表达并诱导阴茎海绵体和阴茎动 脉生成 NO [33]。大鼠去势后,阴茎组织中的 NOS 活性明显降低,影响 L-arg-NO-cGMP 通路 [34],导 致 NO 生成量减少。NO 通过阴茎海绵体内皮细胞 释放,形成 cGMP ,引起阴茎海绵体平滑肌松弛。对大鼠行半去势后,T 水平明显下降,引起血清 -1-磷酸鞘氨醇 (S1P)的变化,S1P1受体减少,S1P2、S1P3受体增加,导致 RhoA/Rho 激酶途径上调, 表 4 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠脏器系数的影响 Table 4 Effects of C. nobilis and its enzymatic hydrolysates on organ coefficient in hemi-castrated male rats 组别 左侧睾丸系数 附睾系数 精囊腺-前列腺系数 Group Left testis index Epididymal index Prostate-seminal gland index 空白对照组 Blank control group 0.350±0.017 0.136±0.011 0.764±0.109 阴性对照组 Negative control group 0.348±0.011 0.130±0.012 0.741±0.024 阳性对照组 Positive control group 0.351±0.029 0.134±0.009 0.816±0.033## 华贵栉孔扇贝肉组 CN group 0.371±0.037*# 0.139±0.021 0.793±0.016## 华贵栉孔扇贝肉酶解产物组 CNH group 0.375±0.018*# 0.136±0.010 0.836±0.054## 120 (a) 图 2 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠血清 睾酮、促卵泡激素和黄体生成素的影响 Figure 2 Effects of C. nobilis and its enzymatic hydrolysates on serum testosterone, follicle stimulating hormone and luteinizing hormone in hemi-castrated male rats 抑制内皮型一氧化氮合酶 (eNOS)活性以降低 NO 的产生 [35]。NOS 活力和 NO 水平明显降低,引 起大鼠勃起功能障碍。本研究表明,CN 和 CNH 可通过增加大鼠阴茎 NO 的释放、提高 NOS 活力 来增强阴茎勃起能力,从而达到改善生殖能力的 目的。 一氧化氮NO2424 总 一 氧 化 氮 合 酶 N O S ## #####兴18T长6 *槲14#岖减之2 2乙0 0 图 3 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠阴茎 一氧化氮和总一氧化氮合酶活性的影响 Figure 3 Effects of C. nobilis and its enzymatic hydrolysates on NO and NOS in penile tissue of hemi-castrated male rats 3 结论 本文通过动物实验研究了华贵栉孔扇贝肉及其 酶解产物对半去势雄性大鼠生殖能力的改善作用。结果表明,华贵栉孔扇贝肉及其酶解产物均具有显 著缩短半去势雄性大鼠勃起潜伏期、增加骑乘次数 等性行为表现的作用,同时能够增大附性腺器官的 脏器系数,具有稳定大鼠血清性激素水平、介导 NO 和 NOS 生成等功效。酶解产物的效果优于贝 肉,但对于改善雄性大鼠生殖能力活性成分的解析 还有待进一步研究。 参考文献: [1] 王祯瑞 .中国动物志无脊椎动物第 31卷软体动物门双壳纲 珍珠贝亚目 [M].北京 :科学出版社 , 2016: 186-188. [2] 任红 ,黄海 ,杨宁 ,等 .华贵栉孔扇贝软体部营养成分分析及评 价 [J].食品工业 , 2015, 36(6): 279-282. [3] CHENG D W, ZHANG H K, LIU H X. Identification and mo-lecular characterization of peroxiredoxin 6 from noble scallop Chlamys nobilis revealing its potent immune response and antiox-idant pooperty[J]. Fish Shellfish Immunol, 2020, 100: 368-377. [4] LIU H X, YE T, ZHENG H P, et al. Effects of stocking density on the growth performance, bacterial load and antioxidant response systems of noble scallop Chlamys nobilis [J]. Fish Shellfish Im-munol, 2019, 92: 40-44. [5] SINGH R, ALI A, SINGH S. Current status of Indian medicinal plants with aphrodisiac potential[J]. J Acute Dis, 2013, 4: 276-284. [6] AYTAC I A, MCKINLAY J B, KRANE R J. The likely world-wide increase in erectile dysfunction between 1995 and 2025 and some possible policy consequences[J]. BJU Int, 1999, 84: 50-56. [7] ROSS A, BHASIN S. Hypogonadism: its prevalence and diagnos-is[J]. Urol Clin North Am, 2016, 43(2): 163-176. [8] SRIVATSAV A, BALASUBRAMANIAN A, PATHAK U L, et al. Efficacy and safety of common ingredients in aphrodisiacs used for erectile dysfunction: a review[J]. Sexual Med Rev, 2020,8(3): 431-442. [9] KIM Y M, JEON Y J, HUH J S, et al. Effects of enzymatic hydro-lysates from seahorse Hippocampus abdominalis on testosterone secretion from TM3 Leydig cells and in male mice[J]. Appl Biol Chem, 2016, 59(6): 869-879. [10]郭锡春 ,高华 ,刘坤 ,等 .海参精囊提取物对环磷酰胺诱导小鼠 生殖系统受损的影响 [J].中国海洋药物 , 2014, 14(17): 3262-3265. [11]张建鹏 ,王俊 ,徐红丽 ,等 .贻贝多糖对大鼠睾丸支持细胞增殖 作用的研究 [J].中国海洋药物 , 2006, 6(3): 12-14. [12]张雪妍 ,秦小明 ,高加龙 ,等 .牡蛎酶解工艺优化及其酶解产物 对小鼠睾酮分泌的影响 [J].广东海洋大学学报 , 2019, 39(3):96-102. [13]黄艳球 .牡蛎肉及其酶解产物对半去势雄性大鼠性功能的影 响 [D].湛江 :广东海洋大学 , 2020: 14-39. [14]杨仓良 ,齐英杰 .动物本草 [M].北京 :中医古籍出版社 , 2001:698-700. [15]姜水生 .维药伊木萨克片对半去势雄性大鼠外周血中性激素水 平的影响 [D].乌鲁木齐 :新疆医科大学 , 2009: 6-11. [16]徐磊 .伊木萨克片对半去势雄性大鼠勃起功能的影响 [D].乌 鲁木齐 :新疆医科大学 , 2009: 8-24. [17]ZHANG Z, SU G, ZHO F, et al. Alcalase-hydrolyzed oyster (Crassostrea rivularis ) meat enhances antioxidant and aphrodisi-ac activities in normal male mice[J]. Food Res Int, 2019, 120:178-187. [18]郑茜 .吉林产玛咖的化学成分及生物活性研究 [D].长春 :吉林 大学 , 2014: 38-45. [19]OBOH G, ADEBAYO A A, ADEMOSUN A O, et al. Aphrodisi-ac effect of Hunteria umbellata seed extract: modulation of nitric oxide level and arginase activity in vivo [J]. Pathophysiology,2019, 26(1): 39-47. [20]阮氏锦秀 .方刺参酒补肾壮阳的实验研究 [D].南宁 :广西医科 大学 , 2017: 18-26. [21]陈悦 ,李路 ,闫朝阳 ,等 .小分子牡蛎多肽对雄性小鼠性功能的 影响 [J].基因组学与应用生物学 , 2019, 38(1): 109-116. [22]TAN K S, LENG X M, ZHAO Y, et al. Amino acid variations in polymorphic noble scallops, Chlamys nobilis [J]. J Food Proc Pre-serv, 2019, 43(12): e14262. [23]NEGRO M, GIARDINA S, MARZANI B, et al. Branched-chain amino acid supplementation does not enhance athletic perform-ance but affects muscle recovery and the immune system[J]. J Sports Med Phys Fitness, 2008, 48(3): 347-351. [24]MORRIS S M. Arginine: beyond protein[J]. Am J Clin Nutr,2006, 83(2): 508S-512S. [25]IMAI H, HAKKAKU N, IWAMOTO R, et al. Depletion of selen-oprotein GPx4 in spermatocytes causes male infertility in mice[J]. J Biol Chem, 2009, 284(47): 32522-32532. [26]李世杰 .近江牡蛎多糖的纯化、结构鉴定、硒化及其生物活性 研究 [D].广州 :广州中医药大学 , 2017: 12-20. [27]YAMAGUCHI S, MIURA C, KIKUCHI K, et al. Zinc is an es-sential trace element for spermatogenesis[J]. Proc Nat Acad Sci USA, 2009, 106(26): 10859-10864. [28]ERHABOR J O, IDU M D. Aphrodisiac potentials of the ethanol extract of Aloe barbadensis Mill. root in male Wistar rats[J]. BMC Complem Altern Med, 2017, 17(1): 360. [29]CREASY D M, CHAPIN R E. Chapter 59: male reproductive sys-tem[M]. Boston: Boston Academic Press, 2013: 2493-2598. [30]PAUL M J, HO P J, HORTON T H, et al. Photoperiodic regula-tion of compensatory testicular hypertrophy in hamsters[J]. Biol Reprod, 2006, 75(2): 261-269. [31]罗琼 ,任世成 ,杨明亮 ,等 .海带多糖对睾丸受辐射雄性大鼠性 功能的影响 [J].营养学报 , 2009, 31(3): 259-262. [32]ROLLAND A D, JEGOU B. Encyclopedia of reproduction[M].2nd ed. New York: Academic Press, 2018: 76-83. [33]HWANG T S, CHEN H E, TSAI T F, et al. Combined use of an-drogen and sildenafil for hypogonadal patients unresponsive to sildenafil alone[J]. Int J Impotence Res, 2006, 18: 400-404. [34]丁维 .丹参酮ⅡA 磺酸钠通过抗氧化应激改善高脂血症大鼠勃 起功能障碍的机制研究 [D].广州 :南方医科大学 , 2018: 1-35. [35]YUJI H P, TOMOYA K P, KAZUNORI K P. Testosterone defi-ciency and endothelial dysfunction: nitric oxide, asymmetric di-methylarginine, and endothelial progenitor cells[J]. Sex Med Rev,2019, 7(4): 661-668.
确定





还剩6页未读,是否继续阅读?
中国格哈特为您提供《华贵栉孔扇贝(高贵海扇蛤)肉及其酶解产物CNH中蛋白质、脂肪含量的检测》,该方案主要用于水产品中营养成分检测,参考标准《GB 5009.5 食品安全国家标准 食品中蛋白质的测定》,《华贵栉孔扇贝(高贵海扇蛤)肉及其酶解产物CNH中蛋白质、脂肪含量的检测》用到的仪器有格哈特全自动凯氏定氮仪VAPODEST 450、格哈特快速干燥仪STL56、格哈特红外加热消解快速消化系统TTs125、格哈特全自动超级总脂肪测定系统HT6+SOX416、格哈特维克松废气实验室废物处理系统涤气VS、德国移液器MM、凯氏定氮催化剂5.0g K2SO4+0.5g CuSO4 x 5H2O
相关方案
更多
该厂商其他方案
更多

































