方案详情
文
热处理对罗非鱼分离蛋白乳液稳定性的影响
方案详情

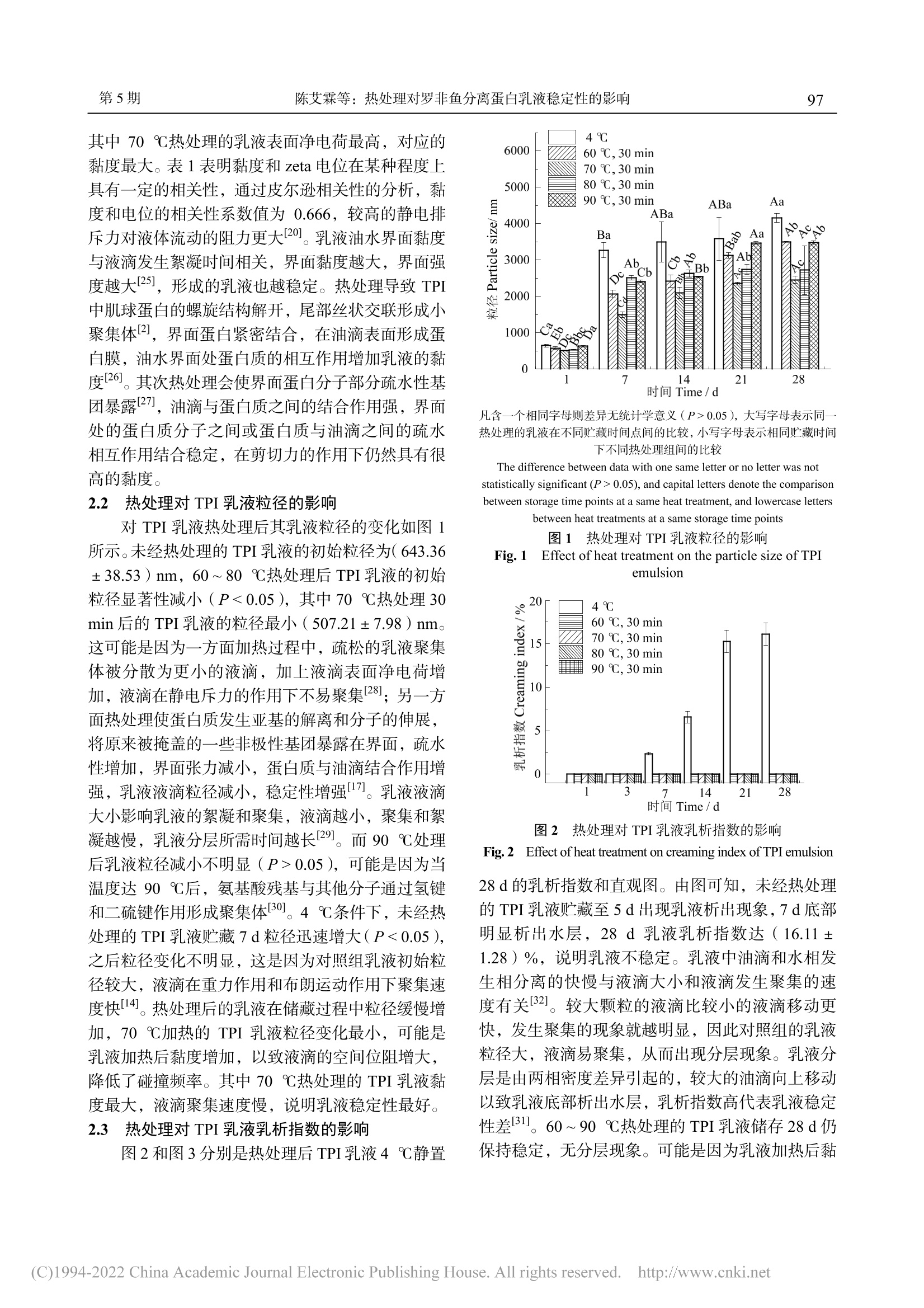
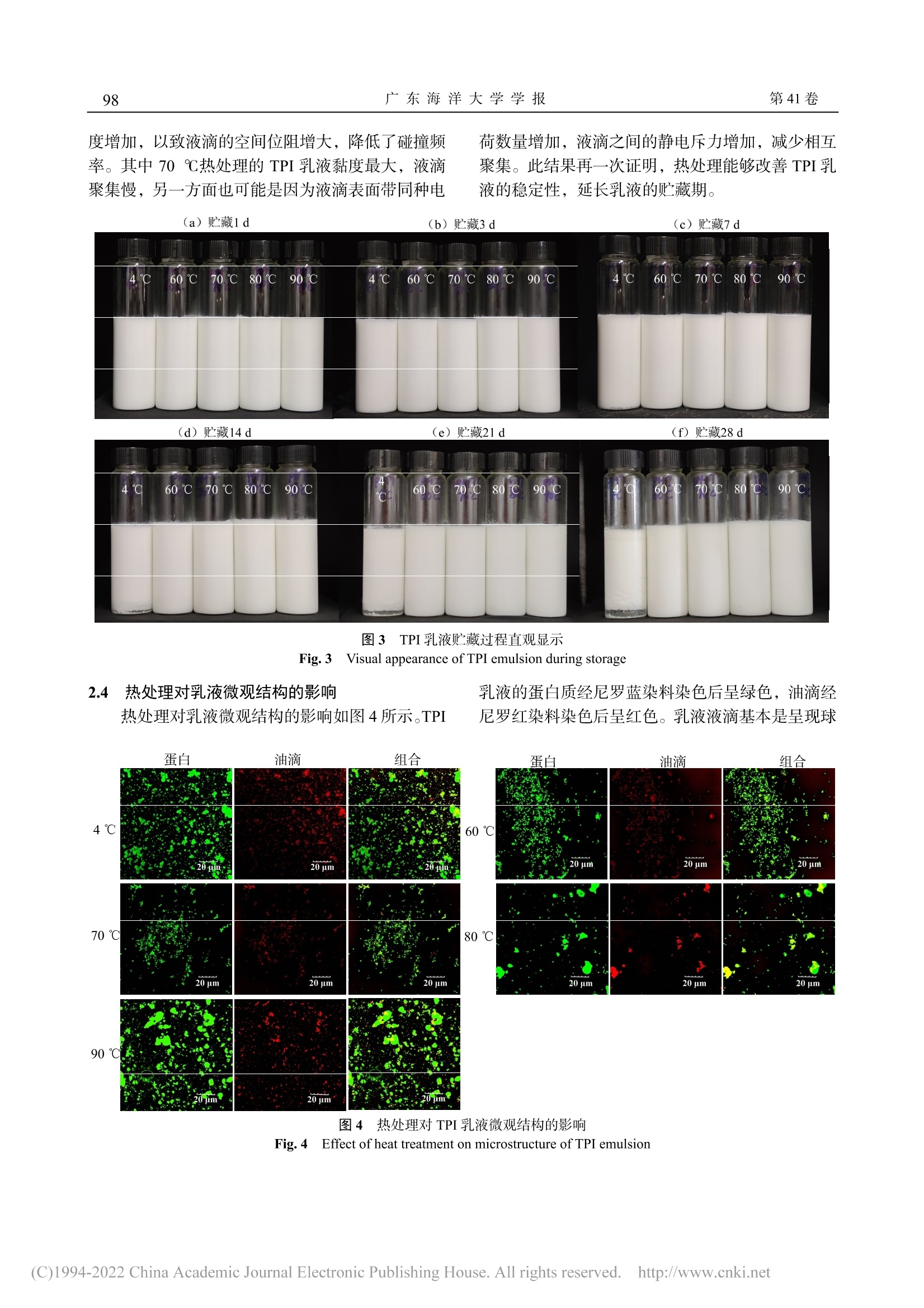
热处理对罗非鱼分离蛋白乳液稳定性的影响广东海洋大学学报Journal of Guangdong Ocean University第 41卷 第 5期2021年 9月Vol.41 No.5Sep. 2021 第5期陈艾霖等:热处理对罗非鱼分离蛋白乳液稳定性的影响95 陈艾霖,刘璐,宋春勇,等 .热处理对罗非鱼分离蛋白乳液稳定性的影响 [J].广东海洋大学学报,2021,41(5):94-100. 热处理对罗非鱼分离蛋白乳液稳定性的影响 陈艾霖 1,刘 璐 1,宋春勇 1,冯 瑞 1,洪鹏志 1,2,周春霞 1,2,林玉锋 1 (1.广东海洋大学食品科技学院//广东省水产品加工与安全重点实验室//广东省海洋食品工程技术研究中心,广东 湛江,524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江,524025) 摘 要 :【目的】提高鱼蛋白乳液的稳定性,拓宽其乳化应用领域。【方法】以罗非鱼分离蛋白(tilapia protein isolate , TPI )作为乳化剂,高压均质制备 O/W 型 TPI 乳液,考察热处理(60、70、80、90 ℃,30 min )对乳液电位、黏 度、粒径、乳析指数和微观结构的影响,探讨热处理对乳液稳定性的改善及机理。【结果】未经热处理的 TPI 乳 液稳定性较差,4 ℃条件下贮藏 5 d 出现分层。经热处理后乳液的平均粒径显著减小(9.16 ~ 136.15 nm )(P < 0.05),电位绝对值显著增大(4.28 ~ 8.60 mV )(P < 0.05),4 ℃贮藏 28 d 无明显的分层和絮凝现象。不同温度热处理结 果比较发现,70 ℃加热 30 min 后乳液粒径减小至(507.21±7.98)nm ,表面净电荷和黏度最大,液滴形状规则 且分布均匀,贮藏 28 d 未分层。【结论】热处理导致乳液液滴的表面净电荷和体系黏度增大,界面蛋白空间位阻 增大不易发生聚集,液滴粒径小且分布均匀,乳液稳定性增加。其中 TPI 乳液经 70 ℃加热 30 min 效果最佳,稳 定性最佳。 关键词 :罗非鱼分离蛋白;乳液;热处理;稳定性 中图分类号 :Q51;TS254.4文献标志码 :A 文章编号 :1673-9159(2021)05-0094-07doi :10.3969/j.issn.1673-9159.2021.05.012 Improving the Stability of Tilapia Protein Isolate Emulsion by Heat Treatment CHEN Ai-lin1, LIU Lu1, SONG Chun-yong1, FENG Rui1, HONG Peng-zhi1,2, ZHOU Chun-xia1,2, LIN Yu-feng1 (1. College of Food Science and Technology , Guangdong Ocean University // Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety // Guangdong Provincial Engineering Technology Research Center of Marine Food , Zhanjiang 524088, China ; 2. Southern Marine Science and Engineering Guangdong Laboratory (Zhanjiang ), Zhanjiang 524025, China ) Abstract: 【Objective 】To improve the stability of fish protein emulsion and broaden its emulsifying application field.【Methods 】The oil-in-water emulsion stabilized by tilapia protein isolate (TPI) was prepared by high pressure homogenization, and the effects of heat treatment (60, 70, 80, 90℃, 30 min) on the emulsion potential, viscosity, particle size, creaming index and microstructure were investigated 收稿日期:2021-03-24 基金项目:广东省科技计划项目(2017A020208067);广东省现代农业产业技术体系创新团队建设项目(2019KJ150) 第一作者:陈艾霖(1996―),女,硕士研究生,研究方向为食品加工与安全。E-mail :ailinchenwei@163.com 通信作者:周春霞(1979―),女,副教授,研究方向为水产品高值化加工与利用。E-mail :zhoucx@gdou.edu.cn to explore the improvement of emulsion stability and its mechanism. 【Results 】The TPI emulsion without heat treatment had poor stability and appeared delamination when stored at 4℃for 5 days. After heat treatment, the average particle size of the emulsion was significantly decreased by (9.16 -136.15 nm)(P < 0.05), and the absolute potential of the emulsion was significantly increased by (4.28 -8.60 mV)(P < 0.05). There was no obvious delamination and flocculation in the emulsion after 28 days of storage at 4℃. In comparison, after heating at 70℃for 30 min, the particle size of emulsion decreased to (507.21±7.98) nm, the surface net charge and viscosity of emulsion reached the maximum, the droplets were small and evenly distributed, and the emulsion had the best stability.【Conclusion 】As a result of heat treatment, the surface net charge and viscosity of the emulsion droplets increased, the steric resistance of the interfacial proteins increased, and it was difficult to aggregate. The particle size of the droplets was small and evenly distributed, and the stability of the emulsion increased. The TPI emulsion heated at 70℃for 30 min had the best stability. Key words: tilapia protein isolate; emulsion; heat treatment; stability 乳液一般由连续相、分散相和乳化剂三部分组 成,是两种互不相溶的液体混合,需要借助乳化剂 形成均匀的分散体 [1]。蛋白质对环境污染小,可再 生且具有表面活性,一般作为可食用乳化剂广泛应 用在食品加工中 [2]。常用的蛋白质乳化剂主要包括 乳蛋白 [3-4]和植物蛋白 [5-6]。与陆地植物蛋白和乳蛋 白相比,鱼类蛋白具有必需氨基酸种类齐全、比例 均衡、消化吸收率高等优点 [7]。有研究表明,鱼类 蛋白能够阻止油滴絮凝和抑制乳液脂质氧化,可作 为一种潜在的乳化剂 [8]。目前对罗非鱼 (Oreochromis niloticus )的研究主要集中在鱼片冷 冻贮藏 [9]和干燥 [10]、蛋白的提取和性质改善 [11]以及 鱼糜凝胶特性 [12]等方面,其分离蛋白作为乳化剂在 实际应用中极少,主要与罗非鱼分离蛋白分子量 大、溶解度较低以及稳定性差、加工贮藏过程中极 易发生变性 [13]有关。 蛋白质乳液稳定性受多种 pH 值、离子强度和 加工条件等 [14]因素影响。热处理是食品加工过程必 不可少的手段,中性条件下的食品乳液必须经过热 处理,才能获得相应的保质期 [15]。研究表明,热处 理能诱导蛋白质分子具有更灵活的界面构象和较 高的游离巯基基团 [16]。30℃和 50℃热处理使大豆 油脂体乳液表面蛋白分子部分疏水性基团暴露,提 高油脂体表面蛋白在油 -水界面的吸附,增加乳液的 界面强度 [17]。Ma 等 [2]发现热处理能促进鳕(Gadus macrocephalus )鱼蛋白的界面吸附,使乳液粒径减 小,乳化性能改善。周春霞等 [11]通过添加十二烷基 硫酸钠,发现静电和疏水相互作用结合导致肌球蛋 白纤丝解离,可改善低离子强度下肌球蛋白的热聚 集。刘慧清 [18]发现,罗非鱼分离蛋白(tilapia protein isolate ,TPI )在碱性条件下也可以乳化花生油制备 稳定的乳液。目前国内外尚没有关于热处理是否可 以改善 TPI 乳液稳定性的相关报道。因此,本研究 以 TPI 为乳化剂,通过高压均质制备 O/W 型 TPI 乳液,探讨热处理(60 ~ 90 ℃,30 min )对乳液稳 定性的影响,为制备稳定的鱼蛋白乳液及热处理在 乳液食品体系中的应用提供参考。 1 材料与方法 1.1 材料 1.1.1 主要的实验材料 罗非鱼,湛江东风市场;玉米油,益海嘉里有限公司;尼罗红,上海麦克林 生化科技有限公司;尼罗蓝,SIGMA 试剂公司;其他试剂均为国产分析纯。 1.1.2 主要仪器设备 AvantiJ-26sxp 落地高速冷 冻离心机:美国 Beckman 公司;VAP-450自动凯氏 定氮仪:德国 Gerhardf 公司;ALPHA1-2LDplus 冷冻干燥机 :德国 Martin Christ Gefriertrocknungsanlagen 公司;高压纳米均质机:加拿大 ATS 仪器公司;DF-101S 恒温水浴锅:河南 省予华仪器有限公司;NanoBrookOmni 激光粒度 及 zeta 电位仪:美国布鲁克海文仪器公司;MARSIII 模块化高级流变仪:Thermo 仪器公司;FV3000激 光扫描共聚焦显微镜:奥林巴斯仪器公司。 1.2 方法 1.2.1 TPI 的提取 取鲜活罗非鱼背部白肉绞碎,按照质量比 1∶9与冰蒸馏水混合,用匀浆机搅拌 3 min ,用 1 mol/L NaOH 调节 pH 值至 11.0,磁力搅 拌提取 15 min 后离心(10 000 r/min 、20 min 、4 ℃)。将离心后的上清液通过 8层纱布过滤,过滤后的滤 液用 1 mol/L HCl 调节过滤液 pH 值至 5.5,再离心 (10 000 r/min 、20 min 、4 ℃)。用冰蒸馏水分散 离心所得的蛋白沉淀,pH 值调至 7.0,透析后冷冻 干燥成蛋白粉末备用。参考 GB5009.5-2016测 TPI 的粗蛋白质质量分数为(96.05±0.76)%。 1.2.2 乳液的制备 将 TPI 粉末分散到冰蒸馏水中 配制质量分数为 1.0%的溶液,冰水浴下用磁力搅拌 器搅拌 2 h 使之完全溶解,调整 TPI 溶液的 pH 为 7.0。将 TPI 蛋白溶液与玉米油按质量比 9∶1比例 混合,12 000 r/min 高速剪切 2 min 获得粗乳液。粗 乳液于 60 MPa 、4℃高压均质 5次获得细乳液。新 制备的乳液分别置于 60、70、80、90℃的水浴锅,放进水浴锅后计时加热 30 min ,冷却至室温,对照 组不加热,所有样品储藏存于 4℃进行乳液稳定性 测定。 1.2.3 粒径和电位的测定 将新鲜制备的乳液稀 释 300倍避免多重散射,利用激光粒度及 zeta 电位 仪测定不同温度处理后乳液的粒径和电位。TPI 乳 液于 4℃贮藏 28 d ,每 7 d 取样测定其平均粒径。 1.2.4 黏度的测定 取 2 mLTPI 乳液于间隔为 1mm 、探头型号 P35TiL 、直径 60 mm 的平行板上,温度设定在 25 ℃,测定 0.1 ~ 100 s-1的剪切速率对 乳液的黏度影响,记录乳液的初始黏度。 1.2.5 乳析指数的测定 乳析指数是一个直观反 映乳液稳定性和蛋白质乳化能力的参数。根据 Surh 等 [19]的方法略有改动测定 TPI 乳液的乳析指数。将 乳液密封于 50 mL 玻璃瓶中(内径 2.5 cm ,高度 6.0cm ),4℃保存。测定乳液储存 28 d 的乳析情况和 实物图拍照。记录乳液析出清液层的高度(H s )和 乳液总高度(H t ),乳析指数(CI )计算公式如下: CI (%)= H s / H t 。 1.2.6 微观结构的测定 参考 Liu 等 [20]的方法进行 测定。分别取不同热处理的 TPI 乳液 30 μL 于离心 管中,同时加入 10 μL 质量分数 0.1%的尼罗红染 液(甲醇溶解)和 10 μL 质量分数 1%尼罗蓝染液 (蒸馏水溶解),在暗处反应 15 min 后取 10 μL 混 合液于载玻片上,盖上盖玻片,利用激光扫描共聚 焦显微镜在 100 ×油镜下观察,拍照分辨率为 1 024× 1 024。尼罗蓝染料对蛋白质进行染色(在激发波 长为 633 nm 和检测波长 618 ~ 710 nm 发射波长的 激光下)观察,尼罗红染料对油滴进行染色(在激 发波长 488 nm 和检测波长 580 ~ 620 nm 下)观察。 1.3 数据统计分析 实验重复 3次,结果以平均值±标准差表示。数据使用 Origin9.0软件作图,数据间的显著性差 异采用 SPSSStatistics24.0软件进行方差分析 (ANOVA ),并且通过 Duncan 法检验平均值间的 显著性,显著性水平 α = 0.05。 2 结果与讨论 2.1 热处理对 TPI 乳液电位和黏度的影响 由表 1可知,未经热处理的 TPI 乳液表面电位 值为(-18.55±1.26)mV ,经热处理后,TPI 乳液 带负电荷不变且电位的绝对值均显著增加(P <0.05)。随着加热温度的升高,乳液表面电荷绝对值 呈先增加后减少的趋势,经 70℃热处理的 TPI 乳 液电位绝对值最大。这可能是因为乳液经热处理后 油 -水界面的蛋白质分子结构展开,分子内部带电基 团和氨基酸残基暴露 [16],界面蛋白质的表面净电荷 增加。乳液界面蛋白电荷量的增加,液滴之间的静 电斥力增加 [21],从而防止液滴聚集,形成更稳定的 乳液体系。ZHAO 等 [22]发现,谷蛋白经 100℃加热 60 min 后,蛋白质表面净电荷增大,蛋白聚集体柔 性增加,与本研究结果一致。Zeta 电位是表征蛋白 质表面电荷量,与油滴间的静电排斥力和相互吸引 力有关,可作为乳液体系潜在稳定性的指标 [23]。乳 液的稳定性与水油界面处蛋白膜的柔性有关,疏水 性和带电性氨基酸的暴露提高蛋白质分子的柔性,进而影响蛋白质的功能性质 [24]。 表 1 热处理对 TPI 乳液黏度的影响 Table 1 Effect of heat treatment on viscosity of TPI emulsion 组别 电位 黏度 Groups Potential /mV Viscosity /(Pa·s) 4 ℃ -18.55±1.26d 7.86±1.08c 60 ℃,30 min -25.47±0.20b 10.28±0.78c 70 ℃,30 min -27.10±0.39a 37.47±1.64a 80 ℃,30 min -24.78±1.02b 22.35±2.835b 90 ℃,30 min -22.78±1.03c 20.68±0.98b 注:同列数据凡含有一个相同字母即为差异无统计学意义(P > 0.05) Note :The data in the same column with a same letter indicat not significant difference (P > 0.05) 加热处理后 TPI 乳液黏度显著增强(P < 0.05), 其中 70℃热处理的乳液表面净电荷最高,对应的 黏度最大。表 1表明黏度和 zeta 电位在某种程度上 具有一定的相关性,通过皮尔逊相关性的分析,黏 度和电位的相关性系数值为 0.666,较高的静电排 斥力对液体流动的阻力更大 [20]。乳液油水界面黏度 与液滴发生絮凝时间相关,界面黏度越大,界面强 度越大 [25],形成的乳液也越稳定。热处理导致 TPI 中肌球蛋白的螺旋结构解开,尾部丝状交联形成小 聚集体 [2],界面蛋白紧密结合,在油滴表面形成蛋 白膜,油水界面处蛋白质的相互作用增加乳液的黏 度 [26]。其次热处理会使界面蛋白分子部分疏水性基 团暴露 [27],油滴与蛋白质之间的结合作用强,界面 处的蛋白质分子之间或蛋白质与油滴之间的疏水 相互作用结合稳定,在剪切力的作用下仍然具有很 高的黏度。 2.2 热处理对 TPI 乳液粒径的影响 对 TPI 乳液热处理后其乳液粒径的变化如图 1所示。未经热处理的 TPI 乳液的初始粒径为(643.36±38.53)nm ,60 ~ 80℃热处理后 TPI 乳液的初始 粒径显著性减小(P < 0.05),其中 70 ℃热处理 30min 后的 TPI 乳液的粒径最小(507.21±7.98)nm 。这可能是因为一方面加热过程中,疏松的乳液聚集 体被分散为更小的液滴,加上液滴表面净电荷增 加,液滴在静电斥力的作用下不易聚集 [28];另一方 面热处理使蛋白质发生亚基的解离和分子的伸展,将原来被掩盖的一些非极性基团暴露在界面,疏水 性增加,界面张力减小,蛋白质与油滴结合作用增 强,乳液液滴粒径减小,稳定性增强 [17]。乳液液滴 大小影响乳液的絮凝和聚集,液滴越小,聚集和絮 凝越慢,乳液分层所需时间越长 [29]。而 90℃处理 后乳液粒径减小不明显(P > 0.05),可能是因为当 温度达 90℃后,氨基酸残基与其他分子通过氢键 和二硫键作用形成聚集体 [30]。4℃条件下,未经热 处理的 TPI 乳液贮藏 7 d 粒径迅速增大(P < 0.05),之后粒径变化不明显,这是因为对照组乳液初始粒 径较大,液滴在重力作用和布朗运动作用下聚集速 度快 [14]。热处理后的乳液在储藏过程中粒径缓慢增 加,70℃加热的 TPI 乳液粒径变化最小,可能是 乳液加热后黏度增加,以致液滴的空间位阻增大,降低了碰撞频率。其中 70℃热处理的 TPI 乳液黏 度最大,液滴聚集速度慢,说明乳液稳定性最好。 2.3 热处理对 TPI 乳液乳析指数的影响 图 2和图 3分别是热处理后 TPI 乳液 4 ℃静置 凡含一个相同字母则差异无统计学意义(P > 0.05),大写字母表示同一 热处理的乳液在不同贮藏时间点间的比较,小写字母表示相同贮藏时间 下不同热处理组间的比较 The difference between data with one same letter or no letter was not statistically significant (P > 0.05), and capital letters denote the comparison between storage time points at a same heat treatment, and lowercase letters between heat treatments at a same storage time points 图 1 热处理对 TPI 乳液粒径的影响 Fig. 1 Effect of heat treatment on the particle size of TPI emulsion 图 2 热处理对 TPI 乳液乳析指数的影响 Fig. 2 Effect of heat treatment on creaming index of TPI emulsion 28 d 的乳析指数和直观图。由图可知,未经热处理 的 TPI 乳液贮藏至 5 d 出现乳液析出现象,7 d 底部 明显析出水层,28d 乳液乳析指数达(16.11±1.28)%,说明乳液不稳定。乳液中油滴和水相发 生相分离的快慢与液滴大小和液滴发生聚集的速 度有关 [32]。较大颗粒的液滴比较小的液滴移动更 快,发生聚集的现象就越明显,因此对照组的乳液 粒径大,液滴易聚集,从而出现分层现象。乳液分 层是由两相密度差异引起的,较大的油滴向上移动 以致乳液底部析出水层,乳析指数高代表乳液稳定 性差 [31]。60 ~ 90℃热处理的 TPI 乳液储存 28 d 仍 保持稳定,无分层现象。可能是因为乳液加热后黏 度增加,以致液滴的空间位阻增大,降低了碰撞频 率。其中 70℃热处理的 TPI 乳液黏度最大,液滴 聚集慢,另一方面也可能是因为液滴表面带同种电 荷数量增加,液滴之间的静电斥力增加,减少相互 聚集。此结果再一次证明,热处理能够改善 TPI 乳 液的稳定性,延长乳液的贮藏期。 图 3 TPI 乳液贮藏过程直观显示 Fig. 3 Visual appearance of TPI emulsion during storage 2.4 热处理对乳液微观结构的影响 热处理对乳液微观结构的影响如图 4所示。TPI 乳液的蛋白质经尼罗蓝染料染色后呈绿色,油滴经 尼罗红染料染色后呈红色。乳液液滴基本是呈现球 图 4 热处理对 TPI 乳液微观结构的影响 Fig. 4 Effect of heat treatment on microstructure of TPI emulsion 状,且蛋白质成功包裹在油滴外部。未经热处理的 TPI 乳液液滴聚结,颗粒较大且不规则。乳液的絮 凝和聚集速率与油滴的分布情况和大小有关,可通 过光共聚焦对其微观结构进行观察 [2]。60℃和 70℃热处理 30 min 后明显看出 TPI 液滴粒径减小 且分布均匀,而 80℃和 90℃热处理后乳液部分 液滴又发生聚结和絮凝。这个结果与粒径随着热处 理温度的增加,乳液粒径先减小后增大的结果一 致,说明一定程度的热处理可能导致乳液油 -水界面 的张力下降,促进更小的液滴产生,液滴的表面增 加,乳液黏度增大。同时,乳液表面净电荷增加,液滴之间净电斥力增大,液滴不易聚集。而当加热 温度过高时,乳液失去抗聚结的能力,蛋白结构过 度展开而聚结成大颗粒 [33]。热处理温度过高导致乳 液液滴之间相互作用形成的聚集体比未经热处理 的乳液聚集体更加稳定,因此 80℃和 90℃热处 理的乳液贮藏过程未发生分层。综上,热处理能够 改善 TPI 乳液的储存稳定性。 3 结论 热处理(60、70、80、90 ℃加热 30 min )过 程中界面蛋白结构展开,内部基团暴露,分子之间 相互作用增强,乳液的表面净电荷和黏度显著增大 (P < 0.05),延缓液滴的絮凝和聚结以及延长乳液 贮藏时间。其中,TPI 乳液经 70℃加热 30 min 效 果最佳,乳液粒径最小为(507.21±7.98)nm ,激 光共聚焦显微镜下观察乳液液滴较小且分布均匀,乳液稳定性好且贮藏 28 d 未分层。热处理能够有效 改善 TPI 乳液的稳定性,控制温度可改变乳液的粒 径和黏度。 参考文献 [1] SHARIF H R, WILLIAMS P A, SHARIF M K, et al. Current progress in the utilization of native and modified legume proteins as emulsifiers and encapsulants – A review[J]. Food Hydrocolloids, 2018, 76: 2-16. [2] MA W C, WANG J M, WU D, et al. Effects of preheat treatment on the physicochemical and interfacial properties of cod proteins and its relation to the stability of subsequent emulsions[J]. Food Hydrocolloids, 2021,112: 106338. [3] HUM,XIE FY,ZHANGS,etal. Homogenization pressureandsoybeanproteinconcentrationimpactthe stability of perilla oil nanoemulsions[J]. Food Hydrocolloids, 2020, 101: 105575. [4] ZANG Z H, CHOU S R, TIAN J L, et al. Effect of whey protein isolate on the stability and antioxidant capacity of blueberry anthocyanins: a mechanistic and in vitro simulation study[J]. Food Chemistry, 2021, 336: 127700. [5] AMAGLIANI L, BEN SASSI E, BUCZKOWSKI J, et al. Influence of protein source on the morphology, physicochemical and flow properties of protein-based emulsion particles to be used as texture modulators[J]. Food Hydrocolloids, 2020, 101: 105581. [6] CHEN W Y, JU X R, ALUKO R E, et al. Rice bran protein-based nanoemulsion carrier for improving stability and bioavailability of quercetin[J]. Food Hydrocolloids, 2020, 108: 106042. [7] KARAPANAGIOTIDIS I T. Nutrient profiles of tilapia[M]//Tilapia in Intensive Co-culture. Chichester, UK: John Wiley & Sons, Ltd, 2016: 261-305. [8] CHALAMAIAH M, DINESH KUMAR B, HEMALATHA R, et al. Fish protein hydrolysates:Proximate composition, amino acid composition, antioxidant activities and applications: a review[J]. Food Chemistry, 2012, 135(4): 3020-3038. [9] 王俏仪 ,董强 ,卢水仙 ,等 .冷冻贮藏对罗非鱼肌肉质 构特性的影响 [J].广东海洋大学学报 ,2011, 31(4):86-90. [10] 薛广 ,李敏 ,关志强 ,等 .基于低场核磁共振的罗非 鱼片微波真空干燥过程水分变化规律 [J].广东海洋大 学学报 , 2020, 40(6): 123-129. [11] 周春霞 ,冯瑞 ,李婷 ,等 .低盐条件下 SDS 对罗非鱼 肌球蛋白热聚集的抑制及其机理 [J].广东海洋大学学 报 , 2020, 40(4): 82-89. [12] 高宇 ,毕保良 ,孔令富 ,等 .低温交联时间对酸诱导 罗非鱼碎肉鱼糜凝胶特性的影响 [J].食品工业科技 ,2020, 41(10): 26-31. [13] 刘诗长 ,周春霞 ,洪鹏志 ,等 .罗非鱼肉分离蛋白的 营养成分分析 [J].现代食品科技 ,2011, 27(7):843-846. [14] DAMODARANS,PARKINKL,FENNEMAOR. Fennema's food chemistry, Fifth Edition[M]. Taylor and Francis, 2017. [15] LIANG Y C, MATIA-MERINO L, GILLIES G, et al. The heat stability of milk protein-stabilized oil-in-water emulsions: a review[J]. Current Opinion in Colloid &Interface Science, 2017, 28: 63-73. [16] WANG J M, XIA N, YANG X Q, et al. Adsorption and dilatational rheology of heat-treated soy protein at the oil-water interface: relationship to structural properties[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3302-3310. [17] 丁俭 ,张巧智 ,韩天翔 ,等 .热处理对大豆油脂体乳 液特性的影响 [J].食品科学 , 2016, 37(19): 8-14. [18] 刘慧清 .罗非鱼蛋白乳化特性的研究 [D].湛江 :广东 海洋大学 , 2013. [19] SURH J, DECKER E A, MCCLEMENTS D J. Influence ofpHandpectintypeonpropertiesandstabilityof sodium-caseinate stabilized oil-in-water emulsions[J]. Food Hydrocolloids, 2006, 20(5): 607-618. [20] LIU C H, WANG R C, HE S H, et al. The stability and gastro-intestinal digestion of curcumin emulsion stabilized with soybean oil bodies[J]. LWT, 2020, 131:109663. [21] 李季楠 ,胡浩 ,吴雪娇 ,等 .环境因素对叶黄素纳米 乳液稳定性及其抗氧化活性的影响 [J].食品科学 ,2019, 40(19): 32-39. [22] ZHAO M, XIONG W F, CHEN B X, et al. Enhancing the solubility and foam ability of rice glutelin by heat treatment at pH12: Insight into protein structure[J]. Food Hydrocolloids, 2020, 103: 105626. [23] SUI X N, BI S, QI B K, et al. Impact of ultrasonic treatment on an emulsion system stabilized with soybean protein isolate and lecithin: Its emulsifying property and emulsion stability[J]. Food Hydrocolloids, 2017, 63:727-734. [24] 朱颖 ,赵思明 ,王冬梅 ,等 .乳液中柔性界面蛋白构 效关系研究 [J].农业机械学报 , 2021, 52(3): 341-349. [25] KUMAR K, NIKOLOV A D, WASAN D T. Mechanisms of stabilization of water-in-crude oil emulsions[J]. Industrial & Engineering Chemistry Research, 2001,40(14): 3009-3014. [26] ZHANG X Y, QI B K, XIE F Y, et al. Emulsion stability and dilatational rheological properties of soy/whey protein isolate complexes at the oil-water interface:Influenceof pH[J]. FoodHydrocolloids, 2021,113:106391. [27] 潘成磊 ,丁景 ,董唯 ,等 .热处理温度对猪肝水溶性 蛋白乳化性质的影响 [J].食品与发酵工业 ,2019,45(16): 82-89. [28] SLIWINSKIEL,ROUBOSPJ,ZOETFD,etal. Effects of heat on physicochemical properties of whey protein-stabilised emulsions[J]. Colloids and Surfaces B:Biointerfaces, 2003, 31(1/2/3/4): 231-242. [29] LI Q, WANG Z G, DAI C X, et al. Physical stability and microstructure of rapeseed protein isolate/gum Arabic stabilized emulsions at alkaline pH[J]. Food Hydrocolloids, 2019, 88: 50-57. [30] SOURDET S, RELKIN P, CÉSAR B. Effects of milk proteintypeandpre-heatingonphysicalstabilityof whipped and frozen emulsions[J]. Colloids and Surfaces B: Biointerfaces, 2003, 31(1/2/3/4): 55-64. [31] MAWC,WANGJM,XUXB,etal.Ultrasound treatment improved the physicochemical characteristics of cod protein and enhanced the stability of oil-in-water emulsion[J].FoodResearchInternational,2019,121:247-256. [32] FLOURY J, DESRUMAUX A, LARDIÈRES J. Effect of high-pressure homogenization on droplet size distributions and rheological properties of model oil-in-wateremulsions[J].InnovativeFoodScience&Emerging Technologies, 2000, 1(2): 127-134. [33] MCCLEMENTS D J. Food emulsions[M]. Boca Raton:CRC Press, 2004. (责任编辑:刘朏)
确定





还剩5页未读,是否继续阅读?
中国格哈特为您提供《罗非鱼分离蛋白TPI中蛋白质含量的检测》,该方案主要用于水产品中营养成分检测,参考标准《GB 5009.5 食品安全国家标准 食品中蛋白质的测定》,《罗非鱼分离蛋白TPI中蛋白质含量的检测》用到的仪器有格哈特全自动凯氏定氮仪VAPODEST 450、格哈特快速干燥仪STL56、格哈特红外加热消解快速消化系统TTs625、格哈特维克松废气实验室废物处理系统涤气VS、凯氏消化管、德国移液器MM、凯氏定氮催化剂5.0g K2SO4+0.5g CuSO4 x 5H2O
相关方案
更多
该厂商其他方案
更多




























