方案详情
文
为满足对蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定,依利特公司,结合 GB
5009.8-2016《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》及《中
国药典》2015 版第一部相关标准,采用示差折光检测器,经氨基色谱柱分离,根据保留时
间定性和峰面积定量,提出了蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定的全套 HPLC
解决方案,包括前处理设备、试剂、前处理方法直至到液相色谱方法。相关人员可参考本实
验中的方法,进行蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的检测。
方案详情

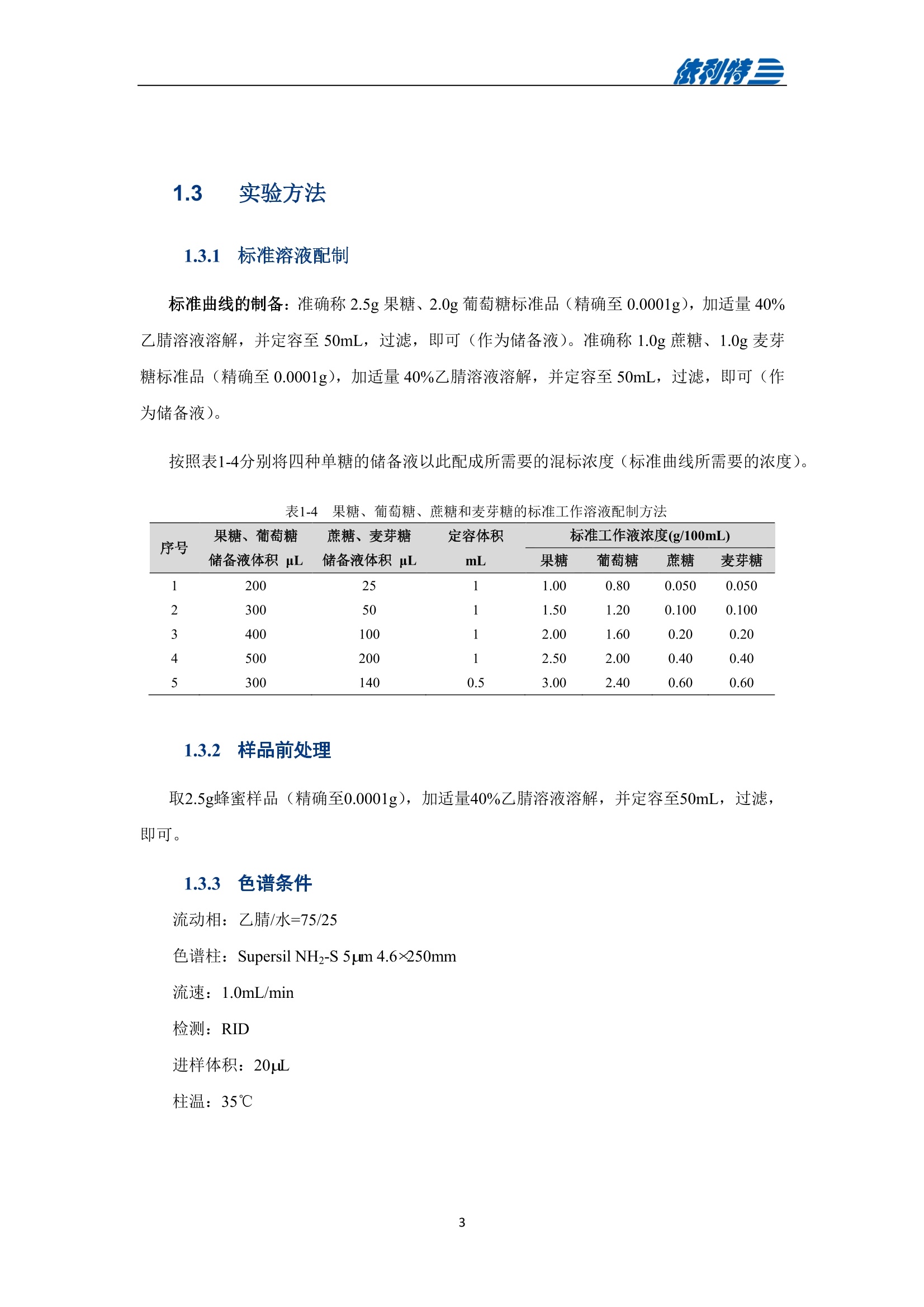
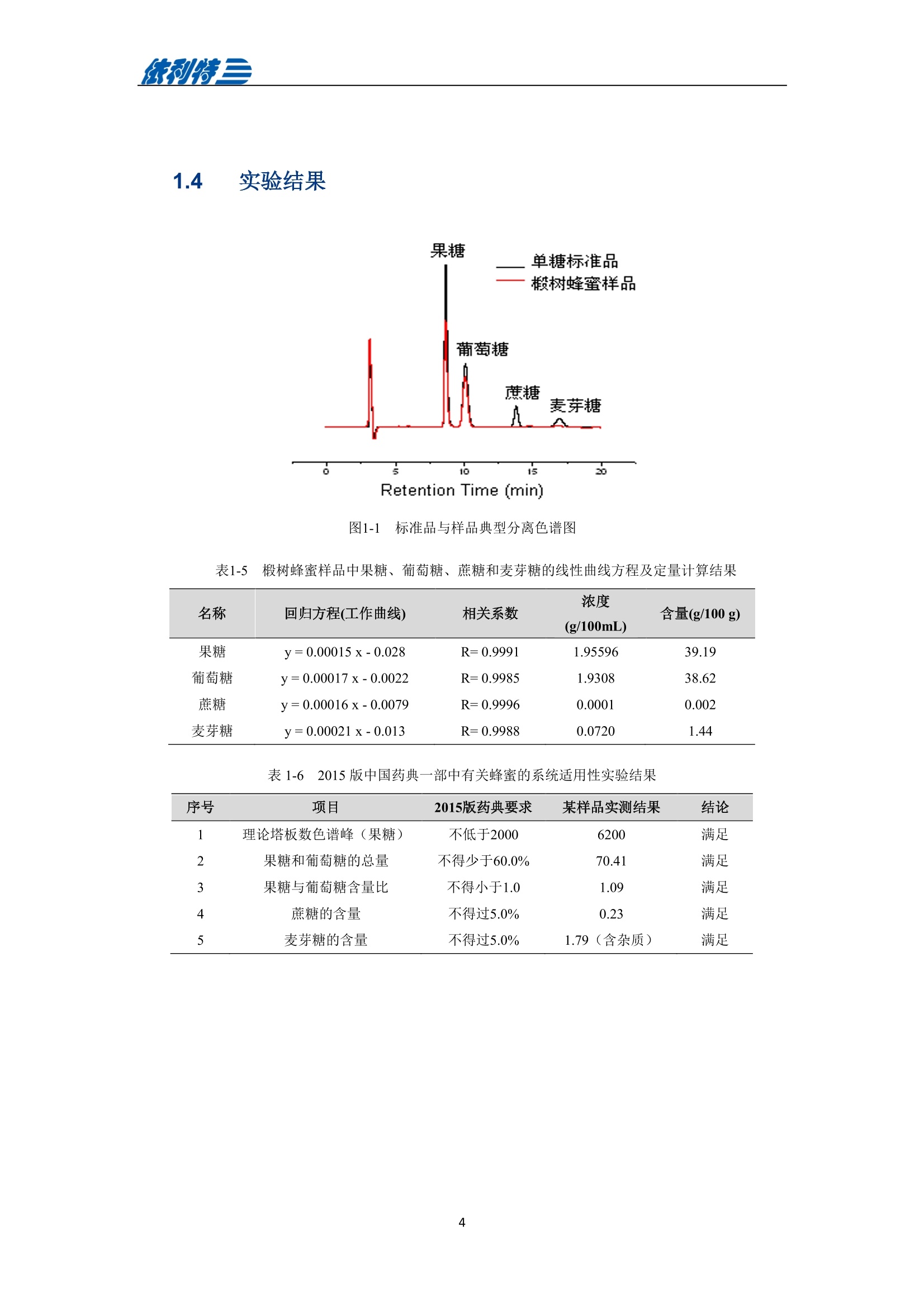
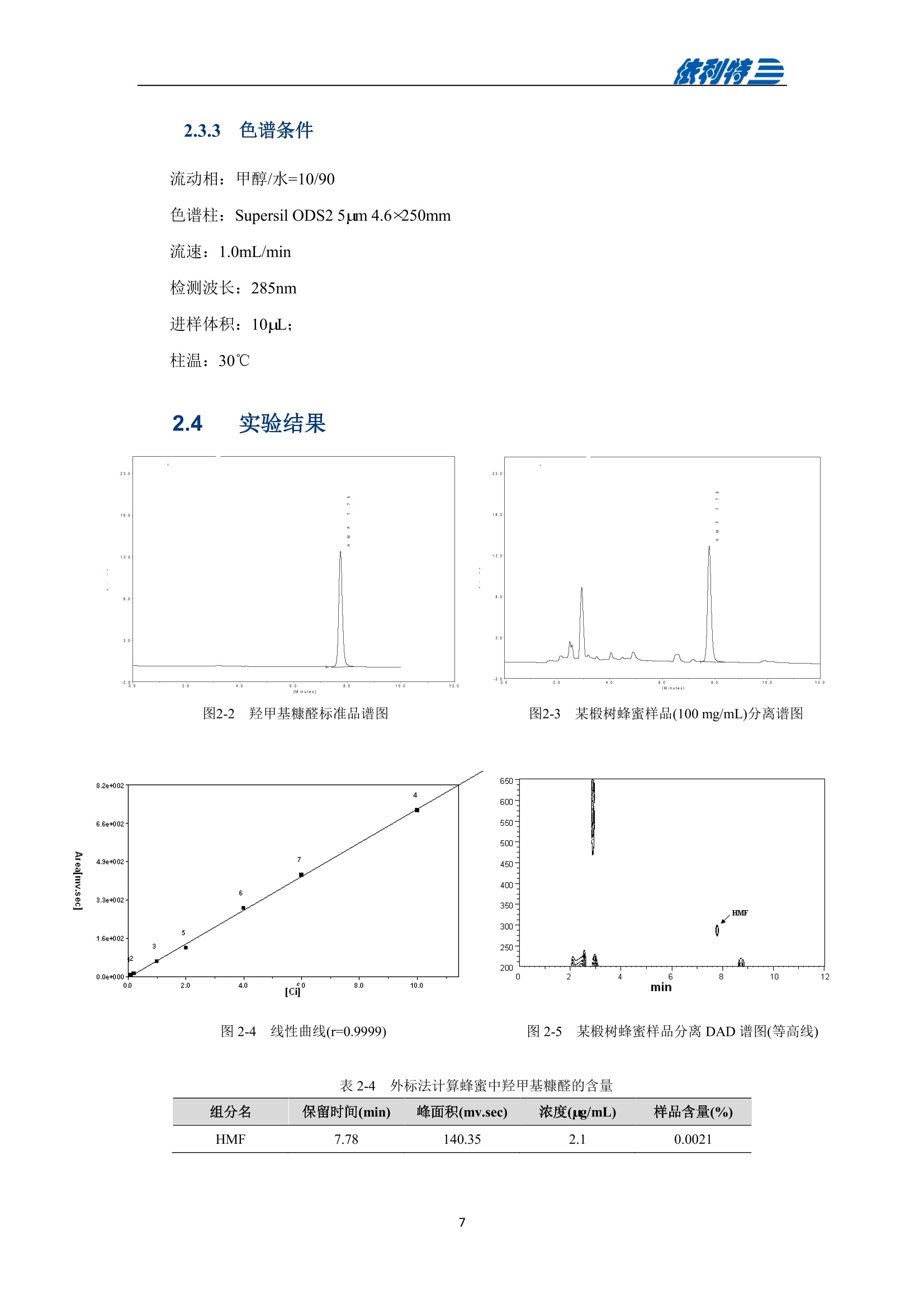
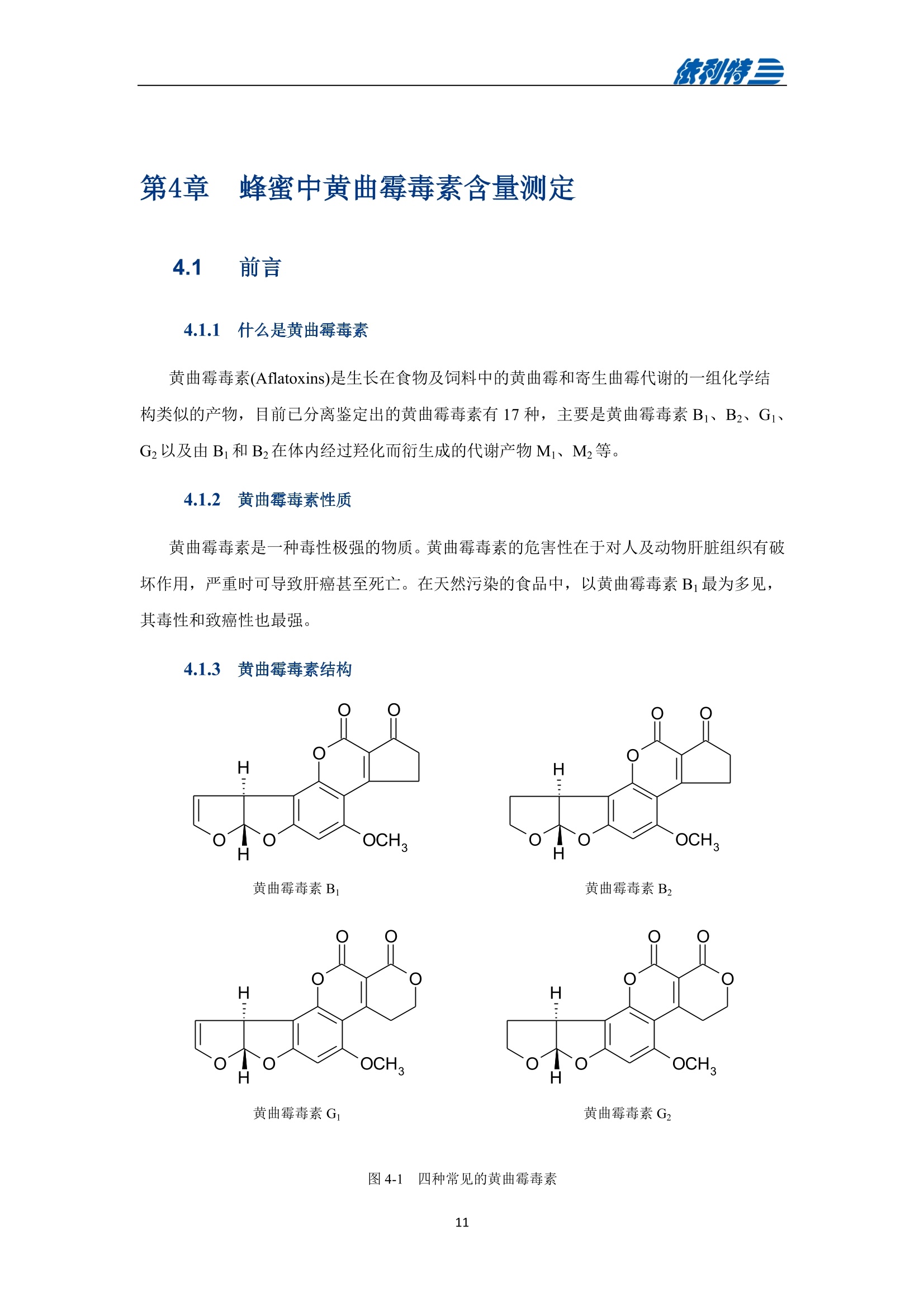
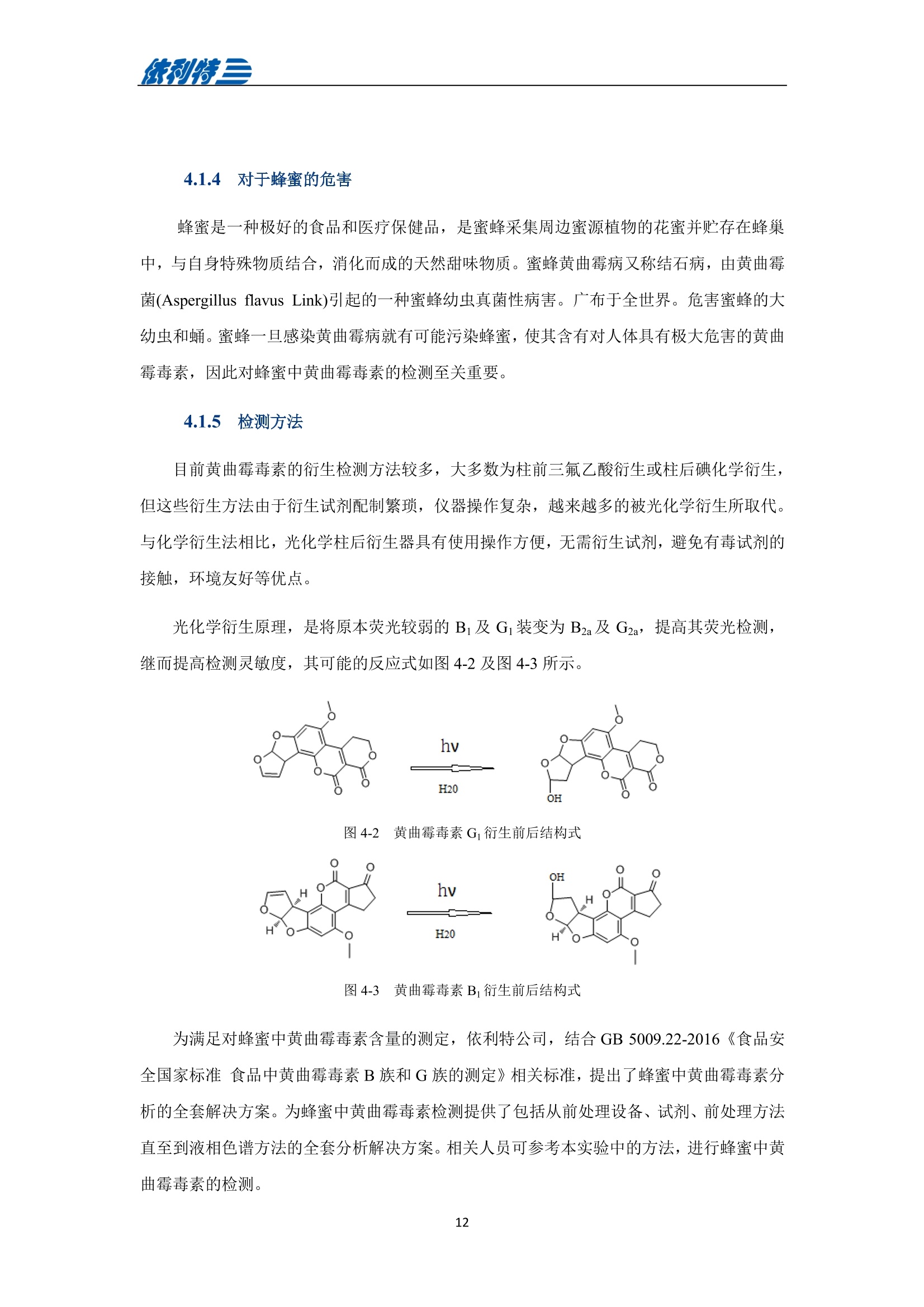
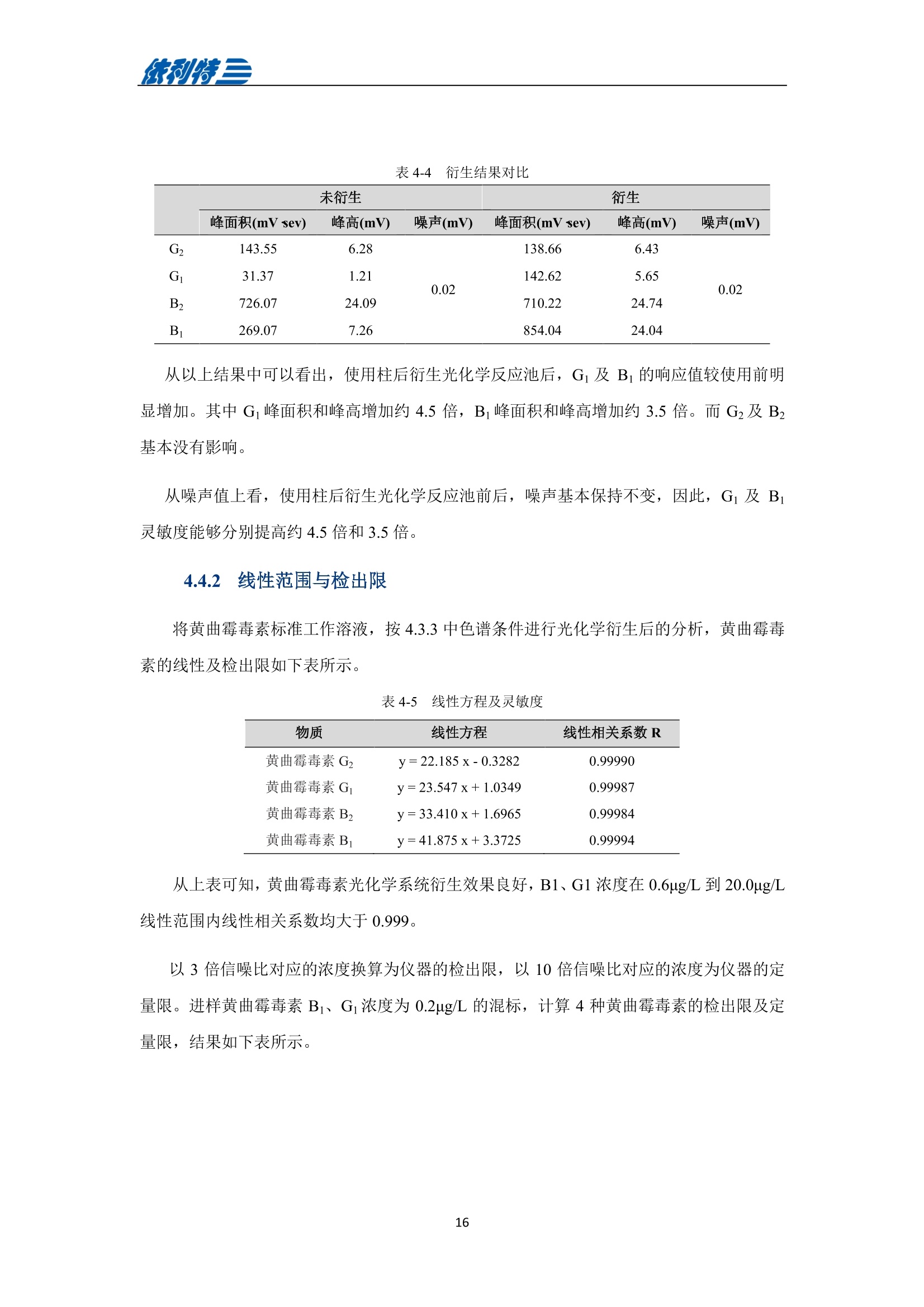
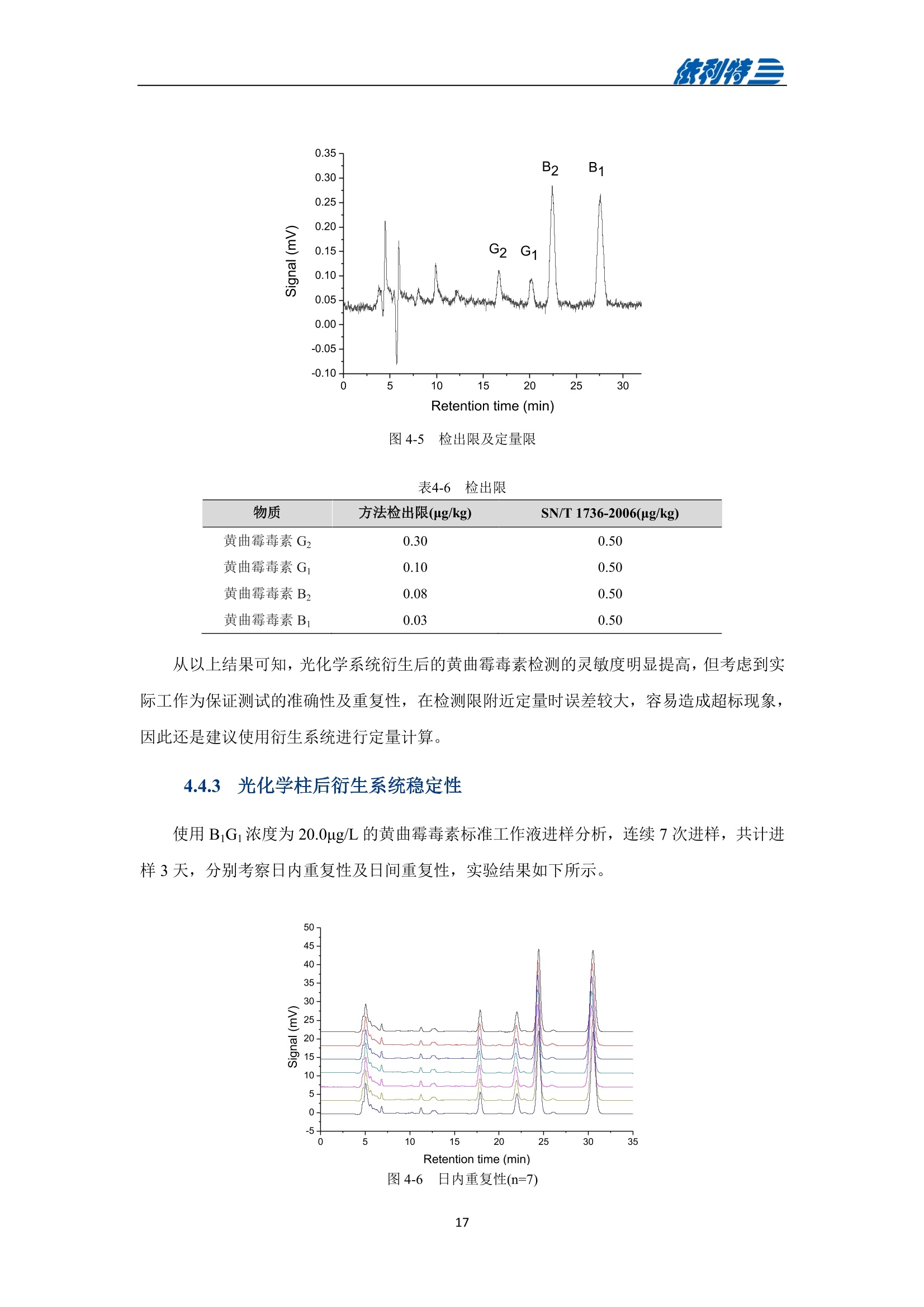
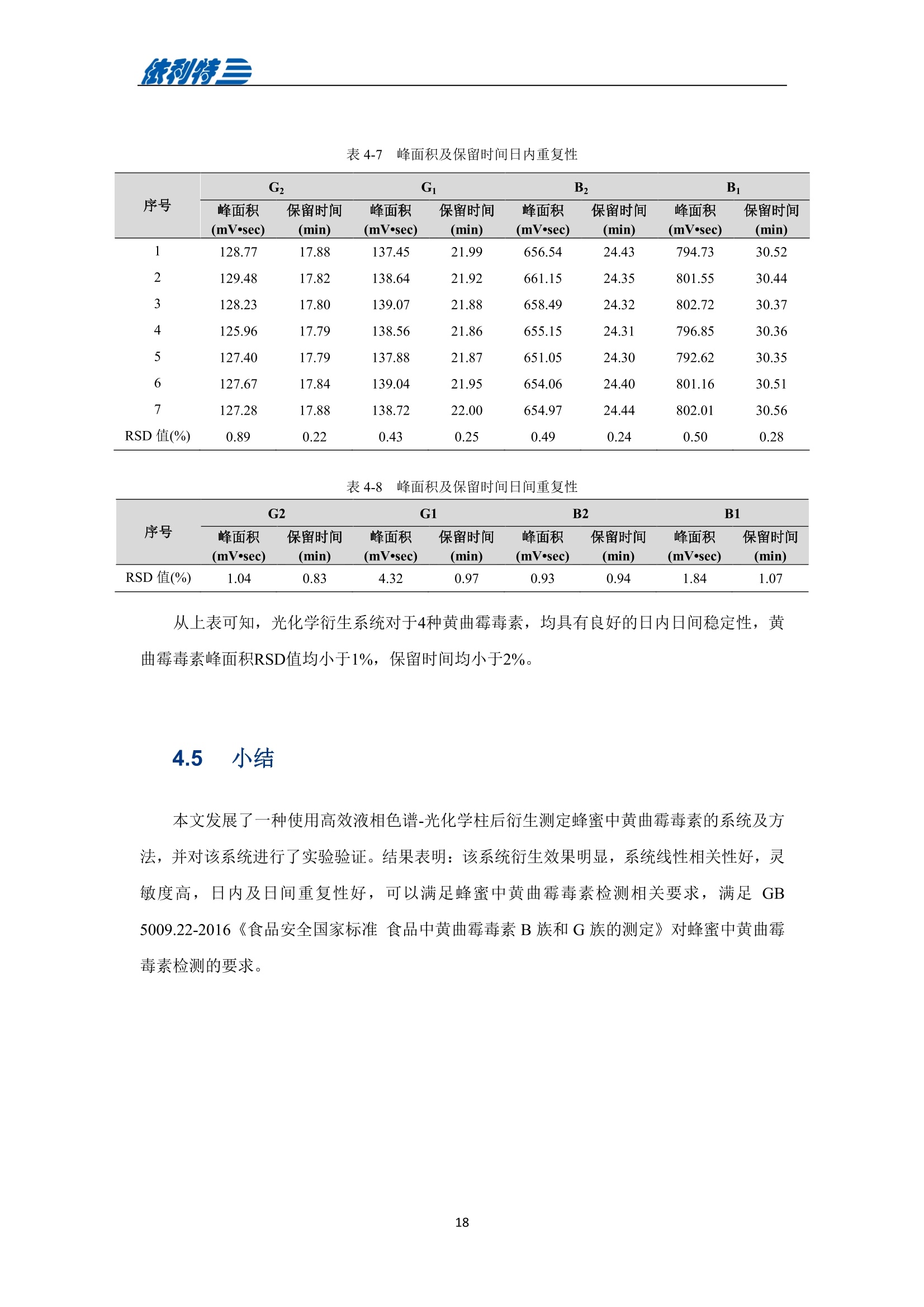
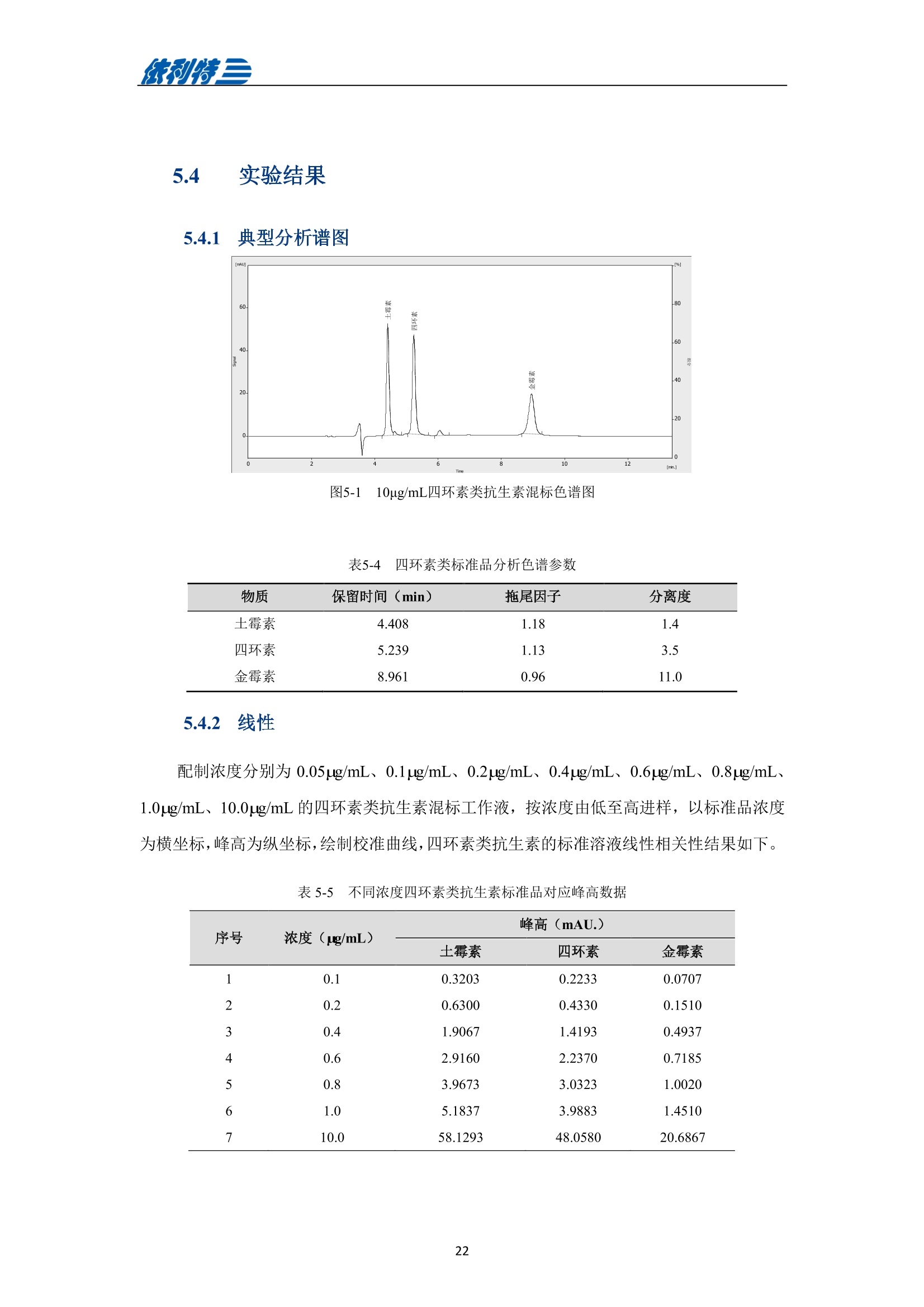
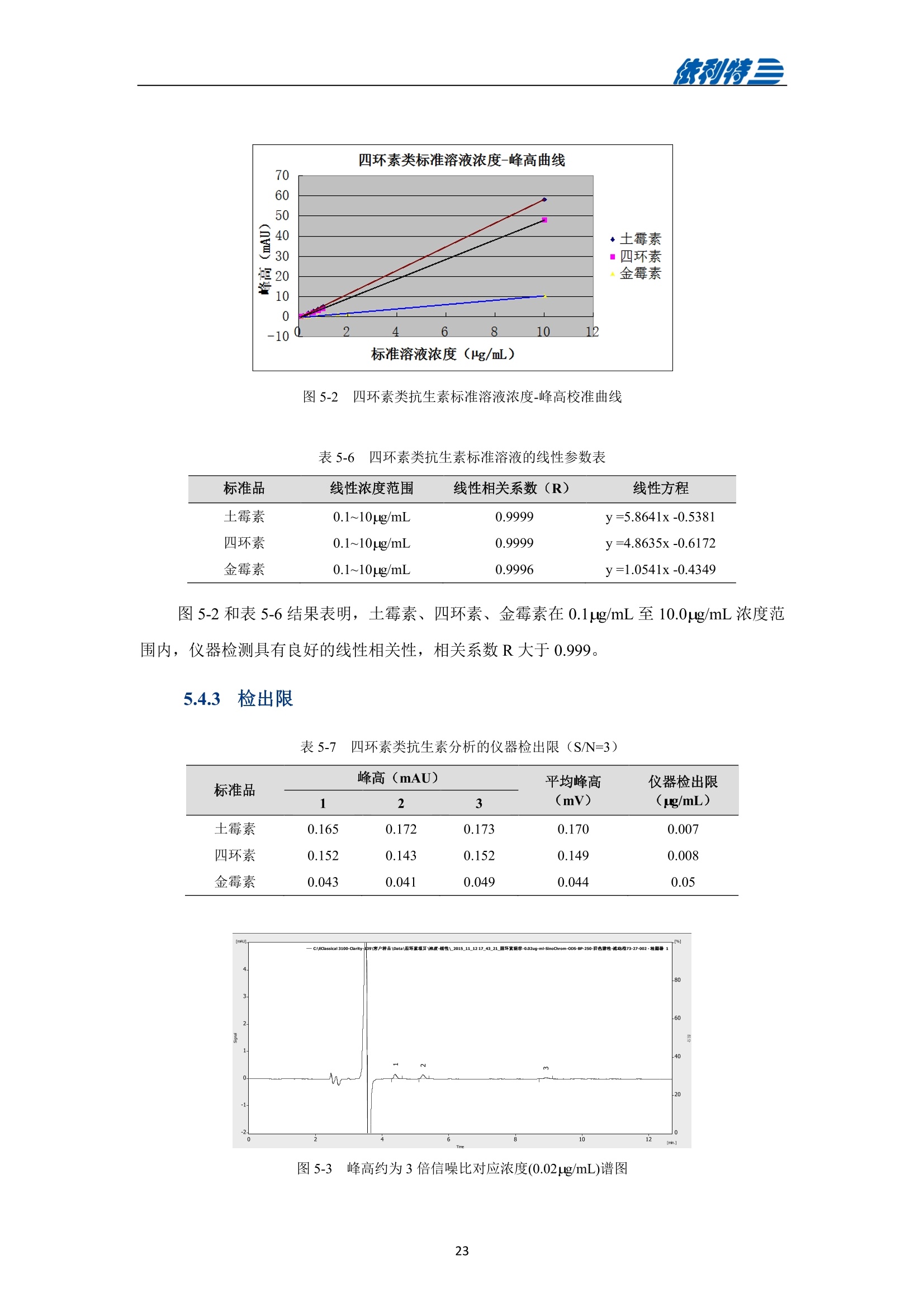
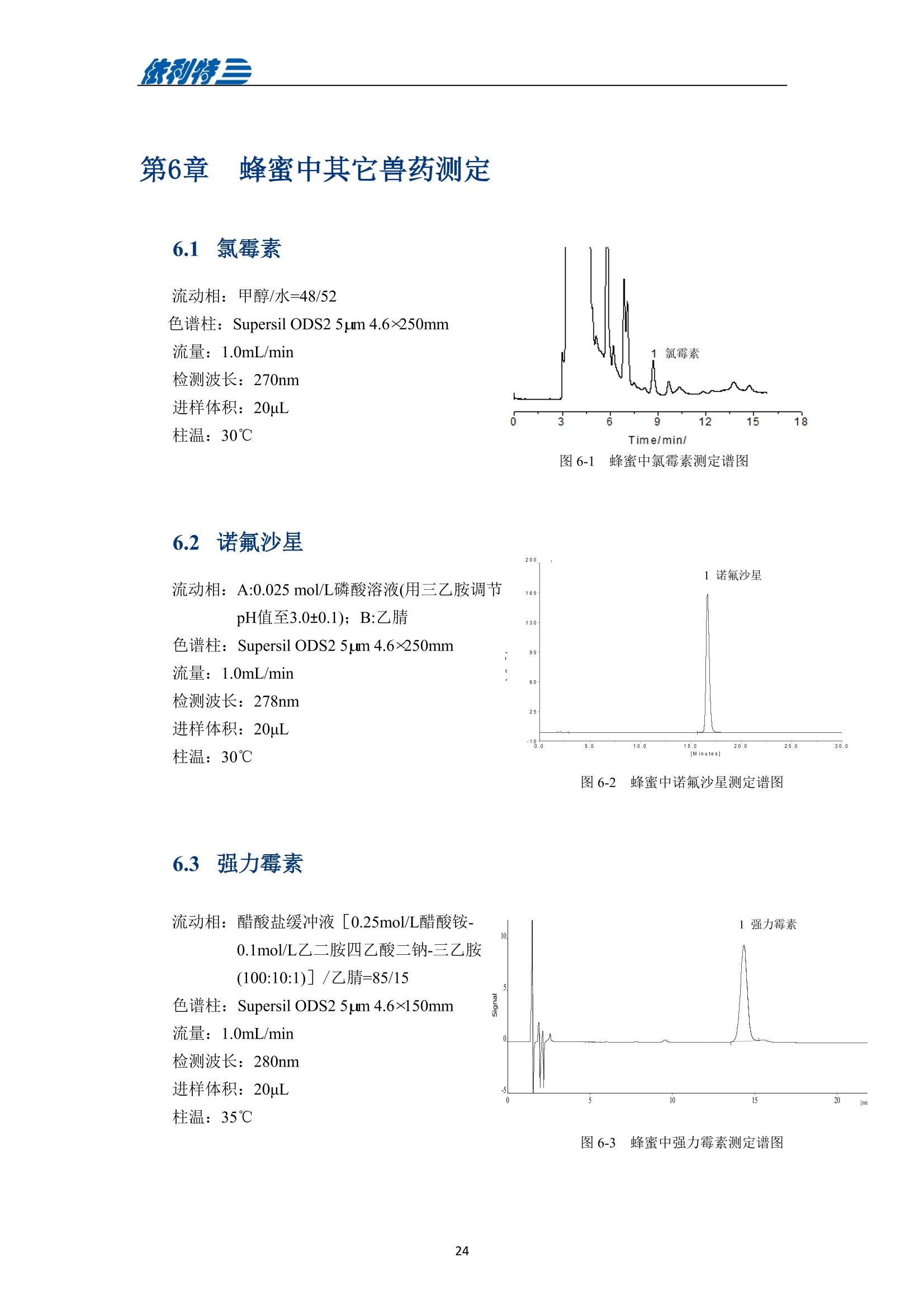
表利特三 依利特三 蜂产品HPLC检测解决方案 ELITE 目录 第1章蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量测定 1.1 前言 1.2 仪器设备与试剂2 1.3 实验方法 3 1.4 实验结果 4 第2章蜂蜜中羟甲基糠醛含量测定 5 2.1 前言 5 2.2 仪器设备与试剂5 2.3 实验方法 6 2.4 实验结果 7 第3章蜂蜜中咖啡因含量测定 8 3.1 前言 8 3.2 仪器设备与试剂9 3.3 实验方法 10 3.4 实验结果 10 第4章蜂蜜中黄曲霉毒素含量测定 11 4.1 前言 11 4.2 仪器设备与试剂13 4.3 实验方法 14 4.4 实验结果 15 4.5 小结 18 第5章蜂蜜中四环素类抗生素含量测定 19 5.1 前言 19 5.2 仪器设备与试剂 19 5.3 实验方法 2 5.4 实验结果 第1章 蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量测定 1.1 前言 随着生活水平的提高,人们的保健意识也越来越强。蜂蜜是一种极好的食品和医疗保健品,是蜜蜂采集周边蜜源植物的花蜜并贮存在蜂巢中,与自身特殊物质结合,消化而成的天然甜味物质。蜂蜜蜜要由碳水化合物(约占总量总3/4)和水分(约占总量的1/4)组成,此外蜂蜜还含有转化酶、过氧化氢酶、淀粉酶、脂酶等蛋白质(酶)、有机酸、芳香物质、挥发油、蜡、色素及一些胶状物等。糖类物质尤其是单糖(葡萄糖和果糖)占碳水化合物的85%-90%,形成了高糖分的饱和溶液。 随着蜂蜜销售的紧俏,一些不法商贩开始人为向蜂蜜中添加水、蔗糖、转化糖、饴糖、羧甲基纤维素、糊精或淀粉类物质以达到以次充好、提高产量的目的。但是假蜂蜜并不具天然蜂蜜的全部营养成分,更不具有天然蜂蜜独特的保健功能。 为满足对蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定,依利特公司,结合 GB5009.8-2016《食品安全国家标准食品中果糖葡萄糖、蔗糖、麦芽糖、乳糖的测定》及《中国药典》2015版第一部相关标准,采用示差折光检测器,经氨基色谱柱分离,根据保留时间定性和峰面积定量,提出了蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定的全套 HPLC解决方案,包括前处理设备、试剂、前处理方法直至到液相色谱方法。相关人员可参考本实验中的方法,进行蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的检测。 表1-1 HPLC系统仪器设备标准配置 序号 名称 数量 1 示差折光检测器 1台 2 P3100高压恒流泵 2台 3 S3100自动进样器(选配) 1台 4 O3100色谱柱恒温箱 1台 5 7725i手动进样阀 1个 6 色谱数据工作站 1套 7 TD-1-15梯度混合器 1个 8 AD适配器 1套 9 TP3100托盘 1台 10 Supersil NH-S 5 um 4.6x250mm色谱柱 1支 表1-2:所需化学试剂 序号 试剂 纯度 1 乙腈 色谱纯 2 去离子水 18.2MQ 3 果糖、葡萄糖、蔗糖、麦芽糖 标准品 表1-3主要样品前处理设备 序号 名称 规格型号 备注 1 溶剂过滤器 1000mL 流动相过滤 2 隔膜真空泵 0.08MPa,160W 流动相过滤, GM-0.33A 3 超声清洗器 3L/6L,40/60KHz, 120W 流动相脱气, AS3120 4 精密电子天平 感量为万分之一 称量 5 溶剂过滤器 1000mL 流动相过滤 实验过程中其它玻璃器皿还包括容量瓶(100mL、50mL、25mL、10mL)、样品瓶(1.5mL)、移液枪(0~1000pL, 0~5000pL)、移液枪枪头(1mL,5mL)、一次性PVC手套、一次性口罩、进样针、滤膜等若干。 1.3 实验方法 1.3.1 标准溶液配制 标准曲线的制备:准确称2.5g果糖、2.0g葡萄糖标准品(精确至0.0001g),加适量40%乙腈溶液溶解,并定容至50mL, 过滤,即可(作为储备液)。准确称1.0g蔗糖、1.0g麦芽糖标准品(精确至0.0001g),加适量40%乙腈溶液溶解,并定容至50mL,过滤,即可(作为储备液)。 按照表1-4分别将四种单糖的储备液以此配成所需要的混标标度(标准曲线所需要的浓度)。 表1-4 果糖、葡萄糖、蔗糖和麦芽糖的标准工作溶液配制方法 序号 果糖、葡萄糖 蔗糖、麦芽糖 定容体积 标准工作液浓度(g/100mL) 储备液体积 uL 储备液体积 pL mL 果糖 葡萄糖 蔗糖 麦芽糖 1 200 25 1 1.00 0.80 0.050 0.050 2 300 50 1 1.50 1.20 0.100 0.100 3 400 100 1 2.00 1.60 0.20 0.20 4 500 200 1 2.50 2.00 0.40 0.40 5 300 140 0.5 3.00 2.40 0.60 0.60 1.3.2样品前处理 取2.5g蜂蜜样品(精确至0.0001g),加适量40%乙腈溶液溶解,并定容至50mL,过滤,即可。 1.3.3色谱条件 流动相:乙腈/水=75/25 色谱柱: Supersil NH2-S 5um 4.6×250mm 流速:1.0mL/min 检测: RID 进样体积:20pL 柱温:35℃ 图1-1 标准品与样品典型分离色谱图 表1-5 椴树蜂蜜样品中果糖、葡萄糖、蔗糖和麦芽糖的线性曲线方程及定量计算结果 名称 回归方程(工作曲线) 相关系数 浓度 含量(g/100 g) (g/100mL) 果糖 y=0.00015x-0.028 R=0.9991 1.95596 39.19 葡萄糖 v=0.00017x-0.0022 R=0.9985 1.9308 38.62 蔗糖 y=0.00016x-0.0079 R=0.9996 0.0001 0.002 麦芽糖 y=0.00021x-0.013 R=0.9988 0.0720 1.44 表1-62015版中国药典一部中有关蜂蜜的系统适用性实验结果 序号 项目 2015版药典要求 某样品实测结果 结论 1 理论塔板数色谱峰(果糖) 不低于2000 6200 满足 2 果糖和葡萄糖的总量 不得少于60.0% 70.41 满足 3 果糖与葡萄糖含量比 不得小于1.0 1.09 满足 4 蔗糖的含量 不得过5.0% 0.23 满足 5 麦芽糖的含量 不得过5.0% 1.79(含杂质) 满足 2.1 前言 蜂蜜中羟甲基糠醛(HMF)含量的多少是决定蜂蜜质量优劣的重要标准,国际贸易中HMF 属于强检指标。HMF 不是蜂蜜中原来就含有的成分,而是后天产生的,当存放时间过长或者加工温度过高,自然产生HMF。 HMF 是黑色的具有难闻气温的有毒物质,它的存在导致蜂蜜风味和颜色的改变,影响其口感和外观。而且HMF 对眼、粘膜或皮肤有刺激性,食之过多会引起中毒。因此蜂蜜中羧甲基糠醛含量的测定非常重要。 图2-1羟甲基糠醛结构式 为满足对蜂蜜中羧甲基糠醛含量的测定,依利特公司,结合 GB 18932.18-2003《蜂蜜中羧甲基糠醛含量的测定方法》及《中国药典》2015版第一部相关标准,采用高效液相色谱-紫外检测法,经反相色谱柱分离,根据保留时间定性和峰面积定量,提出了蜂蜜中羟甲基糠醛含量测定的全套 HPLC 解决方案。相关人员可参考本实验中的方法,进行蜂蜜中羧甲基糠醛含量的检测。 表2-1 HPLC系统仪器系统设备标准配置 序号 名称 数量 UV3100紫外-可见检测器 2 P3100高压恒流泵 3 S3100自动进样器(选配) 4 O3100色谱柱恒温箱 1台 5 7725i手动进样阀 6 色谱数据工作站 7 TD-1-15梯度混合器 8 TP3100托盘 9 Supersil ODS2 5 um 4.6×250mm色谱柱 表2-2 所需化学试剂 序号 试剂 纯度 1 甲醇 色谱纯 2 去离子水 18.2MQ 3 羟甲基糠醛 标准品 表2-3 主要样品前处理设备 序号 名称 规格型号 备注 1 溶剂过滤器 1000mL 流动相过滤 2 隔膜真空泵 0.08MPa, 160W 流动相过滤, GM-0.33A 3 超声清洗器 3L/6L, 40/60KHz, 120W 流动相脱气, AS3120 4 精密电子天平 感量为万分之一 称量 5 溶剂过滤器 1000mL 流动相过滤 实验过程中其它玻璃器皿还包括容量瓶(100mL、50mL、25mL、10mL)、样品瓶(1.5mL)、移液枪(0~1000uL, 0~5000uL)、移液枪枪头(1mL,5mL)、一次性PVC手套、一次性口罩、进样针、滤膜等若干。 2.3 实验方法 2.3.1标准溶液配制 标准储备溶液:准确确取适量的羟甲基糠醛标准物质于100mL容量瓶,约10mL,甲醉溶解,用水稀释至刻度,配成0.20mg/mL的标准储备液。 标准工作溶液:分别吸取适量的羟甲基糠醛标准储备溶液至100mL容量量中,用10%甲醇溶液释稀至刻度,配成0.10ug/mL,0.20ug/mL,1.0ug/mL, 2.0ug/mL,4.0ug/mL, 6.0ug/mL,10ug/ml,标准工作溶液。当天新鲜配制。 2.3.2样品前处理 称取10g试样,精确至0.01g, 置于100mL烧杯中,加人10mL甲醇,用玻璃棒轻轻搅拌均匀,使试样完全溶解。转移至100mL容量瓶中,用水释稀至刻度,充分混匀。过滤,即可。 2.3.3色谱条件 流动相:甲醇/水=10/90 色谱柱: Supersil ODS2 5um 4.6x250mm 流速:.:1.0mL/min 检测波长:285nm 进样体积:10pL; 柱温:30℃ 图2-2羟甲基糠醛标准品谱图 图2-3某椴树蜂蜜样品(100 mg/mL)分离谱图 图2-4线性曲线(r=0.9999) 图2-5某椴树蜂蜜样品分离 DAD 谱图(等高线) 表2-4外标法计算蜂蜜中羟甲基糠醛的含量 组分名 保留时间(min) 峰面积(mv.sec) 浓度(ug/mL) 样品含量(%) HMF 7.78 140.35 2.1 0.0021 第3章 蜂蜜中咖啡因含量测定 3.1 前言 蜂蜜是一种传统的天然保健食品,营养成分十分丰富,主要由碳水化合物(约占总量的3/4)和水分(约占总量的1/4)组成,此外蜂蜜还含有转化酶、过氧化氢酶、淀粉酶、脂酶等蛋白质(酶)、有机酸、芳香物质、挥发油、蜡、色素及一些胶状物等。随着世界各国人们生活水平的提高,对蜂蜜的需求量也不断增加。但鲜为人知的是蜂蜜还可以作为运动营养物。如果作为运动营养物,就要求符合兴奋剂管理的有关规定。在一些科研工作中发现部分蜂蜜中含有咖啡因,咖啡因是一种强有力的中枢神经兴奋剂,可作为食品添加剂使用,但同时咖啡因也是国际奥委会禁用物质中受管制药物之一。 图3-1 咖啡因结构式 为满足对进出口蜂蜜中咖啡因含量的测定,依利特公司结合 SN/T 1354-2004《进出口蜂蜜中咖啡因含量的测定方法》等相关标准,,采用高效液相色谱-紫外检测法,经反相色谱柱分离,根据保留时间定性和外标法定量,提出了蜂蜜中咖啡因含量测定的全套 HPLC 解决方案,包括前处理设备、试剂、前处理方法直至液相色谱方法。相关人员可参考本实验中的方法与结果,进行蜂蜜中咖啡因含量的检测。 表3-1i(iChrom 5100型HPLC系统仪器设备标准配置 序号 名称 数量 1 D5101紫外-可见检测器(选配) 1台 2 P5102高压恒流泵 1台 3 O5100 色谱柱恒温箱 1台 4 Rheodyne 7725i高压六通进样阀 1个 5 VB5101阀支架 1个 6 色谱数据工作站 1套 7 SinoChrom ODS-BP 5um色谱柱 1支 8 5100系统工具包 1套 9 S5101自动进样器(选配) 1台 10 M5101系统组织器 1台 注:或同等配置的其他型号的高效液相色谱仪 表3-2所需化学试剂 序号 试剂 纯度 1 乙腈 色谱纯 2 氢氧化钠 分析纯 3 冰乙酸 分析纯 4 三氯甲烷 分析纯 5 去离子水 18.2MQ 6 咖啡因 标准品 表3-3 主要样品前处理设备 序号 名称 1 离心机 2 旋转蒸发仪 3 氮吹仪 4 漩涡混合器 5 溶剂过滤器 6 隔膜真空泵 7 超声清洗器 8 精密电子天平 实验过程中其它玻璃器皿还包括容量瓶(100mL、50mL、25mL、10mL)、样品瓶(1.5mL)、漏斗、移液枪(0~1000pL,0~5000pL)、移液枪枪头(1mL,5mL)、一次性PVC手套、一次性口罩、进样针、滤膜等若干。 3.3 实验方法 3.3.1 标准溶液配制 标准溶液(1mg/mL):准确称取0.1g(准确至0.0001g)咖啡因标准品,用水溶解并定容至100mL,作为标准储备液。再根据需要用水将标准储备液稀释至适当浓度。 3.3.2样品前处理 准确角取20g(准确至0.01g)试样于50mL具塞离心管中,加人10mL氢氧化钠水溶液混匀,然后定量加人20.0mL三氯甲烷,加塞,在旋涡混匀器上混匀5min于2000r/min离心5min,将上层水相用尖嘴吸管吸取弃去,有机相再用5mL氢氧化钠水溶液洗涤两次,弃去水相;将有机相在旋涡混合器上混匀,用干燥滤纸过滤,弃去初液3mL,收集滤液,定量取滤液10.0mL,于45℃空气流下浓缩至近干,定量加人2.0mL水溶解残渣,过0.45um微孔滤膜后,上液相色谱仪测定,外标法定量。 3.3.3色谱条件 流动相:乙腈/水/乙酸=16/83/1 色谱柱: SinoChrom ODS-BP 5 um 4.6×250mm 流速:1.0mL/min 检测波长:273nm 进样体积:20uL 柱温:40℃ 图3-2 某蜂蜜样品中咖啡因分离色谱图 第4章 蜂蜜中黄曲霉毒素含量测定 4.1 前言 4.1.1 什么是黄曲霉毒素 黄曲霉毒素(Aflatoxins)是生长在食物及饲料中的黄曲霉和寄生曲霉代谢的一组化学结构类似的产物,,目前已分离鉴定出的黄曲霉毒素有17种,主要是黄曲霉毒素B1、B2、Gj、Gz以及由B和Bz在体内经过羟化而衍生成的代谢产物M、M等。 4.1.2黄曲霉毒素性质 黄曲霉毒素是一种毒性极强的物质。黄曲霉毒素的危害性在于对人及动物肝脏组织有破坏作用,严重时可导致肝癌甚至死亡。在天然污染的食品中,以黄曲霉毒素B最为多见,其毒性和致癌性也最强。 4.1.3黄曲霉毒素结构 图4-1 四种常见的黄曲霉毒素 4.1.4对于蜂蜜的危害 蜂蜜是一种极好的食品和医疗保健品,是蜜蜂采集周边蜜源植物的花蜜并贮存在蜂巢中,与自身特殊物质结合,消化而成的天然甜味物质。蜜蜂黄曲霉病又称结石病,由黄曲霉菌(Aspergillus flavus Link)引起的一种蜜蜂幼虫真菌性病害。广布于全世界。危害蜜蜂的大幼虫和蛹。蜜蜂一旦感染黄曲霉病就有可能污染蜂蜜,使其含有对人体具有极大危害的黄曲霉毒素,因此对蜂蜜中黄曲霉毒素的检测至关重要。 4.1.5检测方法 目前黄曲霉毒素的衍生检测方法较多,大多数为柱前三氟乙酸衍生或柱后碘化学衍生,但这些衍生方法由于衍生试剂配制繁琐,仪器操作复杂,越来越多的被光化学衍生所取代。与化学衍生法相比,光化学柱后衍生器具有使用操作方便,无需衍生试剂,避免有毒试剂的接触,环境友好等优点。 光化学衍生原理,是将原本荧光较弱的B及G装变为 B2a及 G2a,提高其荧光检测,继而提高检测灵敏度,其可能的反应式如图4-2及图4-3所示。 图4-22黄曲霉毒素G衍生前后结构式 图4-3 黄曲霉毒素B衍生前后结构式 为满足对蜂蜜中黄曲霉毒素含量的测定,依利特公司,结合GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》相关标准,提出了蜂蜜中黄曲霉毒素分析的全套解决方案。为蜂蜜中黄曲霉毒素检测提供了包括从前处理设备、试剂、前处理方法直至到液相色谱方法的全套分析解决方案。相关人员可参考本实验中的方法,进行蜂蜜中黄曲霉毒素的检测。 4.2 仪器设备与试剂 表4-1(a) EClassical 3100型高效液相色谱系统设备标准配置清单 序号 名称 数量 1 UV3100紫外-可见检测器(选配) 1台 2 P3100高压恒流泵 2台 3 O3100色谱柱恒温箱 1台 4 Rheodyne 7725i高压六通进样阀 1个 5 ZJ-1阀支架 1个 6 色谱数据处理工作站 1套 7 TD-1-15梯度混合器 1个 8 TP3100溶剂托盘 1台 9 SinoChrom ODS-BP 5um 4.6×200mm色谱柱 1支 10 荧光检测器 1台 11 AD适配器 1套 12 光化学柱后衍生器 1套 13 S3100自动进样器(选配) 1台 表4-1(b)iChrom 5100型高效液相色谱系统设备标准配置清单 序号 名称 数量 D5101紫外-可见检测器(选配) P5102高压恒流泵 3 O5100色谱柱恒温箱 4 Rheodyne 7725i高压六通进样阀 5 VB5101阀支架 6 色谱数据处理工作站 7 M5101系统组织器 8 AD模块 9 SinoChrom ODS-BP 5um 4.6×200mm色谱柱 10 荧光检测器 11 光化学柱后衍生器 12 5100系统工具包 13 S5101自动进样器(选配) 14 M5101系统组织器 注:或同等配置的其他型号的高效液相色谱仪 表4-2 主要化学试剂、标准品清单 序号 试剂 纯度 1 乙腈 色谱纯 2 甲醇 色谱纯 3 氯化钠 分析纯 4 去离子水 18.2MQ 5 黄曲霉毒素标准溶液 Sigma-Aldrich 表4-3 主要样品前处理设备 序号 名称 规格型号 备注 1 溶剂过滤器 1000mL 流动相过滤 2 隔膜真空泵 0.08MPa, 160W 流动相过滤, GM-0.33A 3 超声清洗器 3L/6L,40/60KHz, 120W 流动相脱气, AS3120 4 高速万能粉碎机 转速大于10000r/min 5 试验筛 二号筛 6 精密电子天平 感量为万分之一 称量 7 高速搅拌器 转速大于10000r/min 8 免疫亲和柱 黄曲霉毒素免疫亲和柱 或含反相离子交换吸附剂 的多功能净化柱,或同等 效果的净化柱 实验过程中其它玻璃器皿还包括容量瓶(100mL、50mL、25mL、10mL)、具塞锥形瓶(250mL),移液枪(0~1000uL,0~5000uL)、移液枪枪头(1mL,5mL)、一次性PVC手套、-次性口罩、进样针、滤膜等若干。 4.3 实验方法 4.3.1 标准溶液配制 黄曲霉毒素混标标准储备液(100ug/L):黄曲霉毒素混标样品(约 5mL)置于 50mL 容量瓶中,用甲醇定容。 黄曲霉混标标准工作液:用流动相稀释黄曲霉混标标准储备液分别配置的黄曲霉混标标准工作液。如其中Bj、G浓度为 40.0ug/L, 20.0ug/L, 10.0ug/L, 6.0ug/L, 2.0ug/L,0.6pg/L,0.2pg/L。而相对应 B2、G2浓度为 12.0pg/L, 6.0ug/L, 3.0ug/L, 1.8ug/L, 0.6ug/L, 0.18ug/L,0.06pg/L。 4.3.2样品前处理 提取 精密称取供试品 25g 置于250mL的三角瓶中,加入5g氯化钠,精密加入70%甲醇溶液125mL,高速搅拌 5min(搅拌速度大于 11000r/min), 精密称取15mL,置于 50mL容量瓶中,加水 30mL稀释,摇匀,用0.45um滤膜过滤。 净化 量取续滤液15mL, 通过免疫亲和柱,流速1mL/min,然后用水20mL洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用1mL甲醇洗脱,收集洗脱液,用水定容至 2mL,用0.45um滤膜过滤,即得。 4.3.3色谱条件 流动相:甲醇/乙腈/水=20/20/60(V/V/V) 流速:0.8mL/min 进样羊:20uL 色谱柱: SinoChrom ODS-BP 5pm 4.6×200mm 柱温:室温 检测波长:激发360nm,发射450nm 4.4 实验结果 4.4.1 典型分离色谱图 进样分析浓度为20.0ug/L(Bj、G)的黄曲霉毒素标准工作液,使用4.3.3中的色谱条件,结果如下图所示。 图4-4 黄曲霉毒素标准溶液衍生色谱图 表4-4 衍生结果对比 未衍生 衍生 峰面积(mV sev) 峰高(mV) 噪声(mV) 峰面积(mV sev) 峰高(mV) 噪声(mV) G2 143.55 6.28 0.02 138.66 6.43 0.02 G 31.37 1.21 142.62 5.65 B2 726.07 24.09 710.22 24.74 B 269.07 7.26 854.04 24.04 从以上结果中可以看出,使用柱后衍生光化学反应池后, Gi及 B的响应值较使用前明显增加。其中G峰面积和峰高增加约4.5倍,B峰面积和峰高增加约3.5倍。而 Gz及Bz基本没有影响。 从噪声值上看,使用柱后衍生光化学反应池前后,噪声基本保持不变,因此,G及B灵敏度能够分别提高约4.5倍和3.5倍。 4.4.2 线性范围与检出限 将黄曲霉毒素标准工作溶液,按4.3.3中色谱条件进行光化学衍生后的分析,黄曲霉毒素的线性及检出限如下表所示。 表4-5 线性方程及灵敏度 物质 线性方程 线性相关系数R 黄曲霉毒素 G, y=22.185x-0.3282 0.99990 黄曲霉毒素 Gi y=23.547x+1.0349 0.99987 黄曲霉毒素B, y=33.410x+1.6965 0.99984 黄曲霉毒素 B v=41.875x+3.3725 0.99994 从上表可知,黄曲霉毒素光化学系统衍生效果良好, B1、G1浓度在 0.6ug/L 到 20.0ug/L线性范围内线性相关系数均大于0.999。 以3倍信噪比对应的浓度换算为仪器的检出限,以10倍信噪比对应的浓度为仪器的定量限。进样黄曲霉毒素Bj、G浓度为 0.2ug/L 的混标,计算4种黄曲霉毒素的检出限及定量限,结果如下表所示。 图4-5 检出限及定量限 表4-6 检出限 物质 方法检出限(ug/kg) SN/T 1736-2006(ug/kg) 黄曲霉毒素G, 0.30 0.50 黄曲霉毒素G 0.10 0.50 黄曲霉毒素B, 0.08 0.50 黄曲霉毒素B 0.03 0.50 从以上结果可知,光化学系统衍生后的黄曲霉毒素检测的灵敏度明显提高,但考虑到实际工作为保证测试的准确性及重复性,在检测限附近定量时误差较大,容易造成超标现象,因此还是建议使用衍生系统进行定量计算。 4.4.3光化学柱后衍生系统稳定性 使用BjG浓度为 20.0ug/L 的黄曲霉毒素标准工作液进样分析,连续7次进样,共计进样3天,分别考察日内重复性及日间重复性,实验结果如下所示。 图4-6 日内重重性(n=7) 表4-7 峰面积及保留时间日内重复性 序号 G2 G Bz B: 峰面积 保留时间 峰面积 保留时间 峰面积 保留时间 峰面积 保留时间 (mV·sec) (min) (mV·sec) (min) (mV·sec) (min) (mV·sec) (min) 1 128.77 17.88 137.45 21.99 656.54 24.43 794.73 30.52 2 129.48 17.82 138.64 21.92 661.15 24.35 801.55 30.44 3 128.23 17.80 139.07 21.88 658.49 24.32 802.72 30.37 4 125.96 17.79 138.56 21.86 655.15 24.31 796.85 30.36 5 127.40 17.79 137.88 21.87 651.05 24.30 792.62 30.35 6 127.67 17.84 139.04 21.95 654.06 24.40 801.16 30.51 7 127.28 17.88 138.72 22.00 654.97 24.44 802.01 30.56 RSD 值(%) 0.89 0.22 0.43 0.25 0.49 0.24 0.50 0.28 表4-8 峰面积及保留时间日间重复性 序号 G2 G1 B2 B1 峰面积 保留时间 峰面积 保留时间 峰面积 保留时间 峰面积 保留时间 (mV·sec) (min) (mV·sec) (min) (mV·sec) (min) (mV·sec) (min) RSD 值(%) 1.04 0.83 4.32 0.97 0.93 0.94 1.84 1.07 从上表可知,光化学衍生系统对于4种黄曲霉毒素,均具有良好的日内日间稳定性,黄曲霉毒素峰面积RSD值均小于1%,保留时间均小于2%。 4.5 小结 本文发展了一种使用高效液相色谱-光化学柱后衍生测定蜂蜜中黄曲霉毒素的系统及方法,并对该系统进行了实验验证。结果表明:该系统衍生效果明显,系统线性相关性好,灵敏度高,日内及日间重复性好,可以满足足蜜中黄曲霉毒素检测相关要求,满足 GB5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》对蜂蜜中黄曲霉毒素检测的要求。 5.1 前言 蜂蜜是--种极好的食品和医疗保健品,是蜜蜂采集周边蜜源植物的花蜜并贮存在蜂巢中,与自身特殊物质结合,消化而成的天然甜味物质。蜂蜜主要由碳水化合物(约占总量的3/4)和水分(约占总量的1/4)组成,此外蜂蜜还含有转化酶、过氧化氢酶、淀粉酶、脂酶等蛋白质(酶)、有机酸、芳香物质、挥发油、蜡、色素及一些胶状物等。然而,在养蜂业中,为防治蜜蜂的白垩病和腐臭病,蜂农会给蜜蜂喂养四环素类抗生素,四环素类抗生素在蜜蜂中降解慢,留存时间长,可能会造成蜂蜜中四环素残留。 四环素类抗生素主要包括土霉素、金霉素和四环素,此类抗生素具有广谱抗生活性,有良好的杀菌抑菌作用,不仅对革兰氏阳性,革兰氏阴性和支原体,甚至对立克次体和衣原体之类的微生物都有活性。但是这类药物长期使用就会在动物体内累积,从而在相关食品中残留。若长期食用这些食品及其制品就会危害人类的身体健康。 本实验参考 GB/T18932.4-2002《蜂蜜中土霉素、四环素、金霉素、强力霉素残留量的测定(高效液相色谱法)》,采用依利特公司生产的高效液相色谱仪,对四环素类抗生素标准品,加标线性以及实际样品等实验进行检测方法验证。 表5-1 蜂蜜中四环素类抗生素的检测HPLC系统标准配置 序号 名称 数量 4 UV3100紫外-可见检测器 P3100高压恒流泵 S3100自动进样器(选配) O3100色谱柱恒温箱 色谱数据工作站 6 SinoChrom ODS-BP 5um 4.6x250mm 注:或同等配置的其他型号高效液相色谱仪。 表5-2 蜂蜜中四环素类抗生素检测所需试剂 序号 试剂 纯度 1 乙腈 色谱纯 2 磷酸二氢钠 分析纯 3 柠檬酸 分析纯 4 氢氧化钠 分析纯 5 乙二胺四乙酸二钠 分析纯 6 乙酸乙酯 分析纯 7 硝酸(35~37%) 分析纯 8 纯化水 自制 表5-3蜂蜜样品前处理配置 序号 名称 涡旋混合器 2 离心机 3 Oasis HLB柱 4 阴离子交换柱 实验过程中其它玻璃器皿还包括棕色容量瓶(50mL、100mL)、移液枪(0~1000pL)、移液枪枪头(1mL)、一次性PVC手套、、一次性口罩、50mL塑料离心管、10mL塑料离心管、进样针等若干。 5.3 实验方法 5.3.1试剂及相关溶液配制 土霉素、四环素、金霉素标准溶液: 0.1mg/mL。准确称取适量土霉素、四环素、金霉素标准物质,分别用甲醇配成0.1mg/mL的标准储备液。储备液贮存在-18℃,根据需要用流动相逐级稀释成适当浓度的混合标准工作溶液,混合标准工作溶液在4℃保存,可使用3天。 5.3.2样品前处理 Mellvaine缓冲溶液:将1000mL-0.1mol/L柠檬酸溶液与625mL 0.1mol/L磷酸氢二钠溶液混合,必要时用氢氧化钠或盐酸溶液调节pH=4.01=+0.05。 NazEDTA-Mcllvaine缓冲溶液:0.1mol/L称取60.5g乙二胺四乙酸二钠放人1625mL,Mcllvaine缓冲溶液中,使其溶解,摇匀。 提取 称取6g试样,精确到0.01g置于150mL三角瓶中,加人30mLNazEDTA-Mellvaine缓冲溶液,于液体混匀器上快速混合1min,使试样完全溶解。样液倒人50mL离心管中,以3000r/min离心5min, 待净化。 净化 将上清液倒人下接Oasis HLB柱或相当者的贮液器中,上清液以≤3mL/min的流速通过Oasis或相当的固相萃取柱,待上清液完全流出后,用5mL甲醇/水(1/19)洗柱,弃去全部流出液。在65kPa的负压下,减压抽干20min,最后用15ml乙酸乙酯洗脱,收集洗脱液于100mL圆底烧瓶中。 按上述方法使洗脱液在减压情况下以≤3mL/min的流速通过阴离子交换柱,待洗脱液全部流出后,用5mL甲醇洗柱,弃去全部流出液。在65kPa负压下,减压抽干5min,再用4ml流动相洗脱,收集洗脱液于5mL样品管中,定容至4mL,供液相色谱仪测定。 5.3.3色谱条件 流动相:乙腈/磷酸二氢钠缓冲溶液=27/73 色谱柱: SinoChrom ODS-BP 5um 4.6x250mm 流量:1.0mL/min 检测波长:355nm 进样体积:20uL 柱温:30℃ 5.4 实验结果 5.4.1 典型分析谱图 图5-1 10ug/mL四环素类抗生素混标色谱图 表5-4 四环素类标准品分析色谱参数 物质 保留时间(min) 拖尾因子 分离度 土霉素 4.408 1.18 1.4 四环素 5.239 1.13 3.5 金霉素 8.961 0.96 11.0 5.4.2线性 配制浓度分别为 0.05ug/mL、0.1ug/mL、0.2ug/mL、0.4ug/mL、0.6ug/mL、0.8ug/mL、1.0ug/mL、10.0ug/mL 的四环素类抗生素混标工作液,按浓度由低至高进样,以标准品浓度为横坐标,峰高为纵坐标,绘制校准曲线,四环素类抗生素的标准溶液线性相关性结果如下。 表5-5不同浓度四环素类抗生素标准品对应峰高数据 序号 浓度 (ug/mL) 峰高(mAU.) 土霉素 四环素 金霉素 1 0.1 0.3203 0.2233 0.0707 2 0.2 0.6300 0.4330 0.1510 3 0.4 1.9067 1.4193 0.4937 4 0.6 2.9160 2.2370 0.7185 5 0.8 3.9673 3.0323 1.0020 6 1.0 5.1837 3.9883 1.4510 7 10.0 58.1293 48.0580 20.6867 图5-22四环素类抗生素标准溶液浓度-峰高校准曲线 表5-6 四环素类抗生素标准溶液的线性参数表 标准品 线性浓度范围 线性相关系数(R) 线性方程 土霉素 0.1~10ug/mL 0.9999 y=5.8641x-0.5381 四环素 0.1~10pg/mL 0.9999 y=4.8635x-0.6172 金霉素 0.1~10ug/mL 0.9996 y=1.0541x-0.4349 图5-2和表5-6结果表明,土霉素、四环素、金霉素在 0.1ug/mL 至10.0ug/mL浓度范围内,仪器检测具有良好的线性相关性,相关系数R大于 0.999。 5.4.3检出限 表5-7 四环素类抗生素分析的仪器检出限(S/N=3) 标准品 峰高(mAU) 平均峰高 仪器检出限 1 2 3 (mV) (ug/mL) 土霉素 0.165 0.172 0.173 0.170 0.007 四环素 0.152 0.143 0.152 0.149 0.008 金霉素 0.043 0.041 0.049 0.044 0.05 图5-3 峰高约为3倍信噪比对应浓度(0.02ug/mL)谱图 第6章 蜂蜜中其它兽药测定 6.1氯霉素 流动相:甲醇/水=48/52色谱柱: Supersil ODS2 5 um 4.6×250mm流量:1.0mL/min检测波长:270nm进样体积:20uL柱温:30℃ 图6-1 蜂蜜中氯霉素测定谱图 6.2:诺氟沙星 流动相: A:0.025 mol/L磷酸溶液(用三乙胺调节 165pH值至3.0±0.1);B:乙腈 130 色谱柱: Supersil ODS2 5um 4.6×250mm 流量:1.0mL/min 检测波长:278nm 进样体体:20uL 柱温:30℃ 图6-2:2蜂蜜中诺氟沙星测定谱图 6.3强力霉素 流动相:醋酸盐缓冲液[0.25mol/L醋酸铵-0.1mol/L乙二胺四乙酸二钠-三乙胺(100:10:1)]/乙腈=85/15 色谱柱: Supersil ODS2 5 pm 4.6×150mm 流量:1.0mL/min 检测波长:280nm进样体积:20pL 柱温:35℃ 图6-3 蜂蜜中强力霉素测定谱图 大连公司 公司地址:高新园区七贤岭学子街2-2号 公司电话:0411-84753333(总机)-转销售部 公司传真:0411-84732323 客服电话:400-66-35483 公司网址: http://www.eliteHPLC.com 苏州公司 苏州工业园区金鸡湖大道99号苏州纳米城西北区14栋501电话:0512-67997572 北京办事处 地址:北京市朝阳区汤立路201号东亚奥北中心南区4号楼2单元2307室 电话:13624984285 济南办事处 地址:山东省济南市历下区奥体西路1222号力高国际10楼1-1816室 电话:18842689516 上海办事处 地址:徐汇区梅陇路130号华东理工大学实验四楼204室 电话:15140566435 武汉办事处 地址:武汉市洪山区鸿桂苑东区1栋1单元2501 电话:18842683216 南京办事处 地址:江苏省南京市建邺区云锦路45号万达东坊14幢608室 电话:13951643881 厦门办事处 地址:厦门市集美区鱼福三里383号127单元 电话:18842685196 西安办事处 地址:陕西省西安市西稍门十字西南角柠檬柠舍11505室 电话:18842681836 广州办事处 地址:广州市白云区东兴二街3号擎山苑C2栋1404房 电话:18842683616 成都办事处 地址:成都武侯区九兴大道6号高发大厦A座610 电话:18842681865 info@elitehplc.comwww.elitehplc.com(+ 随着生活水平的提高,人们的保健意识也越来越强。蜂蜜是一种极好的食品和医疗保健品,是蜜蜂采集周边蜜源植物的花蜜并贮存在蜂巢中,与自身特殊物质结合,消化而成的天然甜味物质。蜂蜜主要由碳水化合物(约占总量的 3/4)和水分(约占总量的 1/4)组成,此外蜂蜜还含有转化酶、过氧化氢酶、淀粉酶、脂酶等蛋白质(酶)、有机酸、芳香物质、挥发油、蜡、色素及一些胶状物等。糖类物质尤其是单糖(葡萄糖和果糖)占碳水化合物的85%-90%,形成了高糖分的饱和溶液。随着蜂蜜销售的紧俏,一些不法商贩开始人为向蜂蜜中添加水、蔗糖、转化糖、饴糖、羧甲基纤维素、糊精或淀粉类物质以达到以次充好、提高产量的目的。但是假蜂蜜并不具天然蜂蜜的全部营养成分,更不具有天然蜂蜜独特的保健功能。为满足对蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定,依利特公司,结合 GB5009.8-2016《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》及《中国药典》2015 版第一部相关标准,采用示差折光检测器,经氨基色谱柱分离,根据保留时间定性和峰面积定量,提出了蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定的全套 HPLC解决方案,包括前处理设备、试剂、前处理方法直至到液相色谱方法。相关人员可参考本实验中的方法,进行蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的检测。
确定
















还剩25页未读,是否继续阅读?
大连依利特分析仪器有限公司为您提供《蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖检测方案(色谱高压泵)》,该方案主要用于蜂蜜中营养成分检测,参考标准--,《蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖检测方案(色谱高压泵)》用到的仪器有依利特P3100系列恒流泵、依利特RI-201H示差折光检测器、依利特O3100色谱柱恒温箱、Elitapex色谱数据工作站
推荐专场
色谱检测器/蒸发光检测器/紫外检测器
更多
相关方案
更多
该厂商其他方案
更多