方案详情
文
复杂生物样品的高效提取、净化和分析对法医学实验室极为有益。磷脂 (PPL) 已被确定为在全血中四氢大麻酚 (THC) 及其代谢物的 LC-MS/MS 分析中引起基质效应的主要来源。本应用简报介绍了全血中的 Δ9-THC (THC) 及其主要代谢物 11-羟基-Δ9-THC (THC-OH) 和 11-nor-9-羧基-Δ9-THC (THC-COOH) 的提取和 LC-MS/MS 分析。样品前处理中采用孔内蛋白质沉淀法 (PPT) 和 Agilent Captiva EMR-Lipid 直通 1 mL 过滤柱去除 PPL。Captiva EMR-Lipid 能够得到更洁净的洗脱液,去除全血基质中 97% 以上不需要的 PPL,且目标分析物的回收率高于 92%。对 1 ng/mL THC、THC-OH 和 THC-COOH 的分析得到了理想的峰形,并获得了良好的信噪比 (S/N)。在 0.5 至 100 ng/mL 范围内获得的响应呈线性,R2 高于 0.99。获得的定量限在 1.0 ng/g 以下,RSD 小于 11.5%。在三天的实验过程中,得到的结果一致。
方案详情

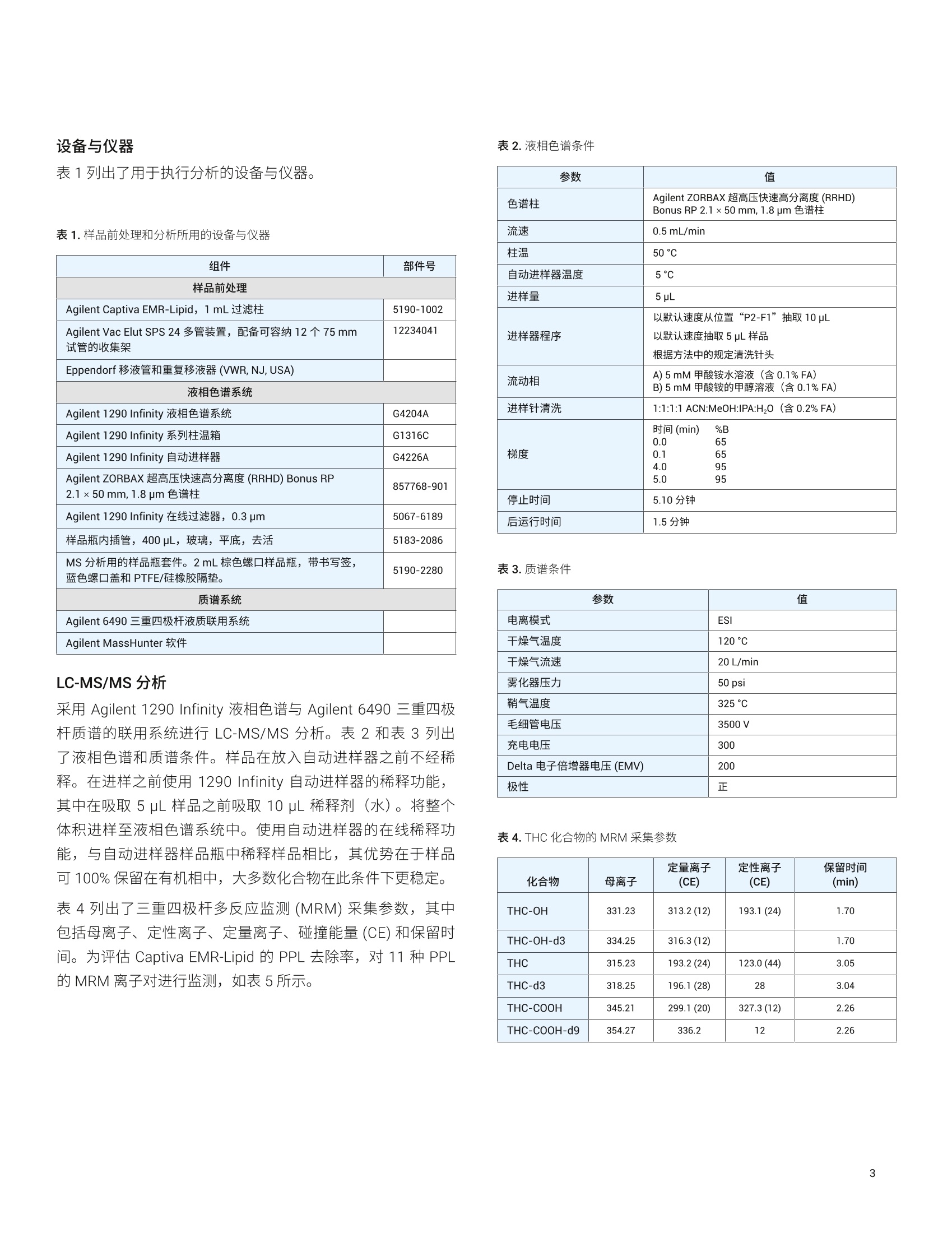
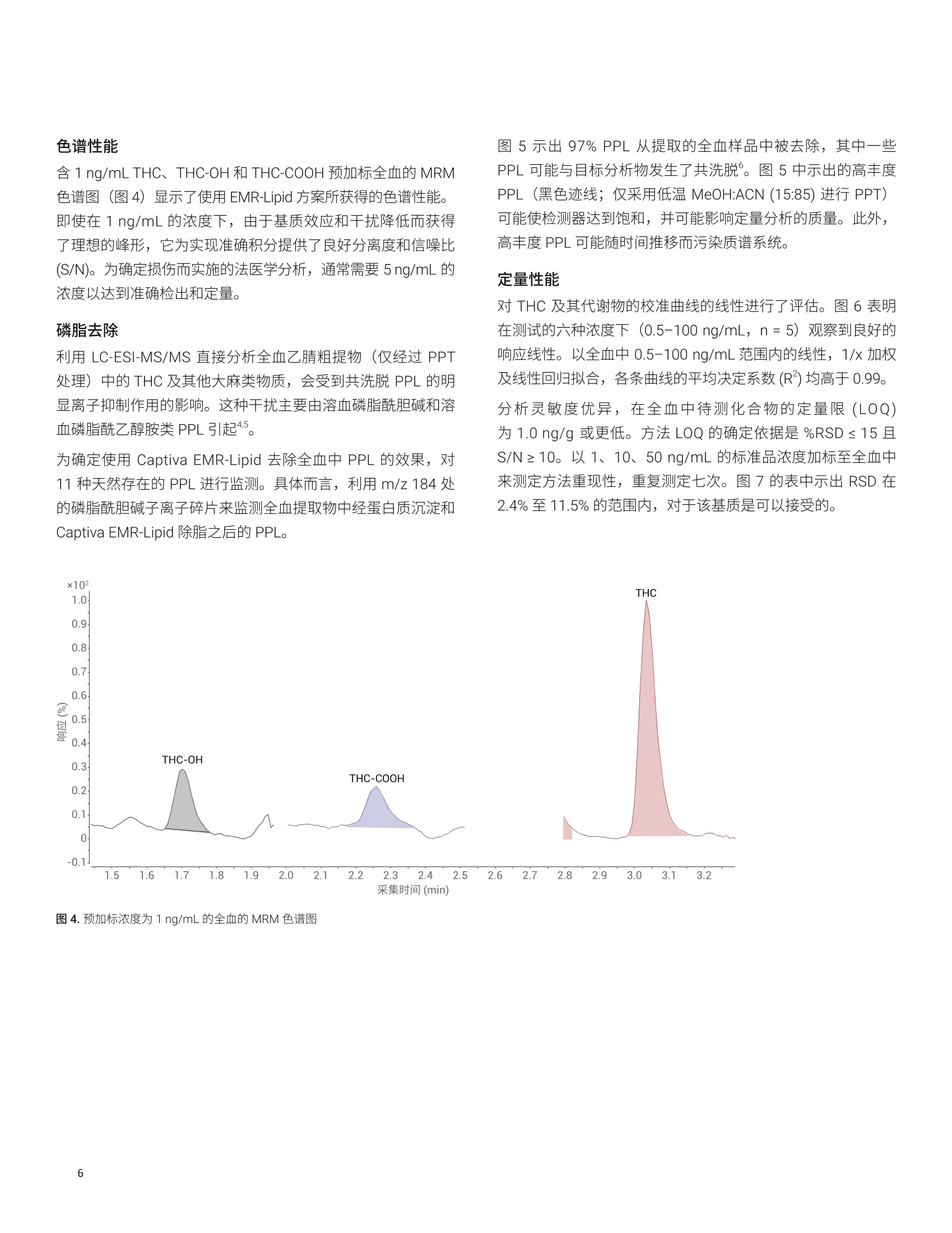
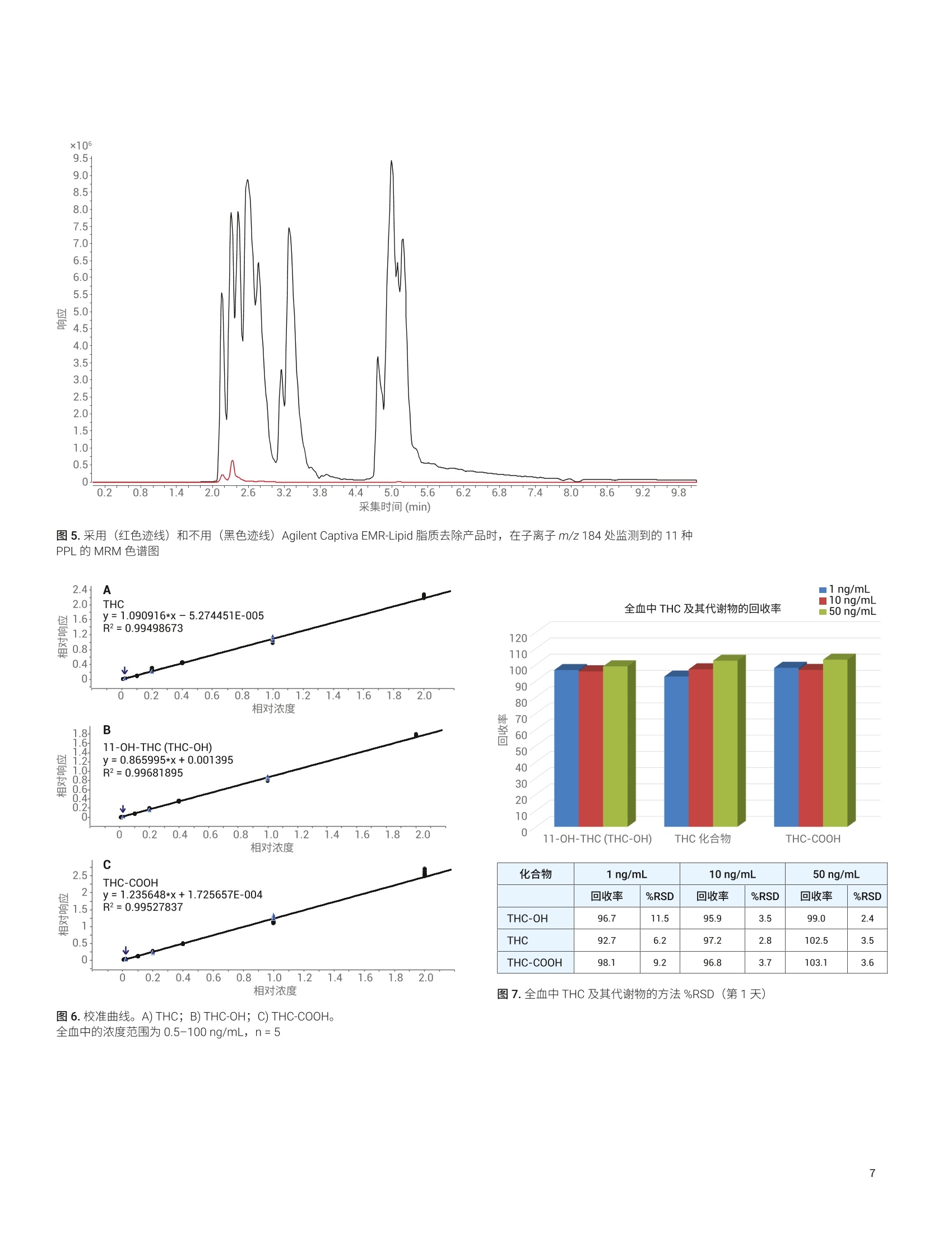
Joan Stevens 和 Limian Zhao 安捷伦科技有限公司 应用简报 Agilent法医学分析Trusted Answers 使用 Agilent Captiva EMR-Lipid 和LC-MS/MS 对全血中的 THC 和代谢物进行高效定量分析 复杂生物样品的高效提取、净化和分析对法医学实验室极为有益。磷脂 (PPL) 已被确定为在全血中四氢大麻酚 (THC) 及其代谢物的 LC-MS/MS分析中引起基质效应的主要来源。本应用简报介绍了全血中的 A-THC (THC) 及其主要代谢物11-羟基-A°-THC (THC-0H)和11-nor-9-羧基-°-THC (THC-COOH) 的提取和 LC-MS/MS分析。样品前处理中采用孔内蛋白质沉淀法 (PPT) 和 Agilent Captiva EMR-Lipid 直通 1 mL 过滤柱去除 PPL。 Captiva EMR-Lipid 能够得到更洁净的洗脱液,去除全血基质中97%以上不需要的 PPL, 且目标分析物的回收率高于92%。对 1 ng/mL THC、THC-0H和 THC-COOH 的分析得到了理想的峰形,并获得了良好的信噪比 (S/N)。在0.5至100 ng/mL 范围内获得的响应呈线性, R²高于0.99。获得的定量限在 1.0 ng/g以下, RSD 小于11.5%。在三天的实验过程中,得到的结果一致。 在法医学实验室中, LC-MS/MS 分析之前高效的样品前处理是一个重要考虑因素。样品前处理可用于减少系统污染并改善数据完整性、方法选择性、分析灵敏度和可靠性。全血中存在的两种主要干扰物为是蛋白质和磷脂(PPL)。 PPL已被确定为LC-MS/MS 生物分析中引起基质效应的主要来源,因为在电喷雾电离 (ESI)期间所形成的液滴表面上会发生竞争电离。 常用的法医学样品前处理技术包括蛋白质沉淀 (PPT)、固相萃取 (SPE)、液液萃取 (LLE) 和介质液液萃取 (SLE)。每种技术在速度、成本和生成数据的质量方面各有优劣。例如, PPT、LLE 和 SLE 无法去除 PPL, 而 SPE 执行起来更耗时且更复杂。然而,在这些技术中, PPT 得到了最广泛的认可。PPT 以规定的比例向生物样品中加入有机沉淀溶剂(如乙腈(ACN)或甲醇(MeOH)), 可轻松高效地除去蛋白质。随着蛋白质的变性,它们形成的沉淀可通过过滤或离心得以去除。但 PPT无法去除PPL, 因为 PPL能够溶于有机沉淀溶剂中。 大麻物质类是支持案件调查的法医学实验室中最常见的目标分析物之一。快速、准确地确认并定量生物样品中的^°-THC(THC)及其主要代谢物11-羟基-A°-THC (THC-OH)和 11-nor-9-A-羧基-THC (THC-COOH) 至关重要。然而, THC 及其代谢物在样品前处理过程中容易发生非特异性结合。 迫切需要一种全血样品前处理方法,在减少样品前处理步骤(包括离线 PPT、离心、转移和稀释)的同时实现简化的孔内 PPT 和 PPL去除。本应用简报介绍了一种借助 AgilentCaptiva EMR-Lipid 1 mL过滤柱去除干扰物质(特别是PPL)的方法,该方法采用简单的直通形式,不会引起分析物损失。所得的提取物更洁净,减少了潜在的离子抑制以及色谱柱和质谱仪污染。 依次使用孔内 PPT 和 Captiva EMR-Lipid 过滤柱去除PPL,对全血中的 THC、THC-OH 和 THC-COOH 进行提取。随后使用Agilent 6490 三重四极杆液质联用系统进行定量分析。对 PPL去除率进行了评估。还测定了 THC及其代谢物的日间(3日)准确度、精密度和回收率。 有关血浆样品的分析,请参见安捷伦应用简报使用 CaptivaEMR-Lipid 和 LC-MS/MS 对人血浆中的 THC 和代谢物进行高效定量分析。 ( 试剂与化学品 ) ( △°-THC、 1 1-羟基-A°-THC、11-nor-9-A°-羧基-THC、△°-THC-d311-羟基-A°-THC-d3 和 11-nor-9-羧基-A°-THC-d9购 自 S igma-Aldrich (S t Louis, MO, USA)。 LC-MS/MS 级甲酸铵 同样购自 Sigma-Aldrich。所有溶剂均为液相色谱级或更高级 别,均购自Burdick and Jackson (Muskegon, MI,USA)。 ) 溶液 ( 在甲醇中配制浓度为 10 pg/mL 的 THC 及其代谢物 THC-O H 和 THC-COOH 的混标工 作 溶液。将气代 THC-d3、TH C -OH-d3 和 THC-COOH-d9 混合到工作溶液中,浓度为 10 pg/mL ( 溶于甲醇中),并用作内标(IS)。 ) 校准标样和质量控制样品 ( 在预加标质量控制(QC)样品中加入适当浓度的标准工作溶液,平行配制七份。QC 样品为低浓度 QC (LQC)、中等浓度 QC (MQC) 和高浓度 QC (HQ C ),分别对应于全血中1、10、 50 ng / mL 的浓度。在每种浓度的QC样品中,添加浓度为 50 ng/mL 的气代混标溶液(IS)。 ) 在经过 Captiva EMR-Lipid 净化的空白基质中,用 THC及其代谢物的工作溶液后加标,其加标浓度分别对应于全血中1、10、50 ng/mL 的浓度。另外,还加入一份5 pL 的 1.0 pg/mLIS溶液。 基质匹配校准曲线由标准工作溶液制得。对经过 CaptivaEMR-Lipid 净化的空白基质进行后加标,加标浓度对应于提取物中0.5、1、5、10、50、100 ng/mL 的浓度。在每种浓度的校准标样中加入5 pL 1.0 ug/mL IS. 表1列出了用于执行分析的设备与仪器。 表1.样品前处理和分析所用的设备与仪器 组件 部件号 样品前处理 Agilent Captiva EMR-Lipid, 1mL过滤柱 5190-1002 Agilent Vac Elut SPS 24 多管装置,配备可容纳12个75mm试管的收集架 12234041 Eppendorf 移液管和重复移液器(VWR,NJ,USA) 液相色谱系统 Agilent 1290 Infinity 液相色谱系统 G4204A Agilent 1290 Infinity 系列柱温箱 G1316C Agilent 1290 Infinity 自动进样器 G4226A Agilent ZORBAX 超高压快速高分离度(RRHD) Bonus RP2.1×50 mm, 1.8 pm色谱柱 857768-901 Agilent 1290 Infinity 在线过滤器, 0.3 pm 5067-6189 样品瓶内插管,400pL, 玻璃, 平底, 去活 5183-2086 MS分析用的样品瓶套件。2mL棕色螺口样品瓶,带书写签,蓝色螺口盖和PTFE/硅橡胶隔垫。 5190-2280 质谱系统 Agilent 6490三重四极杆液质联用系统 Agilent MassHunter 软件 LC-MS/MS分析 采用 Agilent 1290 Infinity 液相色谱与 Agilent 6490 三重四极杆质谱的联用系统进行 LC-MS/MS分析。表2和表3列出了液相色谱和质谱条件。样品在放入自动进样器之前不经稀释。在进样之前使用1290 Infinity 自动进样器的稀释功能,其中在吸取5uL样品之前吸取10 uL稀释剂(水)。将整个体积进样至液相色谱系统中。使用自动进样器的在线稀释功能,与自动进样器样品瓶中稀释样品相比,其优势在于样品可100%保留在有机相中,大多数化合物在此条件下更稳定。 表4列出了三重四极杆多反应监测 (MRM) 采集参数,其中包括母离子、定性离子、定量离子、碰撞能量(CE)和保留时间。为评估 Captiva EMR-Lipid 的 PPL 去除率,对11种PPL的 MRM 离子对进行监测,如表5所示。 参数 值 色谱柱 Agilent ZORBAX超高压快速高分离度(RRHD)Bonus RP 2.1x50mm, 1.8 pm 色谱柱 流速 0.5mL/min 柱温 50°℃ 自动进样器温度 5°℃ 进样量 5 pL 进样器程序 以默认速度从位置“P2-F1”抽取 10 pL 以默认速度抽取5pL 样品 根据方法中的规定清洗针头 流动相 A)5mM甲酸铵水溶液(含0.1%FA)B)5mM甲酸铵的甲醇溶液(含0.1%FA) 进样针清洗 1:1:1:1 ACN:MeOH:IPA:H,0(含0.2%FA) 梯度 时间(min) %B 0.0 650.1 65 4.0 955.0 95 停止时间 5.10分钟 后运行时间 1.5分钟 表3.质谱条件 参数 值 电离模式 ESI 干燥气温度 120℃ 干燥气流速 20L/min 雾化器压力 50 psi 鞘气温度 325C 毛细管电压 3500V 充电电压 300 Delta 电子倍增器电压(EMV) 200 极性 正 表4. THC化合物的 MRM采集参数 化合物 母离子 定量离子(CE) 定性离子 (CE) 保留时间 (min) THC-OH 331.23 313.2(12) 193.1(24) 1.70 THC-OH-d3 334.25 316.3(12) 1.70 THC 315.23 193.2(24) 123.0(44) 3.05 THC-d3 318.25 196.1(28) 28 3.04 THC-COOH 345.21 299.1(20) 327.3(12) 2.26 THC-COOH-d9 354.27 336.2 12 2.26 母离子(m/z) 子离子(m/z) 碰撞能量 808 184 30 806 184 30 786 184 30 784 184 30 760 184 30 758 184 30 704 184 30 524 184 30 522 184 30 520 184 30 496 184 30 使用 Agilent MassHunter 软件进行仪器控制以及定性和定量数据分析。还测定了由该方法得到的 THC及其代谢物的日间(3日)准确度、精密度和回收率。 样品前处理过程 1.将 500 uL 低温*15:85 MeOH:ACN 加入 Agilent CaptivaEMR-Lipid 1 mL 过滤柱中 2. 加入100pL人全血样品 3. 用一次性玻璃移液管进行孔内充分混合,或被动混合5-7分钟 4. 抽真空至3.5-4 psi 5. 加入200 uL 的低温1:4 H,O:ACN 6. 抽真空直至整个体积通过过滤柱,然后将压力提高至11-13psi, 使剩余溶剂完全通过过滤柱 ( 7. 将溶剂蒸发,然后复溶于 100 uL MeOH (含0.1%甲酸 (FA))中 ) ( 8. 将5uL样品与用于稀释的10 pL水直接进样至液相色谱系统中进行分析 ) ( 火 低温15:85MeOH:ACN 储存于-20℃冰箱中,在使用时 放入冷冻容器中 ) ( 注:有关血浆样品的分析,请参见安捷伦应用简报使用 Captiva EMR-Lipid 和 LC-MS/MS 对人血浆中的 THC 和代谢物 进行高效定量分析。 ) 常用并推荐使用1:3至1:5的样品/溶剂比,,以实现蛋白质完全沉淀。使用低温 MeOH/ACN 溶剂是引起红细胞溶血或破裂(溶解)的简便方法。该方法使红细胞的内容物(细胞质)释放到周围的血浆中,形成粉状沉淀,如图1所示。 图1.经主动混合后的全血在抽真空之前形成粉状沉淀 优先使用大口径移液枪头或其他混合装置进行主动孔内混合。真空促使液流通过 Captiva EMR-Lipid 过滤柱。推荐使用每3-5秒一滴的受控流速,以实现最佳脂质去除。在样品从过滤柱洗脱后,施加更高的真空度以最大程度提高样品回收率。 去除不需要的脂质基体 EMR-Lipid 方法简便,通用于极性、中等极性和非极性的目标物分析,,F可消除基质效应并改善分析物回收率。 EMR-Lipid 利用独特的吸附剂化学作用,用水活化 EMR-Lipid 吸附剂后,能通过体积排阻和疏水性相互作用选择性捕集脂类(图2)。脂类上的无支链烃链进入吸附剂中,而体积较大的分析物并不进入其中。然后,进入吸附剂中的脂链通过疏水相互作用被捕集。PPL是细胞膜的主要成分,大量存在于全血中。PPL是由磷酸酯和胆碱单元组成的亲水性头部基团以及由长链烷基组成的疏水性尾部构成。 体积排阻:无支链烃链(脂类)进入吸附剂中;体积较大的分析物并不进入其中。 通过疏水相互作用被捕集。 尽管图3所示的分析物 THC、THC-OH 和 THC-COOH 包含直碳链,但其碳链不够长,无法与 EMR 吸附剂形成稳定的疏水相互作用。此外,分析物体积较大的环结构妨碍了吸附剂对它们的保留。 THC-OH 图3. THC 及其代谢物结构 EMR-Lipid 技术以96孔板或1 mL过滤柱形式提供,并包含用于孔内 PPT的溶剂保留滤芯,适用于需要高通量的应用。这一独特的设计最大程度减少了堵塞的发生。 色谱性能 含1 ng/mL THC、THC-OH 和 THC-COOH 预加标全血的 MRM色谱图(图4)显示了使用 EMR-Lipid 方案所获得的色谱性能。即使在1 ng/mL 的浓度下,由于基质效应和干扰降低而获得了理想的峰形,它为实现准确积分提供了良好分离度和信噪比(S/N)。为确定损伤而实施的法医学分析,通常需要 5 ng/mL 的浓度以达到准确检出和定量。 磷脂去除 利用 LC-ESI-MS/MS 直接分析全血乙腈粗提物(仅经过 PPT处理) 中的 THC 及其他大麻类物质,会受到共洗脱 PPL 的明显离子抑制作用的影响。这种干扰主要由溶血磷脂酰胆碱和溶血磷脂酰乙醇胺类 PPL 引起4.5。 为确定使用 Captiva EMR-Lipid 去除全血中 PPL 的效果,对11种天然存在的PPL 进行监测。具体而言,言用 m/z 184处的磷脂酰胆碱子离子碎片来监测全血提取物中经蛋白质沉淀和Captiva EMR-Lipid 除脂之后的 PPL。 图5示出97% PPL 从提取的全血样品中被去除,其中一些PPL可能与目标分析物发生了共洗脱。图5中示出的高丰度PPL(黑色迹线;仅采用低温 MeOH:ACN (15:85) 进行 PPT)可能使检测器达到饱和,并可能影响定量分析的质量。此外,高丰度 PPL 可能随时间推移而污染质谱系统。 定量性能 对 THC 及其代谢物的校准曲线的线性进行了评估。图6表明在测试的六种浓度下 (0.5-100 ng/mL, n=5) 观察到良好的响应线性。以全血中 0.5-100 ng/mL 范围内的线性,1/x加权及线性回归拟合,各条曲线的平均决定系数(R)均高于0.99. 分析灵敏度优异,在全血中待测化合物的定量限(LOQ)为 1.0 ng/g 或更低。方法 LOQ 的确定依据是 %RSD≤ 15 且S/N≥10。以1、10、50 ng/mL 的标准品浓度加标至全血中来测定方法重现性,重复测定七次。图7的表中示出 RSD 在2.4%至11.5%的范围内,对于该基质是可以接受的。 图5.采用(红色迹线)和不用(黑色迹线) Agilent Captiva EMR-Lipid 脂质去除产品时,在子离子 m/z 184 处监测到的11种PPL 的 MRM 色谱图 图7.全血中 THC及其代谢物的方法%RSD (第1天) 全血中的浓度范围为 0.5-100 ng/mL, n=5 在第3步的 PPT过程中进行主动混合,能够使 THC 及其代谢物 THC-OH 和 THC-COOH 获得 92.7%至103.1%的最佳回收率, RSD 小于11.5%,校准曲线R²达到0.99。被动 PPT 得到的回收率为91%至105%, RSD 小于10%,而校准曲线 R²为0.98。 Captiva EMR-Lipid 采用独特的 PPL去除机制,因此获得了令人满意的回收率。其他技术通常无法区分 PPL 与 THC(LogP= 7.6)等疏水性化合物。 在3天时间内,,11、l、10、50 ng/mL 浓度下得到的日间方法回收率和精密度始终保持良好,处于93.4%至109.2%的范围内, RSD 小于 11.5%。 本应用简报介绍了一种简便而快速的全血样品前处理工作流程,适用于对全血样品中的 THC 及其代谢物进行 LC-MS/MS的法医学分析。依次使用孔内 PPT 和 Agilent Captiva EMR-Lipid 1 mL 过滤柱去除 PPL, 对全血中的 THC 及其主要的两种代谢物 (THC-OH 和THC-COOH) 进行提取。 Captiva EMR-Lipid 能够高效去除全血基质中97%以上不需要的 PPL,并使目标分析物获得优异的回收率。所得到的样品提取物比单独使用 PPT得到的提取物更洁净,从而减少了潜在的离子抑制、LC-MS/MS 系统污染和停机的可能。孔内 PPT具有减少样品处理和转移的优点。 对 1 ng/mL THC、THC-OH 和 THC-COOH 的分析得到了理想的峰形和良好的 S/N,该浓度低于确定定伤所需的浓度。 -七种浓度下(0.5-100 ng/mL)的 THC 及其代谢物的响应呈线性,R²高于0.99。获得的 LOQ 在1.0 ng/g 以下, RSD 小于 11.5%。对于所检测浓度下的 THC 及其代谢物,回收率罕见地高达92%或更高。在3天的重复分析过程中,结果保持一致。 www.agilent.com 用于法医鉴定。 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 ( ◎安捷伦科技(中国)有限公司,2017 ) Captiva EMR-Lipid 方法可轻松融入现有工作流程中,无需额外的样品前处理装置或玻璃器皿。在96孔板或1mL过滤柱形式中, Captiva EMR-Lipid可兼容自动化系统,适用于高通量应用。滤芯设计可轻松高效洗脱样品,不易发生堵塞。 ( 1. Matuszewski,B. K.; Constanzer,M. L . ;Chavez-Eng, C. M. Strategies for the Assessment of Matrix Effectin Quantitative Bioanalytical Methods Based onHPLC-MS/MS. Anal. Chem.2003,75(13),3019-3030 ) ( 2. Jamey, C .; et al. Determinatio n of Cannabinoids i n WholeBlood by UPL C -MS-MS. J.Analytical Tox. 2008, 32, 349-354 ) ( 3. Stevens, J.; Zhao, L . 使用 Captiva EMR-Lipid 和 LC-MS/MS 对人血浆中的 THC 和代谢物进行高效定量分析,安捷伦科技公司应用简报,出版号5991-8636ZHCN, 2017年10月 ) ( 4. Elian. A.; Hackett. J. Solid-Phase Extraction and Analysisof THC and Carboxy-THC from Whole Blood Using a NovelFluorinated Solid-Phase Extraction Sorbent and FastLiquid Chromatography-Tandem Mass Spectrometry. J. Analytical Tox . 2009, 33,461-468 ) ( 5. Sorensen, L; Hasselstrom,J. S ensitive Determination ofCannabinoids in Whole Blood by LC-MS-MS After RapidRemoval of Phospholipids by Filt r ation. J. A nalytical Tox. 2017,41,382-391 ) ( 6. Zhao, L.; Lucas, D. Efficiency of Biological Fl u id MatrixRemoval Using Agilent Captiva EMR-Lipid Cleanup (使 用 Agilent Captiva EMR-Lipid 去除生物体液基质的净化效 率),安捷伦科技公司应用简报,出版号5991-8006EN, 2017年7月 ) 摘要复杂生物样品的高效提取、净化和分析对法医学实验室极为有益。磷脂 (PPL) 已被确定为在全血中四氢大麻酚 (THC) 及其代谢物的 LC-MS/MS 分析中引起基质效应的主要来源。本应用简报介绍了全血中的 Δ9-THC (THC) 及其主要代谢物 11-羟基-Δ9-THC (THC-OH) 和 11-nor-9-羧基-Δ9-THC (THC-COOH) 的提取和 LC-MS/MS 分析。样品前处理中采用孔内蛋白质沉淀法 (PPT) 和 Agilent Captiva EMR-Lipid 直通 1 mL 过滤柱去除 PPL。Captiva EMR-Lipid 能够得到更洁净的洗脱液,去除全血基质中 97% 以上不需要的 PPL,且目标分析物的回收率高于 92%。对 1 ng/mL THC、THC-OH 和 THC-COOH 的分析得到了理想的峰形,并获得了良好的信噪比 (S/N)。在 0.5 至 100 ng/mL 范围内获得的响应呈线性,R2 高于 0.99。获得的定量限在 1.0 ng/g 以下,RSD 小于 11.5%。在三天的实验过程中,得到的结果一致。前言在法医学实验室中,LC-MS/MS 分析之前高效的样品前处理是一个重要考虑因素。样品前处理可用于减少系统污染并改善数据完整性、方法选择性、分析灵敏度和可靠性。全血中存在的两种主要干扰物为是蛋白质和磷脂 (PPL)。PPL 已被确定为 LC-MS/MS 生物分析中引起基质效应的主要来源,因为在电喷雾电离 (ESI) 期间所形成的液滴表面上会发生竞争电离。常用的法医学样品前处理技术包括蛋白质沉淀 (PPT)、固相萃取 (SPE)、液液萃取 (LLE) 和介质液液萃取 (SLE)。每种技术在速度、成本和生成数据的质量方面各有优劣。例如,PPT、LLE 和 SLE 无法去除 PPL,而 SPE 执行起来更耗时且更复杂。然而,在这些技术中,PPT 得到了最广泛的认可。PPT 以规定的比例向生物样品中加入有机沉淀溶剂(如乙腈 (ACN) 或甲醇 (MeOH)),可轻松高效地除去蛋白质。随着蛋白质的变性,它们形成的沉淀可通过过滤或离心得以去除。但 PPT 无法去除 PPL,因为 PPL 能够溶于有机沉淀溶剂中。大麻物质类是支持案件调查的法医学实验室中最常见的目标分析物之一。快速、准确地确认并定量生物样品中的 Δ9-THC (THC) 及其主要代谢物 11-羟基-Δ9-THC (THC-OH) 和 11-nor- 9-Δ9-羧基-THC (THC-COOH) 至关重要。然而,THC 及其代谢物在样品前处理过程中容易发生非特异性结合。迫切需要一种全血样品前处理方法,在减少样品前处理步骤( 包括离线 PPT、离心、转移和稀释)的同时实现简化的孔内 PPT 和 PPL 去除。本应用简报介绍了一种借助 Agilent Captiva EMR-Lipid 1 mL 过滤柱去除干扰物质(特别是 PPL)的方法,该方法采用简单的直通形式,不会引起分析物损失。所得的提取物更洁净,减少了潜在的离子抑制以及色谱柱和质谱仪污染。依次使用孔内 PPT 和 Captiva EMR-Lipid 过滤柱去除 PPL,对全血中的 THC、THC-OH 和 THC-COOH 进行提取。随后使用 Agilent 6490 三重四极杆液质联用系统进行定量分析。对 PPL 去除率进行了评估。还测定了 THC 及其代谢物的日间(3 日)准确度、精密度和回收率。有关血浆样品的分析,请参见安捷伦应用简报使用 Captiva EMR-Lipid 和 LC-MS/MS 对人血浆中的 THC 和代谢物进行高效定量分析。结论本应用简报介绍了一种简便而快速的全血样品前处理工作流程,适用于对全血样品中的 THC 及其代谢物进行 LC-MS/MS 的法医学分析。依次使用孔内 PPT 和 Agilent Captiva EMRLipid 1 mL 过滤柱去除 PPL,对全血中的 THC 及其主要的两种代谢物(THC-OH 和 THC-COOH)进行提取。Captiva EMRLipid 能够高效去除全血基质中 97% 以上不需要的 PPL,并使目标分析物获得优异的回收率。所得到的样品提取物比单独使用 PPT 得到的提取物更洁净,从而减少了潜在的离子抑制、LC-MS/MS 系统污染和停机的可能。孔内 PPT 具有减少样品处理和转移的优点。对 1 ng/mL THC、THC-OH 和 THC-COOH 的分析得到了理想的峰形和良好的 S/N,该浓度低于确定损伤所需的浓度。七种浓度下 (0.5–100 ng/mL) 的 THC 及其代谢物的响应呈线性,R2 高于 0.99。获得的 LOQ 在 1.0 ng/g 以下,RSD 小于 11.5%。对于所检测浓度下的 THC 及其代谢物,回收率罕见地高达 92% 或更高。在 3 天的重复分析过程中,结果保持一致。Captiva EMR-Lipid 方法可轻松融入现有工作流程中,无需额外的样品前处理装置或玻璃器皿。在 96 孔板或 1 mL 过滤柱形式中,Captiva EMR-Lipid 可兼容自动化系统,适用于高通量应用。滤芯设计可轻松高效洗脱样品,不易发生堵塞。
确定





还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《全血中THC 和代谢物检测方案(液相色谱仪)》,该方案主要用于司法鉴定中THC 和代谢物检测,参考标准--,《全血中THC 和代谢物检测方案(液相色谱仪)》用到的仪器有Agilent 1290 Infinity II 液相色谱系统、Agilent 6470 三重四极杆液质联用系统、Agilent 1290 Infinity II Multisampler
推荐专场
相关方案
更多
该厂商其他方案
更多
























