
Agilent Captiva 增强型脂质去除产品 (EMR-Lipid) 是第二代 EMR-Lipid 产品,采用便捷的 SPE 过滤柱或 96 孔板。本研究展示了采用 Captiva EMR-Lipid 96 孔板对人全血中的 24 种代表性滥用药进行 LC/MS/MS 定量测定。样品的前处理方法为:采用孔内蛋白质沉淀法 (PPT) 去除蛋白质,然后采用 Captiva EMR-Lipid 净化产品去除脂类。通过以下方式对该方案进行改进:首先加入全血样品,然后加入沉淀溶剂以促进实现彻底的孔内 PPT。整个样品处理在 96 孔板中作为一个批次执行,并通过离心或正压歧管完成样品洗脱。整个过程简单、快速,能够在两小时内完成 96 个样品的前处理。高效基质净化产品使磷脂去除率高于 99%,从而减小了基质离子抑制效应和系统污染。通过为期三天的准确度和精度运行对定量方法进行验证,在所有加标浓度下均获得了优异的准确度 (100±20%) 和精度 (RSD < 15%),全血中的定量限(LOQ) 为 0.1–0.5 ng/mL,且线性校准曲线的 R2 高于 0.995。结果表明,采用孔内PPT 和 Captiva EMR-Lipid 净化产品建立的方案显著改善了人全血中滥用药化合物定量测定结果的可靠性。
方案详情

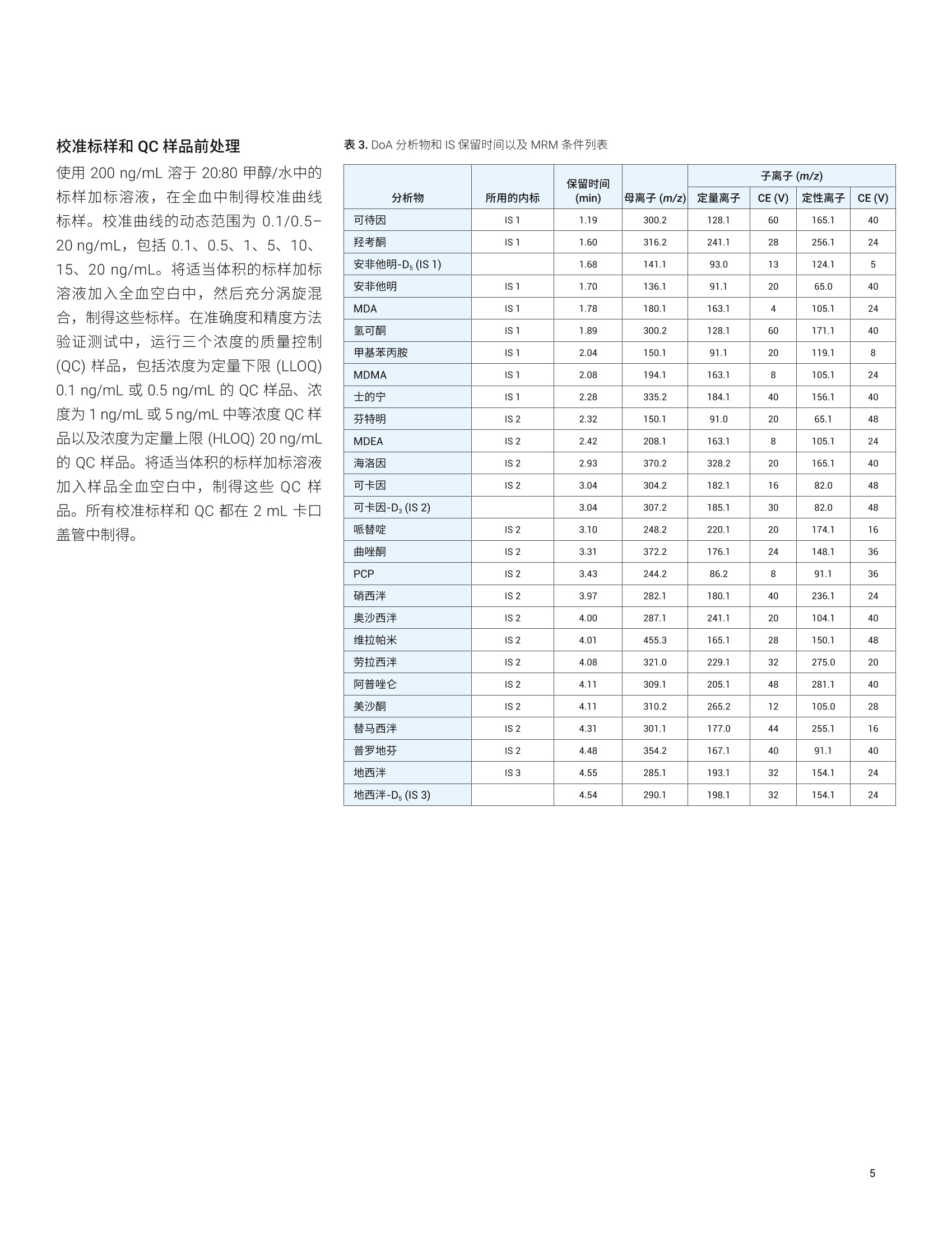
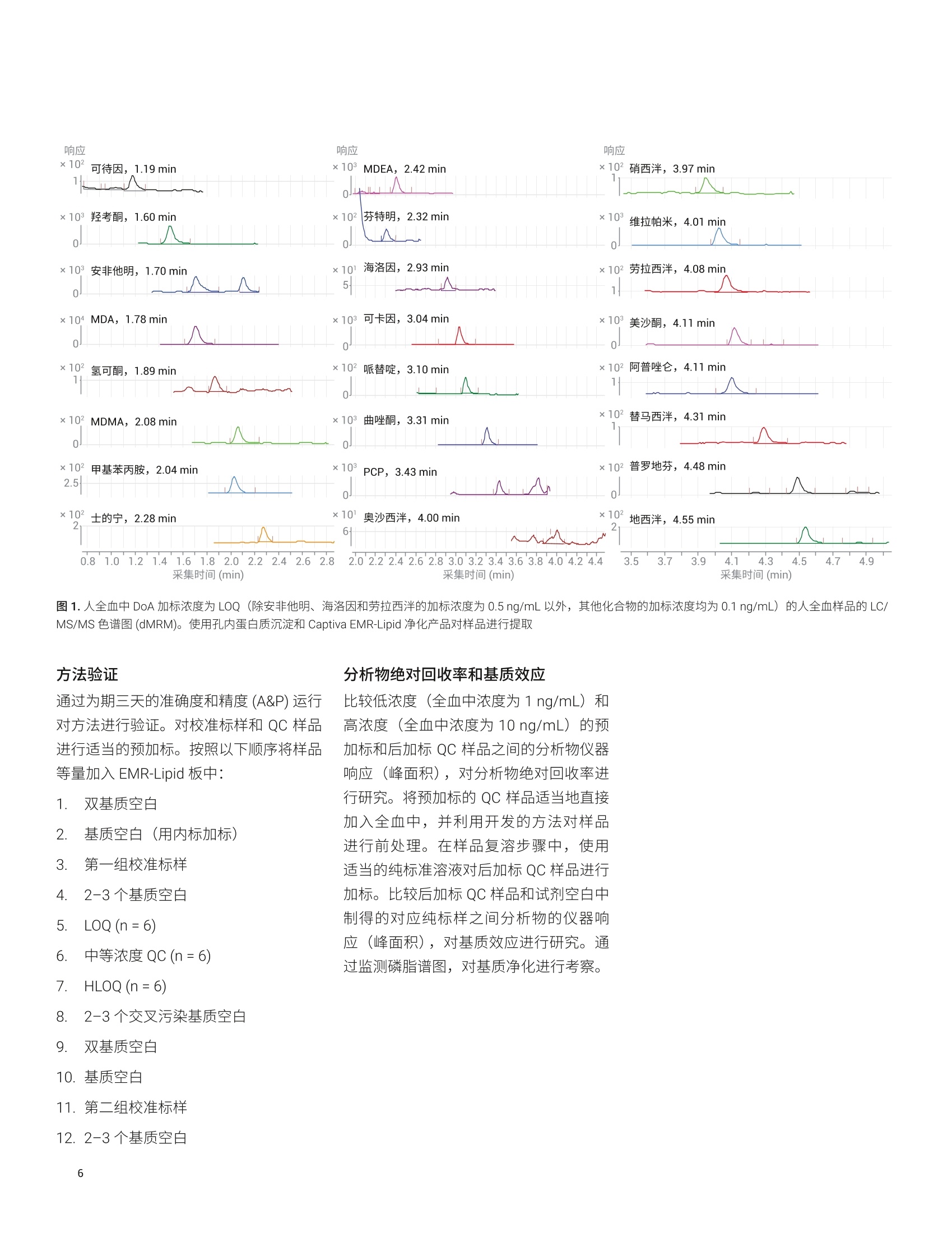
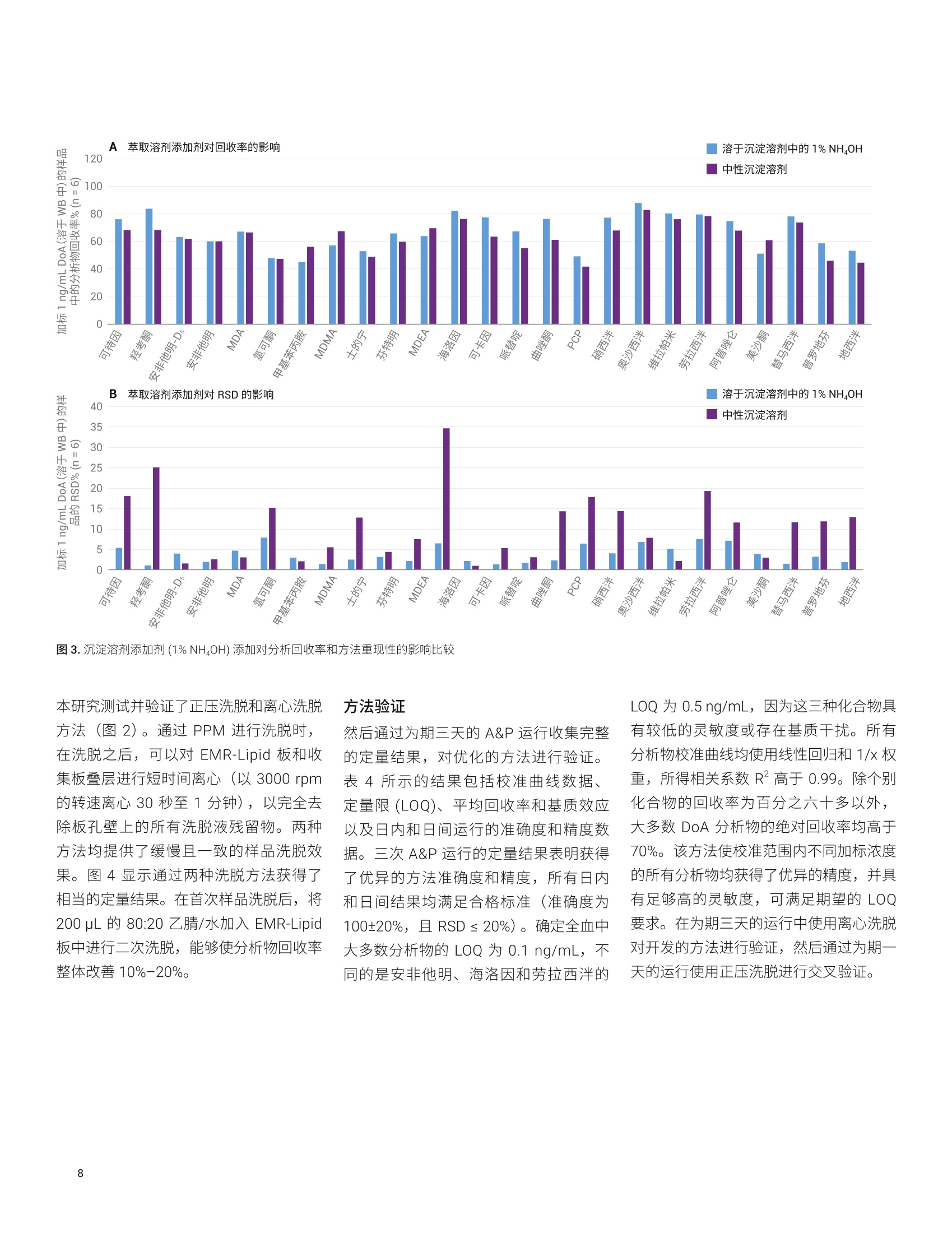
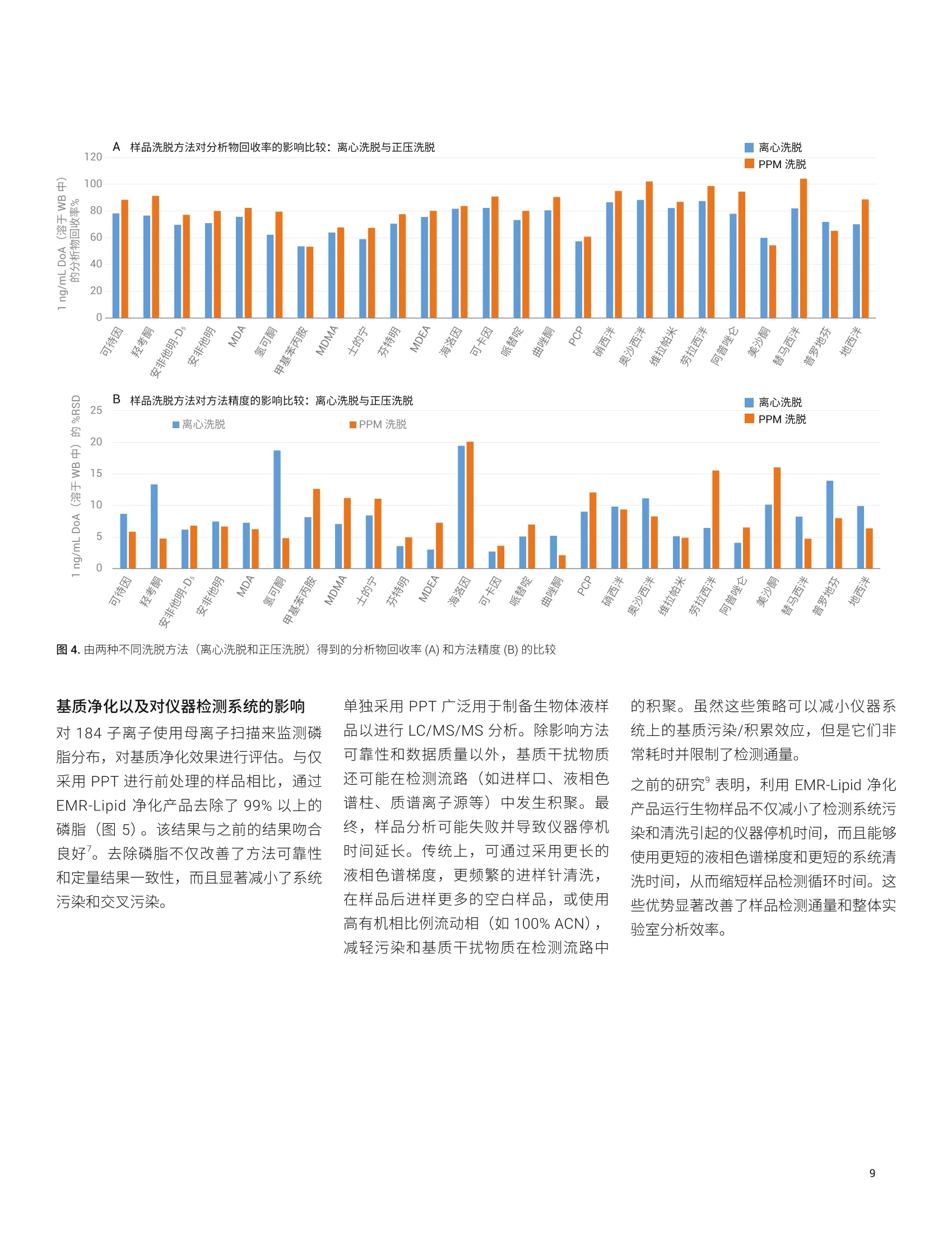
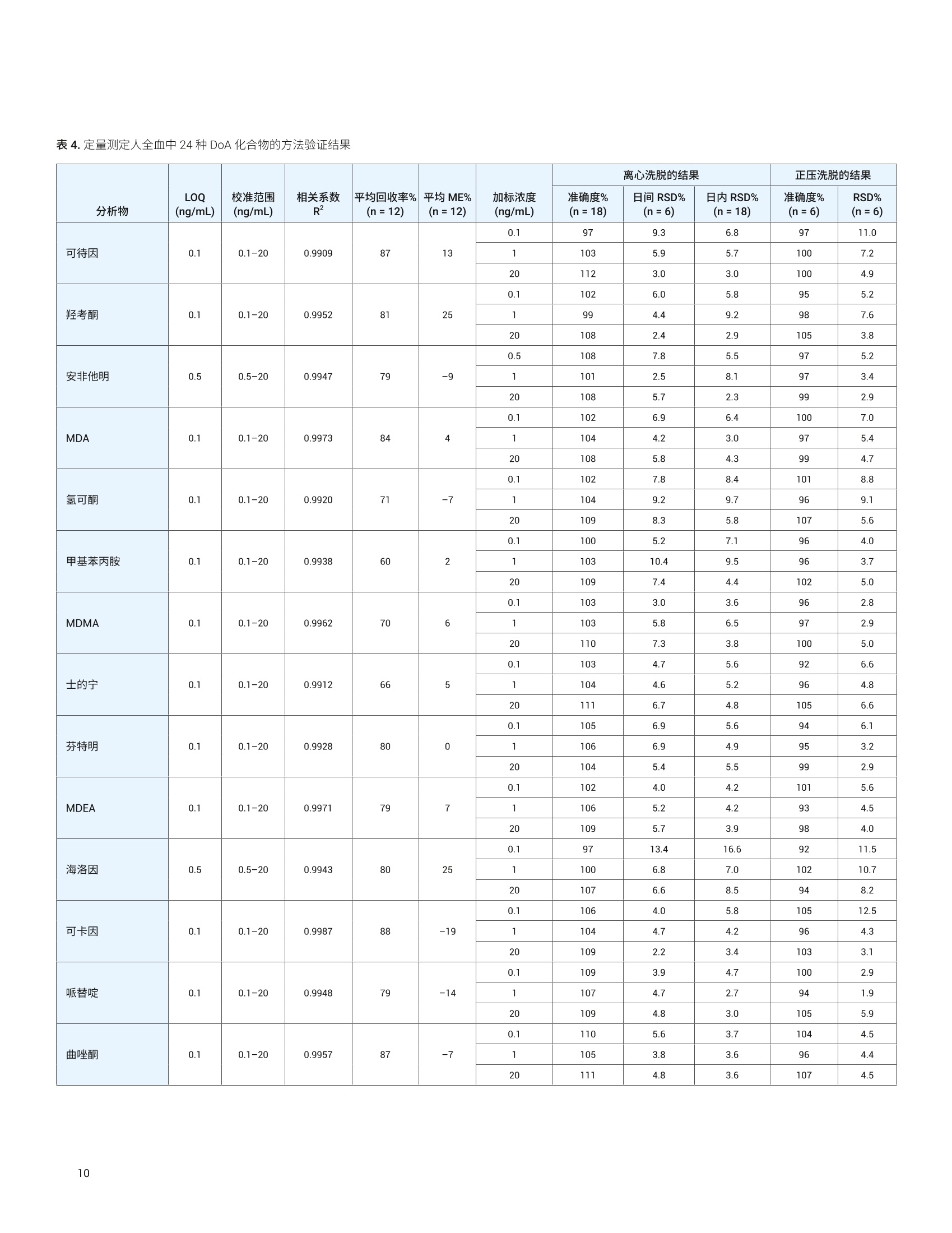
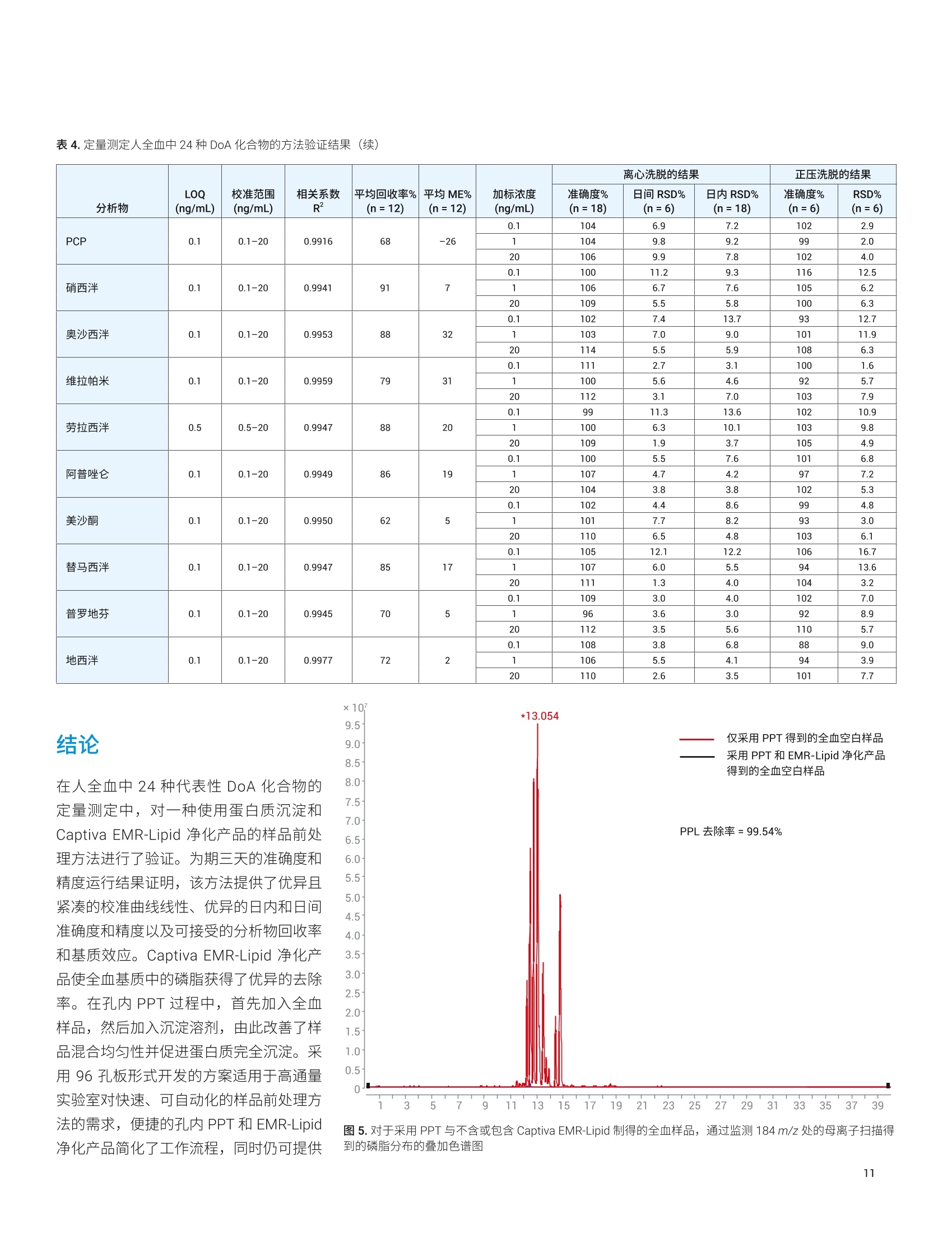
应用简报 Agilent法医学检测Trusted Answers 使用 Agilent Captiva EMR-Lipid净化产品对人全血中的滥用药进行LC/MS/MS定量测定 Limian Zhao 安捷伦科技公司 Agilent Captiva 增强型脂质去除产品 (EMR-Lipid) 是第二代 EMR-Lipid 产品,采用便捷的 SPE 过滤柱或 96孔板。本研究展示了采用 Captiva EMR-Lipid 96 孔板对人全血中的24种代表性滥用药进行 LC/MS/MS 定量测定。样品的前处理方法为:采用孔内蛋白质沉淀法 (PPT)去除蛋白质,然后采用 Captiva EMR-Lipid 净化产品去除脂类。通过以下方式对该方案进行改进:首先加入全血样品,然后加入沉淀溶剂以促进实现彻底的孔内PPT。整个样品处理在96孔板中作为一个批次执行,并通过离心或正压歧管完成样品洗脱。整个过程简单、快速,能够在两小时内完成96个样品的前处理。高效基质净化产品使磷脂去除率高于99%,从而减小了基质离子抑制效应和系统污染。通过为期三天的准确度和精度运行对定量方法进行验证,在所有加标浓度下均获得了优异的准确度(100±20%) 和精度 (RSD<15%), 全血中的定量限(LOQ) 为 0.1-0.5 ng/mL,且线性校准曲线的R’高于 0.995。结果表明,采用孔内PPT 和 Captiva EMR-Lipid 净化产品建立的方案显著改善了人全血中滥用药化合物定量测定结果的可靠性。 在法医毒理学中,对快速可靠地筛查和定量测定生物样本中的滥用药 (DoA)的需求正在不断增加13,主要原因是滥用药以及提交分析的样品数量日益增多。过去,选择尿液样品进行筛查和鉴定。但是,必须对这些药物的代谢物进行鉴定,由此增加了定量检测的复杂度和不确定性。血液样品(包括全血、血浆和血清)的分析日益重要。最初,血浆是定量分析选择的主要样品基质,但是随着样品前处理和仪器检测技术的改进,全血已成为鉴定和定量分析的基质。与尿液相比,使用血液作为样品进行分析具有若干项优势。 首先,这种技术能够在体内代谢和过滤之前立即检测药物 其次,因为生理参数变化的范围非常窄,血液相对均匀 再次,几个欧洲国家和美国一些地区要求毒驾 (DUID) 测试采用血液样品4 因此,可靠地定量测定血液基质(尤其是全血)中的 DoA对于常规毒理学分析非常重要。 目前使用气相色谱/质谱联用系统 (GC/MS) 和液相色谱串联质谱联用系统(LC/MS/MS) 对 DoA 进行毒理学检测。然而, GC/MS 方法通常很耗时,并且通常 需要在分析之前对分析物进行化学衍生。LC/MS/MS分析技术的优势在于检测速度更快,且具有更高的灵敏度、选择性和稳定性。用于系统毒理学分析的样品前处理方法包括液液萃取 (LLE)、固相萃取(SPE)和固相支持液液萃取 (SLE)。这些方法费力费时,并需要使用大量有毒溶济。 安捷伦增强型脂质去除产品 (EMR-Lipid)吸附剂是一种新型吸附材料,能够选择性去除样品基质中的主要脂类且不会造成分析物物失。EMR-Lipid 吸附剂提供的脂质去除机制是基于脂质化合物与这种独特的吸附剂之间的体积排阻和疏水作用。这种相互作用机制能够在 PPT 之后从生物体液中高选择性且高效地去除磷脂及其他脂类。第二代 EMR-Lipid 吸附剂以 SPE 过滤柱/板形式包装,只需使样品通过吸附剂即可完成净化。研究表明,使用 Captiva EMR-Lipid 96 孔板进行孔内PPT,随后进行流通式净化,能够有效去除生物体液中的磷脂,并实现人血清中代表性药物的定量测定7。为证明 CaptivaEMR-Lipid96 孔板对于法医学检测的可行性,本研究选择24种常见的 DoA 化合物。表1列出了所选化合物的化学特性和结构。使用为期三天的准确度和精度测试以及基质净化评估对方法进行验证。 实验部分 试剂与化学品 所有试试和溶剂均为 HPLC 或分析纯级。乙腈(ACN) 购自 Honeywell (Muskegon,MI, USA)。试剂级甲酸(FA)来自安捷伦(部件号 G2453-85060)。乙酸铵和氢氧化铵购自 Sigma-Aldrich (St. Louis, MO,USA)。混合 DoA示准储备液(1pg/mL,溶于甲醇(MeOH)中)来自安捷伦(部件号5190-0470-1)。人全血样品来自Biological Specialty Corp. (Colmar, PA,USA)。内标 (IS) 储备液(1 mg/mL, 溶于MeOH 或 ACN 中)购自 Cerilliant (RoundRock, TX, USA)。 标样和溶液 ( 利用混合 DoA 标准储备液和单独的IS储备液配制标样和 IS加标溶液。夜 20:80甲醇/水中配制浓度为200 ng/mL 的标样加标溶液,用于对校准标样和质量控制 (QC)样品加标。用 20:80 甲醇/水将单独的 IS 储备液稀释至2g/mL, 制得IS加标溶液,并将该 IS味标溶液直接加入样 品中。 ) ( 将385.3 mg 乙酸铵溶于 1 L Milli-Q 水中,然后加入1mL甲酸(FA), 制得含 0.1% FA 的5 mmol/L乙酸铵缓冲液, 作为流动 相A。将1mLFA加入1L乙腈中,制得含0.1% FA的乙腈溶液,作为流动相B。 将400 uL NHOH 加入40 mL 预混合的 95:5 ACN/MeOH中,新鲜配制溶于 95:5 ACN/MeOH 中的1%氢氧化铵(NHOH) 溶 液。该溶液在使用前保存于-20℃下。 ) 表 1. DoA化合物、药物类别、logP、pKa 和结构列表 DoA化合物 类别 pKa LogP 结构 哌替啶 阿片类 8.59 2.72 HgC -CH HC 曲唑酮 三唑吡啶类 6.14 2.9 O PCP 芳基环己胺类 8.29 4.69 .NH2CH3 硝西泮 苯二氮卓类 3.2,10.8 2.25 .NH2 奥沙西泮 苯二氮卓类 1.55,10.9 2.24 XOH 维拉帕米 苯基烷胺类 8.92 3.79 N= 劳拉西泮 苯二氮卓类 13 2.39 -OH 阿普唑仑 苯二氮卓类 11.6 2.12 美沙酮 阿片类 8.93 3.93 NH2 替马西泮 苯二氮卓类 10.86 2.19 OH 普罗地芬 一 6.8 5.1 H:C -CHa H.C 地西泮 苯二氮卓类 3.4 2.82 CI13 H3C- 将 77.06 mg 乙酸铵溶于200 mL Milli-Q水中,制得 5 mmol/L 乙酸铵溶液。以8:2的比例混合上述缓冲液和乙腈,制成复溶溶液。混合80 mL 乙腈和20mL水,制成80:20乙腈/水溶液。 仪器与材料 用于样品前处理的仪器包括: Centra CL3R 离心机 (Thermo IEC,MA, USA) 多管涡旋仪(VWR, PA, USA) Eppendorf 移液器和连续分液器 SPE 干式96蒸发器 安捷伦PPM-96(部件号5191-4116) Agilent Captiva EMR 96孔板(部件号5190-1001) Agilent Captiva 96孔1 mL收集板(部件号 A696001000) Agilent Captiva 96 孔板盖,,10/包(部件号A8961007) 仪器条件 样品在 Agilent 1290 Infinity 液相色谱系统上运行,该液相色谱系统包括 Agilent1290 Infinity 二元泵 (G4220A)、Agilent1290 Infinity 高性能自动进样器 (G4226A)和 Agilent 1290 Infinity 柱温箱 (G1316C)。该液相色谱系统与配备安捷伦喷射流iFunnel 电喷雾离子源的 Agilent G6490 三重四极杆液质联用 LC/MS (G6490A) 系统联用。采用 Agilent MassHunter 工作站软件进行数据采集和分析。仪器方法详细信息见表2。 液相色谱条件 色谱柱 Agilent InfinityLab Poroshell 120, EC-C8,100×2.1 mm, 2.7pm (部件号695775-906(T))Agilent InfinityLab Poroshell 120保护柱, EC-C18,2.1×5 mm, 2.7 pm (部件号821725-911) 流速 0.5mL/min 柱温 60°C 进样量 5 pL 流动相 A) 5 mmol/L醋酸铵缓冲液,含0.1%甲酸的水溶液B)0.1%甲酸的乙腈溶液 进样针清洗 1:1:1:1 ACN/MeOH/IPA/H,O(含0.2%FA) 梯度 时间 (min) %B 流速(mL/min) 0 10 0.5 0.5 10 0.53.0 50 0.54.0 95 0.5 6.0 100 0.5 停止时间 6分钟 后运行时间 2分钟 质谱条件 干燥气温度 120°℃ 气体流速 14L/min 雾化器 40 psi 鞘气温度 400℃ 鞘气流速 12 L/min 毛细管电压 3000V iFunnel 参数 高压RF: 90V(正离子),90V(负离子)低压 RF: 70V(正离子),60V(负离子) 数据采集 dMRM 采集极性 正 有关分析参数,请参见表3;有关人全血中浓度为 LOQ 的 DoA 的 LC/MS/MS色谱图,请参见图1。 校准标样和QC样品前处理 使用 200 ng/mL 溶于 20:80 甲醇/水中的标样加标溶液,在全血中制得校准曲线标样。校准曲线的动态范围为 0.1/0.5-20 ng/mL, 包括0.1、0.5、1、5、10、15、20 ng/mL。将适当体积的标样加标溶液加入全血空白中,然后充分涡旋混合,制得这些标样。在准确度和精度方法验证测试中,运行三个浓度的质量控制(QC)样品,包括浓度为定量下限(LLOQ)0.1 ng/mL 或 0.5 ng/mL 的QC样品、浓度为 1 ng/mL或 5 ng/mL 中等浓度QC样品以及浓度为定量上限(HLOQ) 20 ng/mL的QC样品。将适当体积的标样加标溶液加入样品全血空白中,制得这些QC 样品。所有校准标样和 QC都在2mL卡口盖管中制得。 分析物 所用的内标 保留时间 (min) 母离子(m/z) 子离子(m/z) 定量离子 CE (V) 定性离子 CE (V) 可待因 IS 1 1.19 300.2 128.1 60 165.1 40 羟考酮 IS1 1.60 316.2 241.1 28 256.1 24 安非他明-Ds (IS1) 1.68 141.1 93.0 13 124.1 5 安非他明 IS1 1.70 136.1 91.1 20 65.0 40 MDA IS1 1.78 180.1 163.1 4 105.1 24 氢可酮 IS 1 1.89 300.2 128.1 60 171.1 40 甲基苯丙胺 IS1 2.04 150.1 91.1 20 119.1 8 MDMA IS 1 2.08 194.1 163.1 8 105.1 24 士的宁 IS 1 2.28 335.2 184.1 40 156.1 40 芬特明 IS 2 2.32 150.1 91.0 20 65.1 48 MDEA IS 2 2.42 208.1 163.1 8 105.1 24 海洛因 IS 2 2.93 370.2 328.2 20 165.1 40 可卡因 IS 2 3.04 304.2 182.1 16 82.0 48 可卡因-Ds (IS2) 3.04 307.2 185.1 30 82.0 48 哌替啶 IS 2 3.10 248.2 220.1 20 174.1 16 曲唑酮 IS 2 3.31 372.2 176.1 24 148.1 36 PCP IS 2 3.43 244.2 86.2 8 91.1 36 硝西泮 IS2 3.97 282.1 180.1 40 236.1 24 奥沙西泮 IS 2 4.00 287.1 241.1 20 104.1 40 维拉帕米 IS 2 4.01 455.3 165.1 28 150.1 48 劳拉西泮 IS 2 4.08 321.0 229.1 32 275.0 20 阿普唑仑 IS2 4.11 309.1 205.1 48 281.1 40 美沙酮 IS 2 4.11 310.2 265.2 12 105.0 28 替马西泮 IS 2 4.31 301.1 177.0 44 255.1 16 普罗地芬 IS 2 4.48 354.2 167.1 40 91.1 40 地西泮 IS 3 4.55 285.1 193.1 32 154.1 24 地西尼-Ds (IS 3) 4.54 290.1 198.1 32 154.1 24 图1.人全血中 DoA 加示浓度为 LOQ(除安非他明、海洛因和劳拉西泮的加标浓度为0.5ng/mL以外,其他化合物的加标浓度均为 0.1 ng/mL) 的人全血样品的 LC/MS/MS 色谱图 (dMRM)。使用孔内蛋白质沉淀和 Captiva EMR-Lipid 净化产品对样品进行提取 方法验证 通过为期三天的准确度和精度(A&P)运行对方法进行验证。对校准标样和 QC 样品进行适当的预加标。按照以下顺序将样品等量加入 EMR-Lipid 板中: 1. 双基质空白 2. 基质空白(用内标加标) 3. 第一组校准标样 4. 2-3个基质空白 5. LOQ(n=6) 6. 中等浓度QC(n=6) 7. HL0Q(n=6) 8. 2-3个交叉污染基质空白 9. 双基质空白 10. 基质空白 11. 第二组校准标样 12.2-3个基质空白 分析物绝对回收率和基质效应 比较低浓度(全血中浓度为1ng/mL)和高浓度(全血中浓度为10 ng/mL)的预加标和后加标QC样品之间的分析物仪器响应(峰面积),对分析物绝对回收率进行研究。将预加标的 QC 样品适当地直接加入全血中,并利用开发的方法对样品进行前处理。在样品复溶步骤中,使用适当的纯标准溶液对后加标QC样品进行加标。比较后加标 QC 样品和试剂空白中制得的对应纯标样之间分析物的仪器响应(峰面积),对基质效应进行研究。通过监测磷脂谱图,对基质净化进行考察。 样品萃取 图2介绍了样品前处理过程。在样品前处理之前,将96孔收集板置于 Captiva EMR-Lipid 板下方。对板叠层执行各个步骤,直至收集到洗脱液。首先加入血液样品,然后加入沉淀溶剂,使全血中的蛋白质发生孔内沉淀。这种添加顺序可显著改善样品混合均匀性,并确保蛋白质沉淀完全。Captiva EMR-Lipid 板的深度过滤设计使样品洗脱过程流畅,且不会堵塞。本研究分别测试并验证了通过 PPM 和离心这两种样品洗脱方法。 方法开发 全血孔内 PPT:人全血是一种高度粘稠的体液,因此全血样品处理和制备通常具有挑战性。与血浆和血清不同,全血包含血细胞和阵多的蛋白质,在 PPT过程中产生较多的沉淀物。建议首先添加全血,然后在96孔 EMR-Lipid 板上加入用于孔内 PPT的沉淀溶剂。这种添加顺序对于提供更出色的 PPT 效率、简化工作流程并减小样品损失和交叉污染至关重要。 沉淀溶剂:据报道,使用冷 MeOH/ACN溶剂是一种便捷的方法,能够破坏红细胞,将其内容物(细胞质)释放到周围血浆中,并由此形成粉状沉淀物1。首先基于之前的研究使用 15:85 MeOH/ACN,但是一些分析物表现出的回收率略低。将沉淀溶剂改性为 5:95 MeOH/ACN。 将 Captiva EMR-Lipid 96 孔板置于 Captiva 1 mL收集板上 以 600 ppm 的转速离心5分钟 在2-5 psi下,用PPM-96 洗脱约5分钟 将100 uL 全血等量加入每个孔中 加入200 uL 的 80:20 ACN/水 加入200 pL 的 80:20 ACN/水 加入10 pLIS, 盖上孔板, 以1350 rpm 的转速对孔板涡旋2分钟 以600 rpm 的转速离心3分钟, 然后以 3000 rpm 的转速离心2分钟 在2-5 psi 下,用PPM-96 洗脱约3分钟在6-9 psi下,排空小柱并持续约1分钟 加入500pL 含1%NH40H 的冷 95:5 ACN/MeOH,然后将样品静置5分钟 检查每个孔中的洗脱液,然后在40°℃用N2流吹干样品。 选项2 使用 100 pL 20:80 ACN/5 mmol/L 乙酸铵缓冲液将干燥样品复溶 以1350rpm 的转速涡旋2分钟,超声5分钟,以4000 rpm 的转速离心2分钟 样品可直接进行 LC/MS/MS分析 图2.在人全血样品前处理过程中,使用孔内蛋白质沉淀,然后采用 Captiva EMR-Lipid 净化产品。在96孔板形式中,将样品作为一个批次进行前处理 由于建议在全血 PPT中避免使用酸性沉淀溶剂,因此本研究中对中性沉淀溶剂和碱性沉淀溶剂进行了测试。使用中性沉淀溶剂的 PPT上清液稍显浑浊,表明 PPT 效果较差。向沉淀溶剂中加入 NHOH (1%)能够改善方法重现性并获得较低的 RSD,一些分析物回收率略有降低(图3)。因此,在全血孔内PPT过程中,使用含1%NHOH 的5:95MeOH/ACN 作为沉淀溶剂。 EMR-Lipid 板上的样品洗脱: CaptivaEMR-Lipid 板形式为 PPT之后的生物体液提取物提供了便捷的直通净化,使磷脂去除率达到99%以上。为获得令人满意的脂质去除效率,在样品洗脱过程中采用适当的流速非常重要,因为它在样品和EMR-Lipid 吸附剂之间提供了更出色的相互作用。强烈建议使用每3-5秒一滴的洗脱流速。在96孔板样品洗脱中,洗脱控制方法有三种: 来自板底部的真空 来自板顶部的正压 离心 来自板底部的真空在之前的应用简报中有所描述,在样品洗脱中通常使用 2-4英寸汞柱的真空度。 本研究测试并验证了正压洗脱和离心洗脱方法(图2)。通过 PPM 进行洗脱时,在洗脱之后,可以对 EMR-Lipid 板和收集板叠层进行短时间离心(以3000 rpm的转速离心30秒至1分钟),以完全去除板孔壁上的所有洗脱液残留物。两种方法均提供了缓慢且一致的样品洗脱效果。图4显示通过两种洗脱方法获得了相当的定量结果。在首次样品洗脱后,将200 uL 的 80:20乙月/水加入 EMR-Lipid板中进行二次洗脱,能够使分析物回收率整体改善10%-20%。 方法验证 然后通过为期三天的 A&P 运行收集完整的定量结果,对优化的方法进行验证。表4所示的结果包括校准曲线数据、定量限(LOQ)、平均回收率和基质效应以及日内和日间运行的准确度和精度数据。三次 A&P 运行的定量结果表明获得了优异的方法准确度和精度,所有日内和日间结果均满足合格标准((准确度为100±20%,且 RSD≤ 20%)。确定全血中大多数分析物的 LOQ 为 0.1 ng/mL, 不同的是安非他明、海洛因和劳拉西泮的 LOQ 为 0.5 ng/mL, 因为这三种化合物具有较低的灵敏度或存在基质干扰。所有分析物校准曲线均使用线性回归和1/x权重,所得相关系数R²高于0.99。除个别化合物的回收率为百分之六十多以外,大多数 DoA分析物的绝对回收率均高于70%。该方法使校准范围内不同加标浓度的所有分析物均获得了优异的精度,并具有足够高的灵敏度,可满足期望的 LOQ要求。在为期三天的运行中使用离心洗脱对开发的方法进行验证,然后通过为期一天的运行使用正压洗脱进行交叉验证。 基质净化以及对仪器检测系统的影响! 对184子离子使用母离子扫描来监测磷脂分布,对基质净化效果进行评估。与仅采用 PPT 进行前处理的样品相比,通过EMR-Lipid 净化产品去除了99%以上的磷脂(图5)。该结果与之前的结果吻合良好。去除磷脂不仅改善了方法可靠性和定量结果一致性,而且显著减小了系统污染和交叉污染。 单独采用 PPT 广泛用于制备生物体液样品以进行 LC/MS/MS 分析。除影响方法可靠性和数据质量以外,基质干扰物质还可能在检测流路(如进样口、液相色谱柱、质谱离子源等)中发生积聚。最终,样品分析可能失败并导致仪器停机时间延长。传统上,可通过采用更长的液相色谱梯度,更频繁的进样针清洗,在样品后进样更多的空白样品,或使用高有机相比例流动相(如100%ACN),减轻污染和基质干扰物质在检测流路中 的积聚。虽然这些策略可以减小仪器系统上的基质污染/积累效应,但是它们非常耗时并限制了检测通量。 之前的研究°表明,利用 EMR-Lipid 净化产品运行生物样品不仅减小了检测系统污染和清洗引起的仪器停机时间,而且能够使用更短的液相色谱梯度和更短的系统清洗时间,从而缩短样品检测循环时间。这些优势显著改善了样品检测通量和整体实验室分析效率。 表4.定量测定人全血血 24种 DoA化合物的方法验证结果 表4.定量测定人全血中24 种 DoA 化合物的方法验证结果(续) 在人全血中24种代表性 DoA 化合物的定量测定中,对一种使用蛋白质沉淀和Captiva EMR-Lipid 净化产品的样品前处理方法进行了验证。为期三天的准确度和精度运行结果证明,该方法提供了优异且紧凑的校准曲线线性、优异的日内和日间准确度和精度以及可接受的分析物回收率和基质效应。 Captiva EMR-Lipid 净化产品使全血基质中的磷脂获得了优异的去除率。在孔内PPT过程中,首先加入全血样品,然后加入沉淀溶剂,由此改善了样品混合均匀性并促进蛋白质完全沉淀。采用96孔板形式开发的方案适用于高通量实验室对快速、可自动化的样品前处理方法的需求,便捷的孔内 PPT 和 EMR-Lipid净化产品简化了工作流程,同时仍可提供 图5.对于采用 PPT 与不含或包含 Captiva EMR-Lipid 制得的全血样品,通过监测184 m/z 处的母离子扫描得到的磷脂分布的叠加色谱图 ( 参考文献 ) ( 1. M ali, N.; Karpe,M.; Kadam, V.A review o n b iological m atricesand analytical methods used fordetermination of d rug of abuse,J.Applied Pharmaceutical Science 2011,06,58-65 ) ( 2. S aito, K .; et al. Analysis of Drugsof Abuse in Biological Specimens,J. Health Science 2011, 57(6), 472-487 ) ( 3. Moeller, M. R.; Steinmeyer, S.; Kraemer, T. Determination of drugs of abuse in blood, J. Chromatog. B 1998,713,91-109. ) 4. Moeller, M. R.; Kraemer, T. Drugsof Abuse Monitoring in Bloodfor Control of Driving Under theInfluence of Drugs, TherapeuticDrug Monitoring 2002,24,210-221 5. Cheong,J. C.; et al. Gaschromatography-massspectrometric method for thescreening and quantification of illicitdrugs and their metabolites in humanurine using solid-phase extractionand trimethylsilyl derivatization, J.Sep. Sci. 2010, 33,1767-1778 ( 6. O iestad, E. L .; et al . Drug Screeningof Whole Blood by Ultra-PerformanceLiquid Chromatography-TandemMass S p ectrometry, J . Analytical Toxicology 2011, 35,280-293 ) ( 7. Zhao, L.; Lucas, D. Efficiency ofBiological Fluid Matrix RemovalUsing Agilent Captiva EMR-LipidCleanup (使用 Agilent Captiva EMR- Lipid 净化产品去除生物体液基质的 效率),安捷伦科技公司应用简报, 出版号5991-8006EN,2017 ) ( 8. Zhao, L.; Lucas, D. 使用 Agilent E MR-Lipid 净化产品对人血清中的药物进 行 LC/MS/MS定量分析,安捷伦科技公司应用简报,出版号5991- 8007CHCN,2017 ) ( Protein Precipitation for BiologicalFluid Samples Using Agilent CaptivaEMR-Lipid 96-well Plate s (使用Agilent Captiva EMR-Lipid 96 孔板 对生物体液样品进行蛋白质沉淀), 安捷伦科技公司应用简报,出版号 5991-9222EN,2018 ) ( 10. Stevens,J.; Zhao, L .使用 Agilent Captiva EMR-Lipid 和 LC-MS/MS对 全血中的 THC 和代谢物进行高效定量分析,安捷伦科技公司应用简报, 出版号 5991-8635ZHCN, 2017 ) 摘要Agilent Captiva 增强型脂质去除产品 (EMR-Lipid) 是第二代 EMR-Lipid 产品,采用便捷的 SPE 过滤柱或 96 孔板。本研究展示了采用 Captiva EMR-Lipid 96 孔板对人全血中的 24 种代表性滥用药进行 LC/MS/MS 定量测定。样品的前处理方法为:采用孔内蛋白质沉淀法 (PPT) 去除蛋白质,然后采用 Captiva EMR-Lipid 净化产品去除脂类。通过以下方式对该方案进行改进:首先加入全血样品,然后加入沉淀溶剂以促进实现彻底的孔内 PPT。整个样品处理在 96 孔板中作为一个批次执行,并通过离心或正压歧管完成样品洗脱。整个过程简单、快速,能够在两小时内完成 96 个样品的前处理。高效基质净化产品使磷脂去除率高于 99%,从而减小了基质离子抑制效应和系统污染。通过为期三天的准确度和精度运行对定量方法进行验证,在所有加标浓度下均获得了优异的准确度 (100±20%) 和精度 (RSD < 15%),全血中的定量限(LOQ) 为 0.1–0.5 ng/mL,且线性校准曲线的 R2 高于 0.995。结果表明,采用孔内PPT 和 Captiva EMR-Lipid 净化产品建立的方案显著改善了人全血中滥用药化合物定量测定结果的可靠性。前言在法医毒理学中,对快速可靠地筛查和定量测定生物样本中的滥用药 (DoA) 的需求正在不断增加,主要原因是滥用药以及提交分析的样品数量日益增多。过去,选择尿液样品进行筛查和鉴定。但是,必须对这些药物的代谢物进行鉴定,由此增加了定量检测的复杂度和不确定性。血液样品(包括全血、血浆和血清)的分析日益重要。最初,血浆是定量分析选择的主要样品基质,但是随着样品前处理和仪器检测技术的改进,全血已成为鉴定和定量分析的基质。与尿液相比,使用血液作为样品进行分析具有若干项优势。• 首先,这种技术能够在体内代谢和过滤之前立即检测药物• 其次,因为生理参数变化的范围非常窄,血液相对均匀• 再次,几个欧洲国家和美国一些地区要求毒驾 (DUID) 测试采用血液样品因此,可靠地定量测定血液基质(尤其是全血)中的 DoA 对于常规毒理学分析非常重要。目前使用气相色谱/质谱联用系统(GC/MS) 和液相色谱串联质谱联用系统(LC/MS/MS) 对 DoA 进行毒理学检测。然而,GC/MS 方法通常很耗时,并且通常需要在分析之前对分析物进行化学衍生。LC/MS/MS 分析技术的优势在于检测速度更快,且具有更高的灵敏度、选择性和稳定性。用于系统毒理学分析的样品前处理方法包括液液萃取 (LLE)、固相萃取 (SPE) 和固相支持液液萃取 (SLE)。这些方法费力费时,并需要使用大量有毒溶剂。安捷伦增强型脂质去除产品 (EMR-Lipid) 吸附剂是一种新型吸附材料,能够选择性去除样品基质中的主要脂类且不会造成分析物损失。EMR-Lipid 吸附剂提供的脂质去除机制是基于脂质化合物与这种独特的吸附剂之间的体积排阻和疏水作用。这种相互作用机制能够在 PPT 之后从生物体液中高选择性且高效地去除磷脂及其他脂类。第二代 EMR-Lipid 吸附剂以 SPE 过滤柱/板形式包装,只需使样品通过吸附剂即可完成净化。研究表明,使用 Captiva EMR-Lipid 96 孔板进行孔内 PPT,随后进行流通式净化,能够有效去除生物体液中的磷脂,并实现人血清中代表性药物的定量测定。为证明 Captiva EMR-Lipid 96 孔板对于法医学检测的可行性,本研究选择 24 种常见的 DoA 化合物。表 1 列出了所选化合物的化学特性和结构。使用为期三天的准确度和精度测试以及基质净化评估对方法进行验证。结论在人全血中 24 种代表性 DoA 化合物的定量测定中,对一种使用蛋白质沉淀和 Captiva EMR-Lipid 净化产品的样品前处理方法进行了验证。为期三天的准确度和精度运行结果证明,该方法提供了优异且紧凑的校准曲线线性、优异的日内和日间准确度和精度以及可接受的分析物回收率和基质效应。Captiva EMR-Lipid 净化产品使全血基质中的磷脂获得了优异的去除率。在孔内 PPT 过程中,首先加入全血样品,然后加入沉淀溶剂,由此改善了样品混合均匀性并促进蛋白质完全沉淀。采用 96 孔板形式开发的方案适用于高通量实验室对快速、可自动化的样品前处理方法的需求,便捷的孔内 PPT 和 EMR-Lipid 净化产品简化了工作流程,同时仍可提供高效的样品提取和基质净化。更干净的分析样品还可缩短清洗仪器检测系统所需的时间,改善样品检测通量和数据质量。
确定





还剩10页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《人全血中滥用药检测方案(液相色谱仪)》,该方案主要用于司法鉴定中滥用药检测,参考标准--,《人全血中滥用药检测方案(液相色谱仪)》用到的仪器有Agilent 1290 Infinity II 液相色谱系统、Agilent Ultivo LC/MS/MS 三重四极杆液质联用系统、Agilent 1290 Infinity II Multisampler、OpenLAB 软件
推荐专场
相关方案
更多
该厂商其他方案
更多
























