本应用证明,脂质组学分析工作流程(包括 Lipid Annotator 软件)大大改善了脂质标注和复杂样品的差异分析。我们采用靶向工作流程研究了急性髓性白血病K562 细胞系对 BEZ 和 MPA 候选药物组合的脂质组变化响应。分析结果显示,药物处理后发生了一些细胞变化,包括二酰甘油减少、三酰甘油增加,以及脂肪酰基成分的变化。总而言之,这些结果支持之前的报道,表明 BaP 组合可能通过诱导脂肪生成紊乱发挥其抗癌特性。
与传统的鸟枪法脂质组学方法相比,这种脂质分析工作流程还可提供更全面的脂质标注。具体而言,我们鉴定了 BaP 处理诱导的脂类丰度的显著差异,并且之前报道中未报告这些差异。我们还鉴定了色谱分离脂质异构体的具体案例,这些异构体对药物处理表现出不同的响应。最后,我们采用一种非靶向方法表明,可以用补充工具为未标注脂质特征提供建议的候选化合物标注。
方案详情

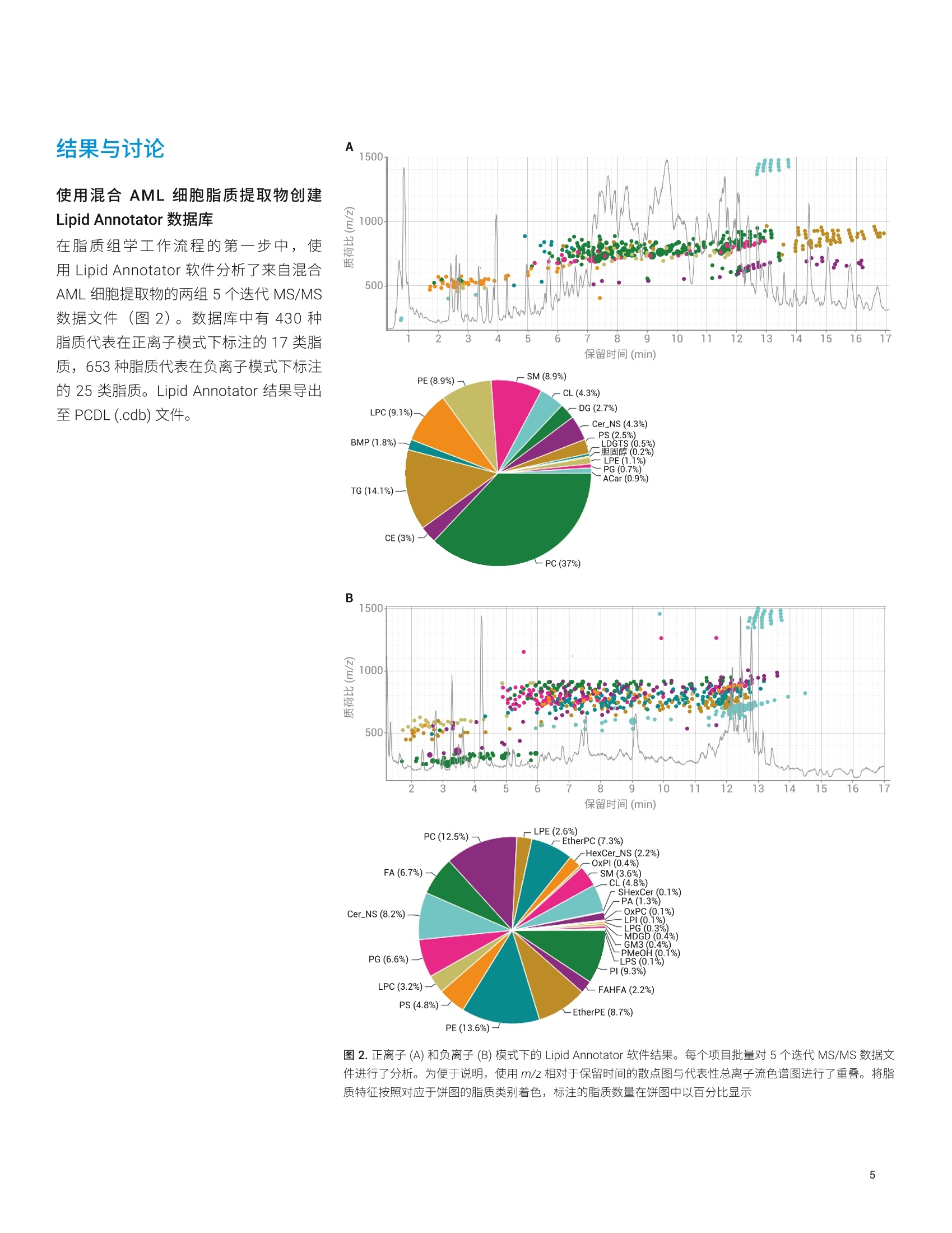
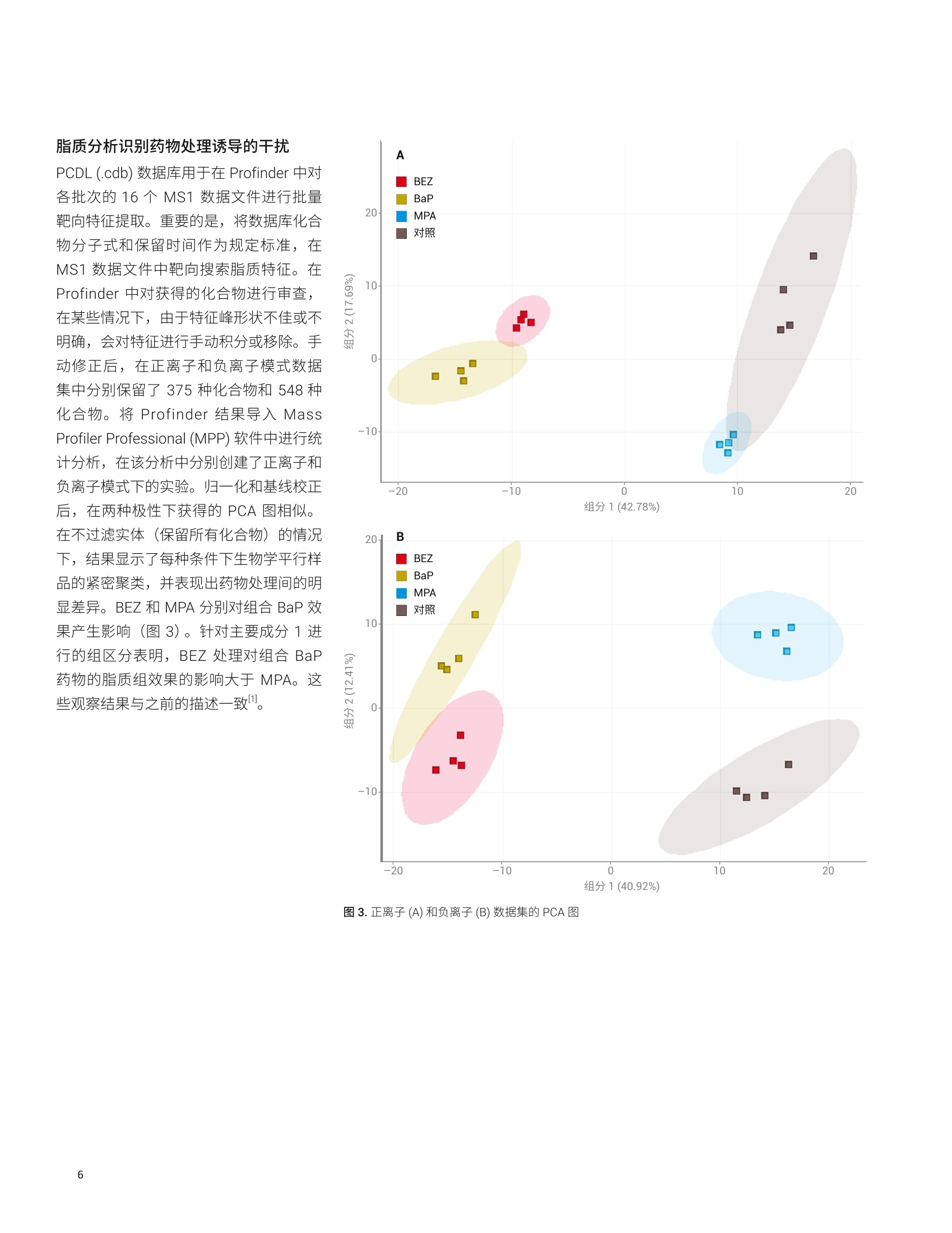
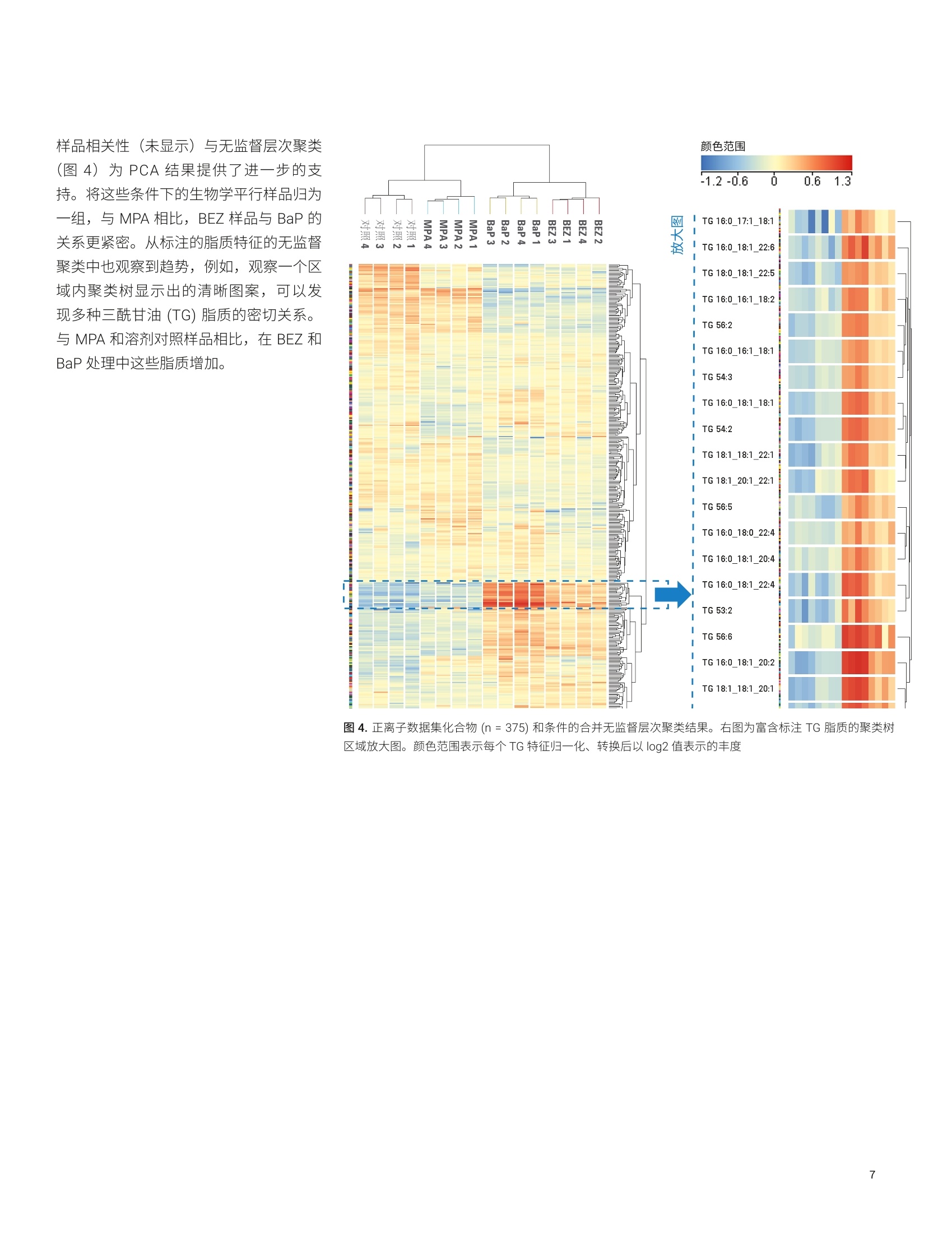
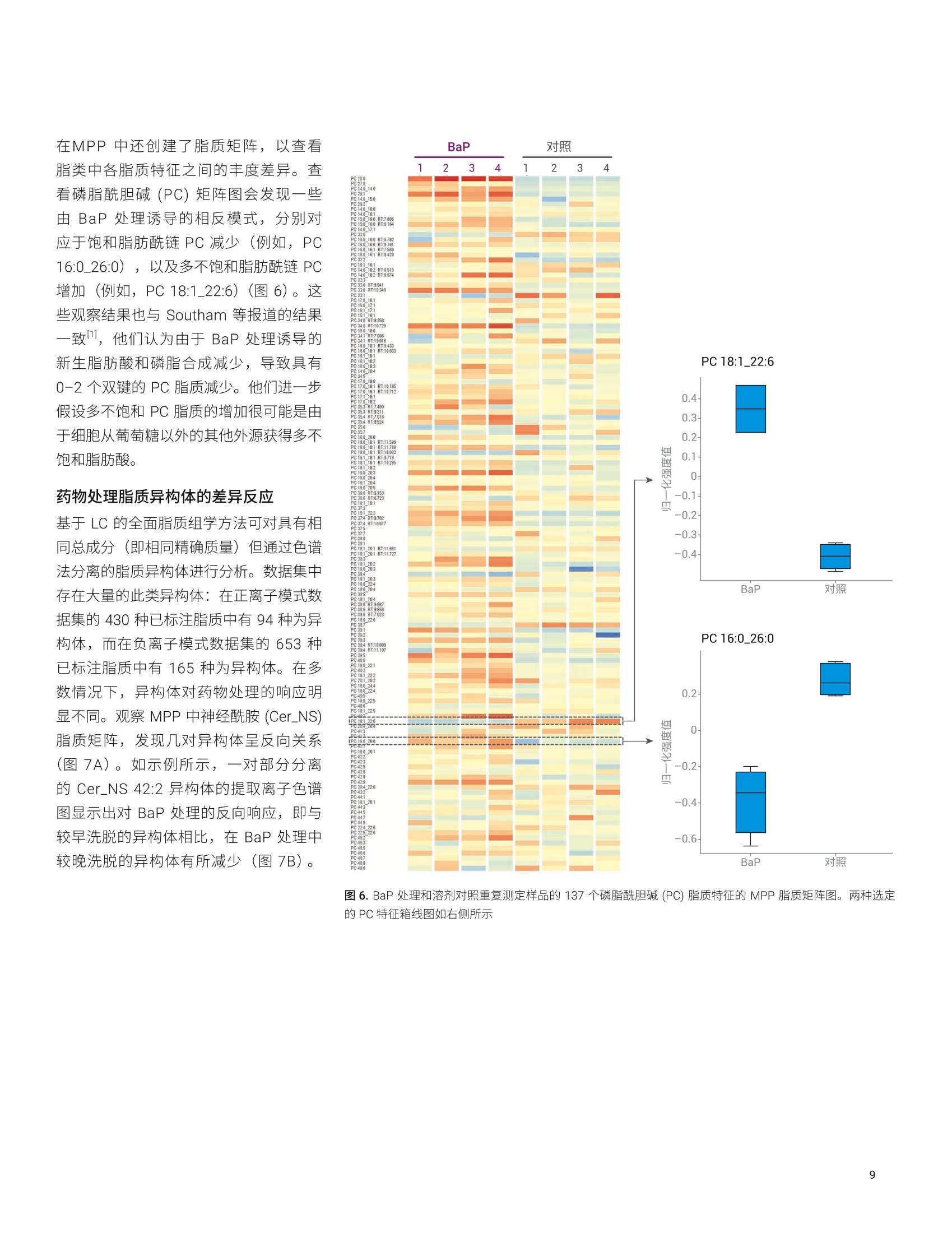
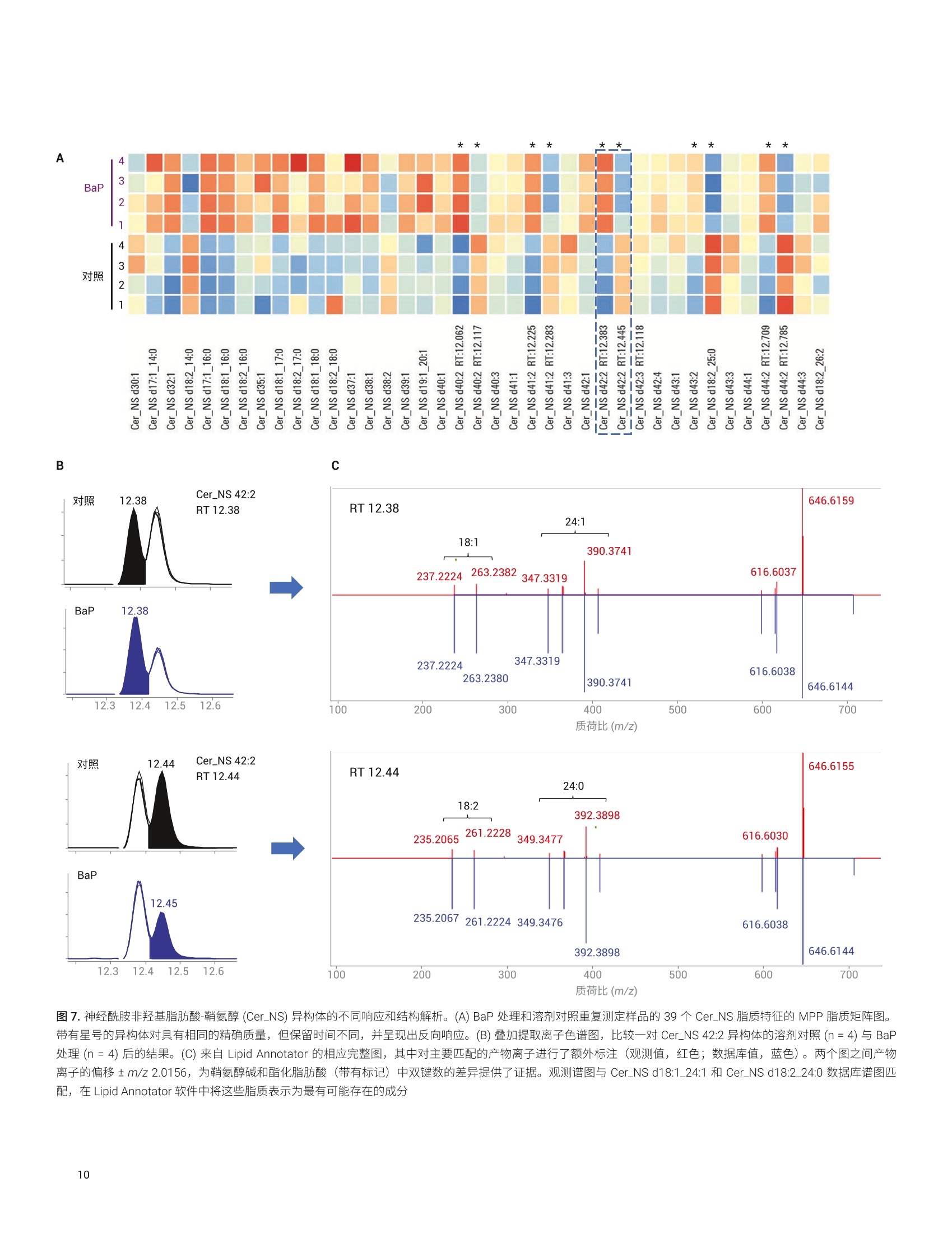
应用简报 Agilent脂质组学Trusted Answers 脂质分析工作流程展示了药物处理诱导的白血病细胞脂肪生成紊乱 使用 Agilent 6546 LC/Q-TOF 和 MassHunter LipidAnnotator 软件 Mark Sartain, Genevieve Van de Bittner, Sarah Stow 本应用使用基于 Agilent 6546 LC/Q-TOF 和 Agilent MassHunter Lipid Annotator 软件的安捷伦脂质组学分析工作流程,进行了药物处理的急性髓性白血病 (AML)细胞的研究。结果证实了之前报道的观察结果,并进一步揭示了脂质差异。由于这一全面工作流程扩展了脂质覆盖率,使差异变得更加明显。 安捷伦科技有限公司 Santa Clara, CA 之前的研究表明,降脂药物苯扎贝特(BEZ)和避孕药醋酸甲羟孕酮(MPA)的药物组合(BaP) 对 AML(一种侵袭性血癌)具有强大的抗癌特性。作者通过一系列实验(包括脂质分析)进一步表明,BaP 通过下调生脂酶来减缓新生脂肪酸和磷脂的生物合成,并提出脂肪生成失调是 BaP 发挥抗癌作用的主要因素。 作为一项原理论证研究,我们应用脂质组学分析工作流程来分析 AML K562 细胞系对 BEZ、MPA和 BaP 药物组合的脂质变化响应。使用 6546 LC/Q-TOF 执行安捷伦脂质分析工作流程。该质谱仪专门设计用于同时提供宽动态范围和高分辨率,并且其分辨率不受采集速率的影响。工作流程的关键在于 MassHunter LipidAnnotator 软件,它可以快速标注脂质MS/MS 谱图并轻松生成标注覆盖范围较宽的检测脂质的自定义谱库。这些谱库是完整脂质分析工作流程的重要组成部分,支持靶向和非靶向脂质组学分析。 细胞培养 将 AML K562细胞置于补充 RPMI 培养基中培养。将细胞以2.4×105个细胞/mL(3mL/孔)的浓度接种至六孔板,并以四种不同的方式进行药物处理:0.5mmol/LBEZ、5 mmol/L MPA、BaP (0.5 mmol/LBEZ和 5 mmol/L MPA的组合)或对照(乙醇:DMSO 1:1)。每种处理方式重复四个孔。在孵育24小时后,对细胞进行离心沉淀,用PBS(含 Ca和Mg, 1mL,4℃)清洗,再次离心沉淀,在-80℃条件下急冻储存。图1展示了细胞培养策略。 脂质提取 将细胞团块置于冰上解冻,并用改进的Folch 提取法提取脂质。将甲醇(200pL)加入2 mL Eppendorf 管内的每个细胞团块中,使用涡旋振荡仪将管振荡2分钟。加入氯仿(400 pL),使用涡旋振荡仪将管振荡2分钟。向每个样品中加入 120 uL水,诱导相分配。然后将混合物涡旋混合2分钟,并在4℃下以16000×g离心5分钟。用气密玻璃注射器小心取出下层,并转移到另外的 Eppendorf 管中。向混合物中加入450 uL 氯仿/甲醇/水(86:14:1, v/v/v) 混合物,涡旋混合2分钟后离心,萃取之前剩余的中间层和上层。 将提取的下层物质混合并加入600 uL氯仿/甲醇/水 (3:48:47, v/v/v) 混合物,将溶液涡旋混合2分钟后离心。将下层转移到新的 Eppendorf 管中,使用真空浓缩仪对其进行干燥,然后用200 uL 复溶溶剂(甲醇/氯仿(9:1,v/v))复溶,并短暂涡旋混合。分离和浓缩提取物,用于以下几种LC/MS采集方法: 正离子模式 LC/MS样品: 1.将50 pL提取物转移到去活玻璃样品瓶内插管中,用于采集每个重复样品的 MS1 数据 2.在一个玻璃样品瓶内插管中混合来自每个50 pL样品的 10 pL等分试样(16个样品=160uL)。使用真空浓缩仪对混合等分试样进行浓缩,然后将其复溶于 50pL复溶溶剂,用于自动 MS/MS (迭代MS/MS) 数据采集 负离子模式 LC/MS样品: 1.将每份剩余的150 pL 提取物转移到去活玻璃样品瓶内插管中,利用真空浓缩仪对其进行干燥。将样品复溶于 50pL复溶溶剂,用于采集每个重复样品的 MS1 数据 2.在一个玻璃样品瓶内插管中混合来自每个50 uL复溶样品的 10 uL等分试样(16个样品=160pL)。使用真空浓缩仪对混合等分试样进行浓缩,然后将其复溶于 50 pL复溶溶剂,用于自动 MS/MS(迭代MS/MS)数据采集 所有样品的进样量均为5pL 仪器 液相色谱系统: Agilent 1290 InfinityⅡ液相色谱系统包括: · Agilent 1290 Infinity ll高速泵(G7120A) ·配备恒温恒的 Agilent 1290Infinity Ⅱ样品瓶进样器 (G7129B) · Agilent 1290 Infinity lI高容量柱温箱(G7116B) 自 质谱系统:配备安捷伦喷射流技术离子源的 Agilent 6546 LC/Q-TOF 方法 通过迭代 MS/MS 采集代表16个样品(4种条件×4次重复进样)的混合K562 脂质提取物。迭代MS/MS 采集为全自动Q-TOF 采集模式,对样品多次进样,并循环排除之前进样中选择用于 MS/MS 碎裂的母离子。之前有研究已经证明了迭代MS/MS 可以从单个样品中获取大量脂质标注的价值。 按照之前介绍的详细实验方法进行色谱和自动MS/MS质谱分析;方法参数如表1和表2所示。此外,采集了各个样品的单纯质谱数据, MS 采集速率为3谱图/秒。 表1.色谱条件 参数 Agilent 1290 Infinity Ⅱ液相色谱系统 分析柱 Agilent InfinityLab Poroshell 120 EC-C18, 3.0×100 mm, 2.7 pm (部件号695975-302) 保护柱 Agilent InfinityLab Poroshell 120 EC-C18, 3.0×5 mm, 2.7 pm (部件号823750-911) 柱温 50°C 进样量 5pL 自动进样器温度 50°C 进样针清洗 放入清洗口15秒(50:50甲醇/异丙醇) 流动相 A) 含10 mmol/L 乙酸铵和 0.2 mmol/L 氟化铵的9:1水/甲醇溶液B)含 10 mmol/L 乙酸铵和 0.2 mmol/L 氟化铵的 2:3:5乙腈/甲醇/异丙醇溶液 流速 0.6mL/min 梯度程序 时间 %B0.00 701.00 703.50 8610.00 8611.00 10017.00 10017.10 7019.00 70 停止时间 19 min 后运行时间 无 观察到的柱压 170-330 bar 利用 Agilent MassHunter Q-TOF数据采集软件10.0版操作6546LC/Q-TOF 使用 Agilent MassHunter LipidAnnotator 软件1.0版并使用默认方法参数,但是在正离子模式分析时仅考虑 [M+H]* 和[M+NH]*母离子,在负离子模式下分析时仅考虑 [M-H]和[M+HAc-H] 母离子 利用 Agilent MassHunter PCDLManager B.08 SP1 版管理并编辑导出的标注注质谱库 (PCDL)。具体而言,利用PCDL Manager 软件去除9个 Cer_NS 脂质冗余,在这些脂质中可以观察到[M-H]和[M+乙酸盐]分子离子的单独条目。删除[M-H]Cer_NS条目,在负离子模式 PCDL中保留653种脂质 利用 Agilent MassHunter Profinder10.0版进行特征提取。提供的“Profinder-Lipids.m”方法用于批量靶向特征提取,并对其进行以下更改: ·第1步:选中+H和+NH4(正离子),选中-H 和+CH3COO(负离子);报告电荷状态为z=1的单离子或单离子特征:选中 ·第2步:预期的MS同位素丰度数据变异:12.5% ·第3步:平滑函数:函数宽度为8的二次/三次 Savitzky-Golay;高度过滤器:取消选中;最高峰的最大限量:10个峰 ·第4步:保持不变 第5步:取消选中得分(Tgt) 表 2. Agilent 6546 LC/Q-TOF 自动 MS/MS(迭代)参数 参数 Agilent 6546 LC/Q-TOF 气体温度 200°C 气体流速 10 L/min 雾化器(psig) 50 鞘气温度 300°℃ 鞘气流速 12L/min 毛细管电压 3500V(+), 3000V(-) 喷嘴电压 0V 碎裂电压 150V 锥孔电压 65V 八极杆 RF Vpp 750V 参比质量 m/z 121.050873, m/z 1221.990637 (+)m/z119.03632, m/z 980.016375(-) MS和 MS/MS 范围 m/z 40-1700 (+) MS 和 MS/MS 最小采集速率 3幅谱图/秒 分离峰宽 窄 (约1.3m/z) 碰撞能量 20eV (+), 25 eV (-) 每个循环的最大母离子数 3 基于母离子丰度的扫描速率 是,目标物为25000响应值/质谱图 使用MS/MS 累积时间限 是 易除未达到目标 TIC 的母离子 否 MS/MS阈值 5000响应值和 0.001% 启用主动排除 是,重复一次,然后排除0.05 min 纯度 严格性70%,截留率0% 同位素模型 常见有机分子 母离子排序 1,2,未知 静态排除范围 m/z 40-151(+)m/z 40-210(-) 迭代MS/MS 质量数误差范围 20ppm 迭代MS/MS RT 排除范围 ±0.1 min 利用 Agilent MassHunter MassProfiler Professional 15.1版进行差异分析。使用“脂质组学”实验类型创建了两个实验(正离子或负离子),并使用相应的 Profinder档案(.pfa) 作为数据源。采用百分位移位归一化算法(75%),将数据集基线校正到所有样品的中值 工作流程 MPP中利用 Agilent MassHunter ID浏览器10.0版在非靶向工作流程中进行标注,与标准相比要求质量数在±5 ppm范围内,保留时间在±0.10分钟范围内 如前文所述,使用了靶向和非靶向脂质组学工作流程4。 1500 使用混合 AML 细胞脂质提取物创建Lipid Annotator数据库 N 1000- 在脂质组学工作流程的第一步中,使用Lipid Annotator 软件分析了来自混合AML 细胞提取物的两组5个迭代 MS/MS数据文件(图2)。数据库中有430种脂质代表在正离子模式下标注的17类脂质,653种脂质代表在负离子模式下标注的 25类脂质。Lipid Annotator 结果导出至 PCDL (.cdb) 文件。 auiin 500- 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 保留时间(min) PE(8.9%)- -SM (8.9%) -CL(4.3%) LPC (9.1%) - DG (2.7%) -Cer_NS (4.3%) PS (2.5%) BMP (1.8%)- LDGTS (0.5%) -胆固醇(0.2%) LPE(1.1%) PG (0.7%) ACar (0.9%) TG(14.1%) CE (3%) -PC (37%) PE(13.6%) 图2.正离子(A)和负离子(B)模式下的 Lipid Annotator 软件结果。每个项目批量对5个迭代 MS/MS 数据文件进行了分析。为便于说明,使用m/z 相对于保留时间的散点图与代表性总离子流色谱图进行了重叠。将脂质特征按照对应于饼图的脂质类别着色,标注的脂质数量在饼图中以百分比显示 脂质分析识别药物处理诱导的干扰 PCDL (.cdb) 数据库用于在 Profinder 中对各批次的16个MS1 数据文件进行批量靶向特征提取。重要的是,将数据库化合物分子式和保留时间作为规定标准,在MS1 数据文件中靶向搜索脂质特征。在Profinder 中对获得的化合物进行审查,在某些情况下,由于特征峰形状不佳或不明确,会对特征进行手动积分或移除。手动修正后,在正离子和负离子模式数据集中分别保留了375种化合物和548种化合物。将 Profinder 结果导入 MassProfiler Professional (MPP) 软件中进行统计分析,在该分析中分别创建了正离子和负离子模式下的实验。归一化和基线校正后,在两种极性下获得的 PCA 图相似。在不过滤实体((保留所有化合物)的情况下,结果显示了每种条件下生物学平行样品的紧密聚类,并表现出药物处理间的明显差异。 BEZ 和 MPA分别对组合BaP 效果产生影响(图3)。针对主要成分1 进行的组区分表明, BEZ 处理对组合 BaP药物的脂质组效果的影响大于 MPA。这些观察结果与之前的描述一致。 图3.正离子(A)和负离子(B)数据集的PCA图 样品相关性(未显示)与无监督层次聚类(图4)为PCA结果提供了进一步的支持。将这些条件下的生物学平行样品归为一组,与 MPA 相比, BEZ 样品与 BaP 的关系更紧密。从标注的脂质特征的无监督聚类中也观察到趋势,例如,观察一个区域内聚类树显示出的清晰图案,可以发现多种三酰甘油(TG)脂质的密切关系。与 MPA 和溶剂对照样品相比,在 BEZ 和BaP处理中这些脂质增加。 颜色范围 图4.正离子数据集化合物(n=375)和条件的合并无监督层次聚类结果。右图为富含标注 TG 脂质的聚类树区域放大图。颜色范围表示每个 TG 特征归一化、转换后以 log2 值表示的丰度 脂质分析显示脂肪生成紊乱 为了更详细地评估脂类丰度之间的差异,在MPP 中从正离子模式数据集创建了脂类矩阵图(热图,图5)。观察到明显差异。与 Southam 等1的观察结果一致,BaP 处理组与溶剂对照相比, TG增高,二酰甘油(DG)降低。DG 是新生磷脂生物合成通路的中间体,作者认为,使用BaP 处理进行的 DG 去除是酰基链加成阶段磷脂合成中断所致。表3汇总了丰度明显不同于正离子和负离子数据集的脂类。 与之前的报道相反, BaP 处理后我们没有观察到溶血磷脂酰胆碱 (LPC)或溶血磷脂酰乙乙胺 (LPE) 类丰度的显著下降。造成这种差异的原因有许多,包括 MS 脂质数据集的归一化和处理方法上的差异。我们观察到之前研究中未报道的显著脂类差异,其中最为突出的是,与溶剂对照相比,BaP 处理的细胞中神经酰胺非羟基脂肪酸-鞘氨醇 (Cer_NS) 和己糖神经酰胺非羟基脂肪酸-鞘氨醇 (HexCer_NS) 浓度升高,磷脂酰胆碱 (PC) 浓度降低。之前的研究使用鸟枪法脂质组学对有限的脂类进行靶向扫描,而我们的靶向工作流程始于发现阶段,以全面搜索计算机谱库,然后将这些结果用于目标数据挖掘。因此,我们的方法不受限制,并且可能发现不同脂类的差异。 图5.BaP 处理和溶剂对照重复测定样品的脂类丰度总体归一化的 MPP 脂类矩阵图。颜色范围表示一类脂质中所有脂质特征的归一化、转换后的总体丰度 表3. BaP 处理诱导后丰度水平显著不同的脂类汇总 脂质类别 缩写 BaP效果 极性* 神经酰胺非羟基脂肪酸-鞘氨醇 Cer_NS 增加 (+)***, (-)* 己糖神经酰胺非羟基脂肪酸-鞘氨醇 HexCer_NS 增加 (-)*** 三酰甘油 TG 增加 (+)*** 神经节甘脂 GM3 增加 (-)** 溶血磷脂酰甘油 LPG 增加 (-)** 连接醚的磷脂酰胆碱 乙醚PC 增加 (-)* 溶血磷脂酰乙醇胺 LPE 增加 (+)* 溶血磷脂酰丝氨酸 LPS 增加 (-)* 硫苷脂 SHexCer 增加 (-)* 二酰甘油 DG 减少 (+)*** 单半乳糖二酰甘油 MGDG 减少 (-)*** 磷脂酰肌醇 PI 减少 (-)*** 胆固醇酯 CE 减少 (+)** 心磷脂 CL 减少 (-)** 氧化磷脂酰胆碱 0xPC 减少 (-)* 氧化磷脂酰肌醇 OxPI 减少 (-)* 磷脂酸 PA 减少 (-)* T采用双侧t检验测定溶剂和 BaP样品组之间差异的显著性:*p<0.05, **p<0.01, ***p<0.001 在MPP中还创建了脂质矩阵,以查看脂类中各脂质特征之间的丰度差异。查看磷脂酰胆碱 (PC)矩阵图会发现一些由 BaP 处理诱导的相反模式,分别对应于饱和脂肪酰链PC 减少(例如,PC16:0_26:0),以及多不饱和脂肪酰链 PC增加(例如, PC 18:1_22:6)(图6)。这些观察结果也与 Southam 等报道的结果一致,他们认为由于 BaP 处理诱导的新生脂肪酸和磷脂合成减少,导致具有0-2个双键的 PC 脂质减少。他们进一步假设多不饱和 PC 脂质的增加很可能是由于细胞从葡萄糖以外的其他外源获得多不饱和脂肪酸。 药物处理脂质异构体的差异反应 基于 LC 的全面脂质组学方法可对具有相同总成分(即相同精确质量)但通过色谱法分离的脂质异构体进行分析。数据集中存在大量的此类异构体:在正离子模式数据集的430种已标注脂质中有94种为异构体,而在负离子模式数据集的653种已标注脂质中有165种为异构体。在多数情况下,异构体对药物处理的响应明显不同。观察 MPP 中神经酰胺 (Cer_NS)脂质矩阵,发现几对异构体呈反向关系(图7A)。如示例所示, 一对部分分离的 Cer_NS 42:2 异构体的提取离子色谱图显示出对 BaP 处理的反向响应,即与较早洗脱的异构体相比,在 BaP 处理中较晚洗脱的异构体有所减少(图7B)。 图 6. BaP 处理和溶剂对照重复测定羊品的137个磷脂酰胆碱 (PC) 脂质特征的 MPP 脂质矩阵图。两种选定的PC 特征箱线图如右侧所示 A B C 图7.神经酰胺非羟基脂肪酸-鞘氨醇 (Cer_NS) 异构体的不同响应和结构解析。(A) BaP 处理和溶剂对照重复测定样品的39个 Cer_NS 脂质特征的 MPP脂质矩阵图。带有星号的异构体对具有相同的精确质量,但保留时间不同,并呈现出反向响应。(B)叠加提取离子色谱图,比较一对 Cer_NS 42:2异构体的溶剂对照 (n=4) 与 BaP处理(n=4)后的结果。(C)来自 Lipid Annotator 的相应完整图,其中对主要匹配的产物离子进行了额外标注(观测值,红色;数据库值,蓝色)。两个图之间产物离子的偏移±m/z 2.0156,为鞘氨醇碱和酯化脂肪酸(带有标记)中双键数的差异提供了证据。观测谱图与 Cer_NS d18:1_24:1 和Cer_NS d18:2_24:0 数据库谱图匹配, 在 Lipid Annotator 软件中将这些脂质表示为最有可能存在的成分 虽然这些异构体标注有相同的总成分,但对 Lipid Annotator结果的检查有力地证明了较早和较晚洗脱的异构体分别为Cer_NS d18:1_24:1和 Cer_NS d18:2_24:0(图7C)。尚不清楚神经酰胺异构体对BaP 处理的差异化响应的生物学意义,但此类信息仅能通过脂质组学分析方法来揭示。 非靶向脂质组学工作流程揭示了一种高度差异化的非典型脂质 如其他文献所述4,同样也支持非靶向工作流程,并且该流程使用与前文所述靶向工作流程相同的 PCDL 和软件。主要的区别在于: 使用 Profinder 中的非靶向特征查找(递归批处理特征提取算法) 在 MPP中工作流程后期使用 ID 浏览器工具执行脂质标注 我们在研究中使用 Profinder 中的递归批处理特征提取算法对16个负离子模式MS1 数据文件进行了分析,并将2052个特征导入了 MPP。结果,根据上文创建的相同负离子模式 PCDL 谱库,使用ID浏览器工具将2052个特征中的513个标注为脂质(规定标准要求为 RT±0.10分钟)。 为将差异分析集中于可重现特征,通过样 品变异性对实体列表进行过滤,四种条件下的 CV 均要求小于25%。此操作使实体列表中的特征减少至1377个。对BaP处理相对于溶剂对照进行的温和t检验结果显示,93个实体存在显著差异(倍数变化临界值1.5,p值0.05),其中41个实体已标注为脂质(图8A)。与溶剂对照相比,差异最大的特征 BaP 细胞增加了3.93倍(p值3.54×10~5),并且在四种条件下检查实体均表现出显著差异(图8B)。目标化合物的中性质量数为339.2774Da, ID 浏览器未返回标注。为了深入了解此化合物的性质,在MPP中为513个标注脂质和93个差异实体的组卧列表创建了Kendrick 质量亏损(KMD)图(图8C)。KMD (Y 轴)与脂类(×轴)的关系图揭示了目标特征与一组四种 Cer_NS 脂质具有相似的 KMD,其中每每 Cer_NS 脂质具有两个双键。有趣的是,四种神经酰胺脂质(质量数707-735 Da) 的质量数远远大于目标特征(339 Da)。利用 Lipid Annotator 中的脂质计算器工具生成假设的Cer_NS 脂质,以评估是否可以生成质量数接近 m/z 339.2774的总成分。采用这种方法,脂 质 Cer_NS d18:2_2:0 的质量数在观测特征质量数的±0.3 ppm范围内。此外,使用定性分析软件进行的分析表明, d18:2鞘氨醇主链的特异性 MS/MS 产物离子为候选 Cer_NS d18:2_2:0标注提供了进一步的证据(数据未显示)。 Cer_NS d18:2_2:0的候选结构(也称为C2神经酰胺或N-乙酰基鞘氨醇)如图8D 所示。这种C2神经酰胺在许多脂质数据库(包括 LipidAnnotator)中都不存在,据我们了解,在脂质组学研究中不对其进行常规鉴定。然而, C2神经酰胺在不同的 AML 细胞系(HL-60)中含量较低。合成的 C2神经酰胺由于具有生物学活性(包括抑制细胞增殖和诱导细胞凋亡的能力),被广泛用作研究工具具。我们推测 BaP 处理后细胞中C2神经酰胺的增加可能与 BaP的抗癌作用有关,相信这一信息有可能引起癌症研究界的兴趣。 图8.使用非靶向工作流程进行的未知差异特征鉴定。(A)经温和t检验和 Benjamini-Hochberg FDR 多重测试校正后得到的 BaP 处理和溶剂对照的 MPP火山图。显著特征(倍数变化临界值>1.5,p值>0.05)用蓝色(标注脂质)和红色(未标注特征)表示。目标特征(2.506处, m/z 339.2774)用绿色圈出。(B)四种药物处理条件下目标特征的箱线图。(C)513个标注脂质的实体列表和93个差异特征列表组合的 MPP Kendrick 质量亏损(KMD)图(n=565)。不能用 PCDL 标注的特性在第一列中以红色表示。区域放大图通过显示了目标特征 KMD 与一组 Cer_NS 脂质的一致性。(D) Cer_NS 18:2_2:0目标特征的候选结构 本应用简报证明,脂质组学分析工作流程(包括 Lipid Annotator 软件)大大改善了脂质标注和复杂样品的差异分析。我们采用靶向工作流程研究了急性髓性白血病K562 细胞系对 BEZ 和 MPA 候选药物组合的脂质组变化响应。分析结果显示,药物处理后发生了一些细胞变化,包括二酰甘油减少、三酰甘油增加,以及脂肪酰基成分的变化。总而言之,这些结果支持之前的报道,表明 BaP 组合可能通过诱导脂肪生成紊乱发挥其抗癌特性。 与传统的鸟枪法脂质组学方法相比,这种 脂质分析工作流程还可提供更全面的脂质 标注。具体而言,我们鉴定了 BaP 处理 诱导的脂类丰度的显著差异,并且之前报 道中未报告这些差异。我们还鉴定了色谱 分离脂质异构体的具体案例,这些异构体 对药物处理表现出不同的响应。最后,我 们采用一种非靶向方法表明,,可以用补充 工具为未标注脂质特征提供建议的候选化 合物标注。 ( 1. Southam,A. D. et al. DrugRedeployment to K i ll Leukemiaand Lymphoma Cells by DisruptingSCD1-Mediated Synthesis ofMonounsaturated Fatty Acids.Cancer Res. 2015,75(12), 2530-2540 ) ( 2. Sartain,M.et al.使用迭代 MS/MS 数 据采集结合 Lipid Annotator 软件和6546 LC/Q-TOF 改善血浆脂质组的覆 盖范围。安捷伦科技公司应用简报,出版号5991-0775ZHCN, 2 019 ) ( 3. MassHunter Profin d er:适用于高质量质谱数据特征提取的批处理软件。 安捷伦科技公司技术概述,出版号 5991-3947CHCN,2014 ) Lipidomics Analysis with LipidAnnotator and Mass ProfilerProfessional (使用 Lipid Annotator和 Mass Profiler Professional 进行脂质组学分析)。安捷伦科技公司技术概述,出版号5994-1111EN, 2019 Snyder, F. et al. Biosynthesisof N-Acetylsphingosine byPlatelet-activating Factor:Sphingosine CoA-independentTransacetylase in HL-60 Cells. TheJournal of Biological Chemistry 1996,271(1),209-217 ( 6. H annun, Y. A. et al. Programmed CellDeath Induced b y Ceramide. Science1993,259(5102),1769-1771 ) 查找当地的安捷伦客户中心:www.agilent.com/chem/contactus-cn 免费专线:800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 本应用证明,脂质组学分析工作流程(包括 Lipid Annotator 软件)大大改善了脂质标注和复杂样品的差异分析。我们采用靶向工作流程研究了急性髓性白血病 K562 细胞系对 BEZ 和 MPA 候选药物组合的脂质组变化响应。分析结果显示,药物处理后发生了一些细胞变化,包括二酰甘油减少、三酰甘油增加,以及脂肪酰基成分的变化。总而言之,这些结果支持之前的报道,表明 BaP 组合可能通过诱导脂肪生成紊乱发挥其抗癌特性。与传统的鸟枪法脂质组学方法相比,这种脂质分析工作流程还可提供更全面的脂质标注。具体而言,我们鉴定了 BaP 处理诱导的脂类丰度的显著差异,并且之前报道中未报告这些差异。我们还鉴定了色谱分离脂质异构体的具体案例,这些异构体对药物处理表现出不同的响应。最后,我们采用一种非靶向方法表明,可以用补充工具为未标注脂质特征提供建议的候选化合物标注。
确定









还剩12页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《AMLK562细胞系对BEZ、MPA和BaP 药物组合中脂质变化响应检测方案(液质联用仪)》,该方案主要用于其他中脂质变化响应检测,参考标准--,《AMLK562细胞系对BEZ、MPA和BaP 药物组合中脂质变化响应检测方案(液质联用仪)》用到的仪器有Agilent 6546 Q-TOF 液质联用系统
推荐专场
相关方案
更多
该厂商其他方案
更多
















