方案详情
文
液质联用鉴定肽段的样品制备,通常由多步骤工作流程组成,包括溶液内蛋白酶解、肽段纯化,以及肽段分馏。该过程通常需要根据样品特性及分析目的( 即定量或表征)定制为具体的应用方法。样品制备工作流程的自动化可提高样品处理能力、降低差异性,并且无需熟练操作人员执行重复工作。然而,自动化平台通常并不用于最初的分析开发,这是因为分析开发者很少具有开发复杂自动化方案的经验。相反,分析通常是采用湿式工作台相关技术进行开发,然后在自动化专家的帮助下移植到自动化平台。
采用 AssayMAP 肽段样品制备解决方案,无需掌握专门的技术也能实现自动化操作。开发者可通过一个简单的软件用户界面和灵活的实验方案对关键实验变量进行完全控制,从而能够专注于科学分析研究。如今,分析开发者、科学家或技术员无需具备自动化专业知识也能实现可扩展、精确的自动化操作。采用 AssayMAP 平台,整个工作流程可直接在相同的硬件上进行开发,如需实现高通量样品前处理,也易于对硬件进行扩展,从而可减少或避免已有实验方案实现自动化所需的额外时间和资源。本文将介绍发现(鸟枪法)蛋白组学研究的一种常规液质联用工作流程,包括溶液内酶解、反相肽段纯化,以及肽段的强阳离子交换分馏 (SCX),所有这些操作均由 AssayMap Bravo 液体处理器完成。采用 SCX 小柱通过增加 pH 或离子强度对大肠杆菌蛋白裂解液进行逐步洗脱,在六个 SCX 馏分中鉴定出 15000 多条特定肽段序列,其中 64-67% 的肽段可专属性地在其中一个馏分中得到鉴定。
方案详情

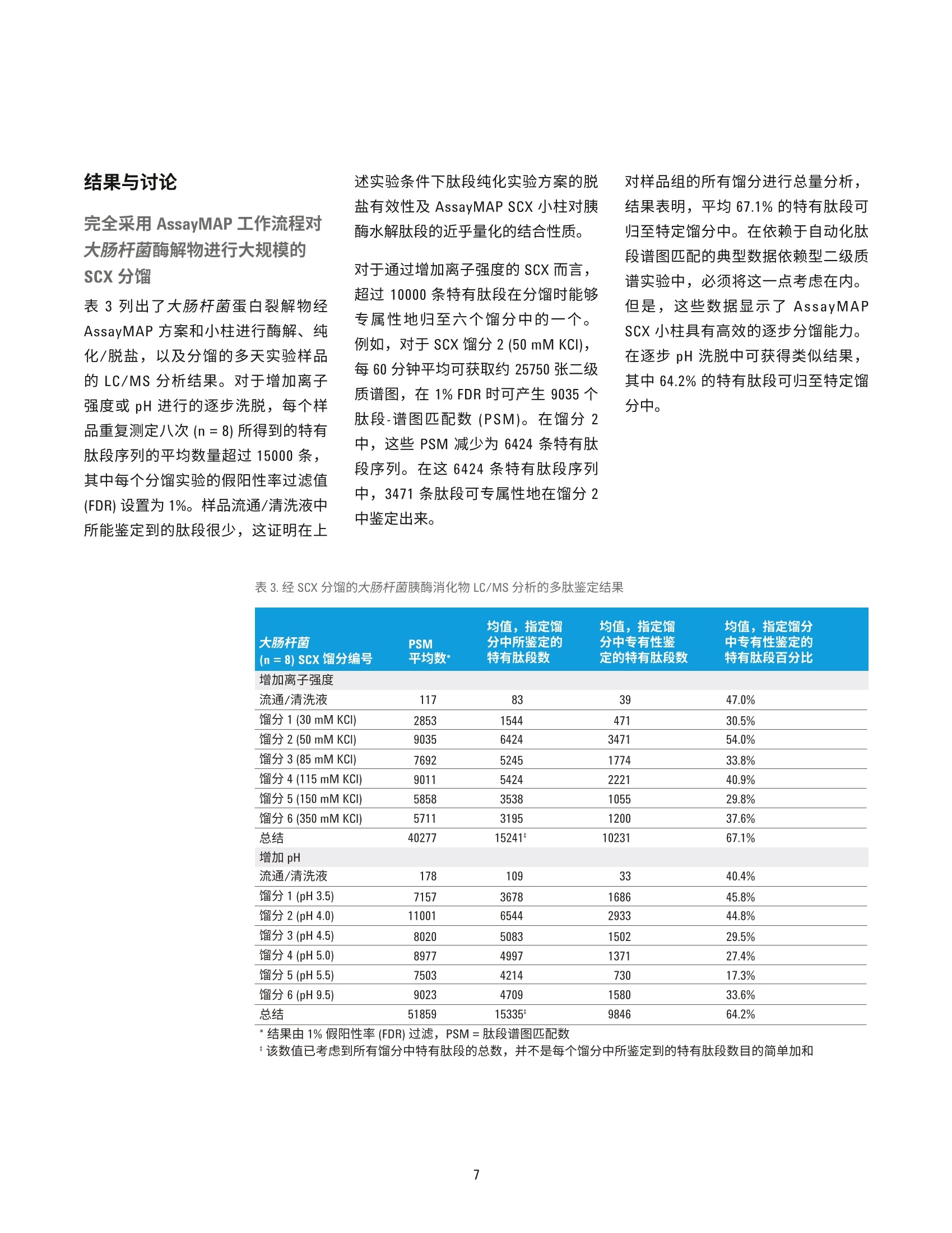
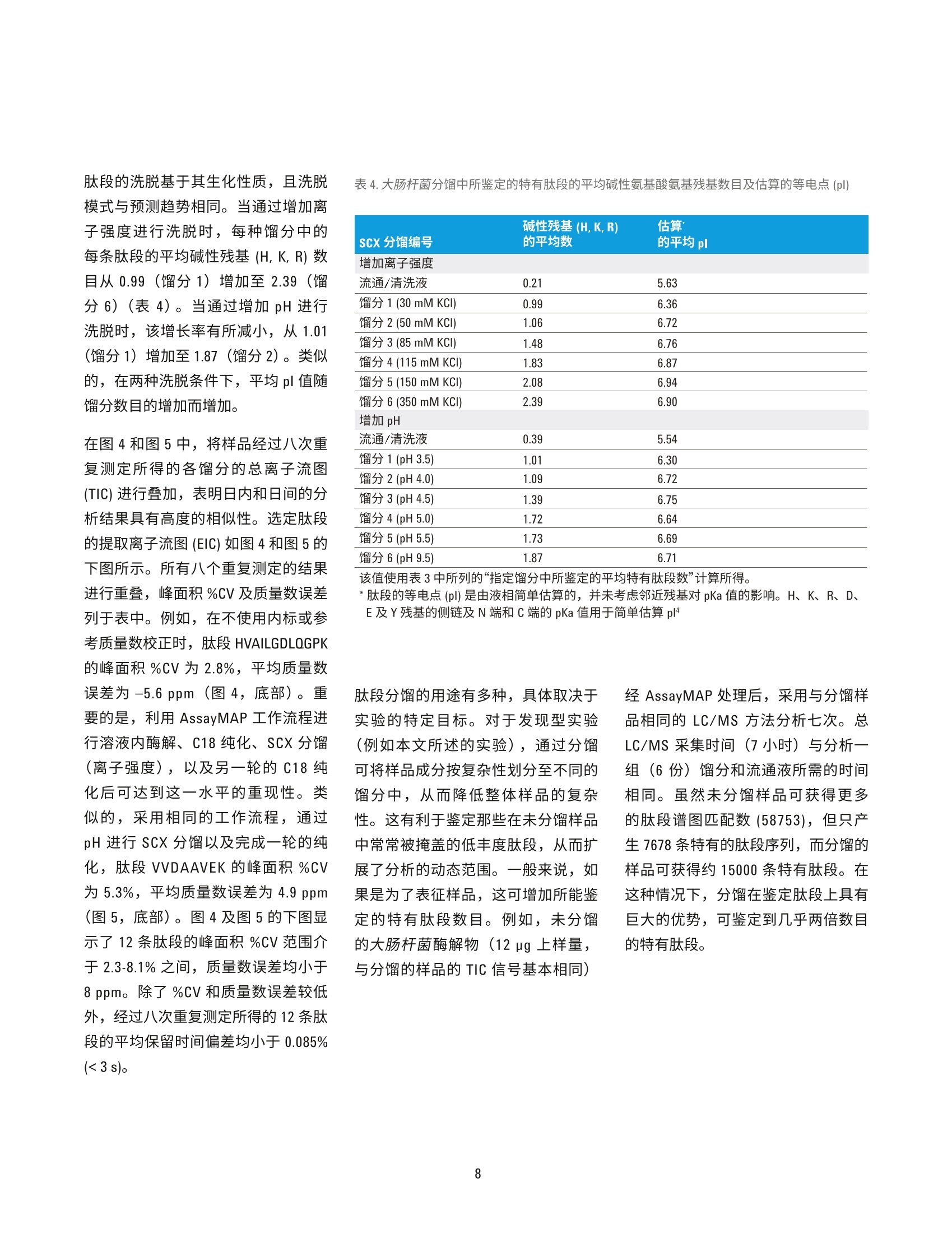
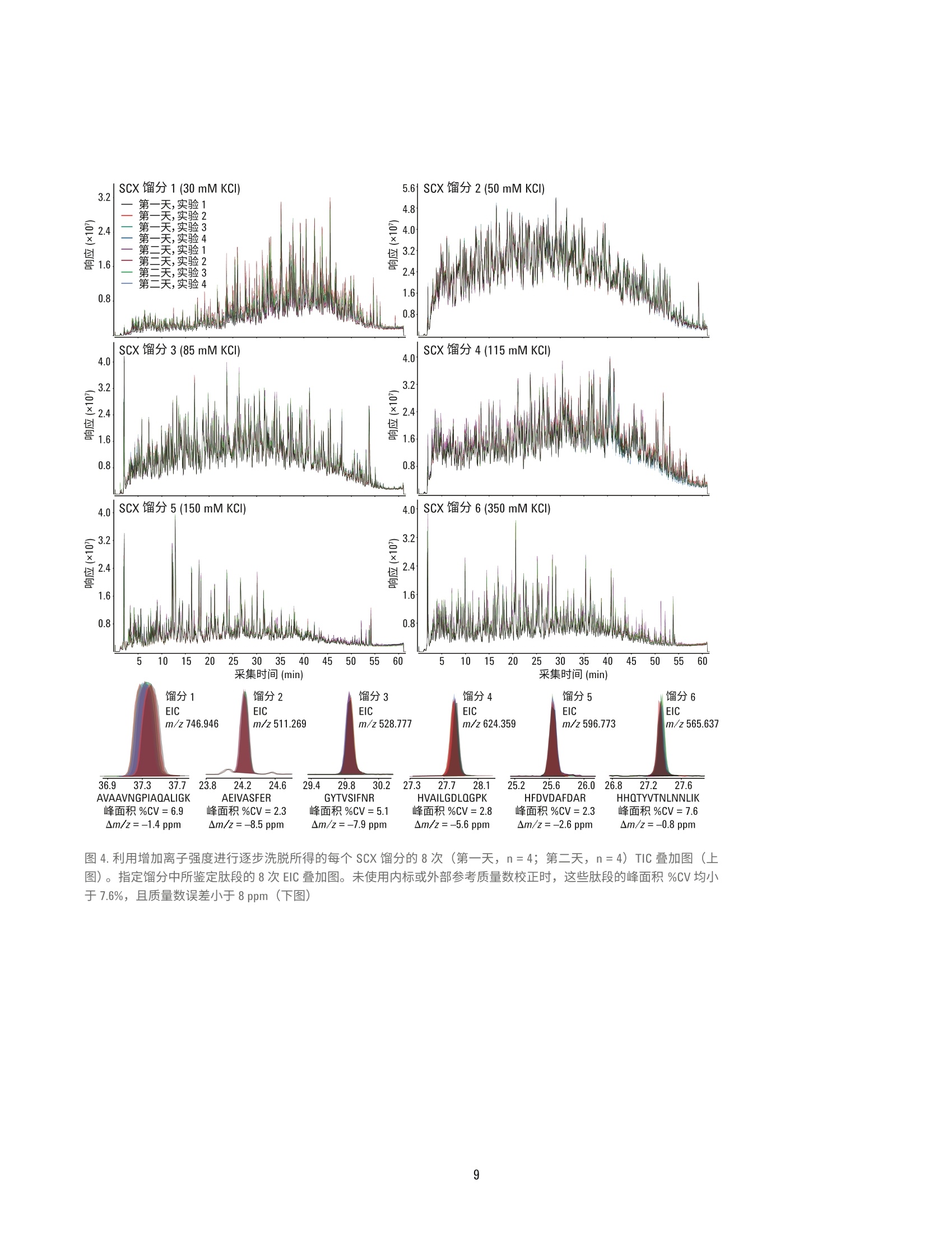
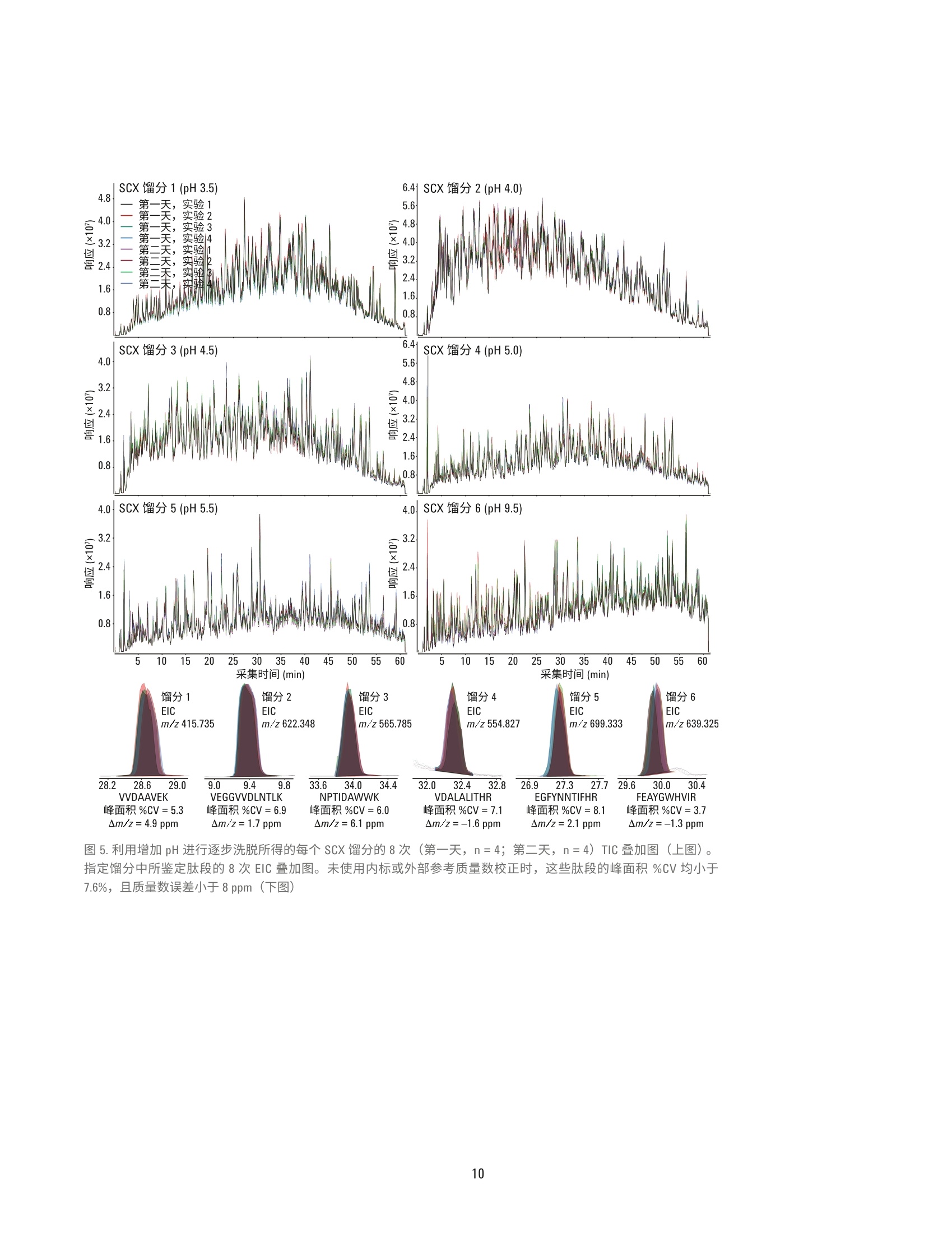
作者 Jason D. Russell、 Zachary Van Den Heuvel、Michael Bovee 及 Steve Murphy 安捷伦科技有限公司 美国威斯康星州麦迪逊 自动化液质联用工作流程:采用AssayMAP技术进行溶液内蛋白酶解、肽段纯化以及肽段的强阳离子交换分馏 应用简报 临床研究 摘要 液质联用鉴定肽段的样品制备,通常由多步骤工作流程组成,包括溶液内蛋白酶解、肽段纯化,以及肽段分馏。该过程通常需要根据样品特性及分析目的(即定量或表征)定制为具体的应用方法。样品制备工作流程的自动化可提高样品处理能力、降低差异性,并且无需熟练操作人员执行重复工作。然而,自动化平台通常并不用于最初的分析开发,这是因为分析开发者很少具有开发复杂自动化方案的经验。相反,分析通常是采用湿式工作台相关技术进行开发,然后在自动化专家的帮助下移植到自动化平台。 采用 AssayMAP 肽段样品制备解决方案,无需掌握专门的技术也能实现自动化操作。开发者可通过一个简单的软件用户界面和灵活的实验方案对关键实验变量进行完全控制,从而能够专注于科学分析研究。如今,分析开发者、科学家或技术员无需具备自动化专业知识也能实现可扩展、精确的自动化操作。采用 AssayMAP平台,整个工作流程可直接在相同的硬件上进行开发,如需实现高通量样品前处理,也易于对硬件进行扩展,从而可减少或避免已有实验方案实现自动化所需的额外时间和资源。本文将介绍发现(鸟枪法)蛋白组学研究的一种常规液质联用工作流程,包括溶液内酶解、反相肽段纯化,以及肽段的强阳离子交换分馏(SCX),所有这些操作均由 AssayMap Bravo 液体处理器完成。采用 SCX 小柱通过增加 pH 或离子强度对大肠杆菌蛋白裂解液进行逐步洗脱,在六个SCX馏分中鉴定出 15000多条特定肽段序列,其中64-67%的肽段可专属性地在其中一个馏分中得到鉴定。 前言 自动化的样品制备工作流程具有诸多好处,包括可扩大样品处理规模以满足所需的通量要求,并且不需要熟练操作人员执行重复而苛刻的样品处理工作。在多步骤工作流程中,借助具有精确液体处理功能的自动化平台还能最大限度减少误差的传播,并实现重现性最大化。特别是在使用液质联用系统的蛋白和肽段分析中,因为这种先进的高精密度和灵敏度的分析仪器会将多步骤样品制备工作流程中的误差放大。然而,实现样品制备的自动化面临一个重大挑战,自动化平台往往用于对现有工作流程进行移植而不是直接基于自动化平台进行分析开发,这就需要额外的优化及资源配置,从而延迟了工作流程自动化的收益。对那些未接受过自动化平台专业培训的人员而言,自动化开发并不现实且过于严格。这种严格性对已完全开发的分析而言非常重要,但可能会阻碍开发过程,因为它要求分析开发者掌握自动化相关知识并且要投入大量时间以使自己成为自动化专家,否则需要依赖其他自动化专家协助完 成分析开发。从分析开发者的角度而言,真正的自动化平台应当能够实现从头至尾的分析开发、将多步骤实验方案无缝地整合到已连接的工作流程中,并且分析人员无需掌握任何自动化专业知识,从而更加专注于科学分析研究而不是自动化过程。 安捷伦引进了 AssayMAP 肽段羊品制备套件,包括用于 AssayMAP Bravo 自动化平台的相关软件和微型小柱,可直接满足分析开发者在自动化工作流程中进行液质联用蛋白组学应用的需求。该技术的核心是 AssayMAPBravo的精确液体处理能力,可处理微量滴定板。AssayMAP Bravo 移液头配有液体位移式96位探针式注射器(250pL),可采用一次性5pL填充床小柱实现严格流量控制的微量级色谱分析。当自动化工程师和液质联用分析科学家协作开发出适用于蛋白组学应用的高灵活性模块化方案后也带来更多的差异化创新。这些实验方案均呈现在一个简单易用的软件界面中,使得分析开发者能够对实验参数进行完全控制,而不需精通基本的自动化知识。从而可在自动化平台上 实现湿式工作台类型的分析开开。AssayMAP 方案针对溶液内酶解、肽段纯化(脱盐)及肽段分馏进行开发。这些方案可作为独立的模块进行操作,或者对这些方案进行搭配,从而建立更加复杂的工作流程架构,实现各个方案之间的转换。 在本应用简报中,我们将介绍多步骤AssayMAP工作流程在一种典型的发现(鸟枪法)蛋白质组学实验中的应用,其中采用大肠杆菌蛋白裂解物进行酶解、反相纯化,并通过增加离子强度或 pH 逐步进行强阳离子交换洗脱分馏。液质联用分析采用Agilent 6550 iFunnel Q-TOF 液质联用系统、Agilent 1290 Infinity 液相系统及 AdvanceBio 肽图分析色谱柱,结果发现使用任一种分馏技术均可在大肠杆菌中鉴定出15000多条独特的肽段序列。在这15000条肽段中,约10000条肽段可在六种馏分中的一种馏分中专属性的识别出来,证实了AssayMAP SCX 小柱逐步分馏的有效性。重复分析说明利用精确的安捷伦分析技术进行蛋白组表征的液质联用工作流程具有高度重现性。 实验部分 溶液内酶解采用脲基变性混合液溶解大肠杆菌蛋白裂解液冻干粉,终浓度为 10 pg/pL(表1)。在两个U型底样品板的四个孔中加入10微升溶液。溶液内酶解方案可用于多达四个96孔板的样品量。在该实验中,虽然只需一个样品板的一列便可轻松容纳所有的样品,但由于样品在酶解后的不同天数内还需要接受进一步的处理,因此最好将样品分至两个样品板中。准备试剂板以匹配样品板的孔配置。开始溶液内酶角,所有板均放置在 AssayMAP Bravo台板上。 注:所有缓冲液均以体积比进行配制。所有缓冲液水相成分的 pH 值均在加入乙腈前进行测量及调节 当实验方案开始时,在溶液内酶解用户界面内输入应用设置,设置值如图1所示。加入变性混合液后,将两个样品板从台板中取出,并使用可移除的塑料密封膜通过 PlateLoc 进行密封,然后放置在60°℃孵育器中1小时进行蛋白变性和二硫键还原。样品板短暂离心后,撕下密封膜,将样品板放回台板上。 继续实施本方案,加入烷基化试剂对游离的半胱氨酸进行烷基化并孵育(室温下40分钟),加入稀释剂,然后加入胰酶(胰酶:蛋白为1:33)。以上步骤均在台板上依序进行,无需中断或用户介入。本方案完成后,取出样品板, 采用 PlateLoc 进行密封,然后放置于37°C孵育器中进行过夜酶解。将样品板从孵育器中取出然后进行短暂离心。加入20 pL 的10%TFA对每个样品板进行酸化。一个含有酸化的大肠杆菌酶解物的样品板立即进行肽段纯化,而另一个样品板则保存在-80°℃下,直到需要寸才取出。然后重复相同的样品酶解实验,以获得另两个样品板。 肽段纯化 将缓冲液(表1)分配至与储存严格的注射器清洗(纯化)缓冲液、通用(平衡/清洗)或洗脱缓冲液的试剂板相对应的12列板的第一列中。空U型底板用作流通液收集板和洗脱液收集板。总共使用四个 AssayMAPC18小柱及四个 AssayMAP 无树脂小柱以填满柱放置台板上的一列。虽然只对一个样品板的四份大肠杆菌酶解物进行肽段纯化,但需要八个 小柱填满整列,以便 AssayMAP 小柱得以正确固定。AssayMAP Bravo 采用压差在整列(8个小柱)增量下固定AssayMAP小柱。小柱最佳效能取决于其在 AssayMAP Bravo 96 通道移液头探针上的合理固定。当样品数不是8 的倍数时,可采用 AssayMAP 无树脂小柱替代填充柱,因为其便利且可重复使用。将酶解步骤所得的U型底样品板放置在第4板位上,其四个孔(A1-D1) 含有经TFA酸化后的大肠杆菌消化物。在肽段纯化用户界面启动肽段纯化实验方案并输入应用设置,同时在实验器具表格中选取实验器具,如图2所示。在每个 AssayMAP C18 小柱中加入245 pL 的大肠杆菌酶解物(约92.5ug)。采用 20pL洗脱缓冲液对样品进行洗脱,然后使用适量的SCX平衡缓冲液将其稀释10倍。 图1. Agilent AssayMAP 溶液内酶解方案用户界面以及大肠杆菌酶解所使用的参数 图 2. Agilent AssayMAP 肽段纯化方案用户界面以及TFA酸化的大肠杆菌胰酶消化物的纯化参数 增加离子强度进行强阳离子交换分馏 在低pH条件(约小于 pH3)下,带正电的肽段可与带负电的强阳离子交换树脂结合,并可通过离子强度不断增加(增加盐盐度)的低 pH 缓冲液进行洗脱。一般来说,肽段在 SCX 固定相中按净正电荷递增(碱性残基的增加量)的顺序洗脱。缓冲液中有机溶剂(一般为乙腈)的存在有助于最小化肽段与固定相的非特异疏水作用结合。 在对应样品板相同样品孔位置的U型底板孔中加入等分的用于通过离子强度逐步分馏的 SCX 洗脱缓冲液(表1)。采用 AssayMAP Bravo 的钳爪启动板堆积方案,构建一堆六个洗脱缓冲液板,以及一堆六个馏分收集板。将另外的试剂板和废液板像样品板一样放置在 AssayMAP Bravo 台板上(图3),这些样品板所含的四份大肠杆菌酶解物已经过肽段纯化方案的处理并在 SCX平衡缓冲液中进行稀释。放置四个 AssayMAP C18 小柱及四个 AssayMAP 无树脂小柱以填满柱放置台板的一整列。启动分馏方案,结束后,每个大肠杆菌酶解样品可收集到六个20pL的馏分。此外,保留每个样品的流通/清洗液以评价肽段的结合能力。每组馏分(总共24组)现含有浓度相对较高的非挥发性氯化钾盐,需用 0.1% TFA 稀释10倍以降低 乙腈的浓度,然后合并到一个板上,并再次使用肽段纯化方案进行处理。几乎不含盐的流通/清洗样品与经过肽段纯化方案处理的馏分洗脱液一起直接冻干。 所收集的24组馏分及4份流通/清洗样品代表“第一天”的样品。对第一天的样品进行液质联用分析。在第一天的样品数据采集完成后,采用相同的 AssayMAP 工作流程对溶液内酶解实验方案所得的第二块样品板(第二天的样品)进行处理和分析。 增加 pH 进行强阳离子交换分馏 此外,还可应用 AssayMAP SCX小柱通过增加 pH 进行逐步洗脱以完成肽段 SCX 分馏。同增加离子强度进行SCX分馏一羊,肽段在低 pH条件下与 固定相结合。但是,洗脱是通过增加洗脱缓冲液的 pH而不是通过增加离子强度来实现的。洗脱时, 当pH增加,肽段的净正电荷减少。当洗脱缓冲液的 pH达到肽段的等电点(pl), 肽段与带负电的固定相间的静电作用减弱,从而促进洗脱。肽段按 pl值递增的顺序洗脱,一般也与碱性残基的增加量相对应。 采用逐步 pH 洗脱的肽段 SCX分馏方式与采用离子强度洗脱分馏的方式相同,除了所使用的缓冲液系统有所不同(表1)。但是,这些馏分无需进一步纯化,因为其中采用了挥发性缓冲液,可直接进行冻干。对于“第一天”和“第二天”的样品组,该处理均可收集到24份馏分及4份流通/清洗样品。 图 3. Agilent AssayMAP分馏方案用户界面以及大肠杆菌胰酶消化物的 SCX 分馏所使用的参数 液质联用系统 所有的液质联用分析均采用配有双安捷伦喷射流电喷雾离子源的 AgilentiFunnel 6550 Q-TOF 液质联用系统(表2)。质谱仪与1290 Inifinity 二元液相色谱系统联用,采用 AdvanceBio 肽图分析 C18色谱柱(2.1×250mm,2.7 um, 120A孔径)进行分析,柱温保持在55°C。流动相A为含有 0.1%甲酸的水溶液,流动相B为99.9%乙腈/0.1%甲酸。将大肠杆菌馏分在30pL流动相A中复溶。每种馏分进样20微升,色谱展开60分钟,线性梯度 2.5-35%B, 流速为 400 pL/min。Q-TOF 采用自动二级质谱模式,每个循环中选择10个丰度最高的母离子进行二级质谱扫描,采用狭窄分离参数和1分钟的主动排除时间。一级质谱扫描的采集速率为 8Hz,二级质谱扫描的采集速率为3.5 Hz。不使用内部参比,但每天均进行质量校正。耳合 Agilent MassHunter (B.05.00版本,型号5.0.519.0)、Spectrum Mill.(B.04.00.127版本)、Morpheus;((64位,用于安捷伦.d文件)及定制脚本进行 数据分析。 分析仪器和消耗品 自动化 核心自动化平台 Agilent AssayMAP Bravo (G5542A) AssayMAP 启始试剂盒 酶解和纯化所使用的 96 C18小柱和实验器皿(G5496-60013) 分馏所使用的 96 SCX小柱和实验器皿 (G5496-60014) 酶解和纯化所使用的 96 RP-S小柱和实验器皿(G6596-60034) AssayMAP小柱 96 C18 柱架 (5190-6532) (数量:每板96个小柱) 96 SCX 柱架(5190-6536) 96 无树脂柱架 (G5496-60009) AssayMap Bravo 配件 96 RP-S 柱架 (G5496-60033) 抬升支架,146 mm (G5498B#055) 配有 STC 控制器的珀尔温控台板 (G5498B#035) 定制化板套 (G5498B#017) PCR 板垫片 (G5498B#013) 其他配件 安捷伦 PlateLoc 微孔板热封膜机 (G5402A) 液质联用系统 质谱仪 Agilent 6550 iFunnel Q-TOF LC/MS 双安捷伦喷射流 ESI 源 液相系统和色谱柱 Agilent 1290 Infinity 液相色谱系统 Agilent AdvanceBio 肽谱分析色谱柱 (C18) 分析柱: 2.1×250mm, 2.7 pm 色谱柱 (651750-902) 结果与讨论 完全采用AssayMAP 工作流程对大肠杆菌酶解物进行大规模的SCX分馏 表3列出了大肠杆菌蛋白裂解物经AssayMAP 方案和小柱进行酶解、纯化/脱盐,以及分馏的多天实验样品的 LC/MS分析结果。对于增加离子强度或 pH 进行的逐步洗脱,每个样品重复测定八次(n=8)所得到的特有肽段序列的平均数量超过15000条,其中每个分馏实验的假阳性率过滤值(FDR)设置为 1%。样品流通/清洗液中所能鉴定到的肽段很少,这证明在上 述实验条件下肽段纯化实验方案的脱盐有效性及 AssayMAP SCX 小柱对胰酶水解肽段的近乎量化的结合性质。 对于通过增加离子强度的 SCX 而言,超过10000条特有肽段在分馏时能够专属性地归至六个馏分中的一个。例如,对于 SCX馏分2(50mM KCl),每60分钟平均可获取约25750张二级质谱图,在1%FDR时可产生9035个肽段-谱图匹配数(PSM)。在馏分2中,这些 PSM 减少为6424条特有肽段序列。在这6424条特有肽段序列中,3471条肽段可专属性地在馏分2中鉴定出来。 对样品组的所有馏分进行总量分析,结果表明,平均67.1%的特有肽段可归至特定馏分中。在依赖于自动化肽段谱图匹配的典型数据依赖型二级质谱实验中,必须将这一点考虑在内。但是,这些数据显示了 AssayMAPSCX小柱具有高效的逐步分馏能力。在逐步 pH 洗脱中可获得类似结果,其中64.2%的特有肽段可归至特定馏分中。 大肠杆菌 (n=8) SCX分分编号 均值,指定馏 均值,指定馏 均值,指定馏分 PSM 分中所鉴定的 分中专有性鉴 中专有性鉴定的 平均数* 特有肽段数 定的特有肽段数 特有肽段百分比 增加离子强度 流通/清洗液 117 83 39 47.0% 馏分1(30mM KCI) 2853 1544 471 30.5% 馏留2(50 mM KCI) 9035 6424 3471 54.0% 馏分 3 (85 mM KCI) 7692 5245 1774 33.8% 馏分4(115mM KCI) 9011 5424 2221 40.9% 馏分5(150mM KCI) 5858 3538 1055 29.8% 馏分6(350mM KCI) 5711 3195 1200 37.6% 总结 40277 15241* 10231 67.1% 增加pH 流通/清洗液 178 109 33 40.4% 馏分1(pH3.5) 7157 3678 1686 45.8% 馏分2(pH4.0) 11001 6544 2933 44.8% 馏留3(pH 4.5) 8020 5083 1502 29.5% 馏分4(pH5.0) 8977 4997 1371 27.4% 馏分5(pH5.5) 7503 4214 730 17.3% 馏分6(pH9.5) 9023 4709 1580 33.6% 总结 51859 15335 9846 64.2% *结果由1%假阳性率(FDR) 过滤, PSM=肽段谱图匹配数 *该数值已考虑到所有馏分中特有肽段的总数,并不是每个馏分中所鉴定到的特有肽段数目的简单加和 肽段的洗脱基于其生化性质,且洗脱模式与预测趋势相同。当通过增加离子强度进行洗脱时,每种馏分中的每条肽段的平均碱性残基(H,K,R)数目从0.99(馏分1)增加至2.39(馏分6)(表4)。当通过增加 pH 进行洗脱时,该增长率有所减小,从1.01(馏分1)增加至1.87(馏分2)。类似的,在两种洗脱条件下,平均pl值随馏分数目的增加而增加。 在图4和图5中,将样品经过八次重复测定所得的各馏分的总离子流图(TIC)进行叠加,表明日内和日间的分析结果具有高度的相似性。选定肽段的提取离子流图(EIC)如图4和图5的下图所示。所有八个重复测定的结果进行重叠,峰面积%CV及质量数误差列于表中。例如,在不使用内标或参考质量数校正时,肽段 HVAILGDLQGPK的峰面积%CV 为2.8%,平均质量数误差为-5.6 ppm(图4,底部)。重要的是,利用 AssayMAP工作流程进行溶液内酶解、C18纯化、SCX分馏(离子强度),以及另一轮的 C18纯化后可达到这一水平的重现性。类似的,采用相同的工作流程,通过pH 进行 SCX 分馏以及完成一轮的纯化,肽段 VVDAAVEK 的峰面积%CV为5.3%,平均质量数误差为 4.9 ppm(图5,底部)。图4及图5的下图显示了12条肽段的峰面积%CV范围介于2.3-8.1%之间,质量数误差均小于8ppm。除了%CV和质量数误差较低外,经过八次重复测定所得的12条肽段的平均保留时间偏差均小于0.085%(<3s)。 碱性残基(H,K,R) 估算 SCX 分馏编号 的平均数 的平均pl 增加离子强度 流通/清洗液 0.21 5.63 馏留1 (30mM KCI) 0.99 6.36 馏分2(50mM KCI) 1.06 6.72 馏分3(85 mMKCI) 1.48 6.76 馏分4(115mM KCI) 1.83 6.87 馏分5(150 mM KCI) 2.08 6.94 馏分6(350 mM KCI) 2.39 6.90 增加 pH 流通/清洗液 0.39 5.54 馏分1 (pH 3.5) 1.01 6.30 馏分2(pH4.0) 1.09 6.72 馏分3(pH4.5) 1.39 6.75 馏分4 (pH 5.0) 1.72 6.64 馏分5(pH5.5) 1.73 6.69 馏分6(pH9.5) 1.87 6.71 该值使用表3中所列的“指定馏分中所鉴定的平均特有肽段数”计算所得。 *肽段的等电点 (pl) 是由液相简单估算的,并未考虑邻近残基对 pKa 值的影响。H、K、R、D、E及Y残基的侧链及N端和C端的pKa 值用于简单估算pl4 肽段分馏的用途有多种,具体取决于实验的特定目标。对于发现型实验(例如本文所述的实验),通过分馏可将样品成分按复杂性划分至不同的馏分中,从而降低整体样品的复杂性。这有利于鉴定那些在未分馏样品中常常被掩盖的低丰度肽段,从而扩展了分析的动态范围。一一般来说,如果是为了表征样品,这可增加所能鉴定的特有肽段数目。例如,未分馏的大肠杆菌酶解物(12pg上样量,与分馏的样品的 TIC 信号基本相同) 经AssayMAP处理后, 采用与分馏样品相同的 LC/MS 方法分析七次。总LC/MS采集时间(7小时)与分析一组(6份)馏分和流通液所需的时间相同。虽然未分馏样品可获得更多的肽段谱图匹配数(58753),但只产生7678条特有的肽段序列,而分馏的样品可获得约15000 条特有肽段。在这种情况下,分馏在鉴定肽段上具有巨大的优势,可鉴定到几乎两倍数目的特有肽段。 图4.利用增加离子强度进行逐步洗脱所得的每个 SCX馏分的8次(第一天,n=4;第二天, n=4) TIC 叠加图(上图)。指定馏分中所鉴定肽段的8次 EIC叠加图。未使用内标或外部参考质量数校正时,这些肽段的峰面积%CV均小于7.6%,且质量数误差小于8 ppm (下图) 图5.利用增加 pH 进行逐步洗脱所得的每个 SCX馏分的8次(第一天,n=4;第二天, n=4) TIC 叠加图(上图)。指定馏分中所鉴定肽段的8次 EIC 叠加图。未使用内标或外部参考质量数校正时,这些肽段的峰面积%CV均小于7.6%,且质量数误差小于8 ppm (下图) 这些数据证明了固相萃取 (SPE)形式的逐步分馏的实用性,尽管肽段分馏通常是采用高效液相色谱系统(HPLC)的梯度洗脱进行的。 AssayMAP Bravo 是一种性能卓越的液体处理器,可通过加载的小柱重复控制小体积的液体。但是, AssayMAP Bravo 不是 96通道HPLC, 并且利用5pL填充床式小柱进行逐步分馏并不能提供与离线梯度分馏相同的分离能力,后者采用较大体积的填充柱及 HPLC 进行。 与标准的 HPLC色谱柱相比,小柱的理论塔板数较小,而正是理论塔板数大大影响了分离效率。传统的 SPE 步及到手动移液或重力/真空辅助的移液,,它们对于简单的“开/关”分析较为有用,因为这些分析的主要目标是结合分析物,洗掉污染物,以及同时洗脱所有目标分析物。在这些情况下,并不一定需要精准的体积及流量控制才可获得实验的成功。相反,精准的体积及流量控制对更为细致的技术而言十分关键,例如化学性质类似的成分的逐步分馏,因为简单的“开/关”化学并不适用。采用传统的 SPE很难进行多通道样品处理,例如液体流过 SPE材料时,每个孔、小柱或预装吸头所接收的液体体积必须完全相同,且流速相同,若非如此,将会导致多通道分馏实验中的重现性不理想。 AssayMAP Bravo 的液体处理性能可实现高重现性的多通道逐步分分,能够精确控制流经小柱的液体体积和流速,因此在微量应用获得最佳结果。AssayMAP 平台是一种桥接技术,对于那些无需 HPLC 性能但需要在可放大的样品制备平台上进行高度重现性分馏的应用而言,它可在分析型 SPE 中实现多通道的逐步分离。 结论 用于肽段 LC/MS分析的多步骤样品制备工作流程可通过 AssayMAP Bravo 实现自动化操作,从而获得高重复性的溶液内蛋白酶解、反相肽段纯化及复杂肽段混合物的强阳离子交换分馏。在原理循证的发现型鸟枪法实验中,采用 100 pg大肠杆菌细胞裂解液蛋白样品进行多步骤的 AssayMAP 工作流程,其中通过增加离子强度度 pH进行六个洗先步骤以完成 SCX分馏。两种形式的分馏均可鉴定超过15000条特有肽段,由 Agilent 6550 iFunnel QTOF液质联用系统、Agilent 1290 Infinity 液相色谱系统及 Agilent AdvanceBio 肽图分析色谱柱进行分析。在15000 多条特有肽段中,采用离子强度或 pH进行 SCX分馏时,分别有67.1%和64.2%的肽段可专属性地归至六个馏分中的一个。在未使用内标情况下,通过多天对选定肽段进行分析,结果表明峰 面积%CV在2.3-8.1%之间。与未分馏的样品分析相比,采用 SCX 馏分可鉴定到接近两倍量的特有肽段,这表明,采用逐步分馏可提高分析的动态范围,提高发现型实验中的蛋白组覆盖率。 采用 AssayMAP Bravo 及其专为精确蛋白组学设计的工具套装可实现多步骤样品制备工作流程的自动化,实验设立简单易行。AssayMAP 肽段样品制备自动化解决方案可使研究人员及分析开发者快速、系统地评价 LC/MS样品制备条件、化学反应和方法学,而无需掌握自动化方面的专业知识。与此同时,一旦工作流程完成后,对于通量需求,无论是每天几个样品,还是每天上百个样品, AssayMAPBravo 平台均可无缝进行通量缩放。这是因为它能够通过一个简单直观的软件界面定制方案,使用户可以完全控制重要的实验变量,而不再需要事先熟悉复杂的精确自动化知识。对于那些已经通过湿式工作台技术开发的样品制备方案,分析开发者可利用其在特定化学反应及实验条件选择和优化方面的投资,将实验方案扩展至AssayMAP平台。总的说来,本文展示的数据证实了采用 AssayMAPBravo 进行自动化样品制备并利用安捷伦的分析方案对多肽进行 LC/MS分析可获得高精度的测量结果。 ( 参考文献 ) 1. A.J. Alpert, P.C. Andrews "Cation-exchange chromatography ( of peptides o n poly(2-sulfoethyl ) aspartamide)-silica”J. Chromatogr. 1988, 443 (0), 85-96 2. J. Dai, C.H. Shieh, Q.H. Sheng, H. Zhou,R. Zeng"Proteomic analysis withintegrated multiple dimensional liquidchromatography/mass spectrometrybased on elution of ion exchangecolumn using pH steps" Anal. Chem.2005,77(18), 5793-9 3. C.D.Wenger, J.J. Coon "A proteomics search algorithm specifically designedfor high-resolution tandem mass spectra"J. Proteome. Res. 2013 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 4. A.L.Lehninger, Principles of Biochemistry 1982, Worth Publishers, 免费专线: New York, 1st Edition 800-820-3278,400-820-3278(手机用户) 5. C.F. Poole, S.K. Poole "Theory 联系我们: Meets Practice” In Solid-PhaseExtraction: Principles, Techniques, LSCA-China_800@agilent.com and Applications, N.J.K. Simpson, Ed. 在线询价: Marcel Dekker Inc.: New York, 2000 www.agilent.com/chem/erfq-cn www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 c安捷伦科技(中国)有限公司,2016 2016年3月16日,中国出版 5991-3602CHCN Agilent Technologies Agilent Technologies 摘要液质联用鉴定肽段的样品制备,通常由多步骤工作流程组成,包括溶液内蛋白酶解、肽段纯化,以及肽段分馏。该过程通常需要根据样品特性及分析目的( 即定量或表征)定制为具体的应用方法。样品制备工作流程的自动化可提高样品处理能力、降低差异性,并且无需熟练操作人员执行重复工作。然而,自动化平台通常并不用于最初的分析开发,这是因为分析开发者很少具有开发复杂自动化方案的经验。相反,分析通常是采用湿式工作台相关技术进行开发,然后在自动化专家的帮助下移植到自动化平台。采用 AssayMAP 肽段样品制备解决方案,无需掌握专门的技术也能实现自动化操作。开发者可通过一个简单的软件用户界面和灵活的实验方案对关键实验变量进行完全控制,从而能够专注于科学分析研究。如今,分析开发者、科学家或技术员无需具备自动化专业知识也能实现可扩展、精确的自动化操作。采用 AssayMAP 平台,整个工作流程可直接在相同的硬件上进行开发,如需实现高通量样品前处理,也易于对硬件进行扩展,从而可减少或避免已有实验方案实现自动化所需的额外时间和资源。本文将介绍发现(鸟枪法)蛋白组学研究的一种常规液质联用工作流程,包括溶液内酶解、反相肽段纯化,以及肽段的强阳离子交换分馏 (SCX),所有这些操作均由 AssayMap Bravo 液体处理器完成。采用 SCX 小柱通过增加 pH 或离子强度对大肠杆菌蛋白裂解液进行逐步洗脱,在六个 SCX 馏分中鉴定出 15000 多条特定肽段序列,其中 64-67% 的肽段可专属性地在其中一个馏分中得到鉴定。前言自动化的样品制备工作流程具有诸多好处,包括可扩大样品处理规模以满足所需的通量要求,并且不需要熟练操作人员执行重复而苛刻的样品处理工作。在多步骤工作流程中,借助具有精确液体处理功能的自动化平台还能最大限度减少误差的传播,并实现重现性最大化。特别是在使用液质联用系统的蛋白和肽段分析中,因为这种先进的高精密度和灵敏度的分析仪器会将多步骤样品制备工作流程中的误差放大。然而,实现样品制备的自动化面临一个重大挑战,自动化平台往往用于对现有工作流程进行移植而不是直接基于自动化平台进行分析开发,这就需要额外的优化及资源配置,从而延迟了工作流程自动化的收益。对那些未接受过自动化平台专业培训的人员而言,自动化开发并不现实且过于严格。这种严格性对已完全开发的分析而言非常重要,但可能会阻碍开发过程,因为它要求分析开发者掌握自动化相关知识并且要投入大量时间以使自己成为自动化专家,否则需要依赖其他自动化专家协助完成分析开发。从分析开发者的角度而言,真正的自动化平台应当能够实现从头至尾的分析开发、将多步骤实验方案无缝地整合到已连接的工作流程中,并且分析人员无需掌握任何自动化专业知识,从而更加专注于科学分析研究而不是自动化过程。安捷伦引进了 AssayMAP 肽段样品制备套件,包括用于 AssayMAP Bravo 自动化平台的相关软件和微型小柱,可直接满足分析开发者在自动化工作流程中进行液质联用蛋白组学应用的需求。该技术的核心是 AssayMAP Bravo 的精确液体处理能力,可处理微量滴定板。AssayMAP Bravo 移液头配有液体位移式 96 位探针式注射器 (250 μL),可采用一次性 5 μL 填充床小柱实现严格流量控制的微量级色谱分析。当自动化工程师和液质联用分析科学家协作开发出适用于蛋白组学应用的高灵活性模块化方案后也带来更多的差异化创新。这些实验方案均呈现在一个简单易用的软件界面中,使得分析开发者能够对实验参数进行完全控制,而不需精通基本的自动化知识。从而可在自动化平台上实现湿式工作台类型的分析开发。AssayMAP 方案针对溶液内酶解、肽段纯化(脱盐)及肽段分馏进行开发。这些方案可作为独立的模块进行操作,或者对这些方案进行搭配,从而建立更加复杂的工作流程架构,实现各个方案之间的转换。在本应用简报中,我们将介绍多步骤AssayMAP 工作流程在一种典型的发现(鸟枪法)蛋白质组学实验中的应用,其中采用大肠杆菌蛋白裂解物进行酶解、反相纯化,并通过增加离子强度或 pH 逐步进行强阳离子交换洗脱分馏。液质联用分析采用 Agilent 6550 iFunnel Q-TOF 液质联用系统、Agilent 1290 Infinity 液相系统及 AdvanceBio 肽图分析色谱柱,结果发现使用任一种分馏技术均可在大肠杆菌中鉴定出 15000 多条独特的肽段序列。在这 15000 条肽段中,约 10000 条肽段可在六种馏分中的一种馏分中专属性的识别出来,证实了AssayMAP SCX 小柱逐步分馏的有效性。重复分析说明利用精确的安捷伦分析技术进行蛋白组表征的液质联用工作流程具有高度重现性。结论用于肽段 LC/MS 分析的多步骤样品制备工作流程可通过 AssayMAP Bravo 实现自动化操作,从而获得高重复性的溶液内蛋白酶解、反相肽段纯化及复杂肽段混合物的强阳离子交换分馏。在原理循证的发现型鸟枪法实验中,采用 100 μg 大肠杆菌细胞裂解液蛋白样品进行多步骤的 AssayMAP 工作流程,其中通过增加离子强度或 pH 进行六个洗脱步骤以完成 SCX 分馏。两种形式的分馏均可鉴定超过 15000 条特有肽段,由 Agilent 6550 iFunnel QTOF液质联用系统、Agilent 1290 Infinity 液相色谱系统及 Agilent AdvanceBio 肽图分析色谱柱进行分析。在 15000 多条特有肽段中,采用离子强度或 pH 进行 SCX 分馏时,分别有 67.1% 和 64.2%的肽段可专属性地归至六个馏分中的一个。在未使用内标情况下,通过多天对选定肽段进行分析,结果表明峰面积 %CV 在 2.3-8.1% 之间。与未分馏的样品分析相比,采用 SCX 馏分可鉴定到接近两倍量的特有肽段,这表明,采用逐步分馏可提高分析的动态范围,提高发现型实验中的蛋白组覆盖率。采用 AssayMAP Bravo 及其专为精确蛋白组学设计的工具套装可实现多步骤样品制备工作流程的自动化,实验设立简单易行。AssayMAP 肽段样品制备自动化解决方案可使研究人员及分析开发者快速、系统地评价 LC/MS样品制备条件、化学反应和方法学,而无需掌握自动化方面的专业知识。与此同时,一旦工作流程完成后,对于通量需求,无论是每天几个样品,还是每天上百个样品,AssayMAP Bravo 平台均可无缝进行通量缩放。这是因为它能够通过一个简单直观的软件界面定制方案,使用户可以完全控制重要的实验变量,而不再需要事先熟悉复杂的精确自动化知识。对于那些已经通过湿式工作台技术开发的样品制备方案,分析开发者可利用其在特定化学反应及实验条件选择和优化方面的投资,将实验方案扩展至 AssayMAP 平台。总的说来,本文展示的数据证实了采用 AssayMAP Bravo 进行自动化样品制备并利用安捷伦的分析方案对多肽进行 LC/MS 分析可获得高精度的测量结果。
确定








还剩10页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《大肠杆菌蛋白裂解液中肽段检测方案(移液工作站)》,该方案主要用于其他中肽段检测,参考标准--,《大肠杆菌蛋白裂解液中肽段检测方案(移液工作站)》用到的仪器有Agilent AssayMAP Bravo 蛋白质样品前处理平台、Agilent 1290 Infinity II 液相色谱系统、Agilent 1290 Infinity II Multisampler
推荐专场
相关方案
更多
该厂商其他方案
更多