蛋白质沉淀技术 (PPT) 是适于 LC/MS/MS 分析的生物体液样品前处理的最常用技术之一。将蛋白质沉淀应用于生物体液样品,可以从基质中有效去除蛋白质。本应用简报讨论了生物体液样品 PPT 的重要步骤、考虑因素和注意事项。本文重点介绍使用 Captiva EMR-Lipid 96 孔板的孔内 PPT,包括合适的沉淀溶剂、比例、添加剂、生物体液基质、生物体液样品等分和沉淀溶剂的板上添加顺序、内标 (IS) 添加,以及板中的样品混合。最后,对使用离心的传统 PPT 和用 Captiva EMR-Lipid 净化后 PPT的对比结果进行了详细讨论,包括时间、方法性能以及对仪器的影响。
方案详情

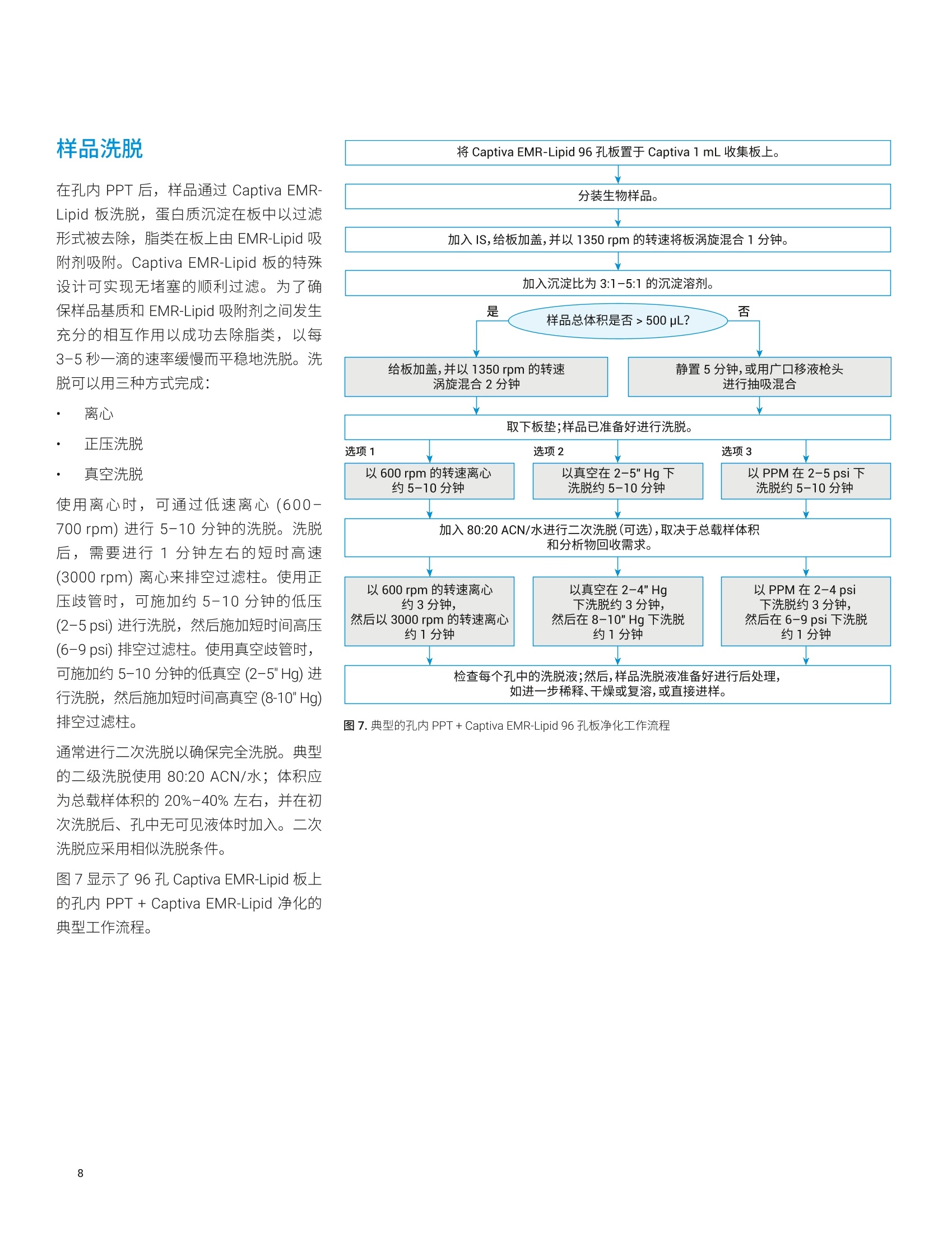
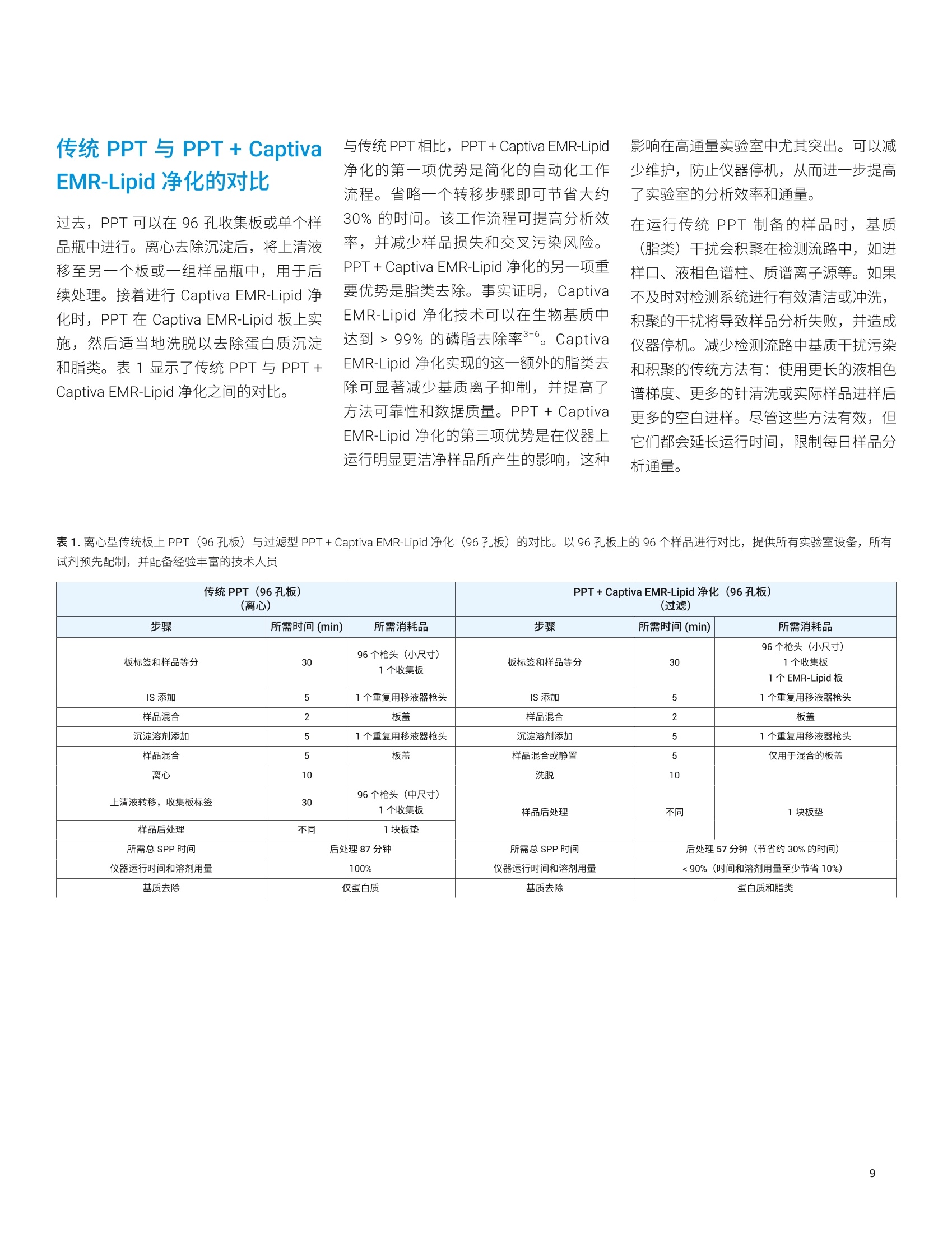
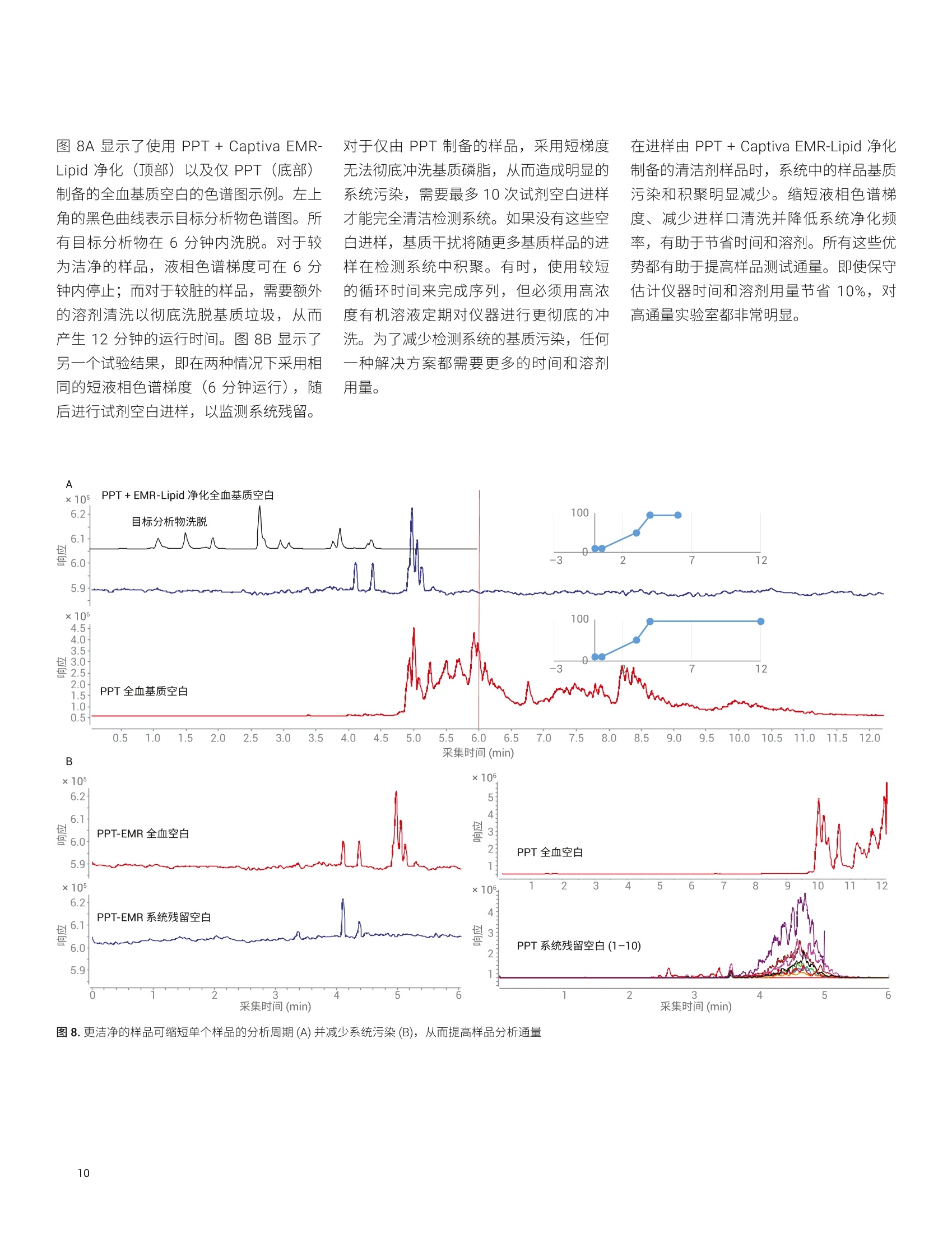
应用简报 Agilent临床研究Trusted Answers 使用 Agilent Captiva EMR-Lipid 96孔板进行生物体液样品的蛋白质沉淀 Limian Zhao 和 Megan Juck 安捷伦科技公司 蛋白质沉淀技术 (PPT)是适于 LC/MS/MS 分析的生物体液样品前处理的最常用技术之一。将蛋白质沉淀应用于生物体液样品,可以从基质中有效去除蛋白质。本应用简报讨论了生物体液样品PPT 的重要步骤、考虑因素和注意事项。本文重点介绍使用 Captiva EMR-Lipid 96 孔板的孔内 PPT,包括合适的沉淀溶剂、比例、添加剂、生物体液基质、生物体液样品等分和沉淀溶剂的板上添加顺序、内标(IS)添加,以及板中的样品混合。最后,对使用离心的传统 PPT 和用 Captiva EMR-Lipid 净化后 PPT的对比结果进行了详细讨论,包括时间、方法性能以及对仪器的影响。 蛋白质沉淀(PPT)已广泛用于 LC/MS/MS分析的生物体液样品前处理。将生物体液样品与3-5倍体积可与水混溶的溶剂(如乙腈(ACN)、甲醇 (MeOH) 或二者的混合物)混合,来实现蛋白质的有效去除。有机溶剂的添加破坏了蛋白质的水化层,降低了蛋白质分子间的排斥力,显著降低了蛋白质的溶解度,从而使蛋白质沉淀出来。之后,可通过离心或过滤去除沉淀,并将上清液用于分析。即使由于蛋白质结合或受蛋白质结合影响的分析物稳定性,导致某些目标分析物可能发生损失, PPT 方法学仍然提供了快速、简单、经济的样品前处理方法,适用于高通量样品分析。 Captiva EMR-Lipid 96 孔板可以进行孔内PPT,然后进行高效过滤以去除沉淀。此外, EMR-Lipid 吸附剂可在样品过滤期间与基质中的脂类发生相互作用,得到更洁净的洗脱液,同时去除了蛋白质和脂类。本应用简报重点讨论了使用 CaptivaEMR-Lipid 96 孔板的这一重要样品前处理技术的关键步骤。 沉淀溶剂与比例 可与水混溶的有机溶剂通用于沉淀蛋白质,通常是 ACN、MeOH 或二者的混合物。之前的研究中对采用 ACN 或 MeOH的 PPT 进行了全面对比。使用 ACN 进行 PPT通常会产生大量黄色凝结沉淀,而 MeOH 通常会产生更细的白色凝结沉淀(图1)。上清液的澄清度通常是 PPT效率的良好指标,浑浊的上清液表明仍然存在未沉淀的蛋白质。图1A表明,使用MeOH 和 ACN的最小沉淀比分别为3:1和2:1时,可以获得澄清的上清液。 图1B表明,样品在10°C下储存24小时后,以3:1的比例使用 ACN 可获得澄清的上清液。结果清晰表明, ACN 可比MeOH 实现更有效的蛋白质沉淀,如需实现有效的蛋白质去除,有必要将最小沉淀比设为3:1。然而,更大的沉淀比也会导致样品更多的稀释。因此,通常推荐采用3:1-5:1的沉淀比,在实现有效蛋白质去除的同时仍保持样品的适当稀释。 图 1. ACN 与 MeOH 用于 PPT的对比。A)混合和离心后的上清液外观;B)10℃下放置24小时后的上清液外观。由Russ Grant 提供 沉淀溶剂的另一个考虑因素是目标分析物的溶剂萃取。 ACN 和 MeOH可对不同化合物表现出不同的萃取能力。在需要调节目标分析物的溶剂可萃取性时,可以添加少部分的 MeOH (通常为5%-15%)。而需要了解的是,即使沉淀溶剂中如此少量的MeOH,也会导致蛋白质沉淀呈现出不同的视觉效果(图2A和图2B)。与沉淀溶剂混合的 MeOH越多,沉淀就越细,过滤去除沉淀时所需的压力也就越大。鉴于 MeOH 的蛋白质沉淀效率低于 ACN,过量 MeOH 会对 PPT 效率产生不利影响。因此,建议沉淀溶剂中的 MeOH 含量不超过15%。 使用 ACN (或主要是 ACN) 作为沉淀溶剂的第三点考虑因素应是易于通过过滤去除蛋白质沉淀。采用 ACN 的 PPT可产生较大颗粒的蛋白质沉淀,这种沉淀不易堵塞滤芯/滤膜,可更轻松地过滤沉淀。采用 MeOH 的 PPT可产生更多更细的沉淀,这种沉淀易于堵塞滤芯/滤膜,因此过滤时需要明显更大的压力。 为减少蛋白质结合,通常将甲酸(FA)或氢氧化铵 (NHOH) 等添加剂加入沉淀溶剂中,其中1% FA 是最常用的添加剂。而在全血 PPT中,应谨慎添加酸,因为酸可以提取出更多的血红蛋白颜色, PPT后会得到棕色/红色上清液。 图2C和图2D 显示采用中性沉淀溶剂、酸化溶剂(含1%FA)和碱性溶剂(含1% NH4OH) 进行 PPT 后的上清液外观。酸化 PPT 的上清液呈深棕色/红色。因此,请仔细考虑或避免使用酸化沉淀溶剂来进行全血 PPT。 图2.使用不同沉淀溶剂在血浆(A)和全血(B)PPT中形成的蛋白质沉淀外观,以及采用添加剂不同的沉淀溶剂在沉淀离心前(C)后(D)得到的蛋白质沉淀外观 生物体液包括全血、血浆、血清、尿液和其他体液。全血、血浆和血清是富含蛋白质的主要血液基质。因此,在LC/MS/MS分析之前有效去除这些蛋白质至关重要。 全血是含有抗凝血剂的血液,,不会分离为液体部分和血细胞 血清是无抗凝剂时与血细胞分离的顶层澄清液体部分,因此血清中不含纤维蛋白原 血浆是与血细胞分离的液体部分,含有纤维蛋白原 在相同体积下,基质中的蛋白质含量遵循全血>血浆>血清,如 PPT生成的蛋白质沉淀所示(图3)。 通常认为尿液和其他体液是低蛋白质含量基质, PPT仍可广泛用于这类基质,但与血液基质相比,这类基质实现有效蛋白质去除的难度不大。因此,这类生物体液基质中采用的沉淀溶剂与沉淀比有更大的灵活性。通常,用于制备这类样品基质的PPT被称为稀释和上样。 高通量批处理中可自动进行 PPT;因此,96孔板形式得到广泛采用。在过滤型沉淀去除中,孔内 PPT 有利于简化工作流程。而避免由沉淀造成的堵塞对过滤非常重要。 Agilent Captiva 增强型脂质去除EMR-Lipid (EMR-Lipid) 吸附剂可在蛋白质沉淀后,高选择性而有效地去除生物体液中的磷脂和其他脂类。这款产品同时采用了深度过滤机制的设计,可实现无堵塞的高效蛋白质沉淀过滤,从而可以使用孔内 PPT并简化工作流程。 A离心前的蛋白质沉淀 血液基质(特别是全血)是高粘度液体。之前建议将血清或血浆样品加入EMR-Lipid 板的沉淀溶剂中34。而将这一方法应用于全血样品,就会出现问题。全血的高粘度使其容易立即沉降在底部,导致样品混合均匀性过低。o一小部分未沉淀的全血可能会流经 EMR-Lipid 过滤柱,造成样品间的显著差异。有效混合有助于实现完全的蛋白质沉淀。而对于96孔板中的全血样品,由于产生大量沉淀、沉淀堵塞枪头的高风险以及孔间交叉污染,使样品抽吸混合较为困难。 B 离心后的蛋白质沉淀 为解决这些问题,颠倒样品和沉淀溶剂的 顺序,即将沉淀溶剂加入全血样品中。图4对比了两种不同添加顺序的样品混合均匀性和蛋白质的沉淀形成物。分别将沉淀溶剂加入全血(左)以及将全血加入沉淀溶济(右),来混合相同量的沉淀溶剂和全血样品。将沉淀溶剂加入全血样品中得到了更好的样品混合均匀性,从而实现了更有效的蛋白质沉淀。采用这一改 进的加入顺序,在加入沉淀溶剂后将样品静置5分钟即可实现蛋白质沉淀;因此抽吸混合不是必要步骤,可以跳过。采用这一先样品、后沉淀溶剂的方法可获得更好的混合均匀性,也可很好地改善不同孔的样品洗脱一致性,避免未沉淀血液流经过滤柱,并实现更顺利、更轻松的洗脱。从工作流程的角度来看,将样品直接加入 Captiva EMR-Lipid 板,可以在添 加沉淀溶剂之前在 Captiva EMR-Lipid 板中实现内标 (IS) 的添加与混合。所有样品前处理步骤均可在 Captiva EMR-Lipid 板中完成,无需样品转移。这样可节省时间和成本,并降低样品交叉污染的风险。图4底部显示的两种不同方案对比,清楚地表明了简化流程的优势。建议使用孔内PPT 接 Captiva EMR-Lipid净化,对所有96孔板方案均采用这一添加顺序。 俯视图 侧视图 全血沉降在底部; 蛋白质未沉淀 由于生物体液更粘稠,样品分装可能具有挑战性。移液是准确移取所需样品体积的首选方法。除标准移液的预防措施外,重要的是分配生物液体样品,使枪头垂直于孔底插入(图5A),而非倾斜到孔壁(图5B)。这样可以避免样品粘附在孔壁上;否则,壁上的样品残留物可能不会有效沉淀。 IS的使用是可靠定量分析的关键。将 IS加标溶液直接加入样品基质而非沉淀溶剂中,这一点非常重要,以便IS化合物可以与样品基质相均衡,并追踪分析物在基质中的行为。样品分装后,第二步通常是添加 IS 加标溶液。一般来说, IS 溶液含有一些有机成分以保持化合物可溶性,但用于配制 IS 溶液的有机溶剂体积应尽可能低。应该调整 IS 加标溶液浓度,使IS加标溶液的添加体积仅为5%-10%(相对于总样品体积)。以上所有注意事项均为了尽量减少 IS 添加带来的部分 PPT。通常使用重复用移液器简化向多个样品添 沉淀溶剂的添加量通常较大,并由于向多个样品添加同一种溶剂/溶液,通常使用重复用移液器。由于添加体积较大,添加溶剂时枪头与孔壁顶部的倾斜角度为60°左右(图5C),这一点很重要。避免枪头垂直添加溶剂(图5D),否则溶剂可能溅出,并造成交叉污染。 加 IS加标溶液的过程。鉴于于加的 IS 加标溶液体积通常较低(10-20pL),必须将 IS加标溶液添加到样品中,而不沾到容器壁。为防止污染,请勿使重复用移液器的枪头接触样品或容器壁。彻底的涡旋混合是使 IS 进入基质并达到均衡的必需手段。 图5.生物样品等分(A和B)和沉淀溶剂添加(C和D) 将沉淀溶剂加入孔中的生物样品时,将发生明显的蛋白质沉淀。不过,要完成 PPT并达到所需的 PPT 效率,建议采用主动混合(涡旋混合/抽吸混合)或被动混合(等待5分钟)。对于96孔板型 PPT,总体积小于500 pL时,21可以使用涡旋混合进行样品混合。涡旋混合前,用板盖小心盖住 Captiva EMR-Lipid 板。由于高速会造成样品交叉污染,请谨慎设定涡旋混合速率。确保液体混合线在涡旋混合过程中不接触板盖,并且混合后板盖上未观察到样品残留(图6A)。为实现有效混合,同时防止样品飞溅和随后的交叉污染,最好使用1350 rpm 转速的多管旋仪。 对于超过 500 pL 的样品量,建议采用被动混合方式,将样品静置5分钟。向样品中加入沉淀溶剂已实现了有效的混合,样品放置5分钟即可实现有效的PPT(图6B)。需要主动 PPT时,强烈建议使用广口抢头进行抽吸混合(图6C)。广口枪头可避免沉淀在混合过程中堵塞枪头。 涡旋混合过程中 涡旋混合后 B C 抽吸混合时需要广口移液枪头 图6.以涡旋(样品体积≤500pL) 或抽吸(样品体积超过 500pL)的主动混合,以及将样品静置5分钟的被动混合完成 PPT的效果 在孔内 PPT后,样品通过 Captiva EMR-Lipid 板洗脱,蛋白质沉淀在板中以过滤形式被去除,脂类在板上由 EMR-Lipid 吸附剂吸附。Captiva EMR-Lipid 板的特殊设计可实现无堵塞的顺利过滤。为了确保样品基质和 EMR-Lipid 吸附剂之间发生充分的相互作用以成功去除脂类,以每3-5秒一滴的速率缓慢而平稳地洗脱。洗脱可以用三种方式完成: 离心 正压洗脱 真空洗脱 使用离心时,,1可通过低速离心(600-700 rpm) 进行5-10分钟的洗脱。洗脱后,需要进行1分钟左右的短时高速(3000 rpm) 离心来排空过滤柱。使用正压歧管时,可施加约5-10分钟的低压(2-5 psi)进行洗脱,然后施加短时间高压(6-9 psi) 排空过滤柱。使用真空歧管时,可施加约5-10分钟的低真空(2-5"Hg)进行洗脱,然后施加短时间高真空(8-10" Hg)排空过滤柱。 通常进行二次洗脱以确保完全洗脱。典型的二级洗脱使用80:20 ACN/水;体积应为总载样体积的20%-40%左右,并在初次洗脱后、孔中无可见液体时加入。二次洗脱应采用相似洗脱条件。 ( 图7显示了96孔 Captiva EMR-Lipid 板上的孔内 PPT + Captiva EMR-Lipid 净化的 典型工作流程。 ) 给板加盖,并以 1350 rpm 的转速涡旋混合2分钟 静置5分钟,或用广口移液枪头进行抽吸混合 取下板垫;样品已准备好进行洗脱。 选项1 选项2 选项3 以 600 rpm 的转速离心约5-10分钟 以PPM 在2-5 psi下洗脱约5-10分钟 加入 80:20 ACN/水进行二次洗脱(可选),取决于总载样体积 和分析物回收需求。 以600 rpm 的转速离心约3分钟, 然后以 3000 rpm 的转速离心约1分钟 以真空在2-4"Hg下洗脱约3分钟, 然后在8-10"Hg 下洗脱约1分钟 以PPM 在2-4 psi 下洗脱约3分钟,然后在6-9psi下洗脱约1分钟 检查每个孔中的洗脱液;然后,样品洗脱液准备好进行后处理, 如进一步稀释、干燥或复溶,或直接进样。 ( 图7.典型的孔内 PP T+ Captiva EMR-Lipid 9 6 孔板净化工作流程 ) 过去, PPT 可以在96 孔收集板或单个样品瓶中进行。离心去除沉淀后,将上清液移至另一个板或一组样品瓶中,用于后续处理。接着进行 Captiva EMR-Lipid 净化时, PPT 在 Captiva EMR-Lipid 板上实施,然后适当地洗脱以去除蛋白质沉淀和脂类。表1显示了传统 PPT 与 PPT+Captiva EMR-Lipid 净化之间的对比。 与传统PPT相比, PPT+ Captiva EMR-Lipid净化的第一项优势是简化的自动化工作流程。省略一个转移步骤即可节省大约30%的时间。该工作流程可提高分析效率,并减少样品损失和交叉污染风险。PPT+Captiva EMR-Lipid 净化的另一项重要优势是脂类去除。事实证明, CaptivaEMR-Lipid 净化技术可以在生物基质中达到>99%的磷脂去除率3-6。 CaptivaEMR-Lipid 净化实现的这一额外的脂类去除可显著减少基质离子抑制,并提高了方法可靠性和数据质量。 PPT+ CaptivaEMR-Lipid 净化的第三项优势是在仪器上运行明显更洁净样品所产生的影响,这种 影响在高通量实验室中尤其突出。可以减少维护,防止仪器停机,从而进一步提高了实验室的分析效率和通量。 在运行传统 PPT 制备的样品时,基质(脂类)干扰会积聚在检测流路中,如进样口、液相色谱柱、质谱离子源等。如果不及时对检测系统进行有效清洁或冲洗,积聚的干扰将导致样品分析失败,并造成仪器停机。减少检测流路中基质干扰污染和积聚的传统方法有:使用更长的液相色谱梯度、更多的针清洗或实际样品进样后更多的空白进样。尽管这些方法有效,但它们都会延长运行时间,限制每日样品分析通量。 表1.离心型传统板上PPT (96孔板)与过滤型 PPT+ Captiva EMR-Lipid 净化(96孔板)的对比。以96孔板上的96个样品进行对比,提供所有实验室设备,所有试剂预先配制,并配备经验丰富的技术人员 传统PPT (96 孔板)(离心) PPT+ Captiva EMR-Lipid 净化 (96孔板) (过滤) 步骤 所需时间 (min) 所需消耗品 步骤 所需时间 (min) 所需消耗品 板标签和样品等分 30 96个枪头(小尺寸)1个收集板 板标签和样品等分 30 96个枪头(小尺寸) 1个收集板 1个EMR-Lipid反 IS添加 5 1个重复用移液器枪头 IS添加 5 1个重复用移液器枪头 样品混合 2 板盖 样品混合 2 板盖 沉淀溶剂添加 5 1个重复用移液器枪头 沉淀溶剂添加 5 1个重复用移液器枪头 样品混合 5 板盖 样品混合或静置 5 仅用于混合的板盖 离心 10 洗脱 10 上清液转移,收集板标签 30 96个枪头(中尺寸)1个收集板 样品后处理 不同 1块板垫 样品后处理 不同 1块板垫 所需总 SPP 时间 后处理87分钟 所需总 SPP寸间 后处理57分钟(节省约30%的时间) 仪器运行时间和溶剂用量 100% 仪器运行时间和溶剂用量 <90%(时间和溶剂用量至少节省10%) 基质去除 仅蛋白质 基质去除 蛋白质和脂类 图8A 显示了使用 PPT+Captiva EMR-Lipid 净化(顶部)以及仅 PPT (底部)制备的全血基质空白的色谱图示例。左上角的黑色曲线表示目标分析物色谱图。所有目标分析物在6分钟内洗脱。对于较为洁净的样品,液相色谱梯度可在6分钟内停止;而对于较脏的样品,需要额外的溶剂清洗以彻底洗脱基质垃圾,从而产生12分钟的运行时间。图8B显示了另一个试验结果,即在两种情况下采用相同的短液相色谱梯度(6分钟运行),随后进行试剂空白进样,以监测系统残留。 对于仅由 PPT 制备的样品,采用短梯度无法彻底冲洗基质磷脂,从而造成明显的系统污染,需要最多10次试剂空白进样才能完全清洁检测系统。如果没有这些空白进样,基质干扰将随更多基质样品的进样在检测系统中积聚。有时,使用较短的循环时间来完成序列,但必须用高浓度有机溶液定期对仪器进行更彻底的冲洗。为了减少检测系统的基质污染,任何一种解决方案都需要更多的时间和溶剂用量。 在进样由 PPT + Captiva EMR-Lipid 净化制备的清洁剂样品时,系统中的样品基质污染和积聚明显减少。缩短液相色谱梯度、减少进样口清洗并降低系统净化频率,有助于节省时间和溶剂。所有这些优势都有助于提高样品测试通量。即使保守估计仪器时间和溶剂用量节省10%,对高通量实验室都非常明显。 结论 PPT因其简便性和适用性,广泛用于制备 LC/MS/MS分析的生物体液样品。使用96孔板形式的批处理提高了样品前处理效率,而得到广泛使用。孔内 PPT +Captiva EMR-Lipid 净化技术与传统 PPT相比具有许多优势,包括简化的工作流程、蛋白质和脂类的同时去除,更高的方法可靠性、高质量数据以及对检测仪器更少的影响。根据分析要求,使用合适的沉淀溶剂类型、比例和添加剂至关重要。合适的溶剂和样品添加顺序(样品、IS和沉淀溶剂)是达到有效均匀混合并防止绕过样品的重要因素。与传统的单个样品处理相比,96孔板上的批处理通常具有更高的交叉污染风险;因此,适当的移液和混合十分关键。 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 ( 1. P olson; et al.,Optimization ofprotein precipitation based uponeffectiveness of protein removaland ionization effect i n liquidchromatography - tandem massspectrometry,J. Chromatogr. B 2003,785(2),263-275 ) ( 2. G rant, R. Solutions Based Extraction Techniques, Presentation on SamplePreparation ASMS Fall Workshop, 2016 ) ( 3. Z hao, L.; Lucas,D . Efficiency ofBiological Fluid Matrix RemovalUsing Agilent Captiva EMR-LipidCleanup ( Agilent Captiva EMR-Lipid 净化的生物体液基质去除效率),出版号5991-8006EN, 2017 ) ( 4. Lucas, D.; Zhao, L. 使用 AgilentCaptiva EMR-Lipid 分析生物样品中 的维生素D代谢物,出版号5991-7956CHCN, 2017 ) Stevens, J.;Zhao,L. EfficientQuantitative Analysis of THC and itsMetabolites in Whole Blood UsingAgilent Captiva EMR-Lipid and LC-MS/MS (使用 Captiva EMR-Lipid 和LC-MS/MS 对全血中的 THC 及其代谢物进行高效定量分析),出版号5991-8635EN, 2017 Zhao, L.; Lucas, D. 使用 Agilent Captiva EMR-Lipid 净化对人血清中的药物进行 LC/MS/MS定量分析,5991-8007CHCN, 2017 摘要蛋白质沉淀技术 (PPT) 是适于 LC/MS/MS 分析的生物体液样品前处理的最常用技术之一。将蛋白质沉淀应用于生物体液样品,可以从基质中有效去除蛋白质。本应用简报讨论了生物体液样品 PPT 的重要步骤、考虑因素和注意事项。本文重点介绍使用 Captiva EMR-Lipid 96 孔板的孔内 PPT,包括合适的沉淀溶剂、比例、添加剂、生物体液基质、生物体液样品等分和沉淀溶剂的板上添加顺序、内标 (IS) 添加,以及板中的样品混合。最后,对使用离心的传统 PPT 和用 Captiva EMR-Lipid 净化后 PPT的对比结果进行了详细讨论,包括时间、方法性能以及对仪器的影响。前言蛋白质沉淀 (PPT) 已广泛用于 LC/MS/MS 分析的生物体液样品前处理。将生物体液样品与 3–5 倍体积可与水混溶的溶剂(如乙腈 (ACN)、甲醇 (MeOH) 或二者的混合物)混合,来实现蛋白质的有效去除。有机溶剂的添加破坏了蛋白质的水化层,降低了蛋白质分子间的排斥力,显著降低了蛋白质的溶解度,从而使蛋白质沉淀出来。之后,可通过离心或过滤去除沉淀,并将上清液用于分析。即使由于蛋白质结合或受蛋白质结合影响的分析物稳定性,导致某些目标分析物可能发生损失,PPT 方法学仍然提供了快速、简单、经济的样品前处理方法,适用于高通量样品分析。Captiva EMR-Lipid 96 孔板可以进行孔内 PPT,然后进行高效过滤以去除沉淀。此外,EMR-Lipid 吸附剂可在样品过滤期间与基质中的脂类发生相互作用,得到更洁净的洗脱液,同时去除了蛋白质和脂类。本应用简报重点讨论了使用 Captiva EMR-Lipid 96 孔板的这一重要样品前处理技术的关键步骤。结论PPT 因其简便性和适用性,广泛用于制备 LC/MS/MS 分析的生物体液样品。使用 96 孔板形式的批处理提高了样品前处理效率,而得到广泛使用。孔内 PPT + Captiva EMR-Lipid 净化技术与传统 PPT 相比具有许多优势,包括简化的工作流程、蛋白质和脂类的同时去除,更高的方法可靠性、高质量数据以及对检测仪器更少的影响。根据分析要求,使用合适的沉淀溶剂类型、比例和添加剂至关重要。合适的溶剂和样品添加顺序(样品、IS 和沉淀溶剂)是达到有效均匀混合并防止绕过样品的重要因素。与传统的单个样品处理相比,96 孔板上的批处理通常具有更高的交叉污染风险;因此,适当的移液和混合十分关键。
确定








还剩9页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《生物体液样品中蛋白质沉淀检测方案(液相色谱仪)》,该方案主要用于其他中蛋白质沉淀检测,参考标准--,《生物体液样品中蛋白质沉淀检测方案(液相色谱仪)》用到的仪器有Agilent 1260 Infinity II Prime HPLC 液相色谱系统、Agilent Ultivo 三重四极杆液质联用系统、Agilent 1290 Infinity II Multisampler、OpenLAB 软件
推荐专场
相关方案
更多
该厂商其他方案
更多

























