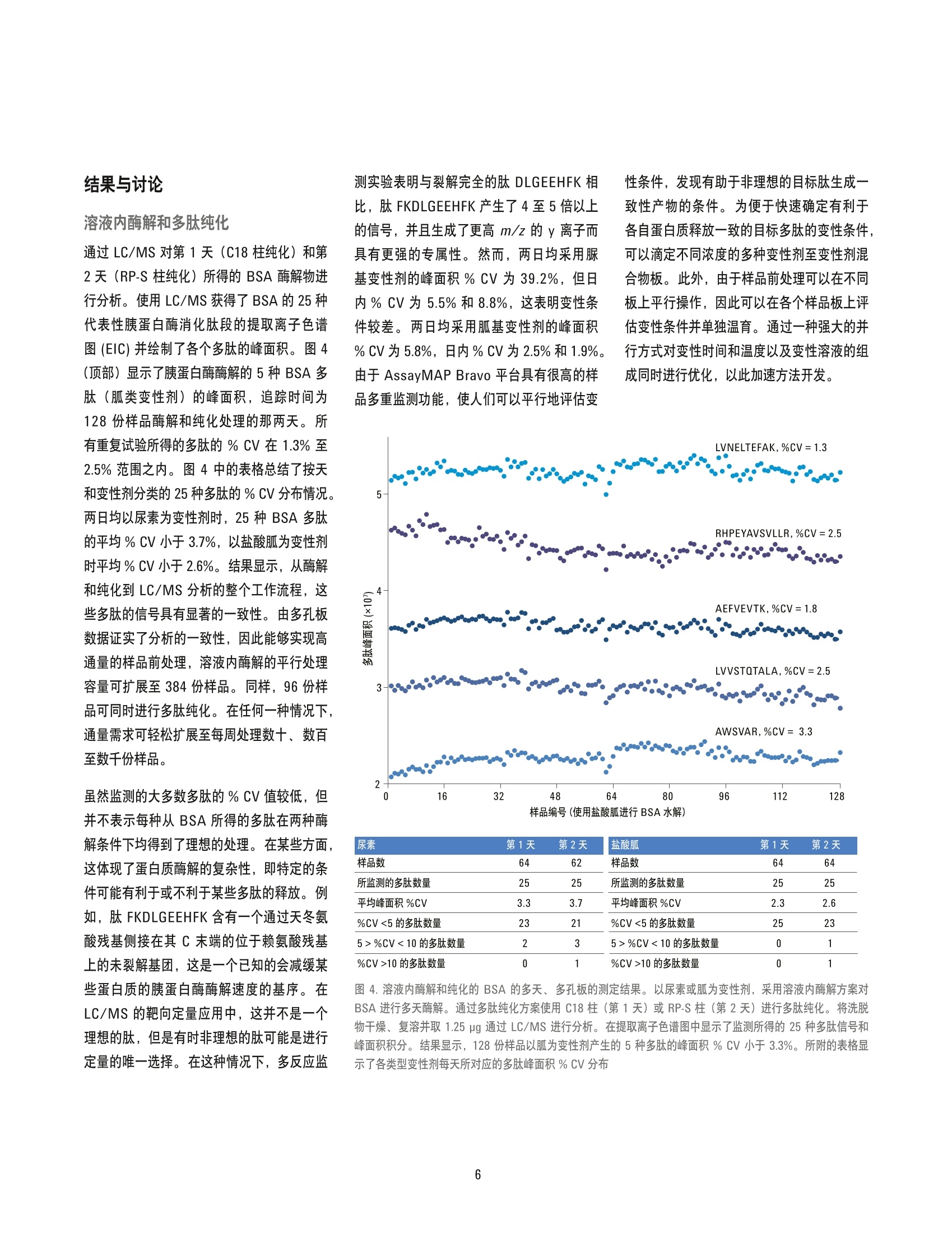
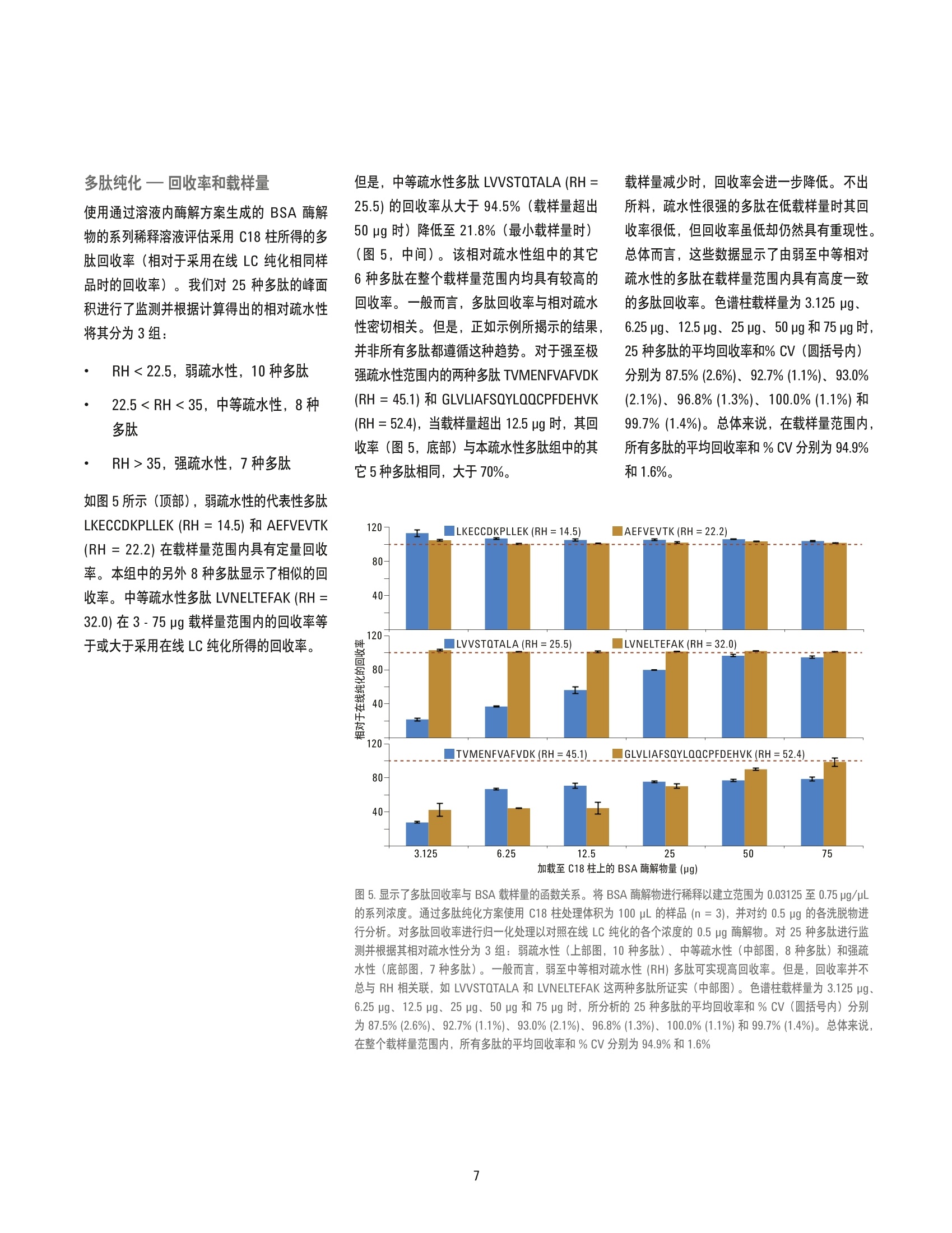
适用于液质联用 (LC/MS) 分析的蛋白质和多肽样品前处理的工作流程由于依赖于连续的手工操作而效率低下,导致试验方案缺乏通量、可扩展性和可转移性。这类工作流程通常依赖于技能非常娴熟的从业人员以达到可接受的重现性,或者在很多情况下,鉴于工作流程的特殊性,较大的差异是可被勉强接受的。为解决这些问题,可以采用安捷伦 AssayMAP Bravo 平台及其蛋白质组学工具套件实现 LC/MS 蛋白质组学工作流程常规样品处理工作的自动化,使 LC/MS 样品前处理具有可重现性、可扩展性、方案可移植性和易用性。本平台由顶级的液体处理器、一次性微量色谱柱和简单的用户可定制方案组成,可高通量地进行蛋白质酶解和多肽纯化。BSA 经酶解后纯化所得的分析性能数据表明 25 种 BSA 目标多肽的日间重现性良好, % CV 小于 5% 此外,我们还展示了用于多肽纯化的 AssayMAP RP-S 和 C18 反相柱的所有特性。
方案详情

Jason D. Russell、 Zachary Van Den Heuvel、 Michael Bovee 和 Steve Murphy 安捷伦科技公司 美国威斯康星州麦迪逊 自动化液质联用样品前处理:通过安捷伦 AssayMAP Bravo 平台实现高通量溶液内酶解和多肽纯化 应用简报 适用于 LC/MS 的自动化多肽样品前处理 摘要 适用于液质联用 (LC/MS)分析的蛋白质和多肽样品前处理的工作流程由于依殊于连续的手工操作而效率低下,导致试验方案缺乏通量、可扩展性和可转移性。这类工作流程通常依赖于技能非常娴熟的从业人员以达到可接受的重现性,或者在很多情况下,鉴于工作流程的特殊性,较大的差异是可被勉强接受的。为解决这些问题,可以采用安捷伦AssayMAP Bravo 平台及其蛋白质组学工具套件实现 LC/MS蛋白质组学工作流程常规样品处理工作的自动化,使LC/MS样品前处理具有可重现性、可扩展性、方案可移植性和易用性。本平台由顶级的液体处理器、一次性微量色谱柱和简单的用户可定制方案组成,可高通量地进行蛋白质酶解和多肽纯化。BSA 经酶解后纯化所得的分析性能数据表明25种 BSA目标多肽的日间重现性良好,%CV小于5%此外,我们还展示了用于多肽纯化的AssayMAP RP-S和 C18反相柱的所有特性。 前言 蛋白质和多肽分析经历了一场变革,部分原因是由于串联质谱、软电离技术、生物信息学和色谱分离技术的进步。分析革新和运算能力的融合,使科学家们得以利用液相色谱与质谱联用 (LC/MS)的工作流程探索蛋白质动力学和具有空前灵敏度和精密度的定量测定方法。随着 LC/MS在定量蛋白质组学领域的应用日益成熟,人们对分析精度的要求将更严格,对提高样品通量的愿望更强烈。然而, 虽然 LC/MS 在蛋白质组学的应用已取得了巨大创新,但是样品前处理的发展未能与其它关键技术并驾齐驱。在生物标记物发现和验证领域,没有哪项技术像定量蛋白质组学的样品前处理技术一样发展得如此明显缓慢。据文献报道,利用 LC/MS 测定已揭示了数百种有关疾病的潜在蛋白质生物标记物并且记录在案。但是,其中绝大多数生物标记物的研究仍然止步于最初的使用一小组患者样品的研究。这些样品组通常比日常 临床应用的分析验证所需的样品数少几个数量级。由于通过多步骤工作流程对患者样品进行单个或小批量处理会导致多重误差,因此在企图扩大样品处理规模时通常伴随着检测变异增大。这种变异会掩盖蛋白质表达中具有重大生物学意义的变化,初步研究表明,这些变化能够指示疾病的状态和易感性。 采用 LC/MS 进行定量蛋白质组学的样品前处理工作流程由于依赖于连续的手工操作而效率低下,导致试验方案缺乏通量、可扩展性和可转移性,而这些特性正是LC/MS 临床应用和高通量筛选及过程控制工作流程所必须的。这些工作流程通常依赖于数量相对有限的技能相当娴熟的从业人员以达到可接受的重现性,虽然保持了所期望的分析质量,但却严重限制了增加样品处理容量的能力。能否成功利用 LC/MS 进行蛋白质分析,样品前处理的重现性非常重要。直观、可靠和样品可扩展的自动化方案的欠缺进一步限制了LC/MS 在需要进行大量样品处理或要 求高通量的分析中的应用。因此必须对样品前处理方法进行开发,使其能够从根据假说进行研究扩展至完整的临床验证和大规模检测。此类扩展能否实现取决于其所基于的自动化方案是否专门设计用于蛋白质样品前处理,重要的是能否满足蛋白质组学研究者们的需求。 本应用简报展示了专为实现可重现、可扩展并且简单易用的 LC/MS 样品前处理而设计的安捷伦 AssayMAP Bravo 自动化平台及其蛋白质组学工具套件。该平台包含配有96个探针式注射器的能够实现正向位移式精确流量控制的顶级液体处理器、一次性5pL填充床色谱柱、灵活并且可自定义的分析方案以及简单的用户界面,可在微孔板中进行自动化的、高通量的蛋白质酶解和多肽纯化。本文将介绍 AssayMAP Bravo 在单一蛋白质模型系统的酶解和纯化中的应用,并报道i了复合工作流程所得的分析性能数据。 实验部分 溶液内酶解在溶液内酶解方案中,用户可以选择平行处理1-4个96孔板的1-12列中的样品(8-96个样品/板)。在本实验中,每板可处理32份样品。在本方法中,首先依次从适当的母板吸取试剂,然后将试剂加入到样品中并在样品板中将溶液混合,具体数量则遵照应用界面输入的参数(图2)。通过应用界面开启或关闭步骤并改变不同试剂的组成以定制反应条件,从而提高了系统的灵活性。将牛血清白蛋白(BSA) 在水中溶解使浓度达到15 pg/pL,吸取 15pL(225pg)至U型底微量滴定板的前四列的各个孔中。在另外3个板上重复上述操作,从而产生4个样品品,总总有128份独立样品进行酶解。将胍基变性剂混合物分配至第1和2列并将脲基变性剂混合物分配至第3和4列,由此制成变性混合物板。将碘乙酰胺添加至U 型底烷基化板的前4列中,Tris 缓冲液添加至1mL 深孔稀释剂混合物板的前4列中以及胰蛋白酶添加至 PCR 蛋白酶板的前4列中。板的布局见图1,试剂列表见表1。 表1.样品、试剂和分析仪器 图1.用于 BSA酶解的多孔板的微孔板布局。样品板含 BSA (15 ug/pL),变性剂混合物板含胍基变性剂混合物(橙色)或脲基变性剂混合物(紫色)。烷基化板含碘乙酰胺,稀释剂混合物板含 Tris 缓冲液以及蛋白酶板含胰蛋白酶 采用溶液内酶解方案中的微孔板堆栈工具在AssayMAP Bravo 台板的位置2将5个U型底板堆成一摞,以充当各个样品板和蛋白酶板的顶盖。这些板在烷基化步骤中可使样品避开光照并最大程度地降低了大气污染的风险。它们还能够在各个液体处理步骤之间提供严格的注射器清洗(本实验未进行严格的注射器清洗)。将试剂和样品板放置于台板上,如图2所示。在“溶液内酶解”用户界面的“应用设置”中输入图2中显示的数值。启动本方案,加入变性剂混合物并与样品混合。本方案可自动中止,以便将样品板从台板上移除。通过 PlateLoc 利用可移除的 密封膜对样品板进行密封并在60℃培养箱中放置1h。样品板经短暂的离心,除去密封膜,样品返回至台板上,继续加入烷化剂,进行烷基化温育(45min), 然后加入稀释剂,再加入胰蛋白酶,这些操作均在 Bravo 台板上连续进行。方案步骤完成后,将样品板从台板上移除,使用 PlateLoc 密封并置于37℃培养箱中酶解过夜。将样品从培养箱中取出,短暂离心,利用单一液体添加工具向各个样品板加入30 pL 10% TFA 使样品酸化。第二天,采用相同条件重复溶液内酶解方案。然后,利用多肽纯化方案处理酸化的 BSA 酶解物。 多肽纯化 AssayMAP 提供了两种可选小柱进行反向纯化,一种小柱装填了传统的C18 (16%碳载量, 150A孔径)固定相,另一种装填了未衍生聚苯乙烯-二乙烯基苯固定相 (RP-S,100A孔径)。每种类型的小柱在选择性方面可能会显示细微差异,这取决于样品和所选的试剂。此外, C18柱在大约 pH2-8范围内具有稳定的性能,而 RP-S 柱具有更宽的pH操作范围(约pH1-13)。 图2.安捷伦 AssayMAP 溶液内酶解方案的用户界面和进行 BSA 酶解分析的多孔板参数 多肽纯化方案从 Workflow Navigator 打开。将缓冲液(表1)分配至与储存注射器清洗(灌注)缓冲液、通用缓冲液(平衡/清洗)或洗脱缓冲液的试剂板相对应的12列板的前4列。空U型底板或PCR 板用作流通液收集板和洗脱液收集板。色谱柱转换器用于将四列 AssayMAP C18 柱(第一天)或 RP-S柱(第二天)从柱架转移至第2板位的柱放置台板上。台板的配置如图3所示,第4板位放置了含酸化 BSA 的单个U型底样品板。在“多肽纯化”用户界面的“应用设置”中输入数值并在“实验室器具表”中选择实验室器具类型(如图3所示)。启动方案并在柱灌注和平衡后,向各个小柱加载100pL BSA 酶解物(75pg)。对通过溶液内酶解方案所得的另外3个样品板重复多肽纯 化方案。将洗脱物冻干并在-80°C下保存。将洗脱物复溶,从各个样品孔取1.25 pg进样。利用 LC/MS 监测25种多肽的信号。 多肽纯化一回收率 在多肽纯化回收率研究中,将通过溶液内酶解方案所得的酸化 BSA 酶解物 (0.75 pg/pL)混合并稀释成以下系列浓度:0.75、0.50、0.25、0.125、0.0625 和0.03125 pg/pL。采用图3中的设置对样品进行多肽纯化,同时,取 100pL各浓度溶液加载至 AssayMAP C18柱上,平行操作3次。将洗脱物冻干并在-80°℃ 下保存。将洗脱物复溶,取各加载浓度溶液所得样品0.5pg 进样。利用 LC/MS监测25种多肽的信号,并直接与各个浓度的0.5 ug酶解物经线线 LC纯化所得的相同多肽 的峰面积对比。(最高至最低浓度的 BSA 溶液的进样体积范围为 0.67 pL至16pL)。 多肽纯化一载样量的差异为进行多肽纯化载样量差异的研究,将来自批量溶液内胰蛋白酶酶解物的酸化 BSA酶解物 (4.75 pg/pL) 稀释为以下系列浓度:4.0、3.0、2.0、1.0、0.75、0.50、0.25和0.10 pg/pL。采用图3中的设置对样品进行多肽纯化,同时, 取100 pL各浓度溶液加载至AssayMAP RP-S 和 C18 柱上,所有样品平行制备2份。将洗脱物冻干并在-80°℃下保存。将洗脱物复溶,取各加载浓度溶液所得样品 1.0 pg 进样并利用 LC/MS监测多肽信号。 图3.安捷伦 AssayMAP 多肽纯化方案的用户界面和用于 BSA 酶解物纯化的参数 结果与讨论 溶液内酶解和多肽纯化 通过 LC/MS 对第1天 (C18柱纯化)和第2天(RP-S柱纯化)所得的 BSA 酶解物进行分析。使用 LC/MS 获得了 BSA 的25种代表性胰蛋白酶消化肽段的提取离子色谱图(EIC)并绘制了各个多肽的峰面积。图4(顶部)显示了胰蛋白酶酶解的5种 BSA多肽(胍类变性剂)的峰面积,追踪时间为128份样品酶解和纯化处理的那两天。所有重复试验所得的多肽的%CV 在1.3%至2.5%范围之内。图4中的表格总结了按天和变性剂分类的25种多肽的%CV分布情况。两日均以尿素为变性剂时,25 种 BSA 多肽的平均%CV 小于3.7%,以盐酸胍为变性剂时平均%CV小于2.6%。结果显示,从酶解和纯化到 LC/MS分析的整个工作流程,这些多肽的信号具有显著的一致性。由多孔板数据证实了分析的一致性,因此能够实现高通量的样品前处理,溶液内酶解的平行处理容量可扩展至384份样品。同样,96份样品可同时进行多肽纯化。在任何一种情况下,通量需求可轻松扩展至每周处理数十、数百至数千份样品。 虽然监测的大多数多肽的%CV值较低,但并不表示每种从 BSA所得的多肽在两种酶解条件下均得到了理想的处理。在某些方面,这体现了蛋白质酶解的复杂性,即特定的条件可能有利于或不利于某些多肽的释放。例如, 肽 FKDLGEEHFK含有一个通过天冬氨酸残基侧接在其C 末端的位于赖氨酸残基上的未裂解基团,这是一个已知的会减缓某些蛋白质的胰蛋白酶酶解速度的基序。在LC/MS的靶向定量应用中,这并不是一个理想的肽,但是有时非理想的肽可能是进行定量的唯一选择。在这种情况下,多反应监 测实验表明与裂解完全的肽 DLGEEHFK 相比,肽FKDLGEEHFK 产生了4至5倍以上的信号,并且生成了更高m/z的y离子而具有更强的专属性。然而,两日均采用脲基变性剂的峰面积%CV为39.2%,但日内% CV为5.5%和8.8%,这表明变性条件较差。两日均采用胍基变性剂的峰面积% CV为5.8%, 日内% CV 为2.5%和1.9%。由于 AssayMAP Bravo 平台具有很高的样品多重监测功能,使人们可以平行地评估变 性条件,发现有助于非理想的目标肽生成一致性产物的条件。为便于快速确定有利于各自蛋白质释放一致的目标多肽的变性条件,可以滴定不同浓度的多种变性剂至变性剂混合物板。此外,由于样品前处理可以在不同板上平行操作,因此可以在各个样品板上评估变性条件并单独温育。通过一种强大的并行方式对变性时间和温度以及变性溶液的组成同时进行优化,以此加速方法开发。 样品编号(使用盐酸胍进行BSA水解) 尿素 第1天 第2天 盐酸胍 第1天 第2天 样品数 64 62 样品数 64 64 所监测的多肽数量 25 25 所监测的多肽数量 25 25 平均峰面积%CV 3.3 3.7 平均峰面积%CV 2.3 2.6 %CV <5 的多肽数量 23 21 %CV<5的多肽数量 25 23 5>%CV<10 的多太数量 2 3 5>%CV<10的多肽数量 0 1 %CV>10的多肽数量 0 1 %CV>10的多肽数量 0 1 图4.溶液内酶解和纯化的 BSA 的多天、多孔板的测定结果。以尿素或胍为变性剂,采用溶液内酶解方案对BSA 进行多天酶解。通过多肽纯化方案使用 C18柱(第1天)或 RP-S柱(第2天)进行多肽纯化。将洗脱物干燥、复溶并取 1.25 ug 通过LC/MS 进行分析。在提取离子色谱图中显示了监测所得的25种多肽信号和峰面积积分。结果显示,128份样品以胍为变性剂产生的5种多肽的峰面积%CV 小于3.3%。所附的表格显示了各类型变性剂每天所对应的多肽峰面积%CV分布 多肽纯化一回收率和载样量 使用通过溶液内酶解方案生成的 BSA酶解物的系列稀释溶液评估采用 C18 柱所得的多肽回收率(相对于采用在线LC纯化相同样品时的回收率)。我们对25种多肽的峰面积进行了监测并根据计算得出的相对疏水性将其分为3组: RH<22.5,弱疏水性,10种多肽 22.535, 强疏水性,7种多肽 如图5所示(顶部), 弱疏水性的代表性多肽LKECCDKPLLEK (RH=14.5) 和 AEFVEVTK(RH=22.2) 在载样量范围内具有定量回收率。本组中的另外8种多肽显示了相似的回收率。中等疏水性多肽 LVNELTEFAK (RH=32.0)在3-75 pg载样量范围内的回收率等于或大于采用用线 LC纯化所得的回收率。 但是,中等疏水性多肽 LVVSTQTALA (RH=25.5)的回收率从大于94.5%(载样量超出50pg时) 降低至21.8%(最小载样量时)(图5,中间)。该相对疏水性组中的其它6种多肽在整个载样量范围内均具有较高的回收率。一般而言,多肽回收率与相对疏水性密切相关。但是,正如示例所揭示的结果,并非所有多肽都遵循这种趋势。对于强至极强疏水性范围内的两种多肽 TVMENFVAFVDK(RH= 45.1) 和 GLVLIAFSQYLQQCPFDEHVK(RH=52.4), 当载样量超出12.5 pg时,其回收率(图5,底部)与本疏水性多肽组中的其它5种多肽相同,大于70%。 载样量减少时,回收率会进一步降低。不出所料,疏水性很强的多肽在低载样量时其回收率很低,但回收率虽低却仍然具有重现性。总体而言,这些数据显示了由弱至中等相对疏水性的多肽在载样量范围内具有高度一致的多肽回收率。色谱柱载样量为 3.125 ug、6.25 ug、12.5ug、25 ug、50 pg 和 75 pg时,25种多肽的平均回收率和% CV(圆括号内)分别为 87.5%(2.6%)、92.7%(1.1%)、93.0%(2.1%)、96.8%(1.3%)、100.0%(1.1%)和99.7%(1.4%)。总体来说,在载样量范围内,所有多肽的平均回收率和%CV分别为94.9%和1.6%。 加载至 C18柱上的 BSA 酶解物量(pg) 图5.显示了多肽回收率与 BSA 载样量的函数关系。将 BSA 酶解物进行稀释以建立范围为 0.03125至0.75ug/pL的系列浓度。通过多肽纯化方案使用 C18柱处理体积为100 pL 的样品(n=3),并对约0.5pg 的各洗脱物进行分析。对多肽回收率进行归一化处理以对照在线 LC 纯化的各个浓度的 0.5 pg 酶解物。对25种多肽进行监测并根据其相对疏水性分为3组:弱疏水性(上部图,10种多肽)、中等疏水性(中部图,8种多肽)和强疏水性(底部图,7种多肽)。一般而言,弱至中等相对疏水性(RH)多肽可实现高回收率。但是,回收率并不总与 RH 相关联, 如 LVVSTQTALA 和 LVNELTEFAK 这两种多肽所证实(中部图)。色谱柱载样量为 3.125 pg、6.25 pg、12.5 ug、25 ug、50 pg 和75 pg时, 所分析的25种多肽的平均回收率和%CV(圆括号内)分别为87.5%(2.6%)、92.7%(1.1%)、93.0%(2.1%)、96.8%(1.3%)、100.0%(1.1%)和99.7%(1.4%)。总体来说,在整个载样量范围内,所有多肽的平均回收率和%CV分别为94.9%和1.6% 多肽纯化一分析物偏差和载样量 通过向 AssayMAP C18 和RP-S柱加载 10-400 pg酶解物,然后取1 pg 洗脱物进样分析,以研究这两种柱的BSA 酶解物结合容量。在图6中, 将 RP-S 和 C18 柱脱脱物的叠加总离子流色谱图 (TIC) 按计算的相对疏水性(RH,采用 SSRCalc 计算)划分成多个区域,并根据增加的载样量进行排列。随着载样量从 10 pg增加至 200pg, 弱至中等相对疏水性(RH 约为8-48)多肽的 TIC信号大致保持不变。 RH值在14.5至48之间的多肽 TIC 信号在载样量高达 300 pg 时仍稳定。载样量达 400 pg 时,这些多肽的结合容量超限。强亲水性多肽 (RH约小于8)随着载样量增加至 100 pg以上时被竞争性取代,之所以会损失是由于强疏水性多肽 (RH大于48)在 10 ug 载样量时的非特异性键合所致。除 C18 柱在载样量增加至100 pg以上时体现出对亲水性多肽的保留略强之外,C18和 RP-S柱的载样量和结合特性几乎相同。AssayMAP 反相柱的样品结合特性和结合容量依赖于若干个实验变量,包括样品结合过程中的样品量、样品复杂性和流速。重要的是, AssayMAP Bravo 多肽纯化方案能够非常快速的对小柱容量和结合特性进行评估而便于样品纯化条件的优化。 图6.多肽纯化的载样量采用多肽纯化方案, 在 RP-S 和 C18柱上加载的 BSA 酶解物量在10-400 pg范围内增长。将洗脱物干燥,复溶并取 1.0 pg 利用 LC/MS 进行分析。载样量在25-100 pg范围内的多肽回收率几乎无偏差并且与相对疏水性 (RH) 无关。载样量超出 100 pg 时,亲水性多肽则被更多的疏水性多肽竞争性取代。载样量低于 25 ug时,疏水性很强的多肽的回收率降低 用于 LC/MS样品前处理的安捷伦 AssayMAPBravo 及其工具套件在一定程度上带来了自动化操作的重现性、可扩展性、灵活性并且简单易用,这是其它平台无法实现的。将此技术应用于定量蛋白质组学中常见而重要的样品前处理工作中,可最大程度缩短手动操作时间、实现通量最大化并轻松获得高精密度。溶液内酶解方案可实现平行处理8-384羊样品,而多肽纯化方案可同时处理8-96份样品。借助单个 AssayMAP Bravo平台,这两种方案可轻松扩展至每周处理数十、数百、数千数样品。将 AssayMAP 的溶液内酶解和多肽纯化方案相结合,使用两种不同的变性剂进行试验并在多孔板上连续数天监测 BSA 的25种多肽所得的平均峰面积%CV在2.3%-3.7%范围之内。对A ssayMAP RP-S 和 C18 反相柱所有特性的表征提供了其重要的性能数据,包括载样量、结合特性和 BSA 的胰蛋白酶酶解物的多肽回收率。弱至中等疏水性多肽在载样量低至3ug 时可获得良好回收率,同时, 在亲水性极强的多肽被竞争性取代之前,可加载100 pg以上的 BSA酶解物。 ( 参考文献 ) ( 1. V . Spicer, et al., "Sequence-specific retention calculator. A family of peptide retention time prediction algorithms in reversed-phase HPLC: Applicability to various chromatographic conditions a nd columns" , Anal. C hem., 7 9 ( 2 2), 8762 - 8768,2007 ) www.agilent.com/chem/cn 本资料中的信息如有变更,恕不另行通知。 @安捷伦科技(中国)有限公司,2013 2013年8月20日,中国印刷 5991-2957CHCN Agilent Technologies Agilent Technologies 摘要适用于液质联用 (LC/MS) 分析的蛋白质和多肽样品前处理的工作流程由于依赖于连续的手工操作而效率低下,导致试验方案缺乏通量、可扩展性和可转移性。这类工作流程通常依赖于技能非常娴熟的从业人员以达到可接受的重现性,或者在很多情况下,鉴于工作流程的特殊性,较大的差异是可被勉强接受的。为解决这些问题,可以采用安捷伦 AssayMAP Bravo 平台及其蛋白质组学工具套件实现 LC/MS 蛋白质组学工作流程常规样品处理工作的自动化,使 LC/MS 样品前处理具有可重现性、可扩展性、方案可移植性和易用性。本平台由顶级的液体处理器、一次性微量色谱柱和简单的用户可定制方案组成,可高通量地进行蛋白质酶解和多肽纯化。BSA 经酶解后纯化所得的分析性能数据表明 25 种 BSA 目标多肽的日间重现性良好, % CV 小于 5% 此外,我们还展示了用于多肽纯化的 AssayMAP RP-S 和 C18 反相柱的所有特性。前言蛋白质和多肽分析经历了一场变革,部分原因是由于串联质谱、软电离技术、生物信息学和色谱分离技术的进步。分析革新和运算能力的融合,使科学家们得以利用液相色谱与质谱联用 (LC/MS) 的工作流程探索蛋白质动力学和具有空前灵敏度和精密度的定量测定方法。随着 LC/MS 在定量蛋白质组学领域的应用日益成熟,人们对分析精度的要求将更严格,对提高样品通量的愿望更强烈。然而,虽然 LC/MS 在蛋白质组学的应用已取得了巨大创新,但是样品前处理的发展未能与其它关键技术并驾齐驱。在生物标记物发现和验证领域,没有哪项技术像定量蛋白质组学的样品前处理技术一样发展得如此明显缓慢。据文献报道,利用 LC/MS 测定已揭示了数百种有关疾病的潜在蛋白质生物标记物并且记录在案。但是,其中绝大多数生物标记物的研究仍然止步于最初的使用一小组患者样品的研究。这些样品组通常比日常临床应用的分析验证所需的样品数少几个数量级。由于通过多步骤工作流程对患者样品进行单个或小批量处理会导致多重误差,因此在企图扩大样品处理规模时通常伴随着检测变异增大。这种变异会掩盖蛋白质表达中具有重大生物学意义的变化,初步研究表明,这些变化能够指示疾病的状态和易感性。采用 LC/MS 进行定量蛋白质组学的样品前处理工作流程由于依赖于连续的手工操作而效率低下,导致试验方案缺乏通量、可扩展性和可转移性,而这些特性正是 LC/MS 临床应用和高通量筛选及过程控制工作流程所必须的。这些工作流程通常依赖于数量相对有限的技能相当娴熟的从业人员以达到可接受的重现性,虽然保持了所期望的分析质量,但却严重限制了增加样品处理容量的能力。能否成功利用 LC/MS 进行蛋白质分析,样品前处理的重现性非常重要。直观、可靠和样品可扩展的自动化方案的欠缺进一步限制了 LC/MS 在需要进行大量样品处理或要求高通量的分析中的应用。因此必须对样品前处理方法进行开发,使其能够从根据假说进行研究扩展至完整的临床验证和大规模检测。此类扩展能否实现取决于其所基于的自动化方案是否专门设计用于蛋白质样品前处理,重要的是能否满足蛋白质组学研究者们的需求。本应用简报展示了专为实现可重现、可扩展并且简单易用的 LC/MS 样品前处理而设计的安捷伦 AssayMAP Bravo 自动化平台及其蛋白质组学工具套件。该平台包含配有 96 个探针式注射器的能够实现正向位移式精确流量控制的顶级液体处理器、一次性 5 μL 填充床色谱柱、灵活并且可自定义的分析方案以及简单的用户界面,可在微孔板中进行自动化的、高通量的蛋白质酶解和多肽纯化。本文将介绍 AssayMAP Bravo 在单一蛋白质模型系统的酶解和纯化中的应用,并报道了复合工作流程所得的分析性能数据。结论用于 LC/MS 样品前处理的安捷伦 AssayMAP Bravo 及其工具套件在一定程度上带来了自动化操作的重现性、可扩展性、灵活性并且简单易用,这是其它平台无法实现的。将此技术应用于定量蛋白质组学中常见而重要的样品前处理工作中,可最大程度缩短手动操作时间、实现通量最大化并轻松获得高精密度。溶液内酶解方案可实现平行处理 8-384 份样品,而多肽纯化方案可同时处理8-96 份样品。借助单个 AssayMAP Bravo 平台,这两种方案可轻松扩展至每周处理数十、数百、数千份样品。将 AssayMAP 的溶液内酶解和多肽纯化方案相结合,使用两种不同的变性剂进行试验并在多孔板上连续数天监测 BSA 的 25 种多肽所得的平均峰面积 % CV 在 2.3%-3.7% 范围之内。对 A ssayMAP RP-S 和 C18 反相柱所有特性的表征提供了其重要的性能数据,包括载样量、结合特性和 BSA 的胰蛋白酶酶解物的多肽回收率。弱至中等疏水性多肽在载样量低至 3 μg 时可获得良好回收率,同时,在亲水性极强的多肽被竞争性取代之前,可加载 100 μg 以上的 BSA 酶解物。
确定








还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《蛋白质和多肽中酶解和多肽纯化检测方案(移液工作站)》,该方案主要用于其他中酶解和多肽纯化检测,参考标准--,《蛋白质和多肽中酶解和多肽纯化检测方案(移液工作站)》用到的仪器有Agilent AssayMAP Bravo 蛋白质样品前处理平台、Agilent 1260 Infinity II Prime HPLC 液相色谱系统、Agilent 6470 三重四极杆液质联用系统、Agilent 1290 Infinity II Multisampler
推荐专场
液体处理工作站(移液工作站)
更多
相关方案
更多
该厂商其他方案
更多