在生物制药行业,单克隆抗体生产的下游加工过程通常包括三步色谱纯化:捕获、中间纯化和精制纯化。蛋白质A 柱常在捕获步骤中使用,它能带来高通量(即分析能力和分析速度),同时在浓缩目标分子和免疫球蛋白方面同样发挥了重要的作用。在投入高成本进行制备以及使用大量蛋白质A 柱之前;若想要对细胞培养上清液的单克隆抗体滴度和产量进行监测,就需要通过小型(分析型)的处理工序来确定单克隆抗体的滴度,以便确定单克隆抗体产品的最佳采集时间。在本应用简报中,采用预填充的Agilent Bio-Monolith 蛋白质A 色谱柱进行了快速捕获细胞上清液中的单克隆抗体滴度的研究。
方案详情

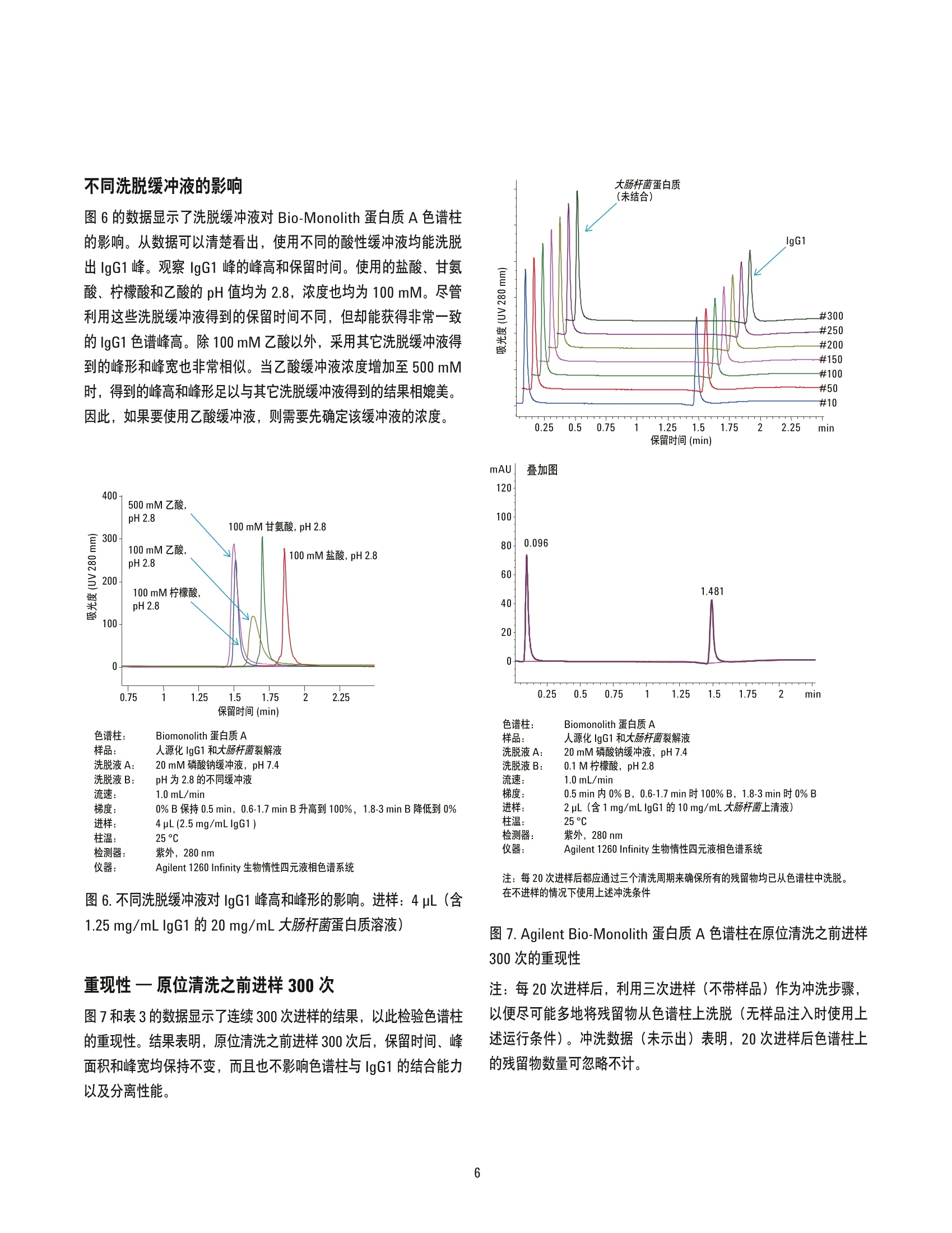
采用 Agilent Bio-Monolith 蛋白质A色谱监测细胞培养液中的单克隆抗体滴度 应用简报 生物制药与生物仿制药 作者 前言 Phu T Duong安捷伦科技有限公司 在生物制药行业,单克隆抗体生产的下游加工过程通常包括三步色谱纯化:捕获、中间纯化和精制纯化。蛋白质A柱常在捕获步骤中使用,它能带来高通量(即分析能力和分析速度),同时在浓缩目标分子和免疫球蛋白方面同样发挥了重要的作用。在投入高成本进行制备以及使用大量蛋白质A柱之前;若想要对细胞培养上清液的单克隆抗体滴度和产量进行监测,就需要通过小型(分析型)的处理工序来确定单克隆抗体的滴度,以便确确单克隆抗体产品的最佳采集时间。在本应用简报中,采用预填充的 Agilent Bio-Monolith蛋白质A 色谱柱进行了快速捕获细胞上清液中的单克隆抗体滴度的研究。 Agilent Technologies 磷酸二氢钠和磷酸氢二钠、J、一水合柠檬酸 (Sigma-Aldrich, 部件号 C1901)和大肠杆菌细胞裂解试剂盒均购自 Sigma-Aldrich (部件号 CB0500)。 CHO细胞衍生的人源单克隆抗体(IgG1)购自 BioCreative Labs。 洗脱液A用于平衡、结合、再平衡。此缓冲液含20mM磷酸钠缓冲液(pH 7.4)。制备1L的20mM磷酸钠缓冲液 (pH7.4),称取 3.1 gNaH,PO·H20和10.9gNa,HPO(无水)溶解于蒸馏水,定容至1L,即可获得0.1M (100 mM) 磷酸钠缓冲液 (pH 7.4,25°C)储备液,此缓冲液可在4℃下存放长达1个月。使用去离子水按1:5比例稀释此储备液(取200mL储备液并加入800mL去离子水),即可获得20mM磷酸钠缓冲液 (pH 7.4)。洗脱液B用于蛋白质洗脱, 为 pH 2.8的0.1M柠檬酸。要制备1L柠檬酸缓冲液,称取21g一水合柠檬酸溶解于大约600 mL 的水中,稍微搅拌,然后使用1M HCI将pH值调节至2.8。最后,使用去离子水稀释并转入1L容量瓶,定容至刻度。 按照制造商推荐的方案制备大肠杆菌上清液。简而言之,该试剂盒包含 Cellytic B细菌细胞裂解试剂(500mL)、溶菌酶溶液(10×1mL)、核酸酶(25000个单位)和蛋白酶抑制剂混合物(5mL)。称取 1.0g细胞浆,然后与10mL Cellytic B 试剂、0.2 mL溶菌酶、0.1 mL 蛋白酶抑制剂和500个单位的核酸酶进行混合。对该混合物短暂旋混合10 min (手动或使用振荡器),以确保有效提取可溶性蛋白。然后5000g离心10min, 使所有不溶物沉淀。小心地将细胞碎片(管底的沉淀物)上方的可溶性蛋白组分(上清液)移出。使用 Bradford 蛋白检测法估算上清液的蛋白浓度。 所测得蛋白浓度为 40 mg/mL。然后按说明往上清液中加入 lgG1;40 mg/mL 大肠杆菌上清液中加入2.5 mg/mL纯化的人源化 lgG1。混合后,使用流动相A(20mM磷酸钠缓冲液, pH 7.4) 按1:1比例进一步稀释此混合物,最终浓度为1.25 mg/mL IgG1 和20 mg/mL 大肠杆菌上清液。 条件 色谱柱: Agilent Bio-Monolith 蛋白质A(部件号5069-3639) 样品: 人源化 IgG1 和大肠杆菌裂解液 洗脱液: A)20mM磷酸钠, pH 7.4B) 0.1M柠檬酸, pH 2.8 进样: 参见色谱图 流速: 1.0 mL/min (除非另有说明) 梯度: 时间 (min) %B 0 0 0 100 0 0 柱温: 25°℃ 检测器: 紫外, 280 nm 系统: Agilent 1260 Infinity 生物惰性四元液相色谱系统 结果与讨论 定量单克隆抗体滴度 准确定量单克隆抗体的滴度和产量有助于确定细胞裂解液(上清液)中的单克隆抗体含量并确定采集时间。这是生产抗体非常关键的步骤。为了考察 Bio Monolith 蛋白质A 色谱柱在定量 lgG1方面的能力,将不同含量(ug) 的纯化 lgG1 进样至色谱柱。图1所示为峰面积与人源化 IgG1的进样量(介于0.625-5pg) 绘制的IgG1线性曲线。该线性校准曲线为标准曲线。相关系数表明,Bio Monolith 蛋白质A色谱柱能够用于定量分析所收集的细胞培养基中不同浓度范围的单克隆抗体。同时还在该色谱柱上上样0.312 pg人源化IgG1(数据点未显示),进样量为 0.312 pg时的信噪比 (S/N) 大于1:1。最大上样量大约为400-500pg lgG。 保留时间(min) 色谱柱: Agilent Biomonolith 蛋白质A样品: 人源化IgG1 和大肠杆菌裂解液洗脱液A: 20 mM 磷酸钠缓冲液, pH 7.4洗脱液B: 0.1M柠檬酸, pH2.8流速: 1.0mL/min梯度: 0%B保持0.5 min, 0.6-1.7 min B 升高到100%,1.8-3 min B 降低到0%进样: 进样量不同(如色谱图所示)柱温: 25°C检测器: 紫外, 280 nm 仪器: Agilent 1260 Infinity 生物惰性四元液相色谱系统 图1.Agilent Bio-Monolith 蛋白质A色谱柱定量分析单克隆抗体 在本例中,图2的数据表明人源化 IgG1 的进样量介于 5-0.625 pg之间时成线性。同时还在该色谱柱上上样 0.312 pg 人源化 lgG1(数据点未显示)。进样量为 0.312 ug 时的信噪比大于 1:1。最大上样量大约为400-500 ug IgG. 确定所采集的细胞培养上清液中的IgG1滴度 单克隆抗体纯化的第一步是确定该抗体是否存在于细胞裂解液(上清液)中。这要求色谱柱必须对单克隆抗体具有极强的特异性亲和作用,并且只保留和定量分析单克隆抗体。 图2可明显看出 Bio-Monolith 蛋白质A色谱柱的特异性。当上清液(大肠杆菌裂解液的蛋白质)不含单克隆抗体(IgG1)时,图A中的色谱图显示所有蛋白质在色谱柱上无保留。上清液的所有蛋白质均从色谱柱流出。图A中的基线延长进一步证明了这一点。图B显示色谱柱仅捕获和分离单克隆抗体(添加IgG1的大肠杆菌上清液)。利用以上的标准曲线(图1)预先测定和再确认 IgG1的含量,约为1.25 pg/pL。 Bio Monolith 蛋白质A色谱柱仅捕获单克隆抗体,该抗体在约1.4 min 时被洗脱。 图2. Agilent Bio-Monolith 蛋白质A色谱柱仅快速捕获所收集的添加IgG1细胞培养液中的 IgG1。图A,大肠杆菌细胞裂解上清液; 图B, 加 lgG1的大肠杆菌细胞裂解上清液。进样:2pL(含1.25 mg/mL IgG1 的 20 mg/mL 大肠杆菌上清液) 流速对 IgG1结合、峰面积和柱反压的影响 采用三种不同的流速(1.0、1.5和2.0mL/min)考察流速对IgG1结合以及色谱柱性能的影响(图3)。在本研究中, IgG1 和大肠杆菌蛋白的进样浓度为原来的两倍,以便于观察变化。提高流速对IgG1 与色谱柱结合的影响微乎其微(表1)。在不同流速下,未结合蛋白(大肠杆菌蛋白)的百分比、相对峰面积以及结合的 IgG1 相对峰面积保持不变(表1)。 mAU 保留时间(min) 色谱柱: Biomonolith 蛋白质 A 样品: 人源化 IgG1和大肠杆菌裂解液 洗脱液A: 20 mM 磷酸钠缓冲液, pH7.4洗脱液B: 0.1M柠檬酸, pH 2.8流速: 1.0、1.5和2.0 mL/min梯度: 0%B保持0.5 min, 0.6-1.7 min B 升高到 100%, 1.8-3 min B 降低到0%进样: 4pL (含1.25 mg/mL IgG1 的 20mg/mL大肠杆菌上清液)柱温: 25C检测器: 紫外, 280 nm 仪器: Agilent 1260 Infinity 生物惰性四元液相色谱系统 图3.考察 IgG1在几种不同流速下与 Agilent Bio-Monolith 蛋白质A色谱柱的结合能力。本研究加大进样量以便于观察色谱图变化以及信号积分 表1的数据也表明提高流速会会色谱柱反压呈线性增长(图4)。 通常来说, Bio-Monolith 蛋白质A色谱柱的推荐操作流速为1.0 mL/min, 而此色谱柱的最大反压为72 bar。 在这种特殊的仪器上,当流速为1.0 mL/min 时,色谱柱反压为 32 bar。当流速提高到2.0mL/min时,色谱柱反压增加到68 bar。如上所示,最大反压值对 lgG1 与色谱柱的结合的影响极小。因此可以在更高的流速下运行,以提高分析速度。 表1.流速与未结合蛋白和IgG1相对峰面积的关系 1.0 1230 738 63 37 32 1.5 840 492 63 37 47 2.0 636 363 64 36 68 图4.流速与反压的关系图。当色谱柱流速呈线性增加时(1.0、 1.5和2.0 mL/min),色谱柱反压也随之线性增加 耐盐性一含有不同盐浓度的细胞培养上清液与 IgG1的混合物 mAU 细胞培养上清液往往含有用于保持蛋白稳定的氯化钠 (NaCl) 和氯化钾 (KCI) 等中性盐。通常所使用的盐浓度介于 100-200 mM之间。然而,在许多纯化过程(包括亲和与离子交换方法)中,盐是一种强洗脱溶剂。在一些方法中,仅仅50mM 的 NaCl 也能将结合的蛋白质从色谱柱上洗脱下来,从而阻止色谱柱保留待分离的蛋白质。因此,讨论 Bio-monolith 蛋白质A亲和色谱柱对一定含量的盐具有耐受性很重要。本实验通过将已加入 lgG1的上清液溶解到0-200mM 的 NaCI中来说明该色谱柱的耐盐性。图5所示为加入到0、150和200mM NaCl 中的样品的分析数据。结果表明, Bio Monolith 蛋白质 A 色谱柱可耐受盐浓度较高的样品,且不影响峰形。此外,在这三种盐浓度下,峰面积的变化不明显,可忽略不计(表2)。 检测器: 紫外,280 nm 仪器: Agilent 1260 Infinity 生物惰性四元液相色系系统 图5.含不同盐浓度的 IgG1和大肠杆菌上清液样品,将其进样至Agilent Bio-Monolith 蛋白质A色谱柱中以考察此柱分析含盐样品的性能。进样:2pL(含1.25mg/mLIgG1 的 20 mg/mL大肠杆菌蛋白质溶液) 表2.含盐样品对色谱柱性能的影响极低 不同洗脱缓冲液的影响 图6的数据显示了洗脱缓冲液对 Bio-Monolith 蛋白质A色谱谱的影响。从数据可以清楚看出,使用不同的酸性缓冲液均能洗脱出lgG1峰。观察 lgG1 峰的峰高和保留时间。使用的盐酸、甘氨酸、柠檬酸和乙酸的 pH值均为2.8,浓度也均为100mM。尽管利用这些洗脱缓冲液得到的保留时间不同,但却能获得非常一致的 IgG1 色谱峰高。除100 mM乙酸以外,采用其它洗脱缓冲液得到的峰形和峰宽也非常相似。当乙酸缓冲液浓度增加至500 mM时,得到的峰高和峰形足以与其其洗脱缓冲液得到的结果相媲美。因此,如果要使用乙酸缓冲液,则需要先确定该缓冲液的浓度。 保留时间(min) 色谱柱: Biomonolith 蛋白质A 样品: 人源化 IgG1 和大肠杆菌裂解液 洗脱液A: 20 mM 磷酸钠缓冲液, pH 7.4洗脱液B: pH 为 2.8的不同缓冲液流速: 1.0 mL/min梯度: 0%B保持0.5 min, 0.6-1.7 min B 升高到100%, 1.8-3min B 降低到0%进样: 4pL(2.5 mg/mLIgG1)柱温: 25°C检测器: 紫外,280 nm仪器: Agilent 1260 Infinity 生物惰性四元液相色谱系统 图6.不同洗脱缓冲液对 IgG1峰高和峰形的影响。进样:4pL(含1.25 mg/mL IgG1 的20 mg/mL 大肠杆菌蛋白质溶液) 重性性原位清洗之前进样300次 图7和表3的数据显示了连续300次进样的结果,以此检验色谱柱的重现性。结果表明,原位清洗之前进样300次后,保留时间、峰面积和峰宽均保持不变,而且也不影响色谱柱与 IgG1的结合能力以及分离性能。 注:每20次进样后都应通过三个清洗周期来确保所有的残留物均已从色谱柱中洗脱。在不进样的情况下使用上述冲洗条件 图7. Agilent Bio-Monolith 蛋白质A色谱柱在原位清洗之前进样300 次的重现性 注:每20次进样后,利用三次进样(不带样品)作为冲洗步骤,以便尽可能多地将残留物从色谱柱上洗脱(无样品注入时使用上述运行条件)。冲洗数据(未示出)表明,20次进样后色谱柱上的残留物数量可忽略不计。 表3.原位清洗之前进样300次得到的 lgG1 的保留时间、峰面积和峰宽(标准偏差为0.75, n=300) 进样次数 (min) (mAU*s) (min) 10 1.48 89 0.02 50 1.48 88 0.02 100 1.48 88 0.02 1.48 87 0.02 1.48 88 0.02 1.48 87 0.02 再生和原位清洗 图8A显示未结合的蛋白与 lgG1 的峰均有所变差。峰的保留时间也发生漂移。这表明需要对色谱柱进行再生处理。图8B 显示根据推荐的程序进行清洗后色谱柱的性能得到了恢复。简单来说,可使用20倍柱体积的缓冲液以 0.5 mL/min 的流速冲洗色谱柱以实现再生,例如含1.0M NaCl的磷酸钠缓冲液(pH7.0至8.0)。该色谱柱应当使用低pH溶液(例如1.0mM盐酸或1.0M甘氨酸-盐酸, pH 2.5) 以 0.5 mL/min 的流速进行冲洗。然后再使用10倍柱体积的去离子水冲洗并使用20倍柱体积的缓冲液 A (20mM磷酸钠缓冲液, pH 7.4)重新平衡,之后才能开始下一次进样。 有些情况下,仅仅对整体柱进行简单的再生是不够的。样品分子可能不能完全从色谱柱上洗脱,或者甚至有可能沉淀在色谱柱上。这类污染物沉积在整体柱上,可能导致分离度和键合能力的降低、反压升高,或使色谱柱完全堵塞。因此,必须根据样品中存在的污染物类型设计特殊的原位清洗程序。表4给出了适当的清洗程序。 图8.A 图所示为 Bio Monolith 蛋白质色谱柱清洗前的色谱图; B图显示清洗后色谱性能得到恢复 表4.推荐的原位清洗程序。注:清洗程序的第一步应当以0.2-0.5 mL/min 的流速反向冲洗色谱柱,从而防止污染物进一步进入色谱柱的其它部位 0.1M NaOH 10到20 去离子水 10到20 3 0.5磷酸钠缓冲液(浓缩的结合缓冲液) 10到20 4 50 结论 Agilent Bio-Monolith 蛋白质A 色谱柱对单克隆抗体具有极高的亲和性。显然,该色谱柱可以在1.4 min 内专门捕获并准确定量分析上清液中的单克隆抗体,以评估收集时间。色谱柱能够在不同的流速下有效地定量分析单克隆抗体,并且不影响数据质量。上述色谱柱的灵活性,例如可使用不同的洗脱缓冲液以及可耐受盐浓度较高的样品,这些性能均可帮助用户轻松设计实验程序。 更多信息 这些数据代表典型结果。有关我们的产品与服务的详细信息,请访问我们的网站: www.agilent.com/chem/cn www.agilent.com/chem/cn 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 本资料中的信息、说明和指标如有变更,恕不另行通知。 C安捷伦科技(中国)有限公司,2014 2014年1月8日,中国印刷 5991-2990CHCN Agilent Technologies 前言在生物制药行业,单克隆抗体生产的下游加工过程通常包括三步色谱纯化:捕获、中间纯化和精制纯化。蛋白质A 柱常在捕获步骤中使用,它能带来高通量(即分析能力和分析速度),同时在浓缩目标分子和免疫球蛋白方面同样发挥了重要的作用。在投入高成本进行制备以及使用大量蛋白质A 柱之前;若想要对细胞培养上清液的单克隆抗体滴度和产量进行监测,就需要通过小型(分析型)的处理工序来确定单克隆抗体的滴度,以便确定单克隆抗体产品的最佳采集时间。在本应用简报中,采用预填充的Agilent Bio-Monolith 蛋白质A 色谱柱进行了快速捕获细胞上清液中的单克隆抗体滴度的研究。结论Agilent Bio-Monolith 蛋白质A 色谱柱对单克隆抗体具有极高的亲和性。显然,该色谱柱可以在1.4 min 内专门捕获并准确定量分析上清液中的单克隆抗体,以评估收集时间。色谱柱能够在不同的流速下有效地定量分析单克隆抗体,并且不影响数据质量。上述色谱柱的灵活性,例如可使用不同的洗脱缓冲液以及可耐受盐浓度较高的样品,这些性能均可帮助用户轻松设计实验程序。
确定







还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《细胞培养液单克隆抗体中滴度检测方案(液相色谱仪)》,该方案主要用于治疗类生物药品中含量测定检测,参考标准--,《细胞培养液单克隆抗体中滴度检测方案(液相色谱仪)》用到的仪器有Agilent 1260 Infinity II Prime HPLC 液相色谱系统、Agilent 1290 Infinity II Multisampler
推荐专场
相关方案
更多
该厂商其他方案
更多


















