应用优势
1)快速定量血浆和血清中的24种神经酰胺、 23种己糖基神经酰胺以及鞘氨醇
2)使用Quanpedia™和SOP构建性能稳定、便 于部署的平台,降低方法开发和培训成本
3)使用TargetLynx™软件和第三方信息学软件(即Skyline)实现快速数据处理和数据可视化
4)比同类工作流程更快、更经济
方案详情

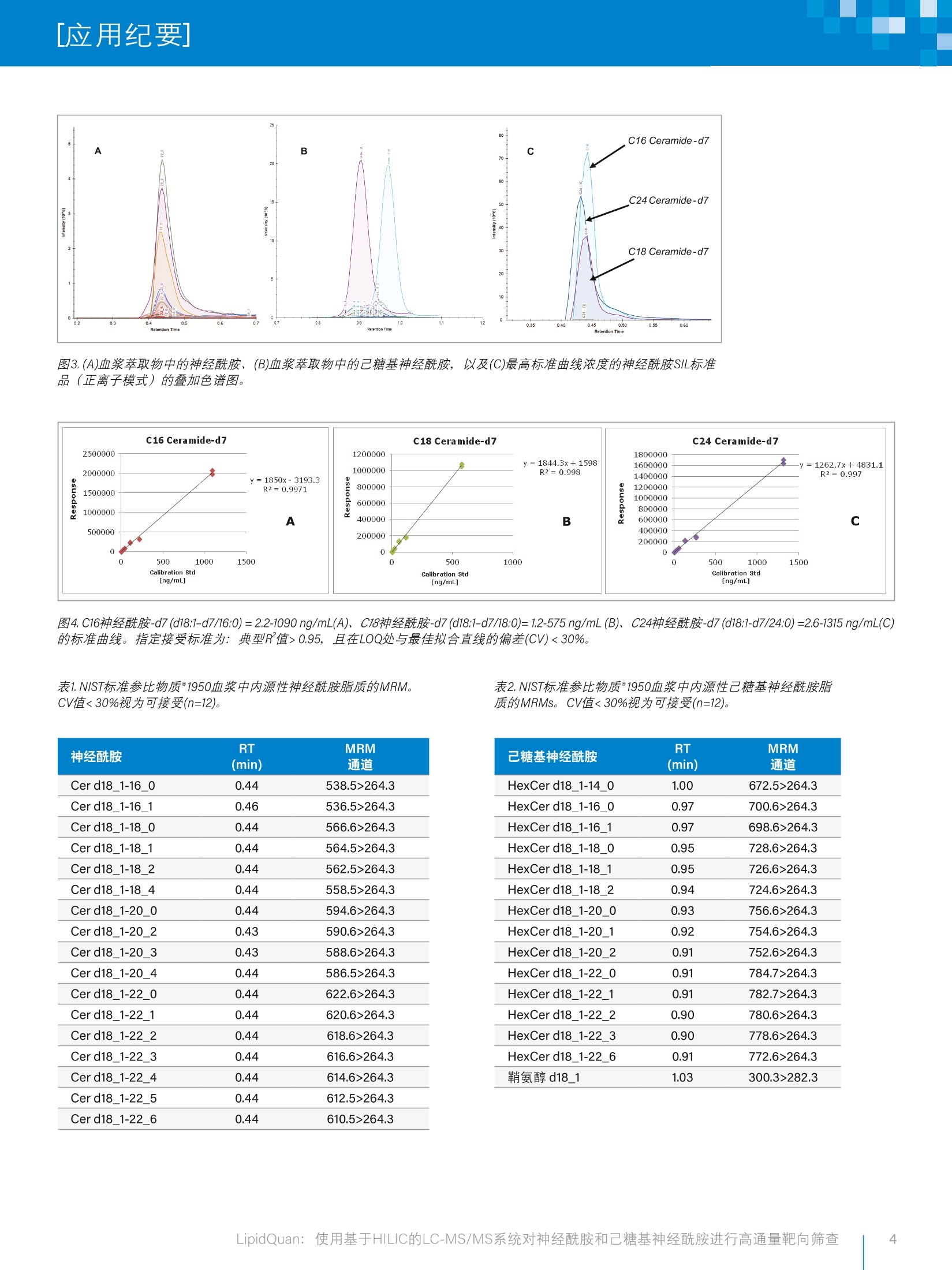
[应用纪要]WatersTHE SCIENCE OF WHAT'S POSSIBLE. [应用纪要] LipidQuan:使用基于HILIC的LC-MS/MS系统对神经酰胺和己糖基神经酰胺进行高通量靶向筛查 应用优势 快速定量血浆和血清中的24种神经酰胺、23种己糖基神经酰胺以及鞘氨醇 使用Quanpedia"和SOP构建性能稳定、便于部署的平台,降低方法开发和培训成本 使用TargetLynx"软件和第三方信息学软件(即Skyline)实现快速数据处理和数据可视化 比同类工作流程更快、更经济 沃特世解决方案 LipidQuan QuanpediaXevo TQ-S micro Xevo TQ-XS XevoTO-S ACQUITYTMUPLCTI-Class系统 BEH Amide色谱柱TargetLynx软件 关键词 神经酰胺、Cer、己糖基神经酰圣、HexCer、鞘氨醇、SPH、脂质组学、靶向、高通量 鞘脂(SLs)是脂质中的一类,包括神经酰胺(Cer)、鞘磷脂(SM)和较为复杂的鞘糖脂。 所有SLs都有一条"长链",也就是鞘氨醇碱基链。这些碱基是鞘氨醇(SPH)等有机脂肪族氨基醇或者结构相似化合物(图1)。这些化合物是细胞膜的重要组成部分,与多种生物功能有关,包括细胞信号转导和细胞凋亡23。SLs在诱导肿瘤细胞增殖、研究化疗耐药机制方面起着关键的作用,另外已有研究发现,帕金森患者体内的神经酰胺(Cer)和己糖基神经酰胺(HexCer)含量偏高。SLs代谢转化快、代谢物种类繁多且功能相似,给单独研究某一种鞘脂的功能带来了很大难度。 图1.鞘脂(SLs)的结构。神经酰胺(Cer)、鞘氨醇1-磷酸盐(S1P)、鞘磷脂(SM)、己糖基神经酰胺(HexCer)。插图为长链碱基(LCB)离子, m/z 264,是SLs产生的典型子离子。 虽然质谱(MS)技术的进步让研究人员得以进行更深入的脂质组学分析,但精准鉴定和定量分析依然比较困难。脂质有大量的同分异构和同量异位物质。此外,MS谱图中通常有多种化合物的峰和和片,要想对特定的分子进行明确鉴定和相对定量,7不仅难度大,而且极为耗时。这严重阻碍了实验室之间的脂质组学数据传递,导致研究人员难以通过多地点研究得出生物学解释。 本研究使用基于亲水作用色谱(HILIC)的方法分离不同类别的脂质,然后使用MS进行检测,从而降低了鉴定结果的不确定性。按照 类别分离不同的脂质还可以减少定量分析所需的稳定同位素标记(SIL)标准品,进而降低成本。本应用纪要介绍了在LipidQuan平台(图2)上运行基于HILIC的方法对Cer、HexCer、SPH进行的靶向筛查。 图2.大多数研究实验室的通用脂质组学工作流程,图中突出显示了LipidQuan工作流程。 实验 样品 向混合的健康人血浆中添加稳定同位素标记(SIL)的SLs(氛代CERAMIDE LIPIDOMIX", Avanti Lipids, 美国亚拉巴马州阿拉巴斯特),制备九个不同浓度的标准品用于绘制定量用标准曲线。分析物的浓度范围如下:C16神经酰胺-d7 (d18:1-d7/16:0)=2.2-1090ng/mL、C18神经酰胺-d7 (d18:1-d7/18:0)=1.2-575 ng/mL、C24神经酰胺-d7 (d18:1-d7/24:0)=2.6-1315 ng/mL、C24:1神经酰胺-d7(d18:1-d7/24:1)=1.3-665 ng/mL。 另外,通过萃取前加标的方式向NIST标准参比物质°1950血浆中 (Sigma Aldrich,英国普尔)添加5%SIL, 制备6个重复样。 样品制备 样品制备方案很简单,使用预冷的异丙醇(IPA)沉淀蛋白(1:5,血浆:IPA)即可。将样品涡旋混合1 min, 在-20℃下放置10 min。接着再将样品涡旋混合1min, 然后在4℃下放置2h,确保蛋白沉淀完全。将萃取的样品在4℃下离心10 min (最大离心力10,300g),然后将上清液转移至玻璃样品瓶,进行LC-MS/MS分析。 离子导入装置偏移2: 0.3V 信息学软件 创建LipidQuan Quanpedia方法文件(1.4版),其中包含LC条件、MS方法以及相关的TargetLynx处理方法(包括保留时间和MRM通道)。使用TargetLynx或Skyline(华盛顿大学MacCoss实验室软件)处理所得数据。 结果与讨论 LipidQuan使用正离子模式MRM对人血浆中的Cer和HexCer类物质进行定性和定量,同时还能分析其它它类,如TG、PC、SM。在HILIC分离条件下, Cer在溶剂前沿洗脱(大约0.4 min处), HexCer和SPH类脂质洗脱为分离的峰(大约0.8-1.1 min处),如图3所示。总共分析了24种Cer、23种HexCer和SPH。得益于该方法的灵敏度,使用50uL血浆可轻松检测出人血浆中正常循环水平的这些脂质,其线性动态范围覆盖4个数量级。此处讨论的Cer和HexCer通质通道使用的是脂质母离子及其特征长链碱基(LCB)子离子(m/z264)(图1)。通道列表见表1和表2。 使用萃取前加标已知浓度SIL标准品的血浆样品制备标准曲线用于定量分析。采用相同条件制备和分析内源性脂质的替代标准品,对同类内源性脂质进行了定量分析。使用市售的预混合SIL溶液而非每种待测脂质的SIL,.,可以显著降低大规模研究的总体成本。SIL标准品C16神经酰胺-d7 (d18:1-d7/16:0)、C18神经酰胺-d7(d18:1-d7/18:0)和C24神经酰胺-d7 (d18:1-d7/24:0)的标准曲线示例如图4所示,可用于定量内源性的Cer和HexCer。使用代CERAMIDE LIPIDOMIXSIL标准品绘制标准曲线时,若典型R²值>0.95,且与最佳拟合直线的偏差(CV)<30%,则视为标准曲线可接受。C24:1神经酰胺-d7 (d18:1-d7/24:1)的标准曲线不符合此标准。 ( 由于事先已开发好LipidQuan Quanpedia方法文件,用户只需下载用于分析Cer和HexCer脂质类别的MRM通道和色谱条件即可,无需手动输入LC-MS方法,因此避免了可能出现的抄录错误。 ) 图3.(A)血浆萃取物中的神经酰胺、(B)血浆萃取物中的己糖基神经酰胺,以及(C)最高标准曲线浓度的神经酰胺SIL标准品(正离子模式)的叠加色谱图。 图4.C16神经酰胺-d7 (d18:1-d7/16:0)=2.2-1090 ng/mL(A)、C18神经酰胺-d7(d18:1-d7/18:0)=1.2-575 ng/mL(B)、C24神经酰胺-d7 (d18:1-d7/24:0)=2.6-1315 ng/mL(C)的标准曲线。指定接受标准为:典型R值>0.95,且在LOQ处与最佳拟合直线的偏差(CV)<30%。 表1.NIST标准参比物质°1950血浆中内源性神经酰胺脂质的MRM。CV值<30%视为可接受(n=12)。 神经酰胺 RT MRM (min) 通道 Cer d18_1-16_0 0.44 538.5>264.3 Cer d18_1-16_1 0.46 536.5>264.3 Cer d18_1-18_0 0.44 566.6>264.3 Cer d18_1-18_1 0.44 564.5>264.3 Cer d18_1-18_2 0.44 562.5>264.3 Cer d18_1-18_4 0.44 558.5>264.3 Cer d18_1-20_0 0.44 594.6>264.3 Cer d18_1-20_2 0.43 590.6>264.3 Cer d181-203 0.43 588.6>264.3 Cer d18_1-20_4 0.44 586.5>264.3 Cerd18_1-22_0 0.44 622.6>264.3 Cer d18_1-22_1 0.44 620.6>264.3 Cer d18_1-22_2 0.44 618.6>264.3 Cer d18_1-22_3 0.44 616.6>264.3 Cer d18_1-22_4 0.44 614.6>264.3 Cer d18_1-22_5 0.44 612.5>264.3 Cer d18_1-22_6 0.44 610.5>264.3 表2.NIST标准参比物质°1950血浆中内源性己糖基神经酰胺脂质的MRMs。CV值<30%视为可接受(n=12)。 己糖基神经酰胺 RT MRM (min) 通道 HexCer d18_1-14_0 1.00 672.5>264.3 HexCer d18_1-16_0 0.97 700.6>264.3 HexCer d18_1-16_1 0.97 698.6>264.3 HexCer d18_1-18_0 0.95 728.6>264.3 HexCer d18_1-18_1 0.95 726.6>264.3 HexCer d18_1-18_2 0.94 724.6>264.3 HexCer d18_1-20_0 0.93 756.6>264.3 HexCer d18_1-20_1 0.92 754.6>264.3 HexCer d18_1-20_2 0.91 752.6>264.3 HexCer d18_1-22_0 0.91 784.7>264.3 HexCer d18_1-22_1 0.91 782.7>264.3 HexCer d18_1-22_2 0.90 780.6>264.3 HexCer d18_1-22_3 0.90 778.6>264.3 HexCer d18_1-22_6 0.91 772.6>264.3 鞘氨醇 d18_1 1.03 300.3>282.3 ( 结论 ) 本研究开发了一种能够快速分析血浆和血清中的SLs及其它脂质的半定量方法。 该方法可在8 min内分析24种神经先胺、23种己糖基神经酰胺以及鞘氨醇。 该方法在四个数量级内呈线性,并且具有足够的灵敏度, 可分析人血浆中的内源性脂质。 由于使用HILIC进行色谱分离, 不同脂质根据其类别洗脱,减少了潜在的同分异构/同量异位物质干扰,也减少了定量分析所需的稳定同位素标记标准品,分析成本得以降低。 仅供研究使用。不适用于诊断。 THE SCIENCE OF WHAT'S POSSIBLE. ( 1. M errill,A. H . (2011).Sphingolipid andGlycosphingolipid Metabolic Pathways in t he Eraof Sphingolipidomics. Chemical Reviews, 111(10), 6387-6422. h t t p : / / doi .o r g/1 0. 1 021 / cr 20 02917 ) ( B ieberich,E.(2008). Ceramide Signaling in Cancerand Stem Cells. Future Lipidol., 3 (3),273-300. h t tp s ://www .nc bi . n l m . n ih. g ov/ pmc /a r ticles/ P MC24 9 3 052/ ) ( 3. K 1 osinska, M . K., Liebisch, G., Lochnit, G., Wilhelm, J., Klein, H., Kaesser, U ., Lasczkoski, G., R i ckert, M.,Schmitz, G., and Steinmeyer, J.(2014). Sphingolipids i n Human Synovial Fluid -A Lipidomic Study,PLoS ONE 9(3).ht t p : / / d oi .o r g/10 . 1371/j ou rnal. pone.009 1 769 ) ( 4. Ogretmen,B.(2017).Sphingolipid Metabolism inCancer Signalling and Therapy, Nature ReviewsCancer volume 18, pages 33-50 (2018). h t tps: / / www. na t u r e .c om / articles/nrc . 2017 . 96 ) 5. Mielke, M. M., Maetzler, W., Haughey,N. J., Bandaru,V.V. R., Savica,R.,Deuschle, C., Gasser,T., Hauser,A-K.,Graber-Sultan, S., Schleicher,E., Berg, D., andLiepelt-Scarfone, l. (2013). Plasma Ceramide andGlucosylceramide Metabolism Is Altered in SporadicParkinson’s Disease and Associated with CognitiveImpairment: A Pilot Study. PLoS ONE, 8(9),1-6.http://doi.org/10.1371/journal.pone.0073094 ( 6. Cifkova,E.,Holcapek, M ., L isa, M .,Ovcacikova,M., Lycka, A.,L y nen, F. , and Sandra, P. (2012).Nontargeted Quantitation of Lipid Classes UsingHydrophilic Interaction Liquid Chromatography-Electrospray lonization Mass Spectrometry withSingle Internal Standard and Response FactorApproach.A n alytical Chemistry,84(22), 10064-10070.h t t p ://d oi .o r g/ 10 .1 0 21/a c 3 024 476 ) 7. Pulfer, M., and Murphy, R. C.(2003).ElectrosprayMass Spectrometry ofPhospholipids.MassSpectrometry Reviews,22(5),332-64.http://doi.org/10.1002/mas.10061 8.6.MDunjoma, N., Isaac, G., Gethings, L., and Plumb, R.,(2018). LipidQuan: HILIC-based LC-MS/MSHigh-Throughput Targeted Phospholipids Screen(PC,LPC,SM).沃特世应用纪要,720006452EN,2019。 扫一扫,关注沃特世微信沃特斯中国有限公司 沃特世科技(上海)有限公司 北京:010-5209 3866 上海:021-61562666 广州:020-28296555 香港:852-29641800 免费售后服务热线:800(400) 820 2676 LipidQuan:使用基于HILIC的LC-MS/MS系统对神经酰胺和己糖基神经酰胺进行高通量靶向筛查 简介鞘脂(SLs)是脂质中的一类,包括神经酰胺(Cer)、鞘磷脂(SM)和较为复杂的 鞘糖脂。所有SLs都有一条“长链”,也就是鞘氨醇碱基链1。这些碱基是鞘氨醇(SPH)等 有机脂肪族氨基醇或者结构相似化合物(图1)。这些化合物是细胞膜的重要组成部分,与多种生物功能有关,包括细胞信号转导和细胞凋亡2,3。SLs在诱 导肿瘤细胞增殖、研究化疗耐药机制方面起着关键的作用4,另外已有研究发现,帕金森患者体内的神经酰胺(Cer)和己糖基神经酰胺(HexCer)含量偏高5。 SLs代谢转化快、代谢物种类繁多且功能相似,给单独研究某一种鞘脂的功能带来了很大难度。
确定




还剩3页未读,是否继续阅读?
沃特世科技(上海)有限公司(Waters)为您提供《Cer d18_1-20_4中高通量靶向筛查检测方案(液质联用仪)》,该方案主要用于全血/血清/血浆中高通量靶向筛查检测,参考标准--,《Cer d18_1-20_4中高通量靶向筛查检测方案(液质联用仪)》用到的仪器有Waters Xevo TQ-S micro 三重四极杆质谱
推荐专场
相关方案
更多
该厂商其他方案
更多















