方案详情
文
采用胶束电动力学毛细管电泳,在25 mmol/L Na2HPO4 -NaH2PO4(pH7.0),40 mmol/L 十二烷基硫酸钠和3 mol/L 尿素的实验条件下,在28 min 内实现了牡蛎中8 种游离丹酰化氨基酸的分离和测定。在一定浓度范围内,氨基酸的峰面积与其浓度呈良好的线性关系,相关系数0. 9955 ~ 0. 9984 之间。对于8种氨基酸,标准加入回收率在99.5% ~ 100.7%之间。
方案详情

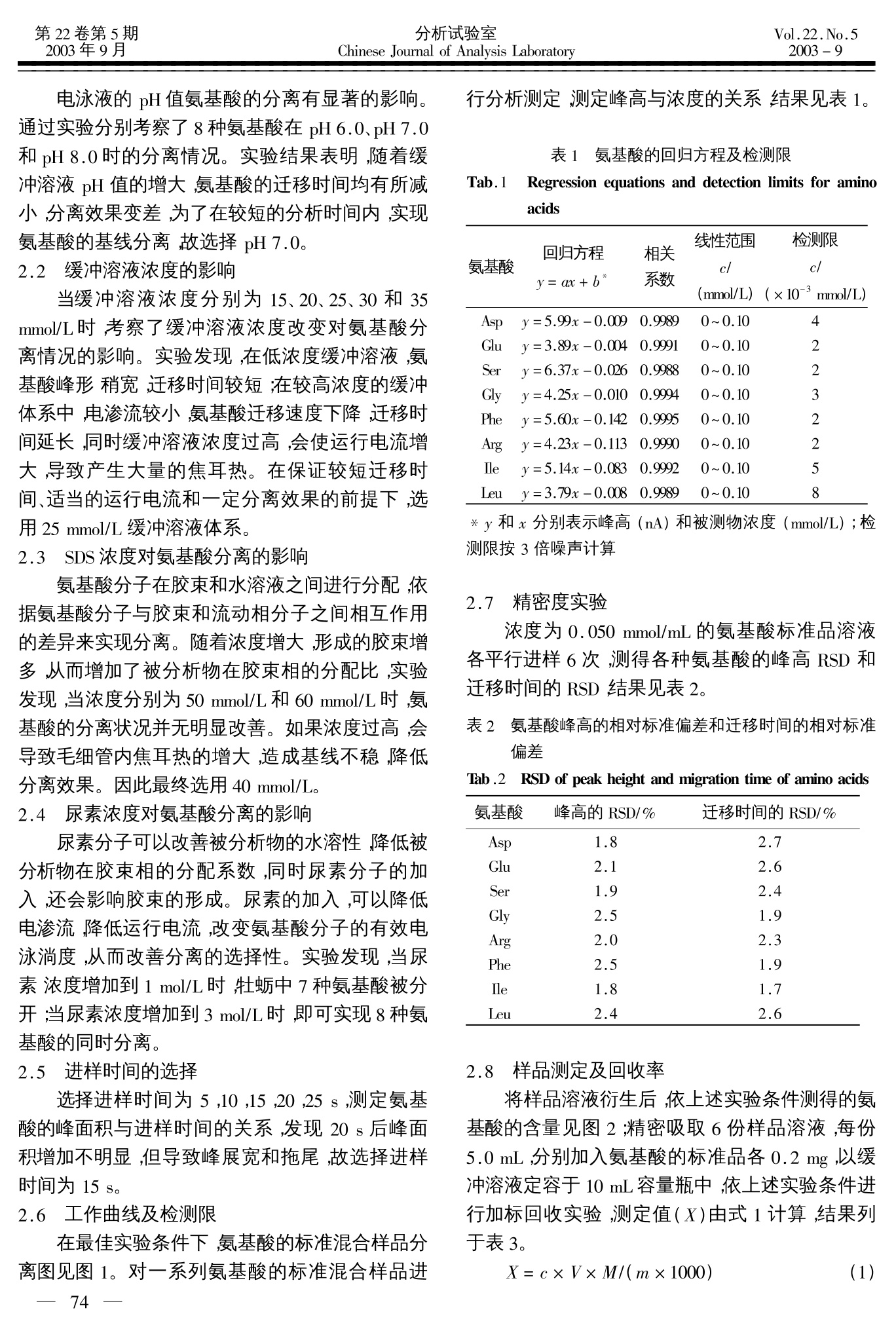
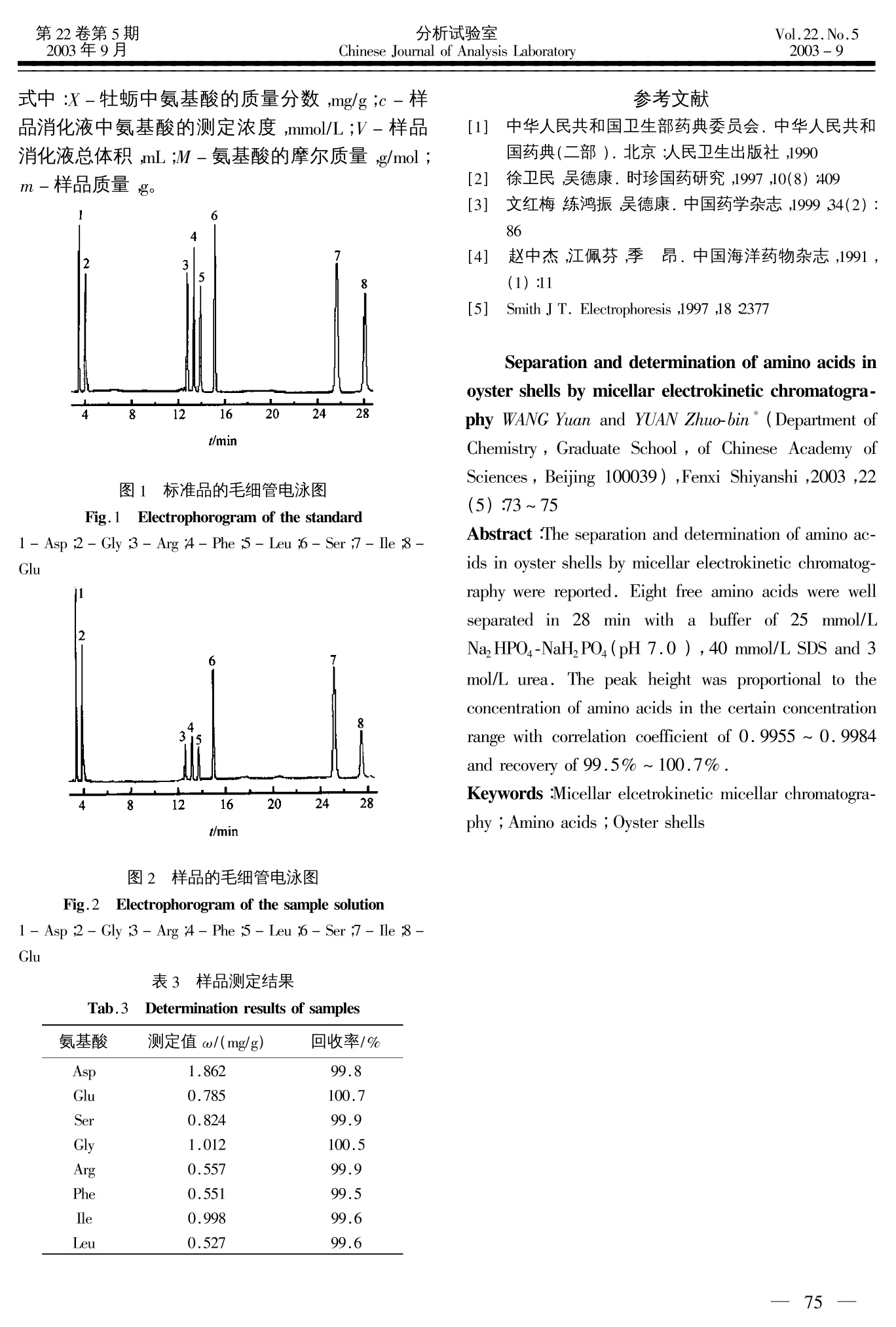
分析试验室Chinese Journal of Analysis Laboratory第22卷第5期2003年9月Vol.22.No.52003-9 胶束电动力学毛细管电泳分离和测定牡蛎中的氨基酸 王 媛,袁倬斌* (中国科学院研究生院,北京100039) 摘 要:采用胶束电动力学毛细管电泳,在25 mmol/L NaHPO-NaH,PO4(pH7.0), 40 mmol/L 十二烷基硫酸钠和 3 mol/L 尿素的实验条件下,在28 min 内实现了牡蛎中8种游离丹酰化氨基酸的分离和测定。在一定浓度范围内,氨基酸的峰面积与其浓度呈良好的线性关系,相关系数 0.9955~0.9984之间。对于8种氨基酸,标准加入回收率在99.5%~100.7%之间。 关键词:毛细管电泳;氨基酸;牡蛎 中图分类号:0657.8 文献标识码:A 文章编号:1000-0720(2003)05-0073-03 牡蛎是一种传统中药材,壳与肉均可药用,《本草纲目》中早有记载。牡蛎壳中含有丰富的氨基酸,可测定的方法很多,其中用氨基酸测定仪较多[2~4]。近年来,毛细管电泳法分离和测定氨基酸的技术得到了很大的发展5],与氨基酸分析仪相比,毛细管电泳法具有快速灵敏、用量少、不需要专用仪器等特点。本文采用胶束电动力学毛细管电泳分离和测定了牡蛎壳中的8种氨基酸。 1实验部分 1.1 仪器与试剂 ACS-2000毛细管电泳仪(中国科学院研究生院应用化学研究所);8823-B紫外检测器(北京新技术研究所);检测波长254 nm;未涂层弹性石英毛细管柱(直径50 um,总长度75 cm,有效长度55cm,河北永年光导纤维厂);pHS-3 型酸度计(上海雷磁仪器厂)。 氨基酸标准品(生化试剂);丹酰氯(Sigma 公司);牡蛎壳(同仁堂);其它试剂均为分析纯;水为二次蒸馏水。 1.2 标准溶液的制备 准确称取8种氨基酸标准品于25 mL容量瓶中,分别用40 mmol/L Li,CO (pH 9.5)缓冲液溶解, 使浓度分别为 0.050 mmol/L,以0.45 um 滤膜过滤后备用。 1.3 样品溶液的置备 将样品洗净,晾干,粉碎,过筛,准确称取0.1 g至球形瓶中,加入浓盐酸10 mL,于110℃恒温水解24h,取出转移至25 mL 容量瓶中定容,过滤即得样品溶液。 1.4 衍生 在2mL样品溶液和标准品溶液中,加入1.5mg/mL丹酰氯乙腈溶液1 mL,混合均匀,避光,放置35 min,然后加入100 uL 乙胺溶液(2%)终止反应,即可上机测定。 .5实验条件的选择 以25mmol/L Na,HPO-NaH,PO缓冲溶液(pH7.0),40 mmol/L SDS 和3 mol/L 尿素为电泳介质,未涂层弹性石英毛细管。所用溶液使用前均用0.45 um 滤膜过滤,每次实验后依次用 0.01 mol/LNaOH 溶液、蒸馏水及电泳缓冲溶液清洗毛细管10min 然后进行分离测定,实验过程采用电动进样,实验温度为室温,峰高定量。 2 结果与讨论 2.1 缓冲溶液 pH的影响 ( 米 收稿日期:2002-02-04;修订日期:2002-04-29 ) ( 基金项目:国家“九五”重点科技攻关项目(96-23-01-06);国家自然科学基金(29875027;20175025)和电分析化学国家实验室基金资助课题 ) ( 作者简介:王 媛(1978-),女,硕士研究生 ) 电泳液的 pH 值氨基酸的分离有显著的影响。通过实验分别考察了8种氨基酸在 pH 6.0、pH7.0和pH8.0的的分离情况。实验结果表明,随着缓冲溶液 pH 值的增大,氨基酸的迁移时间均有所减小,分离效果变差,为了在较短的分析时间内,实现氨基酸的基线分离,故选择 pH 7.0。 2.2 缓冲溶液浓度的影响 当缓冲溶液浓度分别为15、20、25、30和35mmol/L时,考察了缓冲溶液浓度改变对氨基酸分离情况的影响。实验发现,在低浓度缓冲溶液,氨基酸峰形稍宽,迁移时间较短;在较高浓度的缓冲体系中,电渗流较小,氨基酸迁移速度下降,迁移时间延长,同时缓冲溶液浓度过高,会使运行电流增大,导致产生大量的焦耳热。在保证较短迁移时间、适当的运行电流和一定分离效果的前提下,选用25 mmol/L 缓冲溶液体系。 2.3SDS 浓度对氨基酸分离的影响 氨基酸分子在胶束和水溶液之间进行分配,依据氨基酸分子与胶束和流动相分子之间相互作用的差异来实现分离。随着浓度增大,形成的胶束增多,从而增加了被分析物在胶束相的分配比,实验发现,当浓度分别为50 mmol/L 和60 mmol/L时,氨基酸的分离状况并无明显改善。如果浓度过高,会导致毛细管内焦耳热的增大,造成基线不稳,降低分离效果。因此最终选用 40 mmol/L。 2.4 尿素浓度对氨基酸分离的影响 尿素分子可以改善被分析物的水溶性,降低被分析物在胶束相的分配系数,同时尿素分子的加入,还会影响胶束的形成。尿素的加入,可以降低电渗流,降低运行电流,改变氨基酸分子的有效电泳淌度,从而改善分离的选择性。实验发现,当尿素浓度增加到1 mol/L时,牡蛎中7种氨基酸被分开;当尿素浓度增加到3 mol/L时,即可实现8种氨基酸的同时分离。 2.5 进样时间的选择 选择进样时间为5,10,15,20,25s,测定氨基酸的峰面积与进样时间的关系,发现20s后峰面积增加不明显,但导致峰展宽和拖尾,故选择进样时间为 15 s。 2.6 工作曲线及检测限 在最佳实验条件下,氨基酸的标准混合样品分离图见图1。对一系列氨基酸的标准混合样品进 行分析测定,测定峰高与浓度的关系,结果见表1。 表1 氨基酸的回归方程及检测限 Tab. 1 Regression equations and detection limits for aminoacids 回归方程 相关 线性范围 检测限 c/ c/ (mmol/L) (x10-3mmol/L) 氨基酸 y=ax+b 系数 y=5.99x-0.009 00.9989 0~0.10 4 y=3.89x-0.004 4 0.9991 0~0.10 2 y=6.37x-0.026 6 0.9988 0~0.10 y=4.25x-0.010 0.9994 0~0.10 y=5.60x-0.142 0.9995 0~0.10 y=4.23x-0.113 0.9990 0~0.10 y=5.14x-0.083 0.9992 0~0.10 5 Leu y=3.79x-0.008 0.9989 0~0.10 8 *y和x分别表示峰高(nA)和被测物浓度(mmol/L);检测限按3倍噪声计算 2.7 精密度实验 浓度为0.050 mmol/mL的氨基酸标准品溶液各平行进样6次,测得各种氨基酸的峰高 RSD 和迁移时间的 RSD,结果见表2。 表2 氨基酸峰高的相对标准偏差和迁移时间的相对标准偏差 Tab .2RSD of peak height and migration time of amino acids 氨基酸 峰高的 RSD/% 移时间的 RSD/% Asp 1.8 2.7 Glu 2.1 2.6 1.9 2.4 2.5 1.9 2.0 2.3 Phe 2.5 1.9 lle 1.8 1.7 Leu 2.4 2.6 2.8 样品测定及回收率 将样品溶液衍生后,依上述实验条件测得的氨基酸的含量见图2;精密吸取6份样品溶液,每份5.0mL,分别加入氨基酸的标准品各0.2 mg,以缓冲溶液定容于 10 mL 容量瓶中,依上述实验条件进行加标回收实验,测定值(X)由式1计算,结果列于表3。 式中:X-牡蛎中氨基酸的质量分数,mg/g;c -样品消化液中氨基酸的测定浓度, mmol/L;V-样品消化液总体积,mL;M-氨基酸的摩尔质量, g/mol;m-样品质量,g. 图1 标准品的毛细管电泳图 Fig.1 Electrophorogram of the standard 1- Asp;2- Gly;3- Arg;4- Phe;5-Leu;6- Ser;7-Ile;8-Glu t/min 图 2样品的毛细管电泳图 Fig.2Electrophorogram of the sample solution 1-Asp;2-Gly;3- Arg;4-Phe;5-Leu;6-Ser;7- Ile;8-Glu 表3 样品测定结果 Tab.3 Determination results of samples 氨基酸 测定值w/(mg/g) 回收率/% Asp 1.862 99.8 Glu 0.785 100.7 Ser 0.824 99.9 Gly 1.012 100.5 Arg 0.557 99.9 Phe 0.551 99.5 lle 0.998 99.6 Leu 0.527 99.6 ( 参考文献 ) ( [1] 中华人民共和国卫生部药典委员会.中华人民共和国药典(二部).北京:人民卫生出版社,1990 ) ( 徐卫民,吴德康.时珍国药研究,1997,10(8):409 ) ( 文红梅,练鸿振,吴德康.中国药学杂志,1999,34(2): 86 ) ( [4] 赵中杰,江佩芬,季 昂.中国海洋药物杂志,1991, (1):11 ) ( [5] Smith J T . Electrophoresis,1997,18:2377 ) Separation and determination of amino acids inoyster shells by micellar electrokinetic chromatogra-phy WANG Yuan and YUAN Zhuo-bin*(Department ofChemistry, Graduate School, of Chinese Academy ofSciences, Beijing 100039), Fenxi Shiyanshi, 2003, 22(5):73~75 Abstract: The separation and determination of amino ac-ids in oyster shells by micellar electrokinetic chromatog-raphy were reported. Eight free amino acids were wellseparated in 28minwithabuffer of 25mmol/LNa,HPO4-NaH, PO4(pH 7.0), 40 mmol/L SDS and 3mol/L urea. The peak height was proportional to theconcentration of amino acids in the certain concentrationrange with correlation coefficient of 0.9955 ~0.9984and recovery of 99.5%~100.7%. Keywords:Micellar elcetrokinetic micellar chromatogra-phy; Amino acids; Oyster shells _ —
确定

还剩1页未读,是否继续阅读?
北京华阳利民仪器有限公司为您提供《牡蛎中氨基酸检测方案(毛细管电泳仪)》,该方案主要用于水产品中营养成分检测,参考标准--,《牡蛎中氨基酸检测方案(毛细管电泳仪)》用到的仪器有高效毛细管电泳仪(紫外检测)CL1030
推荐专场
相关方案
更多
该厂商其他方案
更多