方案详情
文
摘要:综述了高效毛细管电泳技术在农药分离方面的应用及发展状况,包括各种不同分离模式和手性选择剂的选择,另外还指出了该方法的优点及其发展方向。参考文献50 篇。
方案详情

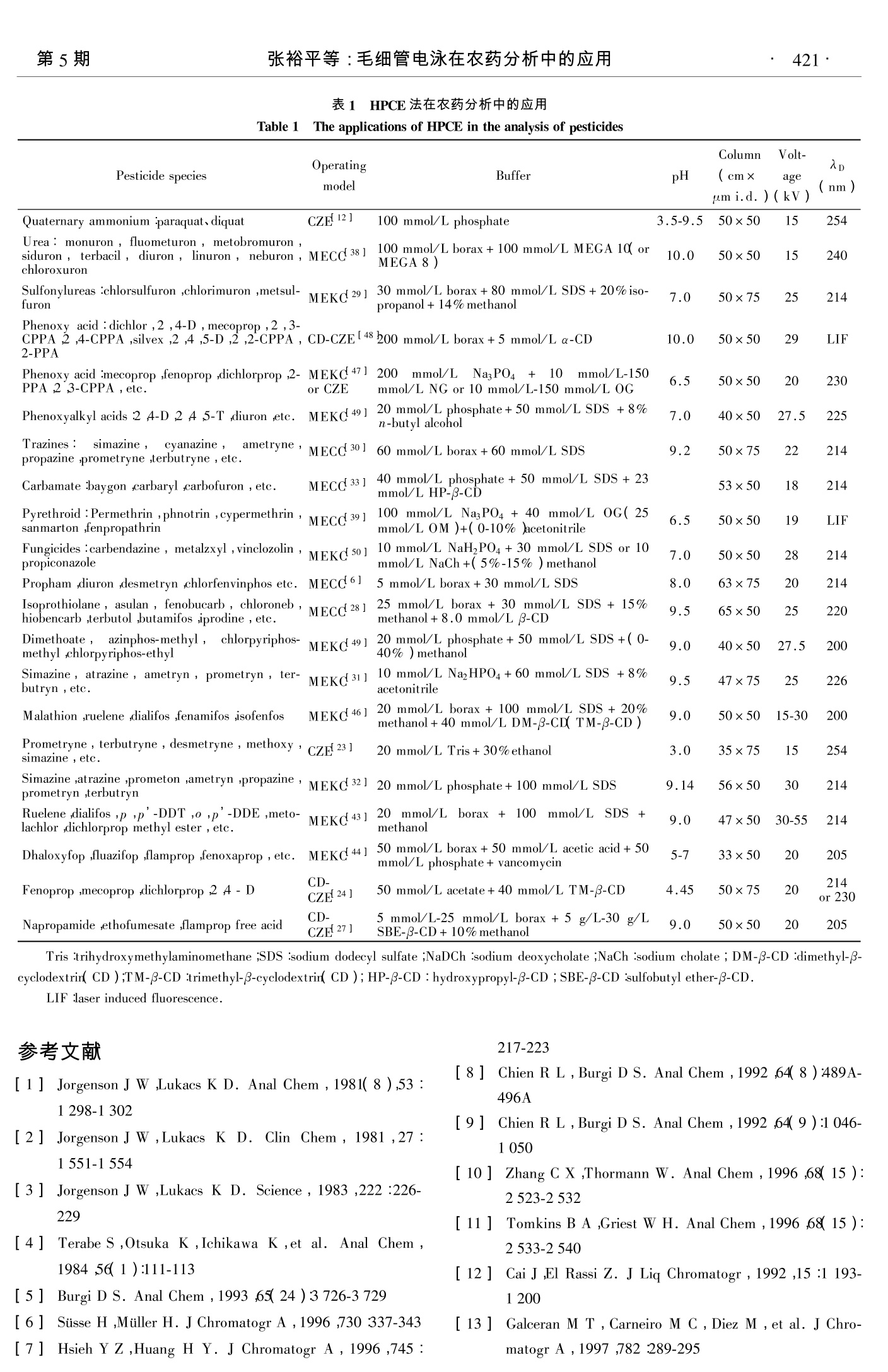
第19卷第5期2001年9月Vol.19 No.5Sept. 2001色 谱CHINESE JOURNAL OF CHROMATOGRAPHY 色 谱第19卷·418· 毛细管电泳在农药分析中的应用 张裕平, 袁倬斌 (中国科学技术大学研究生院,北京100039) 摘要:综述了高效毛细管电泳技术在农药分离方面的应用及发展状况,包括各种不同分离模式和手性选择剂的选择,另外还指出了该方法的优点及其发展方向。参考文献 50篇。 关键词:毛细管电泳;分离模式;农药 中图分类号:0658 文献标识码:A 文章编号:1000-8713(2001)05-0417-06 1 前言 毛细管电泳(capillary electrophoresis, CE)技术是一种高效、快速的新型分离技术。1981年Jorgenson和 Lukacs-1~3]首先创立了现代毛细管电泳。1984年, Terabe 等41提出了以被分析组分在毛细管内的胶束和缓冲溶液之间的分配为基础的胶束电动毛细管色谱(MECC或 MEKC),使得中性物质的测定成为可能。1988~1989年出现了第一批毛细管电泳商品仪器。由于它可以分离从离子到中性分子、从小分子到生物大分子的一系列化合物,尤其符合以生物工程为代表的生命科学领域内多肽、蛋白质、DNA的分离分析及环境实际样品分析的要求,因此近几年来得到了迅猛的发展。虽然毛细管电泳技术用于农药分析起步较晚,但作为一种高效分离技术,CE在这一领域已显示出极大的潜力。近年来,国外毛细管电泳技术用于农药分析的报道逐年增多L5~11],而国内还未有系统的研究。本文综述了近年来毛细管电泳在农药分析中的应用情况,并对其前景作了展望。 2 毛细管区带电泳(CZE) 农药按防治对象不同可分为除草剂、杀虫剂、杀菌剂,从其结构上讲又可分为手性和非手性农药。由于它是由结构差异很大的有机化合物组成,其中很多还是几何、光学异构体或对映体,在水中的极性、溶解度、离子化程度各不同,因此其分离模式就有一定的差别。可采用毛细管区带电泳分离的农药主要是在水溶液中呈离子态存在的或可离子化的化合物,其分离原理主要是基于它们在形状或者是质荷比上的差异。 Cai 和 El Rassil12]在分离两种阳离子型(季铵离子)除草剂时发现,尽管对草快(paraquat)、敌草快(diguat)两者质荷比接近,但分子形状有差异,因此,可以在pH 3.5~9.5的范围内得到分离,其理论塔板数可达2×10/m~3×10/m 之间,由此可见CZE的潜力。在此基础上, Galceran 等[13]也采用毛细管区带电泳间接紫外检测法测定了包括对草快和敌草快在内的5种季铵类除草剂。后来, Lazer 和Lee-14]将飞行时间质谱与毛细管电泳仪联用(TOF-MS),采用样品堆积技术进样对这两种农药进行分离研究,检测限可提高到10-17mol/L。 Kaminasky等[15]也从事过同类工作,实验分离了3种季铵盐除草剂,因为采用的是激光诱导荧光检测器,所以大大地提高了检测灵敏度。 三嗪(均三氮苯类)作为一种除草剂,它的氮芳环在水溶液中能够质子化,产生相应的离子,Schmitt 等[16]曾在 11 min 内分离了 19种不同取代基的三嗪,并且讨论了缓冲溶液的 pH 对不同取代基三嗪(一Cl,一OH,-OCH3,SCH3)分离的影响,当缓冲溶液的 pH在被分离物的(pKa-2)~pK范围内,除氯三嗪外,其他几种作为阳离子的三嗪均可获得良好的分离,迁移时间与分子的相对分子质量有关。另外,作为阳离子的氯三嗪的降解物可在 pH8左右测定,大多数三嗪的检测限为0.05mg/L. 苯氧羧酸类除草剂因其均含有羧酸基团,因此也可以采用毛细管区带电泳法进行分离测定。Garrison等L17]用该法在15 min 内分离了4种苯氧羧酸类除草剂(2,4,5涕丙酸、2甲4氯丙酸、2,4滴丙酸及2,4-滴,其中前3种农药具有光活性)。 许多磺酰脲类农药呈酸性, Garcia 等L18]将电细 ( 收稿日期:2000-12-27 ) ( 基金项目:国家自然科学基金课题(29875027),中国科学院长春应用化学研究所开放实验室基金课题 ) ( 作者简介:张裕平(1969-),男,博士研究生,电话:(010)68240247,E-mail: yupzhang@263.net. ) ( 通讯联系人:袁倬斌,男,教授,博士生导师,电话:(010)68224596。 ) 管电泳和质谱联用,建立了测定磺酰脲类农药的方法,其中的8个弱酸性组分在5 min 中内就得到了分离。另外,利用在线的串列式质谱(CE-MS-MS)方式可以得出30 pmol 的这些化合物的全扫描诱导碰撞质谱图19]。 有机锡类农药常用作杀虫剂、杀菌剂和生物杀伤剂,大多数此类农药都缺少荧光活性或发色团,一般需要在缓冲溶液中加入增强紫外吸收背景的物质。Whang 等L20]采用在5 mmol/L 的乙酸盐溶液中加入3 mmol/L 氨基吡啶的间接紫外检测法测定了多种有机锡类农药。 在毛细管区带电泳过程中,有机溶剂常用作广泛的添加剂。在分离三嗪除草剂时,就有采用非水溶液毛细管电泳的报道[21];在水溶液中分离困难的氯三嗪类农药,采用在10 mmol/L 高氯酸缓冲溶液中分别加入乙腈、甲醇或两者的混合溶液后就可以得到良好的分离。2,4-滴和2甲4氯丙酸是常用的两种苯氧羧酸类除草剂,两者的差异只是苯环上的一个取代基不同,但在含50%乙腈的磷酸-硼砂缓冲溶液中,15 min 内即可得到基线分离L22]。 西玛津和阿特拉津属于三嗪类除草剂,两者在水中的溶解度很低,在萃取时或者标准品溶溶水-乙醇介质的过程中,在室温下即会发生溶剂取代反应。Foret等L23.认为将样品溶解在 pH 3的水溶液或水-甲醇介质中可抑制取代反应,另外在 20 mmol/L的三羟基甲基氨基甲烷中,加入一定量的乙醇可以分离测定其混合物及其取代反应产物。 由此可见,在农药的分离过程中,毛细管区带电泳应用广泛,适合于在水溶液中以离子态存在或可离子化的化合物。 3 环糊精改性的毛细管区带电泳(CD-CZE) 环糊精(CD)改性的毛细管区带电泳已经成功地应用到农药的异构体和对映体的分离过程中。其分离机理是基于被分离的物质能和 CD形成稳定的包合物,而且形成包合物的作用力有一定差异。环糊精是由D-吡喃型葡萄糖基通过α-(1-4)糖苷形成的聚糖,常用作拆分试剂的有 α,B,Y-CD 及其衍生物,它们结构相似,均有疏水空腔,但大小不一,能选择性地包结多种客体分子形成包合物。 Farran 等L22]在分离2,4-滴和2甲4氯丙酸时就采用了 α-CD、B-CD 及Y-CD,研究发现在缓冲溶液中添加 α-CD时,2,4-滴先于2甲4氯丙酸流出;添加 B-CD 时,其流出顺序刚好相反。这是因为α-CD 与 B-CD 内腔大小不一,从而导致与分离物分子结合紧密程度不同,其电泳速率也产生了很大的差 异。添加y-CD时,两者不能分离,这是因为与分离物相比,Y-CD 内腔太大,不能形成稳定的包合物。 Penmetsa 等[24]分别考察了用二甲基-B-CD(DM-B-CD),三甲基-J-CD(TM-B-CD)和羟丙基-y-CD(HP-B-CD)分离3种常用苯氧羧酸类除草剂灭草喹、氯甲草和咪草酯的对映体以及异构体的情况,这3种除草剂可一次性同时分离。研究过程中考察了一些重要参数如缓冲溶液 pH 值、CD 类型和 CD浓度对分离的影响。这是第1篇采用毛细管区带电泳分离灭草喹、氯甲草和咪草酯异构体的报道。 Garrison 等L171在分离2,4-滴和其他3种光活性的苯氧羧酸除草剂2,4,5涕丙酸、2甲4氯丙酸和2,4滴丙酸时,曾将毛细管区带电泳和环糊精改性的毛细管区带电泳作过对比,结果表明 CZE 可分离这4种除草剂,但只有采用 CD-CZE 才能分离3种光活性的苯氧羧酸除草剂的对映体。在醋酸盐缓冲液中添加一定量的25 mmol/L TM-B-CD,只能分离其中一种光活性的苯氧羧酸除草剂对映体,DM-B-CD 或 α-CD可分离2,4-涕丙酸和2甲4氯丙酸的对映体,但不能分离2,4,5涕丙酸的对体,另外当采用 B-CD作选择子时,分离较困难,用y-CD根本不能分离其对映体。添加甲醇可改善分离但使分离时间加倍。计算外消旋物和对映体迁移时间,可得其相对标准偏差在1.3%~4.6%,峰面积和峰高的相对标准偏差在1.6%~17.9%。 Nielen 等L25J也作过类似工作,作者采用 CZE和 CD-CZE 两种方离模式详细考察了6种苯氧羧酸除草剂的分离,结果亦证明在缓冲溶液中加入环糊精(α-CD或DM-B-CD)改性后,其分离的选择性更广。另外,还有人采用柱前衍生、在硼砂溶液中添加TM-B-CD 和 B-CD 作选择子,以及采用激光诱导荧光检测法分离9种苯氧羧酸除草剂[26]。 Desiderio 等L271用毛细管区带电泳法对9种手性除草剂对映体的分离进行了考察,研究发现,带负电的硫代丁基醚-3-环糊精(SBE-B-CD)作为选择子是最有效的,质量浓度为5 g/L 的 SBE-B-CD 足以分离草萘胺和唑啶草的对映体。 由此可见,采用环糊精改性扩大了毛细管区带电泳的分离对象,使得一些不能分离或分离困难的农药,特别是异构体和对映体的分析测定成为现实。根据分离对象不同,选择不同类型的环糊精往往是分离成功的关键。 4 胶束毛细管电泳 4.1 阴离子表面活性剂的胶束毛细管电泳 胶束毛细管电泳的最大特点是使毛细管电泳在 用于离子型化合物分离的同时可进行中性物质的分离,其分离机理为具有不同疏水性的粒子与胶束的相互作用不同。在毛细管电泳的农药分析过程中,MECC 是一种最常用的操作模式。 He 等28]采用正交设计(OADs)法优化分离了复杂环境样品中的农药。利用正交设计法考察了环糊精的类型及浓度、表面活性剂十二烷基磺酸钠(SDS)的浓度、硼砂的浓度、pH及有机添加剂的浓度等6个影响因素,初次实验采用6个因素2个水平,得出单个因素对响应的贡献之后,再采用 OAg(34)正交矩阵(9次实验,4个因素,3个水平)对3个最重要的影响因素作进一步的设计,在30 min 内分离了15种不同类别的农药(三嗪、苯氧羧酸类除草剂、有机磷、氨基甲酸酯等)。 Dinelli 等L29]用重叠分辨图法对 MECC 分离过程进行了优化研究,选定了分离测定的最佳实验条件。实验同样采用 SDS 胶束体系,3种磺酰脲类除草剂得到了定量测定,研究表明通过适当的方法如固相萃取(SPE)富集样品, CE可测定土壤中残留的ug/L级的多种农药。 Carabias-Martinez等L30]采用 SPE 对环境水样萃取预浓缩, MECC 法测定了低至0.2 pg/L的7种三嗪类农药,并对缓冲溶液的浓度、pH、进样条件、表面活性剂浓度、电压进行了优化。对 0.5 ug/L 的样品重复测定6次,其相对标准偏差为11%~23%,回收率为79%~130%。Hinsmann 等L31J通过自动在线浓缩样品,减少了人工处理的繁琐,采用Cig的固相微柱可将水样中的农药浓缩12倍。以SDS作胶束,添加少量的乙腈,可在13 min 内分离测定水中的7种不同种类的农药。 Leinweber等L321分离了7种三嗪类农药,考察了缓冲溶液的浓度、温度、乙腈、SDS浓度以及电压对峰高、塔板数、峰容量的影响。同时还对高效液相色谱(HPLC)、MECC 两种方法进行对比,分离了苯氧羧酸类、三嗪、有机磷、氨基甲酸酯类农药的混合物,通过萃取或改变 MECC 的进样方式可大大提高检测的灵敏度。 Wu 和 Lee 等L33]在磷酸盐缓冲溶液中加入SDS,对 15种氨基甲酸酯类农药进行了分离研究,其中的13种农药可达基线分离;当在缓冲溶液中加入4 mol/L尿素后,结构和水溶性相近而难以分离的克百威和噁虫威得到了分离,同时发现有几种农药的峰序发生了变化;实验还考察了用4种环糊精(α,B,y-CD 及 HP-B-CD)分离时的情况,结果表明只有 HP-B-CD 才能使这 15种氨基甲酸酯类农药获得基线分离。 SDS 胶束体系用于分离有机氮农药也很有效。利用在偏碱性的缓冲溶液中,含氮官能团不会质子化这一特点, He 和 Lee 34]分离了包括三唑酮、除草定、特草定等在内的6种有机氮农药。若采用场堆积技术进样,分析检测限可达10-12 mol/L。 在 MECC 中,采用胆汁盐和离子聚合物胶束体系常常是一种有效的方法。 Aguilar 等L35]以两种有机磷农药(甲基毒死蜱、乙基毒死蜱)为对象,考察了4种表面活性剂(SDS、胆酸钠、脱氧胆酸钠、离子聚合物 Elvacite 2669)对分离的影响,结果表明:采用SDS胶束体系,两者的分离相当困难,它们与胶束结合在一起流出;而用胆汁盐或 Elvacite 2669,同时添加一定的有机改性剂,两者就可以得到很好的分离。 Farran 等L22]采用多种分离模式,通过添加有机改性剂乙腈、使用表面活性剂胆酸钠和不同类型环糊精的方法,对苯氧羧酸类除草剂2,4-滴和2甲4氯丙酸的分离进行了详细的研究,两组分在5 min内即可得到分离。 Cai 和El Rassi36]用烷基苷(辛基苷、壬基苷)作表面活性剂在硼砂溶液中分离了3种三嗪和一种乙酰胺除草剂。在分离一些典型氨基甲酸酯类杀虫剂时,El Rassi 等L37]将壬酰基-N-甲基葡萄糖苷(MEGA 10)和 SDS 进行比较,发现 SDS 的疏水性更强,因此分离时间长很多,理论塔板数只有前者的一半。 Smith 等[38]还用烷基苷MEGA-10-硼砂胶束体系分离了8种除草剂(苯氧羧酸类、乙酰胺类和有机磷类);该体系还适宜9种脲类除草剂的测定,采用MEGA 8,MEGA 10 作表面活性剂,其理论塔板数可分别达到5.54×10/m,8.45×10/m。作者认为辛基麦芽糖苷(OM)、辛酰基蔗糖苷(OS)、辛基葡萄糖苷(OG)、MEGA9作为4种不同的表面活性剂,虽然有相近的临界胶束浓度,但其胶束憎水性能有差异,因而在分离三嗪、脲、苯氧羧酸除草剂时具有不同的选择性,OG,OM憎水性更强,更适合极性化合物的分离。 拟除虫菊酯类农药容易水解, Karcher 39J通过采用激光诱导荧光法测定其水解产物来间接地测定其含量。文中采用OM 作为表面活性剂,乙腈作为改进剂。 由此可见,在 MECC 分离农药的过程中选择合适类型的阴离子表面活性剂非常重要,疏水性很强的胶束体系一般不适合于极性化合物的分离。 4.2 阳离子表面活性剂的胶束毛细管电泳 阳离子表面活性剂通过吸附在未涂层毛细管的内表面,改变 Zeta 电势的符号,而使电渗流反向。 三嗪除了可以用阴离子表面活性剂的胶束体系分离外,还可以采用阳离子的胶束体系。 Lin 等L40J就用十四烷基三甲基溴化铵(TTAB)胶束体系分离过13种三嗪类农药,作者认为在分离过程中,pH的选择非常关键,且与分离物的pKa 值密切相关。 Tsai 等[41]也做过类似工作,以质谱作检测器,在50 mmol/L 醋酸盐介质中,添加0.7 mmol/L的十六烷基三甲基溴化铵作改进剂(CTAB),8种三嗪得到了良好的分离。 Nejad 等142]曾同时采用毛细管电泳和液相色谱-质谱联用技术研究了咪唑啉酮类除草剂的分离测定,实验过程采用了液相萃取、固相萃取、溶剂蒸发等各种样品前处理技术。电泳体系是以十二烷基三甲基溴化铵(DTAB,20 mmol/L)作胶束,缓冲溶液为10 mmol/L 的柠檬酸盐, pH 为6.4,土壤中的7种咪唑啉酮类除草剂的测定取得令人满意的效果。 5手性农药的分离 用于农药的化合物中,大约有25%的化合物含有手性中心,因此用毛细管电泳进行手性分离具有特别的意义。在手性分离过程中,尤为重要的是选择合适的手性选择剂,a、3、y-CD及其衍生物、表面活性剂、胆汁盐、手性混合胶束是目前毛细管电泳分离手性农药中用得较多的手性选择剂。 Haynes 等143J用过一种阳离子型的 B-CD 衍生物,这种环糊精带正电,能使电渗流反向,因此仪器必须带有反向电源。在选定的操作条件下,6种苯氧羧酸除草剂的对映体在30 min 内得到基线分离。 Desiderio 等[44]用万古霉素作手性剂分离了一些酸性除草剂。研究表明缓冲溶液的浓度、毛细管的温度以及万古霉素的浓度都影响所研究的物质的分离。万古霉素的浓度增加,保留时间延长,分离度增大,当手性剂的浓度为6 mmol/L时,对映体在4.5 min ~ 8.4 min 内基线分离很好,检测极限为0.5 umol/L. Zerbinati 等L45]在拆分外消旋的除草剂二氯苯氧丙酸的对映体时,选用了8种环糊精作手性选择子(α、B、Y-CD及它们的衍生物)。在不同的 CD 浓度下,根据电泳迁移时间可计算出除草剂对映体与环糊精主体分子的结合常数,根据结合常数可选择对映体分离的最佳条件。实验发现有几种 CD 可用来拆分该对映体,其中一种碳酸乙酯衍生的 B-CD具有最好的拆分性能。实验可在分子模型的基础上解释农药与 CD 的络合机理。 Schmitt等L46]分别将多种 CD 加到缓冲溶液 SDS 中,同时添加一定的有机改性剂,对3种不同类别的农药(有机磷,滴滴涕,甲酯类芳香酸)进行了分离研究。结果表明:用B-CD、丙羟基-B-CD、Y-CD可分离马拉硫磷、育畜灵和氯亚磷,而不能分离Isofenfos 和 Fenamifosm 的对映体。用y-CD 可得到3种甲酯类芳香酸和2,4,5涕丙酸甲酯对映体的基线分离,但没有一种CD 可分离2甲4氯丙酸和2,4滴丙酸甲酯的对映体。用 y-CD 和少量乙腈改性剂可很好地分离6种同类滴滴涕(DDT),滴滴滴(DDD),滴滴伊(DDE)以及这一系列对映体的手性各组分。 Mechref 等_47]采用两种烷基吡喃葡萄糖苷作手性表面活性剂评价苯氧羧酸除草剂的分离情况,通过对表面活性剂浓度、离子强度、温度进行优化,6种苯氧羧酸的对映体得到了良好的分离。实验表明:分析对象的疏水性越强,所需要的胶束浓度就越低,随着 pH增大,苯氧羧酸离子化程度越大,与胶束的结合能力就越低。 在农药的毛细管电泳分离过程中,区带电泳、环糊精改性的区带电泳、胶束毛细管电泳是其最主要的操作模式,有关农药详细的分离条件见表1。其中手性农药的分离是毛细管电泳的难点,也将是分析工作的热点。 6前景展望 HPCE样品用量少,具有高效、快速、简便、成本低、柱子不易受污染的特点。 CE 主要采用紫外检测器和质谱检测器用于除草剂、杀虫剂或结构相似的农药的分析,但其重现性、灵敏度方面仍存在不足,某些物质的定量分析不如高效液相色谱准确,检测限也难以满足环境分析的要求。随着近年来商品仪器的不断改进和完善、自动进样器的使用以及高灵敏度检测器如激光诱导荧光、飞行时间质谱、串列式质谱等与 CE 的联用,不但可使测定精度提高,而且能完成连续自动进样及在线分析,检测极限可达到10-14g至10-15g,这将大大拓宽毛细管电泳的应用范围。采用 CE-MS、CE-NMR(核磁共振)及 CE-MS-MS技术,充分利用了 HPCE 的高分离效率和MS或NMR的高灵敏度与定性鉴定能力,可快速完成众多复杂成分的分离与结构鉴定,在农药及其降解产物的分析中将变得更为重要。CE 有广泛的适用性,几乎可以分离除挥发性和难溶物之外的各种分子。这一点对化学工作者尤为具有吸引力,随着愈来愈多的开拓性工作的不断推进, CE 在将来的农药分析中会得到更广泛的应用。 表11 HPCE 法在农药分析中的应用 Table 1 The applications of HPCE in the analysis of pesticides Operating Column Volt- 入p (cmx age (nm) um i.d.))(kV) Pesticide species Buffer pH model Quaternary ammonium: paraquatydiquat CZE[12] 100 mmol/L phosphate 3.5-9.5 50×50 15 254 Urea: monuron, fluometuron, metobromuron,siduron, terbacil, diuron, linuron, neburon, MECC[38] 100 mmol/L borax +100 mmol/L MEGA 10(orMEGA 8) 10.0 50×50 15 240 chloroxuron Sulfonylureas: chlorsulfuron, chlorimuron, metsul-Iuron MEKC[29] 30 mmol/L borax+80 mmol/L SDS+20% iso-propanol+ 14% methanol 7.0 50×75 25 214 Phenoxy acid: dichlor, 2, 4-D, mecoprop, 2, 3- CPPA,2,4-CPPA, silvex,2,4,5-D,2,2-CPPA, CD-CZE [48]200 mmol/L borax+5 mmol/L a-CD 2-PPA 10.0 50×50 29 LIF Phenoxy acid: mecoprop, fenoprop, dichlorprop,2- MEKC47] PPA,2,3-CPPA, etc. or CZE 200mmol/L Na3PO4 + 10 mmol/L NG or 10 mmol/L-150 mmol/L OG mmol/L-150 6.5 50×50 20 230 Phenoxyalkyl acids:2,4-D,2,4,5-T,diuron,etc. MEKC 49J 20 mmol/L phosphate+50 mmol/L SDS +8% n-butyl alcohol 7.0 40×50 27.5 225 Trazines: simazine, cyanazine, ametryne,MECCL30] propazine, prometryne,terbutryne, etc. 60 mmol/L borax +60 mmol/L SDS 9.2 50×75 22 214 Carbamate:baygon,carbaryl,carbofuron, etc. MECC[33] 40 mmol/L phosphate + 50 mmol/L SDS+ 23 mmol/L HP-B-CD 53×50 18 214 Pyrethroid: Permethrin, phnotrin,cypermethrin, sanmarton,fenpropathrin MECC[39] 100 mmol/L NagPO4 + 40 mmol/L OG (25 mmol/LOM)+(0-10%)acetonitrile 6.5 50×50 19 LIF Fungicides: carbendazine, metalzxyl, vinclozolin, propiconazole MEKC[50] 10 mmol/L NaH,PO4+30 mmol/L SDS or 10 mmol/L NaCh+(5%-15%) methanol 7.0 50×50 28 214 Propham, diuron,desmetryn,chlorfenvinphos etc. MECC6J 5 mmol/L borax+30 mmol/L SDS 8.0 63×75 20 214 Isoprothiolane, asulan, fenobucarb, chloroneb, hiobencarb,terbutol,butamifos,iprodine, etc. MECCL28] 25 mmol/L borax + 30 mmol/L SDS + 15% methanol+8.0 mmol/L B-CD 9.5 65×50 25 220 Dimethoate, azinphos-methyl,chlorpyriphos- methyl,chlorpyriphos-ethyl MEKC[49] 20 mmol/L phosphate+ 50 mmol/L SDS+(0- 40%) methanol 9.0 40×50 27.5 200 Simazine, atrazine, ametryn, prometryn, ter- butryn, etc. MEKC[31] 10 mmol/L NazHPO4+60 mmol/L SDS +8% acetonitrile 9.5 47×75 25 226 Malathion, ruelene, dialifos,fenamifos,isofenfos MEKC[46] 20 mmol/L borax + 100 mmol/L SDS+ 20% methanol+ 40 mmol/L DM-B-CD(TM-B-CD) 9.0 50×50 15-30 200 Prometryne, terbutryne, desmetryne, methoxy, czp[23] simazine, etc. 20 mmol/L Tris+30%ethanol 3.0 35×75 15 254 Simazine, atrazine, prometon,ametryn, propazine, prometryn,terbutryn MEKC[32] 20 mmol/L phosphate+100 mmol/L SDS 9.14 56×50 30 214 Ruelene,dialifos,p,p'-DDT,o,p'-DDE, meto- lachlor, dichlorprop methyl ester, etc. MEKC[43] 20 mmol/L borax +100 methanol mmol/L SDS + 9.0 47×50 30-55 214 Dhaloxyfop,fluazifop,flamprop,fenoxaprop, etc. MEKC 44J 50 mmol/L borax + 50 mmol/L acetic acid+ 50 5-7 33×50 20 205 mmol/L phosphate+ vancomycin Fenoprop, mecoprop, dichlorprop,2,4-D CD- CZE[24] 50 mmol/L acetate+40 mmol/L TM-B-CD 4.45 50×75 20 214 or 230 Napropamide,ethofumesate,flamprop free acid CD- CZE[27] 5 mmol/L-25 mmol/L borax +5 g/L-30 g/L SBE-B-CD+10% methanol 9.0 50×50 20 205 Tris: trihydroxymethylaminomethane;SDS: sodium dodecyl sulfate; NaDCh: sodium deoxycholate; NaCh: sodium cholate; DM-B-CD: dimethyl-β-cyclodextrin(CD);TM-B-CD: trimethyl-B-cyclodextrin(CD); HP-B-CD: hydroxypropyl-B-CD; SBE-B-CD: sulfobutyl ether-B-CD. ( 参考文献 ) ( [1] Jorgenson J W , Lukacs K D. Anal Chem, 1981(8),53: 1298-1302 ) ( [2] Jorgenson J W, Lukacs K D. Cli n Chem, 1981,27:1551-1554 ) ( [3] Jorgenson JW,Lukacs K D. S c ience, 1983, 222:226- 229 ) ( [4] Terabe S, Otsuka K, Ichikawa K , e t al. A nal C hem, 1984,56(1):111-113 ) ( [5] Burgi D S. Anal Chem, 1 9 93,65(24):3 72 6 -3 729 ) ( [6] Siisse H,Muller H. J Chromatogr A, 1996,730:337-343 ) ( [7] Hsieh Y Z, Huang H Y. J Chromatogr A, 1996,745: ) ( 217-223 ) ( [8] Chien R L, Burgi D S. Anal Chem, 1992,64(8):489A- 496A ) ( [9] Chien R L, B urgi D S. Anal Chem, 1 992,64(9):1 046- 1050 ) ( [10] Zhang C X,Thormann W . Anal C hem, 1996,68(15): 2 523-2532 ) ( [11] Tomkins B A,Griest W H. Anal Chem, 1996,68(15): 2533-2540 ) ( [121 Cai J,El Rass i Z. J Li q Chromatogr, 1992,15:1 1 93-1 200 ) ( [13] Galceran M T, Carneiro M C , D iez M , et al. J Chro- matogr A, 1997,782:289-295 ) ( [14] Lazer L M,Lee M L . J M icrocol Sep, 1999,11: 1 17- 123 ) ( [15] Kaminasky D. Anal Chem, 1 994,66:1 817-1824 ) ( [16] Schmitt P, Garrison A W, Freitag D, et a l . J C hro-matogr A, 1996,723:169-177 ) ( 17 ] Garrison A W,Schmitt P ,Kettrup A . J C hromatogr A, 1994,688:317-327 ) ( 18 Garcia F, Henion J. J Chromatogr, 1992,606:237-247 ) ( [19] Smith J T, E l Rassi Z. Electrophoresis , 1994, 15: 1248-1259 ) ( 201 Whang K S , Whang C W. Ele c trophoresis, 19 9 7, 18: 241-246 ) ( [21] Carabias-Martinez R, Rodriguez-Gonzalo E, Dominguez- Alvarez J,e t al. An a l Chem , 1997,69(21):4437-4 444 ) ( [22] Farran A, Serr a C, Sepaniak M J. J Chromatogr A,1999,835:209-215 ) ( [231 ] Foret F, Sustacek V, B occk P . E l ect r ophoresis, 1 990,11:95-97 ) ( L24J Penmetsa K V, L eidy R B , Shea D . J C hromatogr A, 1997,790:225-234 ) ( 25 Nielen M W F . J Chromatogr, 1993,637:81-90 ) ( 261 Mechref Y, El Rassi Z. Anal Chem, 1 996, 68(10): 1771-1777 ) ( Desiderio C, Polcar o C M, Fanali S . E l ectrophoresis, 1997,18:227-234 ) ( [281 ] He Y,Lee HK. J Chromatogr A ,1998,793:331-340 ) ( [29] Dinell i G , Vicari A , Brandoli n i V. J Chromatogr A, 1995,700:201-207 ) ( Carabias-Martínez R, Rodriguez-Gonza l o E , Mun oz Dominguez A I, e t al. J Chromatogr A, 1 996,733: 349-360 ) ( [31] Hinsmann P, Arce L, Pios A, et al. J Chromatogr A,2000,866:137-146 ) ( 32I Leinweber F C, Otto M. J Chromatogr A, 1 999,848: 347-363 ) ( [33] Wu Y S,Lee H K,Li S FY. J Microcol Sep, 1 998,10: 239-247 ) ( [34]He Y ,Lee H K . Electrophoresis, 1997, 1 8:2036-2041 ) ( [35] Aguilar M,Farran A , Serra C, et al. J Chromatogr A, 1997,778:201-205 ) ( [36J Cai J,El Rassi Z. J Chromatogr, 1992,608:31-45 ) ( [37] El Rassi Z,Karcher A . Electrophoresis,1999,20,3 280- 3296 ) ( [38] Smith J T, Nashabeh W, E lF Rassi Z. Anal Chem,1994,66(7):1119-1 1 33 ) ( [39] Karcher A, E l Rassi Z . E lectrophoresis, 1997, 1 8 : 1173-1179 ) ( [40] Lin C E,Hsueh C C , W a ng T Z, et al . J Chromatogr A,1999,835:197-207 ) ( [41] Tsai C Y , Chen Y R, Her G R . J Chromatogr A,1998,813:379-386 ) ( [42] Nejad H , Safarpour MM,Cavalier T,e t al. J Capil Elec- trophor, 1998,5:81-87 ) ( [43] Haynes J L Ⅲ,Shamsi S A, O ' keefe F , e t al. J Chro- matogr A, 1998,803:261-271 ) ( [44] Desiderio C, Polcaro C M, P adiglioni P, et al. J Chro- matogr A, 1997,781:503-513 ) ( [45] Zerbinati O, Trotta F,Giovannoli C,et al. J C hromatogrA, 1998,810:193-200 ) ( [46] Schmitt P, Garrison A W , F reitag D, et a l . J C h r o-matogr A, 1997,792:419-429 ) ( [47] Mechref Y,El R assi Z. J Chromatogr A, 1997, 757: 263-273 ) ( [48] Mechref Y, El Rassi Z. Anal Chem, 1 996,68,1 7 7 1-1777 ) ( [49] Farran A, Ruiz S, Serra C, e t al. J Chromatogr A, 1996,737:109-116 ) ( [50] Penmetsa K V ,Leidy R B, Sh e a D. Ele c trophoresis, 1997,18:235-240 ) Application of Capillary Electrophoresisin the Analysis of Pesticides ZHANG Yu-ping, YUAN Zhuo-bin (Graduate School, University of Science and Technology of China, Beijing 100039, China) Abstract: Capillary electrophoresis has proved to be a suitable microseparation technique for the analysis of awide variety of chiral and achiral pesticides. In this paper, the applications and developments in the field ofpesticide separation by HPCE are reviewed with 50 references, including different operating models and chiralagents. Furthermore, the advantage and trend of development are also pointed out . Key words: capillary electrophoresis; separation model; pesticide
确定





还剩4页未读,是否继续阅读?
北京华阳利民仪器有限公司为您提供《农药中主要成分含量分析检测方案(毛细管电泳仪)》,该方案主要用于除草剂中主要成分含量分析检测,参考标准--,《农药中主要成分含量分析检测方案(毛细管电泳仪)》用到的仪器有高效毛细管电泳仪(紫外检测)CL1030
推荐专场
相关方案
更多