在本研究中,我们提供一种新流程,结合快速色谱,利用两种规格的整体柱和高分辨Orbitrap质谱仪,对完整及还原利妥昔进行了分析,采用AIF,Multiplexed HCD自上而下的裂解,以及自下而上的分析方法进行序列验证。
即使抗体的上样量低至500pg,我们仍可以得到高质量的质谱图,该数据证明了LC-MS仪器的高灵敏度。此外,为了分析还原型单克隆抗体,我们采用色谱的方法将抗体的重链和轻链分开,设置不同的分辨率对其进行检测。
通过这个流程,我们可以测定完整抗体的分子量,对轻链和重链的氨基酸序列进行确认和验证,对该抗体不同糖基化形式的相对丰度进行鉴定和评价。
方案详情

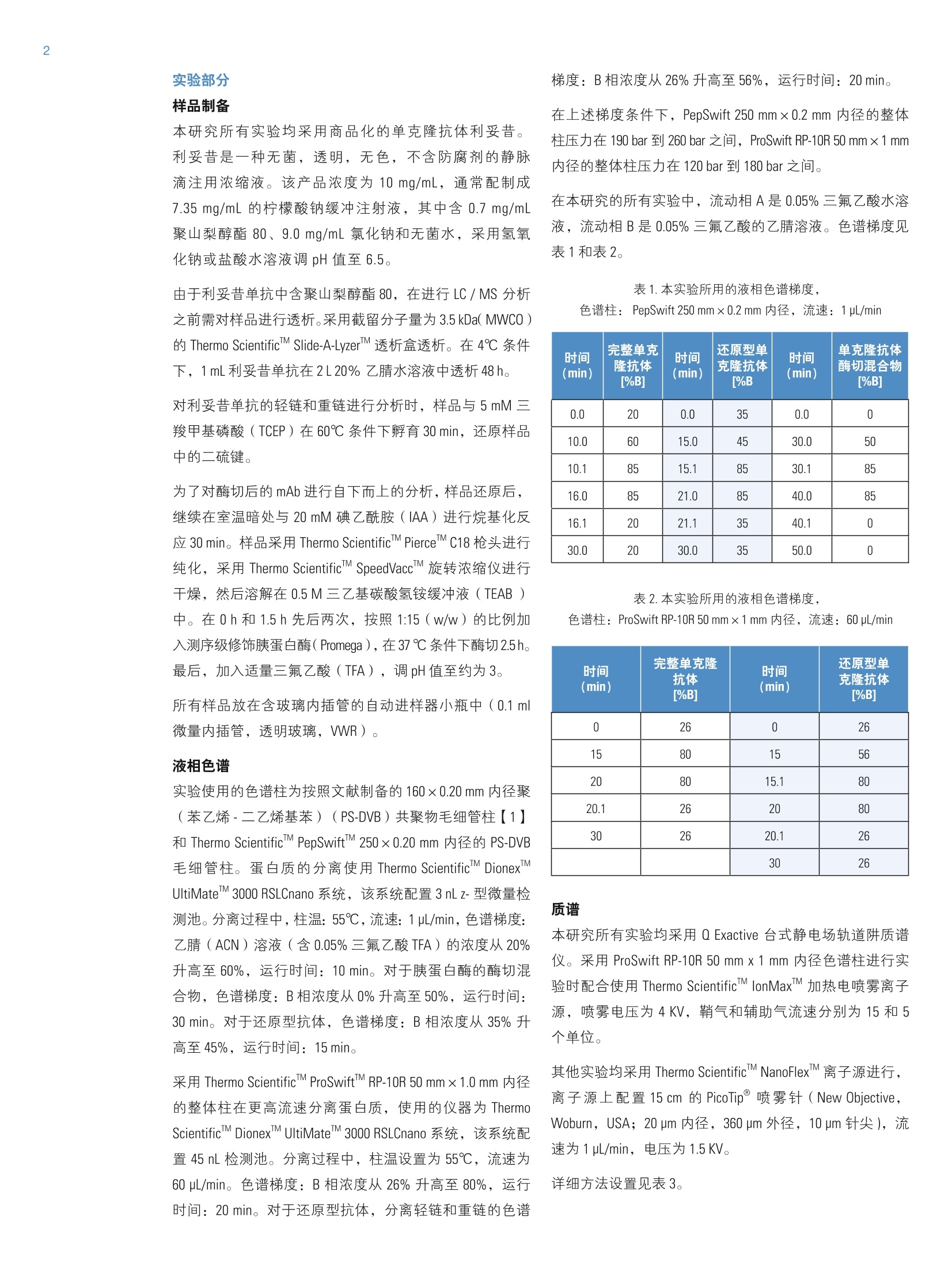
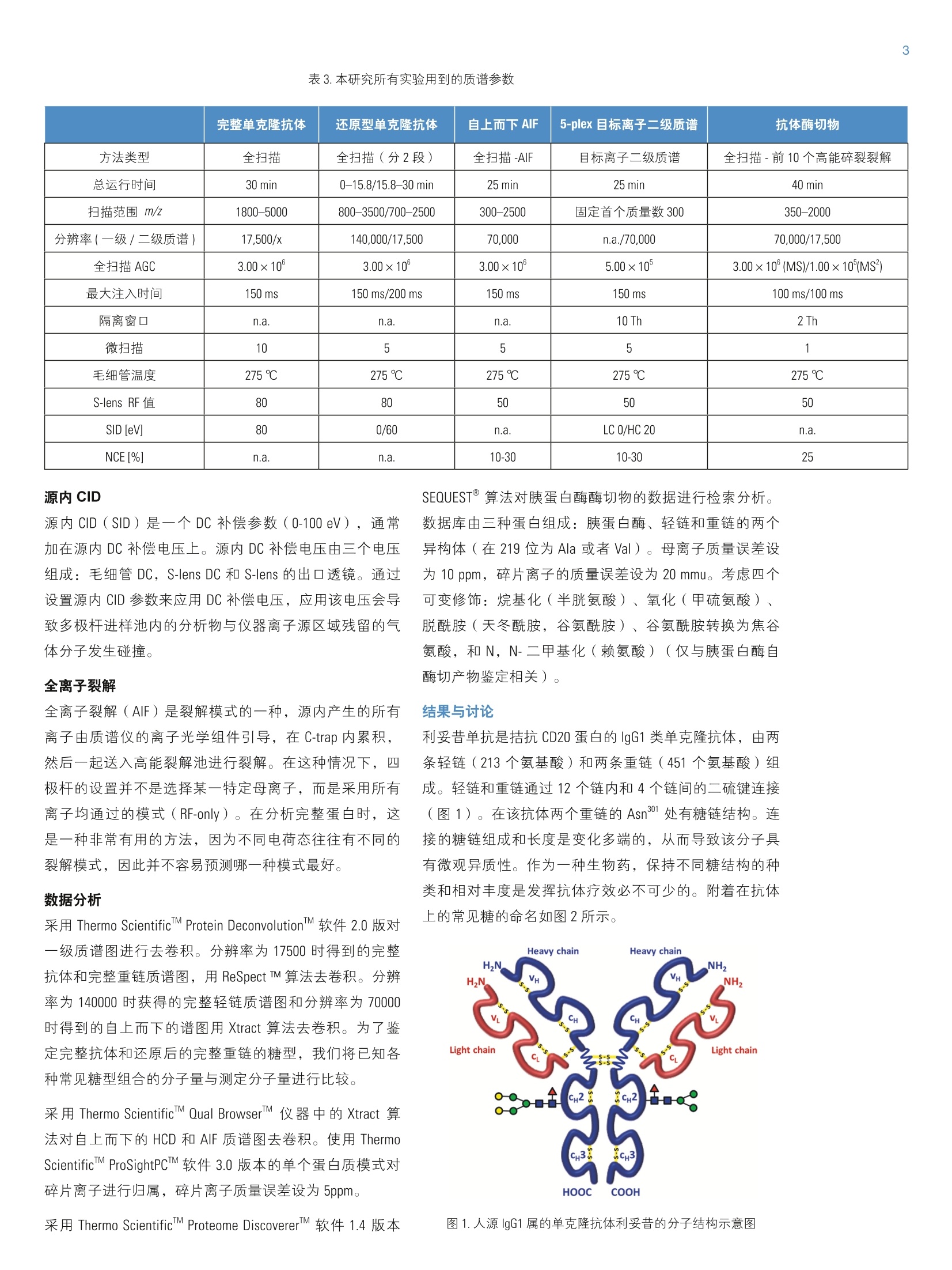
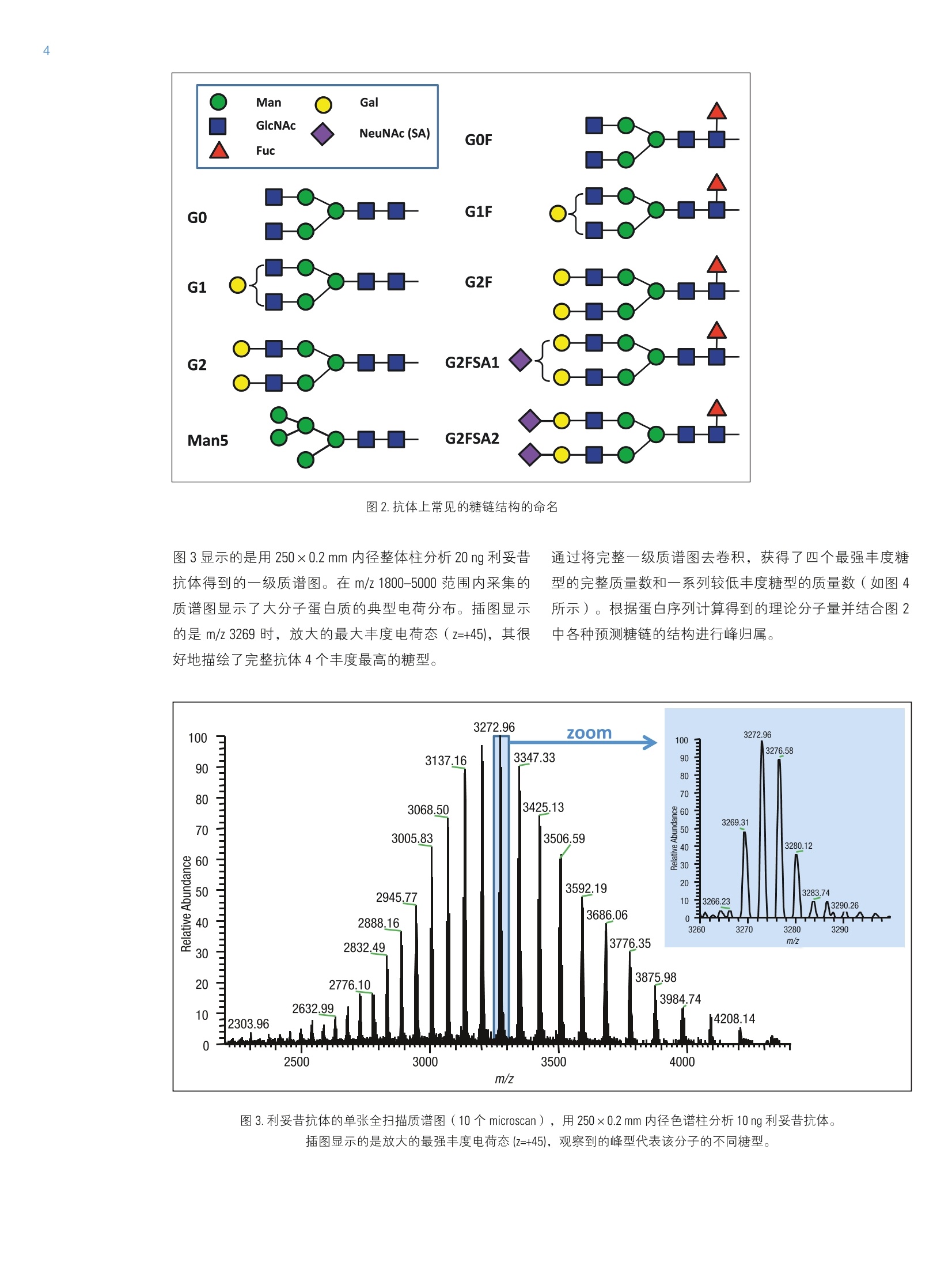
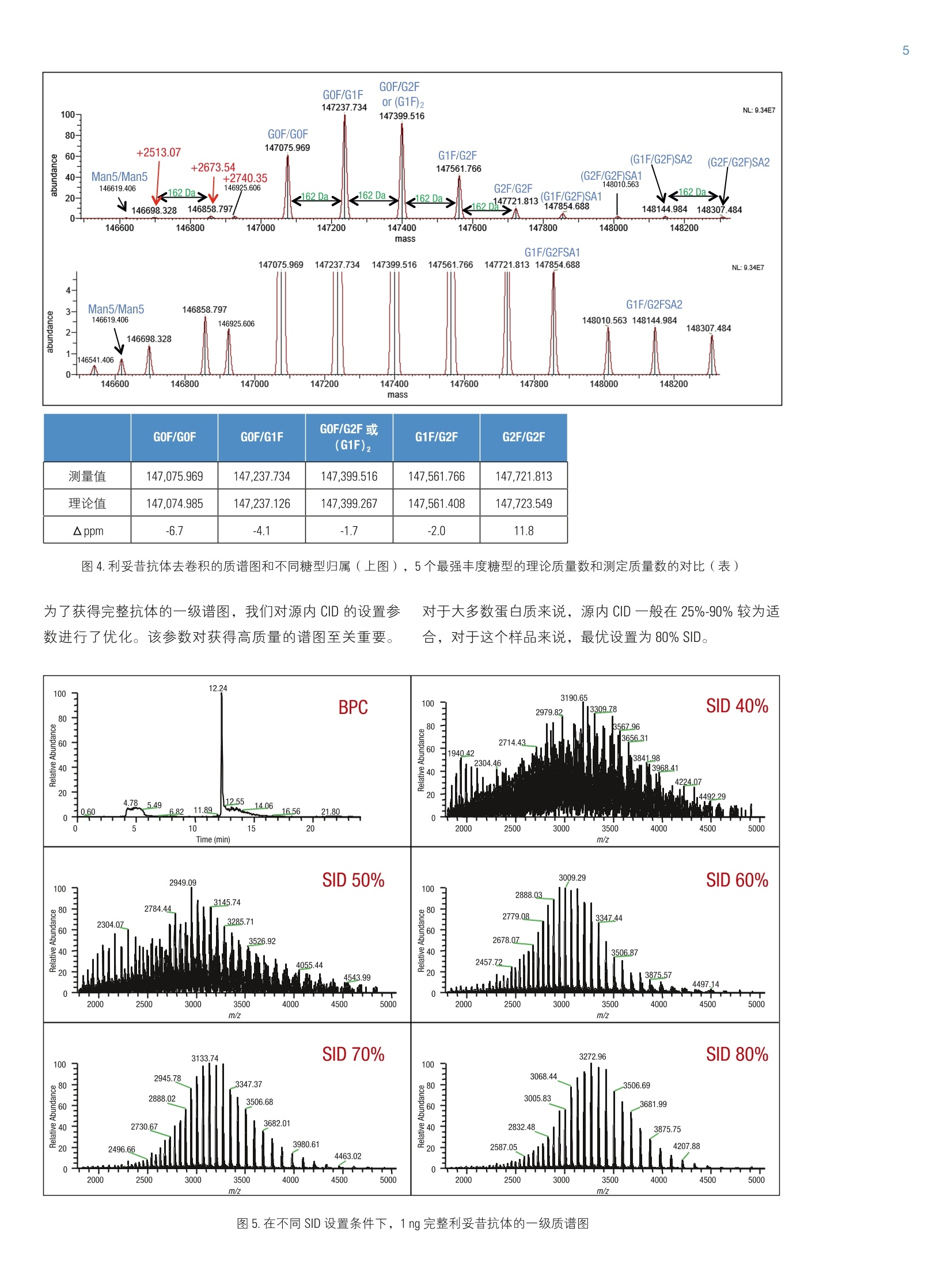
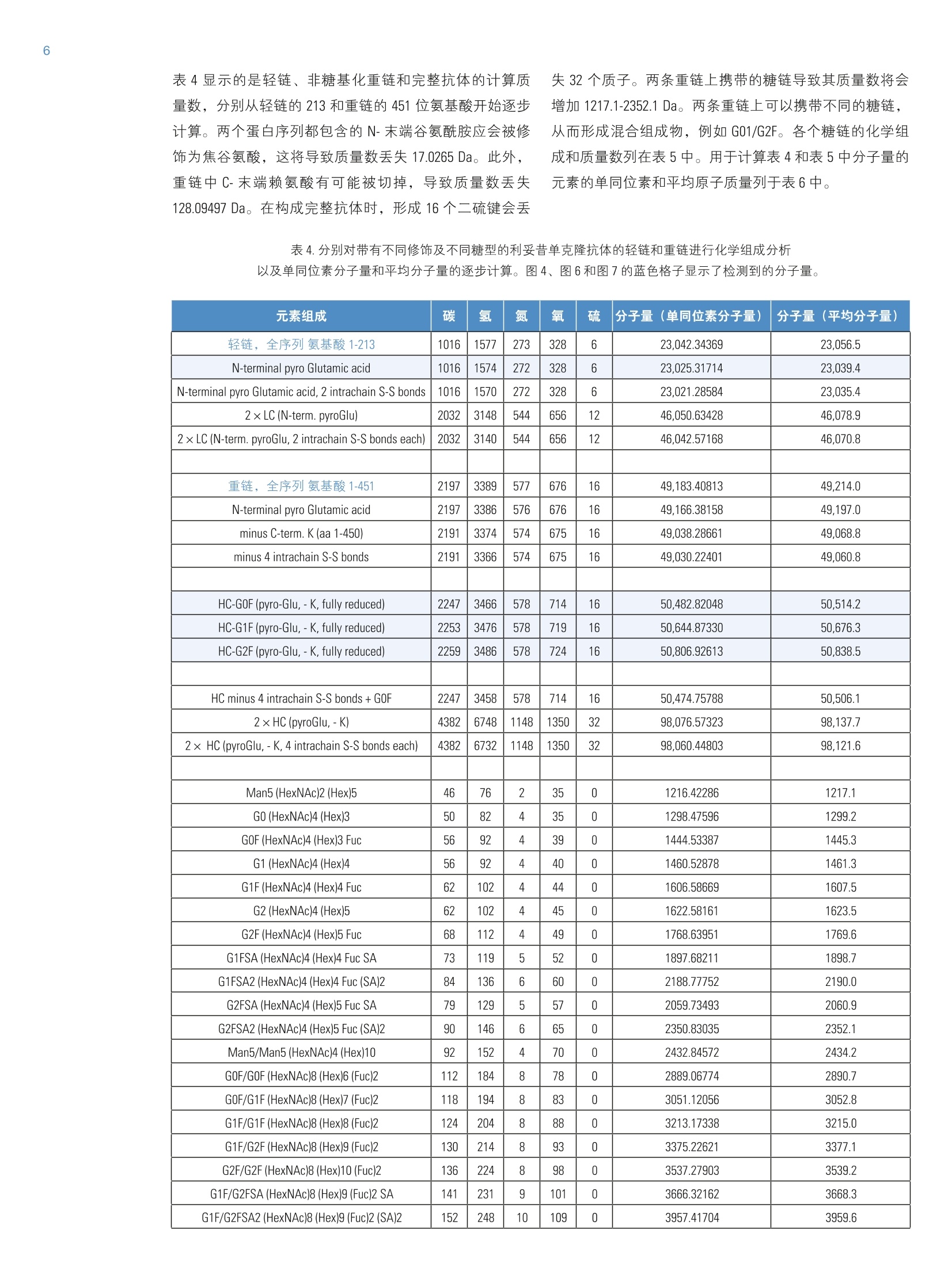
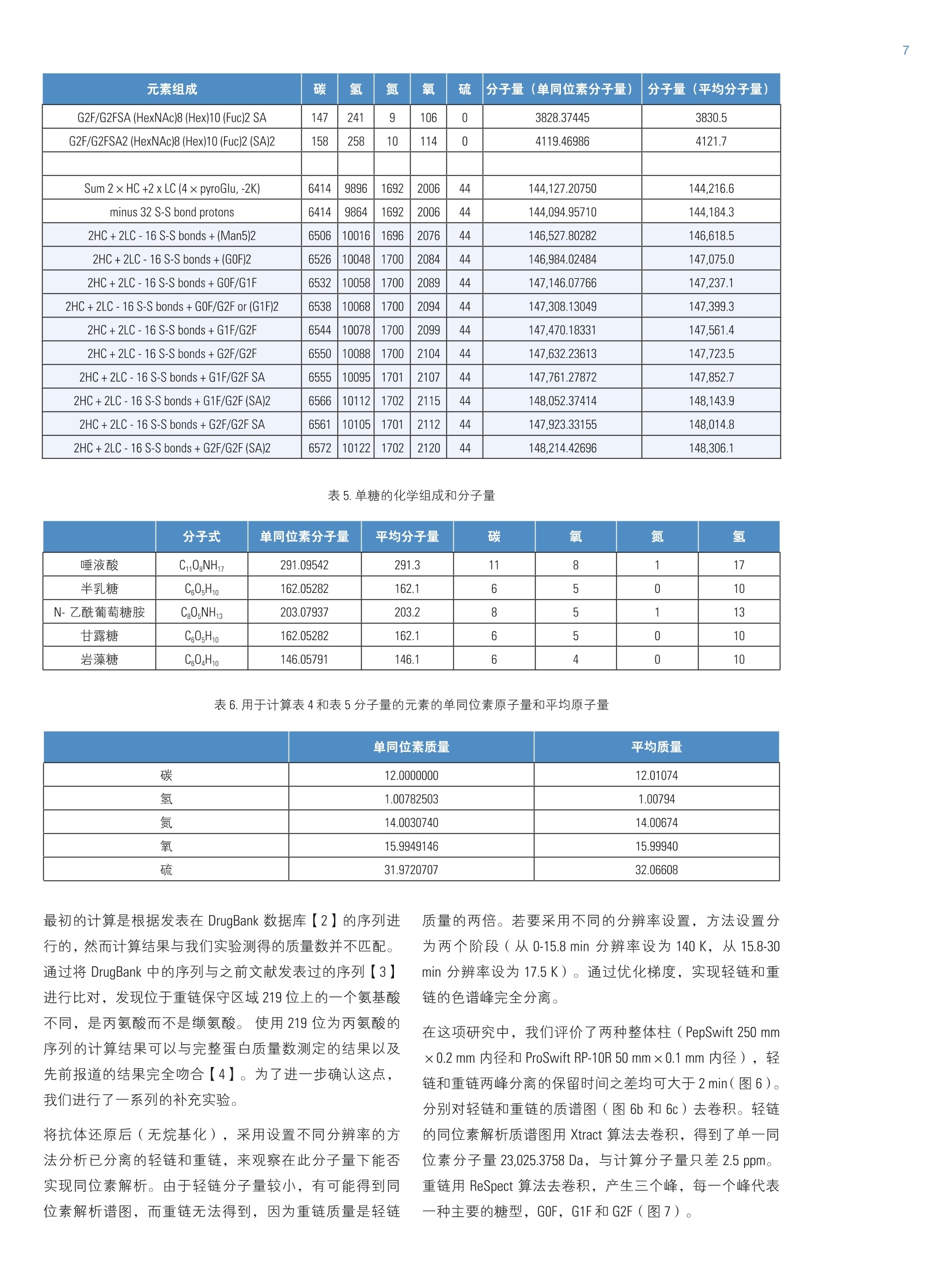
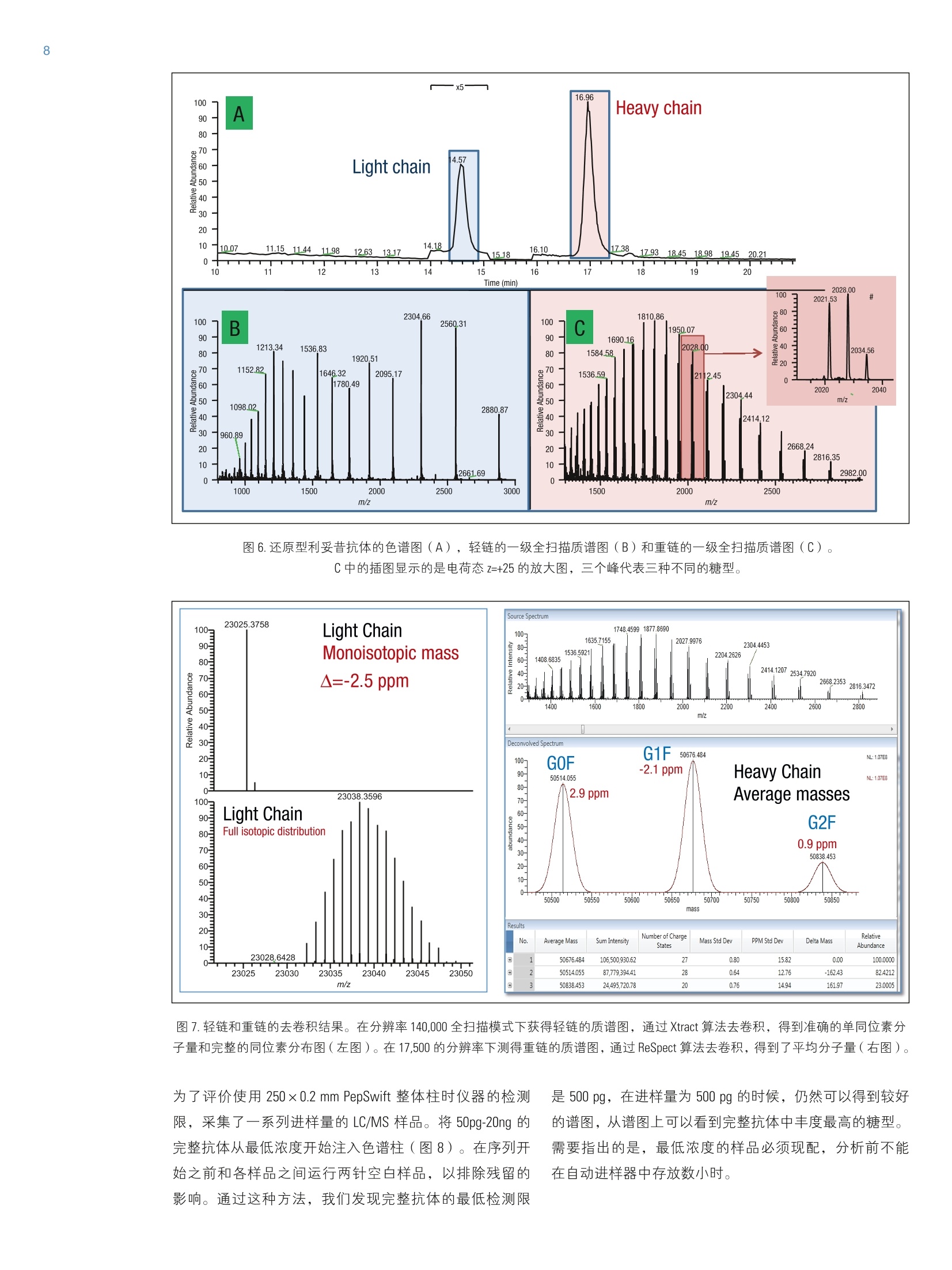
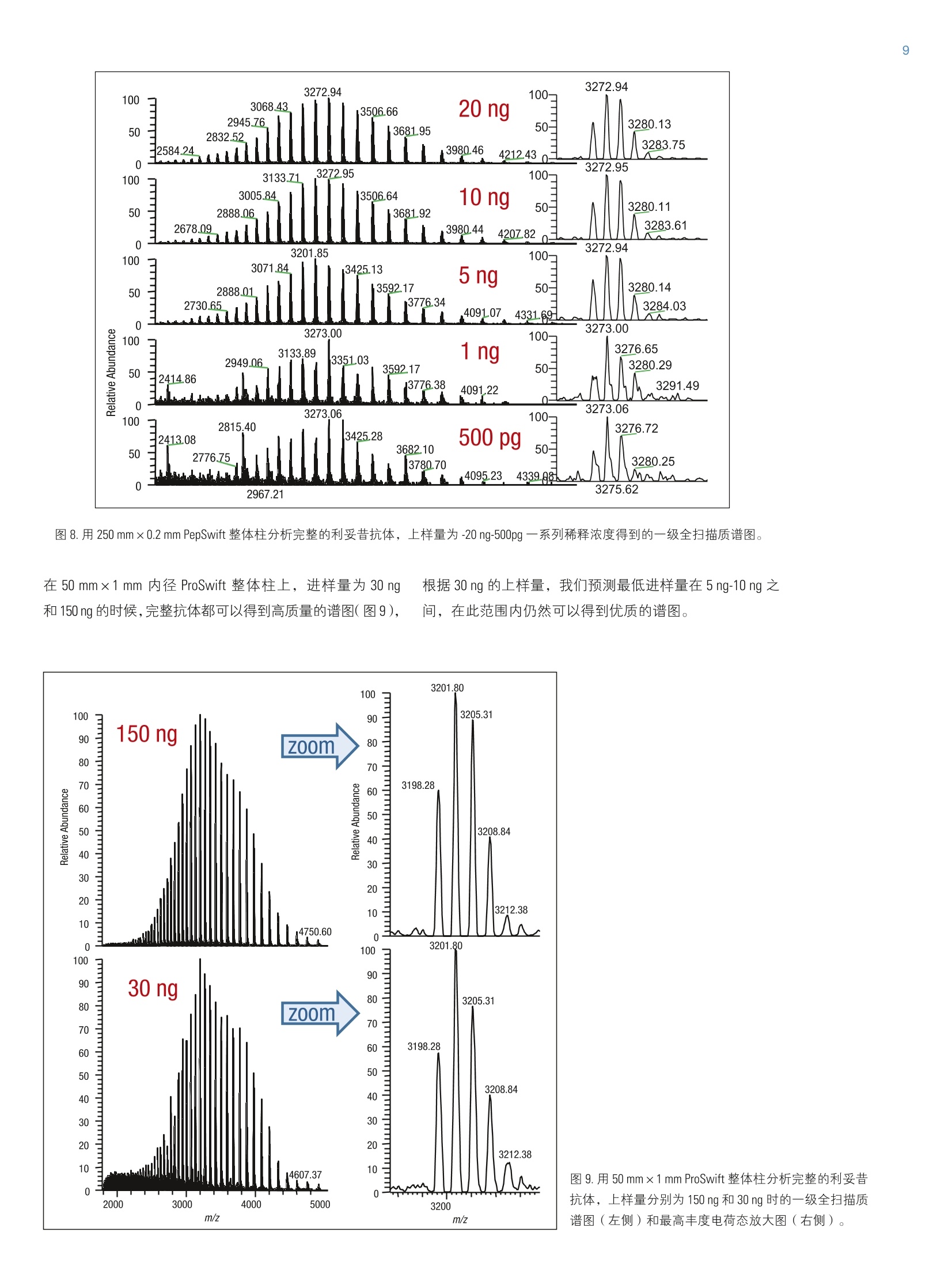
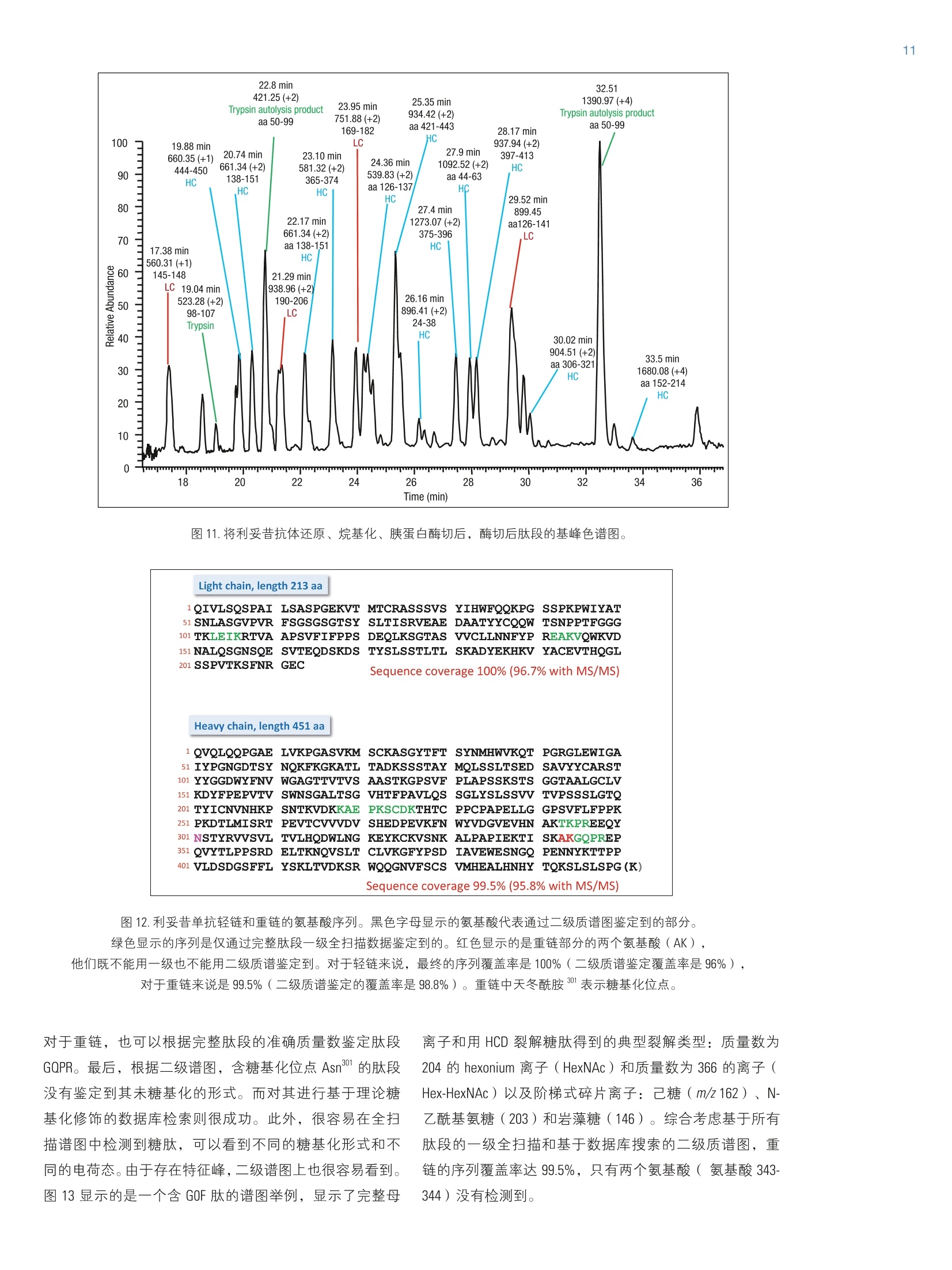
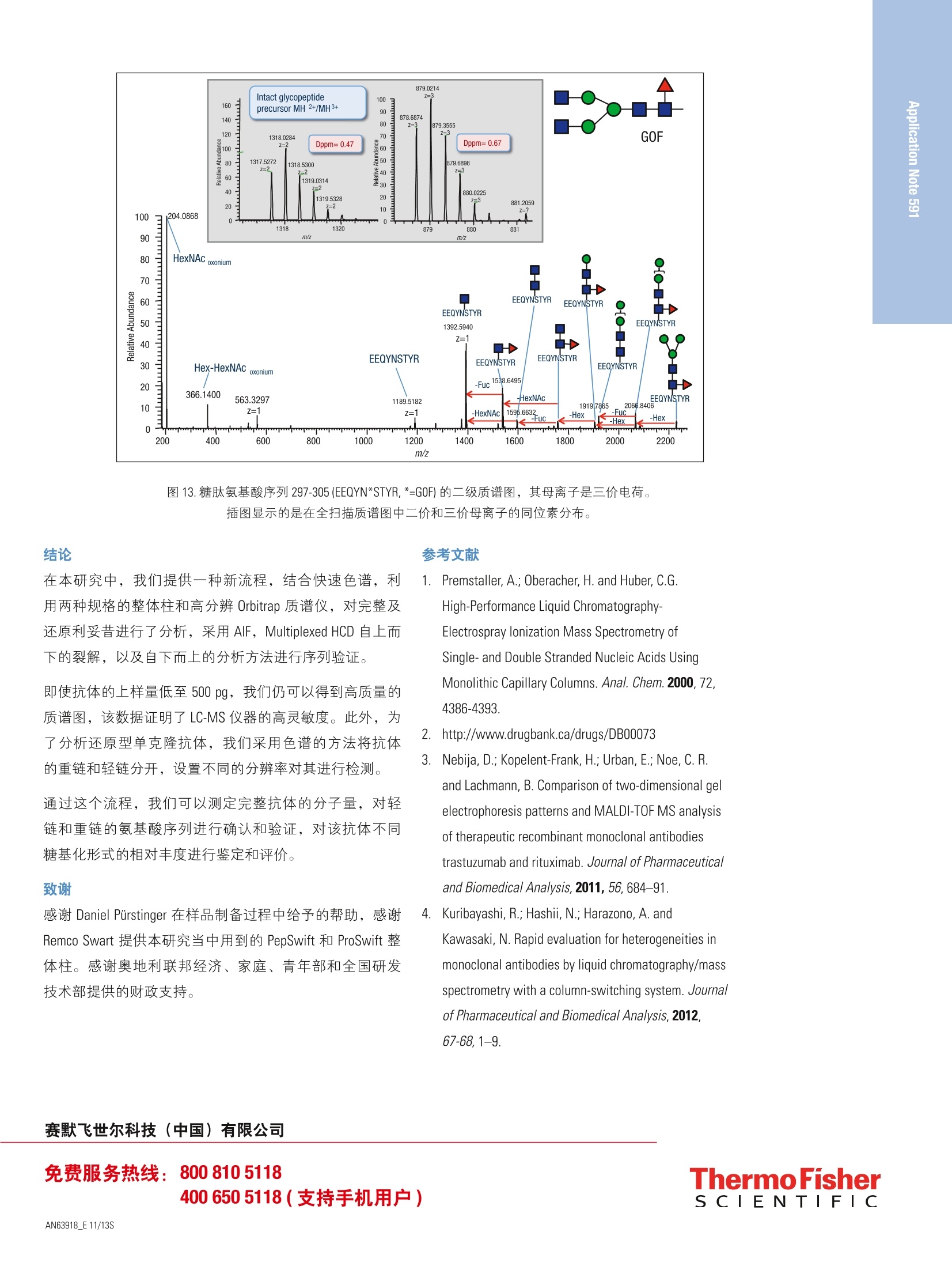
2实验部分 3表3.本研究所有实验用到的质谱参数 Martin Samonigl2, Christian Huber12 and Kai Scheffler23赛默飞世尔科技(中国)有限公司 优化液相色谱质谱工作流程,采用整体柱在线耦联 Thermo Scientific QExactive台式阱道阱质谱仪对单克隆抗体进行分析和表征。 前言 单克隆抗体(mAb)是增长需求最快的医药产品之一。他们在多种病症如癌症、感染性疾病、过敏症、炎症和自免疫疾病的治疗中发挥着主要作用。由于单克隆抗体可以表现出显著的异质性,作为治疗产品,新的 mAb要获得批准需要进行大量的分析表征。质谱法已经成为表征单克隆抗体的重要工具,能测定完整蛋白及分离的轻链和重链的分子量、解析糖基化和糖链的结构,确证正确的氨基酸序列,鉴定杂质,如生产过程中固有的宿主细胞蛋白质(HCP)。 利妥昔单抗是一个拮抗蛋白质 CD20 的重组单克隆抗体,其在美国的商品名为 Rituxan (Biogen Idec 公司/基因泰克公司),在欧洲的商品名为 MabThera°(罗氏)。它是第一代肿瘤免疫治疗药物之一。利妥昔单抗分别在1997年被美国食品和药物监督管理局和1998年由欧盟委员会批准用于恶性淋巴瘤的治疗。这个抗体的可变区域作用靶点为细胞表面分子 CD20,这些分子存在于一些非霍奇金淋巴瘤中。 在这个应用报告中,结合使用自上而下和自下而上的方法,不管是分析完整和还原的利妥昔单抗,还是对其进行氨基酸序列分析, Q Exactive Orbitrap 质谱仪都具有优异的表现。 此外,评价了两套整体柱色谱系统在线耦合质谱仪的灵敏度。数据表居 Q Exactive 系统具有优异的分辨率和质量准确度,是一个具有高置信度的筛选工具,,可快速精确地进行生物制药产品的开发和表征。 样品制备 本母究所有实验均采用商品化的单克隆抗体利妥昔。利妥昔是一种无菌,透明,无色,不含防腐剂的静脉滴注用浓缩液。该产品浓度为 10 mg/mL, 通常配制成7.35 mg/mL 的柠檬酸钠缓冲注射液,其中含0.7 mg/mL聚山梨醇酯80、9.0 mg/mL 氯化钠和无菌水,采用氢氧化钠或盐酸水溶液调 pH 值至6.5。 由于利妥昔单抗中含聚山梨醇酯80,在进行LC/MS分析之前需对样品进行透析。采用截留分子量为3.5 kDa(MWCO)的 Thermo Scientific Slide-A-LyzerM透析盒透析。在4℃条件下,1mL利妥昔单抗在2L20%乙腈水溶液中透析48h。 对利妥昔单抗的轻链和重链进行分析时,样品与5mM三羧甲基磷酸(TCEP)在60℃条件下孵育30 min, 还原样品中的二硫键。 为了对酶切后的 mAb进行自下而上的分析,样品还原后,继续在室温暗处与20mM 碘乙酰胺(IAA)进行烷基化反应 30min。样品采用 Thermo Scientific MPierceM C18 枪头进行纯化,采用 Thermo Scientific M SpeedVaccM 旋转浓缩仪进行干燥,然后溶解在0.5M三乙基基酸氢铵缓冲液(TEAB)中。在0h和1.5h先后两次,按照1:15(w/w)的比例加入测序级修饰胰蛋白酶(Promega), 在37℃条件下酶切2.5h。最后,加入适量三氟乙酸(TFA),调pH值至约为3。 所有样品放在含玻璃内插管的自动进样器小瓶中(0.1ml微量内插管,透明玻璃,VWR)。 液相色谱 实验使用的色谱柱为按照文献制备的160×0.20 mm 内径聚(苯乙烯-二乙烯基苯)(PS-DVB)共聚物毛细管柱【1】和 Thermo Scientific PepSwift 250×0.20 mm 内径的 PS-DVB毛细管柱。蛋白质的分离使用 Thermo ScientificM DionexMUltiMate3000 RSLCnano 系统,该系统配置3nLz-型微量检测池。分离过程中,柱温:55℃,流速:1pL/min,色谱梯度:乙腈(ACN)溶液(含0.05%三氟乙酸 TFA )的浓度从20%升高至60%,运行时间:10 min。对于胰蛋白酶的酶切混合物,色谱梯度:B相浓度从0%升高至50%,运行时间:30 min。对于还原型抗体,色谱梯度:B相浓度从35%升高至45%,运行时间:15min。 采用 Thermo ScientificM ProSwiftM RP-10R 50 mm×1.0mm内径的整体柱在更高流速分离蛋白质,使用的仪器为 ThermoScientificM DionexM UltiMate 3000 RSLCnano 系统,该系统配置45nL 检测池。分离过程中,柱温设置为55℃,流速为60 pL/min。色谱梯度:B相浓度从26%升高至80%,运行时间:20 min。对于还原型抗体,分离轻链和重链的色谱 梯度:B相浓度从26%升高至56%,运行时间:20min。 在上述梯度条件下, PepSwift 250 mm ×0.2 mm 内径的整体柱压力在190 bar 到 260 bar 之间, ProSwift RP-10R 50 mm×1 mm内径的整体柱压力在120 bar 到 180 bar 之间。在本研究的所有实验中,流动相A是0.05%三氟乙酸水溶液,流动相B是0.05%三氟乙酸的乙腈溶液。色谱梯度见表1和表2。 表1.本实验所用的液相色谱梯度, 色谱柱: PepSwift 250 mmx0.2mm 内径,流速: 1pL/min 时间(min) 完整单克隆抗体[%B] 时间(min) 还原型单克隆抗体[%B 时间(min) 单克隆抗体酶切混合物[%B] 0.0 20 0.0 35 0.0 0 10.0 60 15.0 45 30.0 50 10.1 85 15.1 85 30.1 85 16.0 85 21.0 85 40.0 85 16.1 20 21.1 35 40.1 0 30.0 20 30.0 35 50.0 0 表2.本实验所用的液相色谱梯度, 色谱柱: ProSwift RP-10R 50 mm×1mm 内径, 流速: 60pL/min 时间(min) 完整单克隆抗体[%B] 时间 (min) 还原型单 克隆抗体 [%B] 0 26 0 26 15 80 15 56 20 80 15.1 80 20.1 26 20 80 30 26 20.1 26 30 26 质谱 ( 本研究所有实验均采用 Q Exactive 台式静电场轨道阱质谱 仪。 采 用 ProSwift RP-10R 50 mm x1 mm 内径色谱柱进行实验时配合使用 Thermo ScientificM lo n Max加热电喷雾离子 源,喷雾电压为4KV,鞘气和辅助气流速分别为15和5个单位。 ) ( 其他实验均采用 Ther m o Scientific M NanoFlex离子源进行,离子源上配置15 cm 的 PicoTip喷雾 针 (New Objective,Woburn, US A ; 20 pm 内径,360 pm 外 径 ,10pm针尖), 流 速为1pL/min, 电压为1.5KV。 ) ( 详细方法设置见表3。 ) 完整单克隆抗体 还原型单克隆抗体 自上而下 AIF 5-plex 目标离子二级质谱 抗体酶切物 方法类型 全扫描 全扫描(分2段) 全扫描 -AIF 目标离子二级质谱 全扫描-前10个高能碎裂裂解 总运行时间 30 min 0-15.8/15.8-30 min 25 min 25 min 40 min 扫描范围 m/z 1800-5000 800-3500/700-2500 300-2500 固定首个质量数300 350-2000 分辨率(一级/二级质谱) 17,500/x 140,000/17,500 70,000 n.a./70,000 70,000/17,500 全扫描 AGC 3.00×10° 3.00×10° 3.00×10° 5.00×10° 3.00×10°(MS)/1.00×10(MS) 最大注入时间 150 ms 150 ms/200 ms 150 ms 150 ms 100 ms/100 ms 隔离窗 n.a. n.a. n.a. 10 Th 2 Th 微扫描 10 5 5 5 1 毛细管温度 275℃ 275℃ 275℃ 275℃ 275℃ S-lens RF值 80 80 50 50 50 SID [eV 80 0/60 n.a. LC O/HC 20 n.a. NCE[%] n.a. n.a. 10-30 10-30 25 源内CID 源内 CID (SID)是一个DC 补偿参数(0-100eV),通常加在源内DC补偿电压上。源内DC补偿电压由三个电压组成:毛细管 DC, S-lens DC 和 S-lens 的出口透镜。通过设置源内 CID 参数来应用 DC 补偿电压,应用该电压会导致多极杆进样池内的分析物与仪器离子源区域残留的气体分子发生碰撞。 全离子裂解 全离子裂解(AIF)是裂解模式的一种,源内产生的所有离子由质谱仪的离子光学组件引导,在 C-trap 内累积,然后一起送入高能裂解池进行裂解。在这种情况下,四极杆的设置并不是选择某一特定母离子,而是采用所有离子均通过的模式(RF-only)。在分析完整蛋白时,这是一种非常有用的方法,因为不同电荷态往往有不同的裂解模式,因此并不容易预测哪一种模式最好。 数据分析 采用 Thermo Scientific M Protein DeconvolutionTM软件2.0版对一级质谱图进行去卷积。分辨率为17500时得到的完整抗体和完整重链质谱图,用ReSpect TM 算法去卷积。分辨率为140000时获得的完整轻链质谱图和分辨率为70000时得到的自上而下的谱图用 Xtract 算法去卷积。为了鉴定完整抗体和还原后的完整重链的糖型,我们将已知各种常见糖型组合的分子量与测定分子量进行比较。 采用Thermo Scientific Qual BrowserM仪器中的 Xtract 算法对自上而下的 HCD 和 AIF质谱图去卷积。使用 ThermoScientific ProSightPCM软件3.0版本的单个蛋白质模式对碎片离子进行归属,碎片离子质量误差设为 5ppm。 采用 Thermo Scientific Proteome Discoverer软件1.4版本 SEQUEST算法对胰蛋白酶酶切物的数据进行检索分析。 数据库由三种蛋白组成:胰蛋白酶、轻链和重链的两个异构体(在219位为 Ala 或者 Val)。母离子质量误差设为10 ppm,碎片离子的质量误差设为20 mmu。考虑四个可变修饰:烷基化(半胱氨酸)、氧化(甲硫氨酸)、脱酰胺(天冬酰胺,谷氨酰胺)、谷氨酰胺转换为焦谷氨酸,和N,N-二甲基化(赖氨酸)(仅与胰蛋白酶自酶切产物鉴定相关)。 结果与讨论 利妥昔单抗是拮抗 CD20 蛋白的 IgG1类单克隆抗体,由两条轻链(213个氨基酸)和两条重链(451个氨基酸)组成。轻链和重链通过12个链内和4个链间的二硫键连接(图1)。在该抗体两个重链的Asn31 处有糖链结构。连接的糖链组成和长度是变化多端的,从而导致该分子具有微观异质性。作为一种生物药,保持不同糖结构的种类和相对丰度是发挥抗体疗效必不可少的。附着在抗体上的常见糖的命名如图2所示。 图1.人源IgG1 属的单克隆抗体利妥昔的分子结构示意图 图2.抗体上常见的糖链结构的命名 图3显示的是用250×0.2 mm 内径整体柱分析20 ng 利妥昔抗体得到的一级质谱图。在 m/z 1800-5000范围内采集的质谱图显示了大分子蛋白质的典型电荷分布。插图显示的是 m/z 3269 时,放大的最大丰度电荷态(z=+45),其很好地描绘了完整抗体4个丰度最高的糖型。 理论值 147,074.985 147.237.126 147,399.267 147,561.408 147.723.549 Appm -6.7 -4.1 -1.7 -2.0 11.8 图4.利妥昔抗体去卷积的质谱图和不同糖型归属(上图),5个最强丰度糖型的理论质量数和测定质量数的对比(表) 为了获得完整抗体的一级谱图,我们对源内 CID 的设置参数进行了优化。该参数对获得高质量的谱图至关重要。 对于大多数蛋白质来说,源内CID一般在25%-90%较为适合,对于这个样品来说,最优设置为 80% SID。 图5.在不同 SID 设置条件下,1ng完整利妥昔抗体的一级质谱图 表4显示的是轻链、非糖基化重链和完整抗体的计算质量数,分别从轻链的213和重链的451位氨基酸开始逐步计算。两个蛋白序列都包含的N-末端谷氨酰胺应会被修饰为焦谷氨酸,这将导致质量数丢失 17.0265 Da。此外,重链中C-末端赖氨酸有可能被切掉,导致质量数丢失128.09497 Da。 在构成完整抗体时,形成16个二硫键会丢 失32个质子。两条重链上携带的糖链导致其质量数将会增加1217.1-2352.1 Da。两条重链上可以携带不同的糖链,从而形成混合组成物,例如 G01/G2F。各个糖链的化学组成和质量数列在表5中。用于计算表4和表5中分子量的元素的单同位素和平均原子质量列于表6中。 表4.分别对带有不同修饰及不同糖型的利妥昔单克隆抗体的轻链和重链进行化学组成分析以及单同位素分子量和平均分子量的逐步计算。图4、图6和图7的蓝色格子显示了检测到的分子量。 元素组成 碳 氢 氮 氧 硫 分子量(单同位素分子量) 分子量(平均分子量) G2F/G2FSA (HexNAc)8(Hex)10 (Fuc)2 SA 147 241 9 106 0 3828.37445 3830.5 G2F/G2FSA2 (HexNAc)8(Hex)10 (Fuc)2 (SA)2 158 258 10 114 0 4119.46986 4121.7 Sum 2×HC +2 xLC (4×pyroGlu,-2K) 6414 9896 1692 2006 44 144,127.20750 144,216.6 minus 32 S-S bond protons 6414 9864 1692 2006 44 144,094.95710 144,184.3 2HC+2LC -16 S-S bonds +(Man5)2 6506 10016 1696 2076 44 146,527.80282 146,618.5 2HC+2LC-16S-S bonds+(GOF)2 6526 10048 1700 2084 44 146,984.02484 147,075.0 2HC+2LC-16 S-S bonds+GOF/G1F 6532 10058 1700 2089 44 147,146.07766 147,237.1 2HC+2LC-16 S-S bonds + GOF/G2F or (G1F)2 6538 10068 1700 2094 44 147,308.13049 147,399.3 2HC+2LC-16 S-S bonds +G1F/G2F 6544 10078 1700 2099 44 147,470.18331 147,561.4 2HC+ 2LC-16 S-S bonds + G2F/G2F 6550 10088 1700 2104 44 147,632.23613 147,723.5 2HC+2LC-16 S-S bonds +G1F/G2F SA 6555 10095 1701 2107 44 147,761.27872 147,852.7 2HC+2LC-16 S-S bonds + G1F/G2F(SA)2 6566 10112 1702 2115 44 148,052.37414 148,143.9 2HC+2LC-16 S-S bonds +G2F/G2F SA 6561 10105 1701 2112 44 147.923.33155 148,014.8 2HC+2LC -16 S-S bonds + G2F/G2F (SA)2 6572 10122 1702 2120 44 148,214.42696 148,306.1 表5.单糖的化学组成和分子量 分子式 单同位素分子量 平均分子量 碳 氧 氮 氢 液酸 C0NH 291.09542 291.3 11 8 1 17 半乳糖 C0,H10 162.05282 162.1 6 5 0 10 N-乙酰葡萄糖安 C.O,NH 203.07937 203.2 8 5 1 13 甘露糖 C,0,H10 162.05282 162.1 6 5 0 10 岩藻糖 C0H10 146.05791 146.1 6 4 0 10 表6.用于计算表4和表5分子量的元素的单同位素原子量和平均原子量 单同位素质量 平均质量 碳 12.0000000 12.01074 氢 1.00782503 1.00794 氮 14.0030740 14.00674 氧 15.9949146 15.99940 硫充 31.9720707 32.06608 最初的计算是根据发表在 DrugBank 数据库【2】的序列进行的,然而计算结果与我们实验测得的质量数并不匹配。通过将 DrugBank 中的序列与之前文献发表过的序列【3】进行比对,发现位于重链保守区域219位上的一个氨基酸不同,是丙氨酸而不是缬氨酸。使用219位为丙氨酸的序列的计算结果可以与完整蛋白质量数测定的结果以及先前报道的结果完全吻合【4】。为了进一步确认这点,我们进行了一系列的补充实验。 将抗体原后(无烷基化),采用设置不同分辨率的方法分析已分离的轻链和重链,来观察在此分子量下能否实现同位素解析。由于轻链分子量较小,有可能得到同位素解析谱图,而重链无法得到,因为重链质量是轻链 质量的两倍。若要采用不同的分辨率设置,方法设置分为两个阶段(从0-15.8 min 分辨率设为140K,从15.8-30min 分辨率设为17.5K)。通过优化梯度,实现轻链和重链的色谱峰完全分离。 在这项研究中,我们评价了两种整体柱 ( PepSwift 250 mm×0.2 mm 内径和 ProSwift RP-10R 50 mm x 0.1 mm 内径),轻链和重链两峰分离的保留时间之差均可大于2min(图6)。分别对轻链和重链的质谱图(图6b和6c)去卷积。轻链的同位素解析质谱图用 Xtract 算法去卷积,得到了单一同位素分子量 23,025.3758 Da, 与计算分子量只差2.5 ppm。重链用 ReSpect 算法去卷积,产生三个峰,每一个峰代表一种主要的糖型,GOF, G1F 和 G2F(图7)。 图6.还原型利妥昔抗体的色谱图(A),轻链的一级全扫描质谱图(B)和重链的一级全扫描质谱图(C)。C中的插图显示的是电荷态 z=+25的放大图,三个峰代表三种不同的糖型。 图7.轻链和重链的去卷积结果。在分辨率140,000全扫描模式下获得轻链的质谱图,通过 Xtract 算法去卷积,得到准确的单同位素分子量和完整的同位素分布图(左图)。在17,500的分辨率下测得重链的质谱图,通过 ReSpect 算法去卷积,得到了平均分子量(右图)。 为了评价使用250×0.2 mm PepSwift 整体柱时仪器的检测限,采集了一系列进样量的 LC/MS 样品。将 50pg-20ng 的完整抗体从最低浓度开始注入色谱柱(图8)。在序列开始之前和各样品之间运行两针空白样品,以排除残留的影响。通过这种方法,我们发现完整抗体的最低检测限 是500 pg, 在进样量为500 pg的时候,仍然可以得到较好的谱图,从谱图上可以看到完整抗体中丰度最高的糖型。需要指出的是,最低浓度的样品必须现配,分析前不能在自动进样器中存放数小时。 图8.用250mmx0.2 mm PepSwift 整体柱分析完整的利妥昔抗体,上样量为-20 ng-500pg 一系列稀释浓度得到的一级全扫描质谱图。 在50mm×1 mm 内径 ProSwift 整体柱上,进样量为 30 ng和150 ng 的时候,完整抗体都可以得到高质量的谱图(图9), 根据30ng的上样量,我们预测最低进样量在5 ng-10 ng 之间,在此范围内仍然可以得到优质的谱图。 图9.用50mm×1 mm ProSwift 整体柱分析完整的利妥昔抗体,上样量分别为150 ng 和30 ng时的一级全扫描质谱图(左侧)和最高丰度电荷态放大图(右侧)。 接下来,我们试图进一步确认轻链和重链的序列,进行了两类自上而下的实验:在HCD池中进行全离子裂解(AIF),或选择轻链和重链的5个电荷态进行多重(5-plex)目标离子二级质谱实验。所有谱图都是在分辨率为70000下采集。目标离子谱图的采集使用基于保留时间的质量数列表,包括先流出的轻链质荷比(保留时间 13.16 min:m/z 1536.96、1646.6、1773.3、1920.7、2095.4)和后流出的重链(保留时间16-20min: m/z1584.6、1635.7、1684.7、1748.5、1810.9)。在这类实验中,内含物列表中的第一个电荷态被选择并送到 HCD 池中进行裂解,子离子储存在 HCD 池中,同时分离第二个电荷态送到 HCD池,裂解并贮存在该池中,直到第5个电荷态被裂解。5个单独分离和裂解步骤产生的所有离子被一起送到 Orbitrap 分析器中,产生一个单一的碎片离子谱图。 所有归为轻链的碎片离子(如图10所示)在N-和C-末端都有好的覆盖率,在序列的中间也有一些碎片离子匹配,最终的覆盖率为28%,占理论碎片的15%。对于重链来说,两种方法的裂解效率都不是特别好,约产生20个碎片离子,大多数都位于序列的末端。 为了进一步确认序列,采取了自下而上的方法,将蛋白进行还原、烷基化、并用胰蛋白酶进行酶切。图11显示的是酶切后肽段混合物的色谱图。对数据进行数据库检索,数据库由轻链、两个重链变异体以及胰蛋白酶四个条目组成,结果显示轻链的序列覆盖率达96%,重链的序列覆盖率达78.8%(图12)。两个来自轻链的、较短的、没有检测到的肽段(LEIK 和EAK)只能在一级质谱图中以完整质量数的形式检测到,而肽段EAK 可以根据含漏切位点的肽段 EAKVQWK 所对应的准确质量数进行鉴定。综合二级谱图鉴定的肽段和完整短肽的准确质量数,轻链的序列覆盖率是100%。 图10.根据通过 AIF 实验得到的碎片离子匹配利妥昔抗体轻链的序列覆盖率。鉴定到17个b离子和50个y离子, 对应15.7%的理论碎片离子数。Lo(426个理论碎片离子中鉴定到67个离子) 图11.将利妥昔抗体还原、烷基化、胰蛋白酶切后,酶切后肽段的基峰色谱图。 图12.妥妥昔单抗轻链和重链的氨基酸序列。黑色字母显示的氨基酸代表通过二级质谱图鉴定到的部分。 绿色显示的序列是仅通过完整肽段一级全扫描数据鉴定定的。红色显示的是重链部分的两个氨基酸(AK),他们既不能用一级也不能用二级质谱鉴定到。对于轻链来说,最终的序列覆盖率是100%(二级质谱鉴定覆盖率是96%),对于重链来说是99.5%(二级质谱鉴定的覆盖率是98.8%)。重链中天天酰胺301表示糖基化位点。 对于重链,也可以根据完整肽段的准确质量数鉴定肽段GQPR。最后,根据二级谱图,含糖基化位点 Asn3的肽段没有鉴定到其未糖基化的形式。而对其进行基于理论糖基化修饰的数据库检索则很成功。此外,很容易在全扫描谱图中检测到糖肽,可以看到不同的糖基化形式和不同的电荷态。由于存在特征峰,二级谱图上也很容易看到。图13显示的是一个含 GOF 肽的谱图举例,显示了完整母 离子和用 HCD 裂解糖肽得到的典型裂解类型:质量数为204的 hexonium 离子 ( HexNAc)和质量数为366的离子(Hex-HexNAc)以及阶梯式碎片离子:己糖(m/z162)、N-乙酰基氨糖(203)和岩藻糖(146)。综合考虑基于所有肽段的一级全扫描和基于数据库搜索的二级质谱图,重链的序列覆盖率达99.5%,只有两个氨基酸(氨基酸343-344)没有检测到。 图13.糖肽氨基酸序列 297-305 (EEQYN*STYR, *=GOF) 的二级质谱图,其母离子是三价电荷。插图显示的是在全扫描质谱图中二价和三价母离子的同位素分布。 结论 在本研究中,我们提供一种新流程,结合快速色谱,利用两种规格的整体柱和高分辨 Orbitrap 质谱仪,对完整及还原利妥昔进行了分析,采用 AlF, Multiplexed HCD 自上而下的裂解,以及自下而上的分析方法进行序列验证。 即使抗体的上样量低至500 pg, 我们仍可以得到高质量的质谱图,该数据证明了 LC-MS 仪器的高灵敏度。此外,为了分析还原型单克隆抗体,我们采用色谱的方法将抗体的重链和轻链分开,设置不同的分辨率对其进行检测。 通过这个流程,我们可以测定完整抗体的分子量,对轻链和重链的氨基酸序列进行确认和验证,对该抗体不同糖基化形式的相对丰度进行鉴定和评价。 致谢 感谢 Daniel Purstinger 在样品制备过程中给予的帮助,感谢Remco Swart 提供本研究当中用到的 PepSwift 和 ProSwift 整体柱。感谢奥地利联邦经济、家庭、青年部和全国研发技术部提供的财政支持。 ( 1. Premstaller, A.; Oberacher, H. and Huber, C.G.High-Performance Liquid Chromatography- Electrospray lonization Mass Spectrometry of Single- and Double S tranded Nuc l eic Acids UsingMonolithic Capillary Columns. Anal. Chem. 2000, 7 2, 4386-4393. ) ( 2 . http://www.drugbank.ca/drugs/DB00073 ) ( 3. N ebija, D.;Kopelent-Frank, H.; Urban, E.; Noe, C. R. and Lachmann, B . Comparison of two-dimensional gelelectrophoresis patterns and MALDI-TOF MS a n alysisof therapeutic recombinant monoclonal antibodies trastuzumab a nd rituximab. Journal of Pharmaceutical and Biomedical Analysis, 2 011, 56, 6 84-91. ) ( 4 . Kuribayashi, R.; Hashii, N.; Harazono, A. and Kawasaki,N. Rapid evaluation for heterogeneities inmonoclonal a ntibodies by liquid chromatography/massspectrometry wi t h a column-switching system. Journal of Pharmaceutical and Biomedical Analysis, 2012,67-68,1-9. ) 免费服务热线:8008105118 ThermoFisherSCIENTIFIC 支持手机用户)AN 在本研究中,我们提供一种新流程,结合快速色谱,利用两种规格的整体柱和高分辨Orbitrap质谱仪,对完整及还原利妥昔进行了分析,采用AIF,Multiplexed HCD自上而下的裂解,以及自下而上的分析方法进行序列验证。即使抗体的上样量低至500pg,我们仍可以得到高质量的质谱图,该数据证明了LC-MS仪器的高灵敏度。此外,为了分析还原型单克隆抗体,我们采用色谱的方法将抗体的重链和轻链分开,设置不同的分辨率对其进行检测。通过这个流程,我们可以测定完整抗体的分子量,对轻链和重链的氨基酸序列进行确认和验证,对该抗体不同糖基化形式的相对丰度进行鉴定和评价。
确定

还剩10页未读,是否继续阅读?
赛默飞质谱分析为您提供《妥昔单克隆抗体中蛋白质检测方案(液质联用仪)》,该方案主要用于治疗类生物药品中含量测定检测,参考标准--,《妥昔单克隆抗体中蛋白质检测方案(液质联用仪)》用到的仪器有赛默飞Q Exactive Orbitrap LCMSMS系统
推荐专场
相关方案
更多
该厂商其他方案
更多
















