方案详情
文
十二烷基硫酸钠毛细管电泳法 (CE-SDS) 是中国药典 2015 版附录收载的单克隆抗体药物纯度表征方法,其相对于聚丙烯酰胺凝胶电
泳法 (SDS-PAGE) 具有更快的分析速度、更好的分离度、更优越的重现性和更准确的定量,且更加自动化。CE-SDS 方法能够完成SDS-PAGE 方法不能完成的针对非糖基化重链的定量分析。
通过与商品化试剂盒的对比,证明该方法能够有效的分离还原单克隆抗体的非糖基化重链和重链,具有良好的重现性和定量准确性,且价格低廉,简便易行。
方案详情

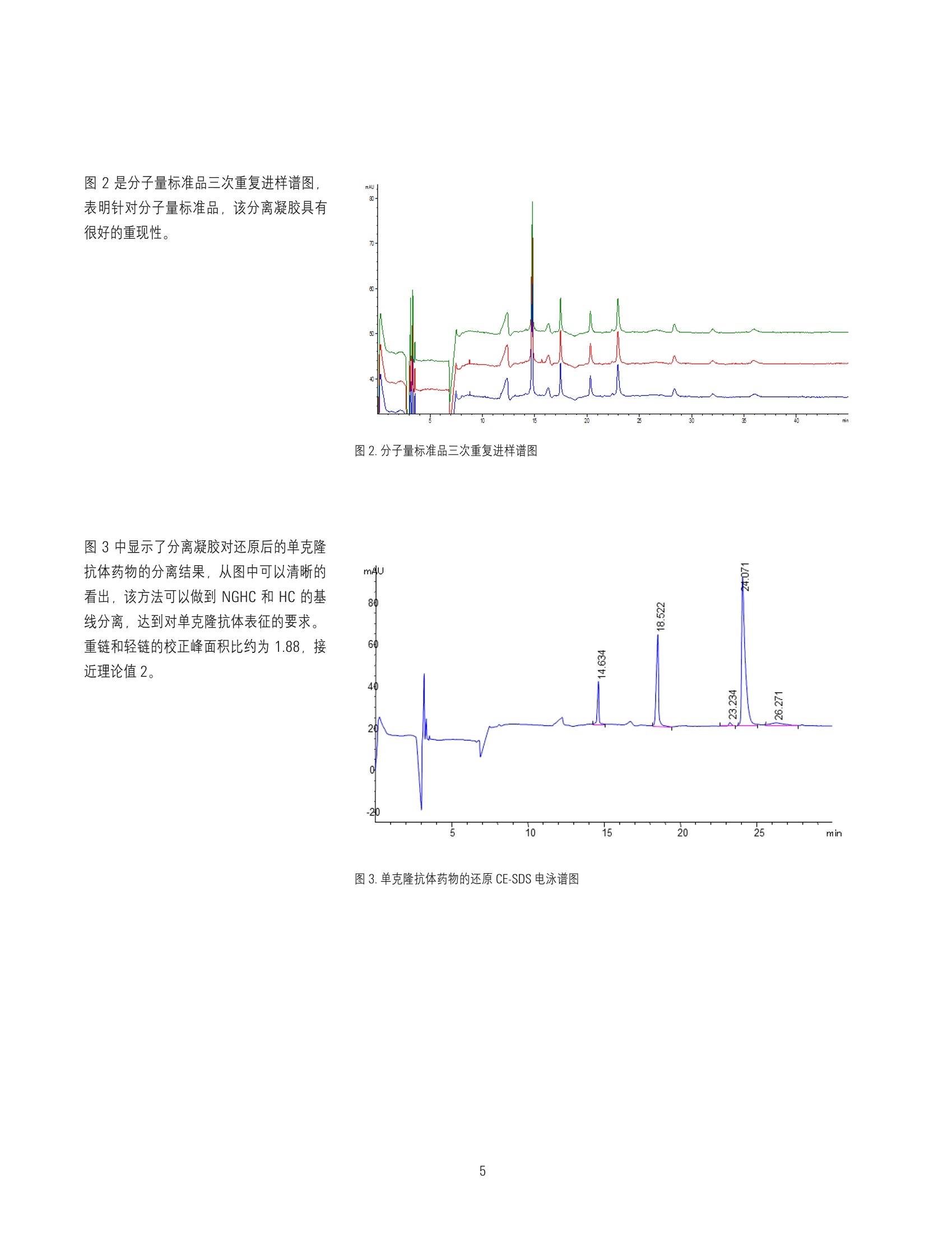
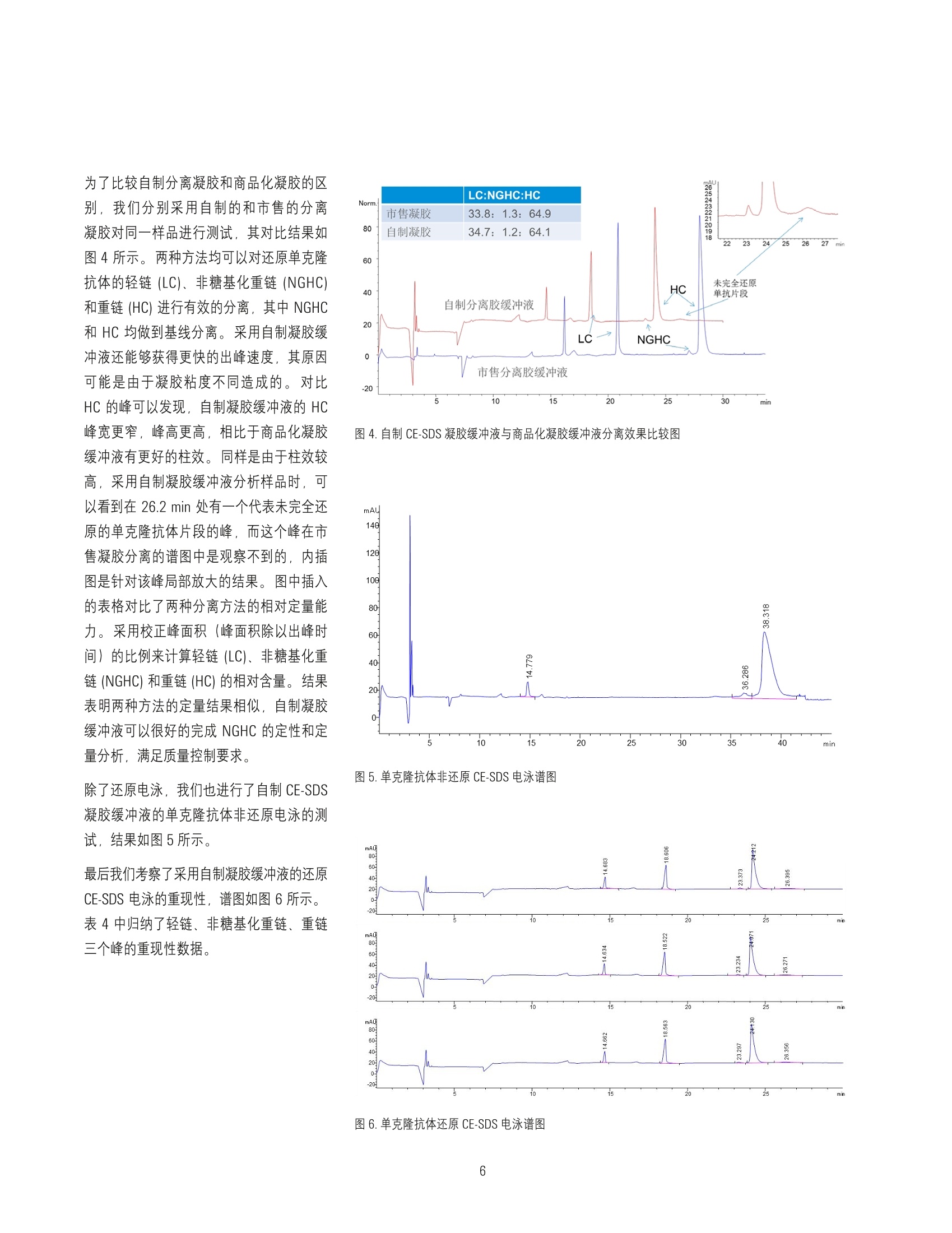
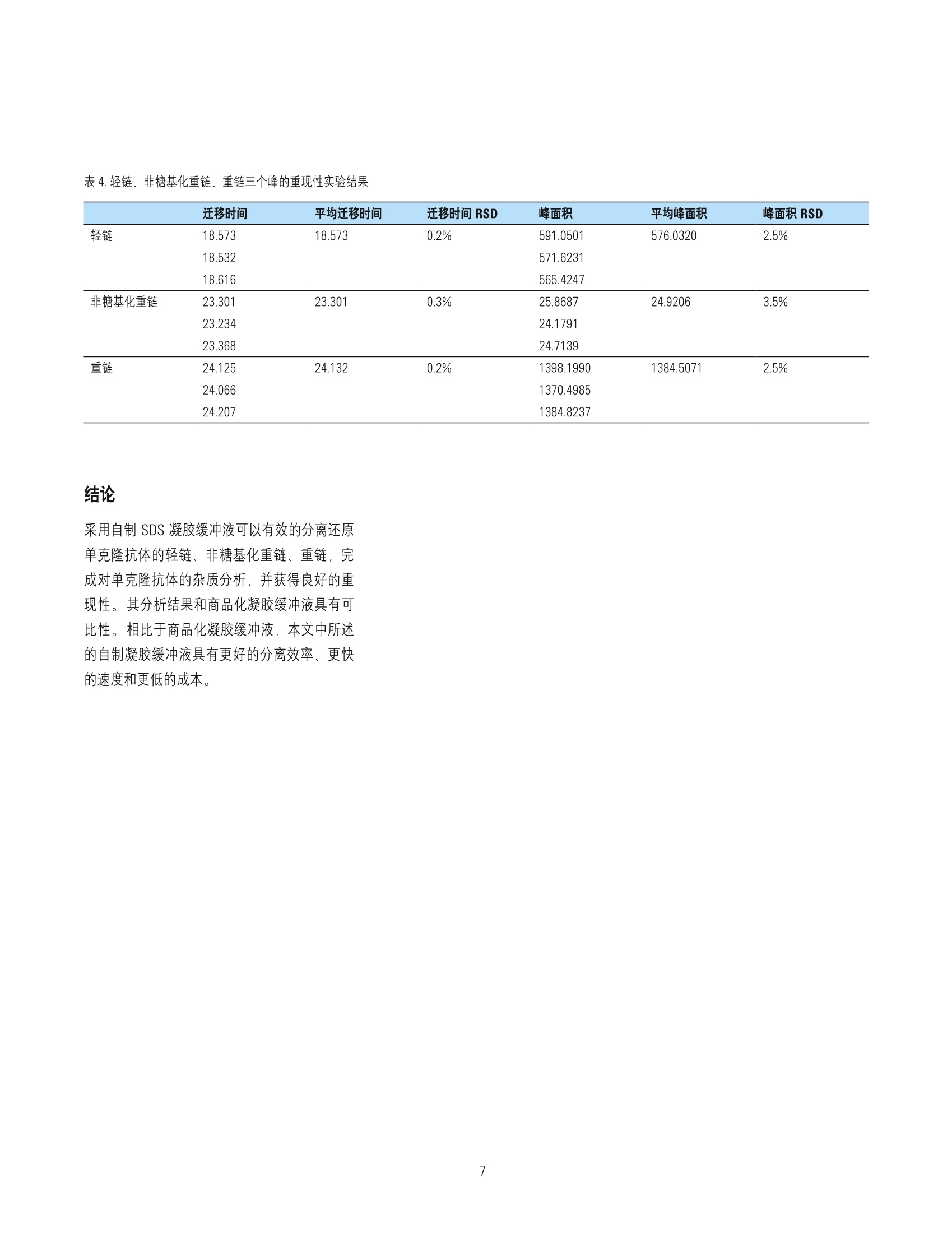
在Agilent 7100 毛细管电泳系统上采用实验室自制凝胶缓冲液分析市售单克隆抗体药物的纯度 应用 生物制药 作者 摘要 窦鹏,孟颖安捷伦科技(中国)有限公司 本实验采用 Agilent 7100 毛细管电自系统和自制凝胶缓冲液进行市售单克隆抗体药物分析。实验结果表明,该方法可以出色的完成对治疗性单克隆抗体药物的非糖基化重链的分析,且重现性良好。采用该方法可代替商品试剂盒进行单克隆抗体纯度测定,且分析时间更短,运行成本更低。 Agilent Technologies 前言 治疗性单克隆抗体药物是目前生物制药领域的热点,相对于小分子药物,单克隆抗体药物的分子结构复杂性更高且更易受生产过程影响,因此对其理化性质进行全面而系统的解析成为生物制药(尤其是生物仿制药)的重中之重。毛细管电泳技术在单克隆抗体药物表征过程中具有广泛的应用,包括抗体的纯度/杂质、等电点、电荷异质性、糖基化等方面的分析。,十二烷基硫酸钠毛细管电泳法 (CE-SDS) 是中国药典2015版附录收载的单克隆抗体药物纯度表征方法,其相对于聚丙烯酰胺凝胶电泳法 (SDS-PAGE) 具有更快的分析速度、更好的分离度、更优越的重现性和更准确的定量,且更加自动化。 CE-SDS 方法能够完成 SDS-PAGE 方法不能完成的针对非 糖基化重链的定量分析。 目前 CE-SDS方法普遍采用商品化凝胶缓冲液,分析成本较高。在本文中介绍了一种可以用于 Agilent 7100 毛细管电泳系统的自制 CE-SDS 分离缓冲液来分析市售单克隆抗体。该方法采用亲水性高分子作为筛分介质,根据分子量大小对 SDS 处理的蛋白质进行分离,符合2015版中国药典对于 CE-SDS分离方法的要求。 通过与商品化试剂盒的对比,证明该方法能够有效的分离还原单克隆抗体的非糖基化重链和重链,具有良好的重现性和定量准确性,且价格低廉,简便易行。 实验部分 仪器 Agilent 7100毛细管电泳系统,配置 4bar氮气钢瓶。 毛细管(PN: G1600-63211):内径:50 um, 总长度: 33cm, 有效长度:24.5 cm 试剂 表1.实验所用试剂列表 试剂 来源 备注 葡聚糖T-2000 Biosharp 分子量:2000000 (pharmacia 17-0330-01) 甘油 国药 分析纯 Trizma Base Sigmaaldrich T-1503 硼酸 天津光复 分析纯 EDTA 国药 分析纯 二硫苏糖醇 Sigmaaldrich 43815 碘乙酰胺 Sigmaaldrich -1149 样品制备 取单克隆抗体药物样品2pL于 200 pL PCR 管中, 加入 5uL 500mM DTT (还原电泳)或5 pL 250mM IMA(非还原电泳), 93 pL 100mM Tris-HCI (1%SDS)。涡旋混匀,在70°℃水浴中加热 10min,常温水浴冷却到室温。移取处理后样品 90 pL, 加入 250 pL样品瓶中待测。 SDS 凝胶缓冲液配置 称取 0.7266 g Trizma Base 和 0.3710g硼酸,加入9mL去离子水中,完全溶解后加入20 mg SDS、1g 葡聚糖、14.6mg EDTA和1mL甘油。搅拌直至完全溶解,静置过夜,即可得到 SDS 缓冲溶液。 样羊缓冲液配置(100 mM Tris-HCI, 1% SDS) 称取 101mg Trizma base、15.2mg Trizma hydrocholoride、 0.1g SDS, 加入10mL 去离子水,配置成 10mL样品缓冲溶液。 样品瓶位置 表2.样品瓶放置位置表 位置 试剂 体积(mL) 备注 1 0,1NNaOH 1.4mL 碱液冲洗 2 0.1NHCI 1.4mL 酸液冲洗 3 去离子水(冲洗) 1.4mL 水冲洗 4 废液 0.6mL 酸、碱、水冲洗废液 5 废液 0.6mL SDS胶冲洗废液 6 去离子水(洗电极) 1.6mL 清洗电极外壁 7 去离子水(洗电极) 1.6mL 清洗电极外壁 8 SDS凝胶缓冲液(冲洗) 1.4mL SDS凝胶缓冲液冲洗 User1* SDS凝胶缓冲液 1.2mL SDS凝胶缓冲液分离 User2* SDS凝胶缓冲液 1.2mL SDS凝胶缓冲液分离 *SDS分离缓缓冲液每8次分离更换,所有溶液需要每天更换。 毛细管预处理方法 10分钟 2bar高压冲洗 (high pressure flush), 0.1 N NaOH; 5分钟2bar 高压冲洗 (high pressure flush), 0.1 N HCI; 2分钟 2bar高压冲洗 (high pressure flush), 水; 10分钟 4bar 高压冲洗 (high pressure flush), SDS胶缓冲溶液; 加-16.5 kV 电压平衡10分钟,电压上升时间为5分钟。 CGE 分离方法 背景缓冲液 (BGE): 自制 SDS凝胶缓冲液或商品化缓冲液 毛细管:50pm 内径熔融石英毛细管,有效长度24.5 cm, 总长度 33 cmDAD检测波长:220nm, 4 nm 带宽 (Reference off) 采样频率:2.5Hz 进样模式:电动进样(-5kV进样20s) 分离电压:-16.5kV(升压时间:1min) 运行过程中进出口缓冲瓶压力:2bar 卡盒温度:25℃ 结果与讨论 首先我们测试了自制凝胶缓冲液对分子量标准品的分离结果、分子量线性响应和重现性。采用市售 SDS-MW试剂盒中分子量标准品测试分离凝胶对 SDS-蛋白质复合物的分离效果,谱图如图1所示。右上角插图表明线性范围,拟合系数达到0.99。 分离条件 表3.毛细管电泳系统分离样品的实验条件 操作步骤 实验条件 分离前平衡 3分钟4bar高压冲洗, 0.1 N NaOH; 1分钟4bar高压冲洗,0.1 N HCl; 1分钟 4bar 高压冲洗,水; 10分钟 4bar高压冲洗, SDS 凝胶缓冲溶液; 进样 进/出口端沾洗。 电动进样:-5kV, 20s; 进口端沾洗。 分离 -16.5kV(升压时间:1min), 加电压的同时在进口和出口端同时施加 2 bar的 压力,卡盒温度25℃。 图1.自制 SDS 凝胶缓冲液对分子量标准品的分离电泳谱图,内插图是分子量计算的校正曲线 图2是分子量标准品三次重复进样谱图,表明针对分子量标准品,该分离凝胶具有很好的重现性。 图2.分子量标准品三次重复进样谱图 图3中显示了分离凝胶对还原后的单克隆抗体药物的分离结果,从图中可以清晰的看出,该方法可以做到 NGHC 和 HC的基线分离,达到对单克隆抗体表征的要求。重链和轻链的校正峰面积比约为1.88,接近理论值2。 图3.单克隆抗体药物的还原 CE-SDS电泳谱图 为了比较自制分离凝胶和商品化凝胶的区别,我们分别采用自制的和市售的分离凝胶对同一样品进行测试,其对比结果如图4所示。两种方法均可以对还原单克隆抗体的轻链(LC)、非糖基化重链 (NGHC)和重链 (HC)进行有效的分离,其中 NGHC和 HC均做到基线分离。采用自制凝胶缓冲液还能够获得更快的出峰速度,其原因可能是由于凝胶粘度不同造成的。对比HC 的峰可以发现,自制凝胶缓冲液的 HC峰宽更窄,峰高更高,相比于商品化凝胶缓冲液有更好的柱效。同样是由于柱效较高,采用自制凝胶缓冲液分析样品时,可以看到在 26.2 min 处有一个代表未完全还原的单克隆抗体片段的峰,而这个峰在市售凝胶分离的谱图中是观察不到的,内插图是针对该峰局部放大的结果。图中插入的表格对比了两种分离方法的相对定量能力。采用校正峰面积(峰面积除以出峰时间)的比例来计算轻链(LC)、非糖基化重链(NGHC)和重链(HC)的相对含量。结果表明两种方法的定量结果相似,自制凝胶缓冲液可以很好的完成 NGHC 的定性和定量分析,满足质量控制要求。 除了还原电泳,我们也进行了自制 CE-SDS凝胶缓冲液的单克隆抗体非还原电泳的测试,结果如图5所示。 最后我们考察了采用自制凝胶缓冲液的还原CE-SDS 电泳的重现性,谱图如图6所示。表4中归纳了轻链、非糖基化重链、重链三个峰的重现性数据。 图4.自制 CE-SDS 凝胶缓冲液与商品化凝胶缓冲液分离效果比较图 图5.单克隆抗体非还原 CE-SDS电泳谱图 表4.轻链、非糖基化重链、重链三个峰的重现性实验结果 迁移时间 平均迁移时间 迁移时间 RSD 峰面积 平均峰面积 峰面积RSD 轻链 18.573 18.573 0.2% 591.0501 576.0320 2.5% 18.532 571.6231 18.616 565.4247 非糖基化重链 23.301 23.301 0.3% 25.8687 24.9206 3.5% 23.234 24.1791 23.368 24.7139 重链 24.125 24.132 0.2% 1398.1990 1384.5071 2.5% 24.066 1370.4985 24.207 1384.8237 结论 采用自制 SDS 凝胶缓冲液可以有效的分离还原单克隆抗体的轻链、非糖基化重链、重链,完成对单克隆抗体的杂质分析,并获得良好的重现性。其分析结果和商品化凝胶缓冲液具有可比性。相比于商品化凝胶缓冲液,本文中所述的自制凝胶缓冲液具有更好的分离效率、更快的速度和更低的成本。 Agilent Technologies 治疗性单克隆抗体药物是目前生物制药领域的热点,相对于小分子药物,单克隆抗体药物的分子结构复杂性更高且更易受生产过程影响,因此对其理化性质进行全面而系统的解析成为生物制药(尤其是生物仿制药)的重中之重。毛细管电泳技术在单克隆抗体药物表征过程中具有广泛的应用,包括抗体的纯度/杂质、等电点、电荷异质性、糖基化等方面的分析。十二烷基硫酸钠毛细管电泳法 (CE-SDS) 是中国药典 2015 版附录收载的单克隆抗体药物纯度表征方法,其相对于聚丙烯酰胺凝胶电泳法 (SDS-PAGE) 具有更快的分析速度、更好的分离度、更优越的重现性和更准确的定量,且更加自动化。CE-SDS 方法能够完成 SDS-PAGE 方法不能完成的针对非糖基化重链的定量分析。目前 CE-SDS 方法普遍采用商品化凝胶缓冲液,分析成本较高。在本文中介绍了一种可以用于 Agilent 7100 毛细管电泳系统的自制 CE-SDS 分离缓冲液来分析市售单克隆抗体。该方法用亲水性高分子作为筛分介质,根据分子量大小对 SDS 处理的蛋白质进行分离,符合 2015 版中国药典对于 CE-SDS 分离方法的要求。通过与商品化试剂盒的对比,证明该方法能够有效的分离还原单克隆抗体的非糖基化重链和重链,具有良好的重现性和定量准确性,且价格低廉,简便易行。
确定





还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《克隆抗体药物中纯度检测方案(毛细管电泳仪)》,该方案主要用于治疗类生物药品中含量测定检测,参考标准--,《克隆抗体药物中纯度检测方案(毛细管电泳仪)》用到的仪器有Agilent 7100 毛细管电泳系统
推荐专场
相关方案
更多
该厂商其他方案
更多