
观察2型糖尿病模型db/db小鼠胰岛β细胞的超微结构、胰岛素表达及数量变化,探讨β细
胞的病理改变与2型糖尿病病因的关系。 分别选取3、5、8月龄尾静脉空腹血糖高于10.1mmol/L,且肥胖的
db/db自发性糖尿病小鼠,每组8只,作为糖尿病组;选取相应年龄段尾静脉空腹血糖低于6.0mmol/L,体重正常
的db/+m表型正常小鼠,每组8只,作为对照组。于相应年龄段取胰尾,用于透射电镜观察、免疫组织化学观察
和图像分析。
方案详情

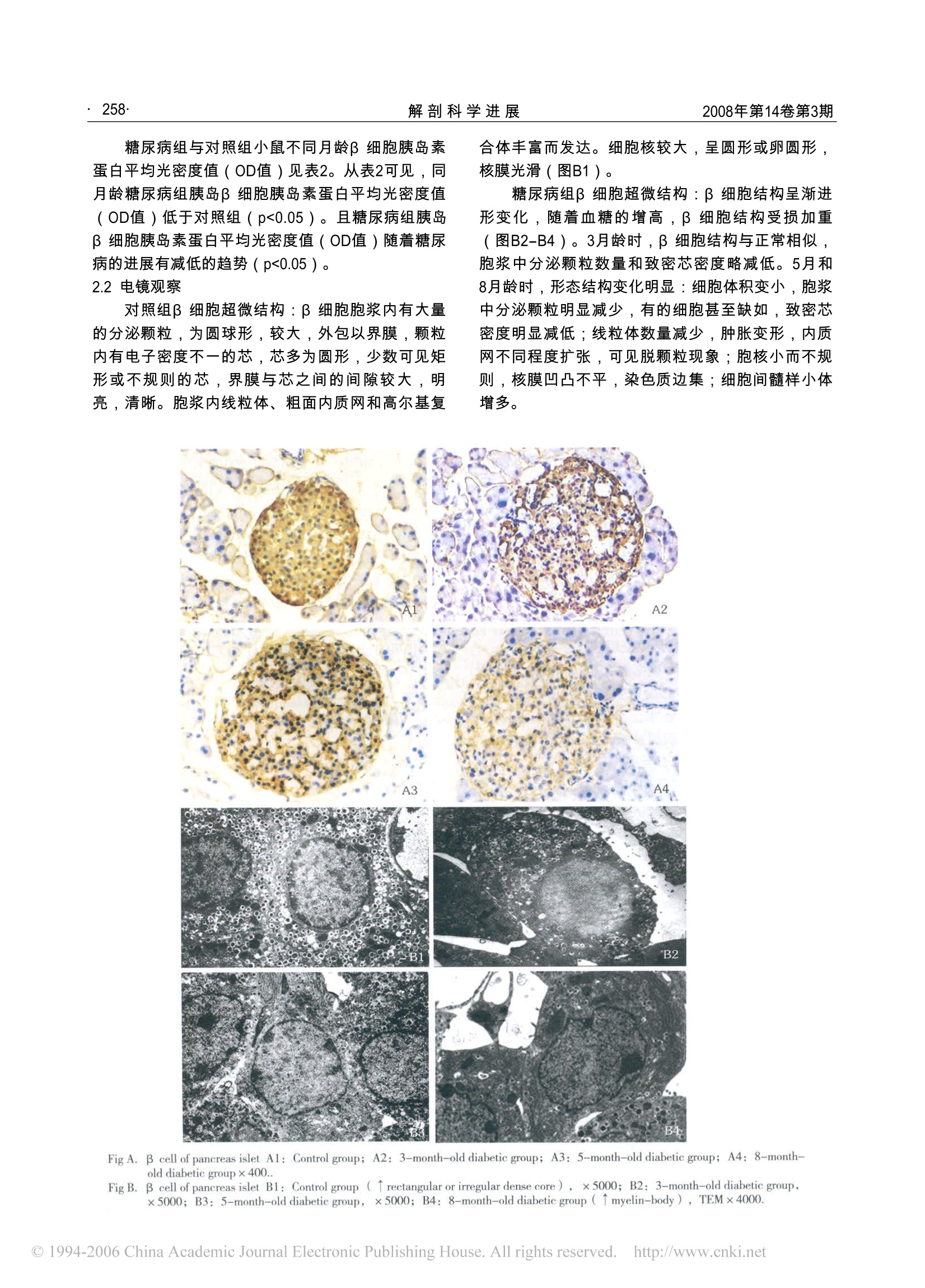
解剖科学进展 Progress of Anatomical Sciences 2008,14(3):256~259,262 张旭东等糖尿病小鼠胰岛β细胞结构的光镜和电镜研究·257·2008年第14卷第3期 糖尿病小鼠胰岛β细胞结构的光镜和电镜研究 张旭东,张雷,赵春芳 (1.长治医学院组织胚胎学教研室,山西长治046000;2.河北医科大学组织胚胎学教研室,河北石家庄050017) 【摘要】目的 观察2型糖尿病模型db/db小鼠胰岛β细胞的超微结构、胰岛素表达及数量变化,探讨β细胞的病理改变与2型糖尿病病因的关系。方法 分别选取3、5、8月龄尾静脉空腹血糖高于10.1mmol/L,且肥胖的db/db自发性糖尿病小鼠,每组8只,作为糖尿病组;选取相应年龄段尾静脉空腹血糖低于6.0mmol/L,体重正常的db/+m表型正常小鼠,每组8只,作为对照组。于相应年龄段取胰尾,用于透射电镜观察、免疫组织化学观察和图像分析。结果 电镜下随病情进展, db/db小鼠胰岛β细胞内的分泌颗粒数量明显减少,有的细胞甚至缺如,致密芯电子密度降低,β细胞可见凋亡的早期改变以及细胞核和细胞器的病理改变,细胞间髓样小体增多。免疫组织化学显示同月龄糖尿病组小鼠胰岛β细胞阳性率和胰岛素蛋白平均光密度值(OD值)低于相应对照组(p<0.05),且随着病程的进展, db/db小鼠胰岛β细胞阳性率和胰岛素表达呈现递减趋势(p<0.05)。结仑2型糖尿病β细胞的超微结构遭到破坏,引起β细胞合成分泌胰岛素障碍和数量减少,与2型糖尿病病情的轻重有关,反映了2型糖尿病病程不同阶段的病机特点。 【关键词】 2型糖尿病;β细胞;胰岛;超微结构;免疫组织化学;小鼠 【中图分类号】R587.1 R361+.3 【文献标识码】A 【文章编号】1006-2947(2008)03-0256-04 The Structure of Pancreatic Islet B Cells in Diabetic Mice by LM and TEM ZHANG Xu-Dong', ZHANG Lei', ZHAO Chun-Fang (1. Department of Histology and Embryology, Changzhi Medical College, Sanxi Changzhi 046000;2. Department of Histology andEmbryology, Hebei Medical University, Hebei Shijiazhuang 050017 China) 【Abstract】Objective To observe and analyze the ultrastructure and insulin expression changes in pancreatic isletbeta cells of spontaneous db/db diabetic mice as the disease developed, and explore their relationship with pathogeny of type2 diabetes mellitus(T2DM). Methods 3,5, 8 month-old obese db/db mice with fasting blood glucose(FBG)more than10.0mmol/L were selected(24mice), the age-matched normal weight db/+m mice with FBG less than 6.0mmol/L as thecontrol group(24mice). The tails of pancreas were excised and observed by light microscope (LM) and transmission electronmicroscope (TEM). Results The number of secretory granules in beta cell cytoplasm of db/db mouse was significantlydecreased or absent, and the electron-density of dense core in the secretory granule decreased as well, with early apoptosisand pathologic changes of nucleus and organelles and increased myelin-bodies between insular cells. The positive rates ofbeta cells and optical density average(OD) of insulin positive cells were significantly decreased in diabetic mice than incontrol mice(p< 0.05), with the decreased trend as the progress of the spontaneous diabetes. Conclusion Theultrastructural and quantitative changes of pancreatic islet beta cells in db/db diabetic mice cause synthesis and secretion dysfunction of insulin, which is related to the degree and different stages of 2-type diabetes mellitus. 【Key words】 type 2 diabetes mellitus; beta cell; pancreatic islet; ultrastructure; immunohistochemistry; mice 糖尿病是严重威胁人类健康的以慢性高血糖为特征的代谢性疾病,而2型糖尿病(T2DM)又占本病的95%,其发病机制多认为是由胰岛素抵抗和3细胞功能缺陷引起,而β细胞功能缺陷包括β细胞分泌胰岛素功能下降和细胞数量的减少。有关β细 ( 【收稿日期】2008-01-14 ) 胞功能缺陷的研究,多集中在检测β细胞各种功能指数,如:胰岛素释放实验、稳态模型、高血糖钳夹技术等间接评价β细胞功能方面[1]。而有关2型糖尿病自然病程中β细胞形态学研究的报道少见。本研究选用遗传性肥胖型2型糖尿病动物模型db/db小鼠为研究对象,观察该小鼠发病期间的β细胞超微 结构、胰岛素表达及数量变化,为探讨β细胞在T2DM发病机制中的作用和意义提供形态学依据。 1 材料和方法 1.1动物来源与分组 实验动物由河北医科大学组织胚胎学教研室提供。分别选取3、5、8月龄尾静脉空腹血糖高于10.1mmol/L,且肥胖的db/db自发性糖尿病小鼠,每组8只,作为糖尿病组;选取相应年龄段尾静脉空腹血糖低于6.0mmol/L,体重正常的db/+m表型正常小鼠,每组8只,作为对照组。每组取3只用于透射电镜观察,其余用于免疫组织化学观察和图像分析。 血糖测定:尾静脉取血,采用美国强生微型血糖仪测空腹血糖(FBG). 1.2免疫组织化学标本制备和SP法染色 于相应月龄,腹腔注射戊巴比妥钠麻醉,开胸,经左心室插管,同时剪开右心耳,先以生理盐水冲洗,再用4%多聚甲醛进行灌注固定,取胰尾组织,放于4%多聚甲醛液24小时,常规石蜡包埋,连续切片,厚度为6um,每隔20张取1片蜡带,裱于涂有APES的载玻片上,进行免疫组织化学染色。 小鼠抗人胰岛素单克隆抗体、SP试剂盒及DAB显色剂购自北京中杉金桥生物技术公司。 切片常规脱蜡至水。3%H202室温下孵育20min。92~100℃枸橼酸缓冲液 (pH6.0)微波炉内抗原热修复20min。冷却至室温。滴加正常山羊血清,37℃温箱湿盒内孵育30min。滴加小鼠抗人胰岛素单克隆抗体下(1:200),37℃温箱湿盒内孵育30min。滴加生物素化二抗(山羊抗小鼠)工作液,37℃温箱湿盒内孵育30min。滴加辣根过氧化物酶标记链酶卵白素工作液,37℃温箱湿盒内孵育30min。DAB显色。自来水冲洗,苏木精复染细胞核。常规脱水、透明,中性树胶封固。阴性对照用PBS替代一抗,其余步骤同上。 1.3电镜标本制备 用于电镜标本的动物用Karnovsky's固定液灌注 (方法同1.3之灌注方法),取胰尾组织,切成约1mm的小块,浸入Karnovsky's液中固定,经0.1MPBS充分冲洗,1%四氧化后固定,梯度酒精逐级脱水,100%酒精:丙酮(1:1)浸透,纯丙酮浸透,丙酮:树脂(1:1)混合液温箱过夜,纯树脂(815、812混合液)浸透, Epon812包埋,半薄切片用甲苯胺蓝染色,光镜观察以确定组织块中含有胰岛,修切组织块的大小适于超薄切片。超薄切片厚50nm, 载于200目上网上,经醋酸铀和柠檬酸铅电子染色后,日立Hitachi-7500型透射电子显微镜观察并摄片。 1.4图像分析 所有标本均在Motic Med 6.0数码医学图像分析系统内,在相同的放大倍数(200倍)7下,每个年龄段计数5只小鼠的胰腺,计数每张切片每个胰岛中切到核的胰岛细胞数,并计数β细胞数,算出β细胞所占的阳性百分比(阳性率),取其均值来代表相应β细胞的数量。以阳性β细胞染色的平均光密度值(OD值)来代表β细胞合成胰岛素的量。用SPSS(10.0)软件包进行统计学分析。集中趋势及离散趋势用均数±标准差描述,单因素两组间比较用t检验,多组间的比较用单因素设计的方差分析,检验水准为a=0.05。 2 结果 2.1胰岛素免疫组织化学染色 阳性反应产物位于胰岛β细胞浆内,棕黄色。对照组胰岛阳性细胞(β细胞)多位于胰岛中央,排列紧密,数量多,染色深(图A1)。糖尿病组胰岛阳性细胞(β细胞)随疾病的进展,在胰岛中的分布弥散,排列疏松,细胞数量明显减少,染色变浅(图A2-A4)。 糖尿病组与对照组小鼠不同月龄胰岛β细胞的数量见表1,同月龄糖尿病组胰岛β细胞数量少于对照组(p<0.05)。且糖尿病组胰岛β细胞数量随着糖尿病的进展有减少的趋势(p<0.05)。 3m 5m 8m F Diabetic group 58.01±6.98 51.26±6.66 43.93±6.43 20.992 0.000 Control group 72.41±5.69 72.35±5.68 72.04±4.37 0.014 0.986 ▲vs control group p<0.05 Table2. OD Values of insulin protein in B cell in diabetic and normal groups (n=5,X±s) 3m 5m 8m F Diabetic group 0.276±0.042^ 0.234±0.035^ 0.223±0.046^ 8.115 0.001 Control group 0.313±0.051 0.311±0.039 0.316±0.029 0.144 0.957 糖尿病组与对照组小鼠不同月龄β细胞胰岛素蛋白平均光密度值 (OD值)见表2。从表2可见,同月龄糖尿病组胰岛β细胞胰岛素蛋白平均光密度值(OD值)低于对照组 (p<0.05))o。且糖尿病组胰岛β细胞胰岛素蛋白平均光密度值(OD值)随着糖尿病的进展有减低的趋势(p<0.05). 2.2电镜观察 对照组β细胞超微结构:细胞胞浆内有大量的分泌颗粒,为圆球形,较大,外包以界膜,颗粒内有电子密度不一的芯,芯多为圆形,少数可见矩形或不规则的芯,界膜与芯之间的间隙较大,明亮,清晰。胞浆内线粒体、粗面内质网和高尔基复 合体丰富而发达。细胞核较大,呈圆形或卵圆形,核膜光滑(图B1)。 糖尿病组β细胞超微结构:β细胞结构呈渐进形变化,随着血糖的增高,β细胞结构受损加重(图B2-B4)。3月龄时,β细胞结构与正常相似,胞浆中分泌颗粒数量和致密芯密度略减低。5月和8月龄时,形态结构变化明显:细胞体积变小,胞浆中分泌颗粒明显减少,有的细胞甚至缺如,致密芯密度明显减低;线粒体数量减少,肿胀变形,内质网不同程度扩张,可见脱颗粒现象;胞核小而不规则,核膜凹凸不平,染色质边集;细胞间髓样小体增多。 Fig A. B [cell of pancreas islet A1: Control group; A2: 3-month-old diabetic group; A3: 5-month-old diabetic group; A4: 8-month-old diabetic groupx400.. Fig B.B cell of pancreas islet BI: Control group (Trectangular or irregular dense core), x5000; B2: 3-month-old diabetic group,x5000; B3: 5-month-old diabetic group, x5000; B4: 8-month-old diabetic group (Tmyelin-body), TEMx4000. 3 讨论 db/db小鼠是一种遗传性肥胖型糖尿病动物模型,在自然情况下发病,表现为不育、肥胖、多饮、多食,逐渐发展为严重的糖尿病,具有高血糖、高胰岛素血症、高甘油三酯血症、胰岛素抵抗等特征。该动物模型性能稳定,且与人类的2型糖尿病极为相似,是研究人类2型糖尿病及其并发症的良好动物模型。 正常糖耐量(NGT) 的维持是胰岛素分泌和胰岛素作用二者平衡的结果。理论上,无论胰岛素抵抗(IR)多么严重,只要β细胞能够分泌足够的胰岛素,就不会发生糖尿病(DM),只有当胰岛β细胞失代偿才会引起糖调节异常(IGR)并发展为DM,这种失代偿来源于β细胞功能受损,即β细胞结构改变引起的分泌功能异常和β细胞总量的减少[2,3,4]。本研究观察了3,5,8月龄db/db小鼠胰岛β细胞的超微结构、胰岛素表达和数量变化,发现同月龄比较,糖尿病组胰岛β细胞数量和OD值均低于对照组,且随着DM的进展逐渐降低。表明T2DM时β细胞数量减少,合成分泌胰岛素能力降低。从电镜观察也证明这一点,电镜下,β细胞结构呈渐进形变化,随着血糖的增高,β细胞结构受损加重,晚期胞浆中分泌颗粒明显减少,有的细胞甚至缺如,致密芯密度明显减低;我们还发现比较多的细胞呈现凋亡早期改变:β细胞体积变小,核染色质边集,核固缩,出现许多畸形细胞核,线粒体数量减少破坏,内质网扩张脱颗粒,这都提示细胞凋亡的发生和合成胰岛素能力下降。足够胰岛素量的维持需一定量的β细胞,也需β细胞合成分泌胰岛素的功能正常,上述结果表明,在T2DM时,随着糖尿病进展,β细胞结构破坏加重,分泌颗粒减少,引起其功能缺陷,合成和分泌胰岛素质量下降;其结构的破坏也造成β细胞凋亡增加,进一步加重了胰岛素分泌量的减少,两方面共同引起胰岛素的不足,造成β细胞功能缺陷,引起和加重DM。在T2DM期期,β细胞结构的进一步破坏也表明残存的胰岛β细胞胰岛素分泌能力可能降低。这也证明在晚期,为什么用药物不能有效控制血糖平衡,需要借助外源性胰岛素的原因。造成β细胞功能缺陷的机理至今不清,推测有几个方面原因:其一是β细胞先天存在缺陷。 通过临床观察和实验研究现已明确,T2DM从其最早的阶段包括糖耐量受损(IGT)及空腹血糖受损 (IFG),甚或在可测出的这些血糖变化之前的“糖尿病前期”就出现胰岛素释放动力学的障碍;其主要特征是对葡萄糖反应的胰岛素释放第一相丧失,随之而来的是逐渐加重的第二相胰岛素和总胰岛素分泌的受损。糖尿病易发人群的β细胞的分泌适应能力是有限的,在胰岛素抵抗或热量负荷对胰岛素释放要求增加时,就难以胜任。此外,即使轻度的高血糖也会严重影响胰岛素的分泌并减少胰岛素原的合成,从而使代谢所需的胰岛素进一步减少表明,在T2DM时,β细胞自身可能存在缺陷。随着疾病的进展,由于高血糖等不利因素的影响,β细胞的这种缺陷进一步加重,使残存的胰岛β细胞分泌能力进一步下降,自身凋亡增加,β细胞数量减少和分泌功能减低,共通引起胰岛素不足。β细胞分泌适应能力缺陷的机制至今不明,可能与β细胞存在先天缺陷有关,有待进一步研究。其二是后天因素造成β细胞功能缺陷。可能的机制包括: (1)高血糖对β细胞的毒性作用,在人体,高血糖能够抑制胰岛素的释放并增加胰岛β细胞凋亡,这种作用与葡萄糖浓度呈现一种剂量依赖的模式。动物实验中也观察到同样的现象。(2)高血脂对β细胞的毒性作用,高脂血症在T2DM发病机制中的地位日益得到重视, McGarry甚至在2002年提出了糖尿病是糖脂病的概念。胰岛细胞持续暴露于高水平的游离脂肪酸(FFA) 中将导致脂过负荷,引起β细胞凋亡。(3)胰淀粉样多肽 (IAPP)对β细胞的毒性作用, IAPP所形成的胰淀粉样物质的沉积是T2DM胰腺特征性的病理改变。尸检研究显示,T2DM患者胰岛内存在淀粉样物质的沉积,β细胞数量减少了40%~60%圈,提示IAPP可能是造成T2DM胰岛β细胞数量减少的原因。有研究发现IAPP还可能通过细胞氧化机制和脂蛋白摄取产生细胞毒效应。值得一提的是,高血糖和胰岛素抵抗能够增加IAPP的表达,能够进一步加重IAPP所引起的细胞凋亡。这些因素损害了β细胞的自身结构,导致β细胞凋亡和分泌功能下降或缺失。 总之,引起β细胞功能缺陷的因素很多,有遗传因素,也有环境因素,引起β细胞结构破坏的发生机理也多种多样,是综合作用的结果,其机制十分复杂。本研究提示β细胞结构损害是其功能缺陷的形态基础。它的破破程度直接与T2DM的发病和病情进展相关。保护β细胞是控制血糖和治疗DM的一个关键因素。 ( 【参考文献】 ) 实bFGF对血内内皮细胞损伤保护作用的同时,进一步探索aFGF, 尤其是MaFGF的作用与效能,也是很有必要的。在本实验中,通过人为施予电刺激损伤颈总动脉血管外壁,随着刺激时间的延长造成血管内皮细胞损伤,进而触发凝血过程,最终造成血管栓塞。实验证明:大鼠股静脉注射中等浓度的外源性MaFGF后,平均堵塞血管的时间明显延长,说明外源性MaFGF发挥了对血管内皮细胞一定的保护作用,并体现一定的量效关系,但其保护活性似乎要比原型aFGF弱,这与我们所做的MaFGF对乙醇所致大鼠颈动脉窦压力感受器神经末稍损伤有保护作用的实验结果颇相似,提示MaFGF对组织损伤的保护作用也许不依赖促有丝分裂活性。同时,实验结果也表明: MaFGF延长血栓形成的时间似乎没有肝素显著。这可能是由于肝素是凝血酶的抑制剂,而外源性MaFGF则通过与内皮细胞表面受体结合而发挥对创伤的保护作用,两者在作用方式和途径等方面很不同。 纵上所述,我们认为:肝素和外源性MaFGF的联合应用在抗凝治疗中有很强的互补性,外源性MaFGF通过直接与内皮细胞表面受体结合而保护内皮细胞免于或延缓致病因素损伤,或促进受损细胞的形态和功能恢复,更接近于“治本”,而且免除了aFGF促有丝分裂活性可能存在的促进机体内潜在肿瘤细胞生长或诱发机体细胞基因突变的担忧,有更好的临床应用前景。 ( 【参考文献】 ) ( (上接第259页) ) ( |1 1] Finegood DT, M c Arthur MD , Koj w ang D, et al. Bet a -cell ma s sdynamics in Zucker diabetic fatty rats. R o siglitazone prevents therise in net cell death[J]. Diabetes,2001,50:1021-1029. ) ( 2] Weir G C , La y butt DR, Kaneto H, e t a l. B - Ce l l ada p tation anddecompensation d u ring the pr o gression of di a betes[J].Diabetes,2001,50(1): S154-159. ) ( [3] C lark A, Jones LC, K o ning E, et al . D e creased insulin se c retion intype 2 d iabetes: a problem o f cellular m a ss or fu n ction?[J] . Diabetes, 2001,50(1): S169-171. ) ( [4] 卜石,杨文英,王昕,等.脂毒性对大鼠胰岛细胞凋亡的作用 ].中华糖尿病杂志,2004,12(6): 435-436. ) ( [1]胡世凤,黄巨恩,谢露,等.碱性成纤维细胞生长因子对大鼠动脉 血栓形成的影响J.广西医科大学学报,2004, (5):671-673. ) ( [2]黄巨恩,胡世凤,邓桂祥,等.碱性成纤维细胞生长因子对兔血液 凝固时间的影响[].中国药理学通报,2007,23(5):699-700. ) ( [3]谢露,胡世凤,郭维坚..一种简易的体内血栓形成动物模型的研 制[,广西医科大学学报,2003,20(60):974-975. ) ( [4]曹鉴平,胡志洁.低分子量肝素的研究进展[]。华西药学杂志, 2003,18(1):35-38. ) ( [5]黄全跃,赵水平.直接凝血酶抑制剂在急性冠状动脉综合症中的 应用[].中国动脉硬化杂志,2003,11(2):175-177. ) ( [6]高传玉.凝血酶、抗凝药物和急性冠状动脉缺血综合症J.河南 诊断与治疗杂志,2002,16(4):260-262. ) ( [7]王慧杰,黄巨恩.酸性成纤维细胞生长因子的基础与应用研究 [J].解剖学研究,2005,27(4): 308-311. ) ( [8] Payson R A,Canatan H,Chotani M A,et al.Cloning of two novel f ormsof h uman a c idic f i broblast g rowth factor (aFGF) mRNA[J]. Nu c leicAcids Res, 1993,21(3):489-495. ) ( [ 9] Forough R, Wang X, Martinez-Lemus L A, et a l . Cell-based anddirect gene Transfer-induced angiogenesis v i a a s e creted c h imericfibroblast growth factor-1 (sp-FGF-1) i n t h e c h ick c h orioallantoicmembrane (CAM) [J]. Angiogenesis, 2 0 03, 6(1): 4 7-54. ) ( [10 ] Lozano RM, Pineda-Lucena A, Gonzalez C, et al.1H NMRstructural characterization of a nonmitogenic,vasodilatory,ischemiaprotector a nd n e uromodulatory acidic fibr o blast grow t h facto r [J].Biochemistry,2000,39 (17):4982-4993. ) ( [11] Linder V, Lappi DA, Bair A, et al, R o le of f i broblast growth factorin vascular lesion formation[J]. Cir c Res , 1991, 68:106-1 1 3. ) ( [12] Lindner V, Majack RA, Reidy MA. Ba s ic fi b roblast growth factorstimulates e ndothelial r egrowth and p r oliferation i n d e nudedarteries[J]. J Clin Invest , 1990,85(6): 2 004-8. ) ( [13]黄巨恩,李校,胡世凤,等.酸性成纤维细胞生长因子对颈动脉窦损伤的保护及量效关系的探讨[].解剖科学进展,2005,11(1): 4-6. ) ( [5] Cerasi E. 胰岛素生成,胰岛素分泌及2型糖尿病:问题的核心在 于β细胞[].中华内分泌代谢杂志,2005,21(3):194-197. ) ( [6]朱波,薛耀明.胰岛β细胞凋亡在2型糖尿病中的作用研究进展 [J].广东医学,2005,26(5):709-711. ) ( [7] Biarnes M, Montolio M , Nacher V, et al. B- c ell death and mass insyngeneically t ransplanted islets exposed t o s hort- and long-termhyperglycemia[J ] . Diabetes, 2002,51:66-67. ) ( [ 8] Butler AE, J anson J , Bonner-Weir S, et al . Be t a-cell de f icit a n dincreased b eta-cell a poptosis i n humans wi t h type 2 dia b etes[J].Diabetes,2003,52:102-103. ) ◎China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
确定




还剩3页未读,是否继续阅读?
海德创业(北京)生物科技有限公司为您提供《糖尿病小鼠胰岛β细胞透射电镜观察》,该方案主要用于其他中--检测,参考标准--,《糖尿病小鼠胰岛β细胞透射电镜观察》用到的仪器有柠檬酸铅、醋酸双氧铀替代品(铅罐)、16%多聚甲醛溶液(EM电镜级别)/8%多聚甲醛溶液(EM电镜级别)
相关方案
更多
该厂商其他方案
更多











