
一般制备淀粉样蛋白的透射电镜标本时。
常会发生含碳铜网不能均匀和完全地吸附样本溶液的情况,
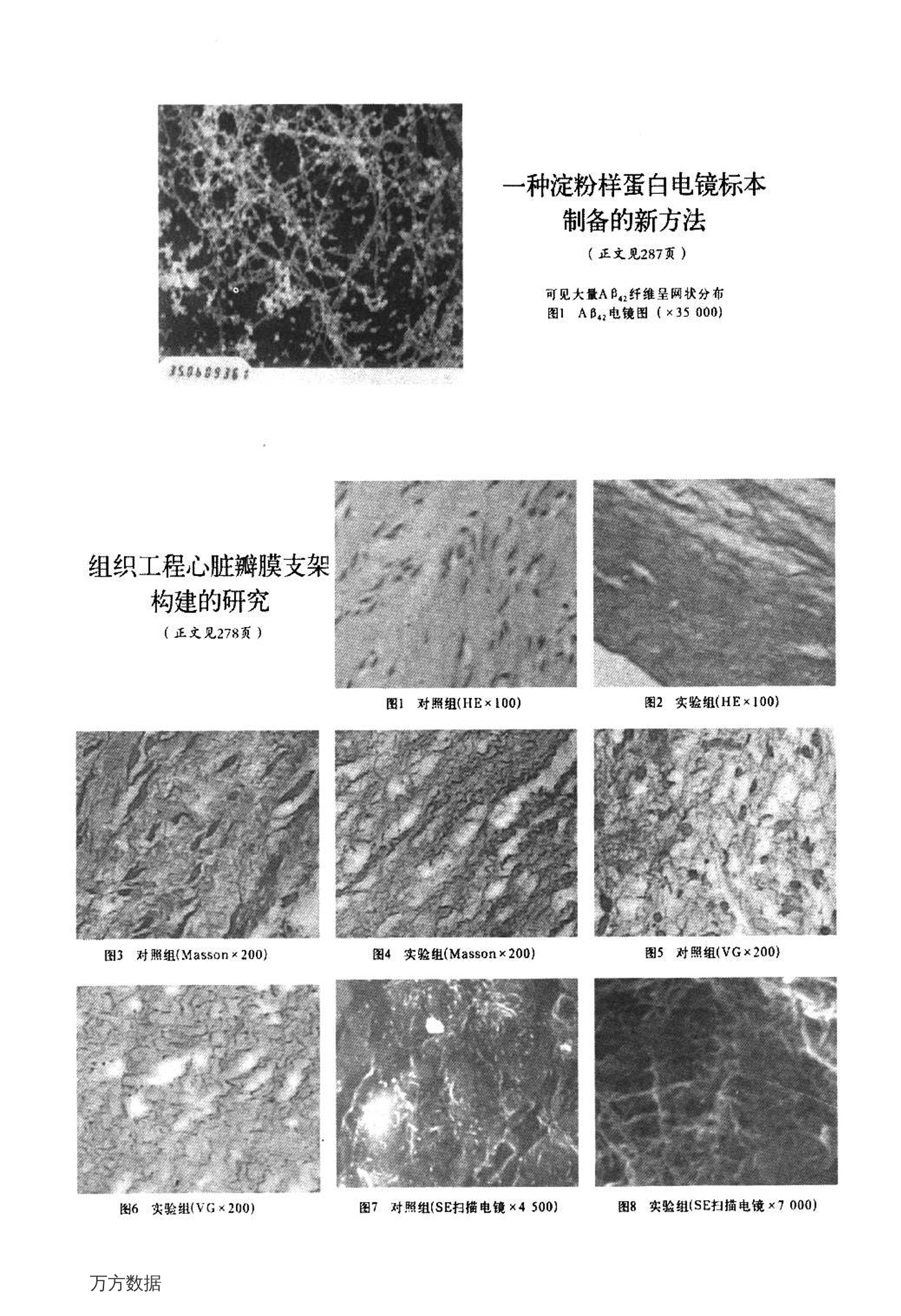
使标本上出现斑块盲视野区和无样本区。染色达不到预期的
效果,电镜下观察淀粉样蛋白超微结构质量较低。为此,本研
究提出了一种扣滴延时染色法,即:采用样本溶液扣滴,延长
样本与含碳铜网接触时间和延长醋酸双氧铀染色时间的方
法,并通过实验证明了这种新方法的有效性。
方案详情

天津医药2007年4月第35卷第4期287新技术交流 万方数据WANFANG DATA文献链接 一种淀粉样蛋白电镜标本制备的新方法* 赵 娟 徐淑梅 关键词 淀粉样β蛋白阵阿尔茨海默病 湿微镜检查,电子 阿尔茨海默病(AD)的发病机制尚不确定且无特效治疗药物,普遍认为淀粉样蛋白(AB)产生和聚集是 AD 的重要病理学特征"。在以Aβ 为靶点进行体外实验阶段的药物研究过程中,通常采用透射电镜观察 AB的形态改变来推断药物能否抑制 AB聚集,这也是体外间接了解药物治疗 AD 机制的一个重要方面。一般制备淀粉样蛋白的透射电镜标本时,常会发生含碳铜网不能均匀和完全地吸附样本溶液的情况,使标本上出现斑块盲视野区和无样本区,染色达不到预期的效果,电镜下观察淀粉样蛋白超微结构质量较低。为此,本研究提出了一种扣滴延时染色法,即:采用样本溶液扣滴,延长样本与含碳铜网接触时间和延长醋酸双氧铀染色时间的方法,并通过实验证明了这种新方法的有效性。 1材料与方法 1.1 材料 淀粉样蛋白(Aβ42),购勾美国 Sigema 公司,纯度大于98%并经高效液相色谱分析法(HPLC)和基质辅助激光解吸附飞行时间质谱(MALDI-TOF MS)检验。二甲基亚砜(DMSO)购自美国 Sigema 公司,纯度大于 99.9%。 MEM 液体培养基购自 Gibco 公司,成分为 MEM 和去离子水。300目标准圆孔微栅和含含支持膜均购自美国 EMS公司。 1.2 方法 100 pg AB42溶于 200 pL DMSO中,配成浓度0.5 g/L 的储存液,分装后-20℃备用。用时 MEM 稀释至浓度50 mg/L。取 5 p.L样本溶液滴于蜡盘中,样本溶液呈液滴状,将含碳支持膜铜网反扣于液滴上,有碳膜的面向下,与样本溶液接触。室温静置15 min。滤纸小心吸去多余液体。取适量2%醋酸双氧铀于试管中,将铜网充分浸充染料中 2 min,避光染色。取出后,蒸馏水冲洗铜网5~10s,用滤纸小心吸去多余液体,避光干燥1 min。电镜(H-600,HITACHI)观察。 2 结果 见图1。电镜观察图像反差大,AB样本在铜网上分布均匀,厚度适宜,含碳支持膜在观察过程中不易破裂,镜下容易观察到样本的结构。AB4z单独孵育7d,可见大量AB42纤维,直径8~10 nm,长 150~450 nm,呈芒刺式晶状聚集,无分枝,可见一些呈聚集状态的无定型 AB42结构。 3讨论 在制备淀粉样蛋白的透射电镜标本时通常采用空气干燥,作用十分有限,样本吸附较少。同时由于液-气表面张力的强烈作用致使样品的结构不可避免发生一定程度的破坏图 在实验中笔者发现5 pL样本溶液滴于铜网上,空气干燥1min 后,仍然呈液滴状附于铜网的含碳膜一侧。延长干燥时间至40 min,样本溶液也不能完全被吸收。干燥 1 min 后进行染色,不仅含碳铜网上吸附的样品比较少给后来的镜下观察带来难度,而且残余的样本溶液对于染色液的稀释使得染色质量下降,降低了标本的反差。 为了解决上述问题,本研究采用固-液-固态干燥,不仅避免了液-气表面张力对样本造成的损伤,又使样本溶液和碳膜更容易达到固液平衡,增加碳膜对于样本的吸附。处于铜网和蜡盘之间的液滴形状发生改变,增加了样本溶液和铜网的接触面积,也有助于样本吸附,减少了标本的无样本结构区。将含碳铜网扣在样本溶液的液滴之上,可以防止样本溶液中可能存在的大分子物质由于重力作用而沉降在含碳铜网上,有效地避免了可能由于这些大分子物质而形成的斑块盲视野区。笔者在实验过程中,延长了样本溶液和铜网的接触时间,使目的样本在容液和含碳铜网之间达到充分的平衡,增加样本的吸附,并且弥补了由于倒扣可能导致的样本厚度不够的缺点。延长负染时间的目的在于增加样本的反差度,有利于辨认和观察淀粉样蛋白的结构。滤纸吸去多余液体则可以使样本溶液在铜网上分布更均匀,铜网上的碳膜各区域紧张度保持平衡,提高了对大量高速电子束的冲击的耐受性。本方法使淀粉样蛋白的电镜标本质量得到了提高,但还存在不足之处,如标本在长时间的观察后,含碳支持膜仍然会发生破裂等问题,还需不断摸索完善。 ( (图1见插页) ) ( 参考文献 ) ( [1] Tumer PR. Roles of am y loid protein and its fr a gments in regulat-ingneural activity plasticity and memory [J. Prog Neurobiol, 2003, 15:70-71. ) ( [2] G o ldsbury CS, Wir t z S, Muller SA, et al. Stud i es on the i n vi t ro as-sembly of a beta 1-40: i m plications for the search for a beta fibrilformation inhibitors[J]. J Struct Biol,2000,130 (2-3):217-231. ) ( [3] 张均田.现代药理实验方法[M].北京:北京医科大学、中国协和医 科大学联合出版社,1998:269-270. ) ( [4] Chiti F, Webster P, Taddei N,et al. Designing conditions for in vitroformation of amyloid proto filaments and fibrils []. Proc Natl AcadSci USA,1999,96(7):3590-3594. ) ( (2006-09-28收稿 2 2006-11-29修回) ) ( *天津市科委基金资助项目(项目编号:USYFGPGX07100) ) ( 作者单位:300070 天津医科大学生理教研室 ) 一种淀粉样蛋白电镜标本制备的新方法 (正文见287页) 可见大量AB纤维呈网状分布 图1 AB电镜图(×35000) 组织工程心脏瓣膜支架构建的研究 (正文见278页) 图1 对照组(HE×100) 图22 实验组(HE*100) 图3对照组(Masson*200) 图4 实验组(Massonx200) 图5 对照组(VG×200) 图6 实验组(VG×200) 图7对照组(SE扫描电镜×4500) 图8实验组(SE扫描电镜×7000) 一种淀粉样蛋白电镜标本制备的新方法 作者:赵娟,,徐淑梅作者单位:300070,天津医科大学生理教研室刊名:天津医药ISTICIIPKU英文刊名:TIANJIN MEDICAL JOURNAL年,卷(期):2007,35(4)被引用次数:1次 参考文献(4条) 1. Tumer PR Roles of amyloid protein and its fragments in regulatingneural activity plasticity andmemory 2003 2. Goldsbury CS;Wirtz S;Muller SA Studies on the in vitro assembly of a beta 1-40:implications forthe search for a beta fibril formation inhibitors[外文期刊]2000(2-3) 3.张均田现代药理实验方法 1998 4. Chiti F;Webster P;Taddei N Designing conditions for in vitro formation of amyloid proto filamentsand fibrils[外文期刊]1999(07) 本文读者也读过(3条) 1.颜永碧.陆月良.郑尊. YAN Yong-bi.LU Yue-liang. ZHENG Zun 微波技术在诊断电镜标本制备中的应用[期刊论文]-电子显微学报2000,19(6) 2..支彭玲.郑容.郑姝颖.郝耀华.谢大鹤.王德炳一种临床实用的快速电镜标本制备方法[会议论文]-2006 3.袁扬电镜负染片病毒图像的细节特征分析系统[学位论文]2005 引证文献(1条) 1.陶忠芬.江海东.李飞.路菊.可金星电镜样品制备技术的应用[期刊论文]-局解手术学杂志2008(6) 本文链接: http://d.g.wanfangdata. com. cn/Periodical_tjyy200704017.aspx 数据
确定


还剩1页未读,是否继续阅读?
海德创业(北京)生物科技有限公司为您提供《一种淀粉样蛋白电镜标本制备的新方法》,该方案主要用于其他中--检测,参考标准--,《一种淀粉样蛋白电镜标本制备的新方法》用到的仪器有醋酸双氧铀替代品(铅罐)
相关方案
更多
该厂商其他方案
更多








