方案详情
文
玉米和大麦体外瘤胃发酵氢气、甲烷和挥发性脂肪酸产量差异研究
方案详情

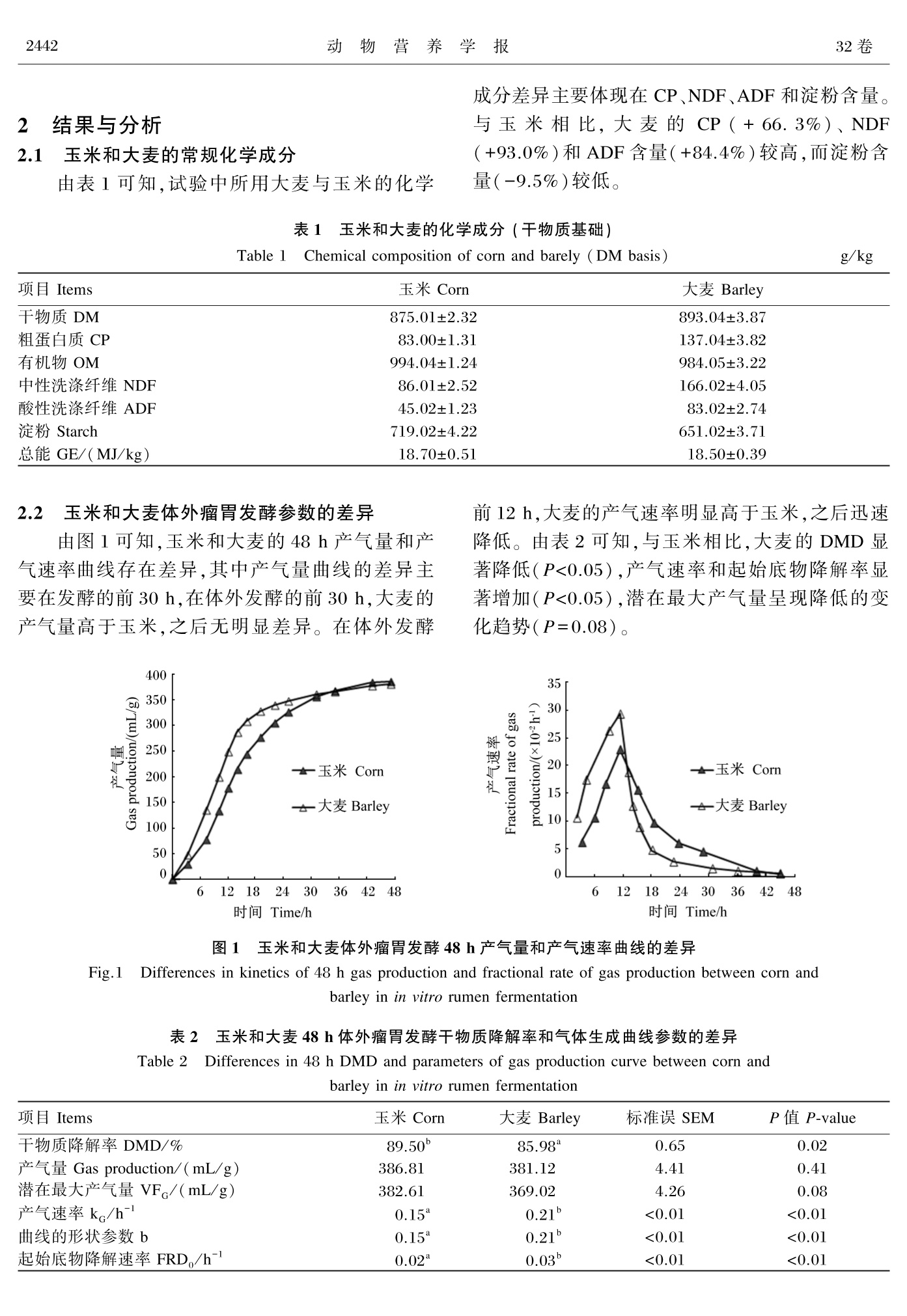
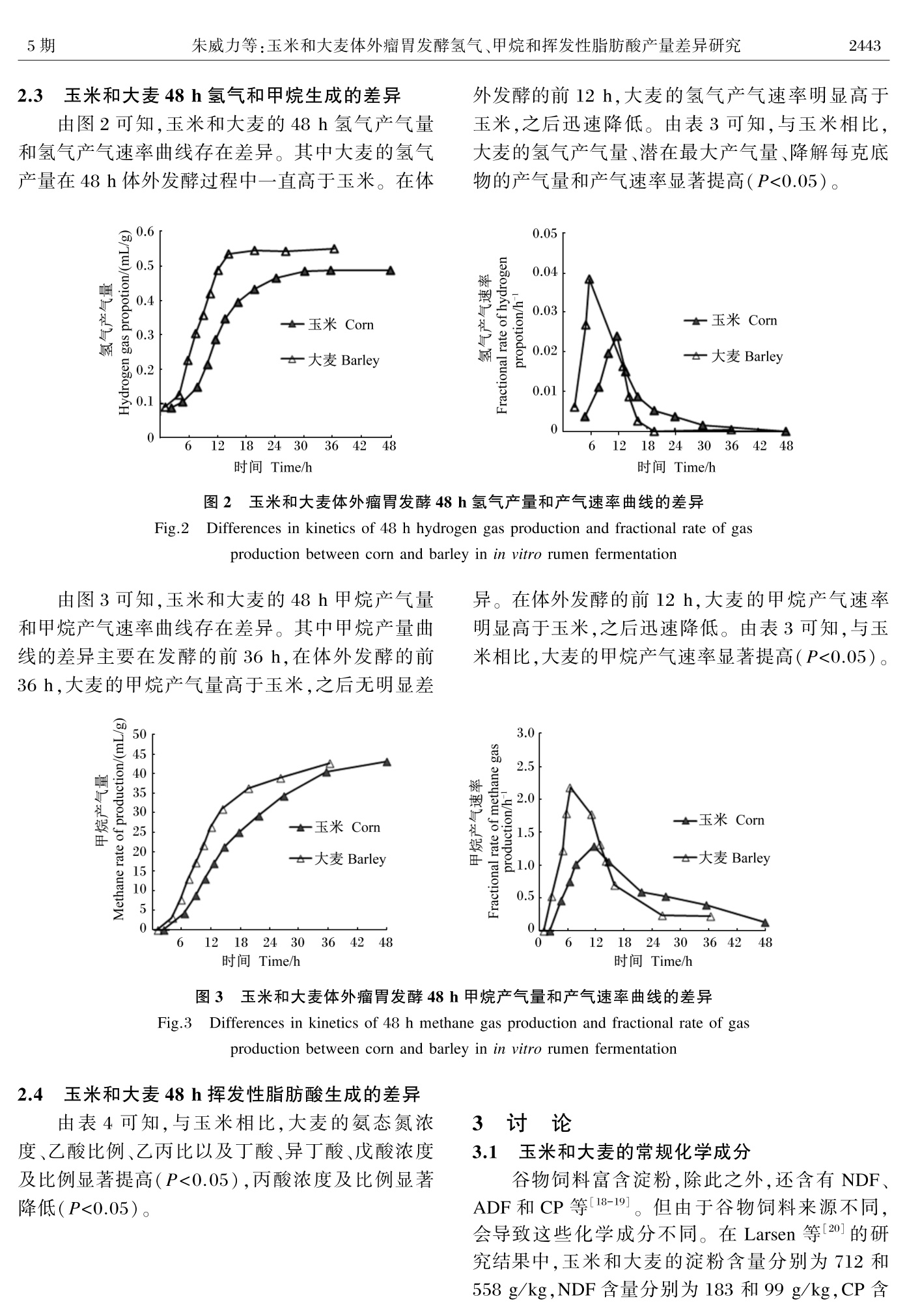
玉米和大麦体外瘤胃发酵氢气、甲烷和挥发性脂肪酸产量差异研究动物营养学报2020,32(5):2440⁃2448Chinese Journal of Animal Nutritiondoi:10.3969/ j.issn.1006⁃267x.2020.05.053 朱威力等:玉米和大麦体外瘤胃发酵氢气、甲烷和挥发性脂肪酸产量差异研究5期1442 玉米和大麦体外瘤胃发酵氢气 、甲烷和挥发性 脂肪酸产量差异研究 朱威力 1,2 王 荣 2 龙 婷 3 石维宏 3 瞿 吉 3 罗 婵 3 郑 琛 1∗ 王 敏 2∗ (1.甘肃农业大学动物科学技术学院 ,兰州 730070;2.中国科学院亚热带农业生态研究所 ,长沙 410125;3.湖南德农牧业集团有限公司 ,湘西 416144) 摘 要 :本试验旨在研究玉米和大麦体外瘤胃发酵氢气 、甲烷和挥发性脂肪酸产量的差异 。以 玉米和大麦为发酵底物 ,选用 3只安装永久性瘤胃瘘管的湘东黑山羊作为瘤胃液供体动物 ,利 用全自动体外模拟发酵系统进行 48 h 体外瘤胃发酵试验 。结果表明 :1)与玉米相比 ,大麦的粗 蛋白质和中性洗涤纤维含量较高 ,而淀粉含量较低 。 2)与玉米相比 ,大麦的干物质降解率显著 降低 (P <0.05),产气速率 、起始底物降解速率均显著升高 (P <0.05);氢气的产气量 、降解每克底 物的产气量 、潜在最大产气量 、产气速率均显著升高 (P <0.05);甲烷的产气速率显著升高 (P <0.05)。 3)与玉米相比 ,大麦的氨态氮浓度 、乙丙比以及丁酸 、异丁酸和戊酸浓度及比例均显著 升高 (P <0.05)。结果提示 ,大麦的前期底物降解速率显著高于玉米 ,促进更多氢气累积 ,有助于 丁酸生成 。 关键词 :体外瘤胃发酵 ;玉米 ;大麦 ;氢气 ;甲烷 ;挥发性脂肪酸 中图分类号 :S816 文献标识码 :A 文章编号 :1006⁃267X (2020)05⁃2440⁃09 淀粉是反刍动物饲粮中的主要能量来源 ,具 有易被瘤胃微生物消化 、利用效率较高等优点 ,为 动物机体的维持 、生长和生产提供重要的能量来 源 [1-3]。淀粉可以根据发酵速率分为快速降解部 分和慢速降解部分 ,这与淀粉颗粒大小 、淀粉直链 支链比和抗性淀粉含量密切相关 [4]。与淀粉慢速 降解部分相比 ,淀粉快速降解部分的消化速率更 快 ,可迅速产生更多氢气 ,促进甲烷生成 。 玉米和大麦是反刍动物饲粮中常见的淀粉来 源 [5],其中玉米中的淀粉含量较高 ,通常在 70%左 右 ,而大麦中的淀粉含量通常只有 58%左右 [6]。尽管玉米淀粉含量高于大麦 ,但姜豇 [7]的研究结 果表明 ,大麦的干物质有效降解率 (79.8%)显著 高于玉米 (49.6%)。这说明大麦的淀粉降解速率 显著高于玉米 ,有利于氢气和甲烷的累积 。另外 , 氢气累积有助于丙酸和丁酸生成 ,进而抑制氢的 生成 [8]。目前很少试验研究这 2种饲料原料对氢 气 、甲烷和挥发性脂肪酸 (VFA )产生的影响 。 因此 ,本试验旨在利用体外瘤胃发酵的方法 ,研究玉米和大麦对干物质降解率及氢气 、甲烷和 VFA 产生的影响 ,为反刍动物合理利用玉米和大 麦提供理论依据和数据支撑 。 1 材料与方法 1.1 试验动物 、饲粮及饲养管理 本试验选用 3只安装永久性瘤胃瘘管的湘东 黑山羊 [体重 (28.0±2.6) kg ]作为瘤胃液供体动 物 。试验动物单笼饲养 ,每头瘘管羊每天饲喂精 料和稻草各 300 g (干物质基础 ),其中精料组成为 玉米 47%,豆粕 24%,麸皮 22%,食盐 0.77%,石粉 收稿日期 :2019-11-13 基金项目 :国家科技计划项目 (2016YFD050054,2018YFD0501800);国家自然科学基金项目 (31860657,31561143009,31472133);湖南省 重大专项 (2017NK1020);中国科学院青年促进会项目 (2016327);中国科学院特聘研究员项目 (2018VBA0031) 作者简介 :朱威力 (1994—),男 ,河南淮阳人 ,硕士研究生 ,从事反刍动物营养与饲料科学研究 。 E⁃mail : 3012880082@qq.com 2.23%,预混料 4%。每千克预混料含有维生素 A 1 000 000 IU ,维生素 D 200 000 IU ,维生素 E 1 250 IU ,锌 8 000 mg ,硒 80 mg ,碘 120 mg ,铁 2 000 mg ,钴 40 mg ,锰 2 500 mg 和铜 2 000 mg 。每天分 2次 (08:30和 18:00)等量饲喂 ,自由 饮水 。 1.2 发酵底物 本试验以玉米和大麦 (购自湖南德农牧业集 团有限公司 )为发酵底物 ,经过 65 ℃烘干 ,磨碎后 过 1 mm 筛 ,分别装入密封袋中 ,作为体外瘤胃发 酵底物 。 1.3 体外瘤胃发酵试验 晨饲前通过瘤胃瘘管采集新鲜瘤胃液 ,迅速 装入保温瓶带回实验室 。参照 Menke 等 [9]的方法 配制 2 000 mL 人工瘤胃营养液 。然后 ,用 6层脱 脂纱布过滤采集瘤胃液 ,量取 500 mL 过滤后的瘤 胃液与人工瘤胃营养液进行混合 ,用磁力搅拌器 搅拌以保持瘤胃液与营养液混合均匀 ,制成混合 人工瘤胃培养液 ,在整个过程中 ,试剂瓶中不断通 入纯二氧化碳以保持厌氧环境 ,并且温度保持在 39.5 ℃。 称取 0.6 g 的玉米或大麦放入 145 mL 的厌氧 发酵瓶中 ,然后在 39.5 ℃的恒温培养箱中预热 2 h ,然后在每个发酵瓶中加入 60 mL 混合人工瘤 胃培养液 ,最后利用 Wang 等 [10]描述的全自动体 外模拟瘤胃发酵系统开展体外发酵试验 ,48 h 后 终止发酵 。每个发酵底物 (玉米和大麦 )设置 2个 平行 ,每个平行重复 3次 (每次所使用的瘘管羊不 同 )。根据发酵瓶顶部空间大小 、压力与气体体积 的转化系数对甲烷 、氢气的产气量进行计算 [11]。具体计算过程如下 : 式中 :△Vgi 表示在 ti -1和 ti 之间甲烷和氢气的 生成体积 (mL );△Vggi 表示气体产生并释放的气 体体积 (mL );△Vghi 表示气体产生并存在发酵瓶 顶端的气体体积 (mL );Pi 表示在 ti 时 ,传感器测 定的压力值 (kPa );ρ 表示传感器测定的压力值和 气体体积的转换系数 ;Cgi 表示在 ti 时 ,气相色谱仪 测定的气体浓度 ;Vgn 表示 t =0和 tn 时积累的气体 体积 (mL );i 和 n 分别表示第 i 次排气和排气次 数 ,i ≤n ;Vh 表示发酵瓶顶端体积 (mL )。 1.4 样品采集和指标 根据 AOAC (1995)[12]的方法对玉米和大麦 中干物质 (DM )、有机物 (OM )和粗蛋白质 (CP )含量进行测定 ;根据 Van Soest 等 [13]的方法测定中 性洗涤纤维 (NDF )和酸性洗涤纤维 (ADF )含量 ;采用等温式全自动量热仪 (5E-AC8018,长沙开元 仪器有限公司 )对能量进行测定 ;根据 Kartchner 等 [14]的方法对淀粉含量进行测定 。 48 h 体外瘤胃发酵试验结束后 ,取 2 mL 的发 酵液 ,在 12 000×g 、4 ℃条件下离心 10 min ,取上 清液 。然后 ,取 1. 5 mL 的上清液加入含有 0.15 mL 25%偏磷酸 (w/ v )的 2 mL 离心管中 ,振 荡后并排出气泡 ,然后置于 -20 ℃保存并过夜 。样品在 4 ℃条件下解冻 ,12 000×g 离心 10 min 。然后使用气相色谱仪 (Agilent 7890A )测定上清液 中 VFA 浓度 [10],根据 Weatherburn [15]的方法 ,测定 上清液中氨态氮浓度 。最后 ,将剩余的发酵内容 物用 300目纱布过滤 ,放置于铝盒中经 105 ℃烘干 至恒重 ,根据发酵后干物质重量差计算干物质降 解率 (DMD )。 1.5 数据分析 1.5.1 产气拟合曲线 应用 NLREG 软件 ,采用 Wang 等 [16]提供的模 型对体外瘤胃发酵产气量进行拟合 ,计算公式 如下 : 式中 :GPt 为 t 时间点底物的累积产气量 (mL );VF 为潜在最大产气量 (mL );k 为产气速率 (h-1);b 为曲线的形状参数 。 根据 Wang 等 [17]提供的模型 ,利用拟合得到 的参数计算起始底物降解速率 (FRD0,h-1),即当 t =0时的底物降解速率 ,计算公式如下 : 式中 : k 为产气速率 (h-1);b 为曲线的形状 参数 。 1.5.2 数据处理 试验数据使用 SPSS 19.0软件的一般线性模 型进行方差分析 。 P <0.05为差异显著 ,P >0.05为 无显著差异 。 2 结果与分析 2.1 玉米和大麦的常规化学成分 由表 1可知 ,试验中所用大麦与玉米的化学 成分差异主要体现在 CP 、NDF 、ADF 和淀粉含量 。与玉米相比 ,大麦的 CP ( + 66. 3%)、 NDF (+93.0%)和 ADF 含量 (+84.4%)较高 ,而淀粉含 量 (-9.5%)较低 。 表 1 玉米和大麦的化学成分 (干物质基础 ) Table 1 Chemical composition of corn and barely (DM basis ) g/kg 项目Items 玉米 Corn 大麦 Barley 干物质 DM 875.01±2.32 893.04±3.87 粗蛋白质 CP 83.00±1.31 137.04±3.82 有机物 OM 994.04±1.24 984.05±3.22 中性洗涤纤维 NDF 86.01±2.52 166.02±4.05 酸性洗涤纤维 ADF 45.02±1.23 83.02±2.74 淀粉 Starch 719.02±4.22 651.02±3.71 总能 GE/(MJ/kg) 18.70±0.51 18.50±0.39 2.2 玉米和大麦体外瘤胃发酵参数的差异 由图 1可知 ,玉米和大麦的 48 h 产气量和产 气速率曲线存在差异 ,其中产气量曲线的差异主 要在发酵的前 30 h ,在体外发酵的前 30 h ,大麦的 产气量高于玉米 ,之后无明显差异 。在体外发酵 前 12 h ,大麦的产气速率明显高于玉米 ,之后迅速 降低 。由表 2可知 ,与玉米相比 ,大麦的 DMD 显 著降低 (P <0.05),产气速率和起始底物降解率显 著增加 (P <0.05),潜在最大产气量呈现降低的变 化趋势 (P =0.08)。 表 2 玉米和大麦 48 h 体外瘤胃发酵干物质降解率和气体生成曲线参数的差异 Table 2 Differences in 48 h DMD and parameters of gas production curve between corn and barley in in vitro rumen fermentation 项目Items 玉米 Corn 大麦 Barley 标准误 SEM P值 P⁃value 干物质降解率 DMD/% 89.50b 85.98a 0.65 0.02 产气量 Gas production/(mL/g) 386.81 381.12 4.41 0.41 潜在最大产气量 VFG /(mL/g) 382.61 369.02 4.26 0.08 产气速率 kG / h-1 0.15a 0.21b <0.01 <0.01 曲线的形状参数 b 0.15a 0.21b <0.01 <0.01 起始底物降解速率 FRD0 / h-1 0.02a 0.03b <0.01 <0.01 2.3 玉米和大麦 48 h 氢气和甲烷生成的差异 由图 2可知 ,玉米和大麦的 48 h 氢气产气量 和氢气产气速率曲线存在差异 。其中大麦的氢气 产量在 48 h 体外发酵过程中一直高于玉米 。在体 外发酵的前 12 h ,大麦的氢气产气速率明显高于 玉米 ,之后迅速降低 。由表 3可知 ,与玉米相比 ,大麦的氢气产气量 、潜在最大产气量 、降解每克底 物的产气量和产气速率显著提高 (P <0.05)。 图 2 玉米和大麦体外瘤胃发酵 48 h 氢气产量和产气速率曲线的差异 Fig.2 Differences in kinetics of 48 h hydrogen gas production and fractional rate of gas production between corn and barley in in vitro rumen fermentation 由图 3可知 ,玉米和大麦的 48 h 甲烷产气量 和甲烷产气速率曲线存在差异 。其中甲烷产量曲 线的差异主要在发酵的前 36 h ,在体外发酵的前 36 h ,大麦的甲烷产气量高于玉米 ,之后无明显差 异 。在体外发酵的前 12 h ,大麦的甲烷产气速率 明显高于玉米 ,之后迅速降低 。由表 3可知 ,与玉 米相比 ,大麦的甲烷产气速率显著提高 (P <0.05)。 图 3 玉米和大麦体外瘤胃发酵 48 h 甲烷产气量和产气速率曲线的差异 Fig.3 Differences in kinetics of 48 h methane gas production and fractional rate of gas production between corn and barley in in vitro rumen fermentation 2.4 玉米和大麦 48 h 挥发性脂肪酸生成的差异 由表 4可知 ,与玉米相比 ,大麦的氨态氮浓 度 、乙酸比例 、乙丙比以及丁酸 、异丁酸 、戊酸浓度 及比例显著提高 (P <0.05),丙酸浓度及比例显著 降低 (P <0.05)。 3 讨 论 3.1 玉米和大麦的常规化学成分 谷物饲料富含淀粉 ,除此之外 ,还含有 NDF 、ADF 和 CP 等 [18-19]。但由于谷物饲料来源不同 ,会导致这些化学成分不同 。在 Larsen 等 [20]的研 究结果中 ,玉米和大麦的淀粉含量分别为 712和 558 g/kg ,NDF 含量分别为 183和 99 g/kg ,CP 含 量分别为 96和 133 g/kg ,这与本试验测定的结果 相接近 。而在姜豇 [7]的研究结果中 ,玉米和大麦 的淀粉含量分别为 625和 498 g/kg 。 表 3 玉米和大麦 48 h 体外瘤胃发酵氢气和甲烷生成的差异 Table 3 Differences in 48 h hydrogen and methane production between corn and barley in in vitro rumen fermentation 项目 玉米 Corn 大麦 Barely 标准误 SEM P值 P⁃value Items 氢气 Hydrogen 产气量 Gas production/(mL/g) 0.47a 0.54b 0.01 0.01 潜在最大产气量 VFH /(mL/g) 0.47a 0.56b 0.01 <0.01 降解每克底物的产气量 0.53a 0.63b 0.02 <0.01 Gas produced by degradation per gram of substrate /(mL/g DM) 产气速率 kH / h-1 0.02a 0.03b <0.01 0.01 甲烷 Methane 0.52 产气量 Gas production/(mL/g) 40.81 42.12 1.27 潜在最大产气量 VFCH /(mL/g) 39.24 39.65 1.22 0.81 降解每克底物的产气量 45.62 48.94 4.67 0.23 Gas produced by degradation per gram of substrate /(mL/g DM) 产气速率 kCH / h-1 0.18a 0.26b 0.01 0.01 表 4 玉米和大麦对 48 h 体外瘤胃发酵氨态氮和挥发性脂肪酸生成的影响 Table 4 Differences in NH3 ⁃N and VFA production between corn and barley in in vitro rumen fermentation 项目 玉米 大麦 标准误 P值 P⁃value Items Corn Barley SEM 氨态氮 NH3 ⁃N /(mmol/L) 4.55a 8.69b 0.35 <0.01 总挥发性脂肪酸浓度 Concentration of TVFA/(mmol/L) 70.21 66.33 3.41 0.46 乙丙比 Acetate to propionate ratio 1.93a 2.37b 0.02 <0.01 挥发性脂肪酸浓度 Concentration of VFA/(mmol/L) 乙酸 Acetate 40.82 39.92 2.01 0.75 丙酸 Propionate 21.23b 16.83a 1.06 0.04 丁酸 Butyrate 5.81a 6.94b 6.12 0.04 异丁酸Isobutyrate 0.43a 0.59b 0.02 0.01 戊酸 Valerate 0.73a 0.99b 0.03 0.01 异戊酸Isovalerate 1.25 1.17 0.04 0.28 挥发性脂肪酸比例 Percentage of VFA/% 乙酸 Acetate 58.15a 60.14b 0.25 0.01 丙酸 Propionate 30.26b 25.33a 0.16 <0.01 丁酸 Butyrate 8.26a 10.42b 0.12 <0.01 异丁酸Isobutyrate 0.62a 0.89b 0.01 <0.01 戊酸 Valerate 1.05a 1.50b 0.02 <0.01 异戊酸Isovalerate 1.78 1.77 0.04 0.85 3.2 玉米和大麦体外瘤胃发酵参数的差异 饲粮在瘤胃微生物的作用下降解并产生大量 的气体 ,其中产气量和消化率可以作为衡量饲粮 在瘤胃内可发酵程度的重要指标 [21]。当饲粮中富 含容易发酵的非结构性碳水化合物时 ,会有助于 其被微生物降解 ,产生更多的气体 [22-23]。与玉米 相比 ,大麦的产气速率显著升高 ,这是因为大麦中 淀粉的快速降解部分较高 [24],有助于快速降解并 产生大量的气体 [25],这也与大麦的前期底物降解 速率显著升高相一致 。另外 ,玉米中的玻璃体胚 乳蛋白质基质也会增加淀粉难以降解的程度 [26]。有研究表明 ,大麦中淀粉的快速降解部分为 88.35%,而玉米只有 39.71%[7]。但是大麦中的纤 维含量高于玉米 ,当大麦中的淀粉降解之后 ,降解 速率会显著降低 ,最终导致干物质消失率降低 ,这 与潜在最大产气量降低相一致 [27]。 3.3 玉米和大麦 48 h 氢气和甲烷生成的差异 碳水化合物在瘤胃发酵的过程中会伴随着氢 的产生 [8],氢在瘤胃内可以转变成氢气 ,氢气主要 分为溶解态氢气和气态氢气 [11],其中溶解态氢气 会被甲烷菌利用合成甲烷 [28],以维持瘤胃内较低 的氢气分压 ,从而保障机体正常的代谢活动 。溶 解态氢气是连接饲粮降解 、甲烷 、挥发性脂肪酸和 微生物的重要中间体 [29]。在本试验结果中 ,与玉 米相比 ,大麦的氢气产气量和产气速率显著提高 。这是因为在发酵前期 ,大麦中淀粉迅速降解 ,从而 导致大量氢气产生 ,当氢气的产气速率超过甲烷 菌的利用程度时 ,就会导致积累 ,未被甲烷菌利用 的溶解态氢气就会转变为气态氢气 ,释放到空 气中 。 有研究表明 ,氢气浓度的升高会刺激甲烷菌 的增殖和对氢气的利用 [30-31],从而增加甲烷的生 成 。但是 ,在本研究中 ,甲烷产气速率虽然显著增 加 ,但是甲烷产气量却没有显著变化 。这可能是 因为大麦只是显著提高了发酵前期 (前 12 h )氢气 的产气速率 ,随着大麦中淀粉的不断降解 ,发酵 12 h 后 ,氢气产气速率明显下降 ,同时甲烷产气速 率也明显下降 ,最终导致甲烷产气量没有显著 变化 。 3.4 玉米和大麦 48 h 挥发性脂肪酸生成的差异 瘤胃中挥发性脂肪酸组分的差异主要与饲粮 中可发酵碳水化合物组分的差异密切相关 [32]。有 研究表明 ,饲粮中的纤维有助于乙酸的生成 ,而淀 粉有助于丙酸的生成 [33-35]。在本研究中 ,大麦显 著增加了乙酸和丁酸的生成 ,降低了丙酸的生成 ,这可能主要是与大麦中较低的淀粉含量和较高的 纤维含量密切相关 。但是 ,Cone [36]研究发现 ,大 麦在体外发酵初期的丙酸比例显著高于玉米 。而 在 Wang 等 [37]的 24 h 体外瘤胃发酵试验中 ,玉米 和大麦的乙酸和丙酸生成量没有显著差异 。这可 能是因为 ,与玉米相比 ,大麦在发酵初期以淀粉发 酵为主 ,发酵速度快 ,导致大量氢气产生 ,而氢气 积累有助于丁酸的生成 。 在本试验中 ,与玉米相比 ,大麦的异丁酸 、戊 酸浓度和比例显著升高 ,这可能是与大麦中较高 的 CP 含量有关 。 Getachew 等 [38]研究表明 ,饲粮 中的 CP 水平会直接影响戊酸生成 。 CP 在瘤胃内 快速降解成氨基酸和小肽 ,然后在微生物作用下 降解产生异丁酸和戊酸的过程中会伴随着氨态氮 的生成 ,这也是导致大麦显著增加氨态氮浓度的 重要原因 [38]。 4 结 论 与玉米相比 ,大麦中的可快速发酵淀粉提高 了产气速率和前期底物降解速率 ,并在发酵前期 产生更多氢气 ,这有助于丁酸的生成 。大麦中含 有较高的 CP ,这会有助于氨态氮 、异丁酸和戊酸 的生成 。 参考文献 : [ 1] POTTS S B ,BOERMAN J P ,LOCK A L ,et al.Resid⁃ual feed intake is repeatable for lactating Holstein dair⁃y cows fed high and low starch diets [ J ] . Journal of Dairy Science ,2015,98(7):4735-4747. [ 2] GOMEZ L M ,POSADA S L ,OLIVERA⁃ANGEL M.Starch in ruminant diets :areview [ J ] .Revista Colom⁃biana de Ciencias Pecuarias ,2016,29(2):77-90. [ 3] MOHARRERY A ,LARSEN M ,WEISBJERG M R.Starch digestion in the rumen ,small intestine ,and hind gut of dairy cows⁃A meta⁃analysis [ J ] . Animal Feed Science and Technology ,2014,192:1-14. [ 4] 沈宜钊 .日粮淀粉来源与有机酸预处理玉米对奶山 羊瘤胃酸中毒的影响及机制 [D ] .博士学位论文 .扬 州 :扬州大学 ,2018. [ 5] NIKKHAH A. Barley grain for ruminants : a global treasure or tragedy [ J ] . Journal of Science and Bio⁃technology ,2012,3(1):22. [ 6] HUMER E ,ZEBELI Q. Grains in ruminant feeding and potentials to enhance their nutritive and health val⁃ue by chemical processing [ J ] .Animal Feed Science and Technology ,2017,226:133-151. [ 7] 姜豇 .反刍动物常用精饲料淀粉降解动力学研究 [D ] .硕士学位论文 .长沙 :湖南农业大学 ,2005. [ 8] WANG M ,WANG R ,XIE T Y ,etal.Shiftsin rumen fermentation and microbiota are associated with dis⁃solved ruminal hydrogen concentrations in lactating dairy cows fed different types of carbohydrates [ J ] .The Journal of Nutrition ,2016,146(9):1714-1721. [ 9] MENKE K H ,RAAB L ,SALEWSKI A ,et al.The Es⁃timation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas produc⁃tion when they are incubated with rumen liquor in vitro [ J ] . Journal of Agricultural Science ,1979,93(1):217-222. [10] WANG M ,WANG R ,YANG S ,et al.Effects of three methane mitigation agents on parameters of kinetics of totaland hydrogen gas production , ruminal fermenta⁃tion and hydrogen balance using in vitro technique [ J ] .Animal Science Journal ,2016,87(2):224-232. [11] WANG M ,JANSSEN P H ,SUN X Z ,etal.A mathe⁃matical model to describe in vitro kinetics of H2 gas accumulation [ J ] .Animal Feed Science and Technolo⁃gy ,2013,184(1/2/3/4):1-16. [12] AOAC.Official methods of analysis [M ]16th ed.Ar⁃lington ,VA :Association of Official Analytical Chem⁃ists ,1995. [13] VAN SOEST P J ,ROBERTSON J B ,LEWIS B A.Methods for dietary fiber , neutral detergent fiber ,and nonstarch polysaccharides in relation to animal nutri⁃tion [ J ] . Journal of Dairy Science ,1991,74:3583-3597. [14] KARTCHNER R J ,THEURER B.Comparison of hy⁃drolysis methods used in feed ,digesta ,and fecal starch analysis [ J ] .Journal of Agricultural and Food Chemis⁃try ,1981,29(1):8-11. [15] WEATHERBURN M W.Phenol⁃hypochlorite reaction for determination of ammonia [ J ] .Analytical Chemis⁃try ,1967,39(8):971-974. [16] WANG M ,TANG S X ,TAN Z L.Modeling in vitro gas production kinetics :derivation of logistic⁃exponen⁃tial (LE ) equations and comparison of models [ J ] .Animal Feed Science and Technology ,2011,165(3/4):137-150. [17] WANG M ,SUN X Z ,TANG S X ,et al.Deriving frac⁃tional rate of degradation of logistic⁃exponential (LE )model to evaluate early in vitro fermentation [ J ] .Ani⁃mal ,2013,7(6):920-929. [18] HUHTANEN P ,SVEINBJÖRNSSON J.Evaluation of methods for estimating starch digestibility and diges⁃tion kinetics in ruminants [ J ] . Animal Feed Science and Technology ,2006,130(1/2):95-113. [19] KHAN M A ,LEE H J ,LEE W S ,Ket al. Starch source evaluation in calf starter :Ⅱ.Ruminal parame⁃ters , rumen development ,nutrient digestibilities , and nitrogen utilization in Holstein calves [ J ] . Journal of Dairy Science ,2008,91(3):1140-1149. [20] LARSEN M ,LUND P ,WEISBJERG M R , et al.Di⁃gestion site of starch from cerealsand legumes in lac⁃tating dairy cows [ J ] .Animal Feed Science and Tech⁃nology ,2009,153(3/4):236-248. [21] NEWBOLD C J ,LÓPEZ S ,NELSON N ,et al.Propio⁃nate precursors and other metabolic intermediates as possible alternative electron acceptors to methanogene⁃sis in ruminal fermentation in vitro [ J ] .British Journal of Nutrition ,2007,94(1):27-35. [22] HATEW B ,CONE J W ,PELLIKAAN W F ,et al.Re⁃lationship between in vitro and in vivo methane pro⁃duction measured simultaneously with different dietary starch sources and starch levels in dairy cattle [ J ] .Ani⁃mal Feed Science and Technology ,2015,202:20-31. [23] WANG R ,SI H B ,WANG M , et al.Effects of ele⁃mental magnesium and magnesium oxide on hydro⁃gen ,methane and volatile fatty acids production in in vitro rumen batch cultures [ J ] . Animal Feed Science and Technology ,2019,252:74-82. [24] OFFNER A ,BACH A ,SAUVANT D.Quantitative re⁃view of in situ starch degradation in the rumen [ J ] .Animal Feed Science and Technology , 2003, 106(1/2/3/4):81-93. [25] LANZAS C ,FOX D G ,PELL A N.Digestion kinetics of dried cereal grains [ J ] . Animal Feed Science and Technology ,2007,136(3/4):265-280. [26] MCALLISTER T A ,PHILLIPPE R C ,RODE L M ,et al.Effect of the protein matrix on the digestion of cere⁃al grains by ruminal microorganisms [ J ] . Journal of Animal Science ,1993,71(1):205-212. [27] HUNTINGTON G B.Starch utilization by ruminants :from basics to the bunk [ J ] . Journal of Animal Sci⁃ence ,1997,75(3):852-867. [28] CZERKAWSKI J W ,HARFOOT C G ,BRECKEN⁃RIDGE G.The relationship between methane produc⁃tion and concentrations of hydrogen in the aqueous and gaseous phases during rumen fermentation in vitro [ J ] . Journal of Applied Microbiology ,1972,35(4):537-551. [29] HUNGATE R E.Hydrogen as an intermediate in the rumen fermentation [ J ] . Archiv für Mikrobiologie ,1967,59(1):158-164. [30] QIAO J Y ,TAN Z L ,GUAN L L ,et al.Effects of hy⁃drogen in headspace and bicarbonate in media on ru⁃men fermentation ,methane production and methano⁃genic population using in vitro gas production tech⁃ niques [ J ] . Animal Feed Science and Technology ,2015,206:19-28. [31] MA Z Y ,ZHANG X M ,WANG M , et al.Molecular hydrogen produced by elemental magnesium inhibits rumen fermentation and enhances methanogenesis in dairy cows [ J ] . Journal of Dairy Science ,2019,102(6):5566-5576. [32] 吴世迪 ,熊宽 ,富俊才 ,等 .大麦替代日粮中玉米对育 肥羊瘤胃发酵的影响 [ J ] .中国畜牧杂志 ,2015,51(13):30-34. [33] LECHARTIER C , PEYRAUD J L. The effects of starch and rapidly degradable dry matter from concen⁃trate on ruminal digestion in dairy cows fed corn si⁃lage⁃based diets with fixed forage proportion [ J ] .Jour⁃nal of Dairy Science ,2011,94(5):2440-2454. [34] GIGER⁃REVERDIN S ,RIGALMA K ,DESNOYERS M ,SAUVANT D ,DUVAUS⁃PONTER C. Effect of concentratelevel on feeding behavior and rumen and blood parametersin dairy goats :relationships between behavioral and physiological parameters and effect of between⁃animal variability [ J ] . Journal of Dairy Sci⁃ ence ,2014,97(7):4367-4378. [35] JANSSEN P H.Influence of hydrogen on rumen meth⁃ane formation and fermentation balances through mi⁃crobial growth kinetics and fermentation thermody⁃namics [ J ] . Animal Feed Science and Technology ,2010,160(1/2):1-22. [36] CONE J W.Fermentation kinetics and production of volatile fatty acids and microbial protein by starchy feedstuffs [ J ] .Animal Feed Science and Technology ,2012,172(1/2):34-41. [37] WANG M ,SUN X Z ,JANSSEN P H ,et al.Responses of methane production and fermentation pathways to the increased dissolved hydrogen concentration genera⁃ted by eight substrates in in vitro ruminal cultures [ J ] .Animal Feed Scienceand Technology ,2014,194:1-11. [38] GETACHEW G ,ROBINSON P H ,DEPETERS E J ,et al.Relationships between chemicalcomposition ,dry matter degradation and in vitro gas production of sev⁃eral ruminant feeds [ J ] . Animal Feed Science and Technology ,2004,111(1/2/3/4):57-71. Differences in Hydrogen , Methane and Volatile Fatty Acids Production between Corn and Barley in in Vitro Rumen Fermentation ZHU Weili1,2 WANG Rong2 LONG Ting3 SHI Weihong3 QU Ji3LUO Chan3 ZHENG Chen1∗ WANG Min2∗ (1. College of Animal Science and Technology , Gansu Agricultural University , Lanzhou 730070, China ; 2. Institute of Subtropical Agriculture , Chinese Academy of Sciences , Changsha 410125, China ; 3. Hunan Denong Animal Husbandry Technology Co., Ltd., Xiangxi 416144, China ) Abstract : This present study was conducted to investigate the hydrogen , methane , volatile fatty acids produc⁃tion in corn and barley in in vitro rumen fermentation. Rumen fluid was collected from three Xiangdong black goats fitted with permanent rumen fistula. The 48 h in vitro ruminal incubation was performed using automatic fermentation system. The results showed as follows : 1) compared with corn , barley had greatercrude protein (CP ) and neutral detergent fiber (NDF ) contents and lower starch content. 2) Compared with corn , dry mat⁃ter degradation (DMD ) of barley significantly decreased (P <0.05),and the fractional rate of gas production and initial fractional rate of degradation significantly increased (P <0.05); hydrogen production , gas produced by degradation per gram of substrate , the final asymptotic volume of hydrogen production and the fractional rate of production significantly increased (P <0.05); fractional rate of methane production significantly in⁃creased (P <0.05) . 3) Compared with corn , ammoniacal nitrogen concentration , acetate to propionate ratio ,the concentrations and percentages of butyrate , isobutyrate and valerate significantly increased (P <0.05) . In conclusion , barley has greater initial fractional rate of degradation than that of corn , which produces a large a⁃mount of hydrogen and favors butyrate production.[Chinese Journal of Animal Nutrition , 2020, 32(5):2440⁃2448] Key words :in vitro rumen fermentation ;corn ; barley ; hydrogen ; methane ; volatilefatty acids
确定






还剩7页未读,是否继续阅读?
中国格哈特为您提供《反刍动物饲粮玉米和大麦中蛋白质、中性洗涤纤维和酸性洗涤纤维含量的检测》,该方案主要用于饲料中营养成分检测,参考标准--,《反刍动物饲粮玉米和大麦中蛋白质、中性洗涤纤维和酸性洗涤纤维含量的检测》用到的仪器有格哈特全自动型纤维分析仪FT12、格哈特快速干燥仪STL56、格哈特自动升降凯氏定氮电热消解仪KT-L 20s、格哈特带自动进样器凯氏定氮仪VAP500C、格哈特维克松废气实验室废物处理系统涤气VS、德国移液器MM、凯氏定氮催化剂5.0g K2SO4+0.5g CuSO4 x 5H2O
相关方案
更多
该厂商其他方案
更多
































