方案详情
文
本应用介绍了一种基于细胞的分析方法,该方法使用 Agilent xCELLigence 实时细胞分析 (RTCA) 仪定量、非侵入性且连续地检测细胞对目标化学物质的反应。分析了三种哺乳动物细胞系(对 ER、AR 或 TR 调节剂均有反应)对参比激动剂和拮抗剂的实时反应。然后将各个细胞系的独特特异性和敏感性用作评价未知化合物的标准。该分析的有效性通过分子和细胞生物学技术得到确认。
方案详情

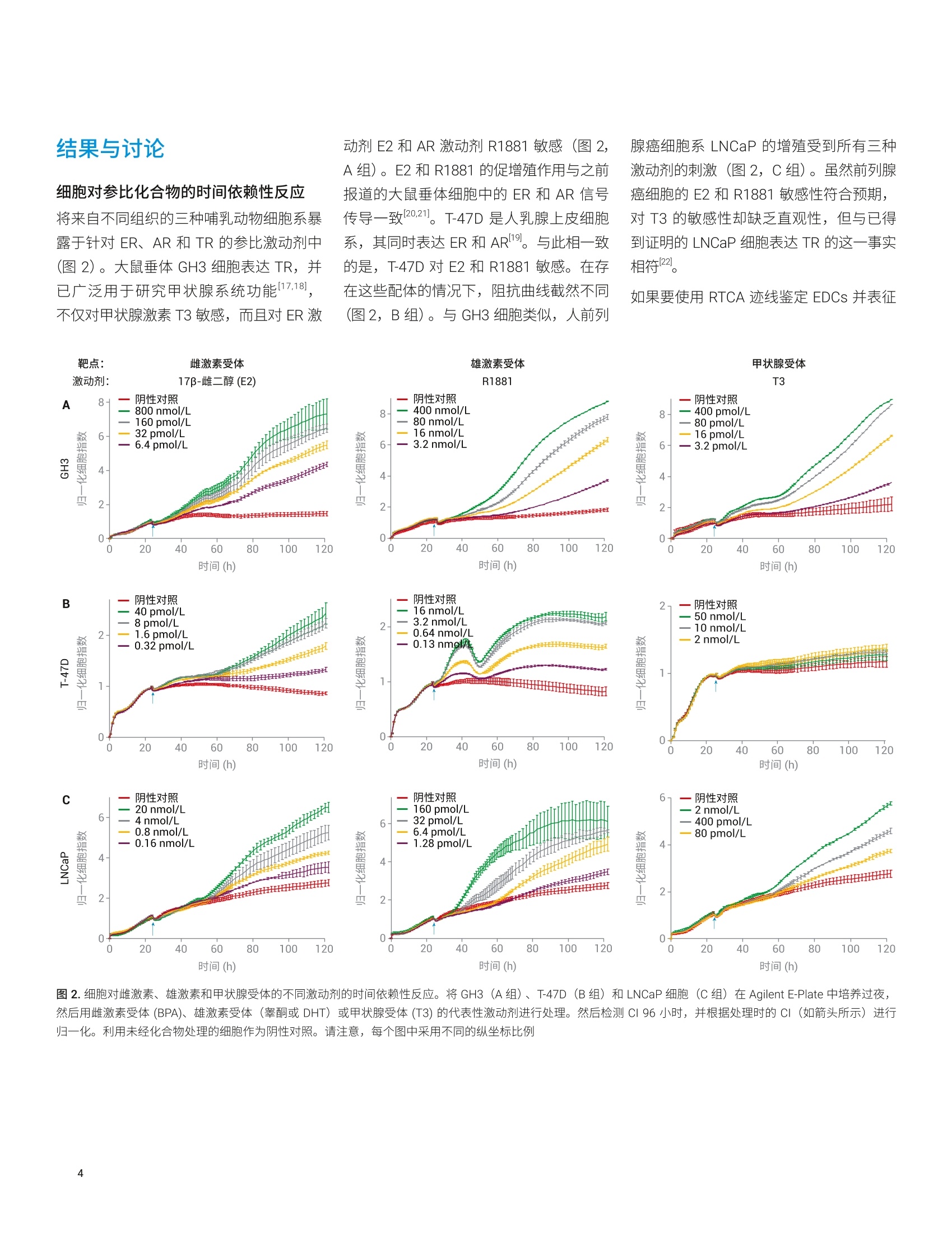
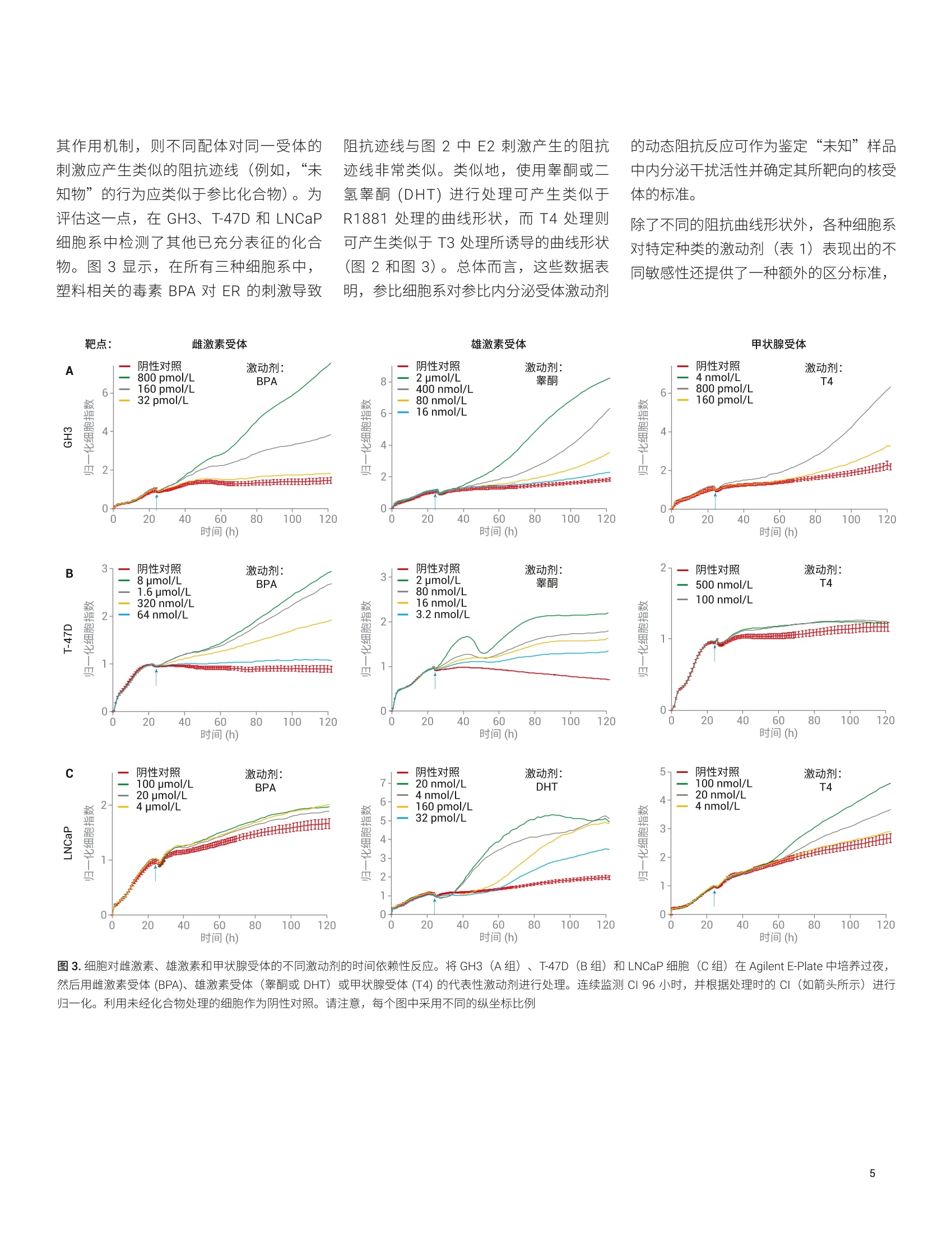
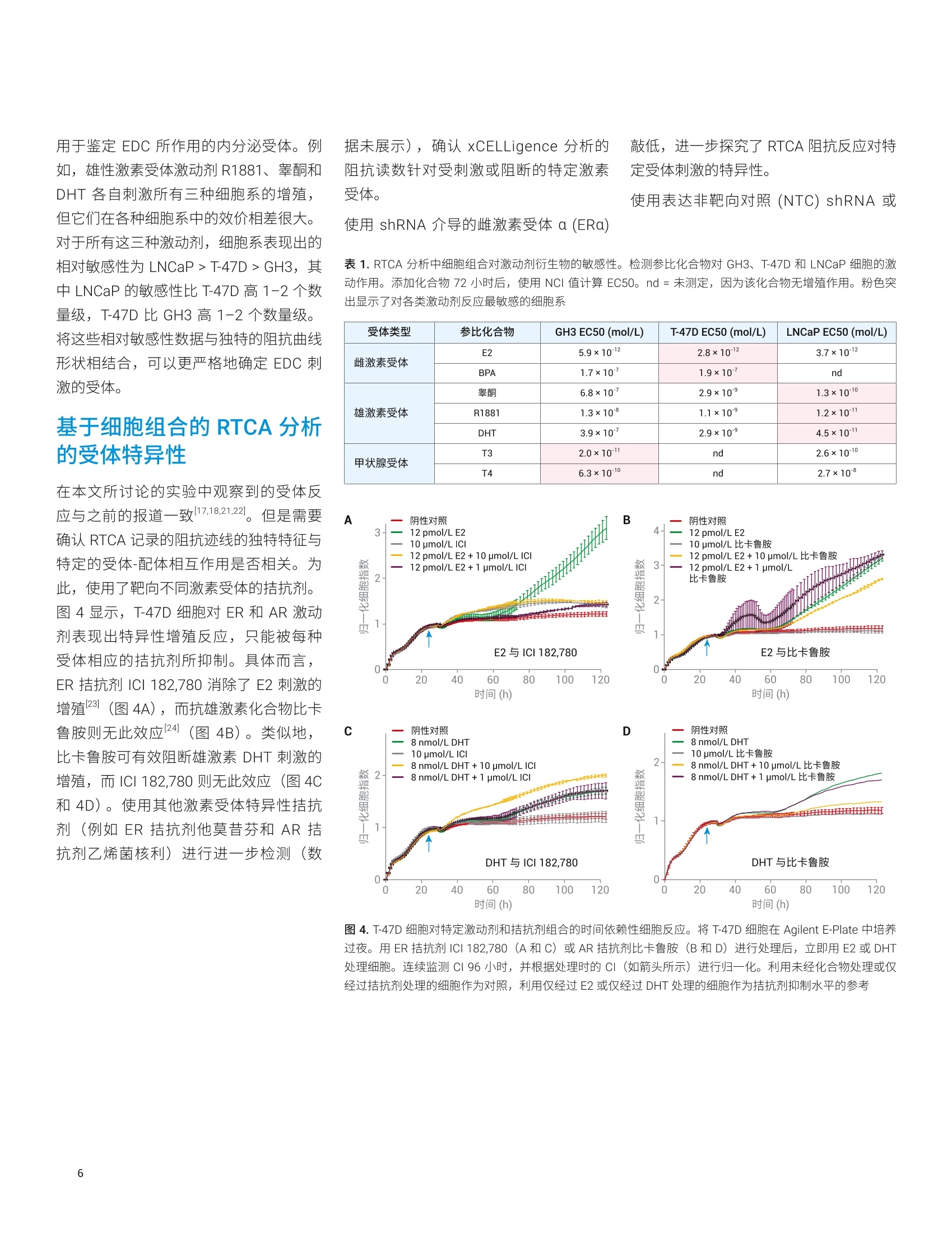
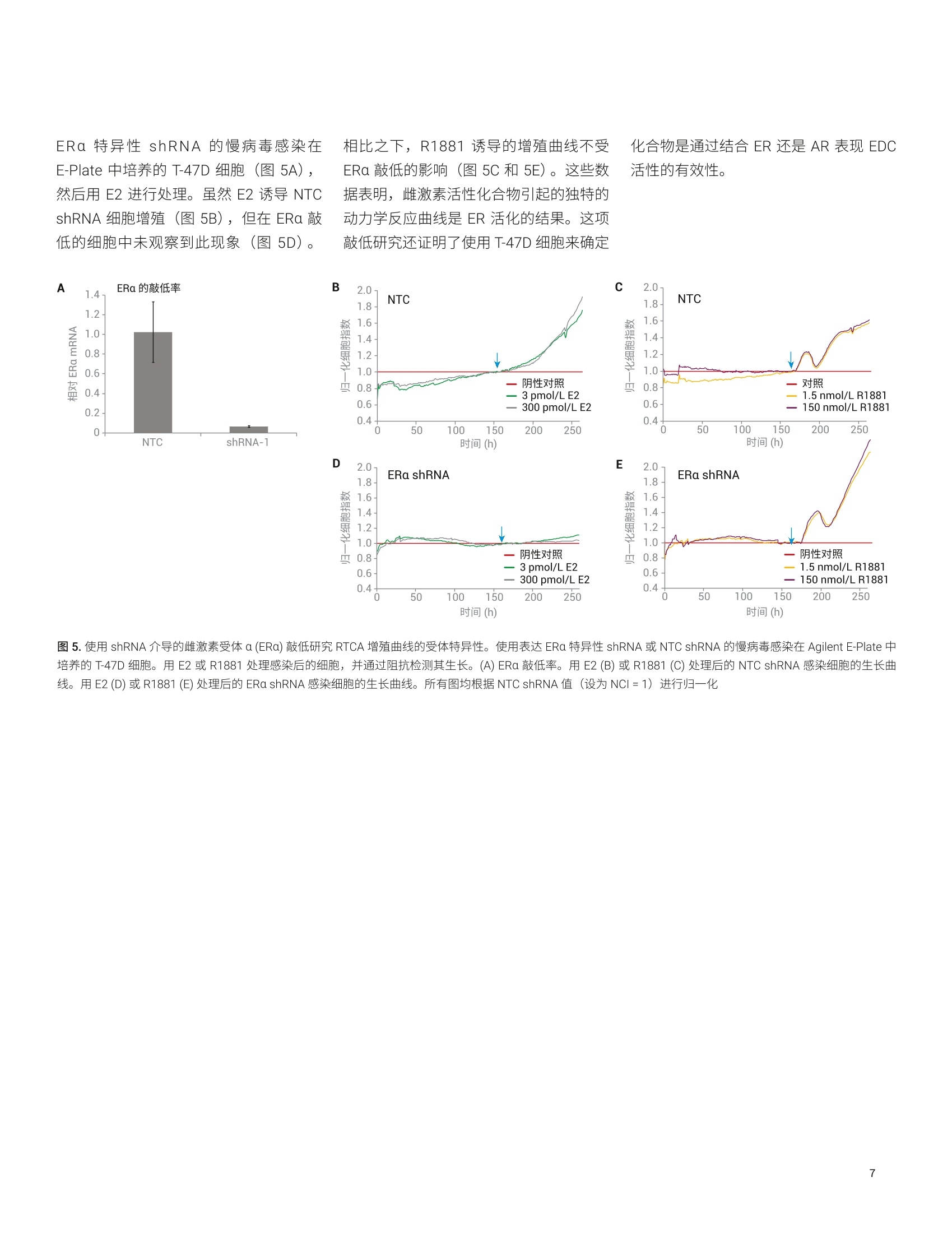
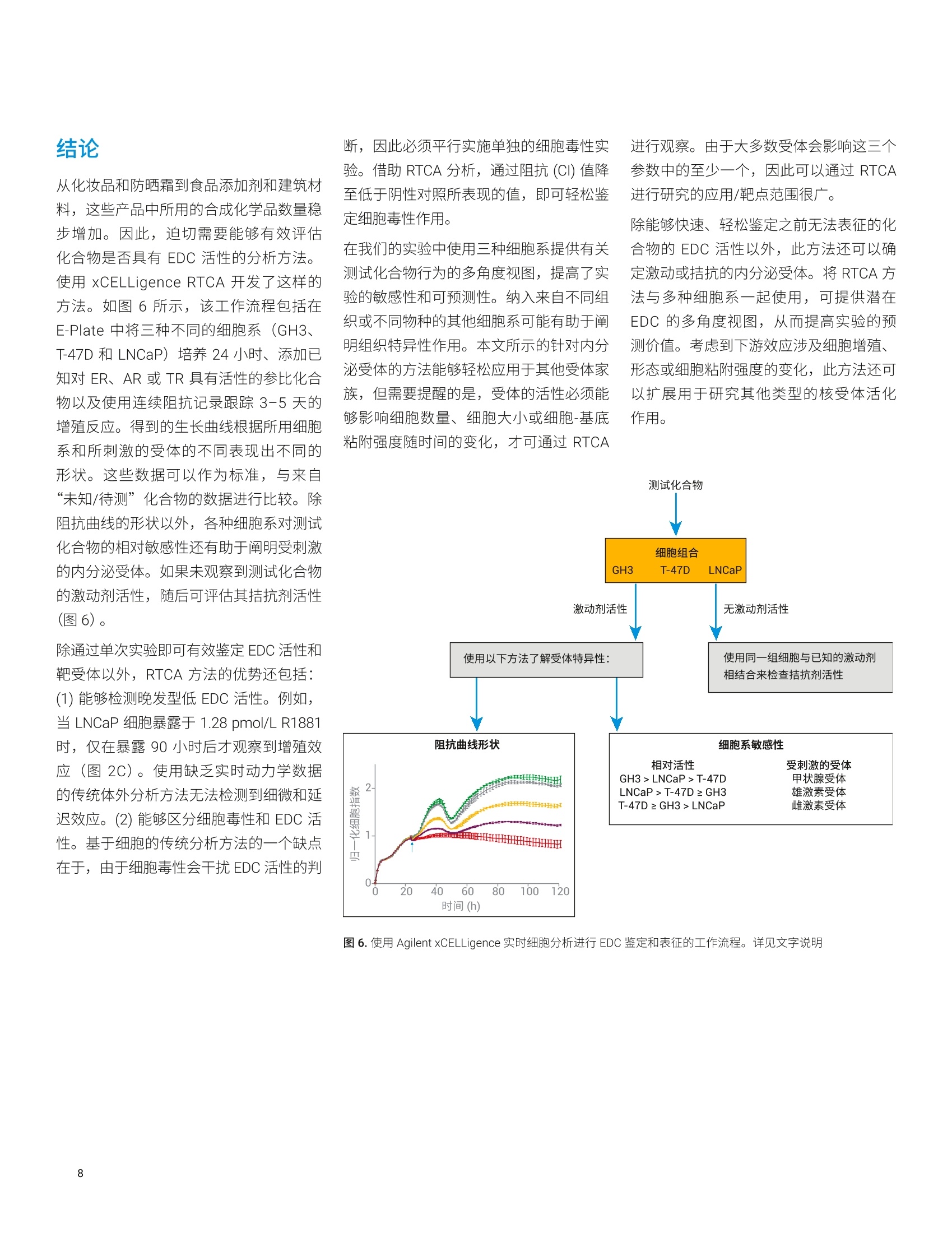
使用基于细胞组合的实时分析技术来鉴定和表征内分泌干扰物 Diana Guimet, Can Jin, David Santa Ana, Yama Abassi 本应用简报介绍了一种基于细胞的分析方法,该方法使用 Agilent xCELLigence 实时细胞分析 (RTCA)仪定量、非侵入性且连续地检测细胞对目标化学物质的反应。分析了三种哺乳动物细胞系(对ER、AR 或 TR调节剂均有反应)对参比激动剂和拮抗剂的实时反应。然后将各个细胞系的独特特异性和敏感性用作评价未知化合物的标准。该分析的有效性通过分子和细胞生物学技术得到确认。 安捷伦科技有限公司 美国加利福尼亚州圣地亚哥 前言 内分泌干扰化学物质 (EDCs) 是指能够干扰内源性激素通过其同源核受体调节体内稳态的能力的一类物质。通过模仿配体本(激动剂)或抑制配体结合活性(拮抗剂)3.4,EDCs 会导致生殖、神经、增生性和免疫疾病5。在使用消费品的过程中,人类可能直接暴露于 EDC。另外,由于消费品、农药和药物的许多成分生物降解性较差,容易在环境中累积b,使人和野生生物通过皮肤、吸入、生殖和口服途径暴露于 EDC。 富含 EDC 的废水导致鱼类出现双性特征,以及乳腺癌与双酚A之间的相关性仅仅是凸显 EDC 问题严重性的两个示例。在消费品中使用这些化合物或在环境中广泛使用之前,必须开发出更有效的方法来鉴定这些化合物。 单孔 A 雌激素、雄激素和甲状腺激素系统是多种关键生理功能的主要调节剂,也是许多EDCs 的靶点。过去,人们采用各种体内和体外试验来检测与雌激素受体(ER)、雄激素受体(AR)或甲状腺激素受体(TR)相互作用的 EDCs。在这些方法中,基于细胞的分析方法尤其有效,原因在于: 受体靶点存在于其正常的生化环境中(最大程度提高了生理相关性) 激素受体靶点仍与其下游反应(包括转录活化、细胞周期调控和增殖11.4,15,16l)相关,从而提供多种 EDC活性读出指标 但是,基于细胞的传统体外分析方法有一个最大的局限性,它们只能生成终点数据,仅代表细胞对处理/暴露的动态连续反应的快照。使用此类有限的数据集可能导致得出虚假结论,并且无法准确评估化合物的体内行为。 Agilent XCELLigence RTCA 阻抗分析法的功能单元是一组与微孔板(AgilentE-Plate,图1)底部表面融合的微金电极生物传感器。当加入导电溶液(例如缓冲液或生长培养基)时,在这些电极上施加弱电压便能产生电流。这种现象取决于电极与溶液的相互作用,因此电极-溶液界面之间的贴壁细胞会阻碍电流。阻抗的大小取决于细胞数量、细胞大小以及细胞-基底之间的粘附强度。值得注意的是,大量研究表明,细胞活力和行为不受微金电极生物传感器表面的影响,也不受电压(以用户定义的频率间歇性施加 22mV电压)影响。 (玻璃或 PET) 图1.细胞阻抗分析原理概览。(A)添加细胞之前和之后, Agilent XCELLigence 电子微孔板 (E-Plate) 单个孔的侧视图。(生物传感器和细胞未按比例绘制)。在不存在细胞的情况下,电流自由流过培养基,在生物传感器之间形成完整的电路。随着细胞粘附到生物传感器上并进行增殖,电流受阻,由此提供有关细胞数量、细胞大小和细胞-基底粘附强度的灵敏读数。(B) Agilent E-Plate 俯视照片。与A图中的简化示意图相比,从照片可以看出电极实际上是一个交错的阵列,覆盖70%以上的孔底面积。尽管在微金电极生物传感器的表面上也可以看到细胞,但孔中间无生物传感器的区域有利于显微成像 由于雌激素、雄激素和甲状腺激素信号转导各自控制着许多影响细胞数量、细胞大小或细胞-基底粘附强度的生化通路,因此使用细胞阻抗可以轻松检测和表征干扰这些信号转导的化合物。 xCELLigence 仪器和数据绘图 本研究中的所有阻抗实验均使用 AgilentXCELLigence 96 孔电子微孔板 (E-Plate96) 在 xCELLigence 实时细胞分析(RTCA) 多板 (MP)仪器上进行。该仪器置于标准组织培养箱中,培养箱条件设置为37°℃恒温和5% CO。所有检测均使用生物学重复样品,并至少重复进行两次独立实验。xCELLigence 仪器记录的阻抗值使用无单位的参数“细胞指数”(CI)进行报告,该参数定义为 (Z-Zb)/15,其中 Z,和Z,分别是存在和不存在细胞的情况下的阻抗值。数据通常以归一化细胞指数(NCI) 进行绘图,其中 NCI = (CIA)/(CIg),其中A=目标时间点,B=即将添加化合物之前的时间点。所有 ECso 值均使用RTCA 2.0软件进行计算。 细胞、培养基和实验详情 将 T-47D 细胞置于在 RPMI1640 (其中含有10%的常规FBS) 中维持培养。在分析前4天,将这些细胞置于不含酚红的RPMI 1640(含有经活性炭处理的 10%FBS)中进行预处理。在所有分析中均采用这种不含雌激素的培养基。 将LNCAP 细胞置于 RPMI 1640(其中含有10%的常规FBS)中维持培养。分析所用的培养基为不含酚红的 RPMI 1640(含有经活性炭处理的10%FBS)。 将 GH3 细胞置于 F12k 中维持培养,其中含有 2.5% FBS和15%马血清。分析所用的培养基为 DMEM, 其中含有经活性炭处理的 4%FBS. 对于所有细胞类型,在E-Plate 中过夜培养后,对细胞进行处理,并使用 XCELLigence仪器每小时检测一次细胞反应,总共持续120小时。 使用慢病毒转导颗粒进行 ERa基因的shRNA 敲低。将细胞接种到E-Plate 上的生长培养基中,过夜培养,第二天将病毒颗粒直接加入细胞中。立即将 E-Plate 置于 xCELLigence 仪器中,检测整个实验过程中细胞的生长情况,包括处理和检测基因敲低介导的反应。实验结束时,收集细胞,通过 qPCR 检查敲低效率。 细胞对参比化合物的时间依赖性反应将来自不同组织的三种哺乳动物细胞系暴露于针对 ER、AR 和TR的参比激动剂中(图2)。大鼠垂体 GH3细胞表达 TR,并已广泛用于研究甲状腺系统功能17.18,不仅对甲状腺激素 T3敏感,而且对ER激 动剂E2和AR 激动剂R1881敏感(图2,A组)。E2和R1881的促增殖作用与之前报道的大鼠垂体细胞中的 ER和 AR信号传导一致120.21。。T-47D 是人乳腺上皮细胞系,其同时表达 ER 和AR19。与此相一致的是,:,T-47D 对E2 和R1881敏感。在存在这些配体的情况下,阻抗曲线截然不同(图2,B组)。与 GH3细胞类似,人前列 图2.细胞对雌激素、雄激素和甲状腺受体的不同激动剂的时间依赖性反应。将 GH3 (A组)、T-47D(B组) 和LNCaP细胞 (C组) 在 Agilent E-Plate 中培养过夜,然后用雌激素受体(BPA)、雄激素受体(睾酮或 DHT) 或甲状腺受体 (T3)的代表性激动剂进行处理。然后检测 CI 96小时,并根据处理时的CI(如箭头所示)进行归一化。利用未经化合物处理的细胞作为阴性对照。请注意,每个图中采用不同的纵坐标比例 腺癌细胞系 LNCaP 的增殖受到所有三种激动剂的刺激(图2,C组)。虽然前列腺癌细胞的E2和R1881敏感性符合预期,对T3的敏感性却缺乏直观性,但与已得到证明的LNCaP 细胞表达 TR 的这一事实相符22。 如果要使用 RTCA 迹线鉴定 EDCs 并表征 其作用机制,则不同配体对同一受体的刺激应产生类似的阻抗迹线(例如,“未知物”的行为应类似于参比化合物)。为评估这一点,在 GH3、T-47D 和 LNCaP细胞系中检测了其他已充分表征的化合物。图3显示,在所有三种细胞系中,塑料相关的毒素BPA对ER 的刺激导致 阻抗迹线与图2中E2刺激产生的阻抗迹线非常类似。类似地,使用睾酮或二氢睾酮(DHT)进行处理可产生类似于R1881处理的曲线形状,而T4处理则可产生类似于T3处理所诱导的曲线形状(图2和图3)。总体而言,这些数据表明,参比细胞系对参比内分泌受体激动剂 图3.细胞对雌激素、雄激素和甲状腺受体的不同激动剂的时间依赖性反应。将 GH3(A组)、T-47D(B组)和LNCaP细胞 (C组) 在Agilent E-Plate 中培养过夜,然后用雌激素受体(BPA)、雄激素受体(睾酮或 DHT) 或甲状腺受体(T4)的代表性激动剂进行处理。连续监测CI 96小时,并根据处理时的CI(如箭头所示)进行归一化。利用未经化合物处理的细胞作为阴性对照。请注意,每个图中采用不同的纵坐标比例 的动态阻抗反应可作为鉴定“未知”样品中内分泌干扰活性并确定其所靶向的核受体的标准。 除了不同的阻抗曲线形状外,各种细胞系对特定种类的激动剂(表1)表现出的不同敏感性还提供了一种额外的区分标准, 用于鉴定 EDC 所作用的内分泌受体。例如,雄性激素受体激动剂R1881、睾酮和DHT 各自刺激所有三种细胞系的增殖,但它们在各种细胞系中的效价相差很大。对于所有这三种激动剂,细胞系表现出的相对敏感性为 LNCaP>T-47D>GH3,其中 LNCaP 的敏感性比 T-47D高1-2个数量级,T-47D比 GH3 高1-2个数量级。将这些相对敏感性数据与独特的阻抗曲线形状相结合,可以更严格地确定 EDC 刺激的受体。 基于细胞组合的 RTCA 分析的受体特异性 在本文所讨论的实验中观察到的受体反应与之前的报道一致[17,18,21,22。但是需要确认 RTCA 记录的阻抗迹线的独特特征与特定的受体-配体相互作用是否相关。为此,使用了靶向不同激素受体的拮抗剂。图4显示,, T-47D细胞对ER和AR激动剂表现出特异性增殖反应,只能被每种受体相应的拮抗剂所抑制。具体而言,ER 拮抗剂 ICI 182,780 消除了E2刺激的增殖23(图4A),而抗雄激素化合物比卡鲁胺则无此效应124(图4B)。类似地,比卡鲁胺可有效阻断雄激素 DHT 刺激的增殖,而 ICI 182,780则无此效应(图4C和4D)。使用其他激素受体特异性拮抗剂(例如ER拮抗剂他莫昔芬和 AR 拮抗剂乙烯菌核利)进行进一步检测(数 敲低,进一步探究了 RTCA 阻抗反应对特定受体刺激的特异性。 使用表达非靶向对照 (NTC) shRNA 或 表 1. RTCA 分析中细胞组合对激动剂衍生物的敏感性。检测参比化合物对 GH3、T-47D 和 LNCaP 细胞的激动作用。添加化合物72小时后,使用 NCI 值计算 EC50。nd=未测定,因为该化合物无增殖作用。粉色突出显示了对各类激动剂反应最敏感的细胞系 受体类型 参比化合物 GH3 EC50 (mol/L) T-47D EC50 (mol/L) LNCaP EC50 (mol/L) 雌激素受体 E2 5.9×10~2 2.8×10 3.7×1012 BPA 1.7×10' 1.9×10' nd 雄激素受体 睾酮 6.8×10 2.9×10 1.3×10 R1881 1.3×10 1.1×10 1.2×10 DHT 3.9×10' 2.9×10 4.5×10 甲状腺受体 T3 2.0×10 nd 2.6×100 T4 6.3×10 nd 2.7×10 图4.T-47D 细胞对特定激动剂和拮抗剂组合的时间依赖性细胞反应。将 T-47D 细胞在 Agilent E-Plate 中培养过夜。用ER 拮抗剂 ICI 182,780 (A和C) 或AR拮抗剂比卡鲁胺(B和D)进行处理后,立即用E2或 DHT处理细胞。连续监测CI 96小时,并根据处理时的CI(如箭头所示)进行归一化。利用未经化合物处理或仅经过拮抗剂处理的细胞作为对照,利用仅经过E2或仅经过 DHT 处理的细胞作为拮抗剂抑制水平的参考 ERa 特异性 shRNA 的慢病毒感染在E-Plate中培养的 T-47D细胞(图5A),然后用E2进行处理。虽然 E2 诱导 NTCshRNA 细胞增殖(图5B),但在ERa 敲低的细胞中未观察到此现象(图5D)。 相比之下, R1881 诱导的增殖曲线不受ERa 敲低的影响(图5C和5E)。这些数据表明,雌激素活性化合物引起的独特的动力学反应曲线是 ER 活化的结果。这项敲低研究还证明了使用T-47D细胞来确定 化合物是通过结合 ER 还是 AR 表现 EDC活性的有效性。 ERa 的敲低率 2.0 图5.使用 shRNA 介导的雌激素受体 a (ERa) 敲低研究 RTCA 增殖曲线的受体特异性。使用表达ERa 特异性 shRNA 或 NTC shRNA 的慢病毒感染在 Agilent E-Plate中培养的T-47D细胞。用E2或 R1881处理感染后的细胞,并通过阻抗检测其生长。(A) ERa 敲低率。用E2(B)或 R1881 (C) 处理后的 NTC shRNA 感染细胞的生长曲线。用E2(D)或 R1881 (E) 处理后的 ERa shRNA 感染细胞的生长曲线。所有图均根据 NTC shRNA值(设为NCI=1)进行归一化 结论 从化妆品和防晒霜到食品添加剂和建筑材料,这些产品中所用的合成化学品数量稳步增加。因此,迫切需要能够有效评估化合物是否具有EDC 活性的分析方法。使用 xCELLigence RTCA 开发了这样的方法。如图6所示,该工作流程包括在E-Plate 中将三种不同的细胞系(GH3、T-47D 和 LNCaP)培养24小时、添加已知对ER、AR 或 TR具有活性的参比化合物以及使用连续阻抗记录跟踪3-5天的增殖反应。得到的生长曲线根据所用细胞系和所刺激的受体的不同表现出不同的形状。这些数据可以作为标准,与来自“未知/待测”化合物的数据进行比较。除阻抗曲线的形状以外,各种细胞系对测试化合物的相对敏感性还有助于阐明受刺激的内分泌受体。如果未观察到测试化合物的激动剂活性,随后可评估其拮抗剂活性(图6)。 除通过单次实验即可有效鉴定 EDC 活性和革受体以外, RTCA 方法的优势还包括:(1)能够检测晚发型低 EDC 活性。例如,当LNCaP 细胞暴露于 1.28 pmol/L R1881时,仅在暴露90小时后才观察到增殖效应(图2C)。使用缺乏实时动力学数据的传统体外分析方法无法检测到细微和延迟效应。(2)能够区分细胞毒性和EDC 活性。基于细胞的传统分析方法的一个缺点在于,由于细胞毒性会干扰 EDC 活性的判 断,因此必须平行实施单独的细胞毒性实验。借助 RTCA 分析,通过阻抗(CI)值降至低于阴性对照所表现的值,即可轻松鉴定细胞毒性作用。 在我们的实验中使用三种细胞系提供有关测试化合物行为的多角度视图,提高了实验的敏感性和可预测性。纳入来自不同组织或不同物种的其他细胞系可能有助于阐明组织特异性作用。本文所示的针对内分泌受体的方法能够轻松应用于其他受体家族,但需要提醒的是,受体的活性必须能够影响细胞数量、细胞大小或细胞-基底粘附强度随时间的变化,才可通过 RTCA 进行观察。由于大多数受体会影响这三个参数中的至少一个,因此可以通过 RTCA进行研究的应用/靶点范围很广。 除能够快速、轻松鉴定之前无法表征的化合物的EDC 活性以外,此方法还可以确定激动或拮抗的内分泌受体。将 RTCA方法与多种细胞系一起使用,可提供潜在EDC 的多角度视图,从而提高实验的预测价值。考虑到下游效应涉及细胞增殖、形态或细胞粘附强度的变化,此方法还可以扩展用于研究其他类型的核受体活化作用。 时间(h) ( 1.Yang, O. et al. Endocrine-DisruptingChemicals: Review of T o xicologicalMechanisms Using MolecularPathway Analysis.J . Cancer Prev. 2015,20(1),12-24 ) ( 2. Grimaldi, M . et al. Reporter Cell Lines for the Characterization ofthe Interactions Between Human Nuclear Receptors a nd Endocrine Disruptors. Front. Endocrinol. 2 015, 6(62), doi: 10.3389 ) 3. ( Swedenborg, E. e t al. E n docrineDisruptive Chemicals: Mechanisms Of Action And Involvement InMetabolic Disorders. J. Mol.Endocrinol . 2009,43,1-10 ) 4. Hotchkiss, A. K. et al. Fifteen YearsAfter"Wingspread"-EnvironmentalEndocrine Disrupters and Humanand Wildlife Health: Where We AreToday and Where We Need to Go.Toxicol. Sci. 2008, 105, 235-259 5. Sharpe, R. M.; Irvine, S. HowStrong is the Evidence of a LinkBetween Environmental Chemicalsand Adverse Effects on HumanReproductive Health? BMJ 2004,328,447-451 6. Gronemeyer, H.; Gustafsson, J.-A.;Laudet, V.Principles for Modulationof the Nuclear Receptor Superfamily.Nat. Rev. Drug Discov. 2004,3,950-964 www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 C安捷伦科技(中国)有限公司,2019 2019年11月1日,中国出版5994-1064ZHCNAN12DE.5668287037 ( 7. Bovee, T.F; Pickkemaat, M. G.Bioactivity-Based Screening of Antibiotics and Hormones. J. Chromatogr. A. 2009,1216, 8035-8050 ) ( 8. D oisneau-Sixou, S. F . et a l. Estrogenand Antiestrogen Regulation o f CellCycle Progression i n Breast CancerCells. Endocr. Relat. Cancer 2003, 10, 179-186 ) ( 9. S chriks, M. et a l. T-Screen to QuantifyFunctional Potentiating, Antagonisticand Thyroid Hormone-Like Activitiesof Poly Halogenated A romaticHydrocarbons (PHAHs). T o xicol.In Vitro.2006,20,490-498 ) ( 10. G hisari, M. e t al. E ffects of CurrentlyUsed Pesticides a nd Their M ixtures on the Function of Thyroid Hormoneand Aryl Hydrocarbon R eceptor in Cell Culture. Toxicol. Appl. Pharmacol. 2015,284,292-303 ) 11. Caporali, S. et al. Distinct SignalingPathways Mediate Stimulation of CellCycle Progression and Prevention ofApoptotic Cell Death by Estrogen inRat Pituitary Tumor PR1 Cells. Mol.Biol. Cell. 2003,14,5051-5059 ( 12. O 'Hara, L. et al. Pituitary AndrogenReceptor Signalling RegulatesProlactin but Not Gonadotrophins inthe Male Mouse.PLoS One 2015, 10(3),e0121657 ) ( 13. Wang, S. et al. Proliferation Assays f or Estrogenicity Testing with High Predictive Value for the In V ivo Uterotrophic Effect. J.Steroid. Biochem. Mol. Biol. 2012, 128, 98-106 ) ( 14. H sieh, M .-L. ; Juang, H.-H. CellGrowth Effects on Triiodothyronineand E xpression o f Thyroid HormoneReceptor in Prostate CarcinomaCells. J. Androl. 2005, 26 (3), 422-428 ) ( 15. Osborne,C.; Wakeling,A.; Nicholson,R. Fulvestrant: an OestrogenReceptor Antagonist with a Novel Mechanism of Ac t ion. Br. J. C ancer. 2004,Supp/ 1,S2-S6 ) ( 16. Osguthorpe, D. J.; Hagler, A. T .Mechanism of Androgen ReceptorAntagonism by Bicalutamide in the Treatment of Prostate C ancer. Biochemistry 2011, 50(19), 4105-4113 ) 本应用介绍了一种基于细胞的分析方法,该方法使用 Agilent xCELLigence 实时细胞分析 (RTCA) 仪定量、非侵入性且连续地检测细胞对目标化学物质的反应。分析了三种哺乳动物细胞系(对 ER、AR 或 TR 调节剂均有反应)对参比激动剂和拮抗剂的实时反应。然后将各个细胞系的独特特异性和敏感性用作评价未知化合物的标准。该分析的有效性通过分子和细胞生物学技术得到确认。
确定




还剩7页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《细胞中对参比激动剂和拮抗剂的实时反应检测方案(细胞定量分析)》,该方案主要用于其他中对参比激动剂和拮抗剂的实时反应检测,参考标准--,《细胞中对参比激动剂和拮抗剂的实时反应检测方案(细胞定量分析)》用到的仪器有Agilent xCELLigence RTCA DP实时无标记细胞分析仪、Agilent xCELLigence RTCA MP实时无标记细胞分析仪
推荐专场
相关方案
更多
该厂商其他方案
更多

















