方案详情
文
在存在或不存在免疫球蛋白 G 同种型特异性抗体的情况下,检测肿瘤细胞(作为靶细胞)对自然杀伤 (NK) 细胞活性(作为效应细胞)的反应,以确定能否使用 Agilent xCELLigence 系统研究细胞介导的细胞毒性(依赖于特异性抗体的细胞介导的细胞毒性 (ADCC))。结果表明,在单层粘附肿瘤细胞上添加 NK 细胞悬液并未导致阻抗或细胞指数 (CI) 产生变化,因为 NK 细胞并不接触底层生物传感器。
但是,这些非粘附 NK 细胞分泌的穿孔素和颗粒酶激活了 Caspase,导致肿瘤细胞凋亡。功能异常和垂死的肿瘤细胞脱离生物传感器,从而减少了生物传感器表面上存活和粘附的细胞数量。我们的发现为 Agilent xCELLigence 系统能够用于动态实时检测细胞介导的细胞毒性和特异性抗体的影响提供了令人信服的证据。
方案详情

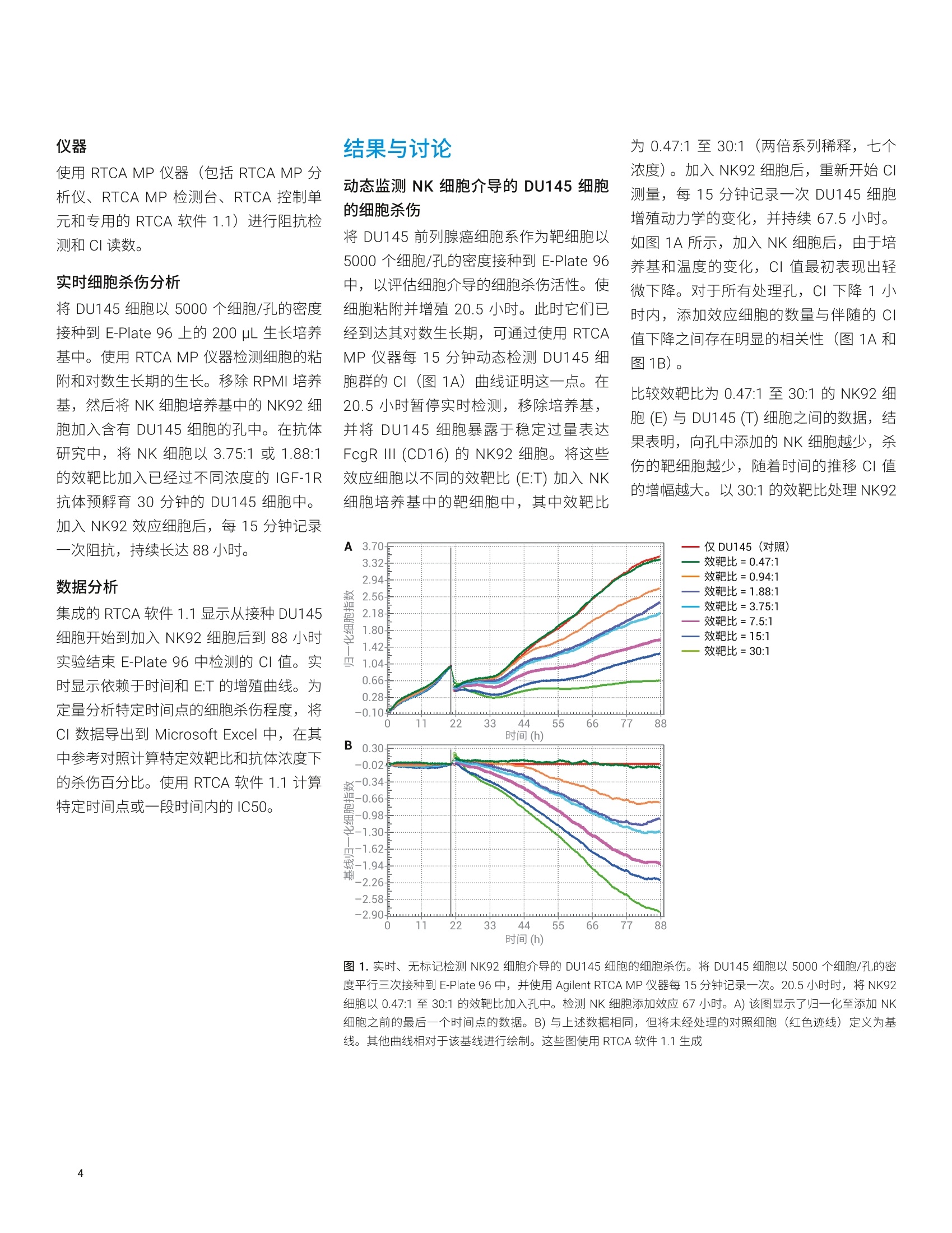
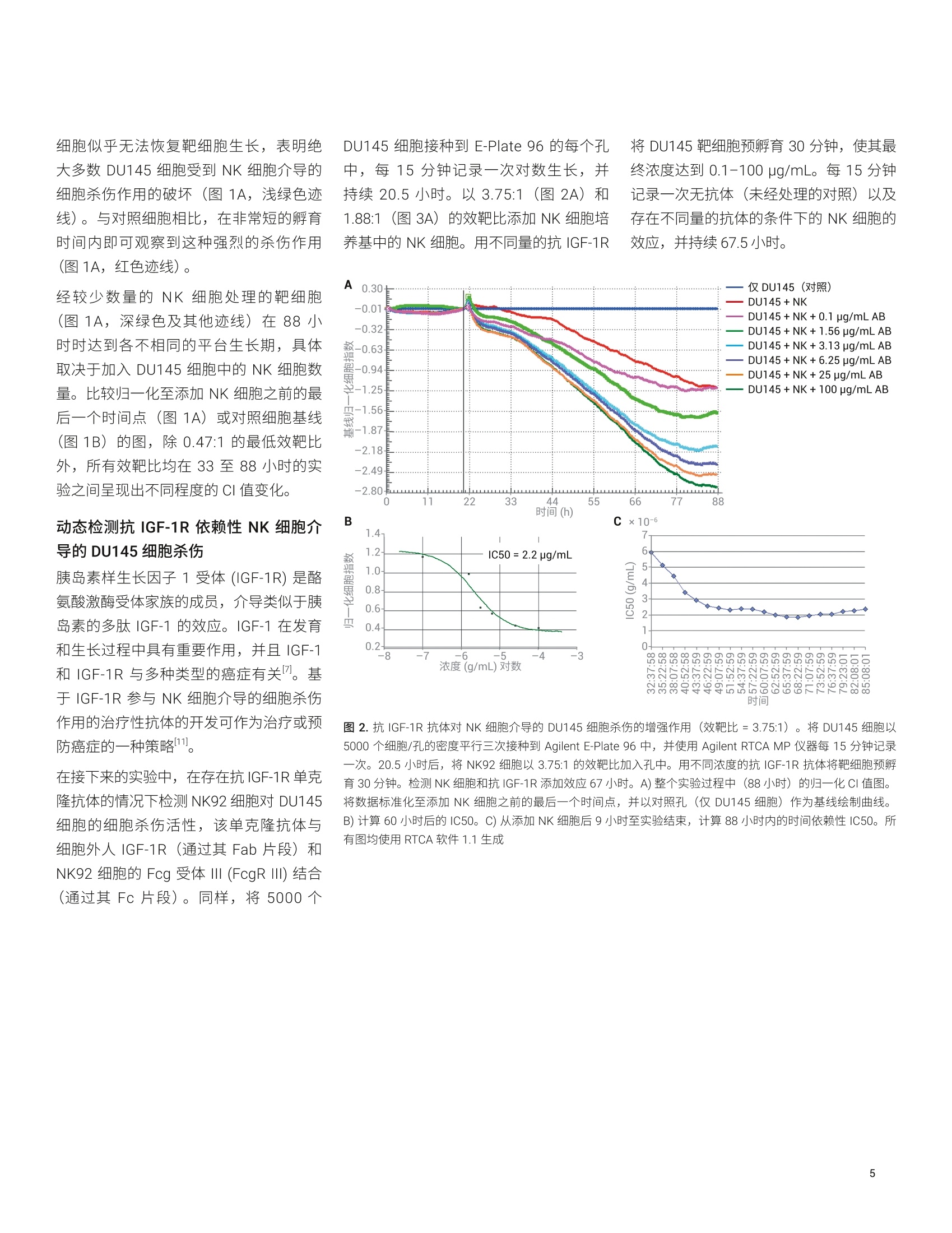
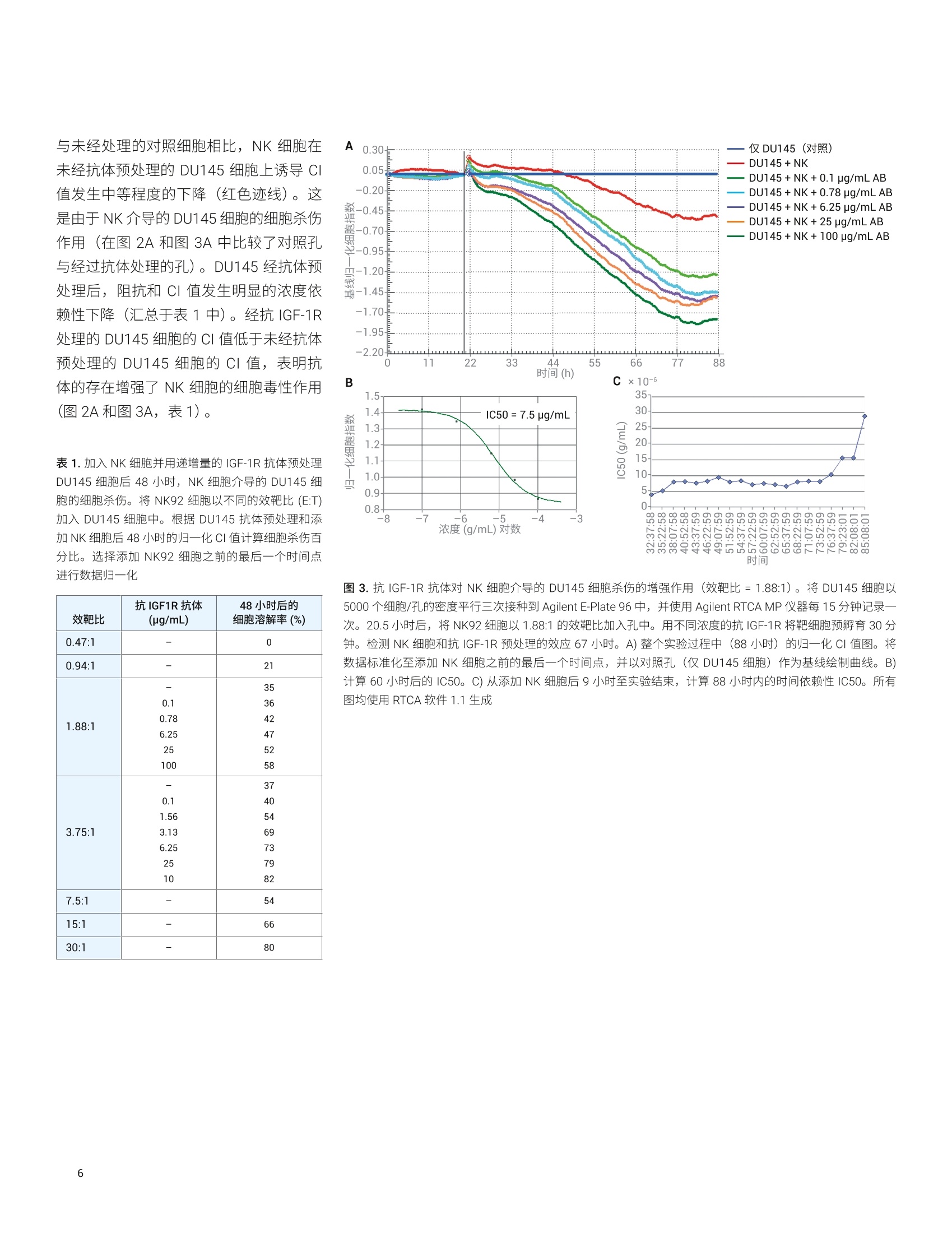
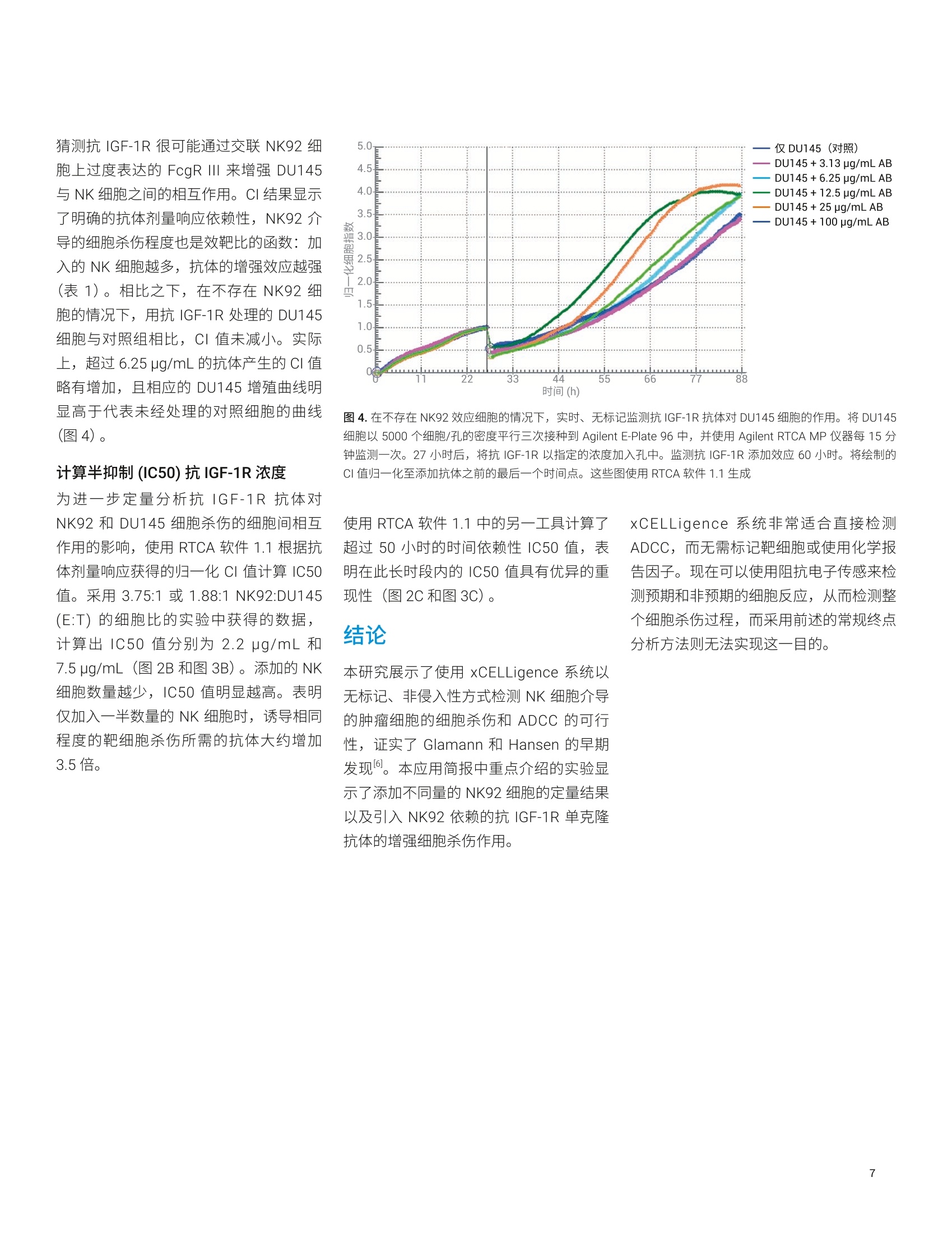
Lauren Jachimowicz 博士, Peifang Ye, Ming Lei, Jeffrey Li, Garret Guenther 博士 安捷伦科技有限公司 细胞分析事业部 美国加利福尼亚州圣地亚哥 在存在或不存在免疫球蛋白G同种型特异性抗体的情况下,检测则瘤细胞(作为靶细胞)对自然杀伤 (NK)细胞活性(作为效应细胞)的反应,以确定能否使用 AgilentxCELLigence 系统研究细胞介导的细胞毒性(依赖于特异性抗体的细胞介导的细胞毒性(ADCC))。结果表明,在单层粘附肿瘤细胞上添加 NK 细胞悬液并未导致阻抗或细胞指数(CI)产生变化,因为 NK 细胞并不接触底层生物传感器。 但是,这些非粘附 NK 细胞分泌的穿孔素和颗粒酶激活了 Caspase,导致肿瘤细胞凋亡。功能异常和垂死的肿瘤细胞脱离生物传感器,从而减少了生物传感器表面上存活和粘附的细胞数量。我们的发现为Agilent xCELLigence 系统能够用于动态实时检测细胞介导的细胞毒性和特异性抗体的影响提供了令人信服的证据。 细胞介导的细胞毒性是机体保护自身免受病原体攻击的重要手段,为对抗病毒、细菌或寄生虫以及转化细胞和功能异常的细胞提供了必要的防御机制。它在维持免疫系统的稳态方面也具有重要作用。细胞介导的细胞毒性具体涉及识别并破坏其他细胞或入侵微生物的白细胞。实现此功能的两种类型的效应白细胞: 细胞毒性T淋巴细胞以及 NK 细胞 骨髓细胞,例如巨噬细胞、嗜酸性粒细胞和嗜中性粒细胞 细胞毒性T淋巴细胞的最重要的作用是消除感染病毒的细胞。受感染的细胞除在细胞表面表达自身的细胞特异性肽以外,还可通过主要组织相容性复合体(MHC)1类分子展示加工过的病原体特异性抗原。感染病毒的细胞将这些病原体特异性抗原呈递给细胞毒性T淋巴细胞,这些T淋巴细胞能够区分自身肽和非自身肽,并据此调动抗病毒应答。 细胞毒性T淋巴细胞和 NK细胞以互补的方式保护人体,因为 NK 细胞特异性识别并杀灭表现出 MHCI类表达下降(或丧失)的细胞。 值得注意的是,肿瘤细胞通常也表现为MHCI类分子表达降低,为 NK 细胞有效的抗肿瘤作用奠定了基础。细胞介导的细胞毒性是以下复杂的细胞间相互作用的结果: · 直接的细胞间相互作用引起受感染细胞或病原体经由巨噬细胞和嗜中性粒细胞的内化和吞噬作用 细胞毒性T淋巴细胞分泌Fas 配体和肿瘤坏死因子等细胞因子 细胞毒性T淋巴细胞和 NK 细胞释放颗粒蛋白,例如穿孔素和颗粒酶 骨髓细胞释放毒性分子,例如活性氧中间体和溶酶体酶 通过交联抗体的靶细胞调理作用过程也促进了细胞脱颗粒。在这一复杂的事件中,抗体首先使用其 Fab 片段特异性粘附在要杀灭的靶细胞表面的抗原上。调理作用通过将靶细胞的 Fc 片段直接与相应效应细胞(细胞毒性T淋巴细胞和 NK 细胞)的 Fc 受体特异性结合,使靶细胞和效应细胞具有所需的空间邻近性。随后的 Fc受体交联是这种免疫应答的重要组成部分,导致靶细胞死亡,称为抗体依赖性细胞介导的细胞毒性(ADCC)。 检测 NK细胞刮性和依赖于添加抗体的细胞毒性新方法的原理 检测和定量效应细胞(例如细胞毒性T淋巴细胞和 NK 细胞)的杀伤能力,对于确定生理和病理生理状态、对感染性病毒的应答以及自身免疫反应很重要。这些类型的研究对于表征杀伤过程本身和鉴定溶解介质也至关重要。可使用从血液中分离的新鲜淋巴细胞或 NK 细胞系作为效应细胞,在体外研究通过 ADCC 进行的细胞介导的细胞毒性现象。合适的体外靶细胞包括感染病原体的真核细胞和肿瘤细胞系。 检测细胞介导的细胞毒性的最常用的方法是基于靶细胞膜完整性丧失的释放试验。在添加效应细胞导致靶细胞溶解后长达4小时内,检测预标记有铬(Cr)或钢(In) 的靶细胞所释放的放射性标记物,或分析释放到培养基中的乳酸脱氢酶(LDH)等天然物质。这些物质的释放可间接衡量效应细胞介导的靶细胞溶解引起的细胞损伤程度4。 替代方法还包括流式细胞分析、基于酶联免疫吸附测定的颗粒酶测量以及显微镜形态分析析。 所有这些复杂、繁琐的研究都是终点分析,, 次次检测通常需要几个小时。放射性标记的靶细胞的使用也不方便,可能影响研究的细胞反应。相比之下, AgilentxCELLigence 系统能够对细胞行为进行实时、动态、无标记和非侵入性分析。该系统基于测量阻抗的微电子传感器1. xCELLigence系统 xCELLigence产品线包括安捷伦实时细胞分析(RTCA) 单板 (SP) 和多板 (MP) 仪器。 RTCA SP 和MP均包括若干组件: RTCA 分析仪,用于实时数据采集 用于运行和分析实验的软件 RTCA SP 检测台或 RTCA MP检测台RTCA SP 和MP检测台安装在标准的细胞培养培养箱中,确保温度、湿度和 CO,环境受控。 RTCA SP 和 MP检测台分别容纳1-6个96孔板 (Agilent E-Plate 96)。 每个孔底的生物传感器可测量细胞阻抗。测得的生物传感器阻抗以细胞指数表示。CI 是一个无量纲值,表示与生物传感器接触的细胞群随时间推移的阻抗变化。 xCELLigence 系统的基本原理是细胞附着并粘附在特殊设计的E-Plate 的每个细胞培养孔底部的传感器表面。与生物传感器接触时,粘附细胞充当绝缘体,阻碍电流流动。利用 RTCA 仪器连续测量阻抗的这些细微变化,在空间上进行积分,并由仪器软件表示为随时间变化的CI。 XCELLigence 系统还包括 Agilent RTCA双重用途 (DP 和 DPlus)仪器,该仪器最多支持两种形式的三个基于阻抗的检测板:用于细胞分析的16 孔 E-Plate 16和用于细胞侵袭/迁移分析的 CIM-Plate 16。实时CI监测可以反映以下基本参数: 细胞增殖动力学 细胞大小 细胞粘附强度 细胞活性 细胞形态 RTCA SP、MP、DP和 DPlus 等仪器适用于研究药物研发、毒理学、癌症生物学、医学微生物学和病毒学等各种研究领域中的细胞反应。xcELLigence 系统所用的基于阻抗的技术已被证明适用于各种应用,例如细胞增殖和细胞毒性10、细胞粘附和伸展2、细胞培养质量控制8、受体酪氨酸激酶活化、肥大细胞活化”以及G蛋白偶联受体(GPCR) 活化。在本应用简报中,最重要的应用是结合 ADCC以检测 NK 细胞活性6. 细胞培养和抗体 DU145 靶细胞和 NK92 效应细胞来自ATCC。经过基因修饰的 NK92细胞可以稳定地也量表达 FcgR Ⅲ。两种细胞系均在标准细胞培养箱中于37°C和5% CO,的条件下生长。将 DU145细胞置于含有10% FCS (Perbio Science)、1%青霉素和1%链霉素 (Roche AppliedScience) 的 RPMI 1640 GlutaMAX 培养基 (Gibco) 中维持培养。将 NK92细胞置于L-谷氨酰胺 (Gibco)、10% FCS、10%马血清(Invitrogen)、0.1 mmol/L2-巯基乙醇(Gibco)、0.2 mmol/L肌醇(Calbiochem)、0.02 mmol/L 叶酸 (AlfaAesar) 和 10 ng/mL 白细胞介素-2(细胞系统)的 MEM a 培养基中进行培养。用于 ADCC 分析的单克隆抗体对人 IGF-1R具有特异性,通过其 Fc 片段与人 FcgRⅢ结合。 仪器 使用 RTCA MP 仪器(包括 RTCA MP分析仪、RTCA MP 检测台、RTCA 控制单元和专用的 RTCA 软件1.1)进行阻抗检测和CI读数。 实时细胞杀伤分析 将 DU145细胞以5000个细胞/孔的密度接种到 E-Plate 96 上的 200 pL生长培养基中。使用 RTCA MP 仪器检测细胞的粘附和对数生长期的生长。移除 RPMI 培养基,然后将 NK 细胞培养基中的 NK92 细胞加入含有 DU145 细胞的孔中。在抗体研究中,将 NK 细胞以 3.75:1 或 1.88:1的效靶比加入已经过不同浓度的 IGF-1R抗体预孵育30分钟的 DU145 细胞中。加入 NK92 效应细胞后,每15分钟记录一次阻抗,持续长达88小时。 数据分析 集成的 RTCA软件1.1显示从接种 DU145细胞开始到加入NK92 细胞后到88小时实验结束 E-Plate 96 中检测的CI 值。实时显示依赖于时间和 E:T 的增殖曲线。为定量分析特定时间点的细胞杀伤程度,将CI数据导出到 Microsoft Excel 中,在其中参考对照计算特定效靶比和抗体浓度下的杀伤百分比。使用 RTCA 软件1.1计算特定时间点或一段时间内的IC50。 动态监测NK 细胞介导的 DU145细胞的细胞杀伤 将 DU145 前列腺癌细胞系作为靶细胞以5000个细胞/孔的密度接种到 E-Plate 96中,以评估细胞介导的细胞杀伤活性。使细胞粘附并增殖20.5小时。此时它们已经到达其对数生长期,可通过使用 RTCAMP 仪器每15分钟动态检测 DU145 细胞群的CI(图1A)曲线证明这一点。在20.5小时暂停实时检测,移除培养基,并将 DU145细胞暴露于稳定过量表达FcgR ⅢII (CD16) 的 NK92 细胞。将这些效应细胞以不同的效靶比 (E:T) 加入 NK细胞培养基中的靶细胞中,其中效靶比 为0.47:1至30:1(两倍系列稀释,七个浓度)。加入 NK92细胞后,重新开始CI测量,每15分钟记录一次 DU145细胞增殖动力学的变化,并持续67.5小时。如图1A所示,加入 NK 细胞后,由于培养基和温度的变化,CI 值最初表现出轻微下降。对于所有处理孔,CI下降1小时内,添加效应细胞的数量与伴随的CI值下降之间存在明显的相关性(图1A和图1B)。 比较效靶比为 0.47:1 至30:1的 NK92 细胞(E)与 DU145 (T)细胞之间的数据,结果表明,向孔中添加的NK 细胞越少,杀伤的靶细胞越少,随着时间的推移CI值的增幅越大。以30:1的效靶比处理 NK92 A 3.70 仅DU145 (对照) 3.32- 效靶比=0.47:1 效靶比=0.94:1 2.94- 2.56- 效靶比=1.88:1 效靶比=3.75:1 2.18- ........... 效靶比=7.5:1 1.80- 效靶比=15:1 1.42- 效靶比=30:1 1.04- 0.66- 0.28- -0.10m 0 11 22 33 44 55 66 77 88 时间(h) 时间(h) 图 1.实时、无标记检测 NK92 细胞介导的 DU145 细胞的细胞杀伤。将 DU145 细胞以5000个细胞/孔仔密度平行三次接种到 E-Plate 96 中, 并使用 Agilent RTCA MP 仪器每15分钟记录一次。20.5小时时,将 NK92细胞以 0.47:1 至30:1的效靶比加入孔中。检测 NK 细胞添加效应67小时。A)该图显示了归一化至添加 NK细胞之前的最后一个时间点的数据。B)与上述数据相同,但将未经处理的对照细胞(红红迹线)定义为基线。其他曲线相对于该基线进行绘制。这些图使用 RTCA软件1.1生成 细胞似乎无法恢复靶细胞生长,表明绝大多数 DU145 细胞受到 NK 细胞介导的细胞杀伤作用的破坏(图1A,浅绿色迹线)。与对照细胞相比,在非常短的孵育时间内即可观察到这种强烈的杀伤作用(图1A,红色迹线)。 经较少数量的 NK 细胞处理的靶细胞(图1A,深绿色及其他迹线)在88小时时达到各不相同的平台生长期,具体取决于加入 DU145 细胞中的 NK 细胞数量。比较归一化至添加 NK 细胞之前的最后一个时间点(图1A)或对照细胞基线(图1B)的图,除 0.47:1的最低效靶比外,所有效靶比均在33至88小时的实验之间呈现出不同程度的Cl值变化。 动态检测抗 IGF-1R 依赖性 NK 细胞介导的 DU145细胞杀伤 胰岛素样生长因子1受体(IGF-1R)是酪氨酸激酶受体家族的成员,介导类似于胰岛素的多肽 IGF-1的效应。IGF-1在发育和生长过程中具有重要作用,并且 IGF-1和 IGF-1R 与多种类型的癌症有关7。基于 IGF-1R 参与 NK 细胞介导的细胞杀伤作用的治疗性抗体的开发可作为治疗或预防癌症的一种策略11. 在接下来的实验中,在存在抗IGF-1R单克隆抗体的情况下检测 NK92 细胞对 DU145细胞的细胞杀伤活性,该单克隆抗体与细胞外人 IGF-1R (通过其Fab 片段)和NK92 细胞的 Fcg 受体ⅢI(FcgRIII) 结合(通过其Fc 片段)。同样,将5000个 DU145细胞接种到 E-Plate 96 的每个孔中,每15分钟记录一次对数生长,并持续20.5小时。以3.75:1(图2A)和1.88:1(图3A)的效靶比添加 NK 细胞培养基中的 NK 细胞。用不同量的抗 IGF-1R 将 DU145 靶细胞预孵育30分钟,使其最终浓度达到0.1-100 pg/mL。 每 15分钟记录一次无抗体(未经处理的对照)以及存在不同量的抗体的条件下的 NK 细胞的效应,并持续67.5小时。 时间 图 2.抗 IGF-1R 抗体对 NK 细胞介导的 DU145 细胞杀伤的增强作用(效靶比=3.75:1)。将 DU145 细胞以5000个细胞/孔的密度平行三次接种到 Agilent E-Plate 96 中, 并使用 Agilent RTCA MP 仪器每15分钟记录一次。20.5小时后,将 NK92细胞以 3.75:1的效靶比加入孔中。用不同浓度的抗 IGF-1R 抗体将靶细胞预孵育30分钟。检测 NK 细胞和抗 IGF-1R 添加效应67小时。A)整个实验过程中(88小时)的归一化CI值图。 将数据标准化至添加 NK 细胞之前的最后一个时间点,并以对照孔(仅DU145细胞)作为基线绘制曲线。 ( B)计算60 小 时后的 IC50。C) 从添加 NK 细胞后9小时至实验结束 , 计算88小时内的时间依赖性IC50。所有图均使 用 RTCA软件1.1生成 ) 与未经处理的对照细胞相比, NK 细胞在未经抗体预处理的 DU145细胞上诱导 CI值发生中等程度的下降(红色迹线)。这是由于 NK 介导的 DU145细胞的细胞杀伤作用(在图2A和图3A中比较了对照孔与经过抗体处理的孔)。 DU145 经抗体预处理后,阻抗和CI值发生明显的浓度依赖性下降(汇总于表1中)。经抗 IGF-1R处理的 DU145 细胞的 CI值低于未经抗体预处理的 DU145细胞的CI值,表明抗体的存在增强了 NK 细胞的细胞毒性作用(图2A和图3A,表1)。 表1.加入NK 细胞并用递增量的 IGF-1R抗体预处理DU145细胞后48小时, NK 细胞介导的 DU145 细胞的细胞杀伤。将 NK92 细胞以不同的效靶比 (E:T)加入 DU145细胞中。根据 DU145 抗体预处理和添加NK细胞后48小时的归一化CI值计算细胞杀伤百分比。选择添加 NK92细胞之前的最后一个时间点进行数据归一化 效靶比 抗IGF1R抗本(pg/mL) 48小时后的 细胞溶解率(%) 0.47:1 - 0 0.94:1 - 21 1.88:1 - 0.10.786.2525 100 353642475258 3.75:1 - 0.1 1.563.136.2525 10 37 405469737982 7.5:1 - 54 15:1 66 30:1 80 图3.抗 IGF-1R 抗体对 NK 细胞介导的 DU145细胞杀伤的增强作用(效靶比=1.88:1)。将 DU145 细胞以5000个细胞/孔的密度平行三次接种到 Agilent E-Plate 96中,并使用 Agilent RTCA MP 仪器每15分钟记录一次。20.5小时后,将 NK92 细胞以1.88:1的效靶比加入孔中。用不同浓度的抗 IGF-1R 将靶细胞预孵育30分钟。检测 NK 细胞和抗 IGF-1R 预处理的效应67小时。A)整个实验过程中(88小时)的归一化CI值图。将数据标准化至添加 NK 细胞之前的最后一个时间点,并以对照孔(仅 DU145细胞)作为基线绘制曲线。B)计算60小时后的IC50。C)从添加 NK 细胞后9小时至实验结束,计算88小时内的时间依赖性 IC50。所有图均使用 RTCA 软件1.1生成 猜测抗 IGF-1R 很可能通过交联NK92 细胞上过度表达的 FcgR ⅢII 来增强 DU145与 NK 细胞之间的相互作用。CI结果显示了明确的抗体剂量响应依赖性, NK92 介导的细胞杀伤程度也是效靶比的函数:加入的 NK 细胞越多,抗体的增强效应越强(表1)。相比之下,在不存在 NK92 细胞的情况下,用抗 IGF-1R 处理的 DU145细胞与对照组相比,CI值未减小。实际上,超过6.25 ug/mL 的抗体产生的CI值略有增加,且相应的 DU145 增殖曲线明显高于代表未经处理的对照细胞的曲线(图4)。 计算半抑制 (IC50)抗 IGF-1R 浓度 为进一步定量分析抗 IGF-1R抗体对NK92和DU145细胞杀伤的细胞间相互作用的影响,使用 RTCA 软件1.1根据抗体剂量响应获得的归一化CI 值计算 IC50值。采用3.75:1或 1.88:1 NK92:DU145(E:T)的细胞比的实验中获得的数据,计算出 IC50 值分别为2.2 ug/mL 和7.5 ug/mL (图2B和图3B)。添加的 NK细胞数量越少, IC50值明显越高。表明仅加入一半数量的 NK 细胞时,诱导相同程度的靶细胞杀伤所需的抗体大约增加3.5倍。 图4.在不存在 NK92 效应细胞的情况下,实时、无标记监测抗IGF-1R 抗体对DU145细胞的作用。将 DU145细胞以5000个细胞/孔的密度平行三次接种到 Agilent E-Plate 96 中, 并使用 Agilent RTCA MP仪器每15分钟监测则次。27小时后,将抗 IGF-1R以指定的浓度加入孔中。监测抗 IGF-1R 添加效应60小时。将绘制的CI值归一化至添加抗体之前的最后一个时间点。这些图使用RTCA 软件1.1生成 使用 RTCA 软件1.1中的另一工具计算了超过50小时的时间依赖性 IC50 值,表明在此长时段内的 IC50 值具有优异的重现性(图2C和图3C)。 本研究展示了使用 xCELLigence 系统以无标记、非侵入性方式检测 NK 细胞介导的肿瘤细胞的细胞杀伤和 ADCC 的可行性,证实了 Glamann 和 Hansen 的早期发现6。本应用简报中重点介绍的实验显示了添加不同量的 NK92 细胞的定量结果以及引入 NK92 依赖的抗 IGF-1R 单克隆抗体的增强细胞杀伤作用。 xCELLigence 系统非常适合直接检测ADCC, 而无需标记靶细胞或使用化学报告因子。现在可以使用阻抗电子传感来检测预期和非预期的细胞反应,从而检测整个细胞杀伤过程,而采用前述的常规终点分析方法则无法实现这一目的。 ( 1. Abassi, Y. A . et al. Label-Free, R eal-Time Monitoring of IgE-Mediated Mast Cell Activation on Microelectronic C ell sensor Arrays. J. Immunol. Methods 2004, 292,195-205 ) ( 2. Atienza,J. M. e t al. Label-Free and Real-Time Cell-Based Kinase Assay for Screening Selective and PotentReceptor Tyrosine Kinase InhibitorsUsing Microelectronic Sensor Array. J. Biomol. Screen. 2006, 11, 634-643 ) ( 3. Atienza, J. M. et a l . DynamicMonitoring of Cell Adhesion andSpreading on Microelectronic SensorArrays. J. Biomol. Screen.2005, 10, 795-805 ) ( 4. Brunner, K. T . e t al. Quantitative assay of the Lytic Action of ImmuneLymphoid Cells on 51-Cr-LabeledAllogeneic Target Cells In Vitro;Inhibition By Isoantibody and byDrugs.Immunology 1968, 14, 181 - 196 ) www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 C安捷伦仑技(中国)有限公司,2019 ( 5. De Meyer, K . et al . MorphometricAnalysis of Cytolysis in Cultured CellMonolayers: a S imple and Versatile Method for the E valuation of the Lytic Activity and the Fate of LAK cells.J . Immunol.Methods 2003,277,193-211 ) 6. ( Glamann, J.;Hansen, A. J.Dynamic Detection of N a tural K i llerCell-Mediated Cytotoxicity and C ellAdhesion by Electrical ImpedanceMeasurements. Assay Drug Dev. Technol.2006,4 , 555-63 ) ( 7. H artog, H . et al. The Insulin-LikeGrowth Factor 1 Receptor in Cancer:Old Focus, New Future. Eur. J . Cancer 2007,43,1895- 1 904 ) 8. ( K irstein, S . L . et al. Live Cell QualityControl and U tility of Real-TimeCell Electronic Sensing for AssayDevelopment. Assay Drug Dev.Technol.2006,4,545-553 ) 9. Yu, N. et al. Real Time Monitoringof Morphological Changes in LivingCells by Electronic Cell SensorArrays: an Approach to StudyG Protein-Coupled Receptors. Anal.Chem. 2006,78,35-43 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线:800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: ( 10. S olly, K.; Wang,X. et al. Application of Real-T i me Cell Electronic Sensing (RT-CES) T echnology to Cell-BasedAssays. Assay Drug Dev. Technol.2004,2,363-372 ) ( 11. Stagg,J.;Smyth, M. J. NK Cell-BasedImmunotherapy. Drug NewsPerspect.2007,20,155-163 ) 在存在或不存在免疫球蛋白 G 同种型特异性抗体的情况下,检测肿瘤细胞(作为靶细胞)对自然杀伤 (NK) 细胞活性(作为效应细胞)的反应,以确定能否使用 Agilent xCELLigence 系统研究细胞介导的细胞毒性(依赖于特异性抗体的细胞介导的细胞毒性 (ADCC))。结果表明,在单层粘附肿瘤细胞上添加 NK 细胞悬液并未导致阻抗或细胞指数 (CI) 产生变化,因为 NK 细胞并不接触底层生物传感器。但是,这些非粘附 NK 细胞分泌的穿孔素和颗粒酶激活了 Caspase,导致肿瘤细胞凋亡。功能异常和垂死的肿瘤细胞脱离生物传感器,从而减少了生物传感器表面上存活和粘附的细胞数量。我们的发现为 Agilent xCELLigence 系统能够用于动态实时检测细胞介导的细胞毒性和特异性抗体的影响提供了令人信服的证据。
确定




还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《自然杀伤细胞活性和抗体依赖性细胞中细胞毒性检测方案(细胞定量分析)》,该方案主要用于其他中细胞毒性检测,参考标准--,《自然杀伤细胞活性和抗体依赖性细胞中细胞毒性检测方案(细胞定量分析)》用到的仪器有Agilent xCELLigence RTCA eSight 实时细胞分析仪、Agilent xCELLigence RTCA S16实时无标记细胞分析仪
推荐专场
相关方案
更多
该厂商其他方案
更多
















