
方案详情
文
由于细胞培养液中成分复杂,极性差异很大。直接稀释进样分析容易导致基质干扰、色谱柱堵塞、回收率低等问题。因此本实验使用 Bond Elut C18 固相萃取柱,采取基质截留方法,对细胞培养液中水溶性维生素成分进行净化处理,并开发液相色谱检测方法,使用 Poroshell EC-C18 色谱柱对水溶性维生素进行检测,方法准确可靠,重现性良好。使用液液萃取方法,用正己烷对稀释后的培养液对脂溶性维生素进行萃取,并使用 Poroshell 120SB-C8 色谱柱开发了维生素 D3 和维 A 酸的分析检测方法。该前处理和色谱分离的方法,可用于培养基样品中水溶性和脂溶性维生素成分的快速检测。
方案详情

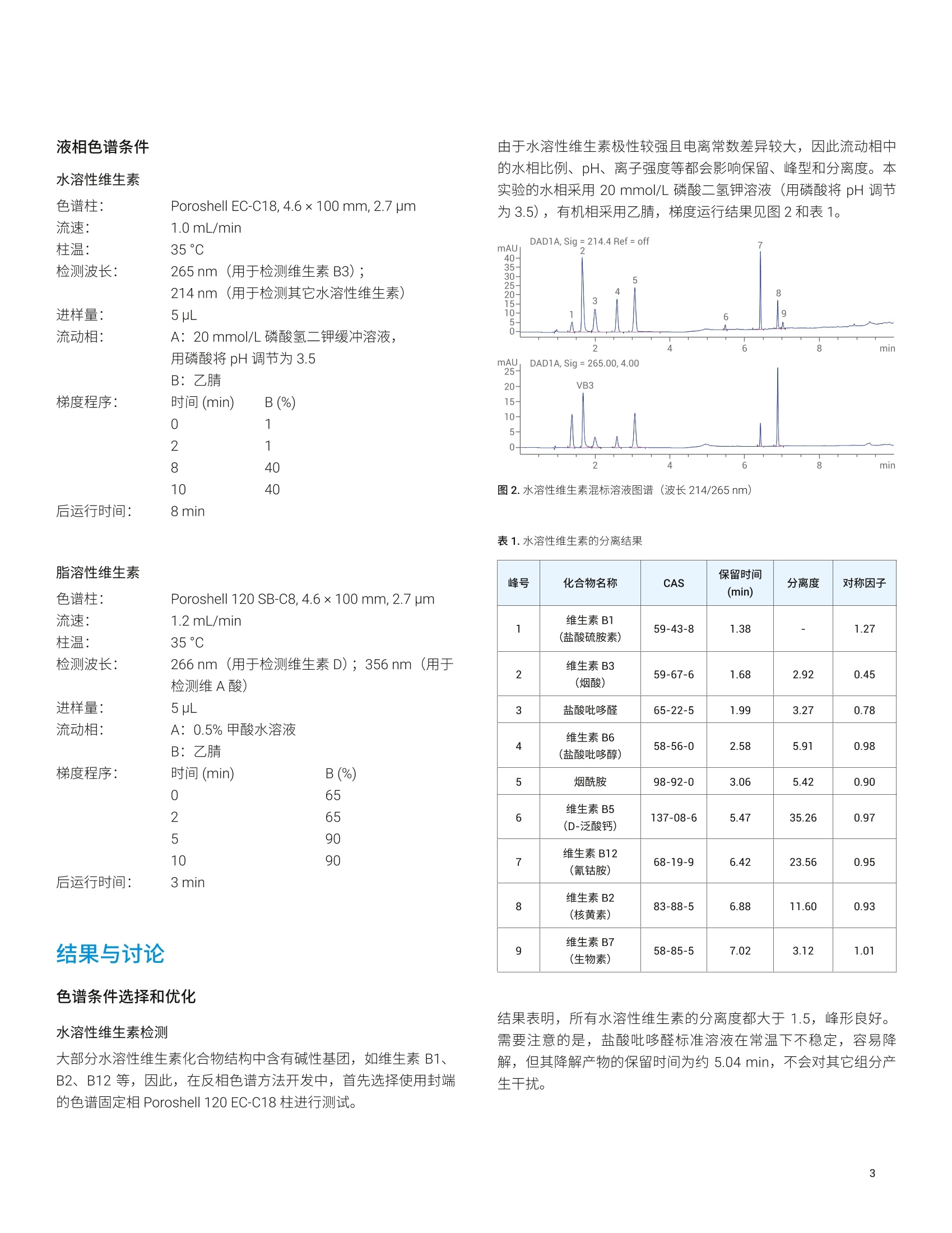
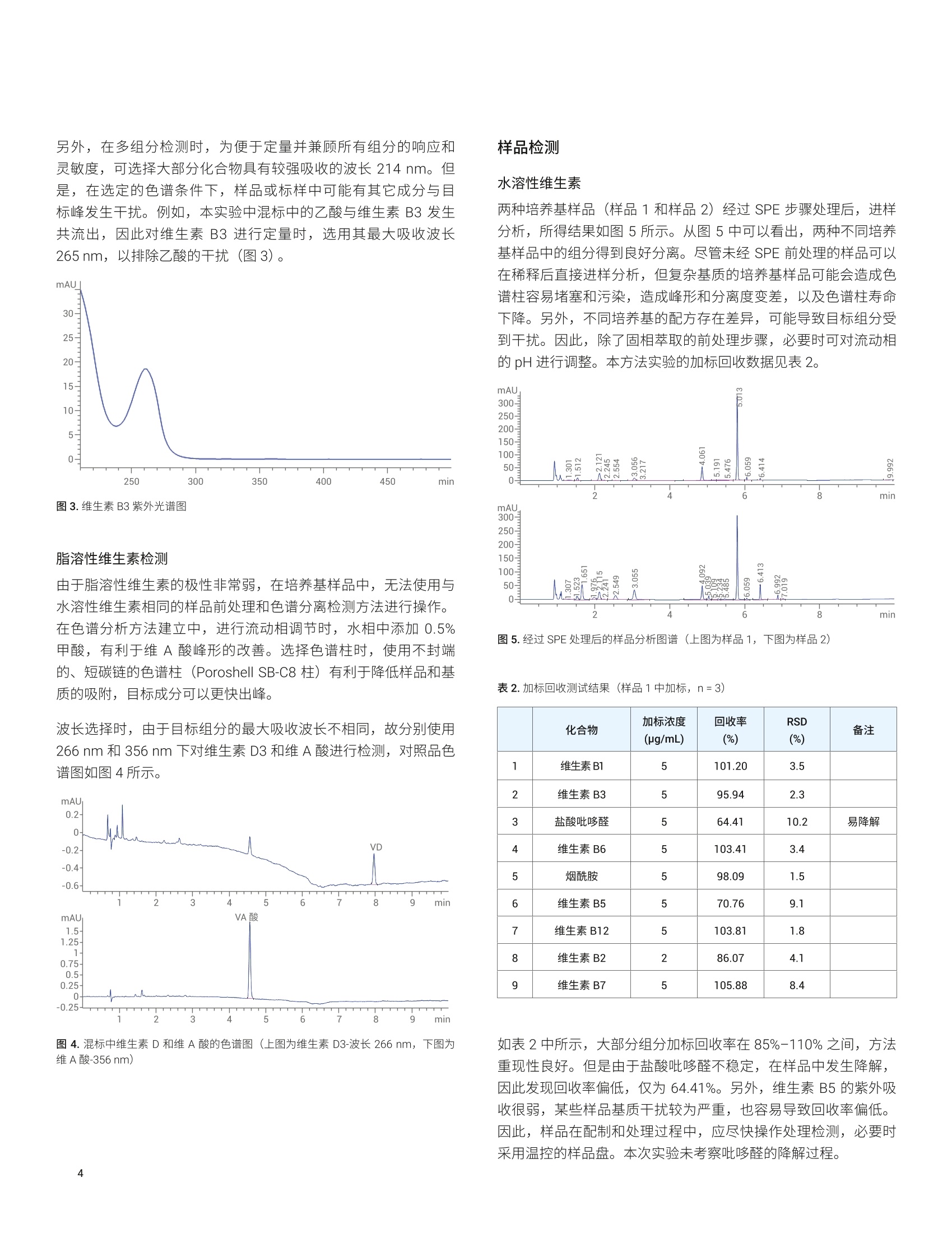
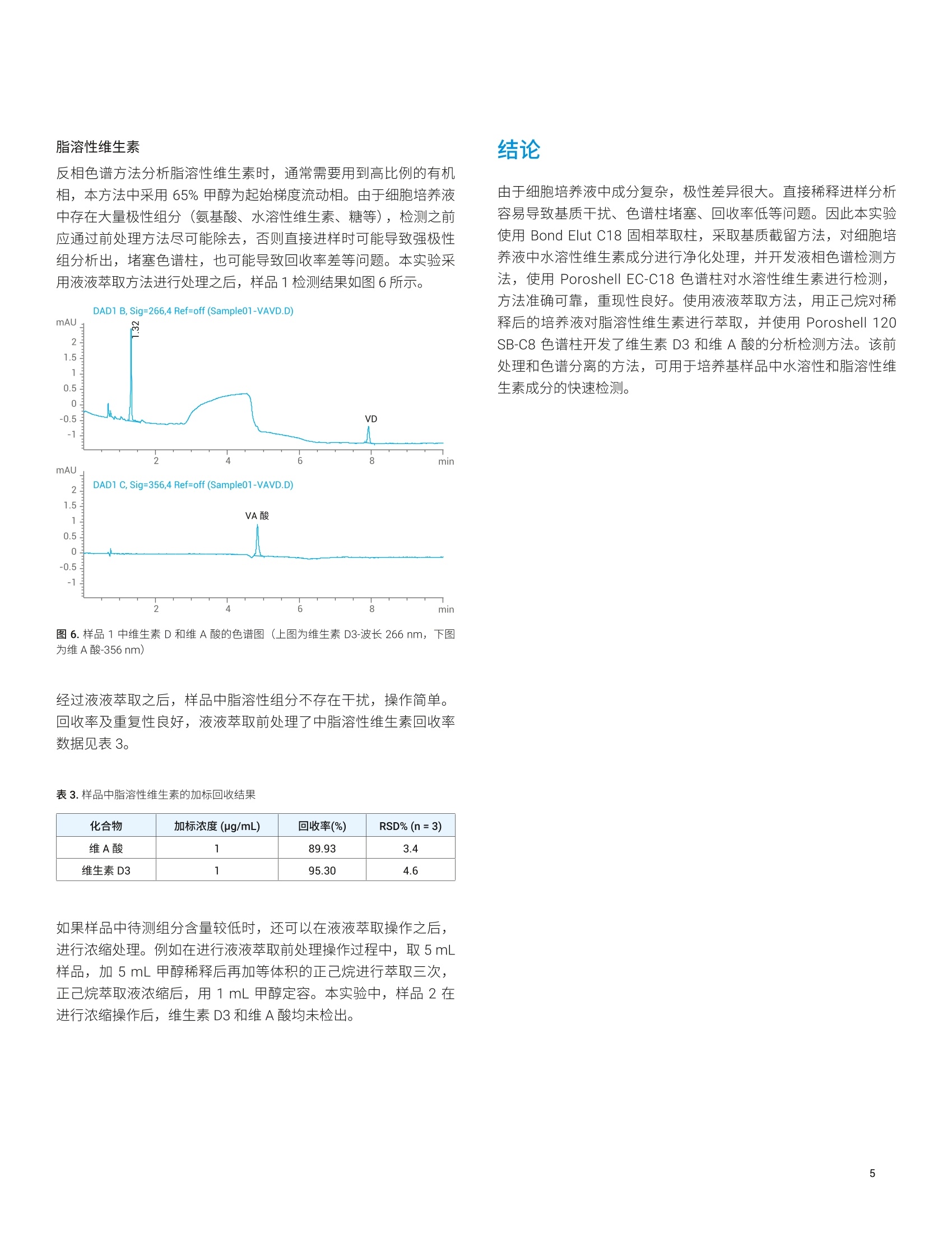
应用简报 Agilent生物制药Trusted Answers 使用 Agilent Poroshell 120色谱柱对细胞培养基中的维生素进行检测 雷启福 安捷伦科技(中国)有限公司 本文采用具有表面多孔层填料的 Agilent Poroshell 120色谱柱,结合固相萃取和液液萃取前处理方法,建立了细胞培养基中水溶性和脂溶性维生素的液相色谱分析方法。此方法成功应用于多种培养基中的9种水溶性维生素和2种脂溶性维生素的快速高效测定。 细胞培养基是提供细胞营养和促进细胞生长增殖的基础物质。在细胞培养基中,主要营养物质包括氨基酸、维生素、碳水化合物、无机盐等。其中,维生素是维持细胞生长的生物活性物质,在细胞代谢中具有调节和控制作用。培养基中的维生素通常包括生物素、叶酸、烟酰胺、泛酸、吡哆醇、核黄素、硫胺素、维生素B12、维生素A和维生素 D 等。无论是对于天然培养基(如动物血清)还是对于人工配制的培养基,都需要通过准确、可靠、灵敏的维生素检测方法,对培养基的生产进行质量控制,并对细胞培养过程中成分的变化进行监测。但是,由于培养基成分非常复杂,且水溶性和脂溶性差异很大,给分析方法的开发带来巨大挑战。 本文采用 Agilent Bond Elut C18固相萃取小柱对样品进行前处理,并利用 Agilent InfinityPoroshell 120 EC-C18 色谱柱建立了用于分析细胞培养基中的9种水溶性维生素的方法;采用液液萃取方法,并结合 Agilent Infinity Poroshell 120 SB-C8色谱柱,建立了用于分析细胞培养基中2种脂溶性维生素的分析方法。 试剂和样品 甲醇、乙腈、正己烷为色谱纯,磷酸氢二钾 (Emsure) 为优级纯,均购自默克化工 (Merck Sigma)。 维生素标准品维生素B1((盐酸硫胺素)、维生素B3(烟酸)、盐酸吡哆醛、维生素B6(盐酸吡哆醇)、烟酰胺、维生素B5(D-泛酸钙)、维生素B12(氰钴胺)、维生素B2(核黄素)、维生素B7(生物素)、维A酸、维生素D3等购自默克化工(MerckSigma)。 所用实验用水为 Millipore Milli-Q超纯水系统现制备的高纯去离子水。 样品为用户提供的细胞培养基(样品1和样品2)。 仪器和设备 ( Agilent 1260 Infinity 四元泵液相色谱系统 , 配备 DAD 检测器。色谱柱: ) ( - A gilent I nfinityLab Poroshell 120 EC-C18, 4.6×1 0 0 mm, 2.7 pm (部件号695975-902 ) +保护柱(部件号820750-911) ) ( - A gilent InfinityLa b Poroshell 120 SB-C8, 4.6×100 mm, 2.7 pm (部件号685975-906)+保护柱(部件号820750-923) ) 固相萃取装置: Vac Elut 12 真空萃取装置,带收集架,可容纳16×100 mm试管(部件号5982-9110) 固相萃取小柱: Agilent Bond Elut C18, 500 mg,6mL (部件号12102052) 标样配制 水溶性维生素 取9种水溶性维生素标准品,分别用水溶解,得到1 mg/mL 单标溶液(注:维生素B12需要加冰乙酸溶解后再加水稀释,维生素B2的浓度为 0.4 mg/mL)。各取单标溶液1mL, 加入10 mL容量瓶中,用水稀释至刻度,得到浓度各为100 pg/mL 混标储备液(其中维生素B2的浓度为 40 pg/mL)。取适量混标储备液,加水稀释为 10 pg/mL 混标工作溶液。绘制校准曲线时,取混标储备液配制系列校准标样(浓度为1-50 ug/mL)。 脂溶性维生素 用甲醇分别配制得到1mg/mL 的维生素A酸和维生素D3单标溶液。分别取两种单标溶液适量,用甲醇稀释,得到 100 pg/mL 混标储备液。取混标储备液适量,加甲醇稀释为 10pg/mL 混标工作溶液。绘制校准曲线时,取混标储备液配制系列校准标样(浓度为1-50 ug/mL)。 样品前处理 水溶性维生素检测样品 样品溶液:取1mL培养基加入5mL刻度试管中,加1mL水稀释后混匀。 加标样品溶液:取1mL培养基,加入100 uL 混标储备液,再加水稀释至2mL。 稀释后的样品溶液和加标样品溶液用固相萃取 (SPE) 小柱净化处理,操作步骤如图1所示。 图1.固相萃取流程 脂溶性维生素检测样品 样品溶液:取1mL培养基,加1mL甲醇稀释,混匀;加2 mL正己烷萃取(涡旋混合1min) 3次;静置分层后,将正己烷萃取液合并,用氮气吹近干,再用甲醇复溶至1mL,得到样品溶液。 加标样品溶液:另取1mL培养基,加入10 pL 混标储备液,再加990 uL甲醇稀释,混匀,同法进行萃取操作,得加标样品溶液。 液相色谱条件 水溶性维生素 色谱柱: Poroshell EC-C18,4.6×100 mm, 2.7 um流速: 1.0 mL/min柱温: 35°℃检测波长: 265nm(用于检测维生素B3);214nm (用于检测其它水溶性维生素)进样量: 5pL流动相: A: 20 mmol/L磷酸氢二钾缓冲溶液,用磷酸将 pH 调节为3.5B:乙腈梯度程序: 时间 (min) B(%)0 12 18 10 后运行时间: 8 min 色谱条件选择和优化 水溶性维生素检测 大部分水溶性维生素化合物结构中含有碱性基团,如维生素B1、B2、B12等,因此,在反相色谱方法开发中,首先选择使用封端的色谱固定相 Poroshell 120 EC-C18 柱进行测试。 由于水溶性维生素极性较强且电离常数差异较大,因此流动相中的水相比例、pH、离子强度等都会影响保留、峰型和分离度。本实验的水相采用20 mmol/L磷酸二氢钾溶液(用磷酸将 pH 调节为3.5),有机相采用乙腈,梯度运行结果见图2和表1。 图2.水溶性维生素混标溶液图谱(波长214/265nm) 表1.水溶性维生素的分离结果 峰号 化合物名称 CAS 保留时间(min) 分离度 对称因子 1 维生素B1 (盐酸硫胺素) 59-43-8 1.38 一 1.27 2 维生素B3(烟酸) 59-67-6 1.68 2.92 0.45 3 盐酸吡哆醛 65-22-5 1.99 3.27 0.78 4 维生素B6(盐酸吡哆醇) 58-56-0 2.58 5.91 0.98 5 烟酰胺 98-92-0 3.06 5.42 0.90 6 维生素B5(D-泛酸钙) 137-08-6 5.47 35.26 0.97 7 维生素B12(氰钴胺) 68-19-9 6.42 23.56 0.95 8 维生素B2(核黄素) 83-88-5 6.88 11.60 0.93 9 维生素B7(生物素) 58-85-5 7.02 3.12 1.01 结果表明,所有水溶性维生素的分离度都大于1.5,峰形良好。需要注意的是,盐酸吡哆醛标准溶液在常温下不稳定,容易降解,但其降解产物的保留时间为约 5.04 min, 不会对其它组分产生干扰。 另外,在多组分检测时,为便于定量并兼顾所有组分的响应和灵敏度,可选择大部分化合物具有较强吸收的波长214 nm。但是,在选定的色谱条件下,样品或标样中可能有其它成分与目标峰发生干扰。例如,本实验中混标中的乙酸与维生素B3发生共流出,因此对维生素B3进行定量时,选用其最大吸收波长265nm, 以排除乙酸的干扰(图3)。 图3.维生素 B3紫外光谱图 脂溶性维生素检测 由于脂溶性维生素的极性非常弱,在培养基样品中,无法使用与水溶性维生素相同的样品前处理和色谱分离检测方法进行操作。在色谱分析方法建立中,进行流动相调节时,水相中添加0.5%甲酸,有利于维A 酸峰形的改善。选择色谱柱时,使用不封端的、短碳链的色谱柱 (Poroshell SB-C8 柱)有利于降低样品和基质的吸附,目标成分可以更快出峰。 波长选择时,由于目标组分的最大吸收波长不相同,故分别使用266 nm 和 356 nm 下对维生素 D3和维A酸进行检测,对照品色谱图如图4所示。 图4.混标中维生素D和维A酸的色谱图(上图为维生素 D3-波长266nm, 下图为维A酸-356nm) 水溶性维生素 两种培养基样品(样品1和样品2)经过 SPE 步骤处理后,进样分析,所得结果如图5所示。从图5中可以看出,两种不同培养基样品中的组分得到良好分离。尽管未经 SPE 前处理的样品可以在稀释后直接进样分析,但复杂基质的培养基样品可能会造成色谱柱容易堵塞和污染,造成峰形和分离度变差,以及色谱柱寿命下降。另外,不同培养基的配方存在差异,可能导致目标组分受到干扰。因此,除了固相萃取的前处理步骤,必要时可对流动相的 pH 进行调整。本方法实验的加标回收数据见表2。 图5.经过 SPE处理后的样品分析图谱(上图为样品1,下图为样品2) 表2.加标回收测试结果(样品1中加标, n=3) 化合物 加标浓度(pg/mL) 回收率(%) RSD(%) 备注 1 维生素B1 5 101.20 3.5 2 维生素B3 5 95.94 2.3 3 盐酸吡哆醛 5 64.41 10.2 易降解 4 维生素B6 5 103.41 3.4 5 烟酰胺 5 98.09 1.5 6 维生素B5 5 70.76 9.1 7 维生素B12 5 103.81 1.8 8 维生素B2 2 86.07 4.1 9 维生素B7 5 105.88 8.4 如表2中所示,大部分组分加标回收率在85%-110%之间,方法重现性良好。但是由于盐酸吡哆醛不稳定,在样品中发生降解,因此发现回收率偏低,仅为64.41%。另外,维生素B5的紫外吸收很弱,某些样品基质干扰较为严重,也容易导致回收率偏低。因此,样品在配制和处理过程中,应尽快操作处理检测,必要时采用温控的样品盘。本次实验未考察吡哆醛的降解过程。 脂溶性维生素 反相色谱方法分析脂溶性维生素时,通常需要用到高比例的有机相,本方法中采用65%甲醇为起始梯度流动相。由于细胞培养液中存在大量极性组分(氨基酸、水溶性维生素、糖等),检测之前应通过前处理方法尽可能除去,否则直接进样时可能导致强极性组分析出,堵塞色谱柱,也可能导致回收率差等问题。本实验采用液液萃取方法进行处理之后,样品1检测结果如图6所示。 图6.样品1中维生素D和维A酸的色谱图(上图为维生素 D3-波长266nm, 下图为维A酸-356nm) 经过液液萃取之后,样品中脂溶性组分不存在干扰,操作简单。回收率及重复性良好,液液萃取前处理了中脂溶性维生素回收率数据见表3。 表3.样品中脂溶性维生素的加标回收结果 化合物 加标浓度(pg/mL) 回收率(%) RSD%(n=3) 维A酸 1 89.93 3.4 维生素 D3 1 95.30 4.6 如果样品中待测组分含量较低时,还可以在液液萃取操作之后,进行浓缩处理。例如在进行液液萃取前处理操作过程中,取5mL样品,加5mL甲醇稀释后再加等体积的正己烷进行萃取三次,正己烷萃取液浓缩后,用1mL甲醇定容。本实验中,样品2在进行浓缩操作后,维生素D3和维A酸均未检出。 由于细胞培养液中成分复杂,极性差异很大。直接稀释进样分析容易导致基质干扰、色谱柱堵塞、回收率低等问题。因此本实验使用 Bond Elut C18 固相萃取柱,采取基质截留方法,对细胞培养液中水溶性维生素成分进行净化处理,并开发液相色谱检测方法,使用 Poroshell EC-C18 色谱柱对水溶性维生素进行检测,方法准确可靠,重现性良好。使用液液萃取方法,用正己烷对稀释后的培养液对脂溶性维生素进行萃取,并使用 Poroshell 120SB-C8 色谱柱开发了维生素 D3 和维A酸的分析检测方法。该前处理和色谱分离的方法,可用于培养基样品中水溶性和脂溶性维生素成分的快速检测。 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 ( 本文中的信息、说明和技术指标如有变更,恕不另行通知。 ) 5994-2333ZHCN 由于细胞培养液中成分复杂,极性差异很大。直接稀释进样分析容易导致基质干扰、色谱柱堵塞、回收率低等问题。因此本实验使用 Bond Elut C18 固相萃取柱,采取基质截留方法,对细胞培养液中水溶性维生素成分进行净化处理,并开发液相色谱检测方法,使用 Poroshell EC-C18 色谱柱对水溶性维生素进行检测,方法准确可靠,重现性良好。使用液液萃取方法,用正己烷对稀释后的培养液对脂溶性维生素进行萃取,并使用 Poroshell 120SB-C8 色谱柱开发了维生素 D3 和维 A 酸的分析检测方法。该前处理和色谱分离的方法,可用于培养基样品中水溶性和脂溶性维生素成分的快速检测。
确定


还剩4页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《细胞培养基中维生素检测方案(液相色谱仪)》,该方案主要用于其他中其他检测,参考标准--,《细胞培养基中维生素检测方案(液相色谱仪)》用到的仪器有Agilent 1260 Infinity II 液相色谱系统
推荐专场
相关方案
更多
该厂商其他方案
更多















