
方案详情
文
本实验证明了EDX法作为“ICH Q3D 原料药样品的元素杂质分析”中规定的ICP-AES/ICP-MS法的一种替代方案的有效性。即使是对于含硫量高达约15%的卡托普利,验证和核实结果也是令人满意的。本方法包使用标准品水溶液样品制作校准曲线,其有效性也得到了证实。根据这些结果,认为可以采用本方法来控制各种原料药和制剂产品的质量。
由于在一些情况下,EDX 法分析的浓度限值满足日用量为 1 g的制剂产品量级,因此认为,针对原料药种类和摄入量选择性地配合使用EDX法操作对于提高效率和降低成本是有用的。
方案详情

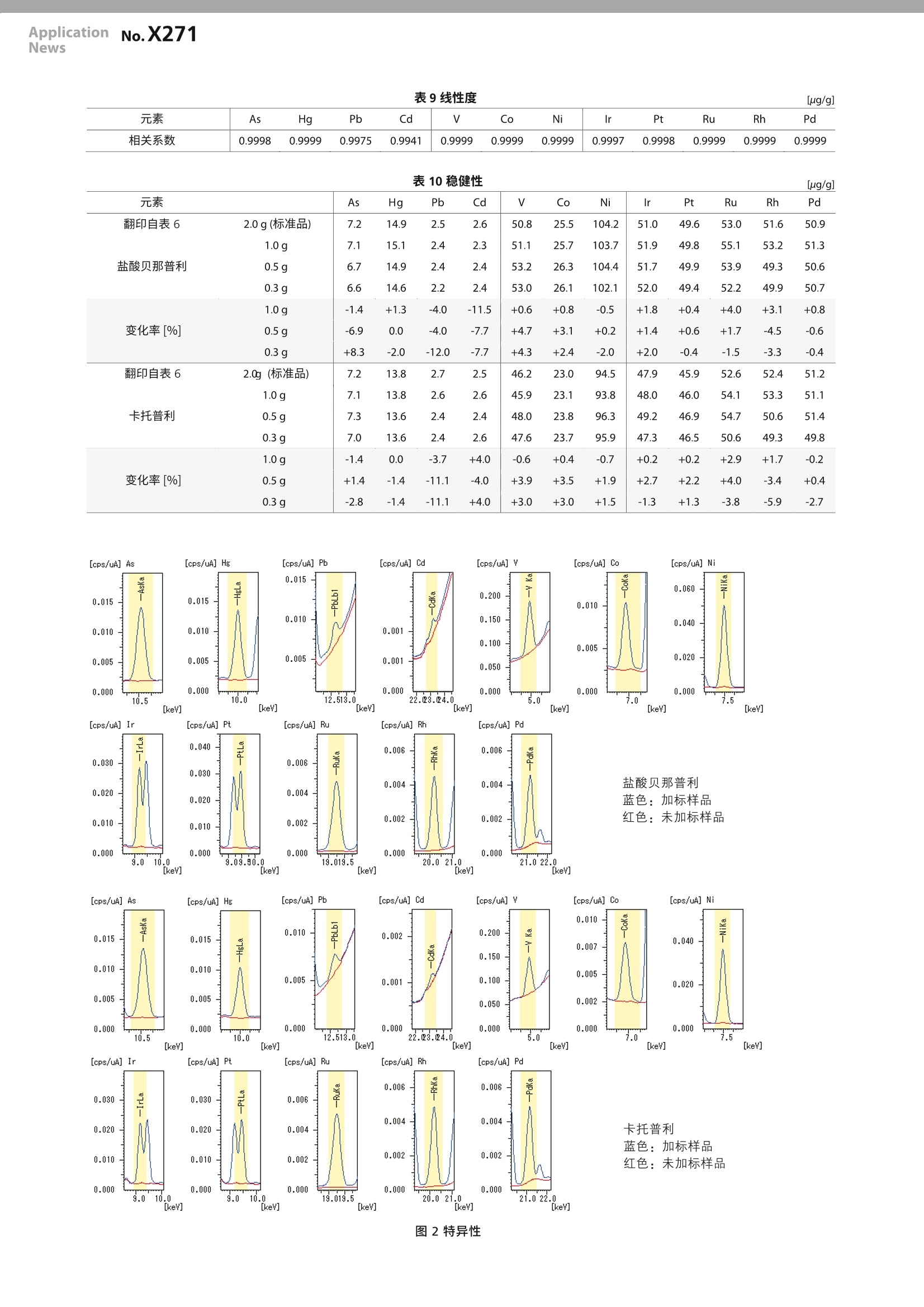
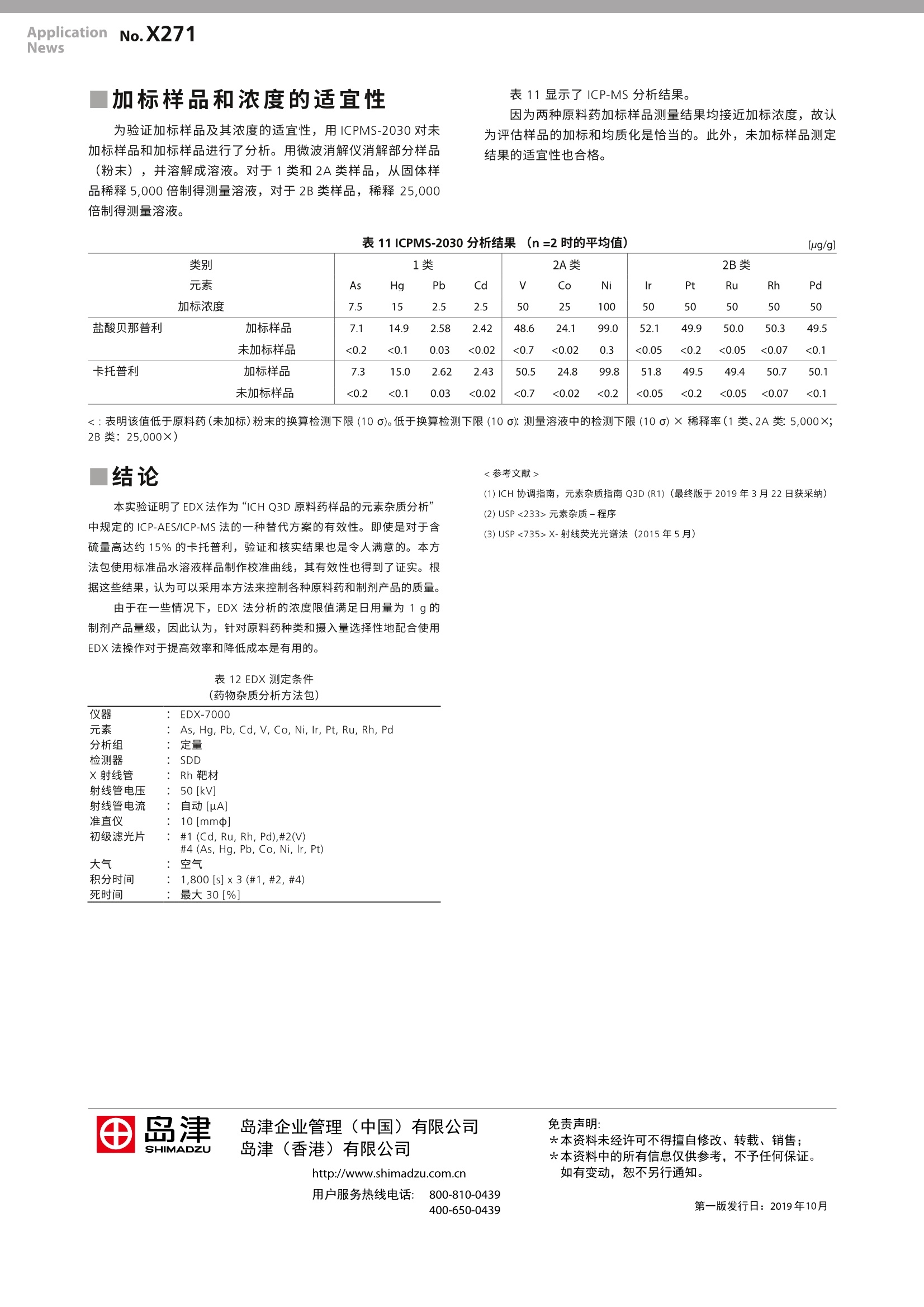
LAAN-A-XR-E044 ApplicationnNNo.X271News 岛津企业管理(中国)有限公司岛津(香港)有限公司http://www.shimadzu.com.cn用户服务热线电话: 800-810-0439第一版发行行:2019年10月400-650-0439 X射线分析 ICH Q3D EDX法分析原料药的元素杂质 制剂产品的元素杂质协调指南 (ICHQ3D)要求对24种关注毒性的元素的残留量进行控制。对于新制剂产品,这一要求自2016年6月起在美国和欧盟启用,在日本则从2017年4月起启用。对于现有药品,美国自2018年1月开始适用,欧盟则从2017年12月起开始适用。 尽管该指南推荐的元素杂质分析方法为电感耦合等离子体-原子发射光谱法(ICP-AES)2和电感耦合等离子体-质谱法(ICP-MS),但若有适宜的备选方法时也允许使用。因此,参考美国药典 USP<735>3),对X-射线荧光光谱法作为上述方法的替代方案的适合性进行了验证。 所用的仪器为一台 EDX-7000 及其选配的“药物杂质分析方法包”。使用两种粉末形式的原料药作为试验材料,以标准样品水溶液用校准曲线法进行了定量分析。结果证明可以使用EDX法对制剂产品中的元素杂质进行分析控制。 T. Nakao, K. Hori 厅元素 “药物杂质分析方法包”能分析 ICH Q3D 中规定的以下12种元素。这些元素是控制元素杂质中的重要部分。 1类: As, Cd, Hg, Pb 2A类:V,Co, Ni 2B类: Ru, Rh, Pd, Ir, Pt l评估样品 使用以下两种类型的原料药粉末作为评估样品。表1显示了某种制剂产品的详情和制剂产品的日用量 盐酸贝那普利 ·卡托普利 表1评估样品和结构式 名称 盐酸贝那普利 卡托普利 组成式 C24H28N2Os·HCI CgH15NO3s 原子量 460.95 217.29 结构式 HC1 CCH 制剂产品的日用量 10 mg/天 150mg/天 对照值的概念 (1)最大允许量的设定 ICH Q3D 规定了每种元素的允许日暴露量(PDE)。因此,当评估制剂产品或其组成成分中的元素杂质时,必须将 PDE值转换为浓度。ICH Q3D中有换算方法选项1、2a、2b和3。在本评估中,制剂产品的日用量为300mg, 高于表1中的规定值,以验证较低的浓度范围。使用口服制剂值作为 PDE值,使用方法选项2b 来换算 PDE 值。 (2)加标浓度的设定值 因为 ICH Q3D 规定将 PDE值的30%作为控制阈值,故将(1)中最大允许浓度的30%设定为对照值。按照 USP <735>将加标浓度设定为对照值的1/2。表2显示的是 PDE 值、最大允许浓度和加标浓度之间的关系。 表2PDE 值和加标浓度 PDE 值(A) 最大允许浓度(B)=(A)/0.3 加标浓度(B)x0.3/2 元素/单位 ug/day ug/g ug/g Pb, Cd 5 16.7 2.5 As 15 50 7.5 Hg 30 100 15 Co 50 167 25 V, Ir, Pt, Ru, Rh, Pd 100 333 50 Ni 200 667 100 标准样品 用以下两种混标溶液中的每一种制备五个标点。表3和表4所示为它们的浓度。 混标溶液 (SPEX 生产) XSTC-2046 m USP-TXM4 表3表3采用 XSTC -2046 配制的标准样品浓度 [ug/mL] 空白样品 STD1 STD2 STD3 STD4 稀释比 (超纯水) 10 5 2 1 Pb,Cd 0 0.5 1 2.5 5 As 0 1.5 B 7.5 15 Hg 0 3 6 15 30 Co 0 5 10 25 50 V 0 10 20 50 100 Ni 0 20 40 100 200 表4采用 USP-TXM4 配制的标准样品浓度 [ug/g] 空白样品 STD1 STD2 STD3 STD4 稀释比 (超纯水) 10 5 2 1 Ir, Pt, Ru,Rh, Pd 0 10 20 50 100 样品预处理 验证结果 (1)加标样品的制备 进行 USP<735>准确度、精密度、特异性、定量限、线性度和稳健性等项目的验证。 将原子吸收标准溶液或含有高As的纤维素粉末以加标浓度添加到评估样品中,混匀,即制得加标样品。 (2)样品设置 表5显示了“USP <735>验证程序”的概述,以及本实验的验证结果;表6至表10和图2显示了各个项目的结果。 如图1所示,将样品盛入衬有聚丙烯膜的样品容器中,然后进行测定。 图1测量样品 表5“USP <735>验证和验证结果综述 项目 方法 验收标准 结果 判定 准确度 ·校准曲线法定量分析 ·加标和回收试验 回收率 70.0-150.0% 回收率 92-108% 通过 精密度 ·加标样品:3·3个样品的3次平行测定。共9次定量分析的相对标 准偏差(RSD) RSD≤20.0% RSD ≤5.8% 通过 特异性 ·可清楚地分离和辨识元素定量光谱与基质的谱图。 满足准确度条件 ·从基质组分分离定量光谱。·准确度令人满意。 通过 定量限 ·未加标样品6次定量分析平行测定的重复性 ·10倍标准偏差的估算值 满足不超过对照值的50%和准确度和精密度条件。 ·估算值 <对照值的50% (=加标浓度) ·准确度和精密度令人满意。 通过 线性度 ·标准样品:5 ·最小二乘法回归线。 NLT0.99 相关系数R>0.9941 通过 稳健性 ·应使用样品量作为实验参数。·使用2.0g作为标准值,并变更为1.0 g、0.5 g 和0.3g。 实验参数改变后定量值的变化率应在±20.0%以内。 定量值的变化率:-12.0-+8.3% 通过 类别 1类 2A 类 2B类 元素 加标浓度 As Hg Pb Cd Co Ni Ir Pt Ru Rh Pd 7.5 15 2.5 2.5 50 25 100 50 50 50 50 50 盐酸贝那普利 加标样品 7.2 14.9 2.5 2.6 50.8 25.5 104.2 51.0 49.6 53.0 51.6 50.9 未加标样品 <0.5 <0.3 <0.6 <1.2 <2.9 <1.4 <0.7 <0.5 <0.5 <0.5 <0.5 <0.5 回收率[%] 卡托普利 加标样品 96 99 102 1047.2 13.8 2.7 2.5 102 102 104 46.2 23.0 94.5 102 47.9 99 106 103 52.6 52.4 102 未加标样品 <0.5 <0.4 <0.7 <1.2 <3.4 <1.7 <0.8 <0.6 <0.4 51.2<0.7 回收率[%] 96 92 108 100 93 92 95 96 92 105 105 102 表7精密度 [%] 元素 As Hg Pb Cd Co Ni Ir Pt Ru Rh Pd 盐酸贝那普利 RSD 卡托普利 RSD 0.5 0.4 4.8 5.8 0.7 0.5 0.3 0.4 0.7 0.8 0.7 0.8 2.3 0.8 4.6 5.5 2.7 1.8 1.1 1.4 0.5 0.6 0.9 0.5 表8定量限的估算值 [ug/g] 元素 As Hg Pb Cd Co Ni Ir Pt Ru Rh Pd 盐酸贝那普利 0.2 0.4 0.6 1.4 4.3 1.0 0.9 0.5 0.1 0.3 0.6 0.7 卡托普利 0.1 0.4 1.0 1.3 4.1 3.3 0.9 0.5 0.4 0.6 0.2 0.5 表9线性度 相关系数 0.9998 0.9975 0.9999 0.9941 0.9999 0.9999 0.9999 0.9997 0.9998 0.9999 0.9999 0.9999 表10稳健性 [ug/g] 元素 As Hg Pb Cd Co Ni lr Pt Ru Rh Pd 翻印自表6 2.0g(标准品) 7.2 14.9 2.5 2.6 50.8 25.5 104.2 51.0 49.6 53.0 51.6 50.9 1.0g 7.1 15.1 2.4 2.3 51.1 25.7 103.7 51.9 49.8 55.1 53.2 51.3 盐酸贝那普利 0.5 g 6.7 14.9 2.4 2.4 53.2 26.3 104.4 51.7 49.9 53.9 49.3 50.6 0.3 g 6.6 14.6 2.2 2.4 53.0 26.1 102.1 52.0 49.4 52.2 49.9 50.7 1.0g -1.4 +1.3 -4.0 -11.5 +0.6 +0.8 -0.5 +1.8 +0.4 +4.0 +3.1 +0.8 变化率[%] 0.5g -6.9 0.0 -4.0 -7.7 +4.7 +3.1 +0.2 +1.4 +0.6 +1.7 -4.5 -0.6 0.3g +8.3 -2.0 -12.0 -7.7 +4.3 +2.4 -2.0 +2.0 -0.4 -1.5 -3.3 -0.4 翻印自表6 2.0g(标准品) 7.2 13.8 2.7 2.5 46.2 23.0 94.5 47.9 45.9 52.6 52.4 51.2 1.0 g 7.1 13.8 2.6 2.6 45.9 23.1 93.8 48.0 46.0 54.1 53.3 51.1 卡托普利 0.5g 7.3 13.6 2.4 2.4 48.0 23.8 96.3 49.2 46.9 54.7 50.6 51.4 0.3 g 7.0 13.6 2.4 2.6 47.6 23.7 95.9 47.3 46.5 50.6 49.3 49.8 1.0 g -1.4 0.0 -3.7 +4.0 -0.6 +0.4 -0.7 +0.2 +0.2 +2.9 +1.7 -0.2 变化率[%] 0.5 g +1.4 -1.4 -11.1 -4.0 +3.9 +3.5 +1.9 +2.7 +2.2 +4.0 -3.4 +0.4 0.3g -2.8 -1.4 -11.1 +4.0 +3.0 +3.0 +1.5 -1.3 +1.3 -3.8 -5.9 -2.7 |加标样品和浓度的适宜性 为验证加标样品及其浓度的适宜性,用ICPMS-2030 对未加标样品和加标样品进行了分析。用微波消解仪消解部分样品(粉末),并溶解成溶液。对于1类和2A类样品,从固体样品稀释5,000倍制得测量溶液,对于2B类样品,稀释25,000倍制得测量溶液。 表11显示了ICP-MS分析结果。 因为两种原料药加标样品测量结果均接近加标浓度,故认为评估样品的加标和均质化是恰当的。此外,未加标样品测定结果的适宜性也合格。 表11ICPMS-2030分析结果 (n=2时的平均值) [ug/g] 类别 元素 加标浓度 1类 As Hg Pb Cd 2A类 2B类 Ir Pt Ru Rh Pd V Co Ni 7.5 15 2.5 2.5 50 25 100 50 50 50 50 50 盐酸贝那普利 加标样品 未加标样品 7.1 14.9 2.58 2.42 48.6 24.1 99.0 52.1 49.9 50.0 50.3 49.5 <0.2 <0.1 0.03 <0.02 <0.7 <0.02 0.3 <0.05 <0.2 <0.05 <0.07 <0.1 卡托普利 加标样品 未加标样品 7.3 15.0 2.62 2.43 50.5 24.8 99.8 51.8 49.5 49.4 50.7 50.1 <0.2 <0.1 0.03 <0.02 <0.7 <0.02 <0.2 <0.05 <0.2 <:表明该值低低原料药(未加标)粉末的换算检测下限(10a)。低于换算检测下限(10o):测量溶液中的检测下限(10a)×稀释率(1类、2A类:5,000×;2B类:25,000×) ( (1) ICH 协调指南,元素杂质指南 Q3D (R1)(最终版于2019年3月22日获采纳) ) (2) USP <233>元素杂质-程序 ( (3) USP <735>X-射线荧光光谱法(2015年5月) ) 制剂产品的元素杂质协调指南(ICH Q3D)(1)要求对 24 种关注毒性的元素的残留量进行控制。对于新制剂产品,这一要求自2016年6月起在美国和欧盟启用,在日本则从 2017年4月起启用。对于现有药品,美国自2018年1月开始适用,欧盟则从2017年12月起开始适用。尽管该指南推荐的元素杂质分析方法为电感耦合等离子体-原子发射光谱法(ICP-AES)(2)和电感耦合等离子体-质谱法(ICP-MS),但若有适宜的备选方法时也允许使用。因此,参考美国药典USP<735>(3),对X-射线荧光光谱法作为上述方法的替代方案的适合性进行了验证。所用的仪器为一台EDX-7000及其选配的“药物杂质分析方法包”。使用两种粉末形式的原料药作为试验材料,以标准样品水溶液用校准曲线法进行了定量分析。结果证明可以使用EDX法对制剂产品中的元素杂质进行分析控制。
确定


还剩2页未读,是否继续阅读?
岛津企业管理(中国)有限公司为您提供《原料药中元素杂质检测方案(能散型XRF)》,该方案主要用于原料药中含量测定检测,参考标准--,《原料药中元素杂质检测方案(能散型XRF)》用到的仪器有
相关方案
更多
该厂商其他方案
更多








