方案详情
文
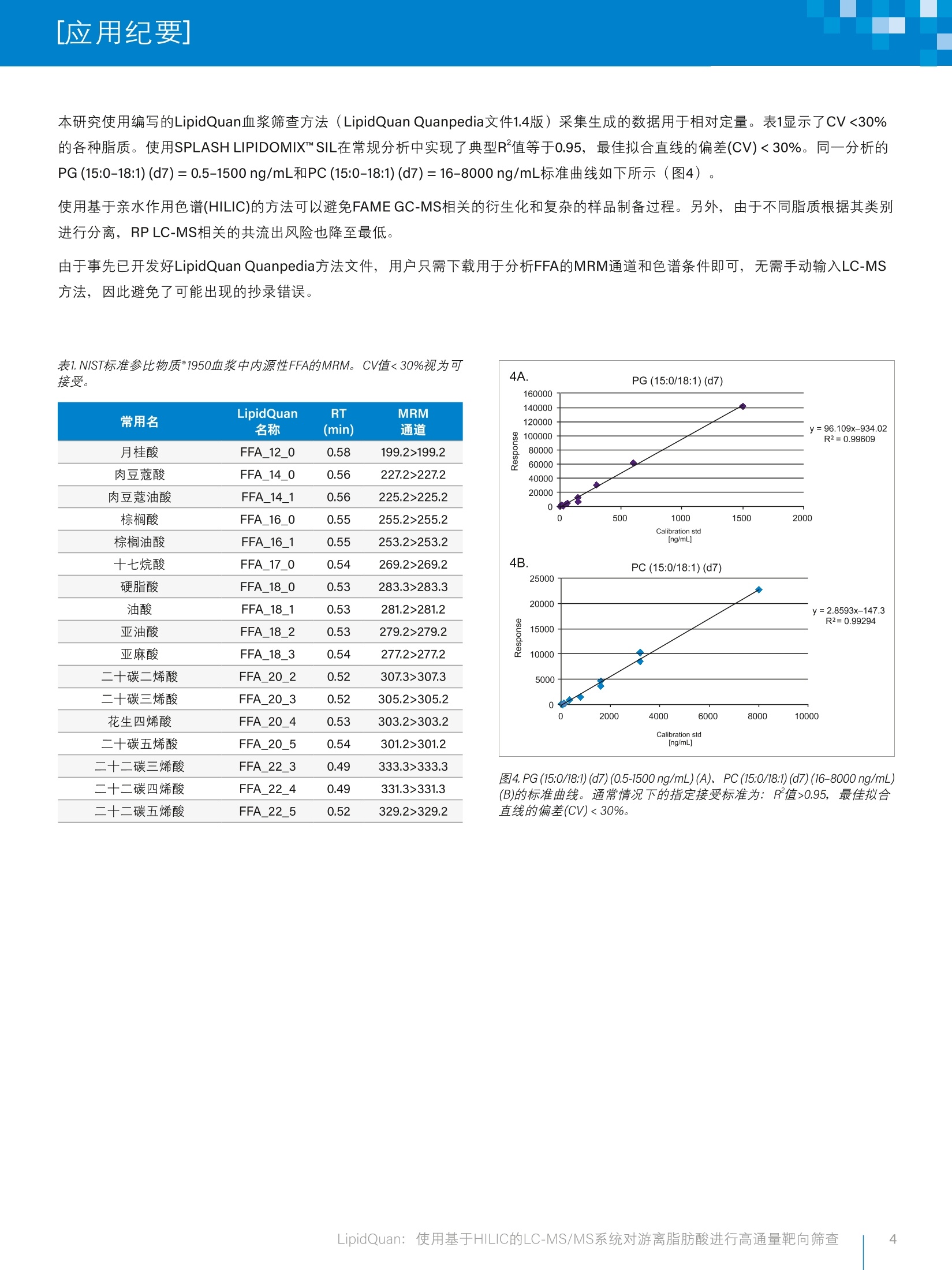
1)快速定量血浆中的24种FFA
2)使用Quanpedia™和SOP构建性能稳定、便 于部署的平台,降低方法开发和培训成本
3) 使用TargetLynx™软件和第三方信息学软件(即Skyline)实现快速数据处理和数据可视化
4) 分析快速、经济有效,可以提高客户生产力
方案详情

[应用纪要]WatersTHE SCIENCE OF WHAT'S POSSIBLE. [应用纪要] LipidQuan:使用基于HILIC的LC-MS/MS系统对游离脂肪酸进行高通量靶向筛查 应用优势 快速定量血浆中的24种FFA 使用Quanpedia""和SOP构建性能稳定、便于部署的平台,降低方法开发和培训成本 使用TargetLynx"软件和第三方信息学软件(即Skyline)实现快速数据处理和数据可视化 分析快速、经济有效,可以提高客户生产力 沃特世解决方案 LipidQuan QuanpediaXevo TQ-S micro Xevo TQ-XSXevoTQ-S ACQUITY"UPLCMI-Class系统 BEH Amide色谱柱 TargetLynx软件 关键词游离脂肪酸(FFA)、脂质组学、靶向、高通量 虽然游离(未酯化)脂肪酸(FFA或NEFA)仅占血浆总脂肪酸的一小部分,但这类脂质的代谢活性仍然较高。血浆中丰度最高的几种FFA为油酸(18:1)、棕榈酸(16:0)、硬脂酸(18:0),这三种酸共占FFA总量的78%。某些不饱和FA为长链多不饱和脂肪酸(LC-PUFA),无法从头(de novo)合成,因此列为“必需脂肪酸”。例如亚油酸(18:2)、花生四烯酸(20:4)、ω-亚麻酸(18:3ω-3)、、二二十碳五烯酸(20:5, EPA) 和二十二碳六烯酸(22:6; DCA) 等主要PUFA。类花生酸来源于花生四烯酸和相关多不饱和脂肪酸(PUFA),是具有局部作用生物活性的信号传导脂质。类花生酸可调节与多种疾病(包括代谢综合征和癌症)有关的各种自我平衡和发炎过程。 本研究使用基于亲水作用色谱(HILIC)的方法分离不同类别的脂肪酸,然后使用质谱(MS)进行检测,从而降低了鉴定结果的不不定性。按照类别分离不同的脂质还可以减少定量分析所需的稳定同位素标记(SIL)标准品,进而降低成本。本应用纪要介绍了在 LipidQuan平台(图2)上运行基于HILIC的方法对 FFA进行的靶向筛查,无需进行复杂的样品制备和长时间的色谱分离。 图2.大多数研究实验室的通用脂质组学工作流程,图中突出显示了LipidQuan工作流程。 实验 样品 向混合的健康人血浆中添加稳定同位素标记(SIL)标准品(SPLASHLIPIDOMIX", Avanti Lipids, 美国亚拉巴马州阿拉巴斯特),制备九个不同浓度的标准品用于绘制定量用标准曲线。 SPLASH LIPIDOMIX"没有合适的替代标准品用于定量FFA,但可以使用线性数据评估生成数据的质量。在常规分析中实现了典型R²值等于0.95,最佳拟合直线的偏差(CV)<30%。使用PG(15:0-18:1)(d7)=0.5-1500 ng/mL、PC (15:0-18:1)(d7)=16-8000 ng/mL说明线性。 另外,通过萃取前加标的方式向NIST标准参比物质°1950血浆中 (Sigma Aldrich,英国普尔)添加5%SIL标准品,制备6个重复样。 样品制备 样品制备方案很简单,使用预冷的异丙醇(IPA)沉淀蛋白(1:5,血浆:IPA)即可。将样品涡旋羊合1min, 在-20℃下放置10 min。接着再将样品涡旋混合1min, 然后在4℃下放置2h,确保蛋白沉淀完全。将萃取的样品在4℃下离心10 min(最大离心力10,300g),然后将上清液转移至玻璃样品瓶,进行LC-MS/MS分析。 LC条件 MS条件LC系统:ACQUITY UPLCI-ClassMS系统:TQ-S micro、TQ-XS或TQ-S固定定量环(FL)或电离模式:ESI(-)流通针式(FTN)毛细管电压:1.9 kV(-)色谱柱:ACQUITY UPLC BEH Amide采集模式:MRM2.1×100 mm, 1.7um离子源温度:120℃柱温:45℃脱溶剂气温度:500°℃流速:0.6mL/min锥孔气流速:150L/h流动相A:95:5乙腈/水+10mM醋酸铵脱溶剂气流速:1000L/h流动相B:50:50乙腈/水+10mM醋酸铵雾化气:7 bar梯度:流动相B在2 min内从0.1%升至20.0%,离子导入装置偏移1:3 V然后在3 min内从20%升至80%,离子导入装置偏移2:0.3V随后重新平衡3 min运行时间:8 min信息学软件进样体积:1pL LipidQuan Quanpedia方法文件(1.4版),包含LC条件、MS方法以及相关的TargetLynx处理方法(包括保留时间)。使用TargetLynx或Skyline (华盛顿大学MacCoss实验室软件)处理所得数据。 结果与讨论 通常使用GC-MS测量NEFA或游离FA'。样品在分析前通常先用固相或液-液萃取技术进行分馏,再使用衍生化试剂水解,最终形成脂肪酸甲酯(FAME)。该方案耗时久,有可能使完整复杂脂质衍生化,对较长链、挥发性较弱的FA(>C24)有时效果不佳。 此外,反相(RP)LC-MS也可用于FFA分析。但该方法的样品制备同样耗时较长,采用的有机溶剂不仅具有毒性,而且购买和弃置费用都很高。反相色谱根据链长和不饱和度分离脂质。反相分离的双重性质(脂肪酰基链的长度越长,保留时间就越长,而脂肪酰基链中的双键越多,保留时间就越短)会妨碍实际样品的分析。此外,由于存在大量共流出组分,鉴定更加困难。 LipidQuan使用负离子模式的伪MRM对人血浆中的24种FFA类物质进行鉴定和定量,同时还能分析相同进样中的其它磷脂类物质。在HILIC分离条件下,FFA洗脱为分离的峰(大约0.5 min处)(图3)。得益于该方法的灵敏度,使用50pL血浆可检测出人血浆中正常循环水平的这些脂质。线性动态范围覆盖4个数量级。 图3.NIST标准参比物质°1950血浆中内源性FFA脂质用HILIC法分离得到的叠加色谱图 本研究使用编写的LipidQuan血浆筛查方法 (LipidQuan Quanpedia文件1.4版)采集生成的数据用于相对定量。表1显示了CV<30%的各种脂质。使用SPLASH LIPIDOMIX""SIL在常规分析中实现了典型R²值等于0.95,最佳拟合直线的偏差(CV)<30%。同一分析的PG (15:0-18:1) (d7)=0.5-1500 ng/mL和PC (15:0-18:1) (d7)=16-8000 ng/mL标准曲线如下所示(图4)。 使用基于亲水作用色谱(HILIC)的方法可以避免FAME GC-MS相关的衍生化和复杂的样品制备过程。另外,由于不同脂质根据其类别进行分离, RPLC-MS相关的共流出风险也降至最低。 由于事先已开发好LipidQuan Quanpedia方法文件,用户只需下载用于分析FFA的MRM通道和色谱条件即可,无需手动输入LC-MS方法,因此避免了可能出现的抄录错误。 表1.NIST标准参比物质°1950血浆中内源性FFA的MRM。CV值<30%视为可接受。 常用名 LipidQuan RT MRM 名称 (min) 通道 月桂酸 FFA_12_0 0.58 199.2>199.2 肉豆蔻酸 FFA_14_0 0.56 227.2>227.2 肉豆蔻油酸 FFA_14_1 0.56 225.2>225.2 棕榈酸 FFA_16_0 0.55 255.2>255.2 棕榈油酸 FFA_16_1 0.55 253.2>253.2 十七烷酸 FFA_17_0 0.54 269.2>269.2 硬脂酸 FFA_18_0 0.53 283.3>283.3 油酸 FFA_18_1 0.53 281.2>281.2 亚油酸 FFA_18_2 0.53 279.2>279.2 亚麻酸 FFA_18_3 0.54 277.2>277.2 二十碳二烯酸 FFA_20_2 0.52 307.3>307.3 二十碳三烯酸 FFA_20_3 0.52 305.2>305.2 花生四烯酸 FFA_20_4 0.53 303.2>303.2 二十碳五烯酸 FFA_20_5 0.54 301.2>301.2 二十二碳三烯酸 FFA_22_3 0.49 333.3>333.3 二十二碳四烯酸 FFA_22_4 0.49 331.3>331.3 二十二碳五烯酸 FFA_22_5 0.52 329.2>329.2 图4.PG(15:0/18:1) (d7)(0.5-1500 ng/mL)(A)、PC (15:0/18:1) (d7) (16-8000 ng/mL)(B)的标准曲线。通常情况下的指定接受标准为:R值>0.95,最佳拟合直线的偏差(CV)<30%。 ( 结论 ) 本研究开发了一种能够快速分析血浆和血清中的FFA及其它脂质(例如PG和PC)的定量方法。 该方法可在8min内内析24种FFA。 LipidQuan方法可以对FFA进行靶向筛查,无需进行复杂的样品制备和长时间的色谱分离。 仅供研究使用。不适用于诊断。 THE SCIENCE OF WHAT'S POSSIBLE. ( 参考文献 ) ( 1. Ran-Ressler, R. R . , Bae S.,Lawrence, P., Wang DH.,(2014) Branched-Chain Fatty Acid Content of Fooda and Estimated Intake in the USA. British Journal of Nutrition,112(4),565-5572 h t tps : // do i .org / 10 . 1017 /S0 00 7 1 1451 4 0 0 1 081 ) ( 2. 1 Ran-Ressler, R. R . , D evapatla, S . , Lawrence, P. , Brenna,J.T.(2008). Branched Chain Fa t ty Acidsare Constituents of the Normal Healthy NewbornGastrointestinal Tract. Pediatric Research,64(6), 605-609. R e trieved from ht t p :// sfx.scho l ar s po rt al.i n f o/ mcmaster?sid= OVI D :m ed line& i d = pm i d: 186 14 964&i d = d oi:10.1203%2 F P DR.0b013e31818 4 d2e6&is s n =0031 - 3998& is bn= & v o lum e =64&i s s ue =6& s p a g e= 60 5 & pag e s = 6 0 5 - 9 & d at e = 200 8 & t itl e = Pedi at r i c + R esear ch & a ti t le= Bra n c h e d + c h ain + f atty +a c i ds + a r e + c o nst i tue ) 3. Quehenberger O.,Armando A. M., Brown A. H., MilneS. B., Myers D. S., Merrill A. H.,Dennis E. A. (2010).Lipidomics Reveals a Remarkable Diversity of Lipidsin Human Plasma, 51,3299-3305.http://doi.org/10.1194/jlr.M009449 4.Brevik, A., Veierod,M. B., Drevon, C. A., Andersen,L. F. (2005). Evaluation of the Odd Fatty Acids 15:0and 17:0 in Serum and Adipose Tissue as Markersof Intake of Milk and Dairy Fat. European Journal ofClinical Nutrition, 59(12), 1417-1422.http://doi.org/10.1038/sj.ejcn.1602256 50..LDennis E. A. and Norris P. C. (2016). Eicosanoid Stormin Infection and Inflammation. HHS Public Access,15(8),511-523. http://doi.org/10.1038/nri3859.Eicosanoid 6.Cifkova,E., Holcapek, M., Lisa, M., Ovcacikova, M.,Lycka, A., Lynen, F., Sandra, P.(2012). NontargetedQuantitation of Lipid Classes Using HydrophilicInteraction Liquid Chromatography-Electrospraylonization Mass Spectrometry with Single InternalStandard and Response Factor Approach.Analytical Chemistry,84(22),10064-10070.http://doi.org/10.1021/ac3024476 7. Kopf,T., Schmitz,G. (2013).Analysis of Non-Esterified Fatty Acids in Human Samples by Solid-Phase-Extraction and Gas Chromatography/Mass Spectrometry.Journal of Chromatography B:Analytical Technologies in the Biomedical and LifeSciences,938,22-26. http://doi.org/10.1016/j.jchromb.2013.08.016 扫一扫,关注沃特世微信 沃特斯中国有限公司 沃特世科技(上海)有限公司 北京:010-52093866 上海:021-61562666 广州:020-28296555 香港:852-29641800 LipidQuan:使用基于HILIC的LC-MS/MS系统对游离脂肪酸进行高通量靶向筛查 简介 脂肪酸(FA)是含有羧基(-COOH)和甲基(-CH3)官能团的碳氢链。传统命名法将羧 基旁边的碳原子指定为α,下一个碳原子为β碳,甲基碳原子指定为ω(图1)。 脂肪酸链可以在特定的位点包含一个或多个双键(具有顺式(Z)或反式(E)构型的不饱和脂肪酸和多不饱和脂肪酸),也可以是完全饱和的。碳链上有一个或多个甲基分支的支链脂肪酸较常见于原核生物体内,据报道,牛奶脂肪和 新生儿的胃肠道内也有此类脂肪酸1,2。
确定




还剩3页未读,是否继续阅读?
沃特世科技(上海)有限公司(Waters)为您提供《二十二碳三烯酸中高通量靶向筛查检测方案(液质联用仪)》,该方案主要用于全血/血清/血浆中高通量靶向筛查检测,参考标准--,《二十二碳三烯酸中高通量靶向筛查检测方案(液质联用仪)》用到的仪器有Waters Xevo TQ-XS三重四极杆质谱仪
推荐专场
相关方案
更多
该厂商其他方案
更多
















