方案详情
文
本文详细描述了采用Oasis WCX μElution板和ACQUITY UPLC BEH Amide色谱柱在HILIC模式下对血浆儿茶酚胺和变肾上腺素的提取和分析过程。采用Oasis WCX板进行提取,可实现所有化合物较低的基质效应和一致的回收率,并能够得到较好的精密度。实验定量结果十分出色,在整个校准范围内具有极高的线性响应,表现出了出色的准确度和分析精度。
方案详情

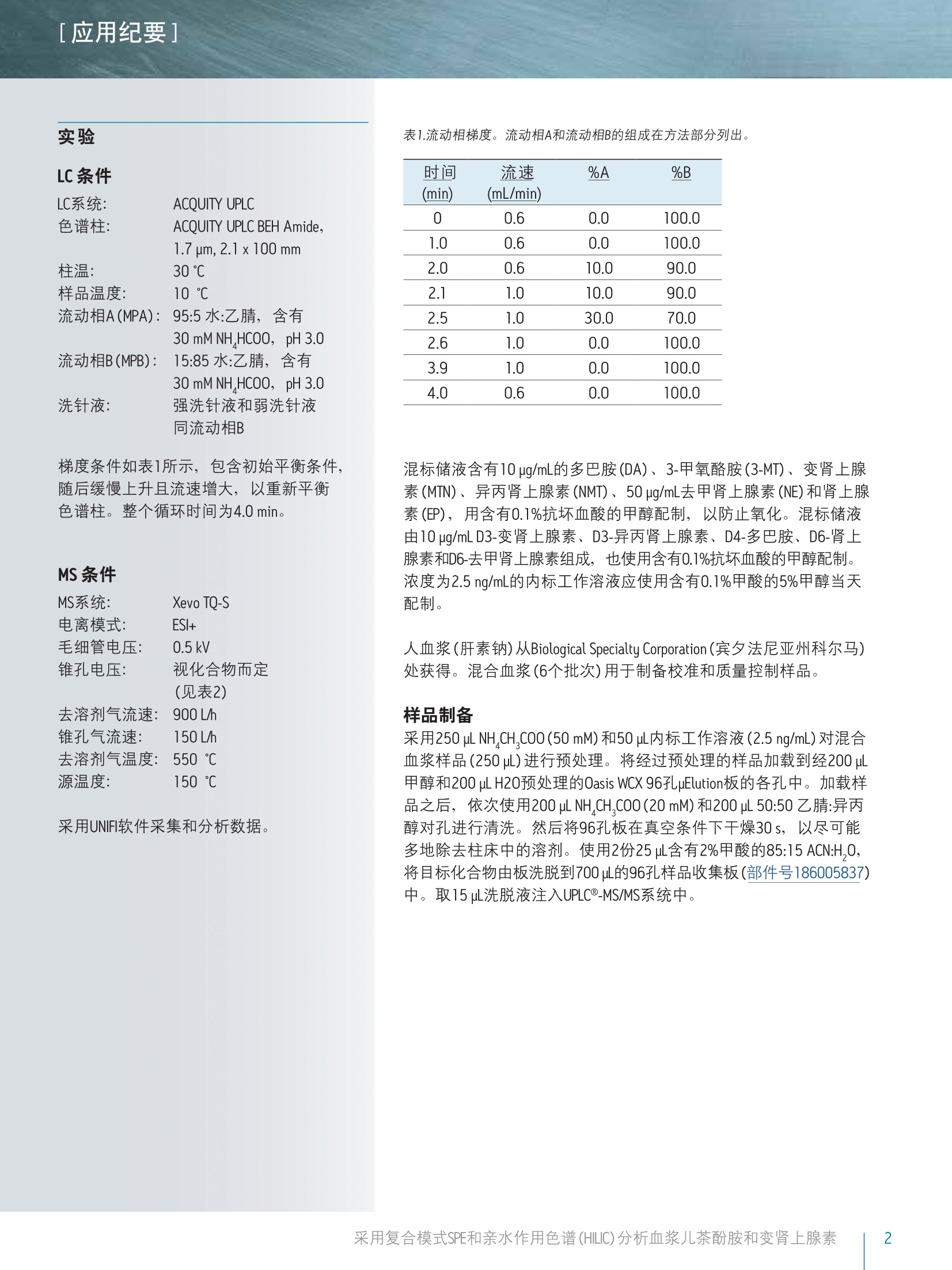
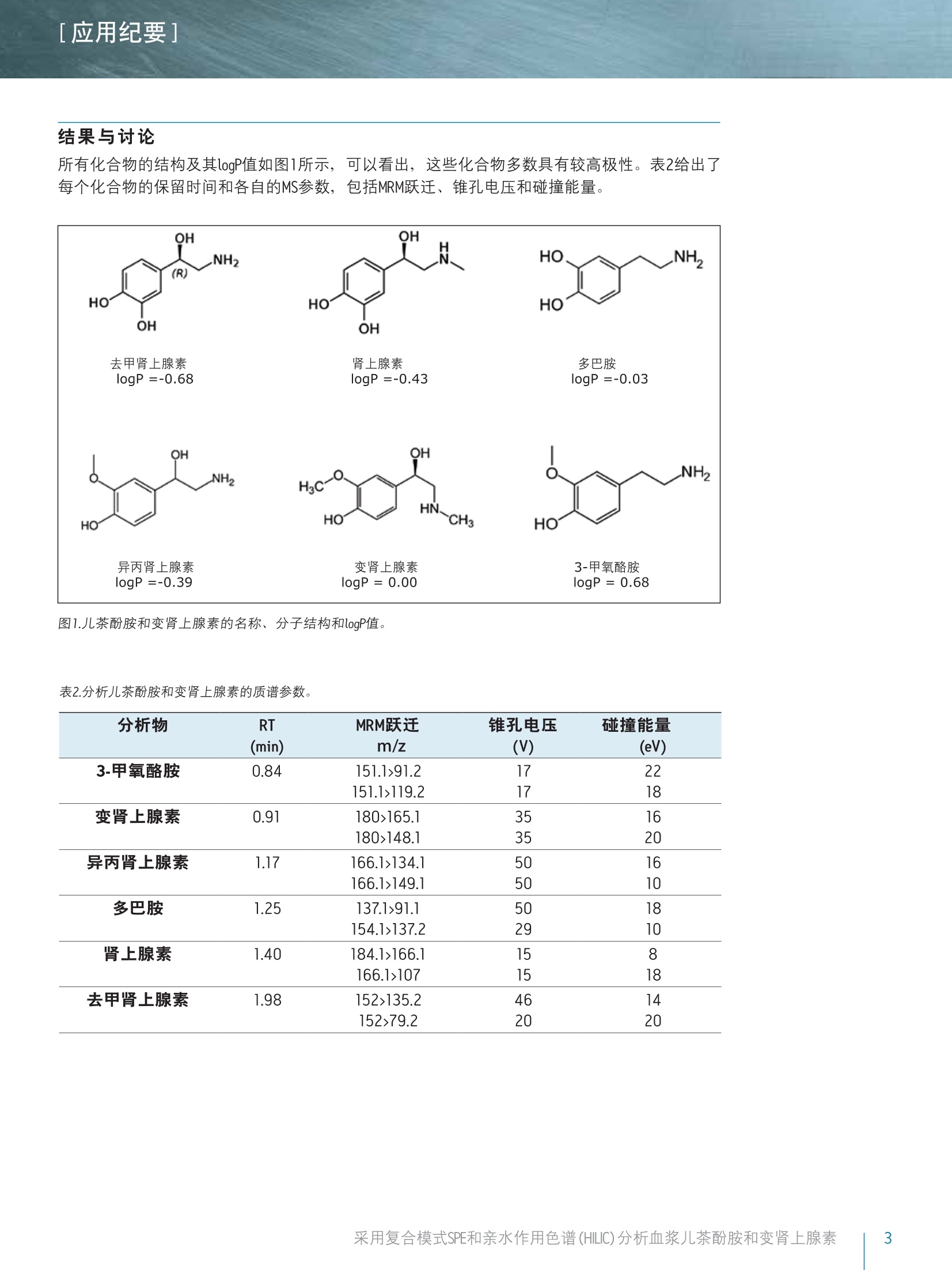
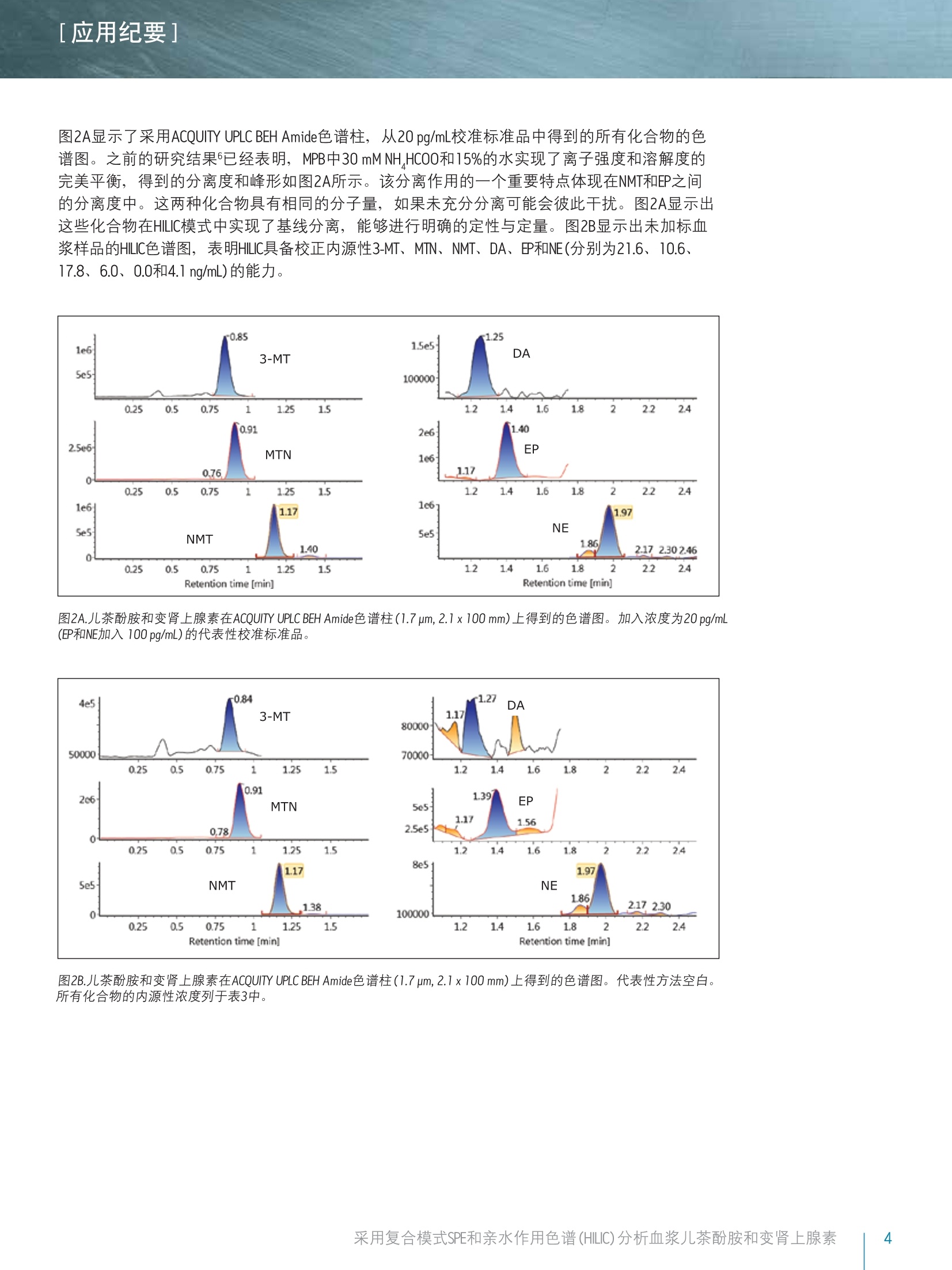
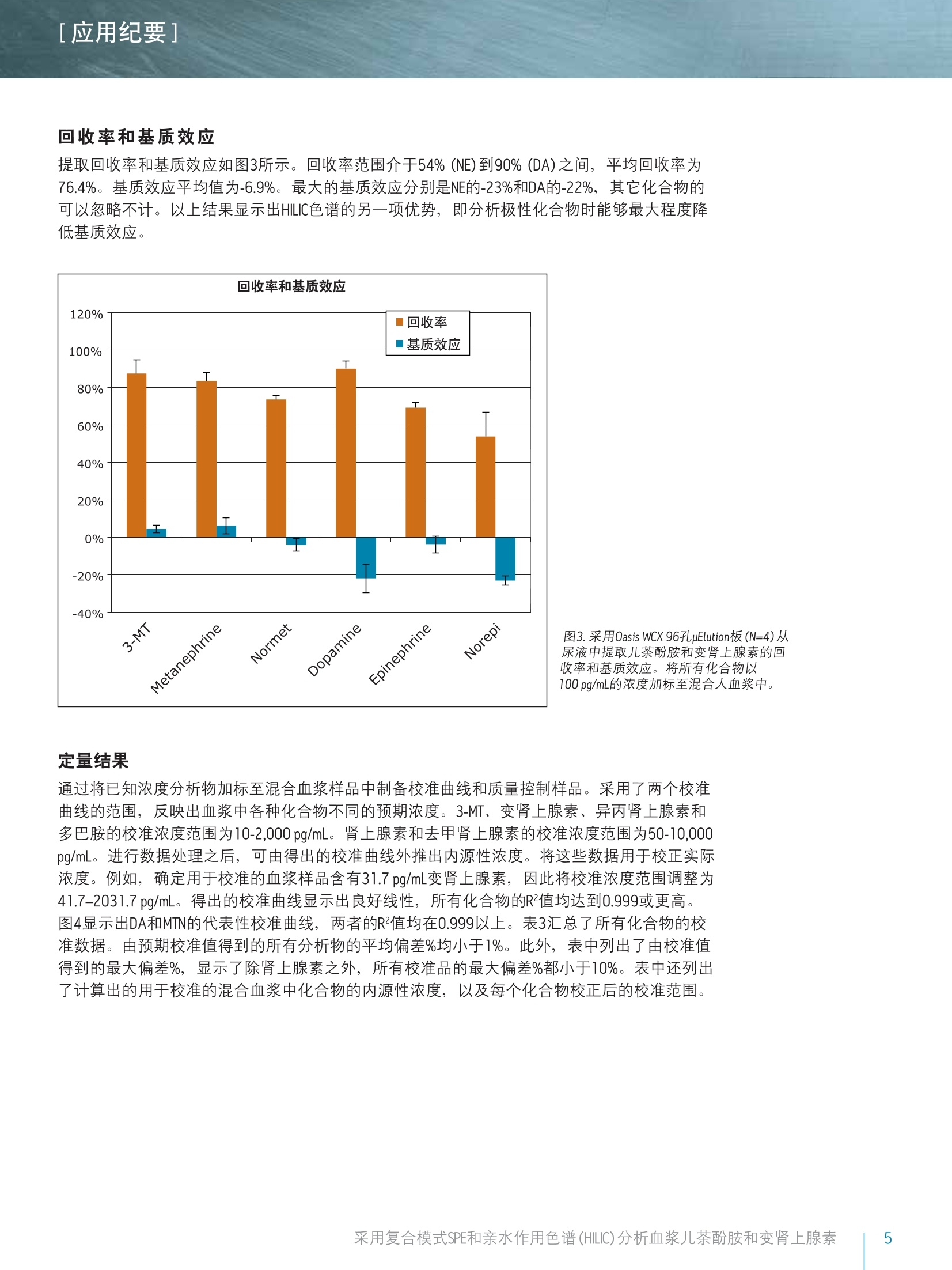
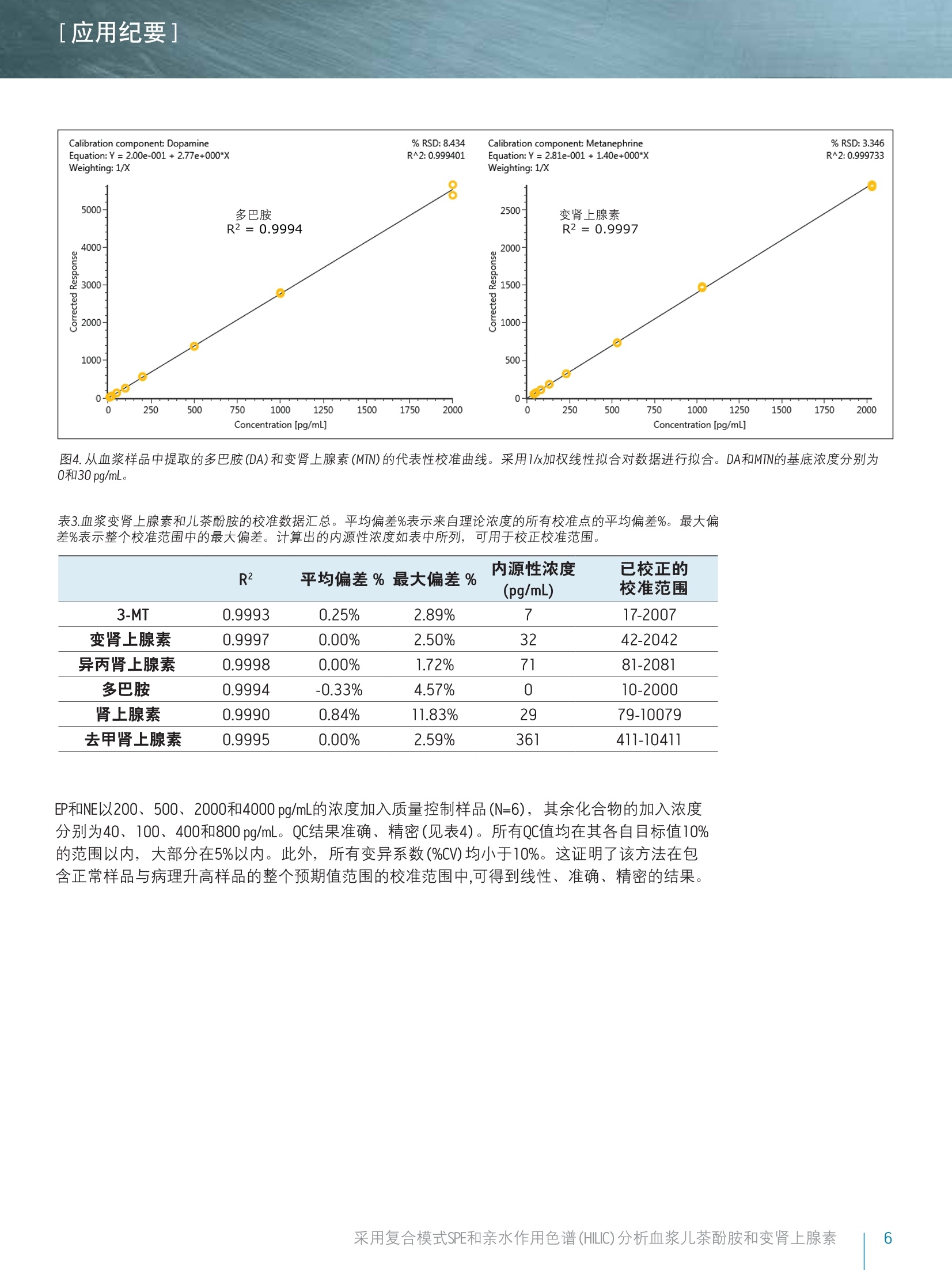
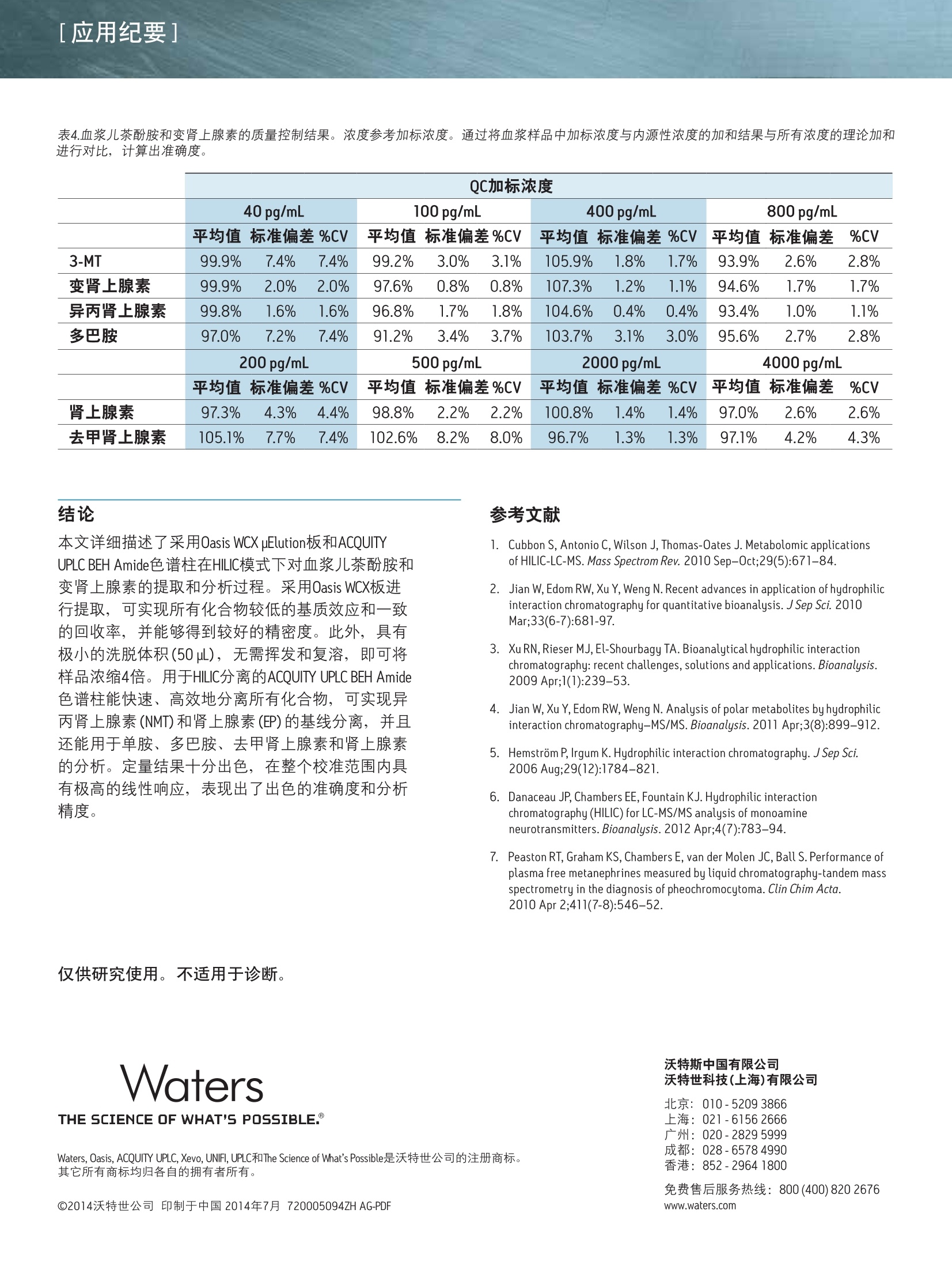
[应用纪要]THE SCIENCE OF WHAT'S POSSIBLE. [应用纪要] Waters 使用针对临床研究的复合模式SPE和亲水作用色谱(HILIC)对血浆儿茶酚胺和变肾上腺素进行快速、同步分析 Jonathan P. Danaceau, Erin E. Chambers和 Kenneth J. Fountain 沃特世公司(美国马萨诸塞州米尔福德) 应用优势 无需离子对试剂即可实现单胺神经递质与变肾上腺素的保留与基线分离 快速、同步定量血浆变肾上腺素和儿茶酚胺 无需进行挥干和复溶,分析物即可浓缩4倍 可得到线性、准确、精密的结果,检测限最低可达10 pg/mL 沃特世解决方案 Oasis@ WCX 96孔pElution板(部件号186002499) 96孔样品收集板,700uL圆孔(部件号186005837) ACQUITY UPLC BEH Amide色谱柱1.7 um, 2.1x100 mm(部件号186004801) ACQUITY UPLC系统 XevoTQ-S质谱仪UNIFI科学信息系统 关键词 儿茶酚胺,,3变肾上腺素, HILIC, SPE,LC-MS/MS,样品制备 简介 临床研究者通常都很关注高浓度血浆儿茶酚胺及其0-甲基化代谢产物(变肾上腺素)的测定。但是,这些化合物(尤其是去甲肾上腺素、肾上腺素和多巴胺)由于极性较大,利用反相LC-MS/MS对其进行分析是一项巨大挑战。因此,许多研究实验室仍采用离子对试剂与电化学检测(ECD)分析这类物质。虽然反相LC-MS/MS已得到成功应用,但由于基质组分发生离子抑制、保留不够和异丙肾上腺素与肾上腺素未基线分离,致使挑战仍然存在。 亲水作用色谱(HILIC)已逐渐成为分析极性化合物的首选1-6。通过对之前发表的方法进行扩展6.7,本应用纪要介绍了血浆中单胺神经递质与变肾上腺素的提取与分析方法。采用沃特世(Waters@) ACQUITY UPLCBEH Amide色谱柱可实现基于HILIC的色谱分离。 Waters Oasis WCX 96孔uElution板可用来提取血浆中的这些化合物。将复合模式弱阳离子交换固相萃取(SPE)板,与用于HILIC色谱和Waters Xevo TQ-S质谱的酰胺基色谱柱结合使用,可获得具有出色线性、准确度和精密度的快速、稳定方法,并且能最大限度减少基质效应。 LC条件 LC系统: ACQUITY UPLC 色谱柱: ACQUITY UPLC BEH Amide, 1.7 um,2.1x100 mm 柱温: 30℃ 样品温度: 10℃ 流动相A(MPA): 95:5水:乙腈,含有 30mM NH HCOO, pH 3.0 流动相B(MPB): 15:85水:乙腈,含有 30 mM NH HCOO, pH 3.0 洗针液: 强洗针液和弱洗针液 同流动相B 梯度条件如表1所示,包含初始平衡条件,随后缓慢上升且流速增大,以重新平衡色谱柱。整个循环时间为4.0 min。 MS 条件 MS系统: Xevo TQ-S 电离模式: ESI+ 毛细管电压: 0.5kV 锥孔电压: 视化合物而定 (见表2) 去溶剂气流速:900L/h 锥孔气流速: 150L/h 去溶剂气温度:550 ℃ 源温度: 150℃ ( 采用UNIFI软件采集和分析数据。 ) 时间 流速 %A %B (min) (mL/min) 0 0.6 0.0 100.0 1.0 0.6 0.0 100.0 2.0 0.6 10.0 90.0 2.1 1.0 10.0 90.0 2.5 1.0 30.0 70.0 2.6 1.0 0.0 100.0 3.9 1.0 0.0 100.0 4.0 0.6 0.0 100.0 混标储液含有10 ug/mL的多巴胺(DA)、3-甲氧酪胺(3-MT)、变肾上腺素(MTN)、异丙肾上腺素(NMT)、50 ug/mL去甲肾上腺素(NE)和肾上腺素(EP),用含有0.1%抗坏血酸的甲醇配制,以防止氧化。混标储液由10 pg/mLD3-变肾上腺素、D3-异丙肾上腺素、D4-多巴胺、D6-肾上腺素和D6-去甲肾上腺素组成,也使用含有0.1%抗坏血酸的甲醇配制。浓度为2.5 ng/mL的内标工作溶液应使用含有0.1%甲酸的5%甲醇当天配制。 人血浆(肝素钠)从Biological Specialty Corporation(宾夕法尼亚州科尔马)处获得。混合血浆(6个批次)用于制备校准和质量控制样品。 样品制备 采用250 pLNH CH,CO0(50 mM) 和50pL内标工作溶液(2.5 ng/mL)对混合血浆样品(250L)进行预处理。将经过预处理的样品加载到经200 uL甲醇和200pLH20预处理的Oasis WCX 96孔pElution板的各孔中。加载样品之后,依次使用200pL NH CH,COO (20 mM)和200pL 50:50 乙腈:异丙醇对孔进行清洗。然后将96孔板在真空条件下干燥30s,,以尽可能多地除去柱床中的溶剂。使用2份25pl含有2%甲酸的85:15 ACN:H,0,将目标化合物由板洗脱到700uL的96孔样品收集板(部件号186005837)中。取15uL洗脱液注入UPLC@-MS/MS系统中。 [应用纪要] 结果与讨论 所有化合物的结构及其logP值如图1所示,可以看出,这些化合物多数具有较高极性。表2给出了每个化合物的保留时间和各自的MS参数,包括MRM跃迁、锥孔电压和碰撞能量。 图1.儿茶酚胺和变肾上腺素的名称、分子结构和logP值。 表2.分析儿茶酚胺和变肾上腺素的质谱参数。 分析物 RT MRM跃迁 锥孔电压 碰撞能量 (min) m/z (V) (eV) 3-甲氧酪胺 0.84 151.1>91.2 17 22 151.1>119.2 17 18 变肾上腺素 0.91 180>165.1 35 16 180>148.1 35 20 异丙肾上腺素 1.17 166.1>134.1 50 16 166.1>149.1 50 10 多巴胺 1.25 137.1>91.1 50 18 154.1>137.2 29 10 肾上腺素 1.40 184.1>166.1 15 8 166.1>107 15 18 去甲肾上腺素 1.98 152>135.2 46 14 152>79.2 20 20 图2A显示了采用ACQUITY UPLC BEH Amide色谱柱,从20pg/mL校准标准品中得到的所有化合物的色谱图。之前的研究结果6已经表明, MPB中30 mM NH,HCOO和15%的水实现了离子强度和溶解度的完美平衡,得到的分离度和峰形如图2A所示。该分离作用的一个重要特点体现在NMT和EP之间的分离度中。这两种化合物具有相同的分子量,如果未充分分离可能会彼此干扰。图2A显示出这些化合物在HILIC模式中实现了基线分离,能够进行明确的定性与定量。图2B显示出未加标血浆样品的HILIC色谱图,表明HILIC具备校正内源性3-MT、MTN、NMT、DA、EP和NE(分别为21.6、10.6、17.8、6.0、0.0和4.1 ng/mL)的能力。 图2A.儿茶酚胺和变肾上腺素在ACQUITY UPLC BEH Amide色谱柱(1.7 pm, 2.1x100mm)上得到的色谱图。加入浓度为20 pg/mL(EP和NE加入 100 pg/mL)的代表性校准标准品。 图2B.儿茶酚胺和变肾上腺素在ACQUITY UPLC BEH Amide色谱柱(1.7 um,2.1x100mm)上得到的色谱图。代表性方法空白。所有化合物的内源性浓度列于表3中。 [应用纪要] 回收率和基质效应 提取回收率和基质效应如图3所示。回收率范围介于54%(NE)到90% (DA)之间,平均回收率为76.4%。基质效应平均值为-6.9%。最大的基质效应分别是NE的-23%和DA的-22%,其它化合物的可以忽略不计。以上结果显示出HILIC色谱的另一项优势,即分析极性化合物时能够最大程度降低基质效应。 图3.采用0asis WCX 96孔pElution板(N=4)从尿液中提取儿茶酚胺和变肾上腺素的回收率和基质效应。将所有化合物以100pg/mL的浓度加标至混合人血浆中。 定量结果 通过将已知浓度分析物加标至混合血浆样品中制备校准曲线和质量控制样品。采用了两个校准曲线的范围,反映出血浆中各种化合物不同的预期浓度。3-MT、变肾上腺素、异丙肾上腺素和多巴胺的校准浓度范围为10-2,000 pg/mL。肾上腺素和去甲肾上腺素的校准浓度范围为50-10,000pg/mL。进行数据处理之后,,可由得出的校准曲线外推出内源性浓度。将这些数据用于校正实际浓度。例如,确定用于校准的血浆样品含有31.7 pg/mL变肾上腺素,因此将校准浓度范围调整为41.7-2031.7 pg/mL。得出的校准曲线显示出良好线性,所有化合物的R²值均达到0.999或更高。 图4显示出DA和MTN的代表性校准曲线,两者的R²值均在0.999以上。表3汇总了所有化合物的校准数据。由预期校准值得到的所有分析物的平均偏差%均小于1%。此外,表中列出了由校准值得到的最大偏差%,显示了除肾上腺素之外,所有校准品的最大偏差%都小于10%。表中还列出了计算出的用于校准的混合血浆中化合物的内源性浓度,,以及每个化合物校正后的校准范围。 图4.从血浆样品中提取的多巴胺(DA)和变肾上腺素(MTN)的代表性校准曲线。采用1/x加权线性拟合对数据进行行合。DA和MTN的基底浓度分别为0和30pg/mL。 表3.血浆变肾上腺素和儿茶酚胺的校准数据汇总。平均偏差%表示来自理论浓度的所有校准点的平均偏差%。最大偏差%表示整个校准范围中的最大偏差。计算出的内源性浓度如表中所列,可用于校正校准范围。 R2 平均偏差%最大偏差% 内源性农度 已校正的 (pg/mL) 校准范围 3-MT 0.9993 0.25% 2.89% 7 17-2007 变肾上腺素 0.9997 0.00% 2.50% 32 42-2042 异丙肾上腺素 0.9998 0.00% 1.72% 71 81-2081 多巴胺 0.9994 -0.33% 4.57% 0 10-2000 肾上腺素 0.9990 0.84% 11.83% 29 79-10079 去甲肾上腺素 0.9995 0.00% 2.59% 361 411-10411 EP和NE以200、500、2000和4000 pg/mL的浓度加入质量控制样品(N=6),其余化合物的加入浓度分别为40、100、400和800 pg/mL。QC结果准确、精密(见表4)。所有QC值均在其各自目标值10%的范围以内,大部分在5%以内。此外,所有变异系数(%CV)均小于10%。这证明了该方法在包含正常样品与病理升高样品的整个预期值范围的校准范围中,可得到线性、准确、精密的结果。 QC加标浓度 40pg/mL 100 pg/mL 400 pg/mL 800 pg/mL 平均值标准偏差%CV 平均值标准偏差%CV 平均值标准偏差%CV 平均值标准偏差 %CV 3-MT 99.9% 7.4% 7.4% 99.2% 3.0% 3.1% 105.9% 1.8% 1.7% 93.9% 2.6% 2.8% 变肾上腺素 99.9% 2.0% 2.0% 97.6% 0.8% 0.8% 107.3% 1.2% 1.1% 94.6% 1.7% 1.7% 异丙肾上腺素 99.8% 1.6% 1.6% 96.8% 1.7% 1.8% 104.6% 0.4% 0.4% 93.4% 1.0% 1.1% 多巴胺 97.0% 7.2% 7.4% 91.2% 3.4% 3.7% 103.7% 3.1% 3.0% 95.6% 2.7% 2.8% 200 pg/mL 500 pg/mL 2000 pg/mL 4000 pg/mL 平均值标准偏差%CV 平均值标准偏差%CV 平均值标准偏差%CV 平均值标准偏差 %CV 肾上腺素 97.3% 4.3% 4.4% 98.8% 2.2% 2.2% 100.8% 1.4% 1.4% 97.0% 2.6% 2.6% 去甲肾上腺素 105.1% 7.7% 7.4% 102.6% 8.2% 8.0% 96.7% 1.3% 1.3% 97.1% 4.2% 4.3% 本文详细描述了采用Oasis WCX uElution板和ACQUITYUPLC BEH Amide色谱柱在HILIC模式下对血浆儿茶酚胺和变肾上上素的提取和分析过程。采用Oasis WCX板进行提取,可实现所有化合物较低的基质效应和一致的回收率,并能够得到较好的精密度。此外,具有极小的洗脱体积(50uL),无需挥发和复溶,,即可将样品浓缩4倍。用于HILIC分离的ACQUITY UPLC BEH Amide色谱柱能快速、高效地分离所有化合物, 可实现异丙肾上腺素(NMT)和肾上腺素(EP)的基线分离,并且还能用于单胺、多巴胺、去甲肾上腺素和肾上腺素的分析。定量结果十分出色,在整个校准范围内具.有极高的线性响应,表现出了出色的准确度和分析精度。 仅供研究使用。不适用于诊断。 THE SCIENCE OF WHAT'S POSSIBLE. Waters, Oasis, ACQUITY UPLC, Xevo, UNIFI, UPLC和 The Science of What’s Possible是沃特世公司的注册商标。其它所有商标均归各自的拥有者所有。 ( 参考文献 ) ( l . C ubbon S , Antonio C, Wilson J, T homas-Oates J. M e tabolomic ap p lications of HI L IC-LC-MS. Mass SpectromRev. 2010 Sep-0ct;29(5):671-84. ) ( 2. J J ian W, Edom R W , Xu Y, Weng N. R e cent advances in application o f hydrophilic interaction chromatography fo r q u antitative bioanalysis. J Sep Sci. 2 0 1 0 Mar;33(6-7):681-97. ) ( 3.1 XuRN,Rieser MJ, El-Sh o urbagy TA.Bioanalytical hydrophilic inte r action chromatography: re c ent challenges, solutions and applications. Bioanalysis. 2009 Apr;1(1):239-53. ) ( 4. Jian W, Xu Y, Edom RW, Weng N. Analysis of polar metabolites by hydrophilic interaction chromatography-MS/MS. Bioanalysis. 2011 A pr;3(8):899-912. ) ( 5. Hemstrom P, Irgum K. Hydrophilic interaction chromatography.J Sep Sci 2006 Aug;29(12):1784-821. ) ( 6. D 1 anaceau JP, Chambers EE, Fountain KJ.Hydrophilic interactionchromatography (HILIC) for LC-MS/MS analysis of monoamine neurotransmitters. Bioanalysis. 2012 Apr;4(7):783-94. ) ( 7 . Peaston RT, Graham KS, Ch a mbers E, van der Mol e n JC, B all S. Performance of plasma free metanephrines m e asured by liquid chromatography-tandem mass spectrometry in the diagnosis of pheochromocytoma. C lin Chim Acta. 2010 Apr 2;411(7-8):546-52. ) 沃特斯中国有限公司 沃特世科技(上海)有限公司 北京:010-52093866 上海:021-61562666 广州:020-28295999 成都:028-65784990 香港:852-29641800 ( 免费售后服务热线:800( 4 00)820 2676 ) Www.waters.com 采用复合模式SPE和亲水作用色谱 (HILIC)分析血浆儿茶酚胺和变肾上腺素
确定

还剩5页未读,是否继续阅读?
沃特世科技(上海)有限公司(Waters)为您提供《血浆儿茶酚胺和变肾上腺素进行快速、同步分析方法》,该方案主要用于全血/血清/血浆中--检测,参考标准--,《血浆儿茶酚胺和变肾上腺素进行快速、同步分析方法》用到的仪器有ACQUITY UPLC 超高效液相色谱、Waters Xevo TQ-S 三重四极杆质谱
推荐专场
相关方案
更多
该厂商其他方案
更多

















