
MALDI-8020体积紧凑、占位面积小、成本低、仪器维护方便、分析速度快,性能与传统大型同等模式的MALDI-TOF相比毫不逊色,可以快速获得N-糖链的分子量信息。通过分析MALDI-TOF质谱图谱的变化,直接评估不同预处理方法对结果的影响。
方案详情

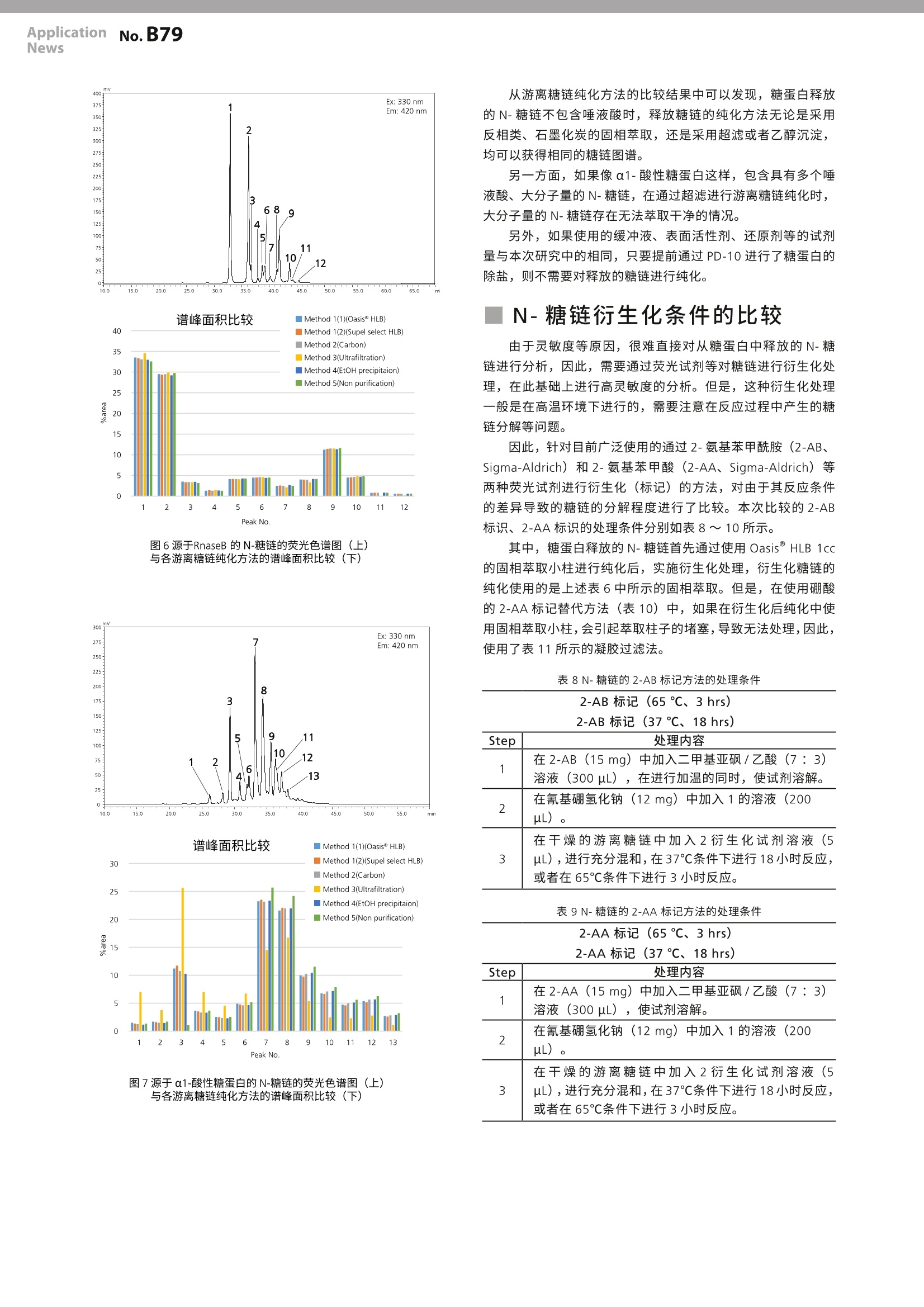
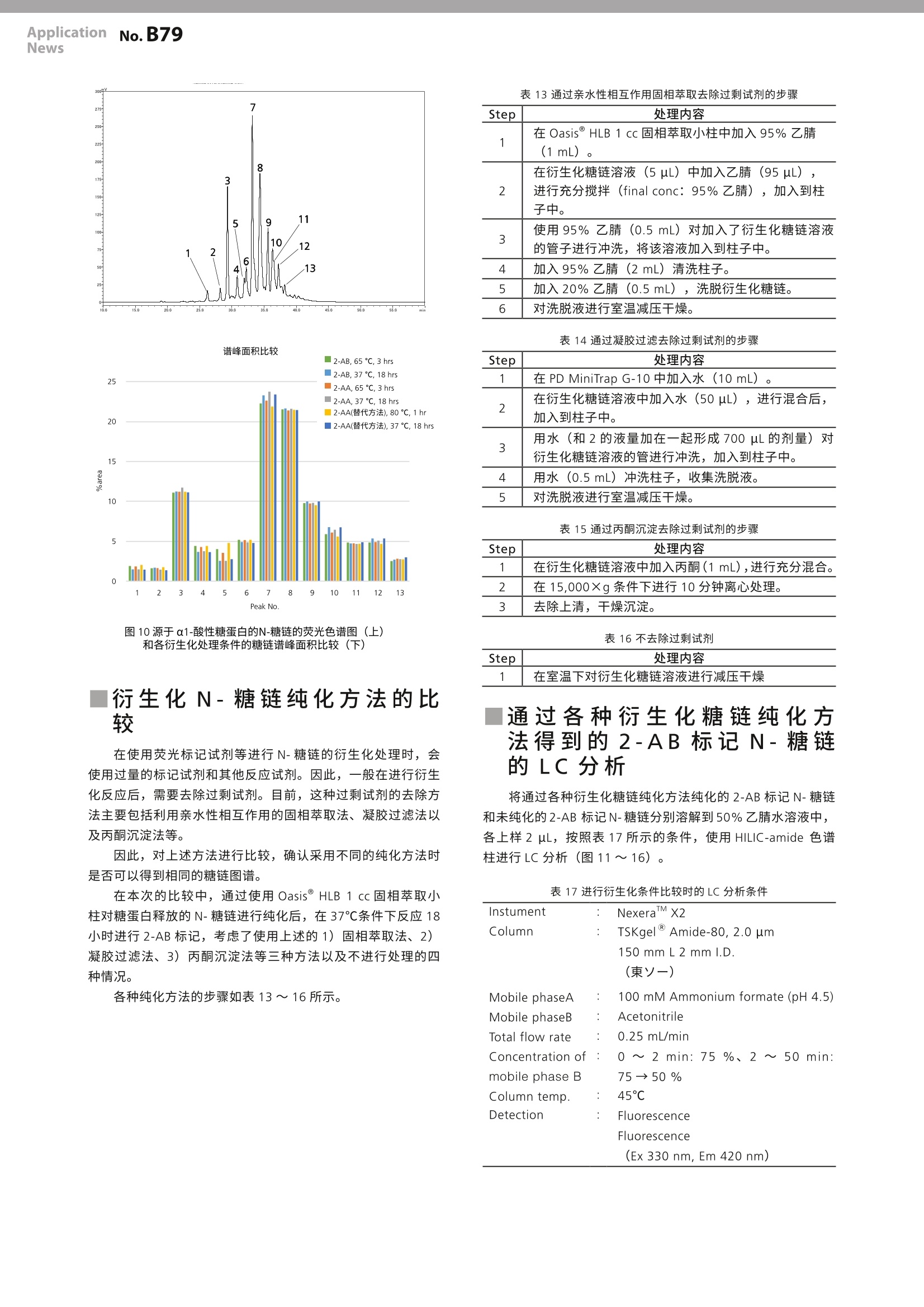
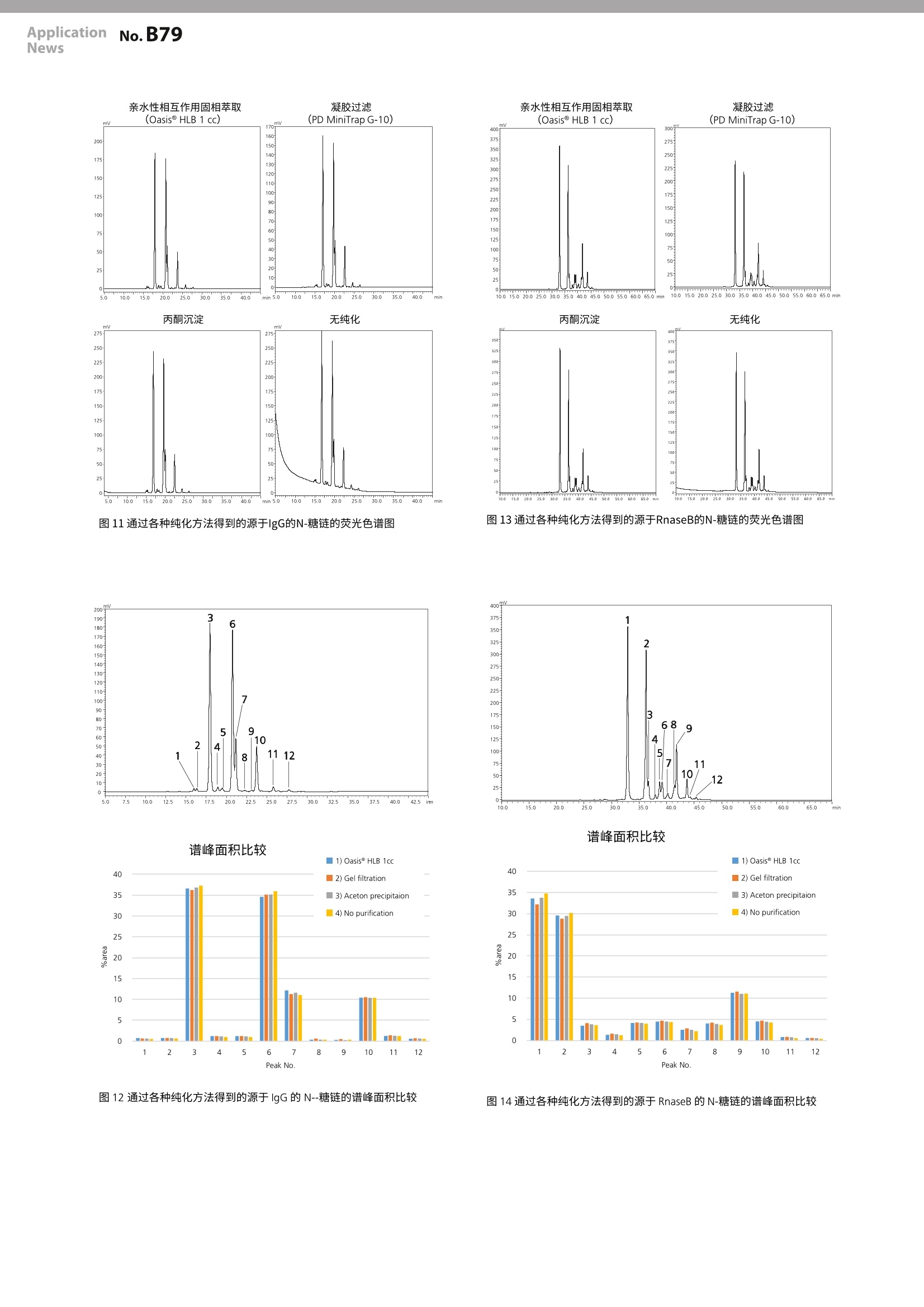
LAAN-A-TM056 ApplicationnNo.B79News 第一版发行行:2018年4月400-650-0439 ApplicationNews MALDI-TOF 质量分析法 No.LB79 生物药品中的糖链评价方法的研讨2-N-糖链分析所需的不同预处理方法的比较- 很多的蛋白质类生物药品是通过源于真核生物的培养细胞进行生物合成的。因此,所合成的蛋白质在绝大部分情况下都是以键合了糖链的糖蛋白存在。与糖蛋白键合的糖链大体可以分为N-键合型糖链(N-glycan)和O-键合型糖链(O-glycan),二者又分别具有多样化、复杂的分支结构。 现在已知,糖链的结构会对糖蛋白的功能和稳定性造成影响。因此,如果由于培养环境的变化等原因,导致与合成的糖蛋白键合的糖链的结构发生了变化,则有可能糖蛋白本身的功能和稳定性会出现意想不到的变化。这种可能性特别是在生物药品的开发与制造过程中,很容易导致重大问题的发生,因此,监控糖链结构是否发生了变化对于质量管理来说是非常重要的项目。 为了正确分析、评价糖链结构的变化,需要充分掌握本来的糖链结构,但是,在糖链分析中存在很多种预处理方法,而且没有实现标准化,因此,即使是同一种糖蛋白,也有可能因为预处理方法的不同,导致糖链分析的结果出现差异。 本文对在N-糖链分析中广泛使用的几种预处理方法进行了比较,研讨各种方法对分析结果所产生影响。 S. Nakaya ■从糖蛋白中释放N-糖链 在预处理方法的比较研讨中使用的糖蛋白是市售的IgG、RNase B 以及α1-酸性糖蛋白等三种。首先,使用 PD-10脱盐柱(GE医疗)对各样品进行除盐、冷冻干燥后,加水重新溶解至10 mg/mL, 然后量取5uL。在该样品中加入200mM磷酸钠缓冲液(pH7.2、2.5 pL)、5%SDS溶液(1.25uL)、0.5 M DTT 溶液(1.25 uL)、水(6uL),进行充分搅拌,在65℃条件下加热10分钟,使糖蛋白变性。然后,对样品溶液进行预冷后,加入5%NP-40溶液(5uL)进行搅拌,再加入PNGaseF (0.5 mU/uL、4 uL、Takara Bio),在37℃条件下使之反应18小时,从糖蛋白中释放N-糖链。 游离N-糖链纯化方法的比较 在完成N-糖链释放处理的反应溶液中除了所使用的酶之外,还包含着缓冲液成分以及其他低分子量化合物 (SDS、DTT)等的杂质,通常,需要对上述杂质进行去除处理。因此,在本实验中,对目前被主要采用的游离糖链纯化方法中的如下方法进行了比较:1.反相类固相萃取法;2.石墨化炭固相萃取法;3.超滤法;4.乙醇沉淀法;5.无处理。各种纯化方法的处理步骤如表1~5所示。 表1采用反相类固相萃取时的纯化步骤 Step 处理内容 1 在Oasis HLB 1cc 或者 Supel select HLB 1cc 中加入甲醇(1mL)、水(1mL)。 2 在反应溶液(25uL)中加水(200uL),进行充分搅拌。 3 将2的溶液加入柱子中。 4 使用10%甲醇(200uL)对加入了反应溶液的管子 进行冲洗,将该溶液加入到柱子中。用一个新管子收集洗脱液。 5 重复4的操作。 6 将10%甲醇(500uL)加入到柱子中。 7 从柱中排出全部溶液,并收集。 8 将4~7步骤的处理中回收的溶液全部收集在一起,在室温下进行减压干燥。 表2石墨化炭固相萃取时的纯化步骤 Step 处理内容 1 在 Supelclean ENVI-Carb SPE bed wt.100 mg中加入 乙腈(1mL)、水(3mL)。 2 将反应溶液(25uL)加入到柱中。 3 使用水(1mL)对加入了反应溶液的管进行冲洗,将 该溶液加入到柱子中。 4 加入水(2mL)清洗柱子。 5 在柱子出口安装 0.22 um 的微孔滤膜一 LG过滤器。 6 加入含有20 mM 三乙基乙酸铵的50%乙腈 (1mL)洗脱收集糖链。 7 在室温下对洗脱液进行减压干燥。 表3采用超滤时的纯化步骤 Step 处理内容 1 将水(0.5mL)加入贮液器[Protein Concentrators PES、10K MWCO、0.5 mL (RNaseB、a1-Acid Glycoprotein 用)或者30K MWC0、0.5mL (IgG用)] 中,按照15,000×g的条件进行10分钟的离心处理,清洗过滤膜。 将加入的溶液和贮液器中残留的溶液全部丢弃。 3 在贮液器中加入水(400uL), 再加入反应溶液(25uL)。 4 用水(100uL)对加入了反应溶液的管子进行冲洗,将该溶液加入贮液器中。 5 按照 15,000×g的条件进行15分钟的离心处理,回收通过膜的溶液。 6 将水(200pL)加入贮液器中,按照15,000×g的条 件进行15分钟的离心处理,回收通过膜的溶液。 7 将水(200pL)加入贮液器中,按照 15,000×g的条件进行10分钟的离心处理,回收通过膜的溶液。 8 将通过5~7步骤的处理回收的溶液全部收集在一起,在室温下进行减压干燥。 表4采用乙醇沉淀时的纯化步骤 Step 处理内容 1 在一20℃条件下进行乙醇的冷却。 2 在反应溶液(25uL)中加入冷乙醇(3倍量),进行 轻轻搅拌后,在一20℃条件下放置3小时。 3 在15,000×g条件下进行10分钟离心处理,回收上 清液。 4 在室温下对回收的溶液进行减压干燥。 在按照表1~5所示的各步骤处理的游离N-糖链中加入糖链标记试剂溶液,进行荧光标记。标记试剂溶液使用的是首先在15mg 的2-氨基苯甲酰胺(2-AB、Sigma-Aldrich)中加入300 uL的二甲基亚砜/乙酸(7:3)溶液,将该溶液200uL加入到12 mg的氰基硼氢化钠中,进行充分搅拌的溶液。在标记反应中,在干燥的糖链样品中加入标记记剂溶液(5uL),在37℃条件下进行18小时的反应。 在按照表6所示的步骤,通过过相萃取对2-AB标识N-糖链进行纯化后,加入50uL的50%乙腈水溶液进行重新溶解,将其作为分析样品。分析使用了 MALDI-TOF MS 和 LC。 表 6 通过亲水性相互作用固相萃取进行2-AB标记N-糖链纯化的步骤 Step 处理内容 1 在Oasis HLB 1cc 中加入95%乙腈(1mL)。 2 在反应溶液(5uL)中加入乙腈(95uL),进行充分搅拌后注入到柱子中。 3 使用95%乙腈(0.5mL)对加入了反应溶液的管进行冲洗,将该溶液注入到柱子中。 4 将95%乙(2mL)加入柱子中。 5 将20%乙腈(0.5mL)加入柱子中,溶出2-AB标记N-糖链。 6 在室温下对洗脱液进行减压干燥。 对通过各种游离糖链纯化方法得到的2-AB标记N-糖连进行MALDI-TOF MS分析 将分析样品溶液(0.5uL) 滴加到MALDI 靶板上。然后,在样品溶液上添加0.5 uL基质溶液,干燥后使用台式 MALDI-TOF MS“MALDI-8020”(图1)进行测定。其中,基质溶液使用的是将5 mg 2,5-二羟基苯甲酸 (DHB、Shimadzu GLC)溶解到50%乙腈/0.05%TFA 水溶液(500uL)中的溶液。 图1台式MADLI-TOF MS“MALDI-8020”外观 在对实施了各种预处理的 IgG 进行测定后发现,进行反相类固相萃取处理及超滤处理后, 2-AB标记N-糖链作为Na+加和离子而被检测出来,但是,在进行石墨化炭固相萃取处理和乙醇沉淀处理后,除了所标记的N-糖链之外,还原末端被氨化的未标记N-糖链也被强烈检测出来。另外,关于未进行游离糖链纯化处理的样品,所检测出的离子是2-AB标记N-糖链,但H+加和离子为主要离子(图2)。 图2源于 lgG 的N-糖链的 MALDI-TOF质谱 关于RnaseB, 也和IgG一样,在进行石墨化炭固相萃取和乙醇沉淀处理时,未标记糖链的离子被强烈检测出来(图3)。 图3源于RnaseB 的N-糖链的 MALDI-TOF质谱图 在α1-酸性糖蛋白中,未能确认未标记糖链的信号,但是,超滤处理后的3-支链唾液酸化的N-糖链离子的相对信号强度减弱。另外,还检测出多个可能是唾液酸的羧基-OH置换为-ONa 后的质量相差22 Da 的信号(图4)。 图4源于 RnaseB 的N-糖链的 MALDI-TOF 质谱图 通过各种游离糖链纯化方法得到的2-AB标记N-糖链的 LC分析 每份分析样品溶液各上样2ul,按照表7所示的条件,使用HILIC-amide 色谱柱进行 LC分析。 Instument : NexeraMX2 Column : TSKgelAmide-80, 2.0 um 150mm L2mm l.D. (東少一) Mobile phaseA : 100 mM Ammonium formate (pH 4.5) Mobile phaseB : Acetonitrile Total flow rate : 0.25 mL/min Concentration of: 0~2min: 75%、2~50 min: mobile phase B 75→50% Column temp. : 45℃ Detection : Fluorescence (Ex 330 nm, Em 420 nm) 进行LC分析后发现,采用不同预处理方法时, IgG、RnaseB 的色谱没有表现出较大的差异,只有含多个唾液酸的a1-酸性糖蛋白的超滤处理样品与其他处理方法相比色谱表现出较大差异。图5~7所示为分别采用各种不同预处理方法时得到的色谱谱峰面积比较图。 mV 200 190 3 Ex: 330nm 180 6 Em: 420 nm 170号 130 120 110号 1001 7 901 01 5 2 10 4 40 8 11 12 5.0 10.0 12.5 15.0 17.5 20.022.5 25.0 30.0 32.5 35.037.5 40.042.5 inm 图5源于 IgG的N-糖链的荧光色谱图(上)与各游离糖链纯化方法的谱峰面积比较(下) Peak No. 图6源于RnaseB 的N-糖链的荧光色谱图(上)与各游离糖链纯化方法的谱峰面积比较(下) 图7源于α1-酸性糖蛋白的N-糖链的荧光色谱图(上)与各游离糖链纯化方法的谱峰面积比较(下) 从游离糖链纯化方法的比较结果中可以发现,糖蛋白释放的N-糖链不包含唾液酸时,释放糖链的纯化方法无论是采用反相类、石墨化炭的固相萃取,还是采用超滤或者乙醇沉淀,均可以获得相同的糖链图谱。 另一方面,如果像α1-酸性糖蛋白这样,包含具有多个唾液酸、大分子量的N-糖链,在通过超滤进行游离糖链纯化时,大分子量的N-糖链存在无法萃取干净的情况。 另外,如果使用的缓冲液、表面活性剂、还原剂等的试剂量与本次研究中的相同,只要提前通过PD-10 进行了糖蛋白的除盐,则不需要对释放的糖链进行纯化。 N-糖链衍生化条件的比较 由于灵敏度等原因,很难直接对从糖蛋白中释放的N-糖链进行分析,因此,需要通过荧光试剂等对糖链进行衍生化处理,在此基础上进行高灵敏度的分析。但是,这种衍生化处理一般是在高温环境下进行的,需要注意在反应过程中产生的糖链分解等问题。 因此,针对目前广泛使用的通过2-氨基苯甲酰胺 (2-AB、Sigma-Aldrich)和2-氨基苯甲酸(2-AA、Sigma-Aldrich)等两种荧光试剂进行衍生化(标记)的方法,对由于其反应条件的差异导致的糖链的分解程度进行了比较。本次比较的2-AB标识、2-AA标识的处理条件分别如表8~10所示。 其中,糖蛋白释放的N-糖链首先通过使用 Oasis HLB 1cc的固相萃取小柱进行纯化后,实施衍生化处理,衍生化糖链的纯化使用的是上述表6中所示的固相萃取。但是,在使用硼酸的2-AA标记替代方法(表10)中,如果在衍生化后纯化中使用固相萃取小柱,会引起萃取柱子的堵塞,导致无法处理,因此,使用了表11所示的凝胶过滤法。 表8N-糖链的2-AB 标记方法的处理条件 Step 处理内容 1 在2-AB(15mg)中加入二甲基亚砜/乙酸(7:3)溶液(300uL),在进行加温的同时,使试剂溶解。 2 在氰基硼氢化钠(12mg)中加入1的溶液(200ul)。 3 在干燥的游离糖链中加入2衍生化试剂溶液(5uL),进行充分混和,在37℃条件下进行18小时反应, 或者在65℃条件下进行3小时反应。 表9N-糖链的 2-AA 标记方法的处理条件2-AA 标记(65℃、3 hrs) 2-AA 标记(65℃、3 hrs)2-AA标记(37℃、18 hrs) Step 处理内容 1 在2-AA(15mg)中加入二甲基亚砜/乙酸(7:3)溶液 (300uL), 使试剂溶解。 2 在氰基硼氢化钠(12mg)中加入1的溶液(200uL)。 3 在干燥的游离糖链中加入2衍生化试剂溶液(5uL),进行充分混和,在37℃条件下进行18小时反应, 或者在65℃条件下进行3小时反应。 表10 N-糖链的2-AA标记替代方法的处理条件 2-AA标记替代方法(80℃、1hrs) 2-AA标记替代方法(37℃、18hrs) Step 处理内容 1 在甲醇(100mL)中加入三水合乙酸钠(4g)和硼酸(2g)。 2 在1的试剂溶液(1mL)中加入2-AA (30mg) 和氰基硼氢化钠(30mg)。 3 在干燥的游离糖链中加入2的衍生化试剂溶液(100uL),进行充分混匀,在37℃条件下进行18小时反应,或者在80℃条件下进行1小时反应。 表11通过2-AA标记替代方法处理的衍生化N-糖链的纯化步骤 Step 处理内容 1 在凝疑过滤柱 (PD MiniTrap G-10)中加入水(10mL)。 2 在衍生化糖链溶液中加入水(50uL), 进行混合后,加入到柱子中。 3 用水(和2的液量加在一起形成700uL的剂量)对衍生化糖链溶液的管进行冲洗,加入到柱子中。 4 用水 (0.5mL) 冲洗色谱柱,收集洗脱液。 5 在室温下对洗脱液进行减压干燥 |通过各种衍生化条件进行标记的N-糖链的 LC分析 将在常规条件(65℃、3 hrs 或者80℃、1 hr)下进行衍生化反应得到的2-AB 标己N糖链及2-AA标记N-糖链和在37℃条件下进行 18 hrs 的反应得到的样品分别溶解到50%乙腈水溶液中,使用 HILIC-amide 色谱柱,按照表12所述的条件上样2ul进行分析。 Instument : NexeraMX2 Column : TSKgelAmide-80, 2.0 um 150mm L2 mm l.D. (東)-) Mobile phaseA 100mM Ammonium formate (pH 4.5) Mobile phaseB Acetonitrile Total flow rate 0.25 mL/min Concentration of: 0~2 min: 75%、2~50 min: mobile phase B 75→50% Column temp. 45℃ Detection Fluorescence Ex 330 nm, Em 420nm (2-AB) Ex 350 nm, Em 425 nm (2-AA) 分别对进行2-AB 标记、2-AA标识的样品进行分析后发现,在以中性糖链为主要N-糖链的IgG (图8) 和 RNase B(图9)中,几乎没有发现反应条件导致的糖链图谱的差异,而在以含有多个唾液酸的酸性糖链为主要N-糖链的α1-酸性糖蛋白(图10)中,相对于在37℃条件下的反应,在65℃(2-AB/2-AA标记)和80C(2-AA标记)条件下的反应中,如色谱的谱峰No.7 和 No.10所示,出现了很多唾液酸局部解吸的情况。 谱峰面积比较 图8源于 lgG 的N-糖链的荧光色谱图(上)和各衍生化处理条件的糖链谱峰面积比较(下) 200 图9源于RnaseB 的N-糖链的荧光色谱图(上)和各衍生化处理条件的糖链谱峰面积比较(下) 25 20 15 10 0 3 4 5 7 8 9 10 11 1 13 PaakNo 图10源于a1-酸性糖蛋白的N-糖链的荧光色谱图(上)和各衍生化处理条件的糖链谱峰面积比较(下) |衍生化N-糖链纯化方法的比较 在使用荧光标记试剂等进行N-糖链的衍生化处理时,会使用过量的标记试剂和其他反应试剂。因此,一般在进行衍生化反应后,需要去除过剩试剂。目前,这种过剩试剂的去除方法主要包括利用亲水性相互作用的固相萃取法、凝胶过滤法以及丙酮沉淀法等。 因此,对上述方法进行比较,确认采用不同的纯化方法时是否可以得到相同的糖链图谱。 在本次的比较中,通过使用 OasisHLB 1 cc 固相萃取小柱对糖蛋白释放的N-糖链进行纯化后,在37℃条件下反应18小时进行2-AB标记,考虑了使用上述的1)固相萃取法、2)凝胶过滤法、3)丙酮沉淀法等三种方法以及不进行处理的四种情况。 各种纯化方法的步骤如表13~16所示。 表13通过亲水性相互作用固相萃取去除过剩试剂的步骤 Step 处理内容 1 在 Oasis HLB 1 cc 固相萃取小柱中加入95%乙腈(1mL)。 2 在衍生化糖链溶液(5uL)中加入乙腈(95uL), 进行充分搅拌(final conc: 95%乙腈),加入到柱子中。 3 使用95%乙腈(0.5mL)对加入了衍生化糖链溶液的管子进行冲洗,将该溶液加入到柱子中。 4 加入95%乙腈(2mL)清洗柱子。 5 加入20%乙腈(0.5mL),洗脱衍生化糖链。 6 对洗脱液进行室温减压干燥。 表14通过凝胶过滤去除过剩试剂的步骤 Step 处理内容 1 在 PD MiniTrap G-10中加入水(10mL)。 2 在衍生化糖链溶液中加入水(50uL),进行混合后,加入到柱子中。 3 用水(和2的液量加在一起形成700 uL的剂量)对衍生化糖链溶液的管进行冲洗,加入到柱子中。 4 用水(0.5mL)冲洗柱子,收集洗脱液。 5 对洗脱液进行室温减压干燥。 Step 处理内容 1 在衍生化糖链溶液中加入丙酮(1mL),进行充分混合。 2 在15,000×g条件下进行10分钟离心处理。 3 去除上清,干燥沉淀。 Step 处理内容 1 在室温下对衍生化糖链溶液进行减压干燥 通过各种衍生化糖链纯化方法得到的2-AB标记N-糖链的LC分析 将通过各种衍生化糖链纯化方法纯化的2-AB标记N-糖链和未纯化的2-AB标记N-糖链分别溶解到50%乙腈水溶液中,各上上2ul, 按照表17所示的条件,使用 HILIC-amide 色谱柱进行LC分析(图11~16)。 表17进行衍生化条件比较时的LC分析条件 Instument NexeraMX2 Column TSKgel Amide-80, 2.0 um 150mm L 2 mmI.D. (東)一) Mobile phaseA 100 mM Ammonium formate (pH 4.5) Mobile phaseB Acetonitrile Total flow rate 0.25 mL/min Concentration of: 0~2min: 75 %、2~50 min: mobile phase B 75→50% Column temp. : 45℃ Detection Fluorescence Fluorescence (Ex 330 nm, Em 420 nm) 图11通过各种纯化方法得到的源于IgG的N-糖链的荧光色谱图 图13通过各种纯化方法得到的源于RnaseB的N-糖链的荧光色谱图 谱峰面积比较 图12通过各种纯化方法得到的源于 lgG 的N--糖链的谱峰面积比较 图14通过各种纯化方法得到的源于RnaseB 的N-糖链的谱峰面积比较 图15通过各种纯化方法得到的源于α1-酸性糖蛋白的N-糖链的荧光色谱图 图16通过各种纯化方法得到的源于α1-酸性糖蛋白的N-糖链的 谱峰面积比较 .致谢 本研究是在2017年度国立研究开发法人日本医疗研究开发机构(AMED)的“新药开发基础推进研究事业”的支持下进行的。 Nexera 是岛津制作所株式会社的商标。 Oasis 是 Waters Technologies Corporation 的注册商标。 TSKgel 是东曹株式会社的注册商标。 MiniTrap 是 GE Healthcare BioProcess R&D AB 的注册商标。 岛津企业管理(中国)有限公司岛津(香港)有限公司 在对通过各种纯化方法处理的样品进行分析后发现,各种方法均可以得到相同的糖链谱图。 总结 在糖蛋白释放的N-糖链的分析中有三种工序是必要的:释放糖链的纯化、糖链的衍生化、衍生化糖链的纯化。 通过本次实施的各种预处理方法的比较,通过 HLB 试剂盒进行固相萃取是最适合的方法,它可以避免在游离糖链的纯化过程中进行衍生化处理后仍然残留未标识体,特别是在进行质谱分析时。但是,如果提前对糖蛋白样品进行了除盐处理,即使不进行游离糖链的纯化,通过荧光标记进行衍生化也是没有问题的。如果由于某种原因不能使用其他方法,必须使用超滤的方法时,需要平行实施不同滤孔大小超滤膜预处理,注意分析结果是否会受到预处理的影响。 至于下一步糖链的衍生化,无论采取何种标记方法,在可完成衍生化反应的温度范围内,通过尽可能在低温环境下进行长时间反应,尽量避免在预处理工程中容易损失的唾液酸等糖的消除反应,可以得到更加准确的糖链图谱。另一方面,在处理不含有酸性糖链的样品时,即使是很高的反应温度,糖链图谱也不会发生很大的变化,因此,可以根据处理样品的不同,选择实施高温短时间的反应,节约预处理所需的时间。 在最后一步衍生化糖链的纯化处理过程中,如果可以获取高浓度的样品而且标记反应所使用的试剂量与本研究中相同,则不进行纯化处理也可以进行分析。但是,这样容易在LC分析中导致基线漂移等问题,因此,如果可能的话,应尽量进行纯化处理。在方法方面,亲水性相互作用固相萃取最为可靠,但也可以使用丙酮沉淀等简便、低成本的处理方法。 *本资料未经许可不得擅自修改、转载、销售; ( *本资料中的所有信息仅供参考,不予任何保证。 ) ( 如有变动,恕不另行通知。 ) 本文对在N-糖链分析中广泛使用的几种预处理方法进行了比较,讨论了各种方法对分析结果所产生影响。对糖蛋白释放的N-链的分析包括释放糖链的纯化、糖链的衍生化、衍生化糖链的纯化等三个工序。通过HLB试剂盒进行固相萃取是最适合的方法。糖链的衍生化,应尽可能在低温环境下进行长时间反应,避免在预处理工程中容易丧损失的唾液酸等的糖的解吸消除反应,可以得到更加准确的糖链图谱。在衍生化糖链的纯化处理过程中,如果可以获取高浓度的试样时样品,则不进行纯化处理也可以进行分析。在方法方面,亲水性相互作用固相萃取是较为最为可靠的,但也可以使用丙酮沉淀等简便、低成本的处理方法。
确定





还剩6页未读,是否继续阅读?
岛津企业管理(中国)有限公司为您提供《N-糖链中分子量检测方案(生物质谱)》,该方案主要用于生物药品药物研发中分子量检测,参考标准--,《N-糖链中分子量检测方案(生物质谱)》用到的仪器有
相关方案
更多
该厂商其他方案
更多








