方案详情
文
本稿报道了一种基于PMP标记法1)的可以抑制剥皮反应的O-聚糖的化学切除方法,并报告了研究结果。以抗体药物为代表的蛋白质类药物,多由来源于真核生物的培养细胞如CHO(Chinese hamster ovary)细胞合成。出于这个原因,生物合成的蛋白质中不可避免地会存在众多翻译后修饰。其中,多聚糖的修饰除参与蛋白质的功能调节外,根据其结构的不同,有时还会产生抗原性,因此在生物药品质量相关评价方面备受瞩目。但是,聚糖的评价尚存在许多技术上的挑战。尤其是O-结合型聚糖(O-聚糖),很难用酶将其从蛋白质上完全切除,因此,主要采用肼解反应和β消除反应这两种化学切除方法进行聚糖的切除,但上述方法还存在必须改善的问题。肼解反应过程中需要处理一种爆炸性试剂,必须小心注意,所以操作性不强。而β消除技术由于连续的β消除反应会引发使多糖逐步降解的剥皮反应(peeling reaction)。一般来说,在使用β消除反应分析O-聚糖时,加入还原性试剂的还原性β消除技术可以在碱性条件下释放聚糖的同时还原糖链根部,而不引发连续的β消除反应。但由于该方法会完全还原聚糖的根部,无法在切除糖链后用荧光试剂等进行标记,这限制了该方法的应用。此外,由于聚糖自身的离子化效率不高,使用质谱对该方法获得的样品进行分析时,灵敏度较低。为了解决这个问题,研究者对一种可以结合2-AB或PA等荧光标记试剂而不还原聚糖根部的非还原性β消除/荧光标记技术进行了探索,但未能大幅度抑制连续的β消除反应。即使如此,在以O-聚糖为分析对象的学术研究中,剥皮反应生成的副产物的存在并未对研究造成重大妨碍。但是,对于生物药品等应用于人体的药物而言,必须对多糖进行评价以进行质量控制,此时如何处理评价过程中的副产物便成为了一大问题。
方案详情

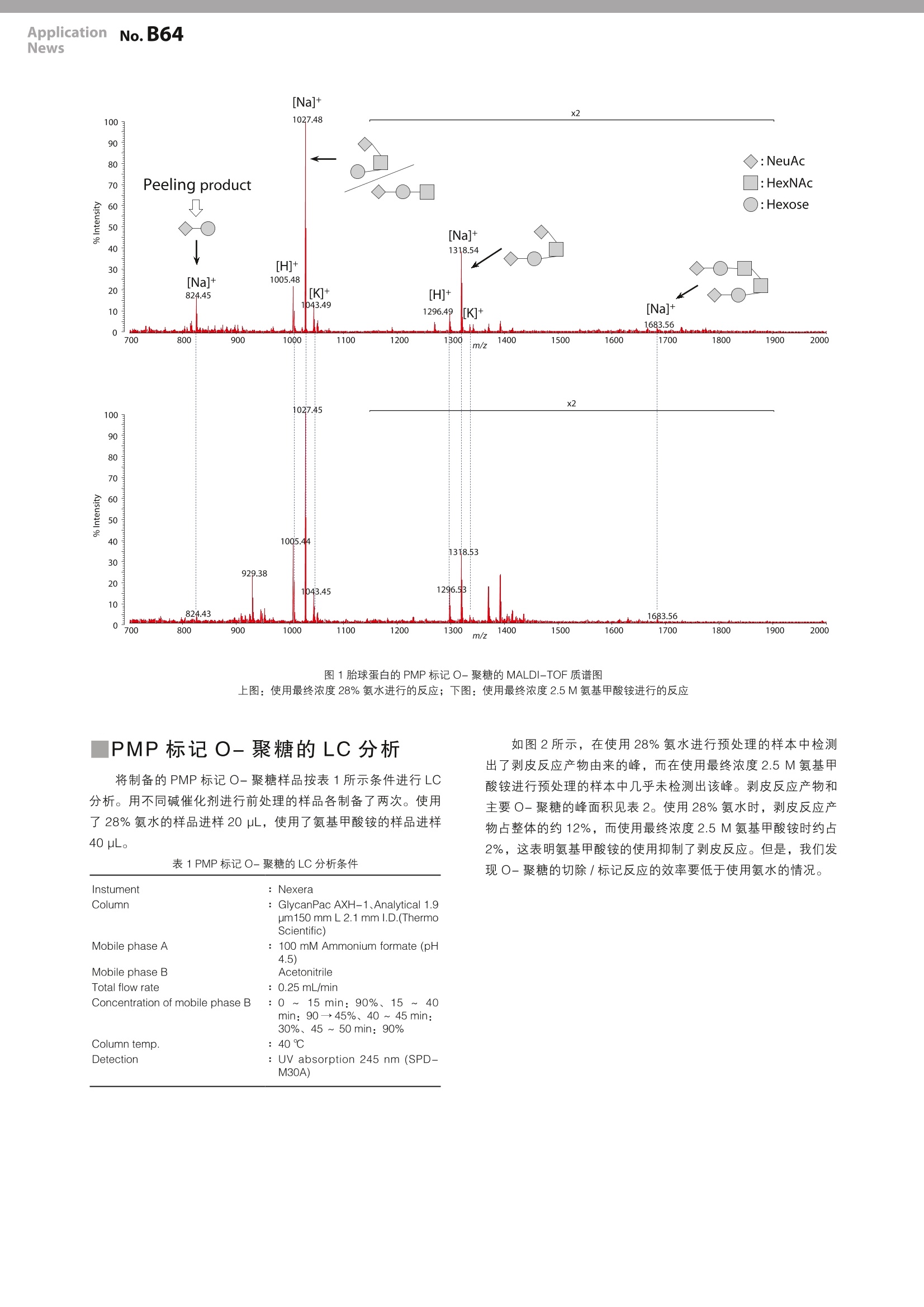
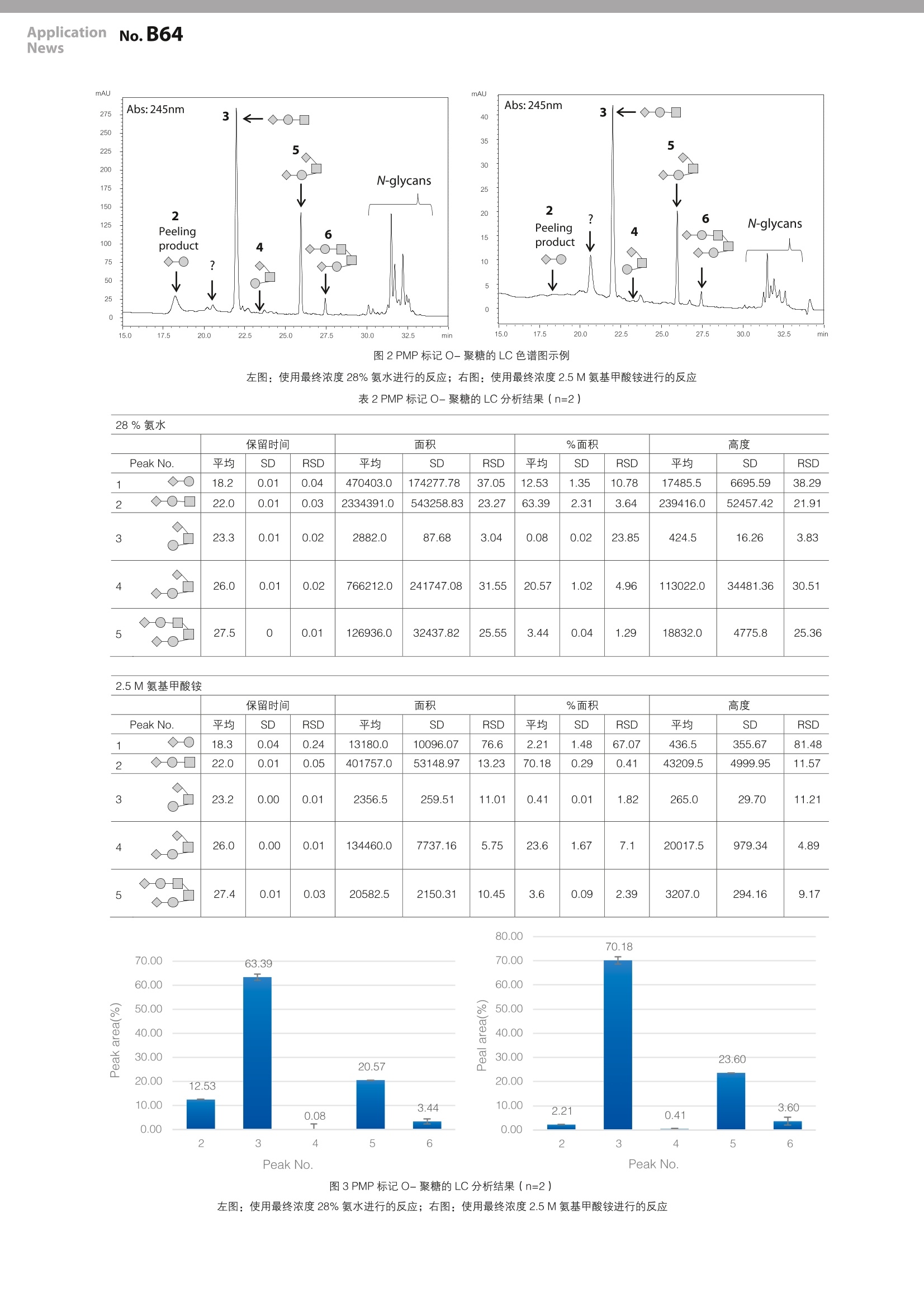
LAAN-A-TM043 ApplicationnNo.B64News 用户服务热线电话: 800-810-0439第一版发行日:2017年5月400-650-0439 ApplicationNews MALDI-TOF 质量分析法 生物药品中聚糖评价方法的研究-O-聚糖分析前处理中的剥皮反应的抑制- No.lB64 以抗体药物为代表的蛋白质类药物,多由来源于真核生物的培养细胞如 CHO ( Chinese hamster ovary )细胞合成。出于这个原因,生物合成的蛋白质中不可避免地会存在众多翻译后修饰。其中,聚糖的修饰除参与蛋白质的功能调节外,根据其结构的不同,有时还会产生抗原性,因此在生物药品质量相关评价方面备受瞩目。但是,聚糖的评价尚存在许多技术上的挑战。尤其是O-结合型聚糖(O-聚糖),很难用酶将其从蛋白质上完全切除,因此,主要采用肼解反应和β消除反应这两种化学切除方法进行聚糖的切除,但上述方法还存在必须改善的问题。肼解反应过程中需要处理一种爆炸性试剂,必须小心注意,所以操作性不强。而β消除技术由于连续的β消除反应会引发使多糖逐步降解的剥皮反应( peeling reaction)。一般来说,在使用β消除反应分析O-聚糖时,加入还原性试剂的还原性β消除技术可以在碱性条件下释放聚糖的同时还原糖链根部,而不引发连续的β消除反应。但由于该方法会完全还原聚糖的根部,无法在切除糖链后用荧光试剂等进行标记,这限制了该方法的应用。此外,由于聚糖自身的离子化效率不高,使用质谱对该方法获得的样品进行分析时,灵敏度较低。为了解决这个问题,研究者对一种可以结合2-AB 或 PA等荧光标记试剂而不还原聚糖根部的非还原性β消除/荧光标记技术进行了探索,但未能大幅度抑制连续的β消除反应。即使如此,在以O-聚糖为分析对象的学术研究中,剥皮反应生成的副产物的存在并未对研究造成重大妨碍。但是,对于生物药品等应用于人体的药物而言,必须对多糖进行评价以进行质量控制,此时如何处理评价过程中的副产物便成为了一大问题。 本稿报道了一种基于 PMP标法法的可以抑制剥皮反应的O-聚糖的化学切除方法,并报告了研究结果。 S. Nakaya 使用改进碱性试剂的One-pod-PMP标记 在用碱催化剂切除聚糖后,为了对释放的糖链进行 PMP标记,我们采用了一种以Wang 等2)人报道的使用了28%氨水的 One-Pod 法为基础的技术。我们选用氨基甲酸铵作为碱催化剂,期望可以看到剥皮反应的抑制效果。样品选用的是胎球蛋白(来源于胎牛血清的胎血蛋白 Sigma-Aldrich F3004-25MG),按下述方法对O-聚糖进行切除和标记。 将10 mg 的胎球蛋白溶于1mL的水后,以10 pL为单位分别注入1.5 mL 带螺帽的微量试管中,室温真空干燥。干燥后配制以下两种试剂溶液作为聚糖切除/标记溶液。 首先,向17.4 mg PMP(1-苯基-3-甲基-5-吡唑啉酮、Sigma-Aldrich )中加入200 pL 的28%氨水( Shigma-Aldrich)使其充分溶解,作为“氨水 PMP 标记溶液”( PMP最终浓度:0.5M、氨的最终浓度:28%)。然后,向34.8 mg 的PMP中加入200 pL 的甲醇溶液使其溶解,并将390 mg的氨基甲酸铵溶于1mL的水中,等量混合上述两种溶液,作为“氨基甲酸铵PMP 标记溶液””( PMP最终浓度:0.5M、氨基甲酸铵最终浓度:2.5M)。 分别取50 pL 上述溶液加入干燥后的胎球蛋白中,50℃反应16小时,同时进行蛋白质中聚糖的切除和PMP标记。将反应后的溶液转移至玻璃微量试管中,加入500 pL的水充分搅拌,室温真空干燥。向干燥后的样品中加入1%乙酸水溶液(500pL)和氯仿(500pL)后充分搅拌,离心,样品分离为水层(上层)和氯仿层(下层)后,将水层转移至新的玻璃微量试管中。向转移的水层中加入氯仿,重复液/液分离的过程两次,包含 PMP标记聚糖的水相就收集在 1.5 mL 管内。 将收集到的溶液室温真空干燥并溶解于1mL的水中,注入预先用2mL的乙腈和2mL的水清洗的C18固相萃取柱(SupelClean LC-18 SPE Tube1 mL、Supelco)上。用3mL的3%乙腈水溶液清洗柱子后,加入1mL的30%乙腈水溶液洗脱 PMP标记糖链。室温真空干燥洗脱液,加入50 uL的50%乙腈水溶液复溶,用于后续质谱和液相色谱分析。 |PMP标 记O-聚糖的 MADLI-TOF MS分析 向 PMP标记的O-聚糖样品(2pL)中加入0.1%三氟乙酸(TFA)水溶液(10pL)并充分搅拌,用经1M氢氧化钠(10pL×3)、水(10pL×5)、50%乙腈/0.1% TFA水溶液(10uL×3)、0.1%TFA 水溶液(10pL×5)清洗过的 NuTipCarbon ( glygen)吸附,再用0.1% TFA水溶液清洗后,加入50%乙腈/0.1% TFA水溶液洗脱O-聚糖,将全部洗脱液(约3uL)点样于 MALDI 靶板上。样品干燥后,在该样本上覆盖0.5 pL的 MALDI 用基质溶液并干燥,加入0.2 pL的乙醇对样品进行重结晶后进行实验分析。基质溶液的配制方法为将5 mg DHB (2,5-二羟基苯甲酸, ShimadzuGLC)溶于50%乙腈/0.05% TFA 水溶液(500pL)中,质谱分析采用的仪器是基质辅助激光解吸附电离飞行时间质谱仪(MALDI-7090、Shimadzu/Kratos)。 分析结果如图1所示,与使用28%氨水的情况相比,使用最终浓度2.5M的氨基甲酸铵时,剥皮反应产物的信号强度较弱。 图1胎球蛋白的 PMP标记O-聚糖的 MALDI-TOF质谱图 上图:使用最终浓度28%氨水进行的反应;下图:使用最终终度2.5M氨基甲酸铵进行的反应 PMP标记O-聚糖的LC分析 将制备的 PMP 标记O-聚糖样品按表1所示条件进行LC分析。用不同碱催化剂进行前处理的样品各制备了两次。使用了28%氨水的样品进样20 pL,使用了氨基甲酸铵的样品进样40 pL. 表 1PMP标记O-聚糖的 LC分析条件 Instument : Nexera Column : GlycanPacAXH-1、Analytical 1.9 pm150 mmL2.1mml.D.(Thermo Scientific) Mobile phase A : 100 mM Ammonium formate (pH 4.5) Mobile phase B Acetonitrile Total flow rate : 0.25 mL/min Concentration of mobile phase B :0~15 min:90%、15~40 min: 90→45%、40~45 min: 30%、45~50 min: 90% Column temp. :40℃ Detection : UV absorption 245 nm (SPD- M30A) 如图2所示,在使用28%氨水进行预处理的样本中检测出了剥皮反应产物由来的峰,而在使用最终浓度2.5M氨基甲酸铵进行预处理的样本中几乎未检测出该峰。剥皮反应产物和主要O-聚糖的峰面积见表2。使用28%氨水时,剥皮反应产物占整体的约12%,而使用最终浓度2.5M氨基甲酸铵时约占2%,这表明氨基甲酸铵的使用抑制了剥皮反应。但是,我们发现O-聚糖的切除/标记反应的效率要低于使用氨水的情况。 图2PMP标记O-聚糖的 LC色谱图示例 左图:使用最终浓度28%氨水进行的反应;右图:使用最终浓度2.5M氨基甲酸铵进行的反应 表2PMP标记O-聚糖的LC分析结果(n=2) 28%氨水 保留时间 面积 %面积 高度 Peak No. 平均 SD RSD 平均 SD RSD 平均 SD RSD 平均 SD RSD 1◇-O 18.2 0.01 0.04 470403.0 174277.78 37.05 12.53 1.35 10.78 17485.5 6695.59 38.29 2 ◇O- 22.0 0.01 0.03 2334391.0 543258.83 23.27 63.39 2.31 3.64 239416.0 52457.42 21.91 3 23.3 0.01 0.02 2882.0 87.68 3.04 0.08 0.02 23.85 424.5 16.26 3.83 4 ◇- 26.0 0.01 0.02 766212.0 241747.08 31.55 20.57 1.02 4.96 113022.0 34481.36 30.51 5 ◇-O-◇-O 27.5 0 0.01 126936.0 32437.82 25.55 3.44 0.04 1.29 18832.0 4775.8 25.36 2.5M氨基甲酸铵 2.5M氨基甲酸铵 保留时间 面积 %面积 高度 Peak No. 平均 SD RSD 平均 SD RSD 平均 SD RSD 平均 SD RSD 1 18.3 0.04 0.24 13180.0 10096.07 76.6 2.21 1.48 67.07 436.5 355.67 81.48 2◇-O-□ 22.0 0.01 0.05 401757.0 53148.97 13.23 70.18 0.29 0.41 43209.5 4999.95 11.57 3 23.2 0.00 0.01 2356.5 259.51 11.01 0.41 0.01 1.82 265.0 29.70 11.21 4 ◇-O- 26.0 0.00 0.01 134460.0 7737.16 5.75 23.6 1.67 7.1 20017.5 979.34 4.89 5 ◇-O-◇-O 27.4 0.01 0.03 20582.5 2150.31 10.45 3.6 0.09 2.39 3207.0 294.16 9.17 80.00 70.18 图3PMP标记O-聚糖的LC分析结果(n=2) 左图:使用最终浓度28%氨水进行的反应;右图:使用最终浓度2.5M氨基甲酸铵进行的反应 考察 根据本次实验结果,确认了进行精确O-聚糖分析时的问题产物-剥皮反应产物的生成,可通过使用氨基甲酸铵的One-pod PMP标记技术,抑制在全部O-聚糖的几个百分点以内。虽然该方法存在所需样品量等限制,但仍可用于O-聚糖糖型分析。 然而,相比于其他技术,本次实验中所用试剂和反应条件对应的聚糖切除效率和标记效率并不高。虽然同时进行糖链切除和标记有效抑制了剥皮反应,但使用 PMP标记时,与PA标记和2-AB标记等的荧光检测相比,基于紫外吸收的LC检测灵敏度较低,且易受到污染试剂的背景干扰。为排除上述影响,有必要探索能同时进行切除/标记反应并且具有良好反应效率的试剂,也有必要对反应条件进行进一步的研究。 ( 参考文献 ) ( 1) S Honda. et al., High-performance l iquid chromatography of r educing carbohydrates as strongly ultraviolet-absorbingand eletrochemically sensitiv e 1-phenyl-3-methyl-5-pyrazolone d e rivatives. Anal. Biochem. 1989, 180,351-357. ) ( 2) C Wang. e t al. , One-pot nonreductive O-glycan release and labeling with 1-phenyl-3-methyl- 5 -pyrazolone followed b y ESI-MS analysis. Proteomics. 20 11 , 11,4229 - 4242 ) ( 致谢 ) ( 本研究得到了独立行政法人日本医疗研究开发机构(AMED) 的2016年度“药物发现基础技术的研究和促进”项目的大力支持。 ) 岛津企业管理(中国)有限公司岛津(香港)有限公司 ( 免责声明: ) ( *本资料未经许可不得擅自修改、转载、销售; ) ( http://www.shimadzu.com.cn ) ( *本资料中的所有信息仅供参考,不予任何保证。 如有变动,恕不另行通知。 ) 以抗体药物为代表的蛋白质类药物,多由来源于真核生物的培养细胞如CHO(Chinese hamster ovary)细胞合成。出于这个原因,生物合成的蛋白质中不可避免地会存在众多翻译后修饰。其中,多聚糖的修饰除参与蛋白质的功能调节外,根据其结构的不同,有时还会产生抗原性,因此在生物药品质量相关评价方面备受瞩目。但是,聚糖的评价尚存在许多技术上的挑战。尤其是O-结合型聚糖(O-聚糖),很难用酶将其从蛋白质上完全切除,因此,主要采用肼解反应和β消除反应这两种化学切除方法进行聚糖的切除,但上述方法还存在必须改善的问题。肼解反应过程中需要处理一种爆炸性试剂,必须小心注意,所以操作性不强。而β消除技术由于连续的β消除反应会引发使多糖逐步降解的剥皮反应(peeling reaction)。一般来说,在使用β消除反应分析O-聚糖时,加入还原性试剂的还原性β消除技术可以在碱性条件下释放聚糖的同时还原糖链根部,而不引发连续的β消除反应。但由于该方法会完全还原聚糖的根部,无法在切除糖链后用荧光试剂等进行标记,这限制了该方法的应用。此外,由于聚糖自身的离子化效率不高,使用质谱对该方法获得的样品进行分析时,灵敏度较低。为了解决这个问题,研究者对一种可以结合2-AB或PA等荧光标记试剂而不还原聚糖根部的非还原性β消除/荧光标记技术进行了探索,但未能大幅度抑制连续的β消除反应。即使如此,在以O-聚糖为分析对象的学术研究中,剥皮反应生成的副产物的存在并未对研究造成重大妨碍。但是,对于生物药品等应用于人体的药物而言,必须对多糖进行评价以进行质量控制,此时如何处理评价过程中的副产物便成为了一大问题。
确定


还剩2页未读,是否继续阅读?
岛津企业管理(中国)有限公司为您提供《生物药品中聚糖检测方案(生物质谱)》,该方案主要用于治疗类生物药品中含量测定检测,参考标准--,《生物药品中聚糖检测方案(生物质谱)》用到的仪器有微芯片电泳系统
推荐专场
该厂商其他方案
更多
















