NR/R双向电泳的基本原理是根据LaemmLi的SDS电泳原理设计的,NR指的是非还原相,R指的是还原相。
SDS聚丙烯酰胺凝胶电泳可将不同相对分子质量的蛋白质按相对分子质量大小分离开来。NR/R双向对角线电泳的第一向是在非还原条件下的SDS电泳,电泳结束后将胶条切下,置于含 2-硫基乙醇的样品处理液中处理,使其-S-S-键被还原断裂,将处理后的胶条置于第二向SDS电泳槽的夹层中凝胶上方,然后进行第二向电泳。
电泳结果中凡是即无链内二硫键又无链间二硫键的蛋白质均处于对角线上,凡含有链间二硫键的蛋白质,因二硫键断裂,使两条或两条以上的肽链分开,相对分子质量变小,迁移率加大,而出现在对角线的下方,凡含有链内二硫键的蛋白质,因二硫键断裂,而使肽链松散,迁移率降低,而出现在对角线的上方。
方案详情

来亨科学仪器Laiheng Lab-Equipment 2北京来亨科学仪器有限公司技术中心:北京金桥科技产业基地景盛南二街33号4号楼4层 蛋白质的 NR/R双向对线电泳 红 一、实验原理 NR/R双向电泳的基本原理是根据 LaemmLi 的 SDS电泳原理设计的,NR指的是非还原相,R指的是还原相。 SDS 聚丙烯酰胺凝胶电泳可将不同相对分子质量的蛋白质按相对分子质量大小分离开来。NR/R双向对角线电泳的第一向是在非还原条件下的 SDS电泳,电泳结束后将胶条切下,置于含2-硫基乙醇的样品处理液中处理,使其-S-S-键被还原断裂,将处理后的胶条置于第二向 SDS 电泳槽的夹层中凝胶上方,然后进行第二向电泳。 北京来亨科学仪器有限公司 技术中心:北京金桥科技产业基地 景盛南二街33号4号楼4层 电泳结果中凡是即无链内二硫键又无链间二硫键的蛋白质均处于对角线上,凡含有链间二硫键的蛋白质,因二硫键断裂,使两条或两条以上的肽链分开,相对分子质量变小,迁移率加大,而出现在对角线的下方,凡含有链内二硫键的蛋白质,因二硫键断裂,而使肽链松散,迁移率降低,而出现在对角线的上方。 二、实验用品 (一)器材 (1)垂直板型电泳装置。 (2)1ml 和100pL微量进样器,10uL微量进样器。 (二)试剂 (1)第一向样品处理用缓冲液:62.5mmol/L Tris.Hcl,2% SDS,10%甘氨酸, PH6.8。 (2)第二向样品处理用缓冲液:62.5mmol/L Tris.Hcl,2% SDS,5%巯基乙醇,10%甘氨酸, PH6.8。 (3)电泳缓冲液:同常规的SDS电泳,二向均相同。 (4)储备液:按下表 编号 名称 配制方法 A pH8.8缓冲液 Tris 18.17g, SDS0.4g, 加蒸馏水至100ml, 用 HCL调至8.8. B pH6.8缓冲液 Tris 18.17g, SDS0.4g, 加蒸馏水至100ml,用HCL调至6.8。 C 30%丙烯先胺溶液 丙烯酰胺 30g, 甲叉双丙烯酰胺 0.8g,用蒸馏水配制100ml D 过硫酸铵 50mg 用蒸馏水配制成0.5ml (5)染色液、脱色液及保存液配制方法。 溶液名称 配制方法 染色液 考马斯亮蓝R-250 0.25g 溶于125ml 甲醇和 17.5ml冰醋 酸中,用蒸馏水配制到250ml。 7%醋酸-20%甲醇脱色液 甲醇100ml, 冰醋酸35ml,加蒸馏水配成 500ml。 7%醋酸保存液 冰醋酸35ml, 加蒸馏水配制成500ml。 (三)材料 电泳纯的牛清白蛋白,胰岛素,核糖核酸酶 三、实验程序 1.制胶 按下列配方依次将各溶液加到25ml三角瓶中(表9-18、表9-19) (1)分离胶: 表9-18 试剂 A 第一向用 (1 mm 厚,10%) 6.75 mL 9 mL 第二向用 (1.5 mm 厚,12.5%) 6.75mL. 11.25mL C SDS 蒸馏水D 0.27 mL 0.27 mL 8.58 mL 120 pL 30 pL 10.83 mL TEMED 总体积 120pL 30pl. 27 mL 27 mL (2)浓缩胶 表9-19 试剂 第、二向用 (3.7%) B C SDS 蒸馏水 D TEMED 3mL 1.5mL 0.12 mL 7.29 mL 75 pL 15 pL 总体积 12 mL 北京来亨科学仪器有限公司 技术中心:北京金桥科技产业基地 注意:在加入D和 TEMED 之前,将混合液抽气,然后加D和 TEMED,且轻轻摇匀。灌制分离胶并加水封胶,室温旋转聚合约 30min,然后去掉分离胶上的水(用滤纸吸干),加浓缩胶,插入样品梳,室温放置聚合约30min,拔掉梳子。 2、样品处理 第一向:将标准蛋白和样品蛋白混合溶于150pL第一向样品处理用缓冲液中,在沸水中加热3min。 第二向:切下胶条置于含巯基乙醇的第二向样品处理用的缓冲液中浸泡 90min。 3.电泳 用经第一向处理液处理过的样品 50pL上样, 第一向电泳时恒定电流17mA。当臭酚兰泳至距胶端约5mm时,停止第一向电泳。切下第一向的胶条。将切下的胶条(1mm厚)经第二向缓冲液处理。将处理后的胶条置于第二向电泳用凝胶(胶厚1.5mm)之上端, (注意:第二向制胶时不要梳子)。第二向电泳时恒定电流25mA, 当溴酚兰泳至距胶端约5mm时,停止第二向电泳。 4.染色、脱色、照相保存 电泳结束后,取下凝胶模,卸下硅胶框,用不锈钢药铲或镊子撬开短玻璃板,从凝胶板上切下一角作为加样标记,在两侧溴酚蓝染料区带中心,插入细铜丝作为前沿标记。将凝胶板放入大培养皿中,加入染色液染色1~2h,用蒸馏水漂洗数次,再用脱色液脱色,直至蛋白质区带清晰,即可计算相对迁移率。 5.电泳结果分析 北京来亨科学仪器有限公司 技术中心:北京金桥科技产业基地 景盛南二街33号4号楼4层 实验原理NR/R双向电泳的基本原理是根据LaemmLi的SDS电泳原理设计的,NR指的是非还原相,R指的是还原相。 SDS聚丙烯酰胺凝胶电泳可将不同相对分子质量的蛋白质按相对分子质量大小分离开来。NR/R双向对角线电泳的第一向是在非还原条件下的SDS电泳,电泳结束后将胶条切下,置于含 2-硫基乙醇的样品处理液中处理,使其-S-S-键被还原断裂,将处理后的胶条置于第二向SDS电泳槽的夹层中凝胶上方,然后进行第二向电泳。 电泳结果中凡是即无链内二硫键又无链间二硫键的蛋白质均处于对角线上,凡含有链间二硫键的蛋白质,因二硫键断裂,使两条或两条以上的肽链分开,相对分子质量变小,迁移率加大,而出现在对角线的下方,凡含有链内二硫键的蛋白质,因二硫键断裂,而使肽链松散,迁移率降低,而出现在对角线的上方。 二、实验用品 (一)器材(1)垂直板型电泳装置。(2) 1ml 和100µL微量进样器,10µL微量进样器。 (二)试剂 (1)第一向样品处理用缓冲液:62.5mmol/L Tris.Hcl,2% SDS,10%甘氨酸,PH6.8。第二向样品处理用缓冲液:62.5mmol/L Tris.Hcl,2% SDS,5%巯基乙醇,10%甘氨酸,PH6.8。 电泳缓冲液:同常规的SDS电泳,二向均相同。
确定



还剩2页未读,是否继续阅读?
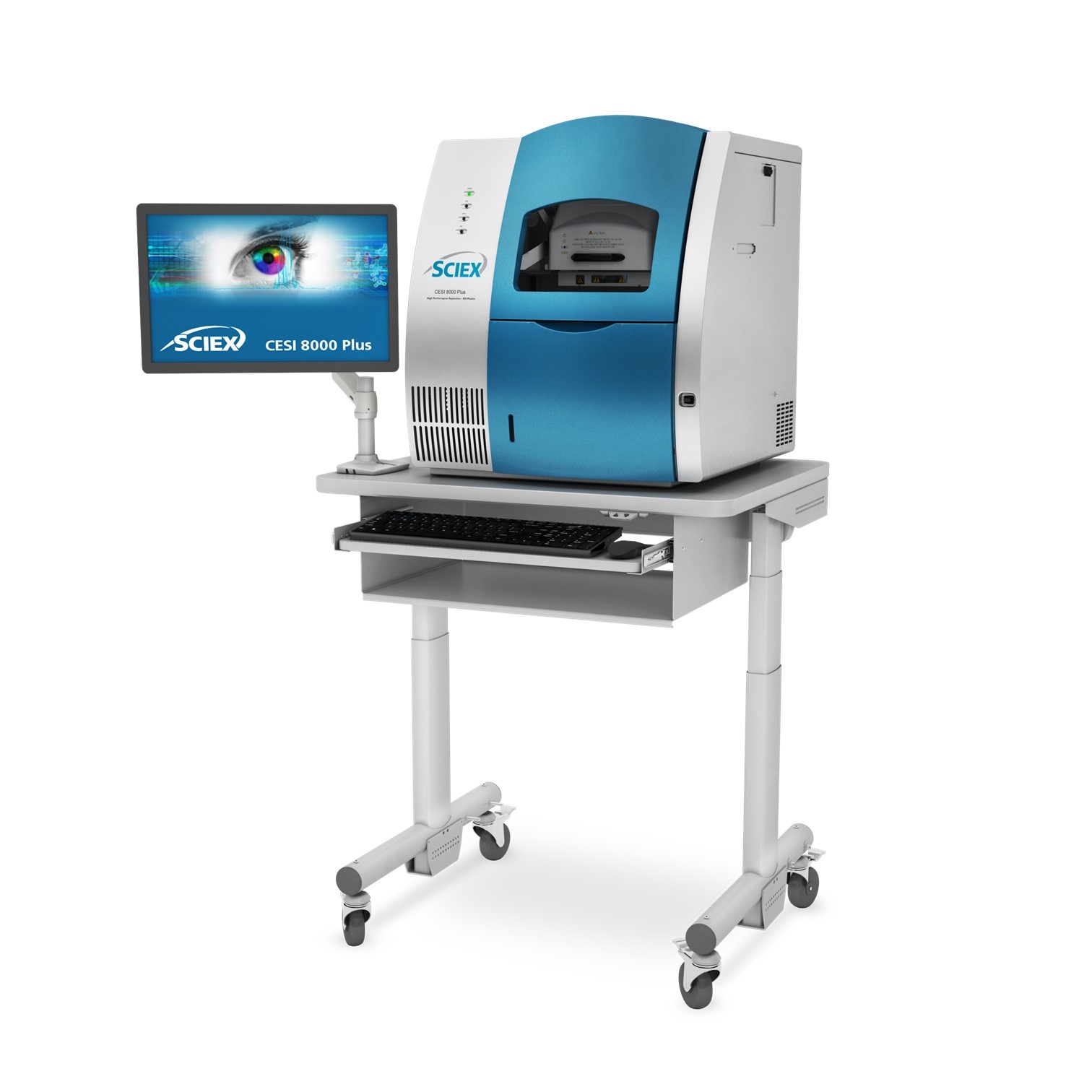
北京来亨科学仪器有限公司为您提供《电泳纯的牛清白蛋白,胰岛素,核糖核酸酶中双向对线电泳检测方案(毛细管电泳仪)》,该方案主要用于其他中双向对线电泳检测,参考标准--,《电泳纯的牛清白蛋白,胰岛素,核糖核酸酶中双向对线电泳检测方案(毛细管电泳仪)》用到的仪器有LUMEX毛细管电泳仪Capel105M
推荐专场
相关方案
更多
该厂商其他方案
更多