摘要:利用亲和毛细管电色谱整体柱对色氨酸对映体进行了手性拆分研究.利用溶胶-凝胶法制备了壳聚糖/硅胶复合基质毛细管整体柱,然后采用戊二醛交联柱上键合牛血清白蛋白(BSA)得到亲和毛细管整体柱,以毛细管电色谱(CEC)模式分离色氨酸对映体,考察了缓冲液pH、浓度及有机修饰剂含量对分离过程的影响.在缓冲液的浓度为20 mmol/L,pH 7.5时,色氨酸对映体分离效果良好,分离度为2.44.
关键词:壳聚糖; 牛血清白蛋白; 亲和整体柱; 色氨酸对映体;
方案详情

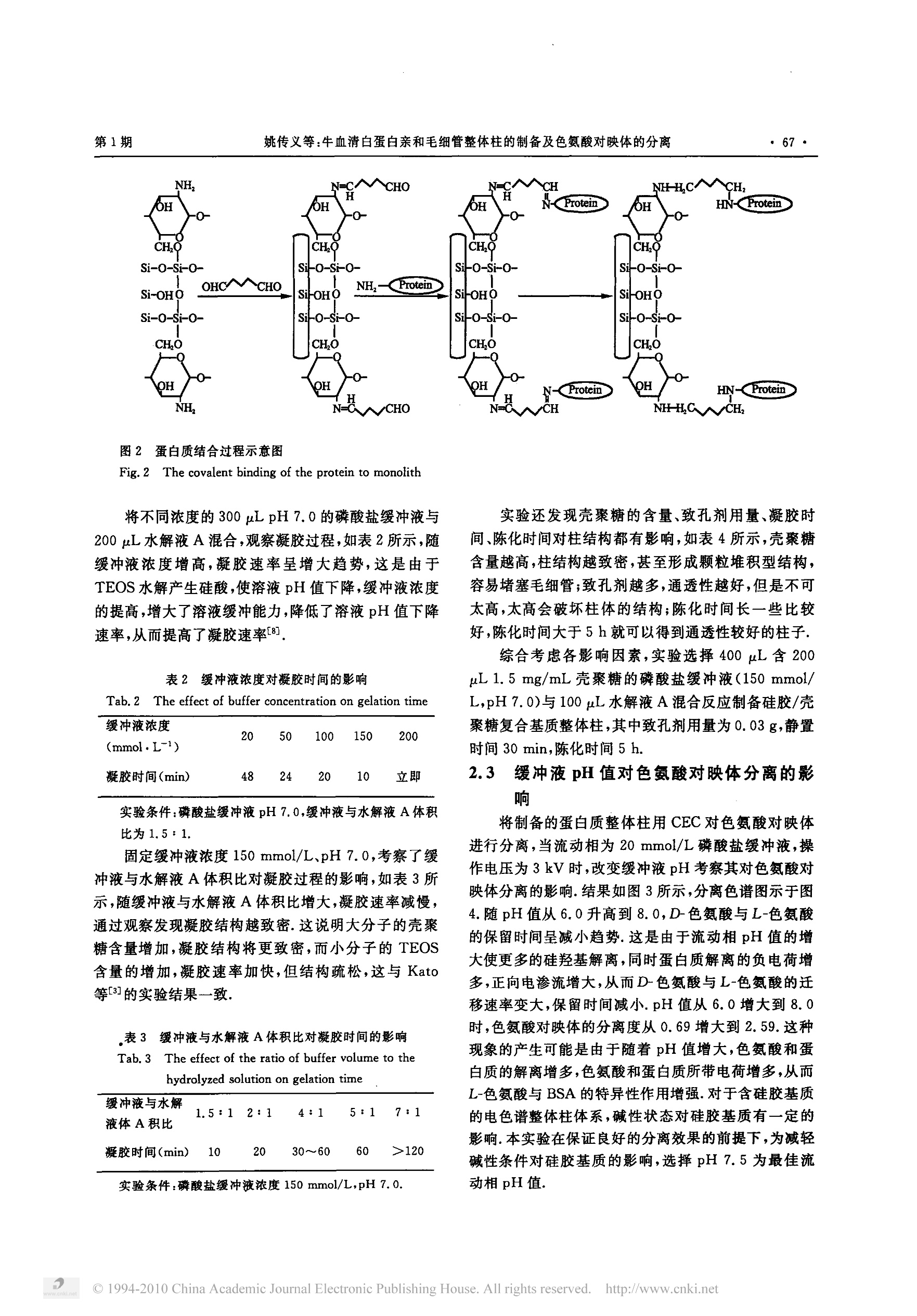
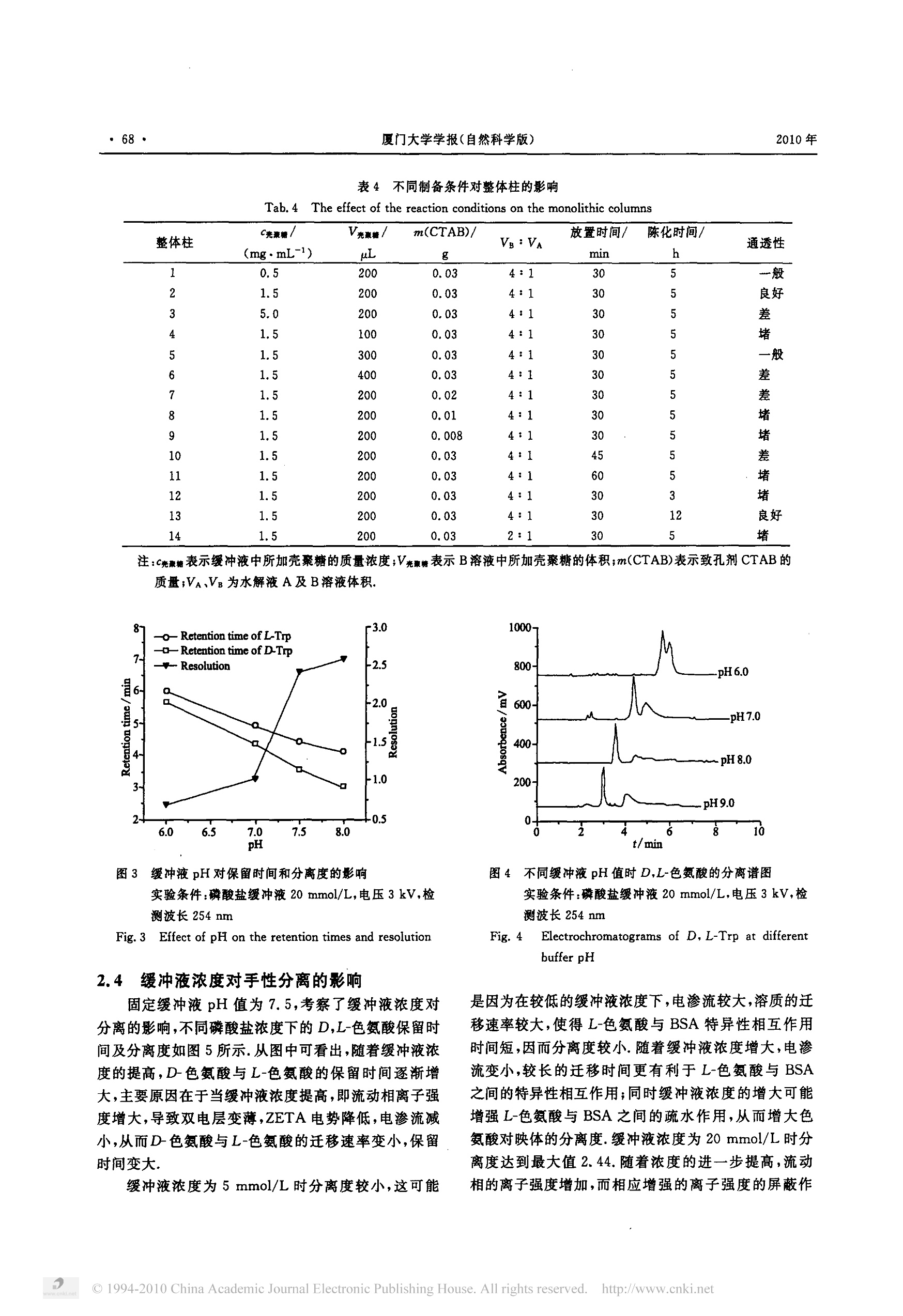
厦门大学学报(自然科学版)Journal of Xiamen University (Natural Science)第49卷 第1期2010年1月Vol.49 No.1Jan, 2010 2010年·66·厦门大学学报(自然科学版) 牛血清白蛋白亲和毛细管整体柱的制备及色氨酸对映体的分离 姚传义,贾静波,陈伟其 (厦门大学化学化工学院,福建厦门361005) 摘要:利用亲和毛细管电色谱整体柱对色氨酸对映体进行了手性拆分研究.利用溶胶-凝胶法制备了壳聚糖/硅胶复合基质毛细管整体柱,然后采用戊二醛交联柱上键合牛血清白蛋白(BSA)得到亲和毛细管整体柱,以毛细管电色电(CEC)模式分离色氨酸对映体,考察了缓冲液pH、浓度及有机修饰剂含量对分离过程的影响.在缓冲液的缓度为20 mmol/L,pH 7.5时,色氨酸对映体分离效果良好,分离度为2.44. 关键词:壳聚糖;牛血清白蛋白;亲和整体柱;色氨酸对映体 中图分类号:0657.8 文献标识码:A 文章编号:0438-0479(2010)-01-0065-06 近几年,将整体柱技术应用于亲和色谱的研究得到了较快发展1-51,产生了亲和毛细管整体柱色谱技术.亲和整体柱技术将亲和色谱中的高选择性与整体柱技术中的高效性有机结合,可以实现难分离物质如手性化化物、生物样品等的分离. Bedair 等61利用甲基丙烯酸缩水甘油酯(GMA)与乙二醇二甲基丙烯酸酯(EDMA)共聚制备了中性的毛细管整体柱,利用GMA、EDMA 与甲基丙烯酰氧乙基三甲基氯化铵共聚制备了带正电荷的毛细管整体柱,通过环氧乙基法或交联法将亲和配体 Con A 或麦胚素键合到整体柱上,发现柱子对特定的糖蛋白和低聚糖具有很强的亲和性,可用于对这些溶质的富集.作者还在两种毛细管整体柱上键合甘露聚糖,该亲和毛细管柱对多种甘露糖结合蛋白具有强的亲和性,可用于从动物血清中提取该类蛋白,一次分离所得蛋白样品量足够用于SDS-PAGE 电泳和基质辅助激光解吸-电离质谱的样品.Kato等8采用溶胶-凝胶法在毛细管中制备了硅胶整体柱,同时将亲和配体(牛血清白蛋白(BSA)或卵类粘蛋白)包埋在整体柱基质中,用于色氨酸、安安香、乙哌立松、氯苯比丙胺的手性分离.所制得的整体柱具有较好的机械强度、流通性及手性分离能力.安息香在包埋卵类粘蛋白的整体柱上第一峰保留时间重复性的RSD=1.23%,在优化的条件下,第一峰的理论塔板数 ( 收稿日期:2009-06-26 ) ( 基金项目:国家自然科学基金(20876128);福建省自然科学基金 (E0610030)项目 ) ( Email:cyao@xmu. edu. cn ) 达72000m-.严丽娟等采用溶胶-凝胶法制备了含有氨丙基官能团的硅胶整体柱,利用戊二醛交联共价键合 BSA制备了手性毛细管整体柱,以毛细管电色谱(CEC)模式分离了色氨酸对映体. 本实验以四乙氧基硅烷(TEOS)和壳聚糖为前体,采用溶胶-凝胶法制备了壳聚糖/硅胶复合毛细管整体柱基质,并采用偶联戊二醛的方法,在基质上键合BSA 得到亲和毛细管整体柱,以 CEC 模式对色氨酸对映体进行了分离研究,对缓冲液的浓度、pH等分离条件进行了优化. 1 实验部分 1.1 仪器与试剂 CL101A型毛管管电泳仪(包括高压电源和紫外检测器),北京彩陆科学仪器有限公司;CT-21 型色谱工作站,上海千谱软件有限公司;环境扫描电子显微镜(XL-30),Philips 公司;超声仪(SK1200H),上海科导超声仪器有限公司;DHG-9070A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;石英毛细管100um ID×375 um OD 购于河北永年光导纤维厂. 壳聚糖(脱乙酰度90.0%),国药集团化学试剂有限公司;TEOS和十六烷基三甲基溴化胺(CTAB),分析纯,国药集团化学试剂有限公司;BSA,北京拜尔迪生物公司;D,L-色氨酸,上海斯高勒生物科技有限公司;硼氢化钠、25%(体积分数)戊二醛和其它试剂均购自国药集团化学试剂有限公司,分析纯. 1.2 毛细管预处理 将毛细管依次用1 mol/L盐酸冲洗30 min,水冲洗10 min,l mol/L氢氧化钠冲洗2h,水冲洗10 min,甲醇冲洗10 min,气气吹干,放入真空干燥器中备用. 1.3 毛细管整体柱基质的制备 将 760 uLTEOS、169 pL 水、0.03 g CTAB 混合搅拌1h形成水解液A.将壳聚糖溶于1%(体积分数)乙酸中,超声振荡1h,得0.15%(质量分数)的壳聚糖溶液,调节pH为 7.0,将壳聚糖溶液与磷酸盐缓冲液(150 mmol/L,pH 7.0)混合为B溶液.取 100uL 水解液A、400 uLB溶液混合超声振荡5s,得混合溶胶,将此溶胶注入备用毛细管内适当位置(距离端口约20cm处),放置一定时间,放人烘箱中陈化.合成整体柱后依次用无水乙醇和水冲洗 30 min. 1.4 亲和整体柱的制备 用10 mmol/L 磷酸盐缓冲液(pH7.0)冲洗整体柱30 min 后,通巧15%(体积分数)的戊二醛,于室温下反应 2.5 h;然后通入2%(质量分数)BSA溶液(用20 mmol/L pH 6.0的磷酸盐缓冲液配制)4℃反应12h;将 50 mg/mL 的硼氢化钠(用0.1mol/L pH8.0的磷酸盐缓冲液配制)通人柱中,反应2h后,依次用纯水和磷酸盐缓冲液冲洗 30 min,保存于冰箱中备用. 1.5 电色谱实验 所有电色谱实验均在彩陆高效毛细管电泳仪上完成,使用254 nm 紫外光检测.毛细管总长 35 cm,流动相在使用前,经过 0.22 um 滤膜过滤及超声振荡除气.分离电压3kV,样品为5 mmol/L的D,L-色氨酸,电进样3 kV×4 s.分离度按 Rs=2(t2一t)/(Wi+Wz)计算O,其中:ti、t2分别为D-色氨酸,L-色氨酸的保留时间,Wi、W为D-色氨酸,L-色氨酸的峰宽 2 结果和讨论 2.1 整体柱的制备 壳聚糖/硅胶基质整体体采用一步法合成, TEOS与壳聚糖作为复合基质前体,通过溶胶-凝胶过程在毛细管中原位共聚合,形成带有氨基的壳聚糖/硅胶基质网状结构,利于进一步与交联剂键合,引入所需官能团.反应过程如图1所所"1. 蛋白质与对映体相互作用机理十分复杂,目前尚不甚清楚,不同蛋白质对不同结构对映体的选择性差别也很大.蛋白质和对映体的相互作用主要表现为疏水和静电相互作用,旦氢键或电荷转移相互作用对手性选择性也有贡献,蛋白质上可能有不同位点参与对 图1 壳聚糖/硅胶基质整体柱的合成 Fig.l The preparation of monolithic column based on chi-tosan /silica hybrid material 映体的选择性作用,其三维结构也有益于对映体选择性.BSA 是由17个双硫键起稳定作用的581个氨基酸组成的球蛋白,其等电点为4.7,在pH5~9范围内稳定,分子结构中具有多个疏水结合位点,其复杂的三维结构可在局部形成手性微环境,是一种较好的手性试剂.壳聚糖分子中含有大量羟基和氨基,亲水性好,生物相容性好,能较好的保持 BSA 的生物活性.戊二醛键合的方法温和、快速,交联剂戊二醛两端的醛基分别与基质和 BSA 上的氨基反应形成席夫碱,不是很稳定,所以用硼氢化钠还原席夫碱形成稳定的单键,反应过程如图2所示2. 2.2 反应条件对硅胶/壳聚糖复合基质凝胶的影响 缓冲液的pH值对凝胶化过程有着重要的影响,将200 uL水解液A与不同pH 值的 300 uL 150 mmol/L磷酸盐缓冲液混合,置于离心管中观察凝胶过程.如表1所示,在不同 pH值时 TEOS 和壳聚糖缩聚反应的速率不同.在pH4时凝胶化时间相对较长;pH越高凝胶速率越快.这是由于随 pH值升高,壳聚糖分子中的羟基解离度增大, TEOS的水解速率增大,从而增大了凝胶速率 表1 缓冲液pH对凝胶时间的影响 Tab.1 The effect of buffer pH on gelation time 缓冲液pH 4 5 6 7 8 凝胶时间 (min) >1440 600 180 6 立即 .实验条件:150 mmol/L 磷酸盐,缓冲液与水解液A体积比.为1.5:1. Fig.2 The covalent binding of the protein to monolith 将不同浓度的 300 uL pH 7.0的磷酸盐缓冲液与200pL水解液A混合,观察凝胶过程,如表2所示,随缓冲液浓度增高,凝胶速率呈增大趋势,这是由于TEOS 水解产生硅酸,使溶液pH值下降,缓冲液浓度的提高,增大了溶液缓冲能力,降低了溶液pH值下降速率,从而提高了凝胶速率8. 表2缓冲液浓度对凝胶时间的影响 Tab.2 The effect of buffer concentration on gelation time 缓冲液浓度 (mmol.L-) 20 50 100 150 200 凝胶时间(min) 48 24 20 10 立即 实验条件:磷酸盐缓冲液 pH 7.0,缓冲液与水解液A体积比为1.5:1. 固定缓冲液浓度150 mmol/L、pH 7.0,考察了缓冲液与水解液A体积比对凝胶过程的影响,如表3所示,随缓冲液与水解液A体积比增大,凝胶速率减慢,通过观察发现凝胶结构越致密.这说明大分子的壳聚糖含量增加,凝胶结构将更致密,而小分子的 TEOS含量的增加,凝胶速率加快,但结构疏松,这与 Kato等31的实验结果一致. .表3 缓冲液与水解液A体积比对凝胶时间的影响 Tab.3 The effect of the ratio of buffer volume to thehydrolyzed solution on gelation time 缓冲液与水解 液体A积比 1. 5 : 1 2:1 4:1 5:1 7:1 凝胶时间(min) 10 20 30~60 60 >120 实验条件:磷酸盐缓冲液浓度150 mmol/L,pH 7.0. 实验还发现壳聚糖的含量、致孔剂用量凝胶时间、陈化时间对柱结构都有影响,如表4所示,壳聚糖含量越高,柱结构越致密,甚至形成颗粒堆积型结构,容易堵塞毛细管;致孔剂越多,通透性越好,但是不可太高,太高会破坏柱体的结构;陈化时间长一些比较好,陈化时间大于5h就可以得到通透性较好的柱子. 综合考虑各影响因素,实验选择400 uL含 200uL 1.5 mg/mL 壳聚糖的磷酸盐缓冲液(150 mmol/L,pH 7.0)与100 uL水解液A混合反应制备硅胶/壳聚糖复合基质整体柱,其中致孔剂用量为 0.03 g,静置时间 30 min,陈化时间5h. 2.3 缓冲液pH 值对色氨酸对映体分离的影响 将制备的蛋白质整体柱用 CEC 对色氨酸对映体进行分离,当流动相为20 mmol/L 磷酸盐缓冲液,操作电压为3kV时,改变缓冲液 pH考察其对色氨酸对映体分离的影响.结果如图3所示,分离色谱图示于图4.随pH值从6.0升高到8.0,D-色氨酸与L-色氨酸的保留时间呈减小趋势.这是由于流动相pH值的增大使更多的硅羟基解离,同时蛋白质解离的负电荷增多,正向电渗流增大,从而D-色氨酸与L-色氨酸的迁移速率变大,保留时间减小.pH值从6.0增大到8.0时,色氨酸对映体的分离度从0.69增大到2.59.这种现象的产生可能是由于随着 pH 值增大,色氨酸和蛋白质的解离增多,色氨酸和蛋白质所带电荷增多,从而L-色氨酸与 BSA 的特生性作用增强.对于含硅胶基质的电色谱整体柱体系,碱性状态对硅胶基质有一定的影响.本实验在保证良好的分离效果的前提下,为减轻碱性条件对硅胶基质的影响,选择 pH 7.5为最佳流动相pH值. 表4不同制备条件对整体柱的影响 Tab.4:The effect of the reaction conditions on the monolithic columns 整体柱 c亮聚糖/ V壳糖/ m(CTAB)/ Vg:VA 放置时间/ 陈化时间/ 通透性 (mg·mL) uL g min h 0.5 200 0.03 4:1 30 5 一般 2 1.5 200 0.03 4:1 30 良好 3 5.0 200 0.03 4:1 30 4 100 0,03 4:1 30 5 5 300 0.03 4:1 30 5 一般 6 1.5 400 0.03 4:1 30 5 7 1.5 200 0.02 4:1 5 8 1.5 200 0.01 4:1 5 9 1.5 200 0. 008 4:1 30 5 10 1.5 200 0.03 4:1 45 5 11 1.5 200 0.03 4:1 60 5 .: 12 200 0.03 4:1 30 3 13 200 0.03 4:1 30 12 良好 14 1.5 200 0.03 2:1 30 5 堵 注:C壳聚糖表示缓冲液中所加壳聚糖的质量浓度;V亮聚糖表示B溶液中所加壳聚糖的体积;m(CTAB)表示致孔剂 CTAB的质量;VA、VB为水解液A及B溶液体积. 图3 缓冲液pH对保留时间和分离度的影响 实验条件:磷酸盐缓冲液 20 mmol/L,电压3kV,检测波长 254 nm Fig.3 Effect of pH on the retention times and resolution 2,4 缓冲液浓度对手性分离的影响 固定缓冲液 pH值为7.5,考察了缓冲液浓度对分离的影响,不同磷酸盐浓度下的 D,L-色氨酸保留时间及分离度如图5所示.从图中可看出,随着缓冲液浓度的提高,D-色氨酸与L-色氨酸的保留时间逐渐增大,主要原因在于当缓冲液浓度提高,即流动相离子强度增大,导致双电层变薄,ZETA 电势降低,电渗流减小,从而D-色氨酸与L-色氨酸的迁移速率变小,保留时间变大. 缓冲液浓度为5 mmol/L时分离度较小,这可能 图4 不同缓冲液 pH 值时 D,L-色氨酸的分离谱图 实验条件:磷酸盐缓冲液20 mmol/L,电压3kV,检测波长 254 nm Fig. 4 Electrochromatograms of D, L-Trp at differentbuffer pH 是因为在较低的缓冲液浓度下,电渗流较大,溶质的迁移速率较大,使得L-色氨酸与 BSA 特异性相互作用时间短,因而分离度较小.随着缓冲液浓度增大,电渗流变小,较长的迁移时间更有利于L-色氨酸与 BSA之间的特异性相互作用;同时缓冲液农度的增大可能增强L-色氨酸与 BSA 之间的疏水作用,从而增大色氨酸对映体体分离度.缓冲液浓度为20 mmol/L时分离度达到最大值2.44.随着浓度的进一步提高,流动相的离子强度增加,而相应增强的离子强度的屏蔽作 图5 缓冲液浓度对保留时间和分离度的影响 实验条件:pH7.5,电压3kV,检测波长254 nm Fig.5 Effect of buffer concentration on the retention timesand resolution 用可能会削弱L-色氨酸酸 BSA 之间的静电作用,使分离度呈下降的趋势. 2.5 有机修饰剂对分离的影响 在20 mmol/L 磷酸盐缓冲液(pH7.5)为流动相,操作电压3kV的情况下,往流动相中加入一定体积正丙醇,考察有机修饰剂对分离的影响.有机修饰剂的加人会改变表面净电荷或双电层局部粘度,导致电渗流减小[13].实验中发现,正丙醇的加入,使色氨酸的保留时间略有减小,但色氨酸对映体并不能得到手性分离,这种情况与文献[14]中应用 BSA 包埋整体柱分离色氨酸对映体,正丙醇的加人减小了保留时间,色氨酸对映体得不到分离相类似.这可能是因为正丙醇作为有机溶剂破坏了蛋白质的生物活性,从而使蛋白质对色氨酸的手性选择作用减弱或消失.在相同条件下,还分别尝试在流动相中加入一定体积的甲醇和乙腈,均未能得到更好的分离效果. 3 结 论 以 TEOS 和壳聚糖为前体,采用溶胶-凝胶法制备了壳聚糖/硅胶复合毛细管整体柱基质,并采用偶联戊二醛的方法,在基质上键合 BSA得到亲和毛细管整体柱.在毛细管电色谱实验中,随磷酸盐缓冲液 pH值的上升,电渗流增大,溶质保留时间减小,分离度增大;随磷酸盐缓冲液浓度的增加,分离度先增大后减小;有机修饰剂的加人可减小溶质的保留时间,但对分离不利.在优化条件下,即磷酸盐缓冲液缓度 20 mmol/L、pH7.5,色氨酸对映体在 5 min 内得到良好的分离,分离度为2.44. ( 参考文献: ) ( [1]Te t ala K K R,Chen B, Visser G M,at al. Preparation of amonolithic capillary column with immobilized a lpha-man- nose for affinity chromatography of lectins[J].Journal of Biochemical and Biophysical Methods,2007,70:63-69. ) ( 2] Tetala K K R,Chen B, Visser G M,et al. Single step syn-thesis of carbohydrate monolithic capillary columns for af- finity chromatography of lectins[J]. Journal of S e paration Science,2007,30:2828-2835. ) ( [3] G G iovannoli C, Baggiani C, Anfossi L,et al. Aptamers an d molecularly imprinted p olymers a s artificial biomimetic receptors in affinity capillary electrophoresis an d ele c tro chromatography[J]. Electrophoresis,2008,29:3349-3365. ) ( 40 Zhao Q ,Li X F, Le X C. Ap t amer-modified mo n olithic capillary chromatography f o r p r otein separation and de- tection[J]. Analytical Chemistry,2008,80:3915-3920. ) ( [5] Ren L B,Liu Z,Dong MM,e t al. Synthesis and character- ization of a new boronate affinity monolithic capillary forspecific capture of c is-diol-containing compounds [J]. Journal of Chromatography A,2009,1216:4768-4774. ) ( [6] B B edair M,El Rassi Z. Affinity chromatography with mon- olithic capillary columns I. Polymethacrylate monolithswith immobilized mannan for t he separation of mannose- binding proteins by c apillary electrochromatography and nano-scale liquid chromatography[J].Journal of Chroma- tography A,2004,1044:177-186. ) ( [7 ] BBedair M,El R assi Z. Affinity chromatography with mon- olithic capillar y columns II . Polymethacrylate monolithswith immobilized lectins for the separation of glycocon- jugates by nano-liquid a ffinity chromatography[J]. Jour- nal of Chromatography A,2005,1079:236-245. ) ( [8] Kato M,Sakai Kato K,Matsumoto N,et al. A protein-en- capsulation technique by the sol-gel method for the prepa-ration of monolithic c olumns for capillary e l ectrochroma- tography[J]. Analytical Chemistry,2002,74:1915-1921. ) ( 9] 严丽娟,张庆合,张维冰,等.牛血清白蛋白手性毛细管整体柱的制备及对映体的分离[J].高等学校化学学报, 2005,26:835-837. ) ( [10] 孙彦.生物分离工程[M].北京:化学工业出版社,1998. ) ( [111 Kang X , Wang J, Tang Z,e t al. Di r ect electrochemistry and e lectrocatalysis of horseradish peroxidase immobi-lized in hybrid o rganic-inorganic f i lm o f c h itosan/sol-gel/carbon n anotubes[J]. Talanta,2009,78:120-125. ) ( 12] K itagawa F, Inoue K, Hasegawa T,et al . Chiral separa- tion of acidic drug components by open tubular e lectro- chromatography using avidin immobilized capillaries[J]. J ournal of Chromatography A,2006,1130:219-226. ) ( [13] Tran A D, Park S, L isi P J . Separation of ca r bohydrate- ) ( mediated microheterogeneity of recombinant human erythropoietin by free so l ution capillary electrophoresis:effects of pH,buffer type and organic additives[J]. Jour- nal of Chromatography A,1991,542:459-471. ) ( of chromatographic performances and binding character- istics o f BSA-encapsulated capillary column prepared by the sol-gel method[J]. Journal of Pharmaceutical and Bi- omedical Analysis,2003,30:1845-1850. ) Preparation of Bovine Serum Albumin Affinity Monolithfor Chiral Separation of D,L-tryptophan by CapillaryElectrochromatography YAO Chuan-yi,JIA Jing-bo,CHEN Wei-qi (College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China) Abstract: Enantioseparation of D,L-tryptophan was studied on an affinity monolithic column by capillary electrochromatography.A chitosan/silica hybrid monolithic column was prepared by the sol-gel method. Then the affinity stationary phase was synthesized bythe in situ covalent immobilization of BSA on the monolithic column activated with glutaraldehyde. The monolith was used for chiralseparation of D,L-tryptophan by capillary electrochromatography. The effects of pH,concentration of running buffer,and the contentof organic modifier on the separation of D,L-tryptophan were investigated. The retention times of the solutes decrease and the resolu-tion increases with the increase of buffer pH from 6. 0 to 8.0. With the increase of buffer concentration from 5 to 50 mmol/L,the re-tention times of the solutes increase,while the resolution increases to a higher value and then decreases. The organic modifier is notconducive to the chiral separation in this experimental system. A best separation of tryptophan enantiomers is achieved by using pH7.5,20 mmol/L phosphate buffer,with the resolution of 2. 44. Key words:chitosan;BSA;affinity monolithic column;tryptophan enantiomers ◎China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
确定




还剩4页未读,是否继续阅读?
北京华阳利民仪器有限公司为您提供《牛血清白蛋白中色氨酸对应体的分离检测方案(毛细管电泳仪)》,该方案主要用于全血/血清/血浆中色氨酸对应体的分离检测,参考标准--,《牛血清白蛋白中色氨酸对应体的分离检测方案(毛细管电泳仪)》用到的仪器有高效毛细管电泳仪(紫外检测)CL1030
推荐专场
相关方案
更多
该厂商其他方案
更多