摘 要: 研究了在聚乙二醇2000(PEG)-硫酸钠(Na2SO4)-邻苯二酚紫(PV)体系中铍(Ⅱ)、铁(Ⅲ)、铁(Ⅱ)、铬(Ⅲ)、锰(Ⅱ)、铝(Ⅲ)的萃取行为。试验结果表明,铍(Ⅱ)在pH3.5-7. 0及铁(Ⅲ)在pH4.0-7. 0范围内可以被PEG相几乎完全萃取,而铝(Ⅲ)、铬(Ⅲ)在pH1.0-7.0、锰(Ⅱ)在pH1.0-4.5、铁(Ⅱ)在pH1.0-4.5则不被萃取。从而实现了将铍(Ⅱ)(pH3.5)、铁(Ⅲ)(pH5.0)与铝(Ⅲ)、铬(Ⅲ)、锰(Ⅱ)、铁(Ⅱ)混合离子的定量分离。同时探讨了PEG相的萃取机理。
关键词:双向萃取体系 聚乙二醇2000 硫酸钠 邻苯二酚紫 金属离子
方案详情

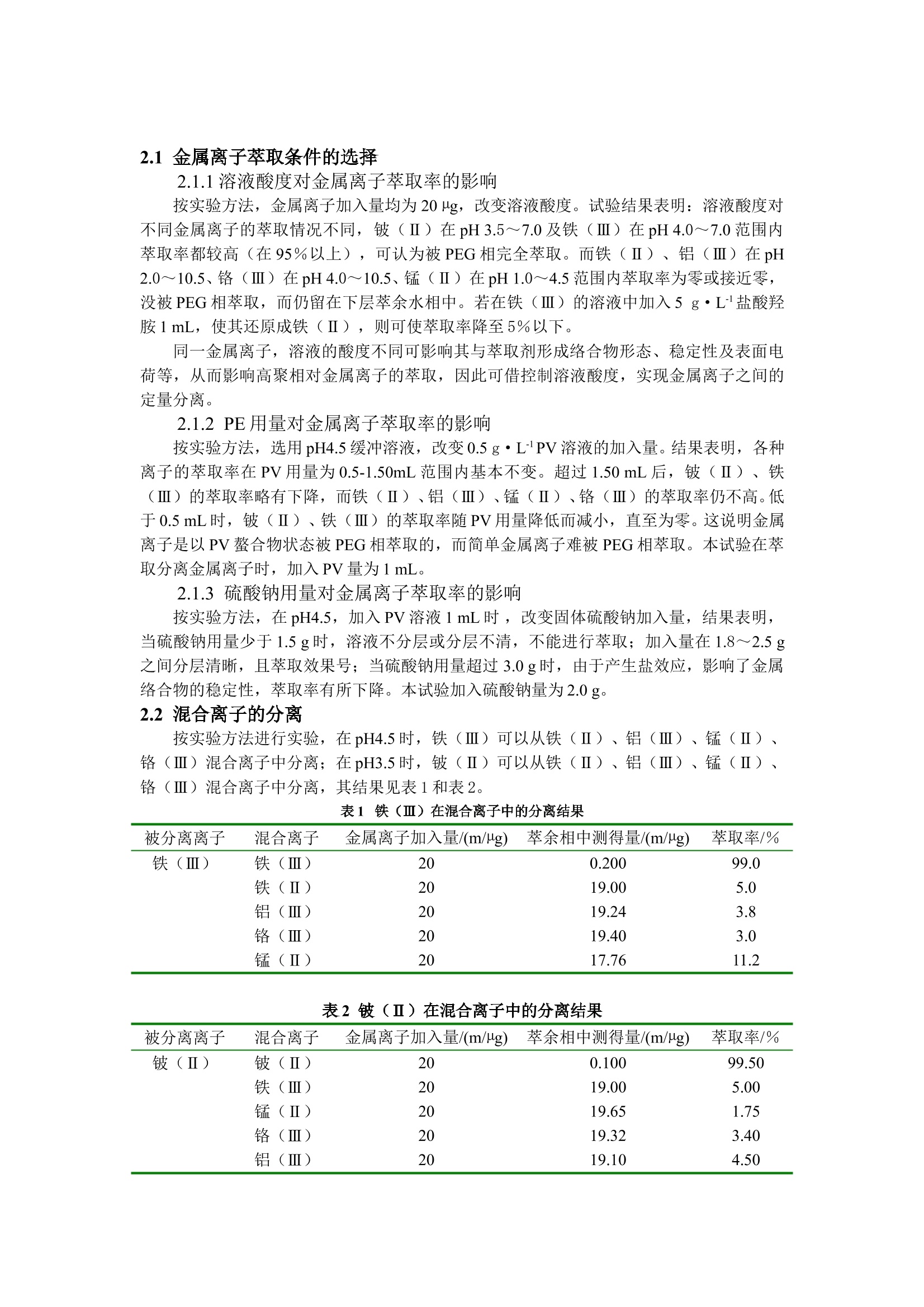
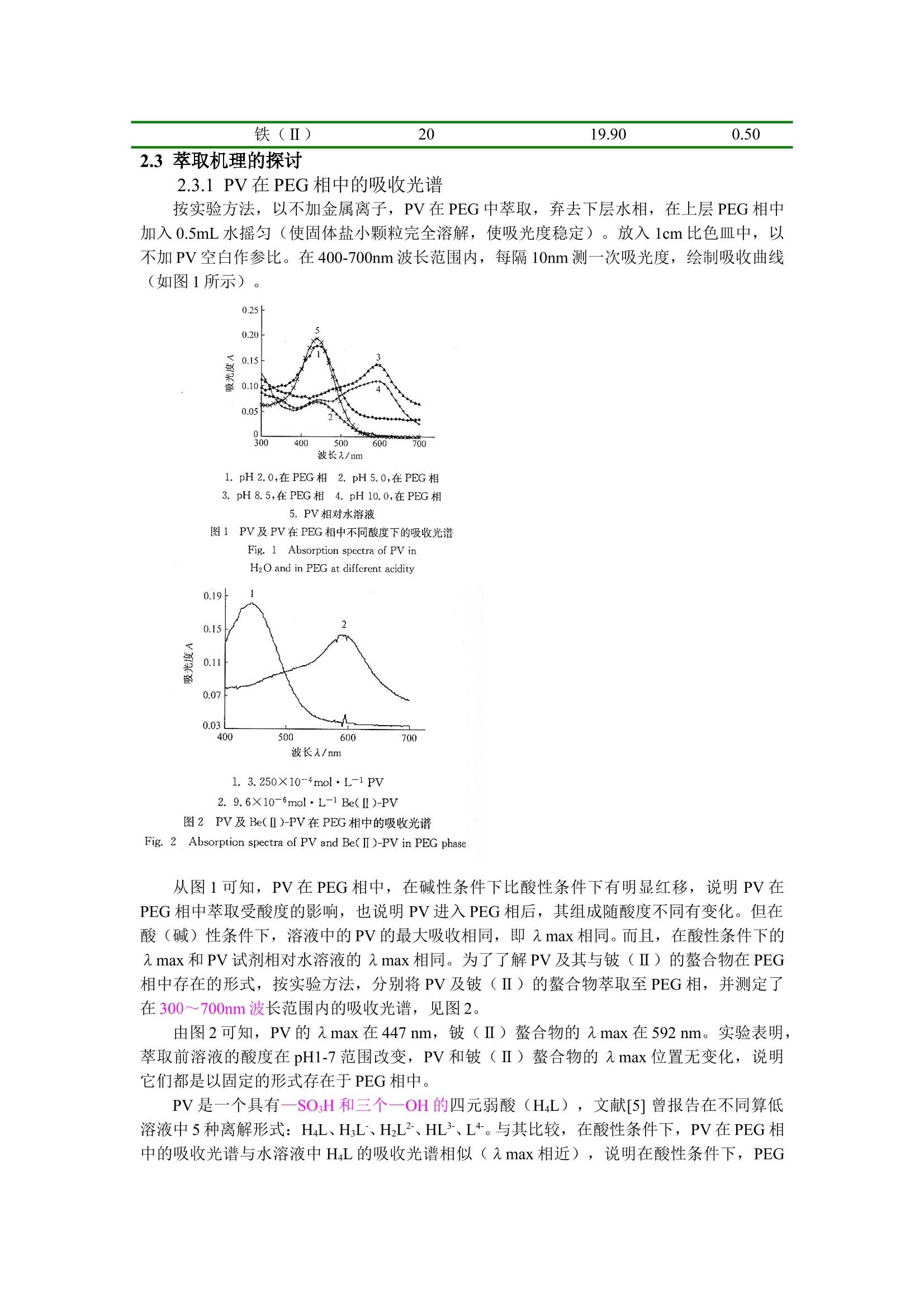
双水相萃取法分离铍(Ⅱ)、铁(Ⅲ)与铁(Ⅱ)、铬(Ⅲ)、锰(Ⅱ)、铝(Ⅲ) 卓馨1 张莉1 石影2 (1 安徽省宿州学院化学系234000; 2 淮北煤炭师范学院化学系 235000) 摘 要: 研究了在聚乙二醇2000(PEG)-硫酸钠(Na2SO4)-邻苯二酚紫(PV)体系中铍(Ⅱ)、铁(Ⅲ)、铁(Ⅱ)、铬(Ⅲ)、锰(Ⅱ)、铝(Ⅲ)的萃取行为。试验结果表明,铍(Ⅱ)在pH 3.5~7. 0及铁(Ⅲ)在pH 4.0~7. 0范围内可以被PEG相几乎完全萃取,而铝(Ⅲ)、铬(Ⅲ)在pH 1.0~7.0、锰(Ⅱ)在pH 1.0~4.5、铁(Ⅱ)在pH 1.0~4.5则不被萃取。从而实现了将铍(Ⅱ)(pH 3.5)、铁(Ⅲ)(pH5.0)与铝(Ⅲ)、铬(Ⅲ)、锰(Ⅱ)、铁(Ⅱ)混合离子的定量分离。同时探讨了PEG相的萃取机理。 关键词:双向萃取体系;聚乙二醇2000; 硫酸钠; 邻苯二酚紫; 金属离子 铍是一种比较稀有的元素,主要存在于绿柱石矿(硅铝酸铍)中。铍及其化合物均剧毒,进入人体后几乎全部被吸收,浓度高时会致死,同时也是重要的致癌物之一。通常采用电感耦合等离子光谱法测定铍,还可用桑色素荧光分光光度法或铝试剂紫外分光光度法测定,但灵敏度不高[1]。利用高聚物水溶液在无机盐存在下可以分成两相的非有机溶剂萃取分离方法已引起人们的重视[2]。这种方法与传统的有机溶剂萃取分离法相比,具有不挥发、无毒和操作简单等特点,为萃取分离法开辟了新途径。目前运用聚乙二醇2000(PEG)-硫酸钠(Na2SO4)-邻苯二酚紫(PV)体系的非有机溶剂萃取分离铍,还未见报道[3]。本文研究了铍(Ⅱ)、铁(Ⅲ)、铁(Ⅱ)、铬(Ⅲ)、锰(Ⅱ)、铝(Ⅲ)等金属离子在PEG- Na2SO4-PV体系中两相间的分配行为。通过控制一定的条件,实现了铍(Ⅱ)(pH3.5)、铁(Ⅲ)(pH5.0)与部分混合金属离子的萃取分离。并通过测定PV及铍(Ⅱ)-PV螯合物在PEG相中的吸收光谱和络合比,以及阴、阳、非离子表面活性剂对萃取率的影响,探讨了萃取机理。 1 实验部分 1.1 仪器与试剂 TU-1201双光束扫描分光光度计(北京普析通用仪器有限责任公司);722分光光度计;pHS-3精密酸度计;116R型恒温水浴锅。 PV溶液:3.250×10-4 mol·L-1;铍(Ⅱ)标准溶液:按文献[4]配成20 mg·L-1;PEG溶液:300 g·L-1。 缓冲溶液:pH1.0-2.5(用HCl配制),pH3.0-6.5(用HOAc-NaOAc配制),pH7.5-13.0(用氨水-NH4Cl配制)。 试剂为分析纯或优级纯,水为二次蒸馏水。 1.2 试验方法 在60 mL分液漏斗中,加入缓冲溶液5.0 mL,PV溶液1 mL,一定量的金属离子溶液,加水至10 mL;加入PEG溶液10 mL,硫酸钠2g,振荡2~3 min,静置。待分层清楚后,螯合物进入上层PEG相,将下层萃余液水相放入25 mL比色管中,用水稀释至刻度,摇匀,用PAR作显色剂的光度法测定残留金属离子量[5],根据加入量计算出金属离子的萃取率E(%)。 2 结果与讨论 2.1 金属离子萃取条件的选择 2.1.1溶液酸度对金属离子萃取率的影响 按实验方法,金属离子加入量均为20 µg,改变溶液酸度。试验结果表明:溶液酸度对不同金属离子的萃取情况不同,铍(Ⅱ)在pH 3.5~7.0及铁(Ⅲ)在pH 4.0~7.0范围内萃取率都较高(在95%以上),可认为被PEG相完全萃取。而铁(Ⅱ)、铝(Ⅲ)在pH 2.0~10.5、铬(Ⅲ)在pH 4.0~10.5、锰(Ⅱ)在pH 1.0~4.5范围内萃取率为零或接近零,没被PEG相萃取,而仍留在下层萃余水相中。若在铁(Ⅲ)的溶液中加入5 g·L-1盐酸羟胺1 mL,使其还原成铁(Ⅱ),则可使萃取率降至5%以下。 同一金属离子,溶液的酸度不同可影响其与萃取剂形成络合物形态、稳定性及表面电荷等,从而影响高聚相对金属离子的萃取,因此可借控制溶液酸度,实现金属离子之间的定量分离。 2.1.2 PE用量对金属离子萃取率的影响 按实验方法,选用pH4.5缓冲溶液,改变0.5 g·L-1 PV溶液的加入量。结果表明,各种离子的萃取率在PV用量为0.5-1.50mL范围内基本不变。超过1.50 mL后,铍(Ⅱ)、铁(Ⅲ)的萃取率略有下降,而铁(Ⅱ)、铝(Ⅲ)、锰(Ⅱ)、铬(Ⅲ)的萃取率仍不高。低于0.5 mL时,铍(Ⅱ)、铁(Ⅲ)的萃取率随PV用量降低而减小,直至为零。这说明金属离子是以PV螯合物状态被PEG相萃取的,而简单金属离子难被PEG相萃取。本试验在萃取分离金属离子时,加入PV量为1 mL。 2.1.3 硫酸钠用量对金属离子萃取率的影响 按实验方法,在pH4.5,加入PV溶液1 mL时 ,改变固体硫酸钠加入量,结果表明,当硫酸钠用量少于1.5 g时,溶液不分层或分层不清,不能进行萃取;加入量在1.8~2.5 g之间分层清晰,且萃取效果号;当硫酸钠用量超过3.0 g时,由于产生盐效应,影响了金属络合物的稳定性,萃取率有所下降。本试验加入硫酸钠量为2.0 g。 2.2 混合离子的分离 按实验方法进行实验,在pH4.5时,铁(Ⅲ)可以从铁(Ⅱ)、铝(Ⅲ)、锰(Ⅱ)、铬(Ⅲ)混合离子中分离;在pH3.5时,铍(Ⅱ)可以从铁(Ⅱ)、铝(Ⅲ)、锰(Ⅱ)、铬(Ⅲ)混合离子中分离,其结果见表1和表2。 表1 铁(Ⅲ)在混合离子中的分离结果 被分离离子 混合离子 金属离子加入量/(m/µg) 萃余相中测得量/(m/µg) 萃取率/% 铁(Ⅲ) 铁(Ⅲ)铁(Ⅱ)铝(Ⅲ)铬(Ⅲ)锰(Ⅱ) 20 20 20 20 20 0.200 19.00 19.24 19.40 17.76 99.0 5.0 3.8 3.0 11.2 表2 铍(Ⅱ)在混合离子中的分离结果 被分离离子 混合离子 金属离子加入量/(m/µg) 萃余相中测得量/(m/µg) 萃取率/% 铍(Ⅱ) 铍(Ⅱ)铁(Ⅲ)锰(Ⅱ)铬(Ⅲ)铝(Ⅲ)铁(Ⅱ) 20 20 20 20 20 20 0.100 19.00 19.65 19.32 19.10 19.90 99.50 5.00 1.75 3.40 4.50 0.50 2.3 萃取机理的探讨 2.3.1 PV在PEG相中的吸收光谱 按实验方法,以不加金属离子,PV在PEG中萃取,弃去下层水相,在上层PEG相中加入0.5mL水摇匀(使固体盐小颗粒完全溶解,使吸光度稳定)。放入1cm比色皿中,以不加PV空白作参比。在400-700nm波长范围内,每隔10nm测一次吸光度,绘制吸收曲线(如图1所示)。 从图1可知,PV在PEG相中,在碱性条件下比酸性条件下有明显红移,说明PV在PEG相中萃取受酸度的影响,也说明PV进入PEG相后,其组成随酸度不同有变化。但在酸(碱)性条件下,溶液中的PV的最大吸收相同,即λmax相同。而且,在酸性条件下的λmax和PV试剂相对水溶液的λmax相同。为了了解PV及其与铍(Ⅱ)的螯合物在PEG相中存在的形式,按实验方法,分别将PV及铍(Ⅱ)的螯合物萃取至PEG相,并测定了在300~700nm波长范围内的吸收光谱,见图2。 由图2可知,PV的λmax在447 nm,铍(Ⅱ)螯合物的λmax在592 nm。实验表明,萃取前溶液的酸度在pH1-7范围改变,PV和铍(Ⅱ)螯合物的λmax位置无变化,说明它们都是以固定的形式存在于PEG相中。 PV是一个具有—SO3H和三个—OH的四元弱酸(H4L),文献[5] 曾报告在不同算低溶液中5种离解形式:H4L、H3L-、H2L2-、HL3-、L4-。与其比较,在酸性条件下,PV在PEG相中的吸收光谱与水溶液中H4L的吸收光谱相似(λmax相近),说明在酸性条件下,PEG相中PV是以不带电荷的H4L形式存在的;在碱性条件下,PV在PEG相中的吸收光谱与水溶液中L4-的吸收光谱相似(λmax相近),说明在碱性条件下,PEG相中PV是以带电荷的L4-形式存在的。 本文用摩尔比法和连续变化法测得PEG相中铍(Ⅱ)与PV螯合物的络合比为1∶2。因此,可知螯合物是以Be(PV)2组成形式存在于PEG相中。 2.3.2 不同表面活性剂对金属离子萃取率的影响 按实验方法,在溶液中分别加入阳离子表面活性剂(CPC)、阴离子表面活性剂(SLS)、非离子表面活性剂(TritonX-100),进行PV和Be(PV)2的萃取。结果表明,表面活性剂都不影响PV和Be(PV)2的萃取率。这用“只有带电荷的物质才能被PEG相萃取[2]”的经典萃取机理难以解释。 实验表明,PEG相对试剂及螯合物的萃取,可用“水分子中介氢键萃取机理”来解释[4],即水分子的两个氢键分别与PV分子中的氧和PEG中的氧形成氢键,而使PEG与PV(或Be(PV)2)连接在一起,具有一定的亲和作用,再有PEG的亚甲基和PV的苯环的疏水作用,从而使PV或Be(PV)2进入PEG相中。 参考文献 [1] 邵剑锋.原子吸收石墨炉法测定饮用水中的铍[J].中国给水排水,2002,18(5):87~88. [2] 邓凡政,石颖,汪玉波等.双水相体系中钛、锆的分离[J].稀有金属,2001,25(6):471 [3] 石影.有机化学试剂[M].北京:中国矿业大学出版社,2000:96~98. [4] 蔡红,张春莉,许秀丽等.光度法研究聚乙二醇-硫酸铵-邻苯三酚红体系中的铋、铁、铜、镍、钴、铅的萃取分离[J].光谱学与光谱分析,2003,23(2):345~347. [5] 杭州大学化学系分析化学教研室编.分析化学手册:第三分册[M].北京:化学工业出版社,1989:439~441.
确定


还剩2页未读,是否继续阅读?
北京普析通用仪器有限责任公司为您提供《Be2+、Fe3+、Fe2+、Cr3+等水相溶液中离子浓度检测方案(紫外分光光度)》,该方案主要用于其他中离子浓度检测,参考标准--,《Be2+、Fe3+、Fe2+、Cr3+等水相溶液中离子浓度检测方案(紫外分光光度)》用到的仪器有1810系列紫外可见分光光度计
推荐专场
相关方案
更多
该厂商其他方案
更多