
方案详情
文
建立天然包装材料箬叶及粽米中荭草苷、异荭草苷、牡荆苷、异牡荆苷、对香豆酸5种黄酮类化合物的高效液相色谱的分析方法。通过测定一次蒸煮、二次蒸煮、不同保存条件等因素对箬叶及粽米中黄酮类化合物含量变化的影响,阐明了不同条件下箬叶中黄酮类化合物在粽子中的迁移规律。结果表明:一次蒸煮后,荭草苷、异荭草苷、牡荆苷、异牡荆苷、对香豆酸5种黄酮化合物从箬叶迁移到粽米的迁移率为7.41%~45.18%;二次蒸煮时,在120 min内箬叶中5种黄酮类化合物的迁移率为18.07%~65.94%,特别是在前30 min中,箬叶中黄酮类化合物降低明显,分别占120 min总减少量的51.61%~72.48%,并且二次蒸煮的迁移率大于一次蒸煮。在30 d的保存时间内,箬叶中黄酮类化合物在前15 d减少明显,占总减少量的68.60%~85.50%(除异牡荆苷为0外);第15天后迁出缓慢;30 d内总迁移率分别为25.90%~64.84%(除异牡荆苷为0外)。随着二次蒸煮时间与保存时间的变化,荭草苷与异荭草苷较迁移缓慢。新鲜保存的方式最有利于异牡荆苷在粽子中迁移,速冻保存最有利于荭草苷、异荭草苷、牡荆苷、对香豆酸的迁移。异牡荆苷在真空保存和速冻保存时短时间内不发生迁移。
方案详情

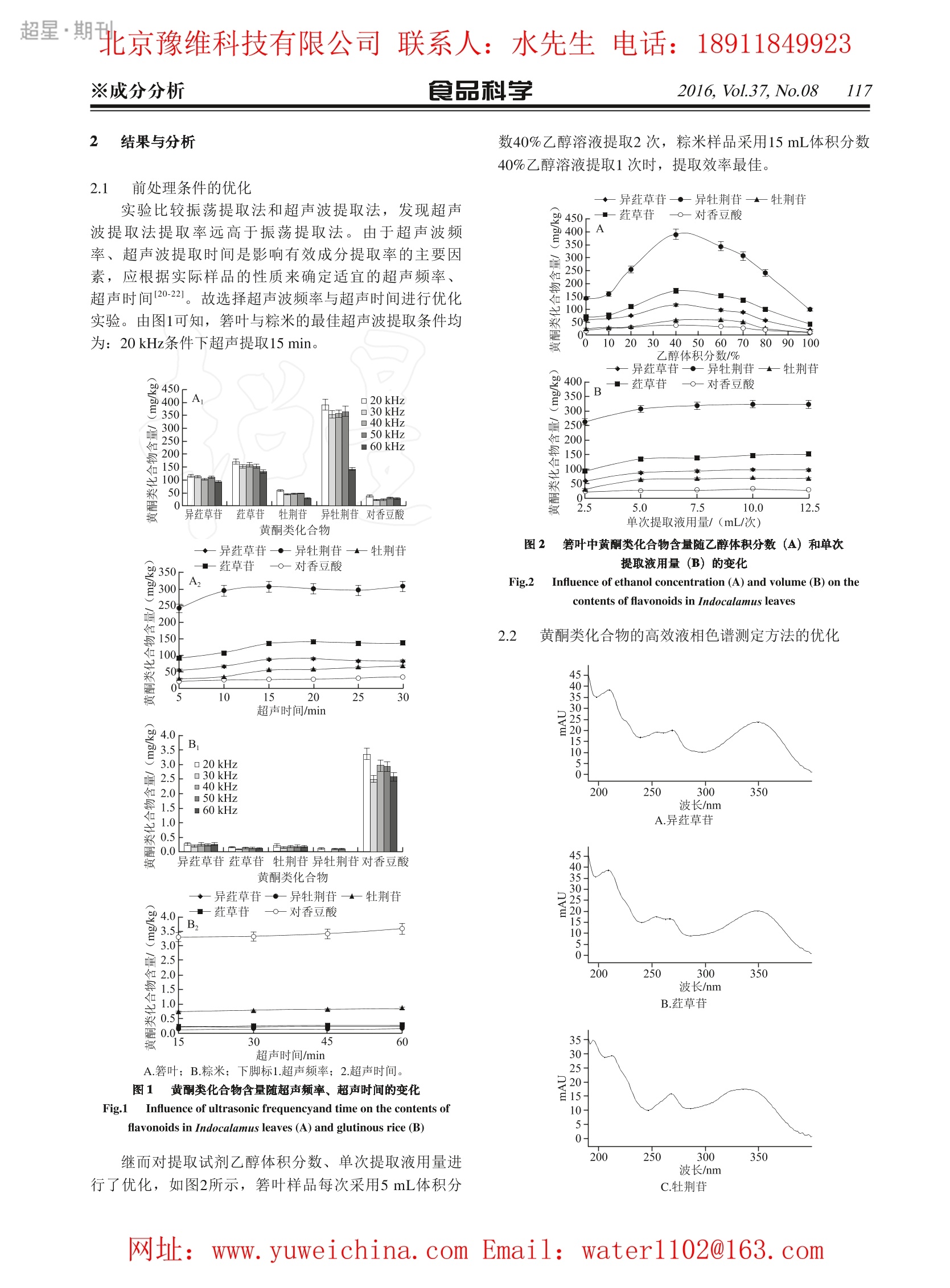
超星期北京豫维科技有限公司联系人:水先生电话:18911849923※成分分析 食品科学2016, Vol.37, No.08115 超星期北京豫维科技有限公司联系人:水先生电话:18911849923食品科学 2016, Vol.37, No.08※成分分析117 高效液相色谱法测定粽子中的黄酮类化合物及其迁移规律 吴 雨12,李红艳,张水锋,牛灿杰',洪 凰3,陈召桂,陈小珍1.2.* (1.浙江省质量检测科学研究院,浙江杭州 310012;2.浙江工业大学化学工程学院,浙江杭州 310014:3.浙江五芳斋实业股份有限公司,浙江嘉兴 314003) 摘 要:建立天然包装材料箬叶及粽米中草苷、异草苷、牡荆苷、异牡荆苷、对香豆酸5种黄酮类化合物的高效液相色谱的分析方法。通过测定一次蒸煮、二次蒸煮、不同保存条件等因素对箬叶及粽米中黄酮类化合物含量变化的影响,阐明了不同条件下箬叶中黄酮类化合物在粽子中的迁移规律。结果表明 -次蒸煮后, 草苷、异草苷、牡荆苷、异牡荆苷、对香豆酸5种黄酮化合物从箬叶迁移到粽米的迁移率为7.41%~45.18%;二次蒸煮时,在120 min内箬叶中5种黄酮类化合物的迁移率为18.07%~65.94%,特别是在前30 min中,箬叶中黄酮类化合物降低明显,分别占120 min总减少量的51.61%~72.48%,并且二次蒸煮的迁移率大于一次蒸煮。在30d的保存时间内,箬叶中黄酮类化合物在前15d减少明显,占总减少量的68.60%~85.50%(除异牡荆苷为0外);第15天后迁出缓慢;30d内总迁移率分别为25.90%~64.84%(除异牡荆苷为0外)。随着二次蒸煮时间与保存时间的变化,草苷与异荭草苷较迁移缓慢。新鲜保存的方式最有利于异牡荆苷在粽子中迁移,速冻保存最有利于草苷、异荭草苷、牡荆:苷、对香豆酸的迁移。异牡荆苷在真空保存和速冻保存时短时间内不发生迁移。 关键词:粽子;箬叶;黄酮类化合物;高效液相色谱;迁移规律 Determination of Flavonoids in Rice Dumplings by High Performance Liquid Chromatography and Their Migration Patterns WU Yu, LI Hongyan', ZHANG Shuifeng', NIU Canjie, HONG Huang’, CHEN Zhaogui, CHEN Xiaozhen1* (1. Zhejiang Institute of Quality Inspection Science, Hangzhou 310012, China; 2. College of Chemical Engineering, Zhejiang University ofTechnology, Hangzhou 310014,China;3. Zhejiang Wufangzhai Industrial Co. Ltd., Jiaxing 314003, China) Abstract: A method was developed for the determination of isoorientin, orientin, vitexin, isovitexin and p-coumaric acidin Indocalamus leaves and rice dumplings wrapped in them by high performance liquid chromatography (HPLC). Themigration patterns of these flavonoid compounds in fresh, vacuum-packaged and quick-frozen rice dumplings during thecooking process were established by determining their contents in Indocalamus leaves and the wrapped rice. The resultsshowed that in the first boiling cycle, the migration percentages of flavonoids from indocalamus leaves to rice dumplingswere 7.41%-45.18%. In the second cycle, the contents of flavonoids in indocalamus leaves were rapidly reduced in thefirst 30 min by 51.61%-72.48% as compared to the total reduction during the entire period of 120 min, and the migrationpercentages of flavonoids were 18.07%-65.94%, which were higher than those in the first boiling cycle. During the storageperiod of 30 days, the contents of flavonoids (except for no change in isovitexin) in Indocalamus leaves were reduced inthe first 15 days by 68.60%-85.50% as compared to the total reduction over the whole storage period and the migrationwas slowed down from the 15 day onwards; the migration percentages of flavonoids (except that isovitexin did not migrate)were 25.90%-64.84% during the 30-day storage. During the second boiling cycle and storage period, the migration ratesof isoorientin and orientin were lower than those of other flavonoids. Fresh rice dumplings were most beneficial for themigration of isovitexin, while quick-frozen samples were beneficial for the migration of other flavonoids. The migration ofisovitexin under vacuum and quick-frozen conditions did not happen in a short time. Key words: rice dumplings; Indocalamus leaves; flavonoids; high performance liquid chromatography (HPLC); migration patternDOI:10.7506/spkx1002-6630-201608020 ( 收稿日期:20 1 5-07-10 ) ( 基金项目:公益性行业(质检)科研专项(201310150);浙江省公益性技术应用研究计划项目 (2015C37055) ) ( 作者简介:吴 雨 (1991一),女, 硕 士研究生,研究方向为食品安全与检测。E-mail: lucky1232009@163.com ) ( *通信作者:陈小珍(1960一),女 , 高级工程师,本科,研究方向为食品安全与检测。E-mail: cxz730@163.com ) 超星期北京豫维科技有限公司联系人:水先生电话:189118499231162016,Vol.37,No.08 食品科学 ※成分分析 中图分类号:TS201.2 文献标志码:A 文章编号:1002-6630(2016)08-0115-06 引文格式: 吴雨,李红艳,张水锋,等.高效液相色谱法测定粽子中的黄酮类化合物及其迁移规律[].食品科学,2016,37(8):115-120.DOI:10.7506/spkx1002-6630-201608020.).http://www.spkx.net.cn WU Yu, LI Hongyan, ZHANG Shuifeng, et al. Determination of flavonoids in rice dumplings by high performance liquidchromatography and their migration patterns[J]. Food Science, 2016, 37(8): 115-120. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201608020. http://www.spkx.net.cn 黄酮类化合物是一类具有2-苯基色原酮结构的化合物,在自然界中以游离态(苷元)和结合态(与糖结合成苷类)的形式存在于植物体内13,具有保护心脑血管、调节血脂、增强免疫力、抗菌、抗病毒等多种保健及药理作用4-8]。箬叶是一种天然生物黄酮的新资源,富含黄酮类、内酯类和酚酸类化合物9-11,因其叶片宽大,气味浓郁,自春秋以来就成为粽子的主要包装材料。粽子作为中国传统的膳食食品,具有清香可口、风味多样、易保存便于烹饪等特性,广受人们的喜爱。目前对粽子的研究主要为工艺方面,而在功能成分方面的研究鲜有报道。 近年来,食品容器、包装等接触材料中某些特定物质在食品中的迁移规律成为国内外研究的热门,主要为涂覆[12]、陶瓷[13]、塑料[14]和玻璃15]等包装材料中有毒有害物质的迁移。目前,国内外关于黄酮类化合物研究[16-19]主要为竹叶、荷叶、艾叶、车前子等植物中黄酮类化合物的检测,对包装材料中黄酮类化合物在食品中迁移规律的研究尚属空白。本实验采用高效液相色谱检测方法,分析了粽米及包装材料箬叶中 草苷、异草苷、牡荆苷、异牡荆苷、对香豆酸5种黄酮类化合物含量,并分别对一次蒸煮、二次蒸煮、保存条件及保存时间等影响因素进行了讨论,研究箬叶中5种黄酮类化合物在粽子中的迁移规律。该研究契合了社会倡导的绿色健康饮食理念,为推广传统天然包装材料在食品中的应用提供了理论依据。 1 材料与方法 1.1 材料与试剂 箬叶、糯米、粽子(约100 g/个,经一次蒸煮后出厂) 浙江五芳斋实业股份有限公司;前处理条件优化所用箬叶采自浙江杭州,包粽子及迁移规律研究所用箬叶采自湖南张家界;;甲醇、乙腈、乙酸、乙醇(均为色谱纯) 德国Meker公司。 1.2 仪器与设备 LC-20AD高效液相色谱仪 日本Shimadzu公司;高速冷冻离心机 美国Thermo公司; AS10200AT超声波 清洗仪 天津奥特赛恩斯仪器有限公司;WH-861涡旋混合器 太仓华利达实验验备有限公司;R-210旋转蒸发仪 瑞士Bichi公司: XBridge C18色谱柱 美国Waters公司;超纯水仪 美国Millipore公司。 1.3 方法 1.3.1 样品前处理 箬叶样品清洗后经自然风干,粉碎过40目筛后,称取0.5g(精确到0.001g);粽米经搅碎后取10g(精确到0.01g)。分别于50mL离心管中,加入体积分数40%乙醇溶液5 mL,涡旋,混合均匀后频率为20 kHz超声提取15 min, 10 000 r/min离心5 min, 收集上清液于鸡心瓶。固体残渣重复提取一次,合并2次上清液,45℃条件下旋转蒸发浓缩,用水定容至10 mL, 过0.22 um水相滤膜后供高效液相色谱法分析测定。 1.3.2 样品提取 振荡提取法和超声波提取法比较:样品分别用振荡提取法和超声波提取法(频率为20kHz) 提取15 min。 超声波提取法优化:超声波频率20~60 kHz,超声时间5~30 min(箬叶样品),15~60 min (粽米样品),试剂乙醇体积分数0%~100%,加入乙醇2.5~12.5mL/次(箬叶样品),5.0~20.0mL/次(粽米样品)。 1.3.3 色谱条件 采用XBridge C色柱(4.6mm×250mm, 5um)分离。流动相:0.1%乙酸-乙腈-甲醇(78:9:13,VIV)溶液,柱温35℃;流速0.9mL/min; 进样量15pL;波长309、342nm。 1.3.4 样品的蒸煮及保存工艺 一次蒸煮:将粽子放入水中,选用蒸煮温度115~170℃,压力0.1MPa,蒸煮时间80 min,经室温冷却后备用;:二次蒸煮:将粽子放入水中,选用蒸煮温度100℃,蒸煮时间30 min, 经室温冷却后备用;新鲜粽:粽子经-次蒸煮后,在室温条件下保存,保质期:5~7d;真空粽:粽子经一次蒸煮后,进行真空包装,在121℃条件下高温灭菌后,室温条件下保存,保质期:270d;速冻粽:粽子经一次蒸煮后,对粽子进行速冻处理,使粽子中心温度降至至18℃,冷冻保存(一18℃),保质期:540d。 2.1 前处理条件的优化 实验比较振荡提取法和超声波提取法,发现超声波提取法提取率远高于振荡提取法。由于超声波频率、超声波提取时间是影响有效成分提取率的主要因素,应根据实际样品的性质来确定适宜的超声频率、超声时间120-221。故选择超声波频率与超声时间进行优化实验。由图1可知,箬叶与粽米的最佳超声波提取条件均为:20kHz条件下超声提取15 min. A.箬叶;B.粽米; 下脚标1.超声频率;2.超声时间。 图1 黄酮类化合物含量随超声频率、超声时间的变化 Fig.1 Influence of ultrasonic frequencyand time on the contents offlavonoids in Indocalamus leaves (A) and glutinous rice (B) 继而对提取试剂乙醇体积分数、单次提取液用量进行了优化,如图2所示,箬叶样品每次采用5mL体积分 数40%乙醇溶液提取2次,粽米样品采用15mL体积分数40%乙醇溶液提取1次时,提取效率最佳。 单次提取液用量/(mL/次) 图2 箬叶中黄酮类化合物含量随乙醇体积分数(A)和单次提取液用量(B)的变化 Fig.2 Influence of ethanol concentration (A) and volume (B) on thecontents of flavonoids in Indocalamus leaves 2.2 黄酮类化合物的高效液相色谱测定方法的优化 C.牡荆苷 波长/nmD.异牡荆苷 5 40- 30- 20- 10 200 250 300 350 波长/nm E.对香豆酸 图3 5种黄酮类化合物的光谱图 Fig.3 UV Spectra of 5 flavonoids 1.异兹草苷;2.草苷;3.对香豆酸;4.牡荆苷;5.异牡荆苷;a.检测波长342 nm; b.检测波长309 nm。 图5同。 图4 标准溶液中5种黄酮化合物的色谱图 Fig.4 Chromatograms of mixed standard solution of 5 flavonoids at 10 mg/L 黄酮类化合物多为中等极性,常采用乙腈或甲醇与乙(或甲)酸水溶液为流动相[23-24],通过反相色谱柱分离、液相色谱紫外分析测定25)。本实验尝试以乙腈与乙酸溶液为流动相,异兹草苷和草苷出峰时间过近,两峰部分重叠,难以定量; 以甲醇与乙酸溶液为流动相时,牡荆苷和异牡荆苷也出现同样状况。最终选用0.1%乙酸-乙腈-甲醇(78:9:13, VIV)溶液,等梯度洗脱。由图3可知,对香豆酸在波长309 nm处有最大吸收峰,其他4种碳苷黄酮在波长342 nm处有最大吸收峰。从图4可以看出,目标分析物均得到了很好地分离和检测。5种黄酮类化合物在0.1~100 mg/L的质量浓度范围内具有良好的线性关系,相关系数r均在0.99以上。检出限(RsN=3)为0.01~0.03 mg/L,定量限(Rsx=10)为0.03~0.09 mg/L。 A.箬叶; B.粽米。 图5 样品中5种黄酮化合物的色谱图 Fig.5 Chromatograms of 5 flavonoids in Indocalamus leaves (A) andglutinous rice (B) 按1.3.1节及1.3.3节,对箬叶与新鲜白粽粽米中的黄酮类化合物进行分析,所得的色谱图如图5所示,进一步说明,该色谱条件分离能力强,检测灵敏度高,适用于实际样品中5种黄酮类化合物的同时分离测定。 2.3 样品中黄酮类化合物的含量 表1 原料及样品中黄酮类化合物的含量(n=3) Table1 Contents of flavonoids in raw materials and samples (n=3) mg/kg 样品 异荭草苷 草苷 牡荆苷 异牡荆苷 对香豆酸 箬叶 84.88 13.71 11.39 16.74 157.78 糯米 0.07 ND ND ND 0.09 新鲜白粽 箬叶 22.27 6.12 2.01 5.32 30.01 (一次蒸煮) 粽米 0.27 0.16 0.22 0.12 3.36 新鲜白粽 箬叶 8.96 1.43 1.39 0.46 13.22 (二次蒸煮) 粽米 0.41 0.34 0.24 0.28 3.99 真空白粽 箬叶 24.28 7.96 3.28 1.13 33.90 (一次蒸煮) 粽米 0.19 0.11 0.32 ND 3.15 速冻白粽 箬叶 27.65 2.74 1.74 3.47 27.41 (一次蒸煮) 粽米 0.60 0.25 0.30 ND 3.79 真空白粽 箬叶 12.34 2.58 1.62 0.43 20.65 (保存30d) 粽米 0.37 0.23 0.37 ND 3.65 注:ND.未检出。 由表1、2可知,原料中黄酮类化合物含量不同,箬叶中分别加入3种不同水平的标准品,5种黄酮类化合物的回收率为74.5%~125.1%;相对标准偏差(relativestandard deviation, RSD) (n=5)为4.0%~8.1%;在糯米基质中加入3种不同水平的标准品,5种黄酮类化合物的回收率为65.2%~126.5%;相对标准偏差(n=5)为2.4%~7.5%。黄酮类化合物在箬叶中检出限(Rs=3)为0.2~0.5 mg/kg, 定量限(Rsv=10) 0.6~1.5mg/kg; 在糯米中检出限为0.02~0.03 mg/kg, 定量限为0.06~0.09 mg/kg,均可以满足实际样品的分析要求。 表2 原料中黄酮类化合物的加标回收率、检出限、定量限、RSD Table 2 Spiked recovery,LOD,LOQand RSD of flavonoids in raw materials 化合物加 叶 加标水平/回检出限/收率/% 定量限/ RSD/% (mg/kg) (mg/kg) (mg/kg) (n=5) 糯米 加标水平/检出限/定量限/回 RSD/%收率/% (mgkg) (mgkg) (mg/kg) (n=5) 6.8 5 4.3 10 05 1.5 7.2 10 0.02 0.06 55 20 6.4 25 6.0 10 6.9 5 6.4 药草苷 20 0.5 1.5 7.0 10 0.03 0.09 6.8 40 5.1 25 99.8 75 4.6 5 5.0 牡荆苷 0.3 10 4.0 10 0.03 0.09 4.2 10 4.7 25 5.9 20 74.6 5.6 5 91.3 41 40 67.2 0.5 1.5 64 10 0.03 0.09 4.8 80 94.7 5.2 25 3.4 8. 2.4 0.2 0.6 7.2 10 0.02 0.06 4.7 10 7.6 25 5.0 2.4 箬叶中黄酮类化合物在粽子中的迁移规律 2.4.1 一次蒸煮对黄酮类化合物迁移的影响 为分析在一次蒸煮后粽子中黄酮类化合物含量的迁移变化规律以及观察粽子本底对迁移是否有干扰,实验选取同一批用于包裹粽子的箬叶和经过一次蒸煮出厂销售的新鲜白粽按1.3.1节处理后进行测定,每个粽子均由两张箬叶包裹而成,两张箬叶的质量约为5.5 g.由表1可得,箬叶中含有相当量的黄酮类化合物,其中异草苷、对香豆酸含量较高,分别为84.88 mg/kg和157.78 mg/kg;糯米中不含苷草苷、牡荆苷及异牡荆苷,只含有少量的异草苷与香豆酸,其含量分别仅为0.07 mg/kg和0.09 mg/kg,对实验结果的影响可忽略不计,因此选择糯米粽子作为评价迁移率的空白本底样品。经过一次蒸煮后,箬叶中各黄酮类化合物含量明显减少,异药草苷、草苷、牡荆苷、异牡荆苷、对香豆酸的减少量分别是62.61、7.59、9.38、11.42、127.77 mg/kg,其中迁移进入粽米中的黄酮类化合物的比例分别为7.41%、36.22%、40.30%、18.05%、45.18%。 2.4.2 二次蒸煮对黄酮类化合物迁移的影响 由于人们从市场购买的都是经过一次蒸煮后出厂销售的粽子,买回经二次蒸煮后食用,因此对黄酮类化合物随二次蒸煮时间的迁移进行探究具有实际意义。选取-批新鲜白粽,放入100℃沸水中蒸煮,选择蒸煮时间为10~120 min, 其余步骤按1.3.1节方法处理。结果表明箬叶中的黄酮类化合物含量随二次蒸煮时间延长均呈减少趋势,后90 min减少缓慢。由表1可知,在120 min内,异药草苷、药草苷、牡荆苷、异牡荆苷、对香豆酸的总减少量分别是13.31、4.69、0.62、4.86、16.79 mg/kg。前 30 min减少量大,分别占总减少量的72.05%、64.39%、51.61%、61.93%、72.48%。粽米中的黄酮类化合物含量随二次蒸煮时间延长而增加,其中迁入粽米中的黄酮类化合物的迁移率分别为18.07%、65.94%、55.43%、56.57%、64.47%;迁移率高于一次蒸煮。对二次蒸煮前后黄酮类化合物含量变化的研究发现,药草苷、异荭草苷在箬叶中含量均高于牡荆苷,而在粽米中的迁移量均低于牡荆苷,故草苷,异草苷随时间迁移较缓慢。总之,高温能实现5种黄酮类化合物的快速迁移,,且二次蒸煮的迁移率大于一次蒸煮。 2.4.3 保存时间对黄酮类化合物迁移的影响 由于真空粽可保存的时间较长,故选取一批保存时间分别为1、15、30d的真空白粽,按1.3.1节处理后进行测定。实验表明箬叶中的黄酮类化合物含量随保存时间延长均呈减少趋势,在30d内,异荭草苷、荭草苷、牡荆苷、异牡荆苷、对香豆酸的总减少量分别是11.94、5.38、1.66、0.70、13.25 mg/kg。箬叶中黄酮类化合物在前15d减少明显,分别占总减少量的72.19%、85.50%、68.67%、22.86%、68.60%,15~30d迁出速率减缓。5种黄酮类化合物能随保存时间发生迁移,粽米中的黄酮类化合物含量都随保存时间延长而增增,由表1可知,由箬叶迁出而迁入粽米中的黄酮化合物迁移率分别为25.90%、38.32%、51.75%、0、64.84%。观察保存时间延长对黄酮类化合物含量的影响,粽米中黄酮类化合物随保存时间延长均匀增加,草苷、异草苷在箬叶中含量均高于牡荆苷,而在粽米中的迁移量均低于牡荆苷,与其他3种黄酮类化合物相比,草苷、异草苷随时间迁移较缓慢,共同的迁移缓慢可能与这2种物质是同分异构体有关。 2.4.4 保存方式对黄酮类化合物迁移的影响 选取仅-批保存方式不同的新鲜白粽(常温保存)、真空白粽(真空包装保存)、速冻白粽(18℃保存),按1.3.1节处理,如表1所示,在不同保存方式条件下,新鲜保存最有利于异牡荆苷在粽子中迁移,而速冻保存最有利于其余4种黄酮类化合物的迁移。异牡荆苷在真空粽与速冻粽中短时间内未发生迁移。其余4种黄酮类化合物迁移到粽米中的含量从大到小依次是速冻粽、新鲜粽、真空粽。故新鲜保存最有利于异牡荆苷在粽子的迁移,而速冻保存最有利于其余4种黄酮类化合物在粽子中的迁移。 3 结 论 通过实验建立了箬叶及粽米中异草苷、草苷、牡荆苷、异牡荆苷、对香豆酸5种黄酮类化合物的高效液相色谱检测方法,并对箬叶和粽米前处理方法进行选择 和优化。对影响粽子中黄酮类化合物迁移因素的研究发现如下结论: 1)原料:箬叶中黄酮类化合物含量很高,糯米基本不含这5种黄酮类化合物,是检测迁移较好的空白本底。 2)蒸煮次数:一次蒸煮、二次蒸煮均能实现5种黄酮类化合物短时间内迁移。70一次蒸煮后,经水浸提进入粽米中的黄酮类化合物的迁移率为7.41%~45.18%。二次蒸煮时,药草苷、异草苷随时间迁移较缓慢,箬叶中的黄酮类化合物前30 min减少量大,分别占120 min内总减少量的51.61%~72.48%。在120 min内迁入粽米中的黄酮类化合物的迁移率为18.07%~65.94%。对比发现,二次蒸煮的迁移率大于一次蒸煮。 3)保存时间:在30d内,草苷,异草苷随时间迁移较缓慢,箬叶中黄酮类化合物在前15d减少明显,分别占总减少量的68.60%~85.50%(除异牡荆苷为0外),15~30d迁出速率减缓。30d内,由箬叶迁出而迁入粽米中的黄酮类化合物迁移率为25.90%~64.84%(除异牡荆苷为0外)。 4)保存方式:新鲜保存最有利于异牡荆苷在粽子中迁移,而速冻保存最有利于草苷、异莲草苷、牡荆苷、对香豆酸的迁移。异牡荆苷在真空保存和速冻保存条件下,短时间内不发生迁移。 ( 参考文献: ) ( [1] GUO X u efeng, YUE Yo n gde, TANG Feng, et al. Simultaneousdetermination of seven flavonoids in d an bamboo phyllostachys glaucamcclure leaf extract and in commercial products by HPLC-DAD[J]. Journal of Food Biochemistry, 2013, 37:748-757. DOI:10.1111/ i .1745-4514.2012.00674.x. ) ( [21 段宙位,李维国,窦志浩,等.沉香叶黄酮类化合物的提取及其抗 氧化活性[J]. 食 品科学,2015,36(6): 45-50. DOI:10.7506/spkx1002- 6630-201 5 06009. ) ( [3] 杨安琪,吕 丽 爽,王华清,等. 茶 叶籽中黄 酮 的分离及HPLC-MS联用 分析[J].食 品 科学,20 14 ,35(24):228-234. DOI:10.7506/spkx1002- 6630-201424044. ) ( [4] J OHNSON T A, S O HNJ, IN M AN W D, et al. Natural p roduct l ibraries to acc e lerate th e high-throughput discovery of therapeutic leads[J]. Journal of Natura l Products , 2011 , 74(12) : 2545-2555.DOI:10.1021/np200673b. ) ( [5] MOON JK, SHIBAMOTO T. Antioxidant assays for plant and food c omponents[J]. Journal of A gricultural and F ood Chemistry, 2009, 57(5): 1 655-1666. D OI:10.1021/jf803537k. ) ( [6] 池玉梅,居 羚 , 邓 海每,等.分光光度测定总黄酮法的适用性[J].分 析 化学,20 10 ,38( 6 ):893-896.DOI:10.3724/SP.J.1096.2010.00893. ) ( [7] 余晓红,朱 雪 梅,李凤伟 , 等. 芦 苇叶黄酮类提取物体内体外抗氧化 性研究[J].食品科学,2015,36(1):209-213. DOI:10.7506/spkx1002- 6630-201501040. ) ( [8] GUO Qi, T IAN Xin, YANG Aoran. Ori e ntin in Trollius chinensis B unge i n hibits proliferation of HeLa human ce r vical carcinoma cel l s by i nduction of apoptosis[J] . Monatsheft e fur Chemie-Chemical M onthly,2014, 145:229-233.D O I:10.1007/s00706-013-1011-x. ) ( [9] L EKER C,PETIT K E, BIA R D J,et al. Search fo r hydrophilic marine f ungal m etabolites: a rational approach for their production and e xtraction i n a bioactivity screening context[ J ]. Marine D rugs, 2011, 9( 1 ):82-97. DOI:10.3390/md9010082. ) ( [10] LU J un, QIN P e izhen, HAN Xue, et al . E v aluation of antioxidant and a ntibacterial p roperties of extracts from Trollius chinensis Bu n ge[J].European Food R e search a n d T e chnology, 2015,240(2):301-310. DOI:1 0 .1007/s00217 - 014-2329-2. ) ( [11] 杨静毅,喻玲玲,吴梅, 等 .银合欢果皮总黄酮含 量 测定及抗氧化活 性[ J ].食品科学,2015,36(8):187-190. DOI:10.7506/spkx1002-6630- 201508034. ) ( [12] 姚卫蓉.食品包装污染物研究进展[J].现代 食 品科技,2005,21(1): 1 50-153. DOI:10.3969/j.issn.1673-9078.2005.01.049. ) ( [13] PALEOLOGOS E K , KONTOMINAS M G. De t ermination ofacrylamide a nd m ethacrylamide b y normalphase hi g h performance l iquid chromatograph and UV detection[J]. Journal o f Chromatograph A, 2005, 1077: 1 28-135.DOI:10.1016/j.chroma.2005.04.037. ) ( [ 1 4] 刘志刚,王志伟,胡长鹰.塑料包装材料化学物迁移试验中食品 模拟物的选用[J].食品科学,2006 , 27(6):271-274. DOI:10.3321/ i .issn:1002-6630.2006.06.062. ) ( [15] 张双灵,赵奎浩,郭康权,等.食品包装化学物迁移研究的现状及 对 策分析[J].食品 工 业科技 , 2007,28(9): 169-172. DOI:10.3969/ i .issn.1002-0306.2007. 0 9.049. ) ( [16] BLUNT J W, COPP B R, M U NRO M H G, et al. Marine natural p roducts[J]. N atural Product Reports, 2013, 30(2): 2 37-323. ) ( [17] 张春娟, 孟 志芬,郭雪 峰 , 等 . HPLC结合紫外光谱法快速定性定量分析四种竹叶黄酮十苷[J].光谱学与光谱分析,2014,34(9):2568- 2572.DOI:10.3964/j.issn.1000-0593(2014)09-2568-05. ) ( [18] LU Zhaolin, DONG Jing, ZHANG Bolin. Ra p id id e ntification and detection of flavonoid compounds from bamboo leaves by LC-(ESI)- I T - T OF/MS[J]. B ioResources, 2011, 7(2) : 1405-1418. DOI:10.15376biores.7.2.1405-1418. ) ( [19] W ANG Jin, YUE Yo n g de, JIA N G Hao, et al. Rapid screening for f lavone C-glycosides in the leaves of different s p ecies o f bamboo andsimultaneous quantitatio n o f four marker compounds by HPL C -UV / D AD[J]. International J o urnal of Analytical Chemistry, 2012, 8: 1 -8 . DOI:10.1155/2012/205101. ) ( [20] WANG Ji n , YUE Yongde, TANG Feng, et al . TL C Screening fo r antioxidant a ctivity of extracts from fifteen bamboo species and i dentification of antioxidant flavone glycosides from l eaves of b ambusa textilis McClure[J]. Molecules, 2012, 1 7(10):12297-12311. DOI:10.3390/molecules171012297. ) ( [21] SONG Zhiling, WANG Hon g , REN Bi a o, et al. On-line study of f lavonoids of T rollius chinensis Bunge binding t o D N A wit h ethidium bromide using a n ovel combination of chromatographic, mass s pectrometric and f l uorescence t e chniques[J]. Journal of C hromatographyA, 2013,1282:102-112.DO I :10.1016/j.chroma.2013.01.060. ) ( [221 X U J i ang, QIAN Junqing, LI S h angqian. Enzymatic acylation of i soorientin isolated from antioxidant of bamboo l eaves w ith p almitic acid a nd a n tiradical activity of the acylated d e rivatives[J]. E u ropean Food Research a nd T echnology, 2014, 2 39:6 6 1-667. DOI:10.1007/ s00217-014-2262-4. ) ( [23] 张颖,崔英杰,房信胜,等 . 毛细管电泳法同时检测南蛇藤中 三种 黄 酮类活性成分[J].食品工业科技,2013,34(6): 57-60. ) ( [24] GAVRILIN M V , SENCHENKO S P, GUSOV R M . Quantitative determination of vitexin-2 - O-rhamnoside in common oats u s ing HPLCand capillary electrophoresis[J]. P harmaceut i cal Chemistry Journal, 2007,41(7):53-55. DOI:10.1007/s11094-007-0085-3. ) ( [251 L I H uilin, SONG F e ngrui, X I NG Ju n peng, et al . S c reening and structural characterization o f a-glucosidase inhibitors from hawthorn l eaf flavonoids extrac t by ultrafiltrati o n LC-DAD-MS"a n d SORI-CID F TICR MS[J]. Journal of the American Society for M ass Spectrometry, 2009,20(8): 1 496-1503.DOI:10.1016/j.jasms.2009.04.003. ) 网址:www.yuweichina.com Email:: watercom
确定





还剩4页未读,是否继续阅读?
北京豫维科技有限公司为您提供《粽子中黄酮类化合物检测方案(液相色谱柱)》,该方案主要用于其他粮食加工品中营养成分检测,参考标准--,《粽子中黄酮类化合物检测方案(液相色谱柱)》用到的仪器有
相关方案
更多
该厂商其他方案
更多








