
方案详情
文
荧光微球系列细胞荧光标记试剂是近年研发的一种新型染料,具有强烈、稳定的荧光,不转染周围细胞,可以长时间地追踪活细胞迁移、运动、贴附的特点。它可使用于MSCs、胚胎干细胞、肿瘤细胞以及心肌、平滑肌细胞等各类细胞的标记。
方案详情

Chinese Journal of Reparative and Reconstructive Surgery, June 2010, Vol. 24, No.6·744· 中国修复重建外科杂志2010年6月第24卷第6期745· 荧光微球体外标记大鼠 BMSCs 的初步研究 姜晓锐 张鑫鑫 杨科跃 江汕 金丹-1 王丹1 裴国献” 【摘 要】 目的 通过检测荧光微球 655 (quantum dot 655, QD655)标记 SD 大鼠 BMSCs 的体外细胞毒性、细胞增殖、细胞贴附性以及标记率,探讨 QD655标记 BMSCs及其示踪的可行性。 方法 收集2周龄健康 SD 大鼠股骨和胫骨骨髓,贴壁培养 BMSCs。取第3代BMSCs 采用 QD655标记作为实验组,以未标记 BMSCs 作为对照组,采用锥虫蓝拒染法检测细胞存活率, MTT 法观察 QD655 对细胞增殖性的影响;取实验组 BMSCs 向成骨诱导分化培养2周,采用茜素红、ALP染色定性鉴定细胞成骨分化能力,实时荧光定量 PCR 鉴定标记对细胞成骨分化的影响;分别在标记后即刻、1、2、4、6周采用荧光显微镜动态检测实验组 BMSCs 阳性标记率;扫描电镜观察实验组细胞在胶原/生物活性玻璃复合材料上的贴附性。 结果 实验组与对照组细胞存活率均>90%,比较差异无统计学意义(P>0.05);培养1、3、5、7、9d,两组细胞增殖率比较差异均无统计学意义(P>0.05)。实验组BMSCs 经成骨诱导分化2周后,茜素红及 ALP染色均呈阳性,实时荧光定量 PCR 检测实验组 BMSCs 的骨桥蛋白、骨钙素、I型胶原、ALP、BMP-2 mRNA 较对照组成倍数高表达。实验组 BMSCs 标记后即刻阳性标记率达96.50%±1.59%,随着标记时间延长标记率下降,标记后1、2、4、6周标记率分别为 93.30%±1.51%、72.40%±2.90%、40.10%±3.60%、10.00%±1.70%,对照组各时间点阳性标记率均为0。扫描电镜观察示实验组标记后细胞和材料贴附良好。 结论 QD655 对大鼠 BMSCs 标记时间长,标记率及安全性高,是一种良好标记物。 【关键词】 BMSCs 荧光微球 体外标记 大鼠 中图分类类:R318 Q813.11 文献标志码:A IN VITRO QUANTUM DOT-LABELED RAT BONE MARROW MESENCHYMAL STEM CELLS/JIANG Xiaorui, ZHANG Xinxin, YANG Keyue, JIANG Shan , JIN Dan, WANG Dan, PEI Guoxian. Department of Orthopaedics andTraumatology, Nanfang Hospital, Southern Medical University, Guangzhou Guangdong, 510515,P.R.China; Institute of Orthopedicsof Chinese PLA, Xijing Hospital, Fourth Military Medical University. Corresponding author: PEI Guoxian, E-mail: nfperry@163.com 【Abstract】 ObjectiveeTo explore the cytotoxicity, labeled time, marking rate, and effect on adhesion of quantumdot 655 (QD655) labeled rat bone marrow mesenchymal stem cells (BMSCs) in vitro, and to confirm its feasibility for stemcell labeling and tracer means for rat.Methods BMSCs were collected from the femur and tibia bone marrow cavity of a2-week-old SD rat, cultured and identified. The 3rd passage of BMSCs were incubated with QD655 as the experimental groupaccording to the recommended concentration of the markers. The cells were not labeled by QD655 as control group. Thecell survival rate after QD655 labeling was detected by trypan-blue exclusion. The effect of QD655 on cell proliferation wasobserved by MTT. The osteogenic differentiation potential was identified by Alizarin red staining, alkaline phosphatase (ALP)staining, and real-time fluorogenic quantitative PCR. At immediately, 1, 2, 4, and 6 weeks, fluorescent microscopy was used toobserve the labeled rate and scanning electron microscope was used to observe the cell adhesion to scaffold (bioglass/collagencomposite).ResultsTThe cell survival rates were more than 90% in both experimental group and control group, showingno significant difference (P> 0.05). There was no significant difference in the cell proliferation between 2 groups (P>0.05).Alizarin red staining and ALP staining showed positive results. Real-time fluorogenic quantitative PCR result showed that themRNA expression levels ofosteopontin, osteocalcin, collagen type I, ALP, and BMP-2 in the experimental group was significantlyhigher than those in the control group. The labeled rates were 96.50%±1.59%,93.30%±1.51%,72.40%±2.90%, 40.10%±3.60%, and 10.00%±1.70% immediately, 1, 2, 4, and 6 weeks after labeling, respectively. The labeled rate in the controlgroup was 0. Scanning electron microscope showed a good distribution of fusiform or polygonal cells in the pores of scaffold.Conclusionn QD655 can be used as a labeling marker for BMSCs. Rat BMSCs labeled with QD655 is of high efficiency andsafety. 【Key words】 Bone marrow mesenchymal stem cells Quantum dot Labeling in vitro Rat ( Foundation items: NSFC-Guangdong Un i on Project (u0732003); National Basic Science Research and Development Grantsof China (2009CB930003) ) ( 基金项目:NSFC-广 东 省联合基金重点资助项目(u0732003);国家重点基础研究发展计划(973)资助项目(2009CB930003) ) ( 作者单位:1 南 方医 科 大学南方医院 创 伤骨科( 广 州, 5 10515);2第四 军 医大学西京骨 科 医院 ) ( 通讯作者 : 裴国献,教授,博士导师,研究方向:骨 组 织工程, E-mai l : nfperry@163.com ) 目前,用于组织工程种子细胞标记的标记物均存在标记率不高、荧光持续表达时间不长、对细胞毒性较大、操作复杂、价格昂贵以及会影响细胞贴附性等弊端[1-4],限制了组织工程体内研究。因此,寻找一种理想的组织工程种子细胞的标记物成为当前热门研究方向。荧光微球(quantum dot, QD)系列细胞荧光标记试剂是近年研发的-一一种新型染料,具有强烈、稳定的荧光,不转染周围细胞,可以长时间地追踪活细胞迁移、运动、贴附的特点。但对于该试剂在体外对大鼠BMSCs标记率、向成骨分化、体外毒性、细胞增殖、在材料的贴附性、标记率动态性变化方面的影响尚不清楚。本实验采用 QD655 标记大鼠BMSCs,对上述问题进行研究,为下一步体内构建大鼠组织工程骨种子细胞示踪奠定实验基础。 材料与方法 1.1 实验动物及主要试剂、仪器 2周龄健康 SD 雄性大鼠1只,体重80 g,购自南方医院实验动物中心,实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准。 SD 大鼠BMSCs标准培养基(Cyagen 公司,美国);低糖 DMEM 培养基、高糖DMEM 培养基、FBS(HyClone 公司,美国);胰蛋白酶、青霉素钠、链霉素、地塞米松、抗坏血酸、β磷酸甘油钠(Sigma 公司,美国);QD655细胞标记试剂盒、Tirzol Isolation Reagent(Invitrogen 公司,美国);ALP试剂盒(南京建成生物有限公司);胶原/生物活性玻璃复合材料(华南理工大学生物材料研究所)。 COz培养部(Harris 公司,美国);倒置荧光相差显微镜(Nikon 公司,日本);iQ5实时荧光定量 PCR 仪(Bio-Rad公司,美国);NO-1000 全波长紫外/可见光扫描分光光度计(Nano Drop 公司,美国)。 1.2 大鼠BMSCs分离、培养及鉴定 断颈处死大鼠后置于75%乙醇浸泡15 min,无菌取出股骨与胫骨,去除骨骼附着软组织,无菌生理盐水冲洗髓腔1~2次,收集于离心管中。以离心半径15 cm、1 000 r/min 离心 10 min,弃上清,采用 SD 大鼠BMSCs标准培养液重悬计数,接种于25 cm²培养瓶中,置于37℃、5%CO2恒温培养箱中培养。24h后换液,以后每2~3天换液1次。细胞达80%~90%融合时(原代培养3~5d),采用0.25%胰蛋白酶消化传代。选取生长良好的第3代细胞采用流式细胞仪及倒置荧光相差显微镜进行形态学观察及鉴定。 1.3 实验分组及方法 根据QD655细胞标记试剂盒操作步骤,分别 将 QD655试剂A和试剂载体B各取1uL混置于1.5 mL微量离心管中,37℃孵育 15 min, 加入 100 pL低糖 DMEM 培养基,涡旋30 s,向管中加入密度为1×107个/mL第3代 BMSCs悬液100pL(实验组),200 pL枪头轻轻吹打悬液后置于37℃、5%CO2恒温培养箱中培养1h,用含 10%FBS 的 SD 大鼠 BMSCs 标准培养基漂洗2次后,在倒置荧光相差显微镜下观测荧光标记状况。另取第3代BMSCs相同浓度的细胞悬液100 uL 不加染料直接接种,作为对照组。 1.4 检测指标 1.4.1 标记后BMSCs 存活率测定 取两组 BMSCs制成浓度为1×106个/mL 的细胞悬液,各取1mL加入0.1 mL 0.4%锥虫蓝溶液,光镜下观察,计数200个细胞中未蓝染细胞占细胞总数的百分比,即细胞存活率。每组设6个复孔。 1.4.2 标记对BMSCs 增殖的影响 取两组细胞制成浓度为1×105个/mL的细胞悬液,各取 10 uL 分别接种于96孔板中,分别于1、3、5、79d每孔加入MTT20pL,37℃孵育4h,弃原培养液加DMSO 150 pL,持续振荡10 min, 酶标仪570 nm/630 nm 检测吸光度(A)值。每个时间点各组各设立7个复孔。 1.4.3 标记 BMSCs 成骨分化鉴定耳取实验组细胞制 成浓度为1×10个/mL的细胞悬液,取100 pL接种于6孔板中,待细胞生长至培养瓶底约70%时,进行成骨诱导分化。成骨诱导分化培养基:含10%FBS的高糖 DMEM 培养基、50 pg/mL 抗坏血酸、100 nmol/L地塞米松及 10 mmol/L β 磷酸甘油钠。每3天更换诱导培养基,成骨诱导培养2周后进行以下鉴定:①茜素红染色:吸取培养板中培养液,用95%乙醇固定10 min,蒸馏水漂洗3次,加入0.1%茜素红-Tris-HCl (pH8.3)溶液,37℃孵育30 min,蒸馏水冲洗、干燥、封片,倒置荧光相差显微镜下观察。② ALP染色:吸取培养板中培养液,用95%乙醇固定10 min,采用蒸馏水漂洗3次,加入 ALP 试剂盒溶液,在湿盒孵育过夜,倒置荧光相差显微镜下观察。③实时荧光定量 PCR 检测:取实验组向成骨诱导培养2周的细胞,对照组细胞不作成骨诱导。采用实时荧光定量 PCR 仪检测两组中骨桥蛋白(osteopontin, OPN)、I型胶原(collagen type I, Col Ⅰ)、骨 钙素(osteo-calcin,OCN)、ALP、BMP-2 mRNA 表达水平。参照Trizol Isolation Reagent 说明书抽提标本总RNA。操作过程中所有的容器和移液器均经高压后的焦炭酸二乙酯水处理。应用 DU800紫外分光光度仪测定A260/A280值,判定总 RNA 纯度及测定其浓度。引物序列:ColI上游5'-CTGGCAACCTCAAGAATCC-3', 下游 3'-CAAGTTCCGGTGTGACTCG-5';ALP上游 5'-GACTGACCCTTCCCTCTCG-3',下游 3'-GGGGAAGCAGCAACACTAGA-5';OCN上 游 5'-GCAGGAGGGCAGTAAGGTG-3', 下游 3'-AAGCCAATGTGGTCCGCTA-5';GAPDH上 游5'-GGACCAGGTTGTCTCCTGTG-3', 下游 3'-TGTAGGCCATGAGGTCCAC-5';BMP-2上游:5'-CGGACTGCGGTCTCCTAA-3', 下卜游3'-GGGGAAGCAGCAACACTAGA-5';OPN上游5'-GAGTTTGGCAGCTCAGAGGA-3', 下游3'-TCT-GCTTCTGAGATGGGTCA-5'。反应试剂包括2×Al-linOneTM Q-PCR Mix 10 uL,终浓度为 2 umol/L 的 Alli-nOneTM Q-PCR Primer 2 pL, cDNA(1:5稀释)2pL,ddHzO终浓度1×6uL。将试剂混匀,加入96孔板中,短暂离心。采用标准三步法进行反应:预变性95℃、10 min, 1个循环;变性95℃、10s,退火60℃、20 s,延伸72℃、15 s, 40个循环。采用 Livak 等[6]的 2-AACt法进行分析,2-^▲Ct值是mRNA 在实验组/对照组中表达水平的相对比值。 1.4.4 标记 BMSCs 动态标记率检测 将第3代BM-SCs 制成1×105个/mL悬液,取1mL以离心半径15 cm、1000 r/min 离心 10 min, 收集细胞按前述方法进行标记,作为实验组;对照组细胞不进行标记。分别将两组细胞于标记后即刻、1、2、4、6周接种于6孔板中,检测时采用0.25%胰蛋白酶消化后,在倒置荧光相差显微镜200倍下计数,以200个细胞中显示荧光的细胞占细胞总数的百分比表示标记阳性率。每个时间点设6个复孔。 1.4.5 标记BMSCs材料贴附性观察 取实验组细胞以1×105个/cm²滴加至胶原/生物活性玻璃复合材料表面,6h后在材料周围添加 SD 大鼠BMSCs标准培养基,使培养基没过材料,于培养后3d扫描电镜观察材料表面细胞形态。 1.5 统计学方法 采用 SPSS13.0统计软件包进行分析。数据以均数±标准差表示,组间比较采用t检验,P值≤0.05为有统计学意义。 2 结果 2.1 大鼠BMSCs 的形态学观察及鉴定 倒置荧光相差显微镜下观察示第3代BMSCs 呈长梭形,轮廓清晰(图1)。流式细胞仪细胞表面鉴定示CD34、CD45呈阴性, CD29、CD44呈阳性。 2.2 QD655 标记 BMSCs 观察 标记1h后,倒置荧光相差显微镜下观察可见 BM-SCs 细胞染为红色,荧光强度高。与倒置相差显微镜下对比观察,细胞标记率高(图2)。 2.3 细胞存活率测定 实验组细胞存活率为92.00%±0.73%,对照组为94.50%±0.99%,两组存活率均>90%,比较差异无统计学意义(P>0.05)。 2.4 细胞增殖检测 培养1、3、5、7、9d,实验组A值分别为0.28±0.04、0.48±0.05、0.57±0.05、0.71±0.04、0.81±0.04,对照组分别为0.33±0.03、0.53±0.04、0.62±0.06、0.76±0.05、0.82±0.06。两组细胞增殖于7d后进入平台期,增殖速度减缓。各时间点两组比较差异均无统计学意义(P>0.05)。 2.5 标记 BMSCs成骨分化鉴定 实验组BMSCs 经成骨诱导培养2周后,倒置荧光相差显微镜下可见如火山口样的细胞团块聚集,茜素红及 ALP 染色均呈阳性(图3)。 实时荧光定量 PCR 检测显示,实验组细胞经成骨诱导2周后, OPN、OCN、ColⅠ、ALP、BMP-2 mRNA与对照组比较,均成倍数高表达,分别为8.06、9.25、3.54、1.88及596.34倍,具体数据见表1. 2.6 标记 BMSCs 动态标记率检测 倒置荧光相差显微镜观察实验组标记后即刻荧光量子点最多,荧光强度最高;随时间推移,细胞内细胞质的红色荧光量子点逐渐减少,细胞荧光强度逐渐减弱,标记6周量子点最少,强度最弱。标记后即刻、1、2、4、6周实验组 BMSCs 的标记阳性率分别为 96.50%±1.59%、93.30%±1.51%、72.40%±2.90%、40.10%±3.60%、10.00%±1.70%,对照组各时间点阳性标记率均为0. 表1 两组实时荧光定量 PCR 检测各相关蛋白 mRNA的表达(n=3,▲Ct,x±s) Tab.1 The mRNA expressions of OPN, OCN,ColI, ALP, and BMP-2 (n=3,▲ Ct,x±s) 组别 OPN OCN ColI ALP BMP-2 Group 实验组 Experimental group 1.37±0.34 9.91±2.10 -4.23±0.19 3.75±0.50 3.85±0.79 对照组 Control group 1.94±0.24 11.98±0.28 -2.41±0.25 4.66±0.18 13.41±0.24 2.7 标记 BMSCs 在材料的贴附性观察 实验组BMSCs 接种后3d,扫描电镜观察可见有较多细胞贴附于材料中(图4)。 3 讨论 种子细胞示踪的研究是组织工程一重要环节,关系到组织工程研究的基本理念。在骨组织工程中新生骨组织的细胞来源存在争议,只有将植入的种子细胞与原有的自身细胞区分开来,才能进一步探讨植入种子细胞的真正作用功。若在组织工程骨构建过程中缺乏有效标记,则不能准确、及时了解移植细胞在体内的存活、生长和迁移,很难说明种子细胞在组织工程中的真正作用,缺乏更直接的客观依据。传统的细胞示踪剂均存在明显缺陷,如标记率低、存在细胞毒性、标记时间短、操作繁琐等,不利于组织工程研究[8-10]。开发种适合用于体内实验且操作简单便于长期观察的标记物是解决以上问题的关键[11-12]。 QD系列荧光标记试剂是一种较新的产品,目前研究应用较少,它可使用于MSCs、胚胎干细胞、肿瘤细胞以及心肌、平滑肌细胞等各类细胞的标记[13-17]。由于 QD655 具备非常高的光致发光量子产量,可发出强烈荧光,同时又可对光漂白和光降解具备较强的耐光性[18],所以在荧光显微镜下或共聚焦显微镜下可清晰 观察标记细胞。有文献报道, QD 标记人胚胎干细胞、人BMSCs、大鼠内皮祖细胞、小鼠胚胎成纤维细胞等可达到接近100%的标记率且不影响细胞增殖[5,19];同时该试剂具有不同的激发波段,可激发不同颜色的光,同时标记不同种子细胞,所以也可采用其示踪不同细胞,用于区分研究[20]。有研究采用 QD800 标记人舌癌Tca8113细胞株,发现其对细胞增殖、黏附、侵袭及趋化性无明显影响 [21],还可在构建的兔组织工程骨中有效示踪6~8周7。经QD标记后的细胞在一定时间内能提供强烈、稳定、不同颜色的荧光,且不转染周围细胞,可以长时间追踪活细胞迁移、运动,由于标记的位置是细胞质,亦可观察细胞形态。 我们前期通过应用 QD525标记兔 BMSCs 观察,认为该试剂具备操作简便、标记率高等优点,用流式细胞仪检测标记率可达到97.19%。本实验在此基础上采用 QD655 对大鼠BMSCs 进行标记,进行细胞向成骨诱导分化的检测研究,以确定 BMSCs 标记后是否具备成骨潜能。实验结果表明,经QD655标记的大鼠BMSCs 在细胞增殖方面与未标记的 BMSCs 无明显差异,将标记后的 BMSCs 种植到支架材料上,扫描电镜观察见细胞仍有效贴附材料上。经体外成骨诱导分化2周后, ALP 和茜素红染色法鉴定,发现均有成骨表现。采用实时荧光定量 PCR 检测成骨基因表达,发现各项 图1 第3代 BMSCs 形态学观察(倒置相差显微镜×100) 图2 QD655标示 BMSCs 后1h 观察(×200)a@ 倒置荧光相差显微镜 ⑥倒置相差显微镜图3 实验组 BMSCs成骨分化检测 @茜素红染色呈阳性(×200) ⑥ALP染色呈阳性(×100) 图4 实验组 BMSCs 接种至材料后培养3d扫描电镜观察(×1000) Fig.1 Morphological observation of 3rd passage of BMSCs (Inverted phase contrast microscope×100)FFig.2 BMSCs observation labeled by QD655after 1 hour (x200) @ Inverted fluorescence phase contrast microscope b Inverted phase contrast microscopeFig.33The detection of osteogenicdifferentiation potential in experimental group There was a positive reaction for Alizarin red staining (x 200) ⑥ There was a positive reaction forALP staining (x100) Fig.4Scanning electron microscope observation of fusiform or polygonal cells in the pores of scaffold at 3 days (x1 000) 成骨指标均较未标记未诱导的 BMSCs 高表达,提示标记后的 BMSCs 仍具备成骨分化功能。但标记 BMSCs6周后荧光强度变弱导致标记率明显下降,提示如将QD655标记后的 BMSCs 移植到动物体内后,超过6周则荧光强度可能明显减弱。我们认为这可能是与细胞染色原理(胞吞)有关,由于随细胞分裂增殖细胞标记强度会持续减弱,最终示踪失效。然而,虽然6周后细胞明显标记率下降,但因细胞大量扩增,于高倍荧光显微镜下或共聚焦显微镜下仍可见大量荧光细胞。 本实验检测了 QD655 体外标记大鼠BMSCs 后的增殖功能、细胞毒性、成骨分化功能、动态标记率,为下一步用于体内实验奠定了实验基础。 ( 4 参考文献 ) ( 1 付霞霏 , 何援利,杨芳, 等 . BrdU, CFSE和GFP标记大鼠间充质干细 胞的比较.第四 军 医大学学报,2008,29(5): 399-402. ) ( 2 卢蓉,张新春, 黄 丹平,等. H oechst33342、BrdU和GFP示踪恒河猴皮肤干细胞的实验研究.中国病理生理杂志,2007 , 23(9):1842-1844. ) ( 3 张瑞平,刘强,李健丁,等.超顺磁性 氧 化铁标记兔BMSCs生物学特 性及MRI成像研究.中国修复重建外科杂志,2009, 2 3(7):851-855. ) ( 4 Liu G, Yang H, Zhang XM, et al . M R imaging for the longevity of mes-enchymal s t em cells l a beled with poly-L-lysine-R e sovist c o mplexes. Contrast Media M ol Imaging, 2010.[ E pub ahead of print] ) ( 5 Rosen A B , Kelly DJ , Schuldt AJ, et al . F i nding fluorescent needles inthe cardiac haystack: t racking h uman mesenchymal stem cells labeled with q uantum dots for quantitative i n vi v o three-dimensional fluores-cence analysis.. Stem Cells, 2007, 2 5(8):2128-213 8 . ) ( 6 Livak J,Schmittgen TD . Analysis of relative gene expression dat a us-ing real-time quantitative PCR and the 2(-Delta Delta C(T)). Method, .2001,25(4):402-408. ) ( 7 陈鹏,刘冰,毛天球.组织工程骨修复颅骨极限缺损种子细胞归宿的探讨.口腔颌面修复学杂志 , 2008(3):161-166. ) ( 8 Loken S , Jakobsen RB, A roen A, et al. Bone marrow m esenchymalstem cells in a hyaluronan s caffold for treatment of an osteochondral defect in a rabbi t model. Knee Surg Sports Traumatol Arthrosc, 2 008, 16(10):896-903. ) ( 9 T u J, Wang H, Li H , et al . The in vivo bon e formation by mesenchymalstem cells i n zein scaffolds. Biomaterials, 2009, 30(26): 4369-4376. ) ( 10 B urns T C, Ortiz-Gonzalez XR, Gutierrez-Perez M , e t al. T hymidine analogs are transferred f r om prelabeled donor to hos t cells in t he cen-tral nervous system after transplantation: a w ord o f caution. S t em Cell, 2006, 24(4): 1 121- 1 127. ) ( 11 Alivisatos P. The u se of nanocrystals i n biological detection. Nat Bio-technol, 2004,22(1):47-52. ) ( 12 Jaiswal JK, M attoussi H , Mauro J, et a l. Long-term m ultiple color im- aging o f live cells using quantum dot bioconjugates. Na t Biotechnol, 2003,21(1):47-51. ) ( 13 Buono C, Anzinger J J, A m ar M, et al. Fluorescent pegylated na n opar- ticles demonstrate f luid-phase pinocytosis by macrophages in m o useatherosclerotic lesions. J Cli n Invest, 2009 , 119(5) : 1373-1381. ) ( 14 Wylie PG. M u ltiple cell lines using quantum do t s. Methods Mol Biol , 2007, 3 74:113-123. ) ( 15 M urasawa S, Kawamoto A, Horii M, e t al. Ni c he-dependent tra n slin- eage c ommitment of endothelial progenitor cel l s, not ce l l fusion ingeneral, into myocardial l i neage cells. Arterioscler T h romb Vasc Biol, 2005,25(7):1388-1394 ) ( 16 Fischer UM, H a rting M T , Jimenez F, et al. P u lmonary passage is amajor obstacle f o r intravenous stem cell delivery: the pu l monary first-pass e ffect. Stem Cells Dev, 2009, 1 8(5): 683-692. ) ( 17 L in S, Xie X, Patel MR, et al . Quantum dot imaging for embryonic stem cells. BMC Biotechnol,2007,7:67. ) ( 18 Medintz IL, Uyeda HT, Goldman ER, et al. Quantum d ot biocon-jugates f or imaging, labelling and sensing. N a t Mater, 20 0 5, 4(6): 435-446. ) ( 19 E strada CR, S alanga M , Bielenberg DR,et al. Behavioral profiling ofhuman t r ansitional cell carcinoma ex vivo. C a ncer R esearch, 2 006, 66(6):3078-3086. ) ( 20 S troh M , Zimmer JP, Duda DG, et a l. Quantum dots spectrally distin- guish multiple species within t h e tumor milieu in vivo. Nat Me d , 2005,11(6):678-682. ) ( 21 Yang K, Li ZG, Cao Y, et al. Effect of peptide-conjugated ne a r-infrared fluorescent quantum dots (NIRF-QDs) on the invasion an d metastasisof h uman t o ngue squamous cel l ca r cinoma cel l line Tc a 8113 in v itro. I nt J Mol Sci, 2009,10(10): 4418-4427. ) ( (收稿:2010-03-03 修回: 2 010-04-10) ) ( (本文编辑:王雁) ) 根据《2009年版中国科技期刊引证报告》(CJCR),我刊在2008年度影响因子为 0.764,总被引频次为1618。在51种外科学类期刊中综合排名位居第5位。 ?China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
确定



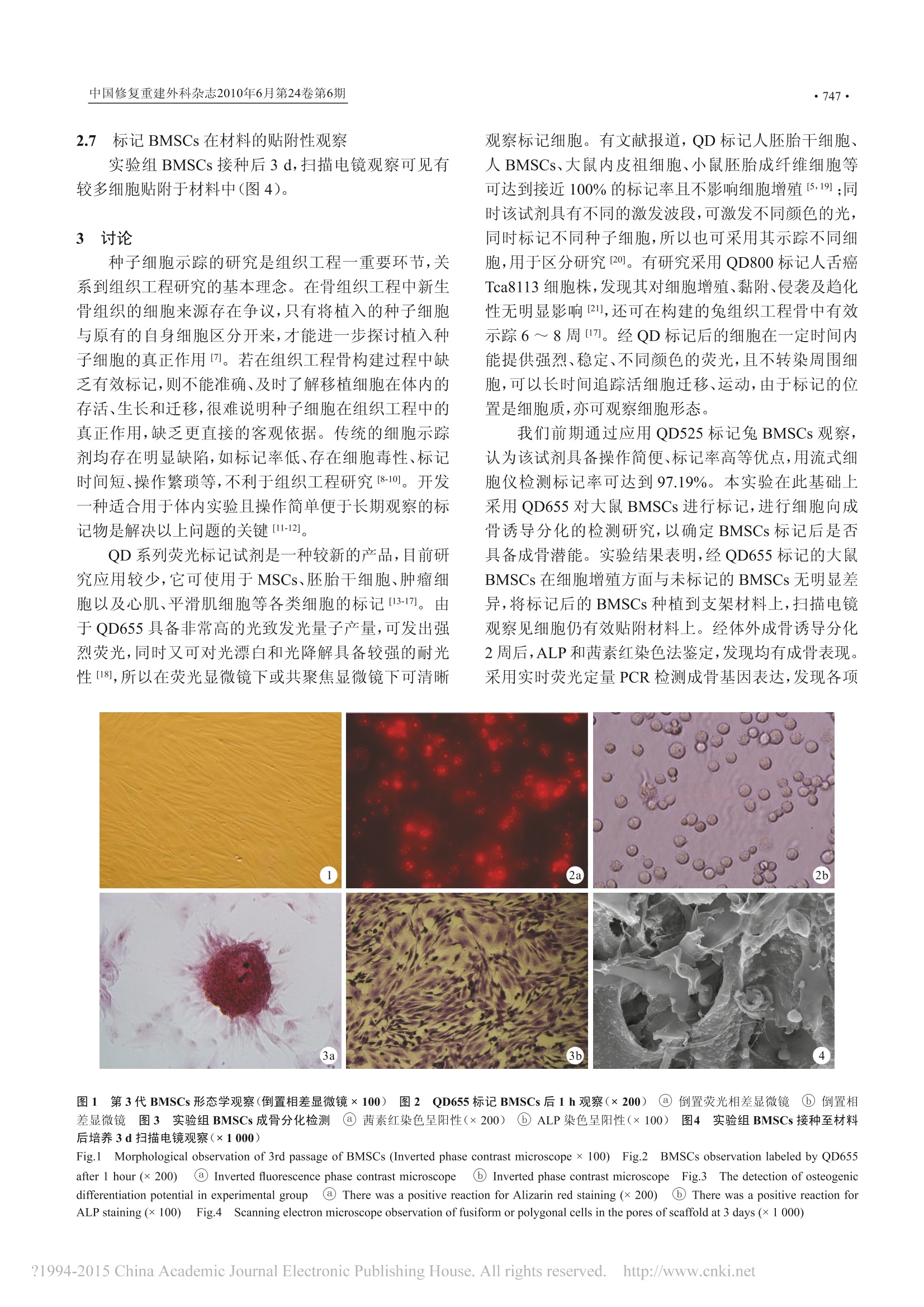

还剩3页未读,是否继续阅读?
海德创业(北京)生物科技有限公司为您提供《荧光微球体外标记大鼠BMSCs的初步研究》,该方案主要用于其他中--检测,参考标准--,《荧光微球体外标记大鼠BMSCs的初步研究》用到的仪器有流式细胞仪校正用荧光微球
相关方案
更多
该厂商其他方案
更多









