
iQue® 高通量流式细胞仪作为一种高通量、多参数、低成本的细胞定量分析工具,为进一步提升CAR-T细胞的构建效率以及治疗反应等提供解决方案。
方案详情

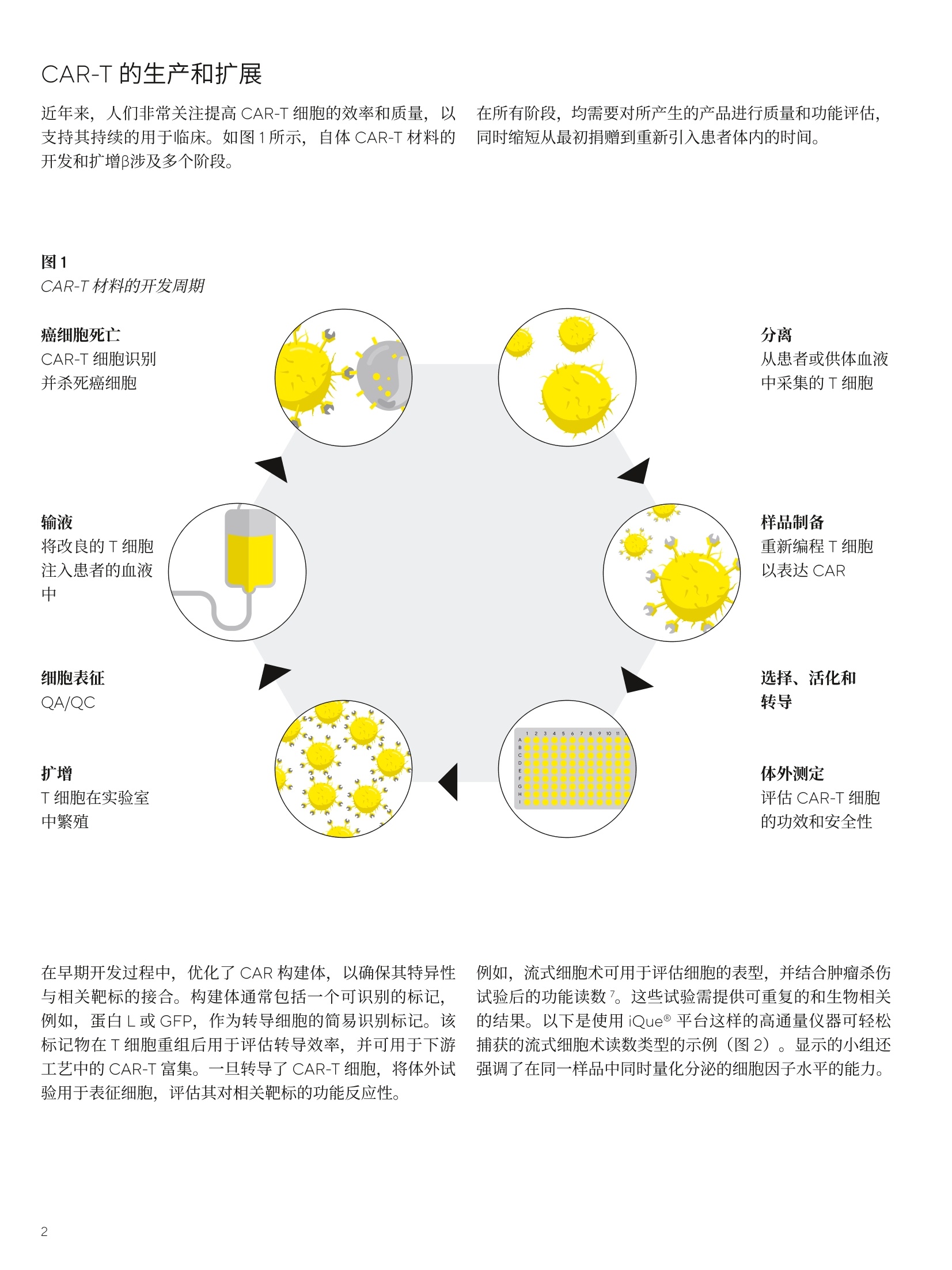
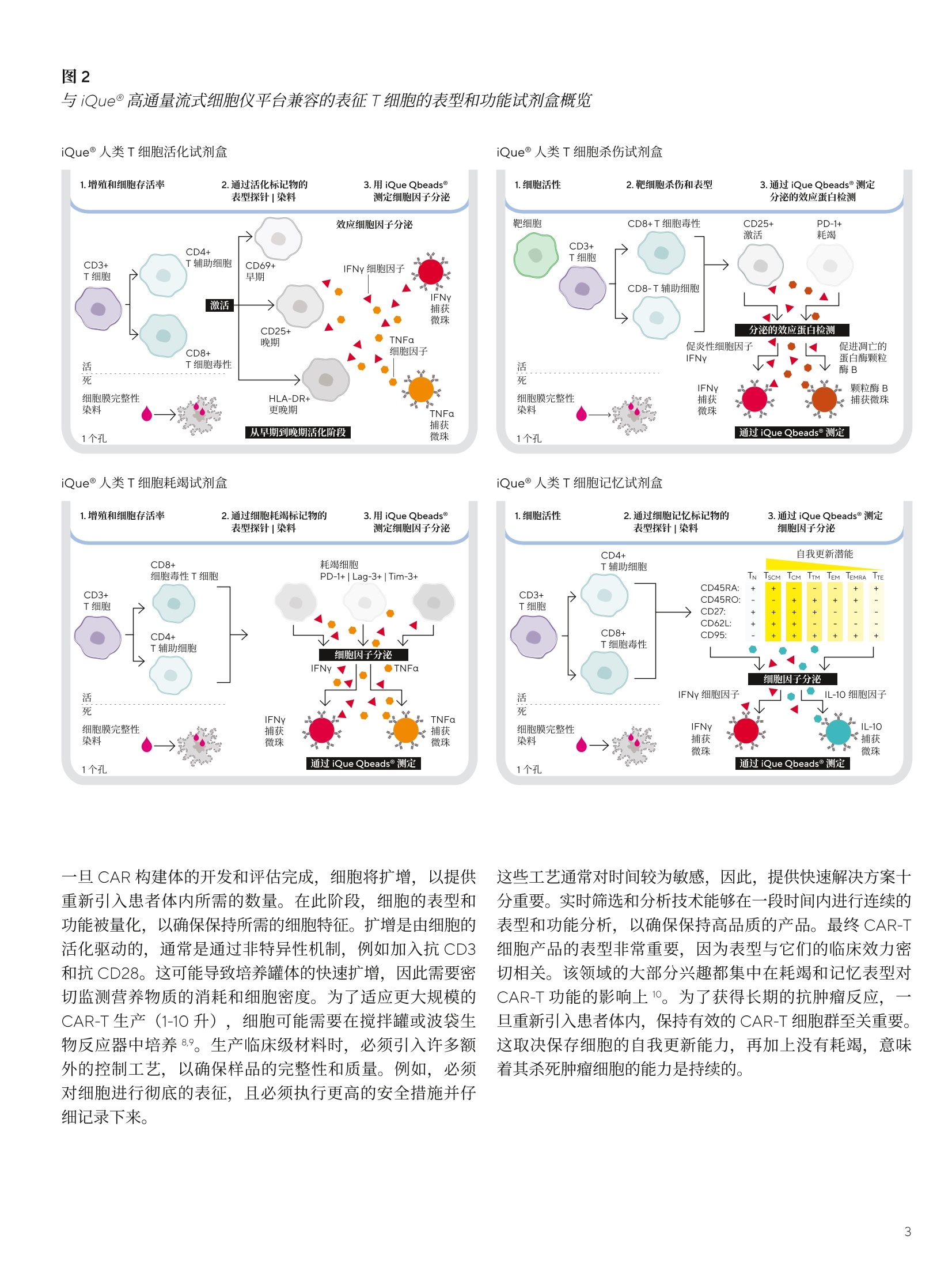
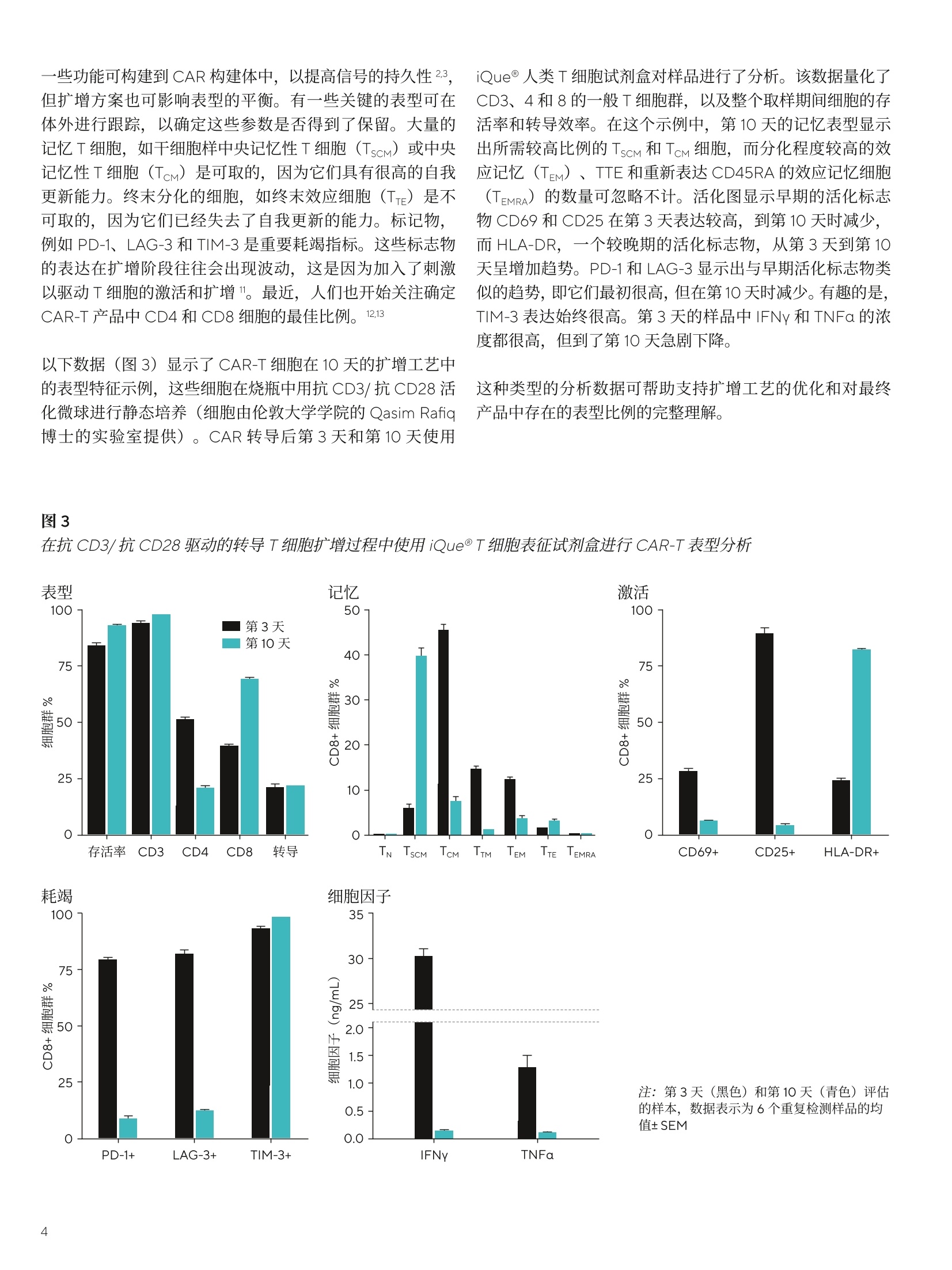
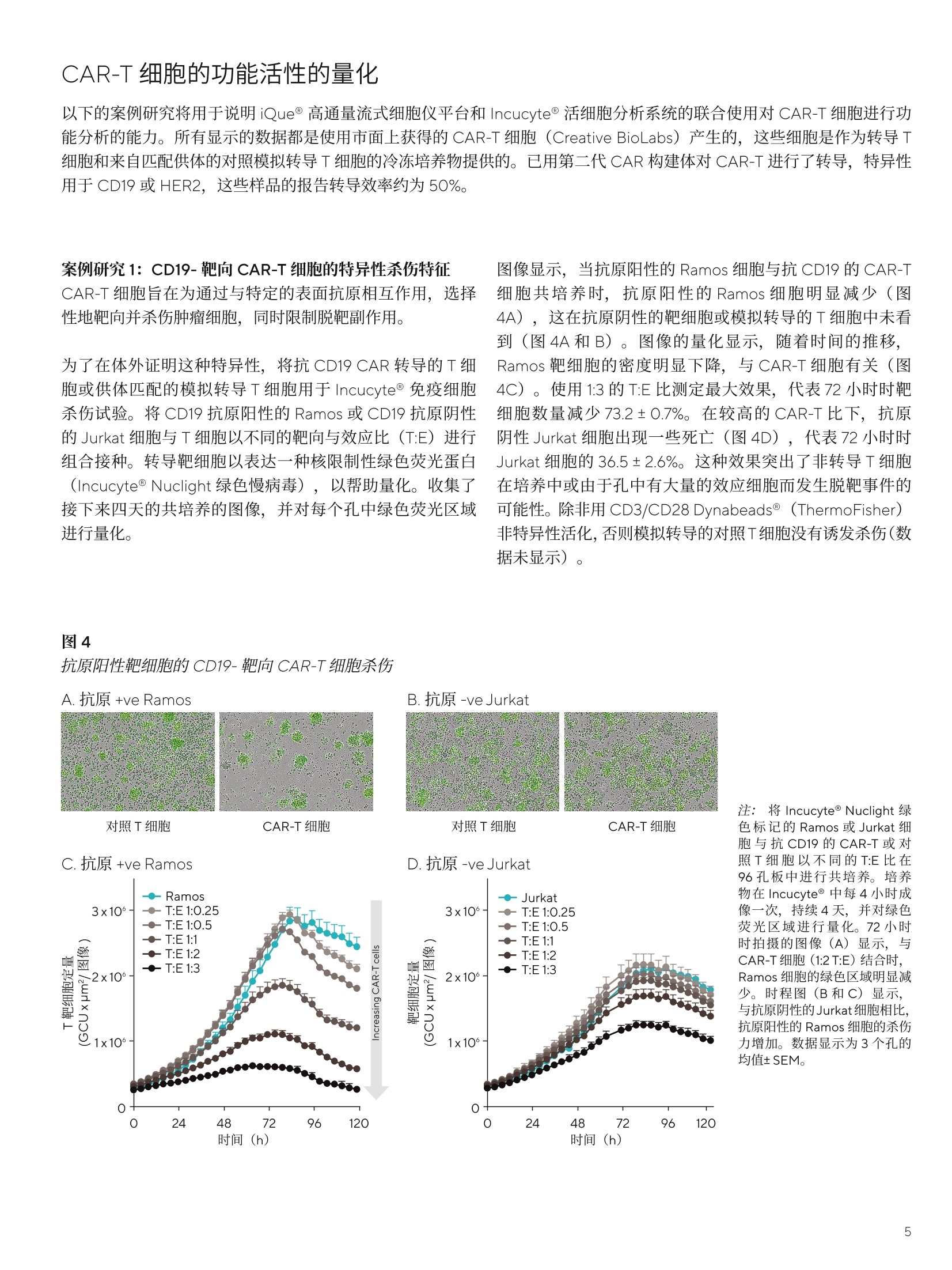
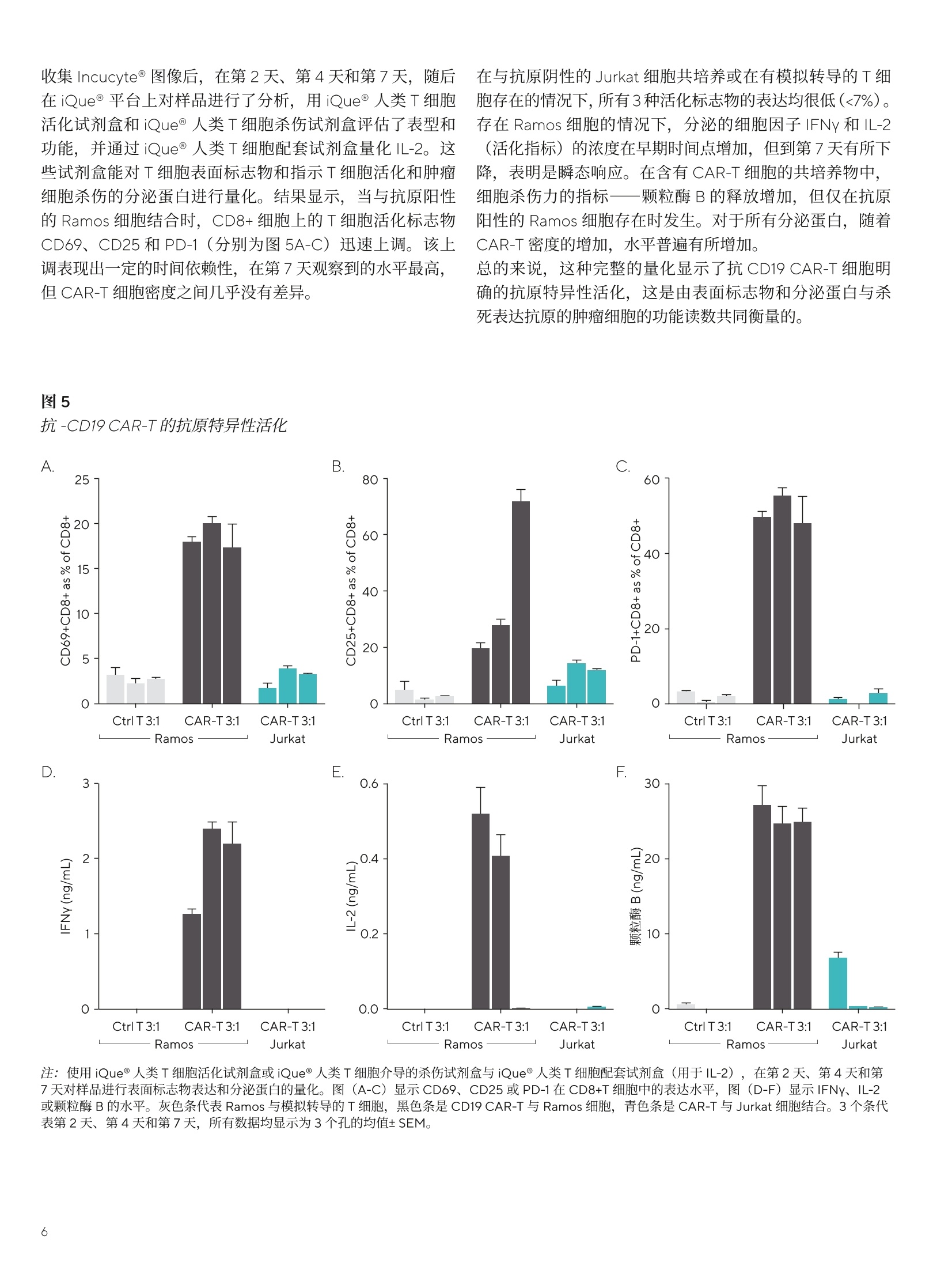
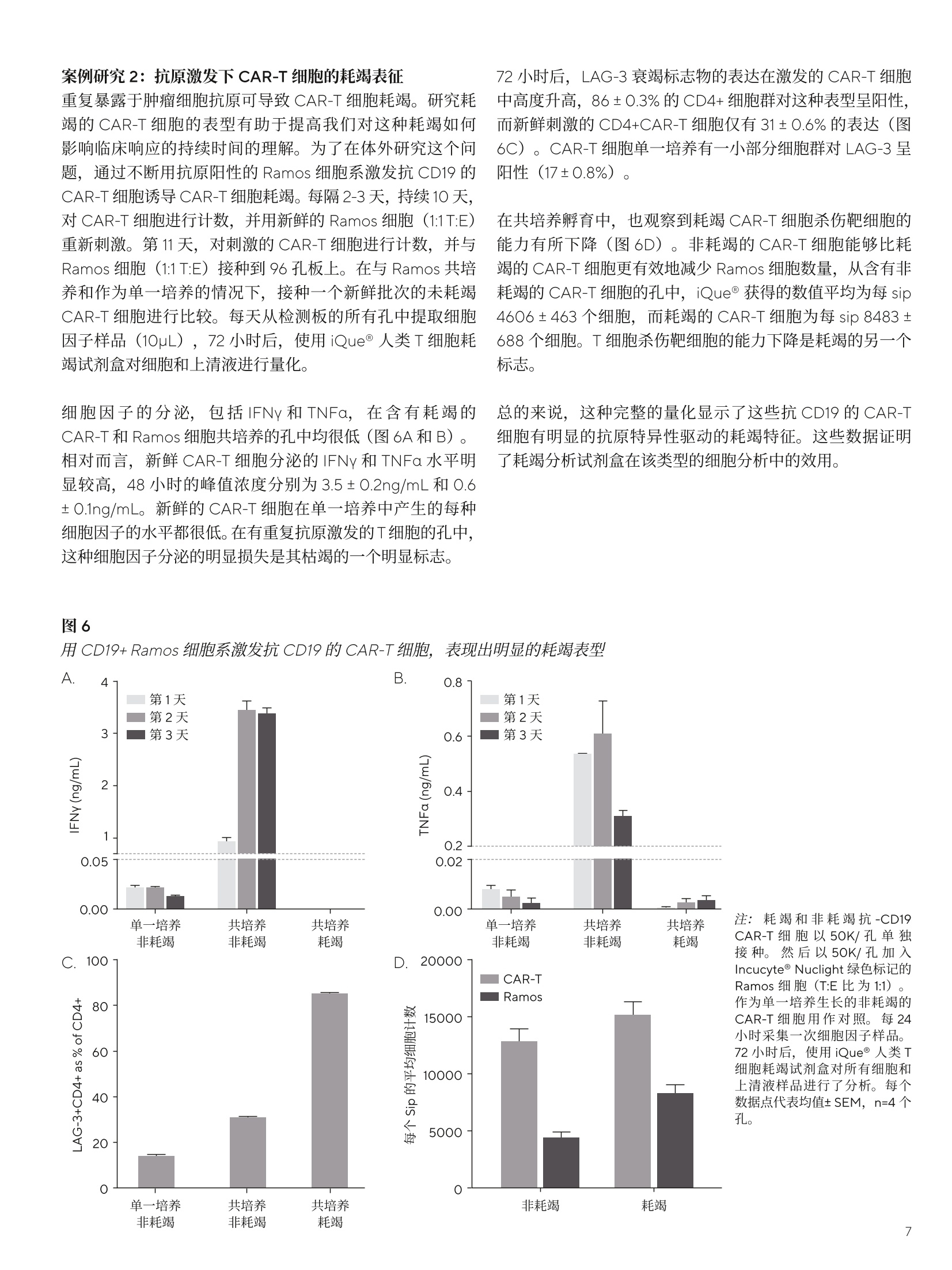
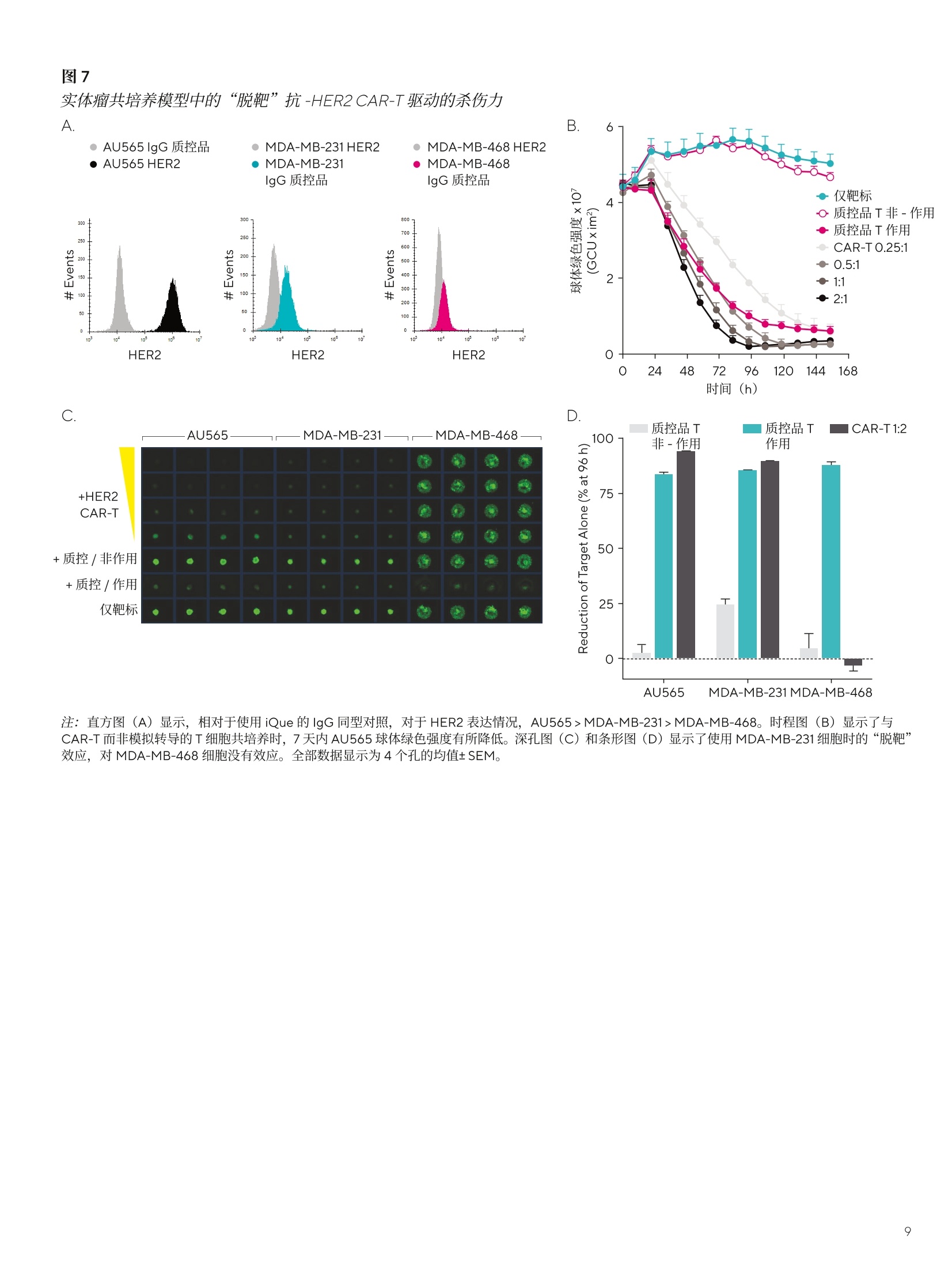
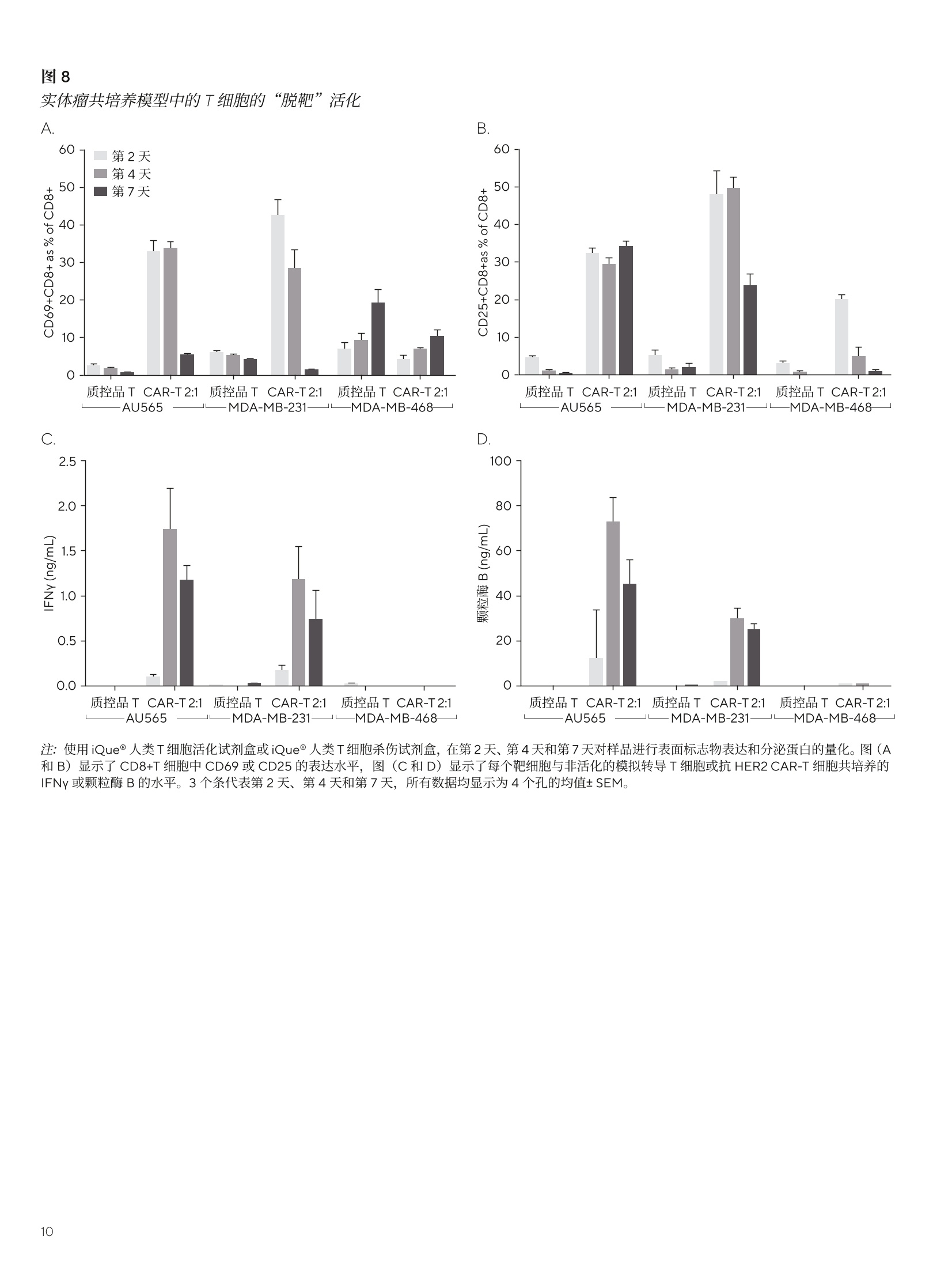
SARTORIUS 总结和结论 关键词或短语: 嵌合抗原受体(CAR)、CAR-T、免疫细胞杀伤、癌症、T细胞疗法、免疫疗法 用先进的流式细胞术和活细胞分析对 CAR-T 细胞进行表型和功能表征 引言 过去几年中,成功使用免疫疗法帮助抗击癌症的范围迅速扩大,许多疗法现已获批用于临床。与传统的化疗策略相比,免疫系统的精确性允许采用更有针对性的方法杀死癌细胞,同时不伤害健康细胞。 一个关键的进展领域是使用基因修饰的细胞疗法,其中嵌合抗原受体(CAR)T细胞的引入在该领域处于领先地位。 CAR 构建体旨在与肿瘤细胞上存在的特异性表面表位或抗原相互作用,一旦接近就能使T细胞杀死肿瘤细胞。当肿瘤细胞上的特定抗原可被识别时, CAR-T 细胞就会显示出靶向作用,并且由于其来自于患者(称为自体疗法),因此没有排斥反应。CD19 靶向 CAR-T细胞疗法,例如 Kymriah@ (Novarits)或 Yescarta@(Kite/Gilead)1,已经对淋巴细胞白血病和非霍奇金淋巴瘤中常见的液体肿瘤取得临床成功。尽管取得了这一进展,障碍仍然存在,例如,对免疫细胞进行表型、分析和纯化的成本很高,技术上也有困难23。而且,虽然一些患者对治疗反应强烈,但其他患者却不适用,揭开这些不同结果的机制基础也是一个活跃的研究领域。近年来,该β研究已经取得进展,探索将 CAR 构建体引入替代免疫细胞,例如CAR-NK 或 CAR-巨噬细包4-6,并研究靶向实体瘤的基因修饰细胞。 本文将谈及生产和扩大细胞治疗产品的工艺,重点是 CAR-T 细胞。将介绍用于表型和评估这些修饰细胞功能的关键体外检测方法,并通过三个案例研究说明 iQue@先进的高通量流式细胞术平台和 Incucyte@活细胞分析系统 (Sartorius) 的效用。 近年来,人们非常关注提高 CAR-T 细胞的效率和质量,,以支持其持续的用于临床。如图1所示,[自体 CAR-T材料的开发和扩增β涉及多个阶段。 在所有阶段,均需要对所产生的产品进行质量和功能评估,同时缩短从最初捐赠到重新引入患者体内的时间。 图1 CAR-T材料的开发周期 在早期开发过程中,优化了 CAR 构建体,,以确保其特异性与相关靶标的接合。构建体通常包括一个可识别的标记,例如,蛋白L或 GFP, 作为转导细胞的简易识别标记。该标记物在T细胞重组后用于评估转导效率,并可用于下游工艺中的 CAR-T富集。一旦转导了 CAR-T 细胞,将体外试验用于表征细胞,评估其对相关靶标的功能反应性。 例如,流式细胞术可用于评估细胞的表型,并结合肿瘤杀伤试验后的功能读数7。这些试验需提供可重复的和生物相关的结果。以下是使用 iQue@平台这样的高通量仪器可轻松捕获的流式细胞术读数类型的示例(图2)。显示的小组还强调了在同一样品中同时量化分泌的细胞因子水平的能力。 与iQue@高通量流式细胞仪平台兼容的表征T细胞的表型和功能试剂盒概览 iQue@人类T细胞耗竭试剂盒 一旦 CAR 构建体的开发和评估完成,细胞将扩增,以提供重新引入患者体内所需的数量。在此阶段,细胞的表型和功能被量化,以确保保持所需的细胞特征。扩增是由细胞的活化驱动的,通常是通过非特异性机制,例如加入抗 CD3和抗 CD28。这可能导致培养罐体的快速扩增,因此需要密切监测营养物质的消耗和细胞密度。为了适应更大规模的CAR-T 生产 (1-10升),细胞可能需要在搅拌罐或波袋生物反应器中培养8.9。生产临床级材料时,必须引入许多额外的控制工艺,以确保样品的完整性和质量。例如,必须对细胞进行彻底的表征,且必须执行更高的安全措施并仔细记录下来。 iQue@人类T细胞杀伤试剂盒 iQue@人类T细胞记忆试剂盒 这些工艺通常对时间较为敏感,因此,提供快速解决方案十分重要。实时筛选和分析技术能够在一段时间内进行连续的表型和功能分析,以确保保持高品质的产品。最终 CAR-T细胞产品的表型非常重要,因为表型与它们的临床效力密切相关。该领域的大部分兴趣都集中在耗竭和记忆表型对CAR-T功能的影响上1。为了获得长期的抗肿瘤反应,旦重新引入患者体内,保持有效的 CAR-T 细胞群至关重要。这取决保存细胞的自我更新能力,再加上没有耗竭,意味着其杀死肿瘤细胞的能力是持续的。 一些功能可构建到 CAR构建体中,以提高信号的持久性23,但扩增方案也可影响表型的平衡。有一些关键的表型可在体外进行跟踪,以确定这些参数是否得到了保留。大量的记忆T细胞,如干细胞样中央记忆性T细胞(TscM) 或中央记忆性T细胞(TcM)是可取的,因为它们具有很高的自我更新能力。终末分化的细胞,如终末效应细胞(TTe)是不可取的,因为它们已经失去了自我更新的能力。标记物,例如 PD-1、LAG-3 和 TIM-3是重要耗竭指标。这些标志物的表达在扩增阶段往往会出现波动,这是因为加入了刺激以驱动T细胞的激活和扩增“。最近,人们也开始关注确定CAR-T 产品中 CD4和 CD8细胞的最佳比例。12.13 以下数据(图3)显示了 CAR-T细胞在10天的扩增工艺中的表型特征示例,这些细胞在烧瓶中用抗 CD3/抗 CD28活化微球进行静态培养(细胞由伦敦大学学院的 Qasim Rafig博士的实验室提供)。CAR 转导后第3天和第10天使用 iQue@人类T细胞试剂盒对样品进行了分析。该数据量化了CD3、4和8的一般T细胞群,以及整个取样期间细胞的存活率和转导效率。在这个示例中,第10天的记忆表型显示出所需较高比例的 TscM 和 TcM细胞,而分化程度较高的效应记忆(TeM)、TTE 和重新表达 CD45RA 的效应记忆细胞(TEMRA)的数量可忽略不计。活化图显示早期的活化标志物 CD69 和 CD25在第3天表达较高,到第10天时减少,而 HLA-DR,一个较晚期的活化标志物,从第3天到第10天呈增加趋势。PD-1和 LAG-3显示出与早期活化标志物类似的趋势,即它们最初很高,但在第10天时减少。有趣的是,TIM-3表达始终很高。第3天的样品中IFNy 和 TNFa 的浓度都很高,但到了第10天急剧下降。 这种类型的分析数据可帮助支持扩增工艺的优化和对最终产品中存在的表型比例的完整理解。 在抗 CD3/抗 CD28驱动的转导T细胞扩增过程中使用 iQueT细胞表征试剂盒进行 CAR-T表型分析 CAR-T细胞的功能活性的量化 以下的案例研究将用于说明iQue@高通量流式细充仪平台和 Incucyte@活细胞分析系统的联合使用对 CAR-T 细胞进行功能分析的能力。所有显示的数据都是使用市面上获得的 CAR-T 细胞 (Creative BioLabs) 产生的,这些细胞是作为转导T细胞和来自匹配供体的对照模拟转导T细胞的冷冻培养物提供的。。已用第二代 CAR 构建体对 CAR-T进行了转导,特异性用于 CD19 或 HER2, 这些样品的报告转导效率约为50%。 案例研究1: CD19-靶向 CAR-T细胞的特异性杀伤特征CAR-T 细胞旨在为通过与特定的表面抗原相互作用,选择性地靶向并杀伤肿瘤细胞,同时限制脱靶副作用。 为了在体外证明这种特异性,将抗 CD19 CAR 转导的T细胞或供体匹配的模拟转导T细胞用于 Incucyte@免疫细胞杀伤试验。将 CD19 抗原阳性的 Ramos 或 CD19 抗原阴性的 Jurkat 细胞与T细胞以不同的靶向与效应比(T:E)进行组合接种。转导靶细胞以表达一种核限制性绿色荧光蛋白(Incucyte@ Nuclight 绿色慢病毒),以帮助量化。收集了接下来四天的共培养的图像,并对每个孔中绿色荧光区域进行量化。 图像显示,当抗原阳性的 Ramos 细胞与抗 CD19 的 CAR-T细胞共培养时,抗原阳性的 Ramos 细胞明显减少(图4A),这在抗原阴性的靶细胞或模拟转导的T细胞中未看到(图4A和B)。图像的量化显示,随着时间的推移,Ramos 靶细胞的密度明显下降,与 CAR-T细胞有关(图4C)。使用1:3的T:E比测定最大效果,代表72小时时靶细胞数量减少73.2±0.7%。在较高的CAR-T比下,抗原阴性 Jurkat 细胞出现一些死亡(图4D),代表72小时时Jurkat 细胞的36.5±2.6%。这种效果突出了非转导T细胞在培养中或由于孔中有大量的效应细胞而发生脱靶事件的可能性。除非用 CD3/CD28 Dynabeads (ThermoFisher)非特异性活化,否则模拟转导的对照T细胞没有诱发杀伤(数据未显示)。 图4 抗原阳性靶细胞的 CD19-靶向 CAR-T细胞杀伤 注:将Incucyte@ Nuclight 绿色标记的 Ramos 或 Jurkat 细胞与抗 CD19的 CAR-T或对照T细胞以不同的T:E比在96孔板中进行共培养。培养物在Incucyte@中每4小时成像一次,持续4天,并对绿色荧光区域进行量化。72小时时拍摄的图像(A)显示,与CAR-T细胞(1:2T:E)结合时,Ramos 细胞的绿色区域明显减少。时程图(B和C)显示,与抗原阴性的Jurkat 细胞相比,抗原阳性的 Ramos 细胞的杀伤力增加。数据显示为3个孔的均值±SEM。 收集 Incucyte@图像后,在第2天、第4天和第7天,随后在iQue@平台上对样品进行了分析,用iQue@人类T细胞活化试剂盒和iQue@人类T细胞杀伤试剂盒评估了表型和功能,并通过iQue@人类T细胞配套试剂盒量化IL-2。这些试剂盒能对T细胞表面标志物和指示T细胞活化和肿瘤细胞杀伤的分泌蛋白进行量化。结果显示,,当与抗原阳性的 Ramos 细胞结合时, CD8+细胞上的T细胞活化标志物CD69、CD25和PD-1(分别为图5A-C)迅速上调。该上调表现出一定的时间依赖性,在第7天观察到的水平最高,但 CAR-T 细胞密度之间几乎没有差异。 在与抗原阴性的 Jurkat 细胞共培养或在有模拟转导的T细胞存在的情况下,所有3种活化标志物的表达均很低(<7%)。存在 Ramos 细胞的情况下,分泌的细胞因子 IFNy 和IL-2(活化指标)的浓度在早期时间点增加,但到第7天有所下降,表明是瞬态响应。在含有 CAR-T 细胞的共培养物中,细胞杀伤力的指标——颗粒酶B的释放增加,但仅在抗原阳性的 Ramos 细胞存在时发生。对于所有分泌蛋白,随着CAR-T密度的增加,水平普遍有所增加。总的来说,这种完整的量化显示了抗 CD19 CAR-T 细胞明 确的抗原特异性活化,这是由表面标志物和分泌蛋白与杀死表达抗原的肿瘤细胞的功能读数共同衡量的。 图5 抗 -CD19 CAR-T 的抗原特异性活化 案例研究2:抗原激发下 CAR-T 细胞的耗竭表征 重复暴露于肿瘤细胞抗原可导致 CAR-T 细胞耗竭。研究耗竭的 CAR-T细胞的表型有助于提高我们对这种耗竭如何影响临床响应的持续时间的理解。为了在体外研究这个问题,通过不断用抗原阳性的 Ramos 细胞系激发抗 CD19 的CAR-T 细胞诱导 CAR-T 细胞耗竭。每隔2-3天,持续10天,对 CAR-T细胞进行计数,并用新鲜的 Ramos 细胞 (1:1T:E)重新刺激。第11天,对刺激的 CAR-T 细胞进行计数,并与Ramos细胞(1:1T:E)接种到96孔板上。在与 Ramos 共培养和作为单一培养的情况下,接种一个新鲜批次的未耗竭CAR-T细胞进行比较。每天从检测板的所有孔中提取细胞因子样品(10uL),72小时后,使用iQue@人类T细胞耗竭试剂盒对细胞和上清液进行量化。 细胞因子的分泌,包括 IFNy 和 TNFa, 在含有耗竭的CAR-T 和 Ramos 细胞共培养的孔中均很低(图6A和B)。相对而言,新鲜 CAR-T 细胞分泌的 IFNy和 TNFa水平明显较高,48小时的峰值浓度分别为3.5±0.2ng/mL 和0.6±0.1ng/mL。新鲜的 CAR-T 细胞在单一培养中产生的每种细胞因子的水平都很低。在有重复抗原激发的T细胞的孔中,这种细胞因子分泌的明显损失是其枯竭的一个明显标志。 72小时后, LAG-3衰竭标志物的表达在激发的 CAR-T 细胞中高度升高,86±0.3%的 CD4+细胞群对这种表型呈阳性,而新鲜刺激的 CD4+CAR-T细胞仅有31±0.6%的表达(图6C)。CAR-T细胞单一培养有一小部分细胞群对LAG-3呈阳性(17±0.8%)。 在共培养孵育中,也观察到耗竭 CAR-T 细胞杀伤靶细胞的能力有所下降(图6D)。非耗竭的 CAR-T 细胞能够比耗竭的 CAR-T细胞更有效地减少 Ramos 细胞数量,从含有非耗竭的 CAR-T 细胞的孔中, iQue@获得的数值平均为每 sip4606±463个细胞,而耗竭的 CAR-T 细胞为每 sip 8483+688个细胞。T细胞杀伤靶细胞的能力下降是耗竭的另一个标志。 总的来说,这种完整的量化显示了这些抗 CD19的 CAR-T细胞有明显的抗原特异性驱动的耗竭特征。这些数据证明了耗竭分析试剂盒在该类型的细胞分析中的效用。 用CD19+ Ramos 细胞系激发抗 CD19 的 CAR-T细胞,表现出明显的耗竭表型 案例研究3: HER2 CAR-T 免疫细胞杀伤表征实体瘤杀伤和“脱靶” 在抗 CD19 的 CAR-T疗法治疗液体肿瘤取得临床成功后,人们对将类似疗法应用于实体瘤的兴趣越来越大,例如,在抗击乳腺癌方面。这一领域的一个明显的目标是 HER2(ERBB2)受体,其已被确认在许多乳腺癌中过表达。不幸的是,在早期试验中,临床上出现了与“脱靶”效应有关的严重不良事件,进一步的试验被停止14.15。有人指出,CAR 细胞已经攻击了全身表达低水平 HER2 表位的其他“非肿瘤”细胞,因此被定义为“靶向”。文献中还有证据表明,CAR-T与 HER2抗原相互作用的亲和力也可以促成该效应16 为了在体外模拟潜在的“脱靶”效应,用抗 HER2的CAR-T 细胞进行球状细胞共培养,以模拟实体瘤的免疫杀伤。三个细胞系的 HER2表达情况(图7A)显示了相对于IgG同型对照的表达水平谱。AU565 显示了 HER2的最高表达(减去IgG 背景后的中位荧光强度(MFI)为1x106)。MDA-MB-231,通常用作三阴性对照线,在我们的实验中显示了相对于 IgG的非常低的表达水平 (MFI11x10),而MDA-MB-468显示了极轻微的表达 (MFI 4.2x103)。 对这三个细胞系进行基因编辑,F,以表达核限制性绿色荧光蛋白(Incucyte@ Nuclight绿色慢病毒),并接种到超低附着力(ULA)平板中,并在存在 Matrigel@((1.25%)的情况下让其在3天内形成单球体。 一旦形成,将抗 HER2CAR-T细胞或模拟转导的对照T细胞以不同的T:E 比加入孔中。在 Incucyte@中对球体进行了7天的成像,并对绿色荧光强度进行了量化,以衡量球体的健康情况。 高表达AU565 细胞的结果表明, CAR-T细胞驱动的绿色荧光明显减少(图7B),表明球体死亡(与单独靶细胞相比,96小时减少了96%)。除非存在 CD3/CD28Dynabeads@,否则用非活化、模拟转导的T细胞未测定到死亡。当使用低水平表达的 MDA-MB-231细胞时,抗HER2 的 CAR-T 细胞也有很强的杀力力,表明有“脱靶”效应(图7C和D)。对MDA-MB-231的效应可在两个独立的CAR-T细胞制剂中看到,并与以前报道的抗HER2CAR-T 数据相一致16。测定的杀伤力范围与 AU565 细胞的杀伤力相似(96小时时减少了91%)。使用MDAMB-468靶细胞时,该靶细胞具有极轻度的 HER2 表达,未测定到CAR-T驱动的死亡(图7C和D)。 如之前的示例中,在第2天、第4天和第7天,在iQue@平台上对样品进行了分析。收集上清液进行分泌蛋白分析,然后轻轻分离培养培以去除 Matrigel@并打破球体。使用iQue@人类T细胞活化试剂盒和iQue@人类T细胞杀伤试剂盒对样品进行表型和功能评估。结果显示, AU565和MDA-MB-231 与抗 HER2 的 CAR-T细胞共培养时, CD8+细胞群的CD69 和 CD25 活化标志物都有所增加(图8A和B)。存在模拟转导T细胞时,不存在该效应。与对照组T细胞相比, MDA-MB-468 细胞的 CD69没有变化, CD25的水平较低,到第4天时有所下降。使用作为试剂盒一部分的iQue Qbeads@检测,评估上清液的 IFNy 和颗粒酶B水平。AU565和MDA-MB-231 CAR-T 共培养物再次显示了这两种蛋白的高水平,而在MDA-MB-468共培养孔中未检测到。 活细胞分析和流动数据均居明,在与高表达 AU565 和低表达MDAMB-231细胞共培养时,抗 HER2 CAR-T 驱动的T细胞杀伤或活化情况,表明这些细胞有可能产生“脱靶”效应。在存在 MDA-MB-468 细胞的情况下缺乏活性,这表明了抗 HER2 CAR-T 细胞的预期特异性。在试验的2D单层中观察到类似数据(数据未显示)。 图7 实体瘤共培养模型中的“脱靶”抗-HER2 CAR-T驱动的杀伤力A D 注:直方图(A)显示,相对于使用 iQue 的 IgG同型对照,对于 HER2 表达情况, AU565>MDA-MB-231>MDA-MB-468。时程图(B)显示了与CAR-T 而非模拟转导的T细胞共培养时,7天内AU565 球体绿色强度有所降低。深孔图(C)和条形图(D) 显示了使用 MDA-MB-231细胞时的“脱靶”效应,对 MDA-MB-468 细胞没有效应。全部数据显示为4个孔的均值±SEM。 实体瘤共培养模型中的T细胞的“脱靶”活化 注:使用iQue人类T细胞活化试剂盒或iQue@人类T细胞杀伤试剂盒,在第2天、第4天和第7天对样品进行表面标志物表达和分泌蛋白的量化。图(A和B)显示了 CD8+T 细胞中 CD69 或 CD25 的表达水平,图(C和D)显示了每个靶细胞与非活化的模拟转导T细胞或抗 HER2 CAR-T细胞共培养的IFNy 或颗粒酶 B的水平。3个条代表第2天、第4天和第7天,所有数据均显示为4个孔的均值±SEM。 先进细胞疗法的使用正在迅速发展,人们越来越关注提高用于临床的细胞生产效率。开发的重点是改善构建体的寿命、选择性、生产并交付给患者。转而使用异体、现成的产品的可能性为临床提供了许多潜在的好处,如降低生产成本,改善细胞的长期储存,以及提高大批产品的一致性。如前所述, CAR-NK 细胞领域的开发正在进行中,其具有 HLA无关疗法的优点,对潜在的异体疗法具有吸引力。 本白皮书中分享的数据示例表明,在开发和表征T细胞疗法时,使用活细胞分析和高通量流式细胞仪可增加价值。这些技术在细胞产品的开发和扩增的多个阶段有价值,并可应用于多种细胞类型。 ( 作者要感谢 Qasim Rafig 博士(伦敦大学学院)和他的团队提供了本研究中部分使用的 CAR-T 细胞。此外,他们还要感谢赛多利斯公司的 AT 团队对 UCL 合作的管理。 ) ( 1 . H an D, Xu Z, Zhuang Y, Ye Z, Qian QJ. Current Progressin CAR-T Cell T h e rapy for Hematological Malignancies. Cancer.2021;12(2):326-334. ) ( 2. Hardy IR, Schamel WW, B a euerle PA, Getts DR, Hofmeister R. Implications of T c e ll receptor biology onthe development of new T cell therapies for cancer. Immunotherapy. 2020 Jan;12(1):89-103. ) ( 3. Gomes-Silva D, Ramos CA. CancerImmunotherapyUsing CAR-T Cells: From the Research Bench to the Assembly Line. BiotechnolJ.2018 Feb;13(2):10. 1 002. ) ( 4. C ( henY, Yu Z, Tan X, et al. CAR-macrophage:A newimmunotherapy candidate against solid tumors. Biomedicine and Pharmacotherapy. 2021;139:111605. ) ( 5. Wrona E, Borowiec M, Potemski P. CAR-NK Cells in the T reatment of Solid T umors. Int.J.Mol. Sci. 2021;22(11):5899. ) ( 6. G ( ongY, K l ein Wolterink RGJ, Wang J, Bos G, Germeraad W. Chimeric antigen receptor natural killer (CAR-NK) cell design and engineering for cancer therapy. JHemato/Oncol. 2021;14(1):73. ) ( 7. Martinez EM, Klebanoff SD, Secrest S, et al.High-Throughput Flow Cytometric Method for the Simultaneous Measurement of CAR-T Cell Characterization and C y totoxicity against Solid Tumor Cell Lines. SLAS Discov. 2018 Aug;23(7):603-612. ) ( .8. Costariol E, Rotondi M , AminiA, et al. Establishing thescalable manufacture of primary human T- c ells in anautomated stirred-tank bioreactor. Biotechnol Bioeng. 2019;16:2488-2502. ) ( 9 . Costariol E,Rotondi MC, AminiA, et al. Demonstrating the Manufacture of Human CAR-T Cells in anAutomated Stirred-Tank Bioreactor. Biotechnol.J. 2020;15(9):e2000177. ) 10.McLellan AD, Rad SMAH. Chimeric antigen receptorT cell persistence and memory cell formation.Immuno/Cell Biol. 2019 Aug;97(7):664-674. 11. Gargett T, Yu W, Dotti G, et al.GD2-specific CART CellsUndergo Potent Activation and Deletion Following.Antigen Encounter but can be Protected FromActivation-induced Cell Death by PD-1Blockade.Mol Ther.2016Jun;24(6):1135-1149. 12. Stock S, Schmitt M, Sellner L.Optimizing ManufacturingProtocols of Chimeric Antigen ReceptorT Cells forImproved Anticancer Immunotherapy. Int JMo/Sci. 2019Dec10;20(24):6223. 13.Turtle CJ,Hanafi LA, Berger C, et al.CD19 CAR-T cells ofdefined CD4+:CD8+ composition in adult B cell ALLpatients. J Clin Invest. 2016 Jun 1;126(6):2123-38 ( 14. Morgan RA, Yang JC, Kitano M, Dudley ME, Laurencot CM,Rosenberg SA. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mo/ Ther. 2010 Apr;18(4):843-51. ) 15. Antoine P, MaherJ. Developing a safe and effective CART-cell immunotherapy for breast cancer: progress andpitfalls. Breast Cancer Management. 2020;9(3):1758-1923. 16. Liu X, Jiang S, Fang C, et al. Affinity-Tuned ErbB2 orEGFR Chimeric Antigen Receptor T Cells Exhibit anIncreased Therapeutic Index against Tumors in Mice.Cancer Res. 2015 Sep 1;75(17):3596-607 销售与服务联系方式 服务热线 400 920 9889|800 820 9889邮箱 lab.cn@sartorius.com 更多联系信息,请访问www.sartorius.com.cn 赛多利斯(上海)贸易有限公司上海市浦东新区盛荣路 388 弄百佳通产业园3号楼,7-11层, 200120电话 +86 21 6066 6100 技木规格如有变更,恕不另行通知。赛多利斯保留最终解释权和修改权。版本06|2022 了解更多: www.sartorius.com 过去几年中,成功使用免疫疗法帮助抗击癌症的范围迅速扩大,许多疗法现已获批用于临床。其中嵌合抗原受体(CAR)T细胞的引入在该领域处于领先地位。CAR构建体旨在与肿瘤细胞上存在的特异性表面表位或抗原相互作用,一旦接近就能使T细胞杀死肿瘤细胞,同时不伤害健康细胞。当肿瘤细胞上的特定抗原可被识别时,CAR-T细胞就会显示出靶向作用,并且由于其来自于患者自身(称为自体疗法),因此没有排斥反应。CD19靶向CAR-T细胞疗法,例如Kymriah®(Novarits)或Yescarta®(Kite/Gilead),已经在淋巴细胞白血病和非霍奇金淋巴瘤等常见的液体肿瘤治疗中取得临床成功。如图1所示,自体CAR-T材料的开发和扩增涉及多个阶段。在所有阶段,均需要对所产生的产品进行质量和功能评估,同时最大程度地缩短从最初捐赠到重新引入患者体内的时间。图1. CAR-T流程图解iQue® 高通量流式细胞仪作为一种高通量、多参数、低成本的细胞定量分析工具,为进一步提升CAR-T细胞的构建效率以及治疗反应等提供解决方案。接下来,我们通过两个案例分享一下iQue® 3高通量流式细胞仪是如何助力CAR-T细胞表征的吧!应用案例1CD19-靶向CAR-T细胞的特异性杀伤特征CAR-T细胞具备特异性杀伤功能。为了在体外证明这种特异性,首先将抗CD19 CAR转导的T细胞或供体匹配的模拟转导T细胞用于Incucyte® 免疫细胞杀伤试验。在收集图像的同时,分别于第2天、第4天和第7天取样,在iQue® 高通量流式细胞仪上利用iQue® 人类T细胞活化试剂盒和iQue®人类T细胞杀伤试剂盒评估了表型和功能,并通过iQue® 人类T细胞配套试剂盒量化细胞因子IL-2。这些试剂盒能对T细胞表面标志物和指示T细胞活化和肿瘤细胞杀伤的分泌蛋白进行量化。结果显示,当与抗原阳性的Ramos细胞结合时,CD8+细胞上的T细胞活化标志物CD69、CD25和PD-1(分别为图2A-C)迅速上调。该上调表现出一定的时间依赖性,在第7天观察到的水平最高,但CAR-T细胞密度之间几乎没有差异。在与抗原阴性的Jurkat细胞共培养或在有模拟转导的T细胞存在的情况下,所有3种活化标志物的表达均很低(<7%)。存在Ramos细胞的情况下,分泌的细胞因子IFNγ和IL-2(活化指标)的浓度在早期时间点增加,但到第7天有所下降,表明是瞬态响应。在含有CAR-T细胞的共培养物中,细胞杀伤力的指标——颗粒酶B的释放增加,但仅在抗原阳性的Ramos细胞存在时发生。对于所有分泌蛋白,随着CAR-T密度的增加,水平普遍有所增加。总的来说,这种完整的量化分析结果显示了抗CD19 CAR-T细胞明确的抗原特异性活化,这是由表面标志物和分泌蛋白与杀死表达抗原的肿瘤细胞的功能指标共同判定的。图2. 抗-CD19 CAR-T的抗原特异性活化应用案例2抗原激发下CAR-T细胞的耗竭表征重复暴露于肿瘤细胞抗原可导致CAR-T细胞耗竭。研究耗竭的CAR-T细胞的表型有助于提高我们对这种耗竭如何影响临床响应的持续时间的理解。为了在体外研究这个问题,通过不断用抗原阳性的Ramos细胞系激发抗CD19的CAR-T细胞诱导CAR-T细胞耗竭。每隔2-3天,持续10天,对CAR-T细胞进行计数,并用新鲜的Ramos细胞(1:1 T:E)重新刺激。第11天,对刺激的CAR-T细胞进行计数,并与Ramos细胞(1:1 T:E)接种到96孔板上。在与Ramos共培养和作为单一培养的情况下,接种一个新鲜批次的未耗竭CAR-T细胞进行比较。每天从检测板的所有孔中提取细胞因子样品(10 μL),72小时后,使用iQue®人类T细胞耗竭试剂盒对细胞和上清液进行量化。结果如图3所示。图3. CD19+ Ramos细胞系激发抗-CD19的CAR-T细胞表现出明显的耗竭表型细胞因子的分泌,包括IFNγ和TNFα,在含有耗竭的CAR-T和Ramos细胞共培养的孔中均很低(图3A和B)。相对而言,新鲜CAR-T细胞分泌的IFNγ和TNFα水平明显较高,48小时的峰值浓度分别为3.5±0.2 ng/mL和0.6±0.1 ng/mL。新鲜的CAR-T细胞在单一培养中产生的每种细胞因子的水平都很低。在有重复抗原激发的T细胞的孔中,这种细胞因子分泌的明显损失是其枯竭的一个明显标志。72小时后,LAG-3衰竭标志物的表达在激发的CAR-T细胞中高度升高,86±0.3%的CD4+细胞群对这种表型呈阳性,而新鲜刺激的CD4+CAR-T细胞仅有31±0.6%的表达(图3C)。CAR-T细胞单一培养有一小部分细胞群对LAG-3呈阳性(17±0.8%)。在共培养孵育中,也观察到耗竭CAR-T细胞杀伤靶细胞的能力有所下降(图3D)。非耗竭的CAR-T细胞能够比耗竭的CAR-T细胞更有效地减少Ramos细胞数量,从含有非耗竭的CAR-T细胞的孔中,iQue® 获得的数值平均为每sip 4606±463个细胞,而耗竭的CAR-T细胞为每sip 8483±688个细胞。T细胞杀伤靶细胞的能力下降是耗竭的另一个标志。综上,这种完整的量化结果显示了这些抗-CD19的CAR-T细胞有明显的抗原特异性驱动的耗竭特征。Summary眼明心亮的同学不难从两个案例看出,iQue® 高通量流式细胞仪不仅可以在极低的样品消耗量下准确定量检测相应的生物学指标,同时提供完善的配套试剂。例如,上述两个案例中提到的iQue®人类T细胞活化试剂盒、iQue®人类T细胞杀伤试剂盒、iQue®人类T细胞配套试剂盒量化细胞因子IL-2以及iQue®人类T细胞耗竭试剂盒(图4)。为大家提供了更优的工作效率和样品前处理体验。图4. iQue® T细胞表型和功能表征试剂盒实验原理细胞疗法的使用正在迅速发展,人们越来越关注提高用于临床的细胞生产效率。使用先进生物分析技术能够助力改善构建体的寿命、选择性,优化生产工艺以及安全性。iQue® 3高通量流式细胞仪为新一代CAR-T开发提供智能的解决方案。Download下载白皮书《使用先进的流式细胞术和活细胞分析进行CAR-T 细胞表型和功能表征》点击下载 获取全文
确定




还剩10页未读,是否继续阅读?
德国赛多利斯集团为您提供《细胞中表型和功能表征检测方案(流式细胞仪)》,该方案主要用于其他中其他检测,参考标准--,《细胞中表型和功能表征检测方案(流式细胞仪)》用到的仪器有赛多利斯 iQue® 3 高通量流式细胞仪
推荐专场
相关方案
更多
该厂商其他方案
更多















