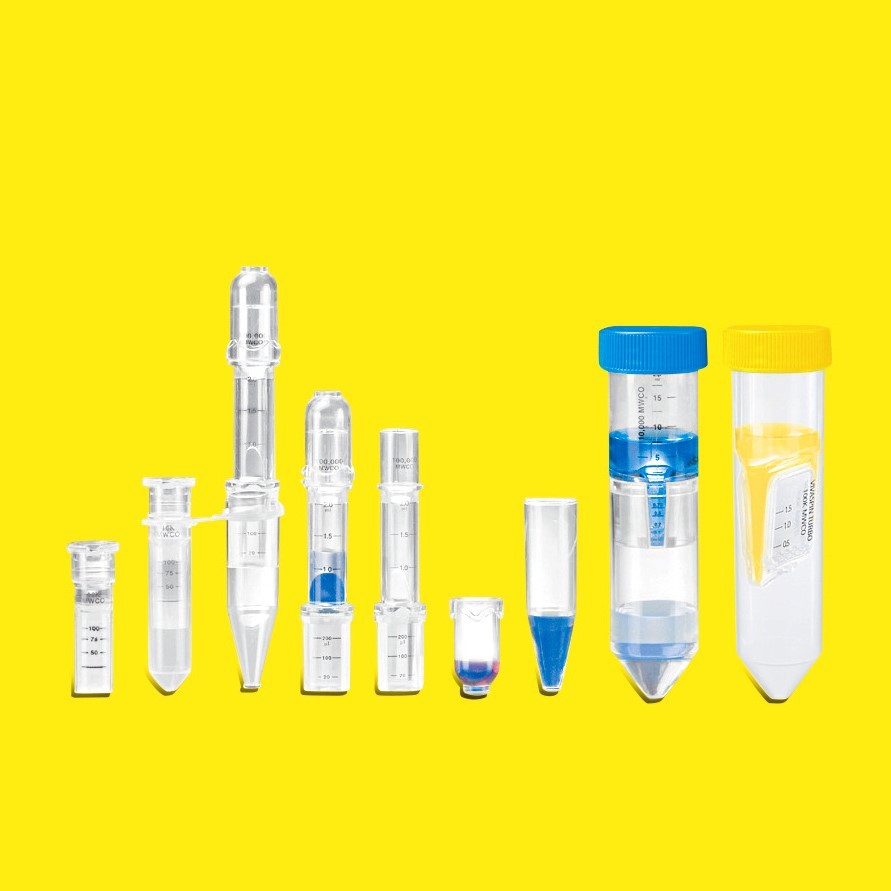
一般病毒的颗粒大小都在20nm到几百纳米之间,使用超滤管(Sartorius Vivaspin®系列)或是超滤膜包(Sartorius Vivaflow系列)进行提取是非常适合的方法。而具体超滤产品的选择标准和原则则和病毒的类型以及后续的应用密切相关,这也是常常为大家所忽略的。
方案详情

SARTORIUS应用指南 结论 2021年2月18日 关键词或短语: 超滤法、病毒纯化、抗病毒药物、疫苗、基因治疗、噬菌体、冠状病毒、SARS-CoV-2、废水 综述::超滤法浓缩与纯化病毒 1赛多利斯实验室仪器有限责任公司 Otto-Brenner-StraBe 20, 37079 Gottingen, Germany *联系方式: adam.green@sartorius.com 本文简要综述并重点介绍了各种病毒在不同研究应用背景下的浓缩和纯化步骤。所讨论的方法可应用于医学研究、海洋生物学以及饮用水和食品质量研究。对于典型的浓缩应用,本综述中的指南将助您选择具有最佳截留分子量(MWCO)的理想性能超滤装置。 Hannes Landmann², Kristin Menzel, Adam Green", Klaus Schone1 2赛多利斯斯泰帝生物技术有限公司 August-Spindler-StraBe 11, 37079 Gottingen, Germany 随着 COVID-19 全球疫情的出现,冠状病毒类病毒已成为免疫学、流行病学和疫苗学研究的关注热点。。一般冠状病毒病毒学、冠状病毒刺突蛋白、从水流中捕获冠状病毒病毒体和游离 RNA 研究是科学界研究重点的三个核心示例,此外,我们还提供了这些冠状病毒研究工作流程中浓缩和纯化步骤的部分示例(参见表5和表6)。 ( 了解更多: ) https://www.sartorius.com/en/products/lab-filtration-purification/ultrafiltration-devices 病毒在进化过程中衍生出各种机制进行相互作用并操纵其靶细胞的遗传物质。基于此,现代分子生物学利用病毒进行的应用研究与日俱增。1它们的应用范围从细胞的受控基因转染至医学科学各种不同的基础研究。?在医学研究中,战略重点为重组疫苗和开发基因治疗的潜在载体。3.4 除了病毒与医学应用的高度相关性之外,病毒类型和含量的评估对于食品和饮用水的风险评估也至关重要。5此外,病毒含量的分类通常与水生生物群的质量控制高度相关。6 在病毒或病毒样颗粒(VLP)的制备、处理或分析过程中,经常需要进行浓缩和/或纯化步骤。5典型病毒的大小约为20nm至几百纳米。7因此,它们易于在超滤膜系统中截留,并且这类超滤装置广泛用于基础病毒研究。此类超滤装置的规格取决于病毒的特定类型以及后续应用的目的。 本简要综述重点介绍了基础医学研究中各种哺乳动物病毒的纯化方法。此外,还强调了水和食品样品中致病性病毒的浓缩和海洋噬菌体(病毒浮游生物)的纯化。对于用户特定的超滤工艺,本综述还为选择具有最佳截留分子量(MWCO)的理想性能超滤装置提供指导。 医学研究中哺乳动物病毒的浓缩 在医学研究中,病毒和VLP为主要的研究热点,特别是用于研究传染性病毒性疾病以及开发疫苗或抗病毒药物。而且,某些VLP可以定向控制遗传物质,并广泛用于基因治疗方法的开发。此外,使用病毒载体将基因转移至细胞系是一种成熟的转染方法,例如在体内和体外处理哺乳动物细胞。 在医学背景下使用赛多利斯超滤装置纯化并浓缩病毒和VLP的主题相关出版物概述参见表1。在其他应用中,Vivaspin@装置可用于浓缩经离子交换色谱法纯化后的腺相关病毒(AAV)和慢病毒载体,8-10在血清上制备丙型肝炎病毒(HCV)阳性血清的空白样品,11用于开发抗人类免疫缺陷病毒(HIV)的疫苗和抗基孔肯雅病毒的抗病毒药物。12,13 饮用水和食品样品中病毒的浓缩 世界卫生组织的饮用水质量指南描述了降低各种病毒感染潜在风险的安全性计划。16该指南指出,由于病毒对消毒方法的抵抗力日渐增强,消毒后无细菌污染不能作为饮用水供水中是否存在致病性病毒的可靠指标。考虑到这一点,对于饮用水质量和食品安全研究,超滤法可在检测这类病毒污染中发挥至关重要的作用。 超滤步骤无需对水样进行预处理,其浓缩病毒的效果几乎与病毒的化学性质和结构无关。17因此,超滤法非常适合从水样中分离和浓缩病毒颗粒,并有助于水质评估。在水和食物样品中发现的大多数病毒均源自粪便。筛查这些病毒对避免感染至关重要。最常见的感染为甲型肝炎、戊型肝炎和诺如病毒。18超滤法已被视为从蔬菜和其他食品中回收甲型肝炎病毒最合适的方法。。19感染性病毒主要通过细胞培养增殖(噬菌斑测定)或分子扩增技术,如定量逆转录酶聚合酶链反应(RT-PCR)检测病毒基因组进行检测。 表1 Vivaspin 和Vivaflow@在医学研究中的病毒应用实例汇总 研究目的 过滤目的 赛多利斯超滤装置 后续步骤 参考编号 (病毒类型,宿主) (缓冲液系统) (MWCO) 基因治疗 滤(20 mM Tris盐水缓冲液) Vivaflow@ 储存,在Sartobind STIC膜层析 14 (5型腺病毒, VLP,人) (100 kDa) (FPLC)上进行色谱分析 减少HCV诱导的纤维化 从人血清(血清)中去除HCV Vivaspin 制备阴性对照(来自阳性样品) 11 (丙型肝炎病毒;人) (30 kDa) 用于免疫荧光试验、纤维化诱导 试验 开发HIV病毒基础抑制剂((HIV, 人) 从病毒中去除蛋白组分(PBS) Vivaspin20 病毒灭活 12 (1,000 kDa) 用于癌症治疗的基因治疗(腺相关病 表达后进行浓缩和纯化, His标记后置换 Vivaspin20 滴度, ELISA,细胞结合试验, 8 毒; rAAV-2,人) 缓冲液(FreeStyle 293表达培养基(Gibco (1,000 kDa) 细胞凋亡|细胞周期试验 ),无血清) 小鼠脑中的受控基因表达系统(腺相 阴离子交换色谱层析后浓缩洗脱液(洗脱 VVivaspin20 小鼠神经元的转导 9 关病毒,小鼠) 缓冲液) (100 kDa) 高效基因转移至CNS(慢病毒,人) 离子交换层析(PBS)后进行浓缩 Vivaspin 采用实时PCR和终点稀释法定 10 (100 kDa) 量。体内鼠神经元和神经胶质细 胞的转导 鉴定有效的抗基孔肯雅病毒药物(基 浓缩 Vivaspin@20 采用TCID50定量 13 孔肯雅病毒,人) (100 kDa) 小鼠色盲的基因治疗(重组腺相关病 浓缩(阴离子交换色谱层析洗脱缓冲液) Vivaspin4 采用斑点印迹分析、视网膜下注15 毒,在小鼠中使用人类病毒) (10kDa) 射测定滴度 表2: Vivaspin 和Vivaflow@用于饮用水和食品样品中病毒的超滤应用示例总结 研究目的 过滤目的 赛多利斯超滤装置 后续步骤 参考编号 (病毒类型,宿主) (缓冲液系统) (MWCO) 诺如病毒基因组I(诺如病毒,人)的 浓缩(PBS处理的食物样品) Vivaspin 提取RNA进行实时RT-PCR 22 检测方法 (5kDa) 分析地下水中的病毒含量(一组致病 浓缩饮用水样品(饮用水) Vivaflow200 采用RT-巢式PCR和微量滴定 21 性病毒,可能为人) (10 kDa) 中和试验进行定性分析(肠道 病毒) 比较分析病毒浓缩方法(甲型肝炎病 浓缩(0.25M苏氨酸, 0.3M NaCl, pH Vivaspin 20 提取RNA进行实时RT-PCR 19 毒,人) 9.5) (100 kDa) 分析因饮用水污染而引起的胃肠炎区 浓缩(50mmol/L甘氨酸缓冲液,1%牛 Vivaspin2 提取核酸 23 域性爆发情况(诺如病毒、星状病毒 肉膏) 、轮状病毒、肠道病毒、甲型肝炎病 海洋生物样品中病毒和噬菌体的浓缩 在海洋生物学中,海洋噬菌体(浮游病毒)的浓缩和后续分析是主要的研究热点。它们的数量比细菌浮游生物(它们的宿主)高出一个数量级,因此可对整个海洋生物圈产生重要影响。24 因此,其被广泛应用于水生病毒的分析。例如, Schroeder等人(参考文献26)确定了感染赫氏圆石藻(一种全球重要的光合浮游生物)病毒的多样性并监测其种群动态。本研究在储存和分析之前,采用了可重复使用且配备聚醚砜(PES)膜(MWCO 为 50 kDa) 的Vivaflow@50 单元浓缩海水样品中的病毒。有关海洋生物样品中病毒浓缩的更多示例请参见表3。 如 Wyn-Jones & Sellwood (参考文献17)所述,超滤法可用于浓缩水样中的病毒颗粒,无需事先对样品进行任何预处理,并且几乎与病毒的化学性质和结构特征无关。 表3赛多利斯 Vivaflow@ 和 Vivaspin@用于海洋生物样品的超滤应用示例总结 研究目的 过滤目的 赛多利斯超滤装置 后续步骤 参考编号 (病毒类型,宿主) (缓冲液系统) (MWCO) 评估病毒浮游生物的多样性(浮游病毒, 0.2 pm过滤得到澄清滤液,再经3kDa Vivaflow@200 随后在琼脂糖凝胶上采用DNA 25 浮游生物) 过滤器后用于浓缩(海水) (0.2 um和30 kDa) 分离进行分析 进行病毒分类(MpRNAV-01B, 细小微 Vivaflow 200:收获和浓缩全细胞裂解 Vivaflow200, Vivaspin@ 对新病毒进行分类:基因组、 28 胞藻) 物; Vivaspin:清洗(去除CsCI) (30 kDa) 蛋白质、稳定性等。 评估病毒浮游生物的遗传多样性(赫氏圆 经0.45um过滤后,从1L浓缩至20 mL Vivaflow50 PCR和变性梯度凝胶电泳 26 石藻病毒,真核浮游植物-藻类) (海水) (50 kDa) 研究感染过程中的基因表达(赫氏圆石藻 从5L浓缩至20mL (f/2培养基) Vivaflow@50 CsCI-梯度 27 病毒株86,真核浮游植物-藻类) (50 kDa) 研究宿主基因组整合(噬病毒体、咖啡厅使用0.2 um过滤器澄清,并用100 kDa Vivaflow200 CsCI梯度,电子显微镜 29 洛博金斯病毒) 过滤器浓缩(咖啡厅洛博金斯病毒, f/2 (0.2 pm 和100 kDa) 培养基) 一般研究和蛋白质研究用冠状病毒的浓缩(刺突蛋白)冠状病毒为球形、有包膜、基于RNA的病毒,直径通常为80-120 nm, 但在很多情况下直径会超出该范围。冠状病毒基因组是所有RNA病毒中体型最大的病毒,其研究领域相对广泛。相应地,该大型基因组未来突变的潜力可导致未来人类疾病的发生,这些疾病有可能演变成流行病和大流行病,如以前的中东呼吸综合征(MERS-CoV),以及严重急性呼吸综合征1(SARS-CoV-1)和2(SARS-CoV-2)。因此,在未来几年,将投入更多的时间和资金,继续对复制、传播、基因组和结构做进一步研究。 冠状病毒刺突(S)蛋白为感染周期的关键组成部分,可通过附着和膜融合介导进入宿主细胞。因此,其为开发新型抗病毒药物和疫苗的主要靶点。 在结构、功能分析和结合试验等之前,对细胞培养物和上清液中的病毒体和刺突蛋白进行浓缩和纯化通常是分离相应靶点的关键要求。 表4重点介绍了已使用Vivaspin@离心浓缩管或Vivaflow@切向流过滤膜包浓缩冠状病毒蛋白(包括刺突蛋白)的部分应用示例。此外,还直接为读者提供了参考文献,,以供详细阅读。 ( 表5提供了使用相同设备浓缩完整病毒体或冠状病毒样颗 粒(VLP)的示例。 ) 表4 赛多利斯 Vivaflow和 Vivaspin用于冠状病毒蛋白样品的超滤应用示例总结 研究目的 过滤目的 赛多利斯超滤装置 后续步骤 参考编号 (病毒类型,宿主) (缓冲液系统) (MWCO) 研究SARS-CoV-2抗体对三聚体刺突(S)蛋 置换SARS-CoV-2RBD蛋白的缓冲液 Vivaspin 20@, PES 采用UV/Vis法浓缩蛋白,采用 30 白上功能保守的受体结合域(RBD)的中和 (10 kDa) 链霉亲和素BLI法(赛多利斯 作用 Octet)测定结合亲和力 研究SARS-CoV-2刺突糖蛋白RBD-SpyVLP 浓缩SpyTag-RBD蛋白载体 Vivaspin20PES 采用SEC进行纯化 31 (病毒样颗粒)平台的中和抗体应答 (10 kDa) 研究含冠状病毒刺突(S)蛋白的外来体疫 浓缩上清液中溶解的刺突蛋白 Vivaspin, PES 免疫印迹分析 32 苗(用于SARS-CoV-1) (10 kDa) 分析小鼠肝炎冠状病毒刺突(S)蛋白感染 浓缩细胞受体蛋白载体 Vivaspin@, PES 免疫印迹分析 33 人癌细胞的重定向功能 测定冠状病毒SARS-CoV-1非结构蛋白1( 浓缩纯化工艺中的冠状病毒nsp1 Vivaspin, PES 筛选结晶 34 nsp1)的结构 测定猫冠状病毒(FCoV)非结构蛋白3(nsp3 浓缩纯化工艺中的冠状病毒nsp3 Vivaspin, PES 筛选结晶 35 )ADRP结构域的结构 (10 kDa) 研究三种跨膜蛋白酶在SARS-CoV-1刺突(S 浓缩HEK293T细胞培养上清液中的 Vivaspin, PES 细胞-细胞融合试验 36 )蛋白活化中的作用 VLP 对人冠状病毒HCoV-NL63刺突糖蛋白三聚 浓缩果蝇S2澄清细胞培养上清液中的 Vivaflow@, PES 亲和纯化 37 体进行冷冻电镜检查,该三聚体是感染期间 重组HCoV-NL63病毒 (10kDa) 中和抗体的潜在靶点 表5 赛多利斯 Vivaflow@和Vivaspin@用于冠状病毒体和 VLP 样品的超滤应用示例总结 研究目的 过滤目的 赛多利斯超滤装置 赛多利斯超滤装置 后续步骤 参考编号 (病毒类型,宿主) (缓冲液系统) (MWCO) (MWCO) 表征病毒分离株(如MERS-CoV) 的表 浓缩MERS-CoV病毒分离株 Vivaspin, PES (100 Vivaspin@, PES 使用蚀斑滴定法定量病 38 型变化,其可能与潜在的大流行相关 kDa) (100 kDa) 毒RNA测序分析 研究紫锥菊(Echinaforce@)对人冠状病 浓缩MERS-CoV和SARS-CoV Vivaspin20, PES Vivaspin20, PES 有限稀释法(TCID50) 39 毒SARS-CoV和MERS-CoV的抗病毒潜 病毒稀释液 力 研究加热和化学方案对SARS-CoV-2的 从裂解缓冲液中浓缩并分离灭 Vivaspin500, PES Vivaspin500, PES 接种到Vero-E6单细细胞40 灭活作用 活的SARS-CoV-2 上 研究病毒和细胞控制hCoV-EMC进入宿 主细胞的决定因素 浓缩SARS-CoV和hCoV-EMC 病毒样颗粒(VLP) Vivaspin, PES Vivaspin@, PES 免疫印迹分析 41, 42 废水中病毒体和/或病毒RNA的浓缩和捕获 在人类和鸟类中,冠状病毒可能引起轻度至致死性呼吸道感染,在其他动物群体中也可能发生一系列其他疾病,如肝炎和神经系统疾病42。在一系列冠状病毒流行病中,SARS-CoV-2是一种最新的病毒,早期迹象表明,由于其传染性强、无症状感染率高、潜伏期显著、我们对传播动力学的了解相对有限以及全球疫情准备工作整体缺乏,该病毒已演变为真正的全球疫情,并对全球的卫生、社会和经济造成重大影响。 该疫情的严重程度正在推动所有相关领域的研究和资金不断增长。 一旦该地区正在进行SARS-CoV-2感染的追踪和流行病学研究。则重点关注的领域之一为区域废水系统的使用,这些系统的划分可提供实时、明确的追踪,无症状出现和临床诊断的滞后情况43。此外,所收集的数据可作为病毒在社区传播的补充、低成本监测指标,而无需筛查个体。而且,新增另一项流行病指标有助于追踪感染率44。 RT-PCR 是检测 SARS-CoV-2的标准方法,但通常需要在检测前对样本中的非冠状病毒物质进行浓缩并去除,,以确保获得最佳结果。超滤方法可成功适用于该情况43部分示例参见表6. 赛多利斯 Vivaflow@和 Vivaspin@用于废水样品中病毒和病毒 RNA 的超滤应用示例总结 研究目的 过滤目的 赛多利斯超滤装置 后续步骤 参考编号 (病毒类型,宿主) (缓冲液系统) (MWCO) 测定污水中的SARS-CoV-2 RNA 浓缩病毒RNA Vivaspin,PES 提取病毒RNA并定量纯化 43,44, (50 kDa) RT-qPCR 45 对原废水中定量SARS-CoV-2的病毒浓 浓缩病毒RNA Vivacell, PES 提取病毒RNA并定量纯化 46 缩方法进行基准测试 (10 kDa) RT-qPCR 评价两种从未经处理的废水中浓缩 将病毒RNA从40mL(总计)浓缩至 Vivaspin 提取病毒RNA并定量 47 SARS-CoV-2的方法 700-1000 pl (10kDa) RT-qPCR和ddPCR 通过病毒浓缩监测(包括诺如病毒、札幌 病毒和轮状病毒)在全规模膜生物反应器 浓缩污水中的病毒颗粒 Vivaflow50, PES 定量PEG沉淀的病毒RNA 48 (MBR)工厂中进行病毒检测。 评价膜生物反应器废水中病毒(包括诺如 病毒、札幌病毒和腺病毒)的去除情况 将污水从1L浓缩至40mL Vivaflow50, PES 定量核酸提取的RT-PCR 49 评价膜生物反应器废水中诺如病毒的去 浓缩污水中的病毒 Vivaflow50, PES 定量核酸提取的RT-PCR 50 除情况 评价社区戊型肝炎病例数与当地污水浓 浓缩污水中的病毒 Vivaflow50, PES 定量核酸提取的RT-qPCR 51 度的相关性 采用超滤法纯化病毒几乎与病毒颗粒的化学性质和结构无关。由于病毒的大小约为20 nm至数百纳米,它们甚至比最大的蛋白复合物还大几个数量级。7因此,大多数病毒均可稳定保留在高达1000kDa的大型MWCO膜上。理想超滤膜的确切规格取决于后续的应用目的。 用于浓缩冠状病毒的超滤法在一系列工作流程中发挥着重要作用。由于病毒和VLP的大小分布可能不同,因此各项研究中使用的确切MWCO不一定符合标准。虽然在通常情况下,对于80-120 nm的颗粒,100 kDa MWCO将在回收率、干扰物质去除、速度和剪切应力之间提供最佳平衡。但对于RNA物质的回收,建议使用较低的MWCO(10-50kDa)以捕获更长的RNA链。然而,在进一步标准化之前应对每次应用进行确认,在执行程序之前,应谨慎测试特定设备。 在医学研究用病毒载体的制备过程中,可以使用各种尺寸的 MWCO 进行柱纯化后的缓冲液置换。。8,9,10,15为了从小蛋白中分离病毒颗粒,研究已证明1,000 kDa 的截留值有效。12为了完全去除血清中的 HCV,可使用 30 kDaMWCO。11当全病毒含量的评估至关重要时(例如食物、饮用水或海洋水样品),使用较小的 MWCO (5-100 kDa)可确保病毒颗粒完全回收。19,21,22,25-29 缩写 AAV 腺相关病毒 CNS 中枢神经系统DNA脱氧核糖核酸 CoV 冠状病毒 ELISA 酶联免疫吸附测定 FPLC 快速蛋白液相色谱法 fCoV 猫冠状病毒 hCoV 人冠状病毒 HCV 丙型肝炎病毒 HlV 人类免疫缺陷病毒 kDa 千道尔顿(1000g/摩尔) M 摩尔浓度(摩尔/升) MERS 中东呼吸综合征mol 摩尔MWCO 截留分子量nsp 非结构蛋白PBS 磷酸盐缓冲盐水 PCR 聚合酶链反应 PEG 聚乙二醇 PES 聚醚砜 RNA 核糖核酸 SARS 严重急性呼吸综合征 RBD 受体结合域 BLI 生物膜层干涉技术 RT-PCR 逆转录酶-聚合酶链反应 ddPCR 微滴数字聚合酶链反应 TCIDP50 半数组织培养感染剂量 VLP 病毒样颗粒 1. Vannucci, L., Lai, M., Chiuppesi, F., Ceccherini-nelli, L.&Pistello, M. Viral vectors : a look back and ahead ongene transfertechnology. New Microb. 36, 1-22 (2013). 2 Luo, D. & Saltzman, W.M.Synthetic DNA deliverysystems. Nat. Biotechnol.8,33-37(2000). ( 3 . U r a, T ., Ok u d a , K . & S h im a d a, M . D e v el o p m en t s i n V ir a l V ec to r -B ase d Va c c ine s . V a c c ines 2 , 6 2 4-41 ( 201 4) . ) ( . 4 . M ingoz zi, F . & Hi g h , K . A . The r ap e ut ic in vi v o g e n e t r an s fer f o r g e n et ic d ise a se u s i n g A AV: pr o g r es s and c h a l le n ges. N a t Re v Gen e t 12 , 3 4 1-3 55 ( 2 0 1 1) . ) 56..SSoule, H., Genoulaz, O., Gratacap-Cavallier, B. Chevallier,P., Liu, J.-X. & Seigneurin,J.-M.Ultrafiltration and reversetranscription-polymerase chain reaction: an efficientprocess for poliovirus, rotavirus and hepatitis Avirusdetection in water. Water Res.34,1063-1067(2000). 6. Bergh, O.,BOrsheim, K.Y., Bratbak, G. &Heldal, M. Highabundance of viruses found in aquatic environments.Nature340,467-468(1989). 7. Hulo, C. et al.ViralZone:A knowledge resource tounderstand virus diversity. Nucleic Acids Res.39,576-582(2011). ( 8 D . . H a g e n, S. e t a l . Mo d u la r ad e no - a s soci a t e d vi r u s ( r AAV) v e ctor s u sed f o r ce l l ula r v i r u s -d ir e c te d e n z ym e p r o d r u g t h e r a p y . S ci .Re p . 4 , 3759 ( 2 0 1 4 ). ) ( 9 . S ch in d l e r , S . E . e t a l . P hot o -a c t i v a table C r e reco m b in a se r eg u la t es g en e e x p r e s s i on i n vivo. S c i . R ep . 5 , 1 3 6 27 ( 2 0 1 5 ) . ) ( 1 0 . S c h err, M . et a l . Ef f i c i e n t ge n e t r a nsf e r i nt o t h e C N S by l e n t i v i r a l vect o r s pu r i fied b y a n i o n e xc h a n g e chr o mat ogr a p h y . Ge ne T h e r . 9 , 1 708 - 1714 ( 2 00 2 ) . ) ( 1 1 . G r a n a t o , M . e t a l .H C V d er i v e d f r o m s e ra o f H C V - i n fected pa t ien ts i n du c es p r o - f i b r otic effec t s i n h u ma n pr i m a r y f ib r o b l a s ts b y a c t iv a t i ng G L I2. S c i. R ep. 6 , 306 4 9 ( 2 016) . ) 12. Martin, L. et al. Rational design of a CD4 mimic thatinhibits HIV-1 entry and exposes cryptic neutralizationepitopes. Nat. Biotechnol.21,71-76(2003). ( 1 3 . K a rlas , A . e t al. A h u m a n ge n o m e - w i d e loss - o f - f unc t i o n s c r e en ident i f ie s eff e c ti v e c hi k un g un ya a nt i v i ra l dr u g s. N at. C o mm u n . 7,1 1 3 2 0 (2 0 16 ) . ) ( 1 4 . N 1 e stola , P . et al . R a t i on al d e v elop m e nt o f tw o f lo w t h r o ugh pu r if i c a ti on s t ra t egi e s f or a denov i ru s typ e 5 a n d r e tr o v i r u s-li ke p ar tic l es . J. C h r o m at og r . A 1426 , 91 - 1 01 ( 2 01 5 ) . ) ( 1 5 . C ar v alh o, L . S . et a l . L on g - te r m an d age- d epende n t r es to rat i o n o f v i s ual f u n c ti o n i n a m o use mo del o f C NG B 3-as s o c i ated a chr o m a t o p s ia f o l lo wi n g ge ne t h e rapy. H um . M o l. G e ne t . 2 0 ,3 1 61 - 3 17 5( 20 1 1) . ) ( 1 6 . G u i delines fo r d rin k ing- w a t er q ua l i ty-4 th ed . W or ld H e a lt h O r g a n i z a tio n 2 0 1 1. ) 177..VWyn-Jones, a P. & Sellwood, J. Enteric viruses in theaquatic environment.J.Appl.Microbiol. 91, 945-962(2001) 18. Botzenhart, K. Viren im Trinkwasser.Bundesgesundheitsblatt-Gesundheitsforsch.-Gesundheitsschutz 50, 296-301(2007). 19. Lee, K. B., Lee, H., Ha, S. D., Cheon, D. S. & Choi, C.Comparative analysis of viral concentration methods fordetecting the HAV genome using real-time RT-PCRamplification.Food Env. Virol. 4, 68-72(2012). 20. Bosch, A. et al. Analytical Methods for Virus Detection inWater and Food. Food Anal. Methods 4, 4-12(2011). 21. Masciopinto, C. et al. Unsafe tap water in householdssupplied from groundwater in the Salento Region ofSouthern Italy.J.Water Health 5,129-148(2007). 22. Dreier,J., Stormer, M., Made, D., Burkhardt, S. & Kleesiek,K.Enhanced reverse transcription-PCR assay fordetection of norovirus genogroup 1.J. Clin.Microbiol. 44,2714-2720(2006). 23. Maunula, L. et al.Enteric Viruses in a Large WaterborneOutbreak of Acute Gastroenteritis in Finland. FoodEnviron. Virol.1,31-36(2009). 24. Wommack, K. E. &Colwell,R. R.Virioplankton: virusesin aquatic ecosystems. Microbiol. Mol. Biol.Rev.64,69-114(2000). 25. Parada, V., Baudoux, A.-C., Sintes, E., Weinbauer, M. G.& Herndl,G.J. Dynamics and diversity of newly producedvirioplankton in the North Sea. ISME J.2, 924-936(2008). 26. Schroeder, D. C.,Oke,J., Hall, M., Malin, G.& Wilson, W.H. Virus Succession Observed during an Emiliania huxleyiBloom Virus. Appl. Environ.Microbiol. 69,2484-2490(2003). 27. Allen, M.J. et al.Locus-Specific Gene Expression PatternSuggests a Unique Propagation Strategy for a Giant AlgalVirus.J. Virol.80,7699-7705(2006). 28. Brussaard, C. P. D., Noordeloos,A.A. M.,Sandaa,R. A.Heldal, M.& Bratbak, G. Discovery of a dsRNA virusinfecting the marine photosynthetic protist Micromonaspusilla. Virology 319, 280-291 (2004). 29. Fischer, M. G. & Hackl, T. Host genome integration andgiant virus-induced reactivation of the virophagemavirus.Nature 540, 288-291(2016). 30. Liu, H. et al. Cross-Neutralization of a SARS-CoV-2Antibody to a Functionally Conserved Site Is Mediatedby Avidity. Immunity 53,1272-1280 (2020) 31. Tan, T.K. et al.A COVID-19 vaccine candidate usingSpyCatcher multimerization of the SARS-CoV-2 spikeprotein receptor-binding domain induces potentneutralizing antibody responses. NatureCommunications 12:542(2021) 32. Kuate, S. et al. Exosomal vaccines containing the Sprotein of the SARS coronavirus induce high levels ofneutralizing antibodies. Virology 362,26-37(2007). 33. Wurdinger, T. et al. Soluble receptor-mediated targetingof mouse hepatitis coronavirus to the human epidermalgrowth factor receptor. J.Virology 79,15314-15322(2005) 34. Jansson,A. M. Structure of Alphacoronavirustransmissible gastroenteritis virus nsp1 has implicationsfor coronavirus nsp1 function and evolution.JVirology 87,2949-2955(2013), 35. Justyna, A. et al. Structure of the X(ADRP) domain ofnsp3 from feline coronavirus. Bio. Crystallography 65,1292-1300 (2009). 36. Bertram, S, et al. Cleavage and activation of the severeacute respiratory syndrome coronavirus spike proteinby human airway trypsin-like protease.JVirology 85,13363-13372(2011). 37. Walls, A. C. et al.Glycan shield and epitope masking of acoronavirus spike protein observed by cryo-electronmicroscopy. Nature Str &M. Biology23 (2016). 38. Schroeder, S. et al. Functional comparison of MERES-coronavirus lineages reveals increased zoonotic potentialof the recombinant lineage 5. Pending publication. 39. Signer, J. In vitro antiviral activity of Echinaforce°,anEchinacea purpurea preparation, against common coldcoronavirus 229E and highly pathogenic MERS-CoVandSARS-CoV.Pending publication ( 40. P a s t o ri no , B . et a l . E val uati o n o f he at i n g a n d ch e m ic a l pr o t o col s fo r i nact i v at ing SA R S - C oV - 2. P e n d i ng p ubl ic a ti o n ) 41. Gierer,S. et al. The spike protein of the emergingbetacoronavirus EMC uses a novel coronavirus receptorfor entry, can be activated by TMPRSS2, and is targetedby neutralising antibodies.J.Virology 87,5502-5511(2013). 42. Masters,P. S. The Molecular Biology of Coronaviruses.Adv. Virus Research 66,193-292 (2006) 43. Larsen,D. A, Wigginton KR. Tracking COVID-19 withWastewater. Nature Biotechnology 38, 1151-1153(2020). 44. TrottierJ.et al. Post-lockdown detection of SARS-CoV-2RNA in the in the wastewater of Montpellier, France. OneHealth10 (2020) 45. Hokkaido University. SARS-CoV-2 RNADetected inUntreated WastewaterfromLouisiana.ScienceDaily.(26 Aug 2020) 46. Jafferalli, M. H. et al. Benchmarking virus concentrationmethods for quantification of SARS-CoV-2 in rawwastewater. Science of the Total Environment 10, 755,(2021) 47. Dumke, R. et al. Evaluation of Two Methods toConcentrate SARS-CoV-2 from Untreated Wastewater.Pathogens 195 (2021) 48. Takayuki, M. et al.Virus type-specific removal in a full-scale membrane bioreactor treatment process.Food andEnv.Virology 10, 176-186 (2017). 49. Sima,L. C.et al. Calicivirus removal in a membranebioreactorwastewater treatment plant. Applied and Inv.Microbiology 77,5170-5177(2011). 50. Schaeffer, J. et al. Improving the efficacy of sewagetreatment decreases norovirus contamination in oysters.Int.J. of Food Microbiology 286,1-5(2018). 51.TTakayuki, M. et al. Detection of hepatitis E virus in sewageafteran outbreak on a French island. Food and Env.Virology 8,194-100 (2016). 销售与服务联系方式 更多联系信息,请访问 www.sartorius.com.cn 赛多利斯(上海)贸易有限公司 邮箱 lab.cn@sartorius.com 服务热线 400 920 9889|800 820 9889 上海北京上海市浦东新区盛荣路 388北京市顺义区空港工业区B弄百佳通产业园3号楼区裕安路 33号, 1013007-11层,200120电话+86 10 8042 6300 电话+86 21 6066 6100苏州广州 苏州市虎丘区科技城锦峰路广州市越秀区水荫路 117 号 158 号 101park-28 幢201,1105单元, 510075 215163电话+8620 3761 7284 电话+86512 6616 0490 成都西安成都市上东大街 246号新良西安市和平路 118 号和平银大厦2406室, 610012座1107室, 710001电话+86 28 8666 6877电话 +86 29 8751 2305 ( 技木规格如有变更,恕不另行通知。 ) ( 赛 多利斯保留最终解释权和修改权。 ) ( 版本03| 2 021 ) 今天要聊的主角是一位小朋友——病毒。今年的COVID-19全球大流行也让这位小朋友成了家喻户晓的熊孩子。而和这位小朋友长期接触的家长都知道,这位熊孩子一点都不好管。比如怎么逮住他,因为他总是有很多办法让他的小兄弟来逃脱,那怎么样最大限度的逮住这帮熊孩子呢?今天我们就讲讲因材施教,不同病毒的不同的浓缩和提取的方法。由于病毒在进化过程中衍生出各种机制进行相互作用并操纵靶细胞的遗传物质,也使得现代分子生物学利用病毒进行的应用研究与日俱增。而在这些常见的病毒研究中,病毒或病毒样颗粒(VLP)的制备,处理和分析通常需要浓缩和纯化的步骤。这个前处理的过程的优劣是后面我们对病毒的分析能否完整正确的基础。而从病毒本身的特性来看,一般病毒的颗粒大小都在20nm到几百纳米之间,使用超滤管(Sartorius Vivaspin®系列)或是超滤膜包(Sartorius Vivaflow®系列)进行提取是非常适合的方法。而具体超滤产品的选择标准和原则则和病毒的类型以及后续的应用密切相关,这也是常常为大家所忽略的。比如如下几种情况,你是否知道什么样的超滤产品最合适呢:- 如何纯化在医学研究中的哺乳动物细胞的病毒?- 如何从水中或是食品中浓缩和提取病原体病毒?- 如何纯化海洋中的噬菌体病毒?- 如何进行冠状病毒(刺突蛋白)的浓缩?- 如何进行废水中病毒体和/或病毒RNA的浓缩和捕获?如果你平时正好在为这些问题而纠结,那就快来搬好小板凳,我们来详细讲解一下这几种情况的病毒纯化。首先,我们先来看看如何纯化在医学研究中的哺乳动物病毒。在现代的医学研究中,病毒和病毒样颗粒VLP越来越成为主要的研究热点,特别是用于研究治疗传染性病毒类疾病,或是开发疫苗或抗病毒药物。由于某些病毒样颗粒VLP可以定向控制遗传物质,被广泛用于基因治疗方法的开发。此外,病毒载体还可以将基因转移至细胞系,他这种特性使得他作为传递遗传物质的载体也是一种成熟的转染方法,例如在体内和体外处理哺乳动物细胞。在医学研究中,使用赛多利斯超滤装置(Vivaspin®和Vivaflow®)纯化并浓缩病毒和病毒样颗粒VLP的参考文献非常多,也是一种常见的,并被常规用于浓缩和提取的过程之中的方法。那么,大家关心的具体怎么选型的各种情况小编也为大家整理了一个表,这样我们就可以因材施教了。(表1)表1 Vivaspin® 和Vivaflow® 在医学研究中的病毒应用实例汇总在其他的一些表上没有提及的应用中,比如浓缩经离子交换色谱法纯化后的腺相关病毒(AAV)和慢病毒载体(文献1–3);在血清上制备丙型肝炎病毒(HCV)阳性血清的空白样品(4)等可以查阅下列文献。由于篇幅有限,小伙伴们可以下载《综述:超滤法浓缩与纯化病毒》详细了解各种应用,也可留言给我们申请试用赛多利斯刚刚上市的再生纤维素膜(RC)超滤管。另外,除了再生纤维素膜(RC)超滤管,赛多利斯还有聚醚砜膜(PES),醋酸纤维素膜(CTA)和专利的hydrosart膜的超滤产品可供选购。-参考文献-【1】Hagen, S. et al. Modular adeno-associated virus (rAAV)vectors used for cellular virus-directed enzyme prodrug therapy. Sci. Rep. 4, 3759 (2014).【2】Schindler, S. E. et al. Photo-activatable Cre recombinase regulates gene expression in vivo. Sci. Rep. 5, 13627(2015).【3】Scherr, M. et al. Efficient gene transfer into the CNS by lentiviral vectors purified by anion exchange chromatography. Gene Ther. 9, 1708–1714 (2002).【4】Granato, M. et al. HCV derived from sera of HCV infected patients induces pro-fibrotic effects in human primary fibroblasts by activating GLI2. Sci. Rep. 6,30649 (2016).
确定









还剩8页未读,是否继续阅读?
德国赛多利斯集团为您提供《液体中病毒检测方案(微滤系统)》,该方案主要用于其他中前处理检测,参考标准--,《液体中病毒检测方案(微滤系统)》用到的仪器有赛多利斯 Vivaspin 超滤浓缩管系列、赛多利斯 Vivaflow 切向流膜包
推荐专场
该厂商其他方案
更多















