本实验室按照2020版《中国药典》中分析方法,筛选合适的色谱柱,使地黄饮片和熟地黄中地黄苷D与其前后相邻杂质之间的分离度能够达到基线分离,同时,地黄苷D峰的理论塔板数应满足药典要求(不低于5000)。
方案详情

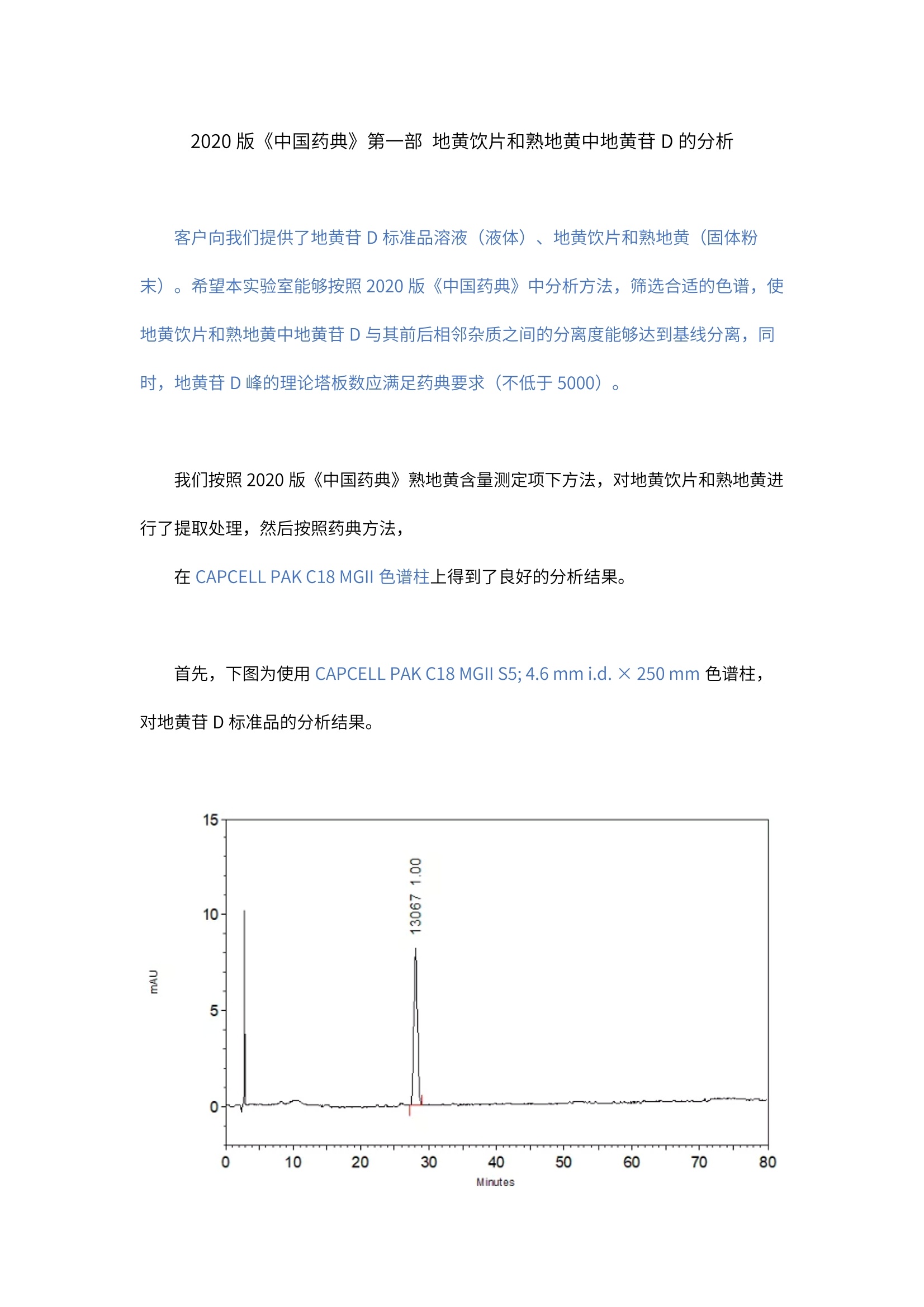
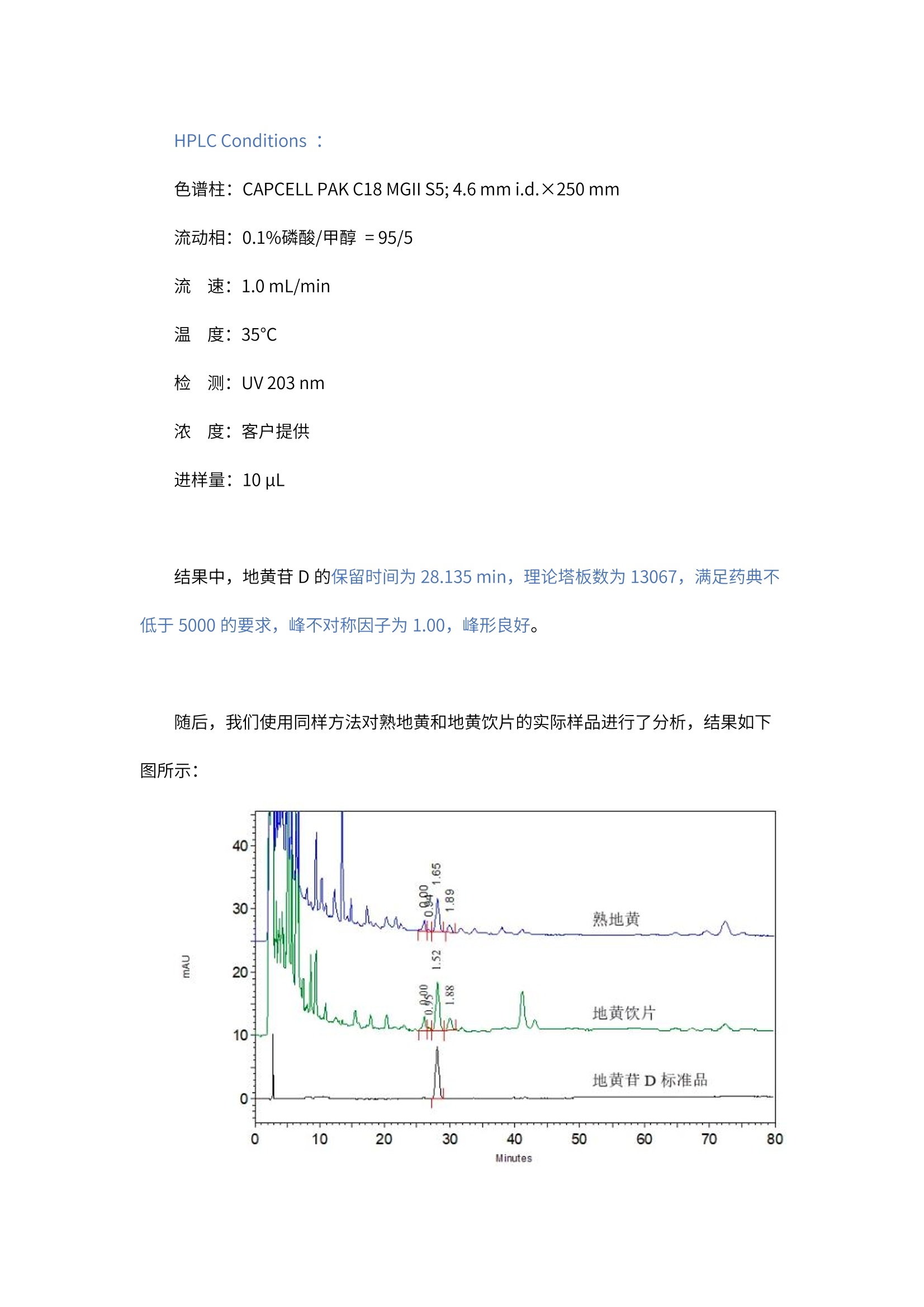
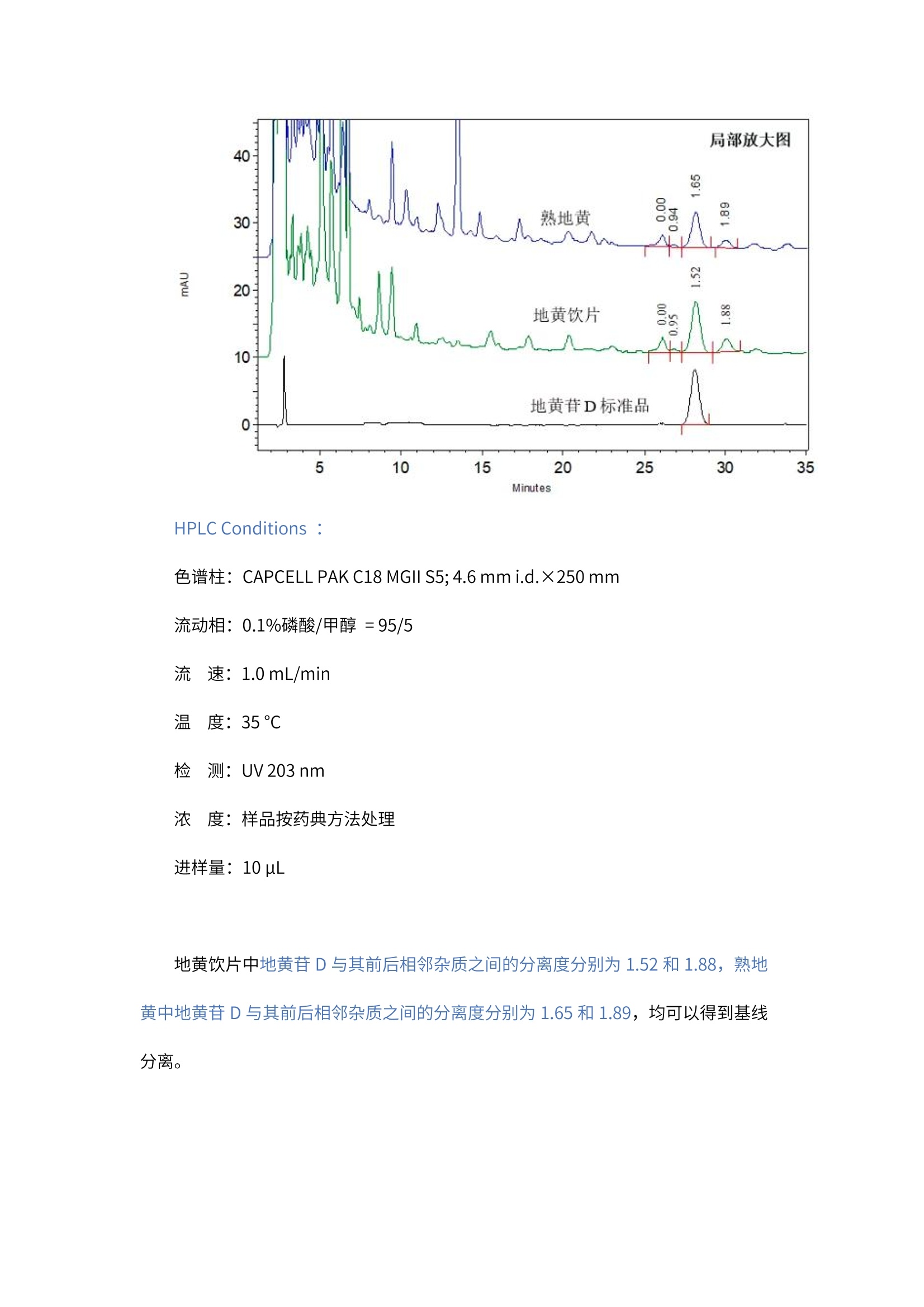
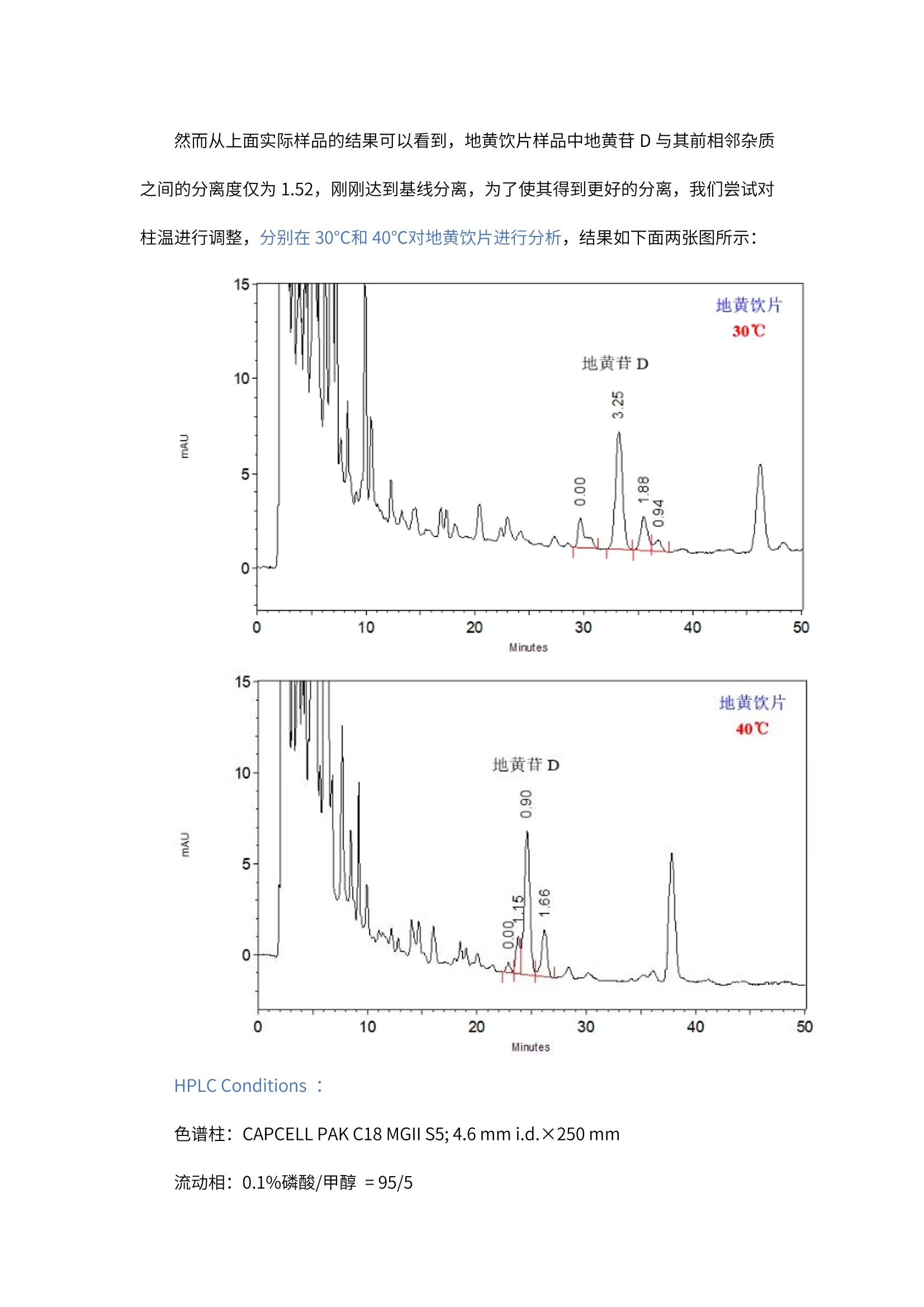
2020版《中国药典》第一部地黄饮片和熟地黄中地黄苷D的分析 客户向我们提供了地黄苷D标准品溶液(液体)、地黄饮片和熟地黄(固体粉末)。希望本实验室能够按照2020 版《中国药典》中分析方法,筛选合适的色谱,使地黄饮片和熟地黄中地黄苷D与其前后相邻杂质之间的分离度能够达到基线分离,同时,地黄苷D峰的理论塔板数应满足药典要求(不低于5000)。 我们按照2020版《中国药典》熟地黄含量测定项下方法,对地黄饮片和熟地黄进行了提取处理,然后按照药典方法, 在CAPCELL PAK C18 MGII 色谱柱上得到了良好的分析结果。 首先,下图为使用 CAPCELL PAK C18 MGII S5; 4.6 mm i.d. × 250 mm 色谱柱,对地黄苷D标准品的分析结果。 HPLC Conditions : 色谱柱: CAPCELL PAK C18 MGII S5;4.6 mm i.d.×250 mm 流动相:0.1%磷酸/甲醇=95/5 流速:1.0mL/min 温度:35℃ 检测: UV203 nm 浓度:客户提供 进样量:10uL 结果中,地黄苷D的保留时间为 28.135 min, 理论塔板数为13067, 满足药典不低于5000 的要求,峰不对称因子为 1.00,峰形良好。 随后,我们使用同样方法对熟地黄和地黄饮片的实际样品进行了分析,结果如下图所示: HPLC Conditions: 色谱柱: CAPCELL PAK C18 MGII S5; 4.6 mm i.d.×250 mm 流动相:0.1%磷酸/甲醇=95/5 流速:1.0mL/min 温度: 35℃ 检测:UV203 nm 浓度:样品按药典方法处理 进样量: 10uL 地黄饮片中地黄苷D与其前后相邻杂质之间的分离度分别为 1.52和1.88,熟地黄中地黄苷D与其前后相邻杂质之间的分离度分别为 1.65 和1.89,均可以得到基线分离。 然而从上面实际样品的结果可以看到,地黄饮片样品中地黄苷D与其前相邻杂质之间的分离度仅为1.52,刚刚达到基线分离,为了使其得到更好的分离,我们尝试对柱温进行调整,分别在30℃和 40℃对地黄饮片进行分析,结果如下面两张图所示: vE HPLC Conditions : 色谱柱: CAPCELL PAK C18 MGII S5; 4.6 mm i.d.×250 mm 流动相:0.1%磷酸/甲醇=95/5 流速:1.0mL/min 温度: 30℃/40℃ 检测: UV203 nm 浓度:样品按药典方法处理 进样量: 10uL 在30℃柱温下,地黄苷D与其前后相邻杂质之间的分离度分别为3.25 和1.88,能够得到良好的分离。在40℃柱温下,地黄苷D与其前后相邻杂质之间的分离度分别为 0.90 和1.66,地黄苷D与其前杂质未能达到基线分离,升温不利于分离。 针对药典中地黄饮片和熟地黄中地黄苷D的分析,我们总结了以下注意事项: (1).由于中药样品中成分比较复杂,在不同色谱柱上的分离情况差异比较大,建议客户在分析时,可根据具体分离情况,对有机相比例及柱温进行调整,以得到良好的分离。 (2).地黄饮片及熟地黄中均含有疏水性较大的物质,我们进行80min 的洗脱后,仍可能有疏水性物质未得到洗脱,建议使用高有机相进行冲洗。 综上所述,使用 CAPCELL PAK C18 MGII 色谱柱,按照2020版《中国药典》熟地黄含量测定项下方法,能够得到满足药典分离度和理论塔板数要求的分析结果。 2020版《中国药典》第一部 地黄饮片和熟地黄中地黄苷D的分析 客户向我们提供了地黄苷D标准品溶液(液体)、地黄饮片和熟地黄(固体粉末)。希望本实验室能够按照2020版《中国药典》中分析方法,筛选合适的色谱柱,使地黄饮片和熟地黄中地黄苷D与其前后相邻杂质之间的分离度能够达到基线分离,同时,地黄苷D峰的理论塔板数应满足药典要求(不低于5000)。 我们按照2020版《中国药典》熟地黄含量测定项下方法,对地黄饮片和熟地黄进行了提取处理,然后按照药典方法,在CAPCELL PAK C18 MGII色谱柱上得到了良好的分析结果。 首先,下图为使用CAPCELL PAK C18 MGII S5; 4.6 mm i.d. × 250 mm色谱柱,对地黄苷D标准品的分析结果。HPLC Conditions :色谱柱:CAPCELL PAK C18 MGII S5; 4.6 mm i.d.×250 mm流动相:0.1%磷酸/甲醇 = 95/5流 速:1.0 mL/min温 度:35°C检 测:UV 203 nm浓 度:客户提供进样量:10 µL 结果中,地黄苷D的保留时间为28.135 min,理论塔板数为13067,满足药典不低于5000的要求,峰不对称因子为1.00,峰形良好。 随后,我们使用同样方法对熟地黄和地黄饮片的实际样品进行了分析,结果如下图所示:HPLC Conditions :色谱柱:CAPCELL PAK C18 MGII S5; 4.6 mm i.d.×250 mm流动相:0.1%磷酸/甲醇 = 95/5流 速:1.0 mL/min温 度:35 °C检 测:UV 203 nm浓 度:样品按药典方法处理进样量:10 µL 地黄饮片中地黄苷D与其前后相邻杂质之间的分离度分别为1.52和1.88,熟地黄中地黄苷D与其前后相邻杂质之间的分离度分别为1.65和1.89,均可以得到基线分离。然而从上面实际样品的结果可以看到,地黄饮片样品中地黄苷D与其前相邻杂质之间的分离度仅为1.52,刚刚达到基线分离,为了使其得到更好的分离,我们尝试对柱温进行调整,分别在30℃和40℃对地黄饮片进行分析,结果如下面两张图所示:HPLC Conditions :色谱柱:CAPCELL PAK C18 MGII S5; 4.6 mm i.d.×250 mm流动相:0.1%磷酸/甲醇 = 95/5流 速:1.0 mL/min温 度:30°C / 40°C检 测:UV 203 nm浓 度:样品按药典方法处理进样量:10 µL 在30℃柱温下,地黄苷D与其前后相邻杂质之间的分离度分别为3.25和1.88,能够得到良好的分离。在40℃柱温下,地黄苷D与其前后相邻杂质之间的分离度分别为0.90和1.66,地黄苷D与其前杂质未能达到基线分离,升温不利于分离。 针对药典中地黄饮片和熟地黄中地黄苷D的分析,我们总结了以下注意事项:(1). 由于中药样品中成分比较复杂,在不同色谱柱上的分离情况差异比较大,建议客户在分析时,可根据具体分离情况,对有机相比例及柱温进行调整,以得到良好的分离。(2). 地黄饮片及熟地黄中均含有疏水性较大的物质,我们进行80min的洗脱后,仍可能有疏水性物质未得到洗脱,建议使用高有机相进行冲洗。 综上所述,使用CAPCELL PAK C18 MGII色谱柱,按照2020版《中国药典》熟地黄含量测定项下方法,能够得到满足药典分离度和理论塔板数要求的分析结果。
确定

还剩3页未读,是否继续阅读?
三耀精细化工品销售(北京)有限公司为您提供《地黄饮片和熟地黄(固体粉末)中地黄苷D检测方案 》,该方案主要用于中药材和饮片中限度检查检测,参考标准--,《地黄饮片和熟地黄(固体粉末)中地黄苷D检测方案 》用到的仪器有CAPCELL PAK MGⅡ C18液相色谱柱
相关方案
更多
该厂商其他方案
更多










