
方案详情
文
饲料是能够提供给饲养动物所需养分,保证健康,促进生产,并且在合理使用下不产生有害物质的可饲物质。近 30 年来,我国畜牧养殖业发展迅速,我国的动物性食品如猪肉、禽肉、禽蛋及水产品供应已相当丰富。养殖业的迅猛发展,带动了饲料工业的发展,饲料添加剂的研究也得到了快速发展。同时随着养殖业的发展,人们对动物性产品的需求已经从刚开始的数量需求转向了对质量、安全性的需求。饲料添加剂的广泛应用,对于提高动物的生产性能、增强抗病力、提高饲料利用效率、改善动物产品品质和提高经济效益等方面发挥着重要作用。合理使用饲料添加剂,对于促进养殖业及饲料工业的发展具有重要意义。饲料添加剂的种类很多,从广义上大致分为营养性添加剂和非营养性添加剂。营养性添加剂包括氨基酸添加剂、维生素添加剂和矿物质添加剂;非营养性添加剂包括药物添加剂(抗菌药物添加剂、抗寄生虫药物添加剂、中草药添加剂和镇静药物添加剂)、激素添加剂、酶制剂添加剂、微生物添加剂以及其它抗氧化剂、调味剂、防腐剂等。但是,近年来一些不法分子滥用饲料添加剂,导致屡屡发生动物性食品中毒事件,使饲料添加剂在人们心中蒙上了阴影。
方案详情

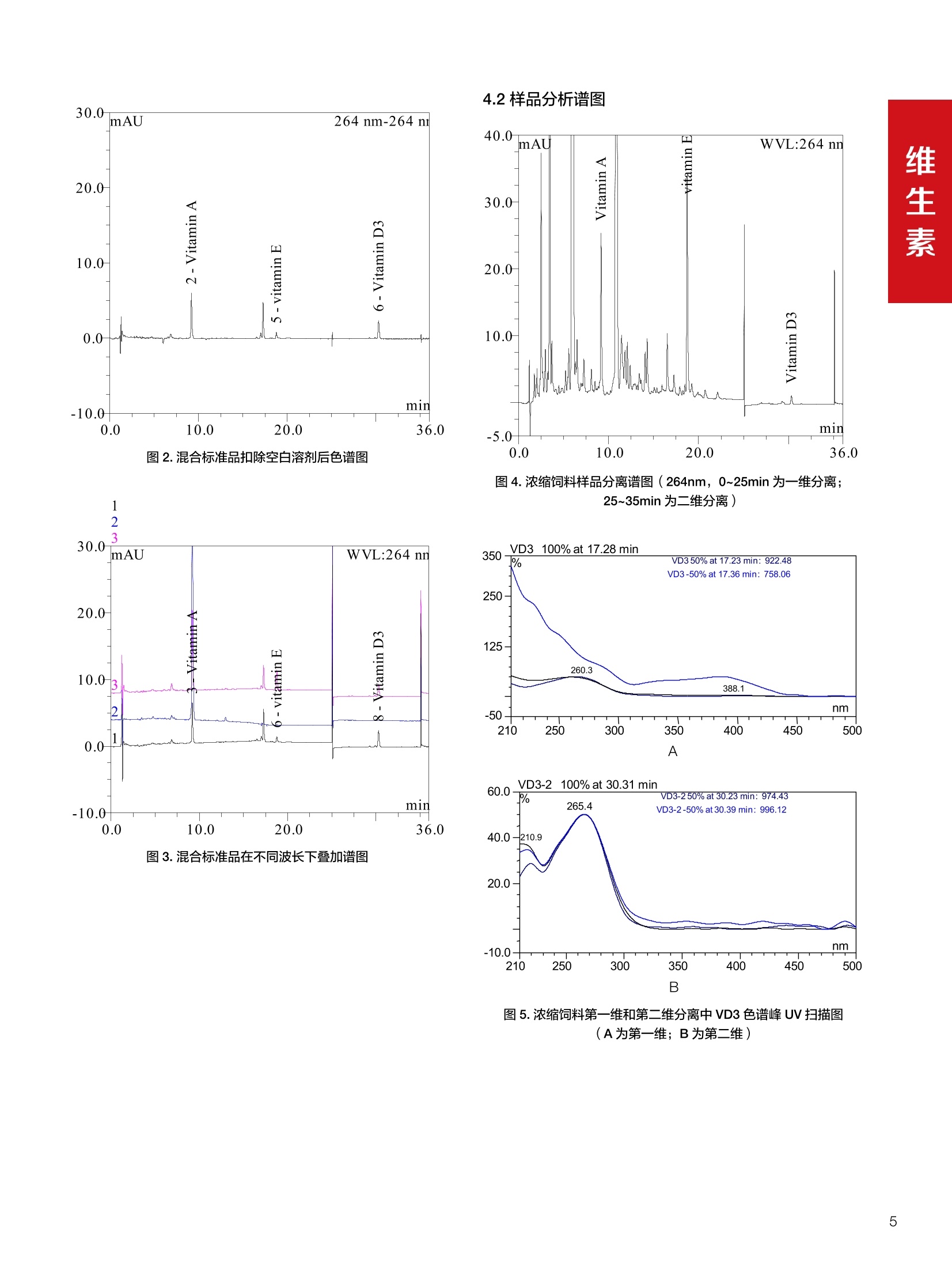
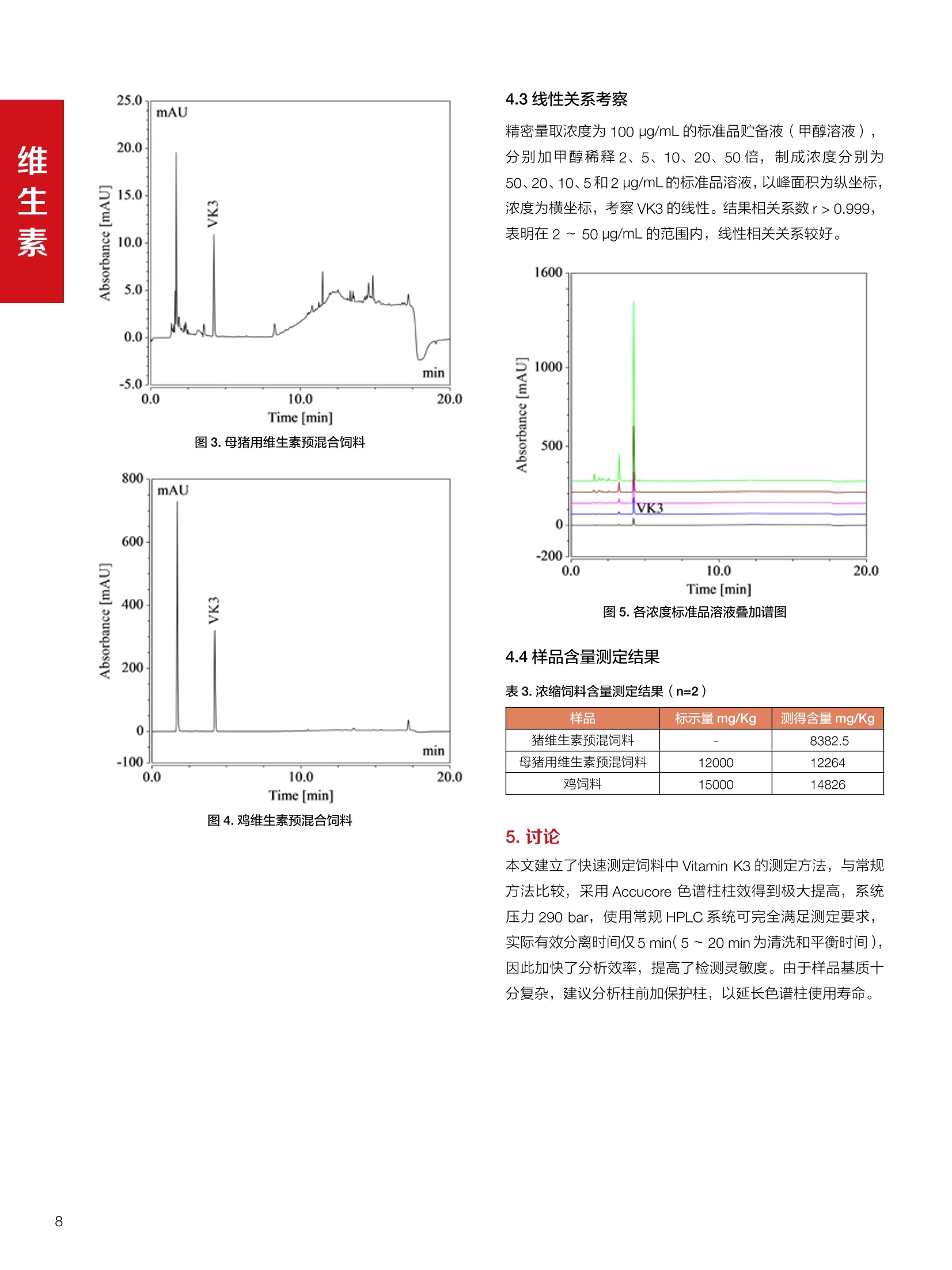
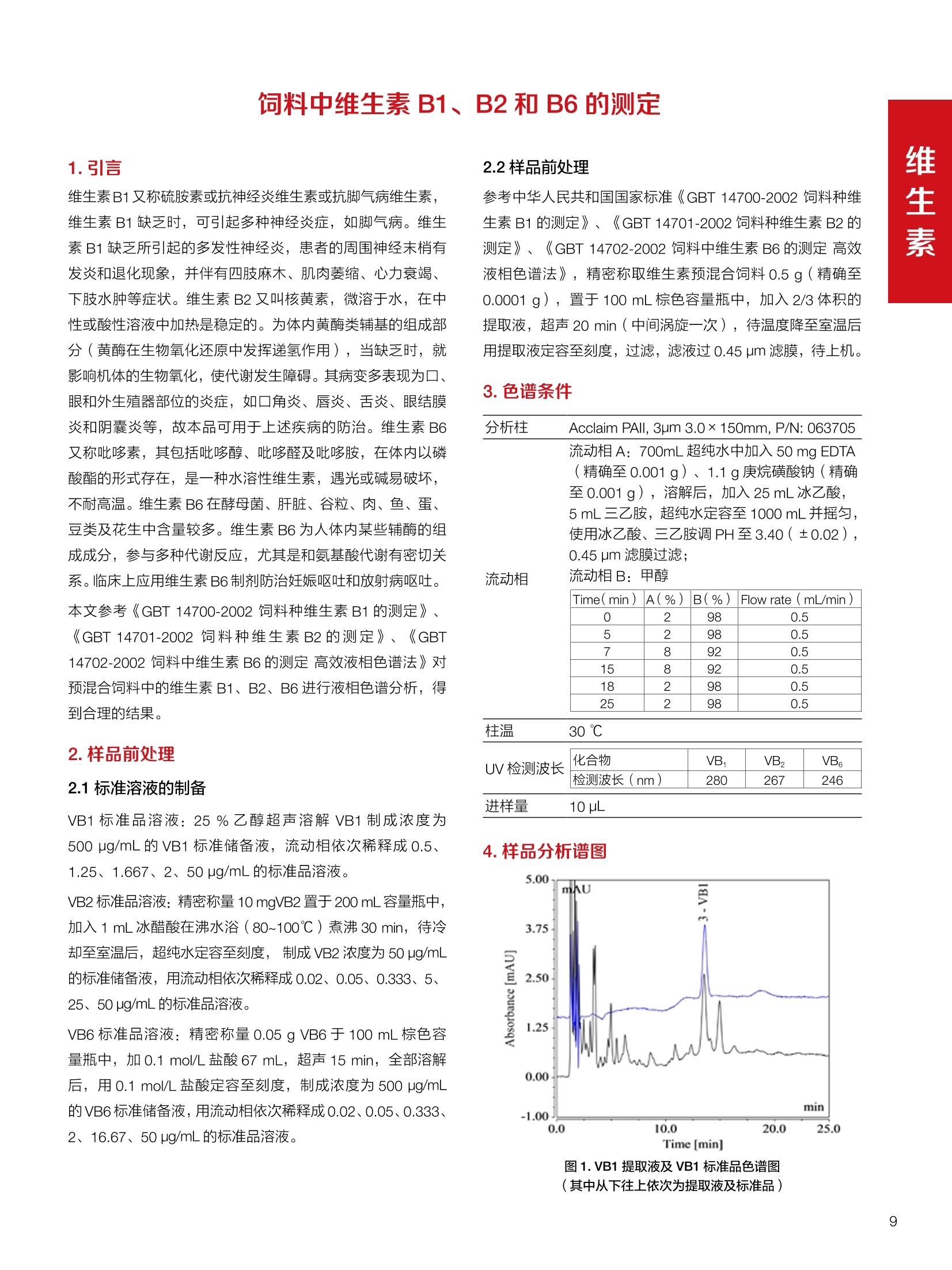
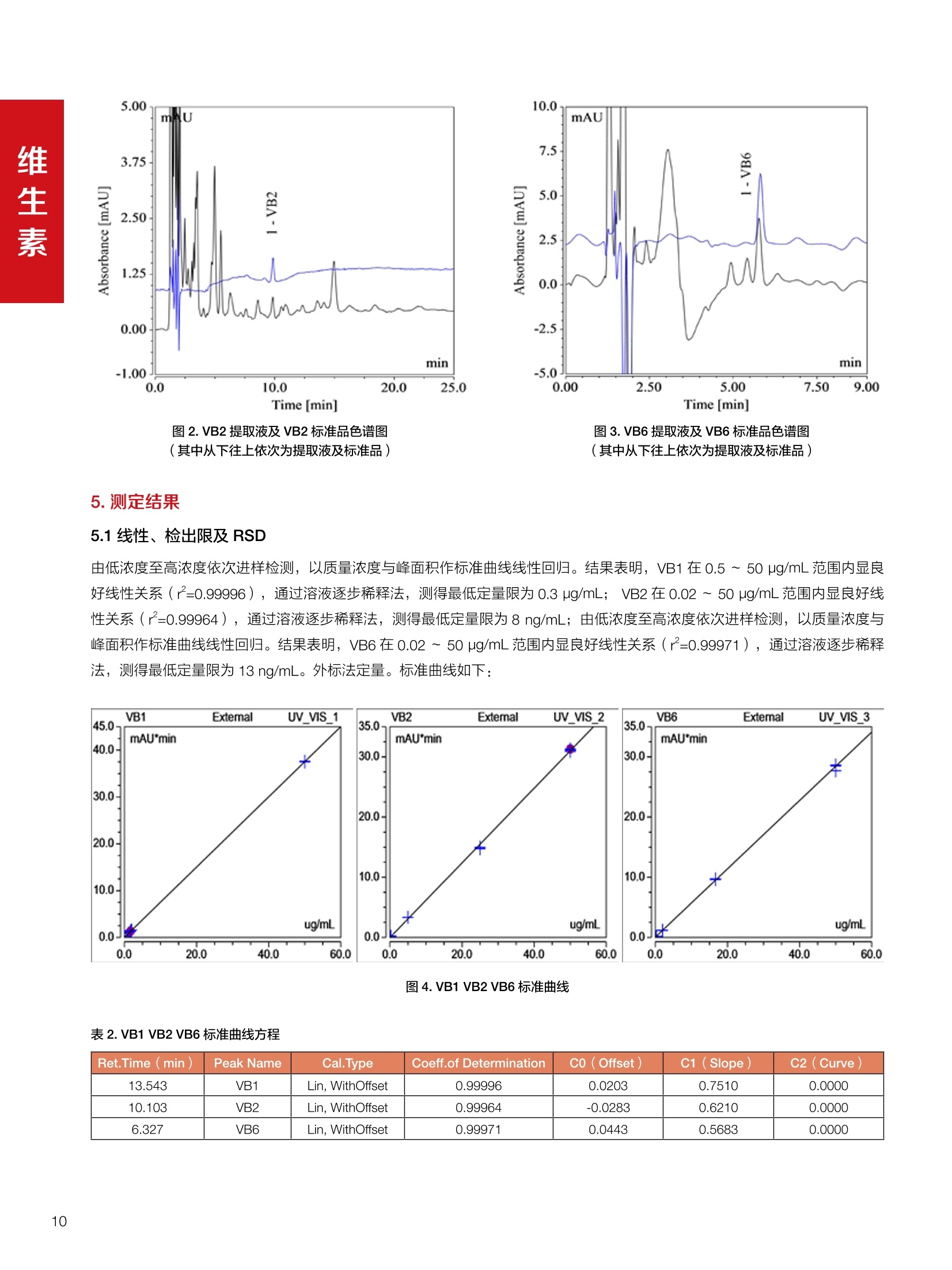
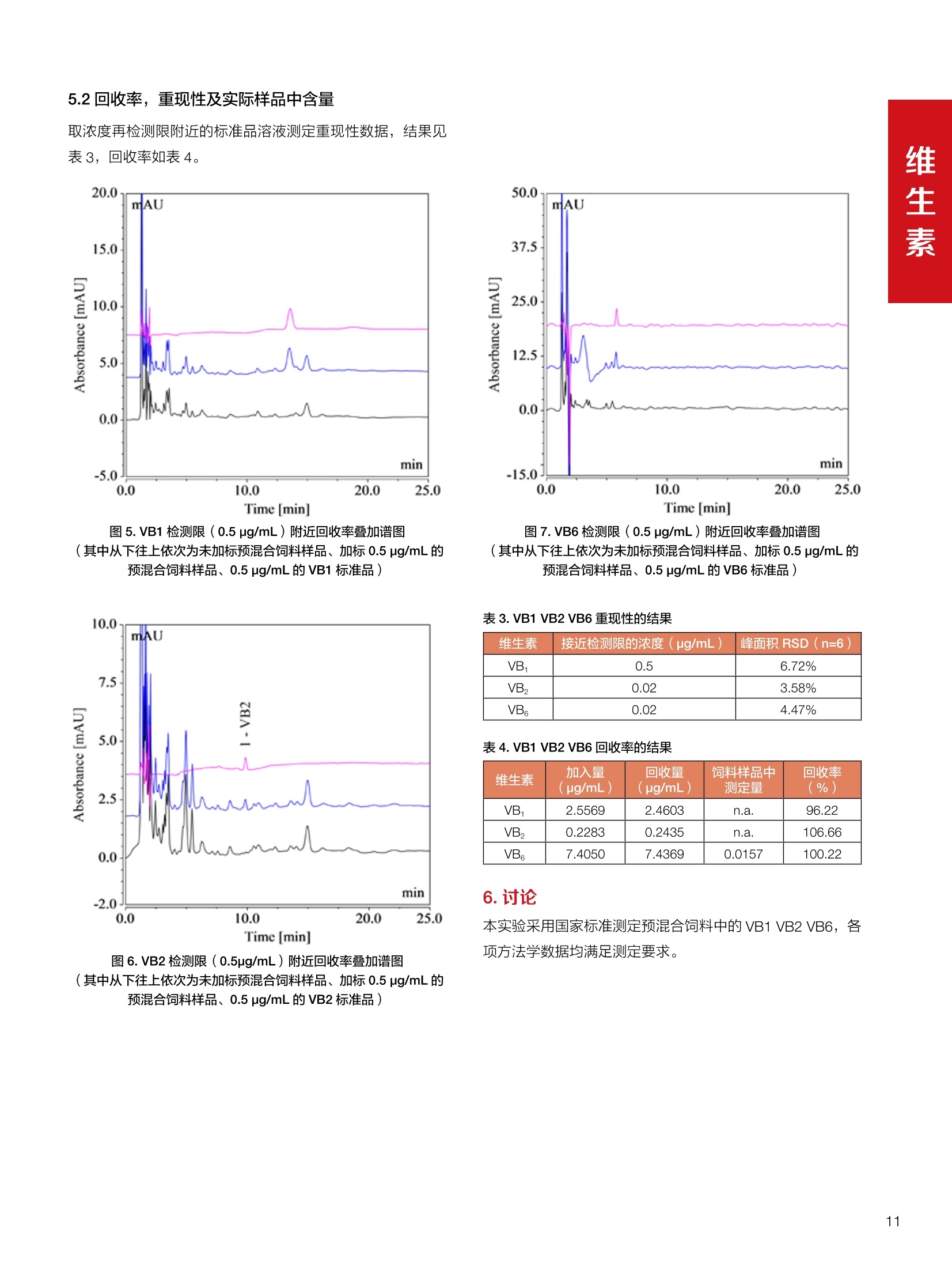
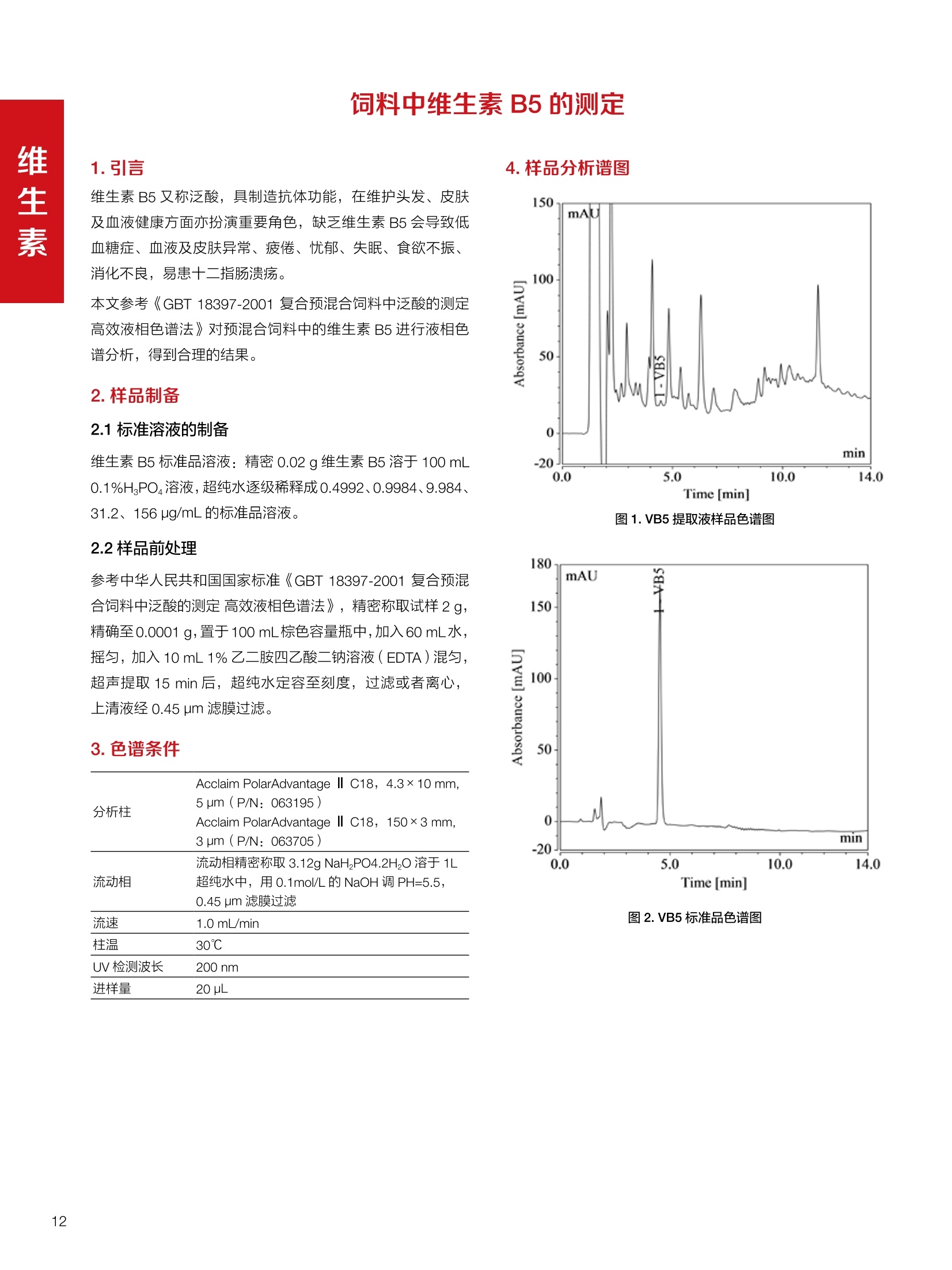
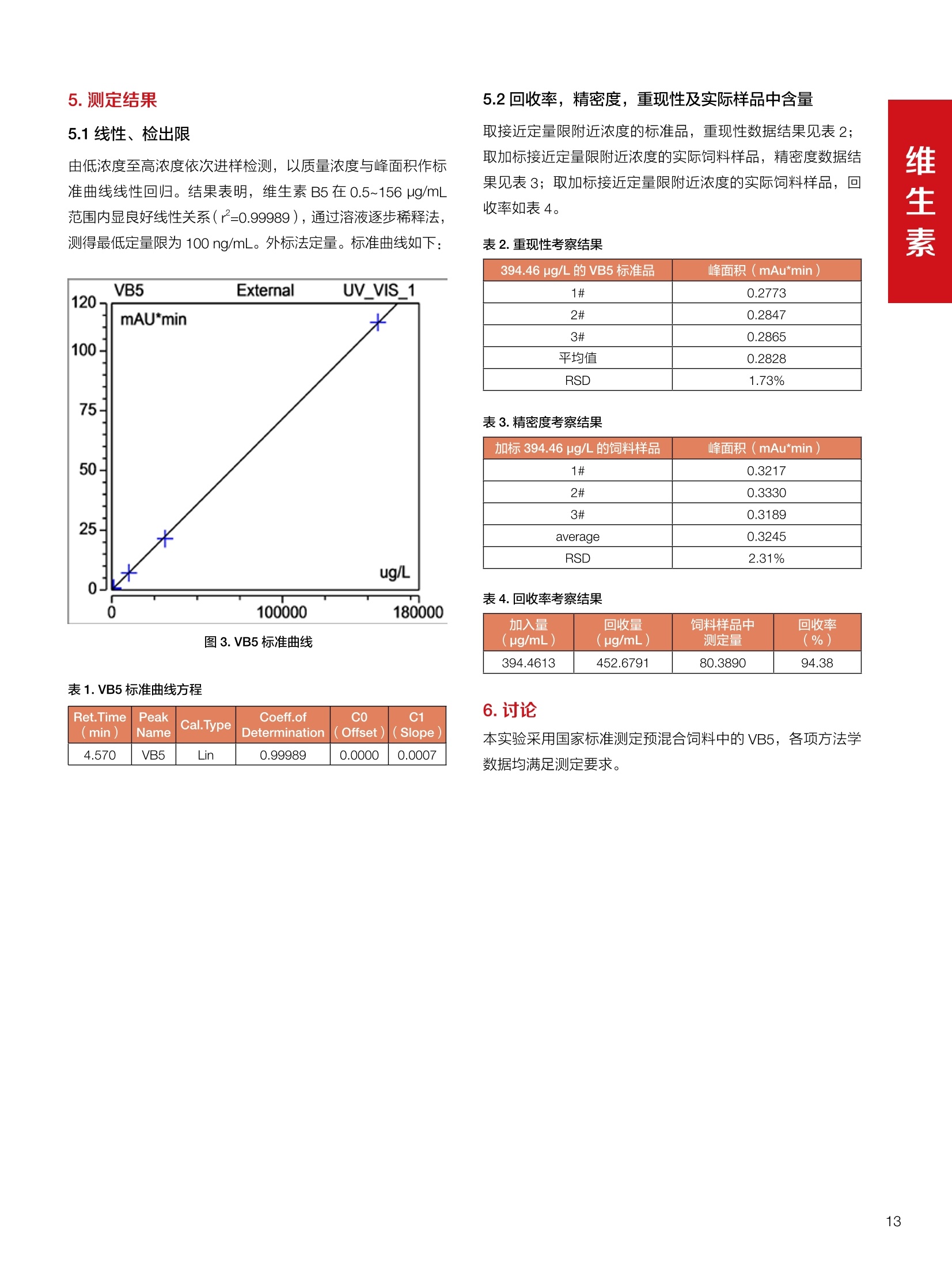
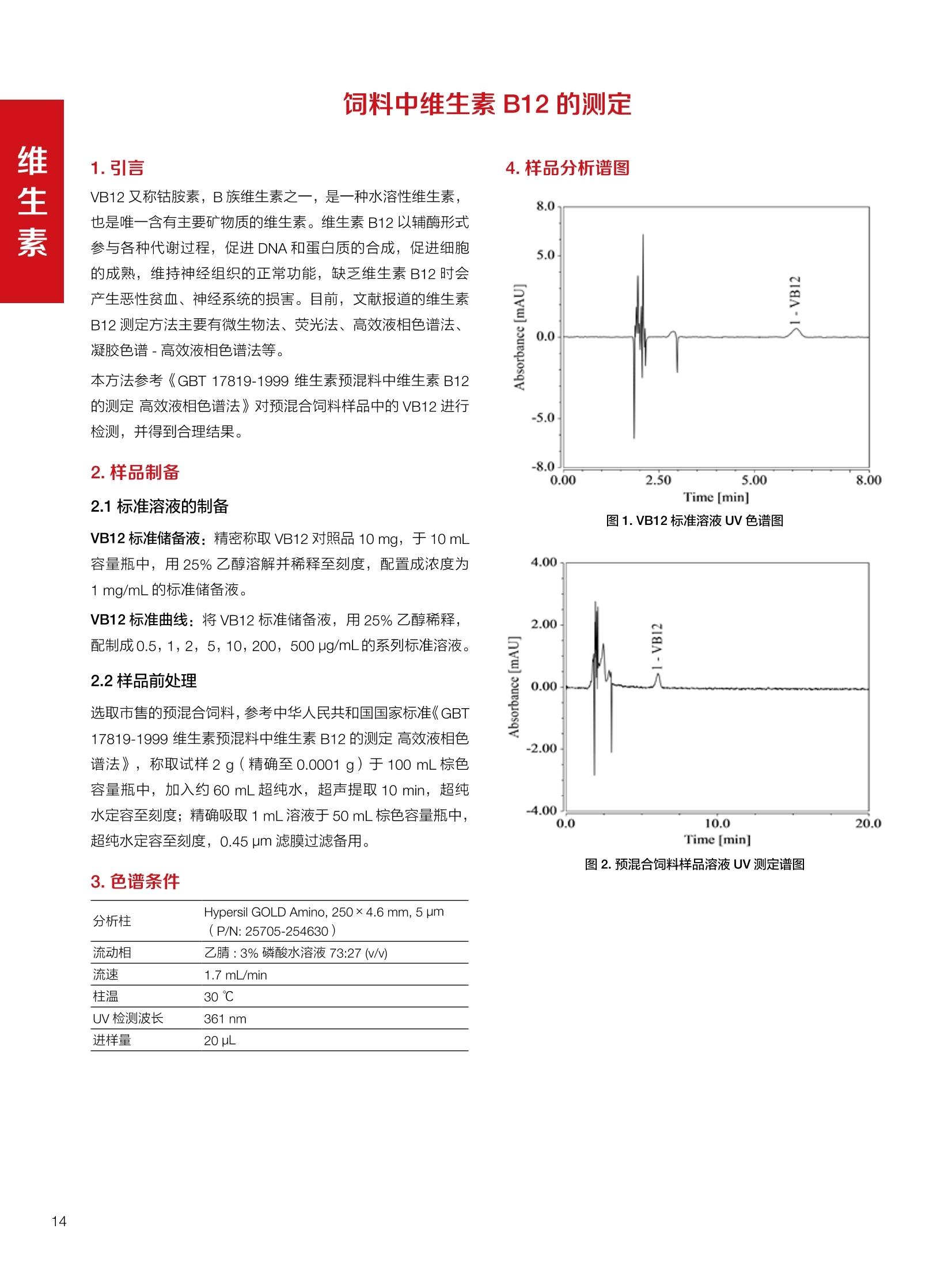
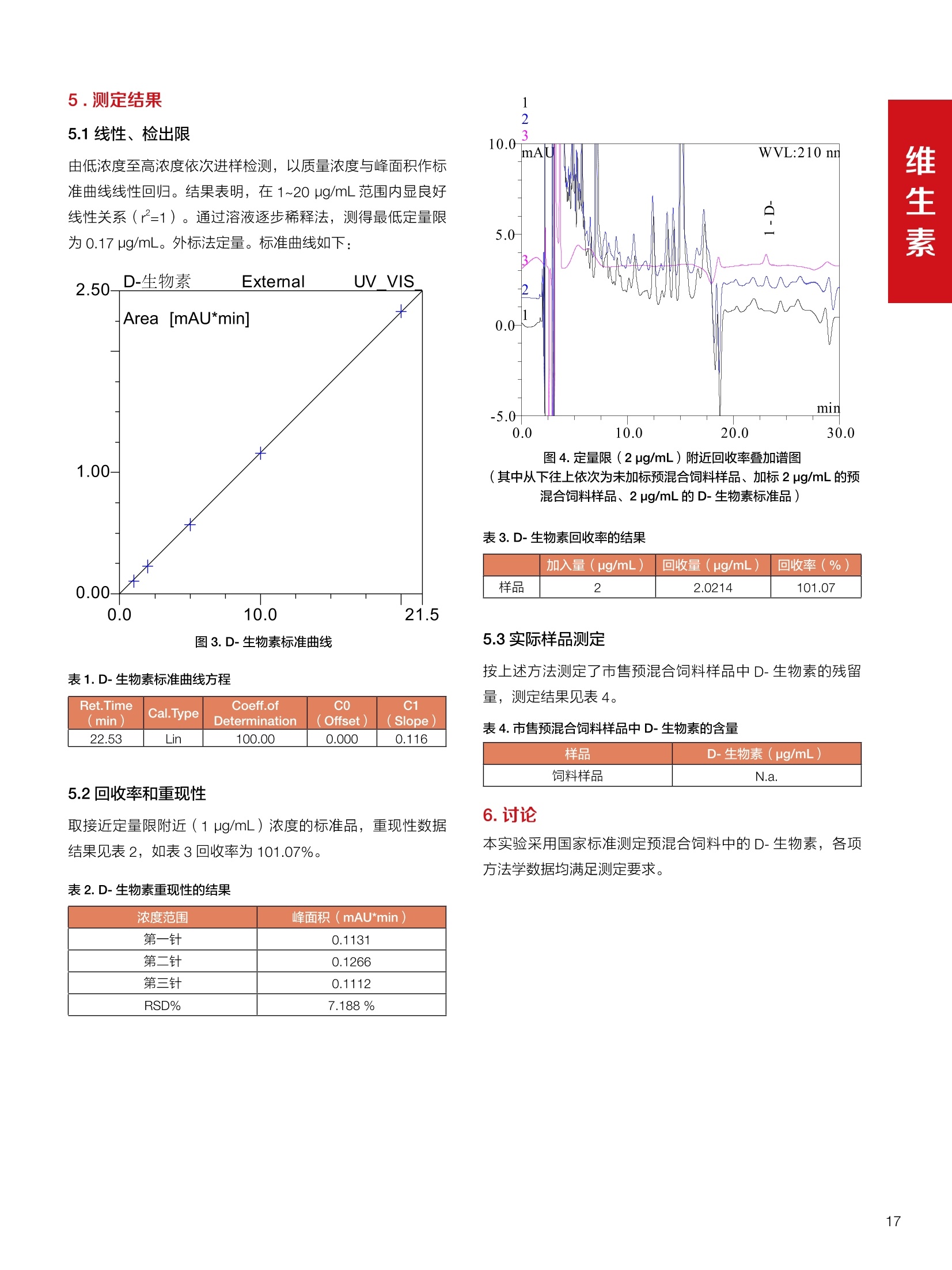
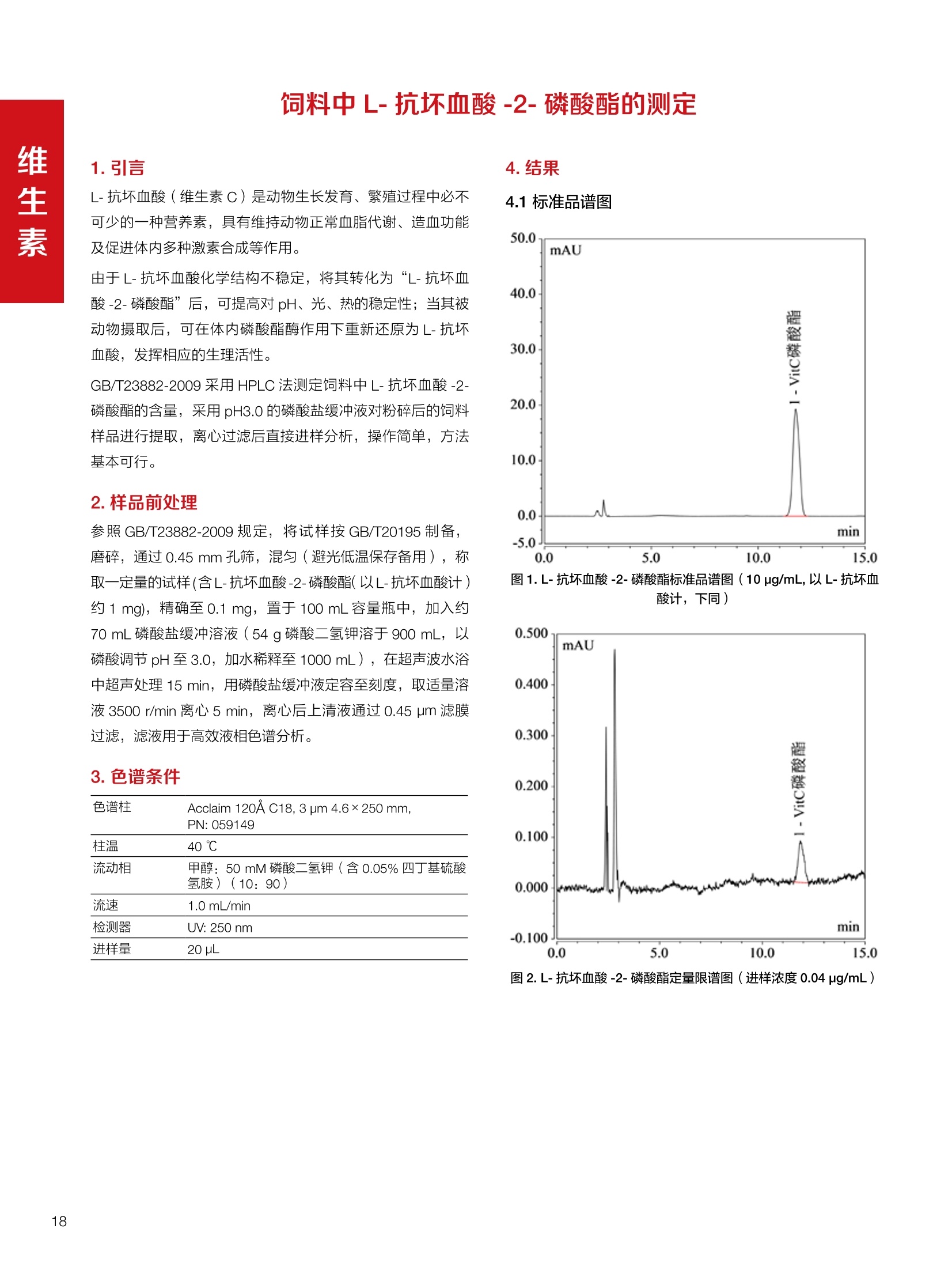
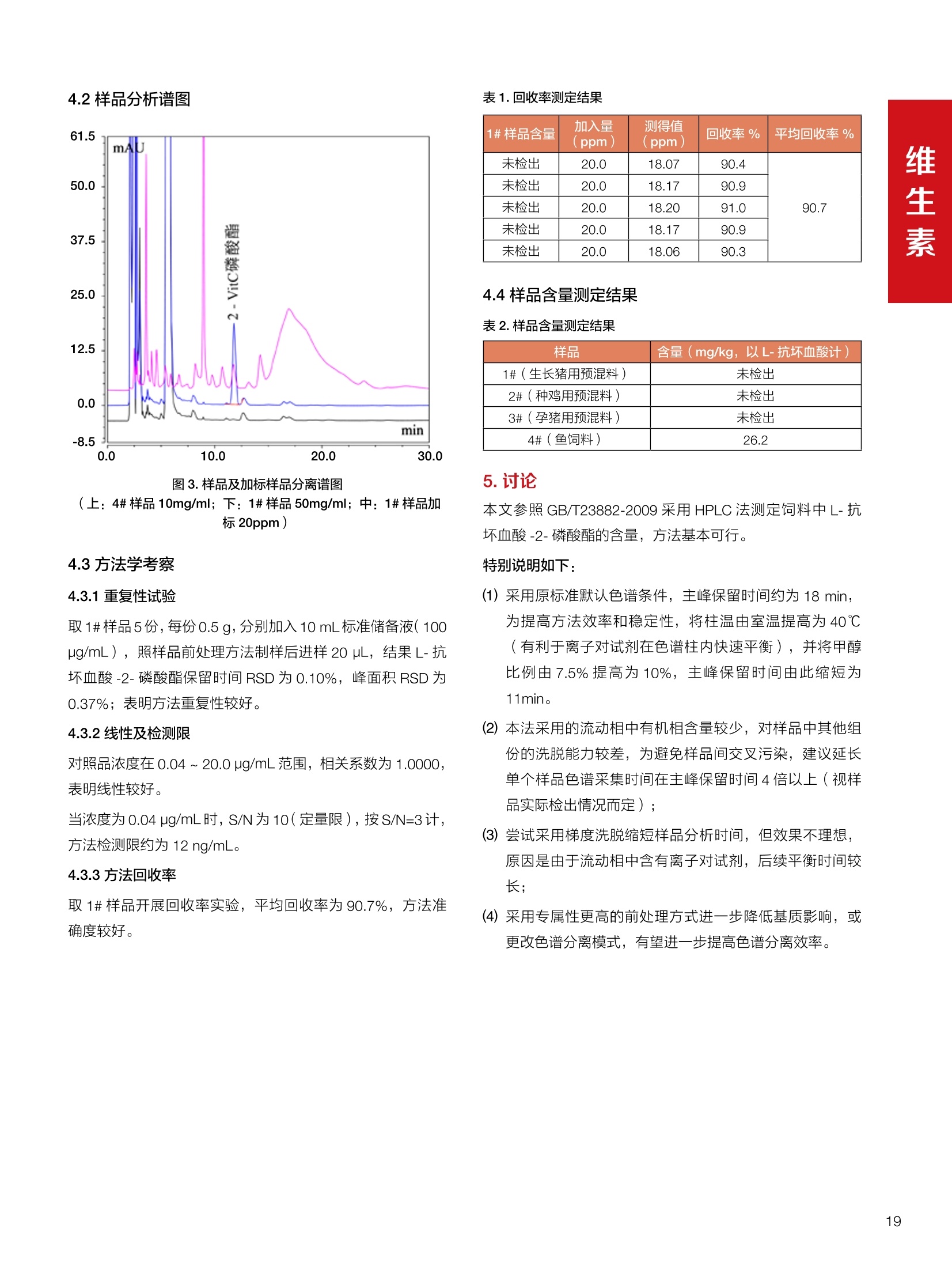
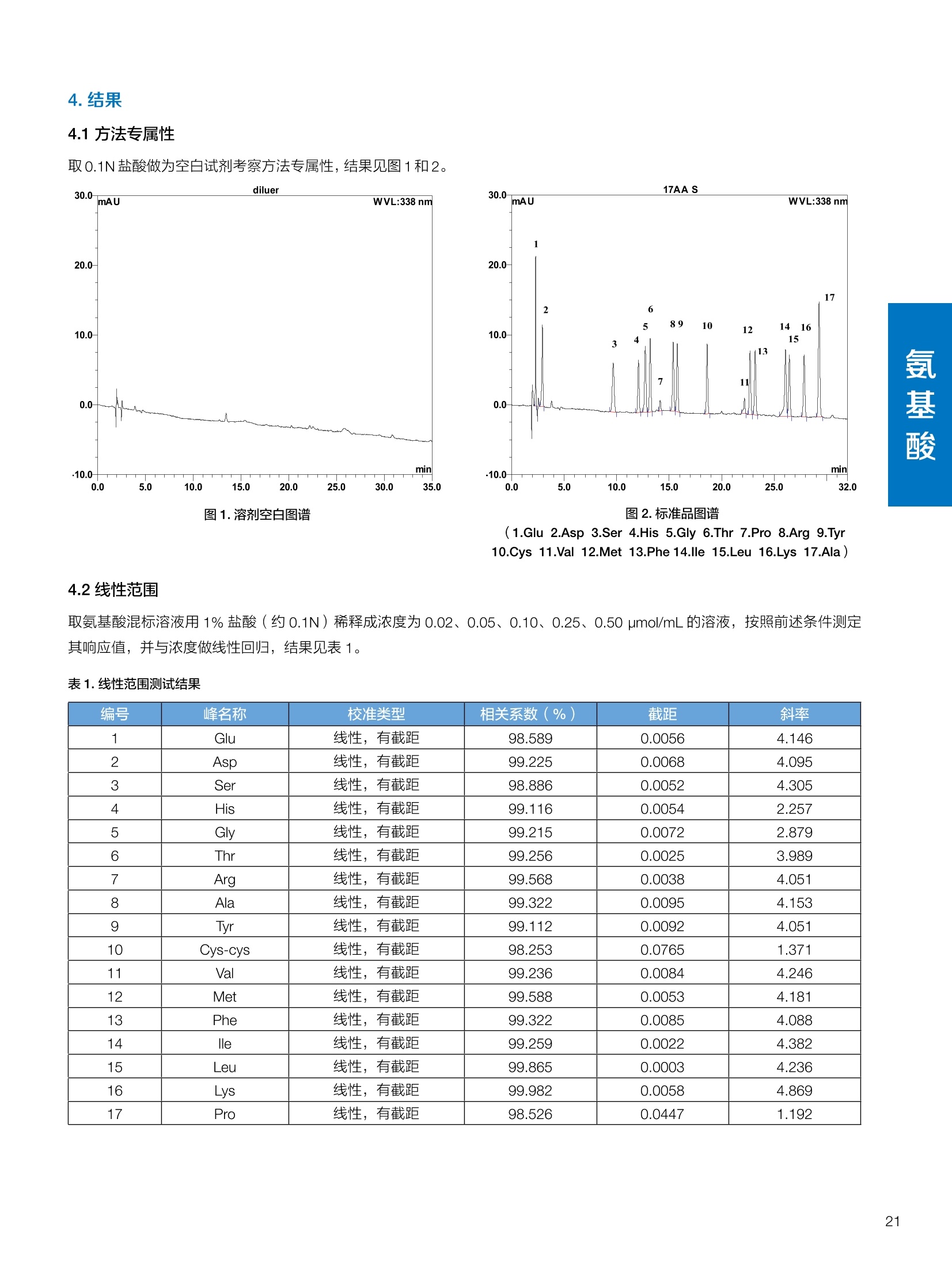
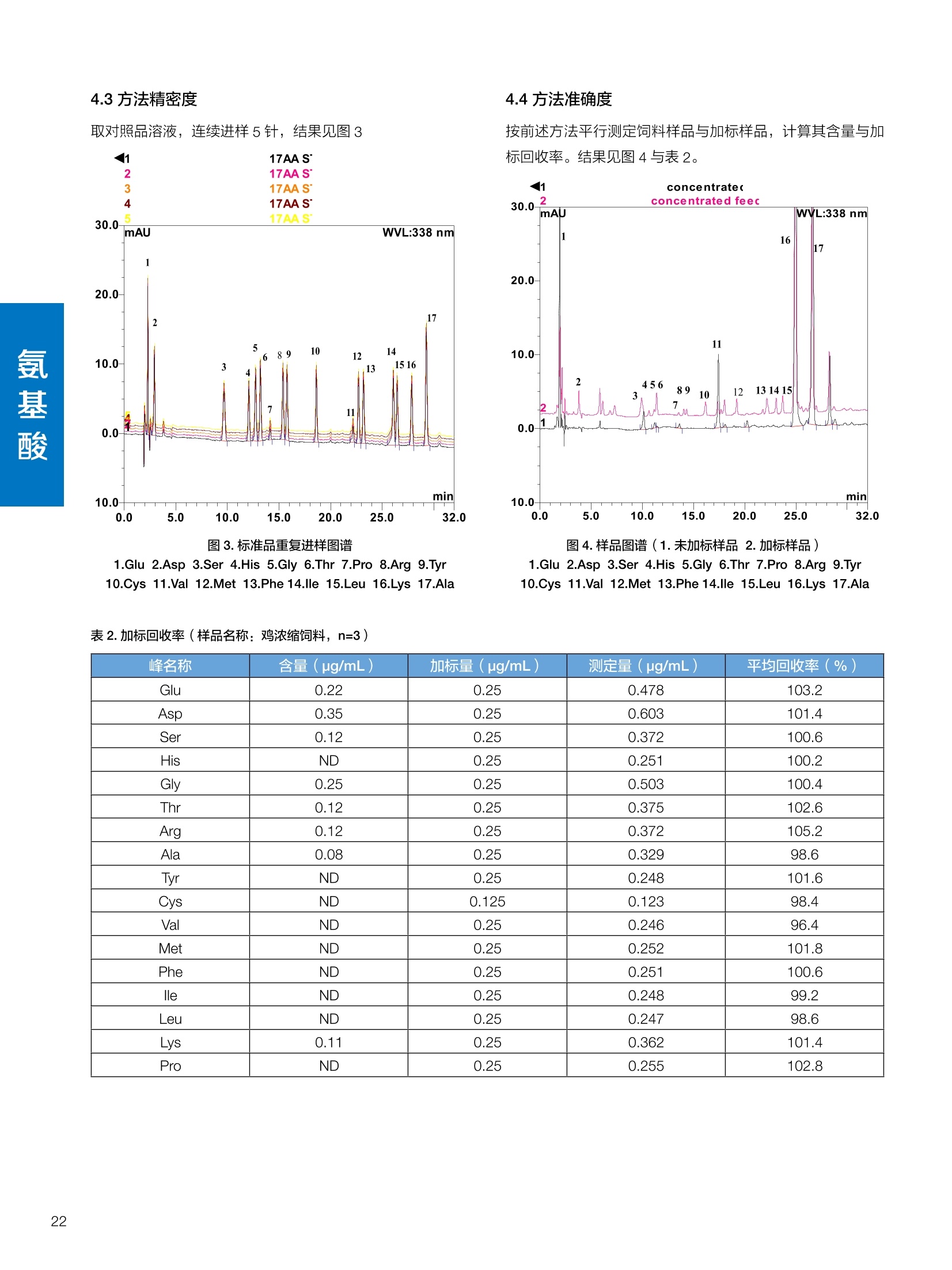
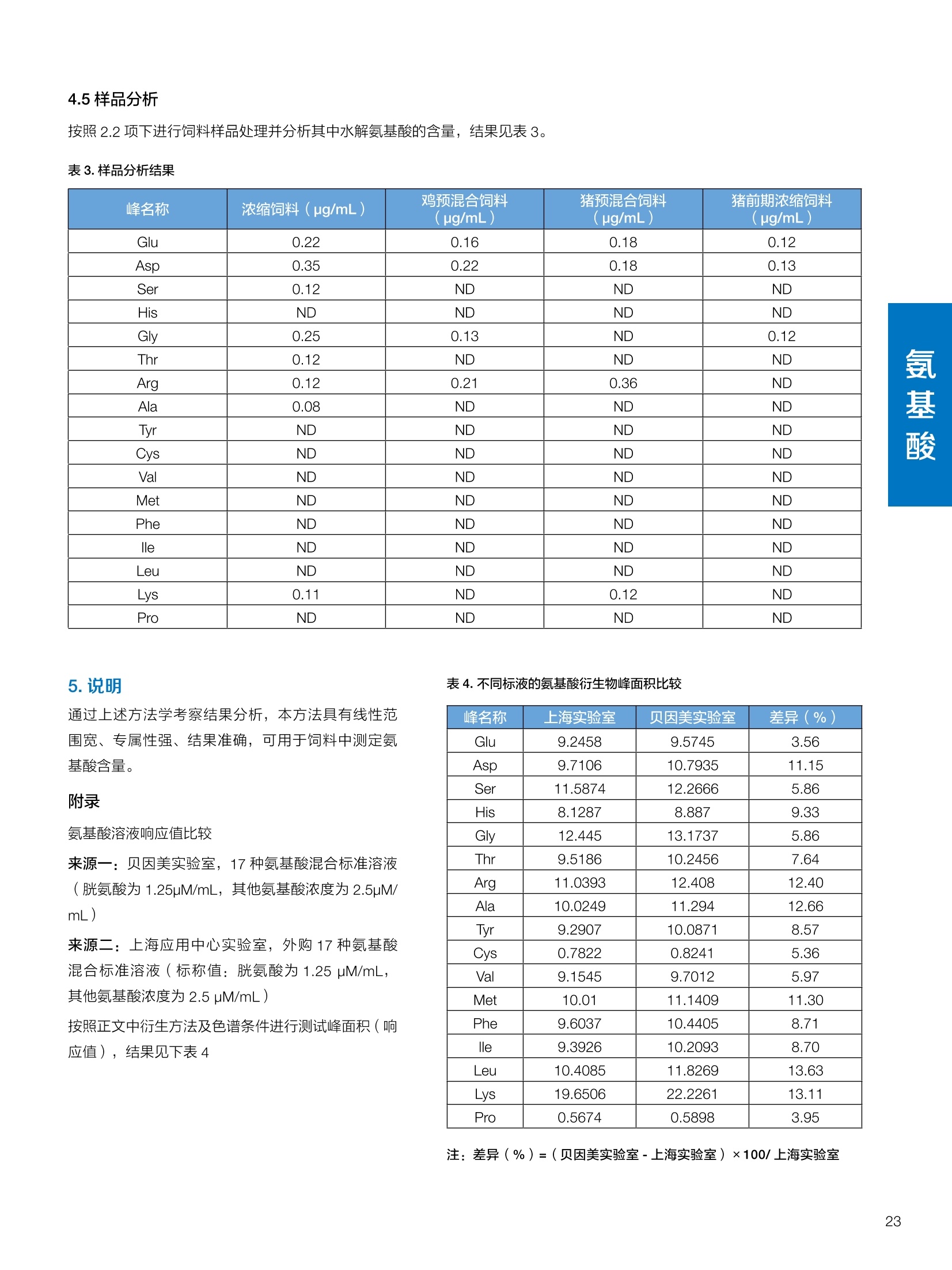
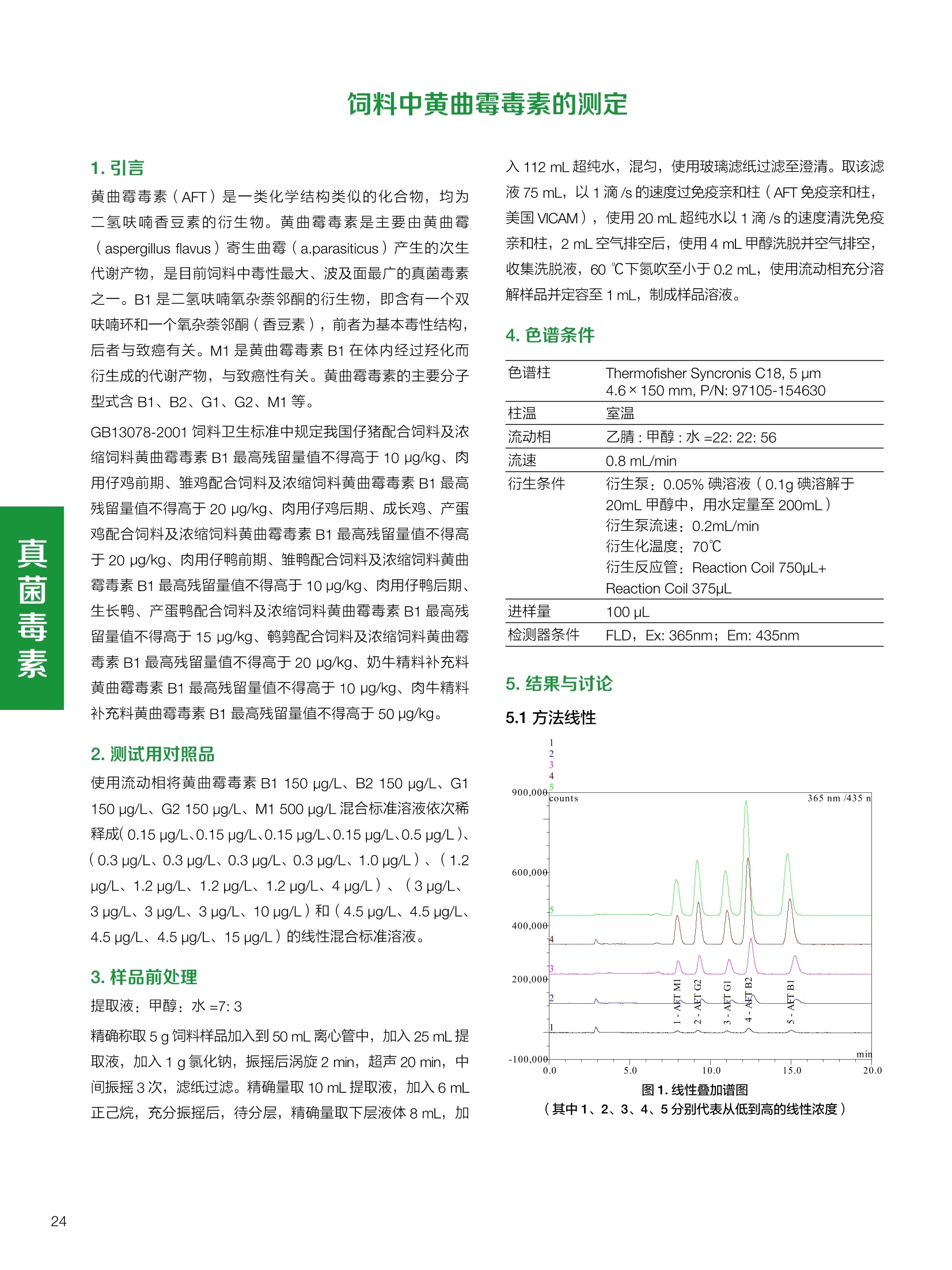
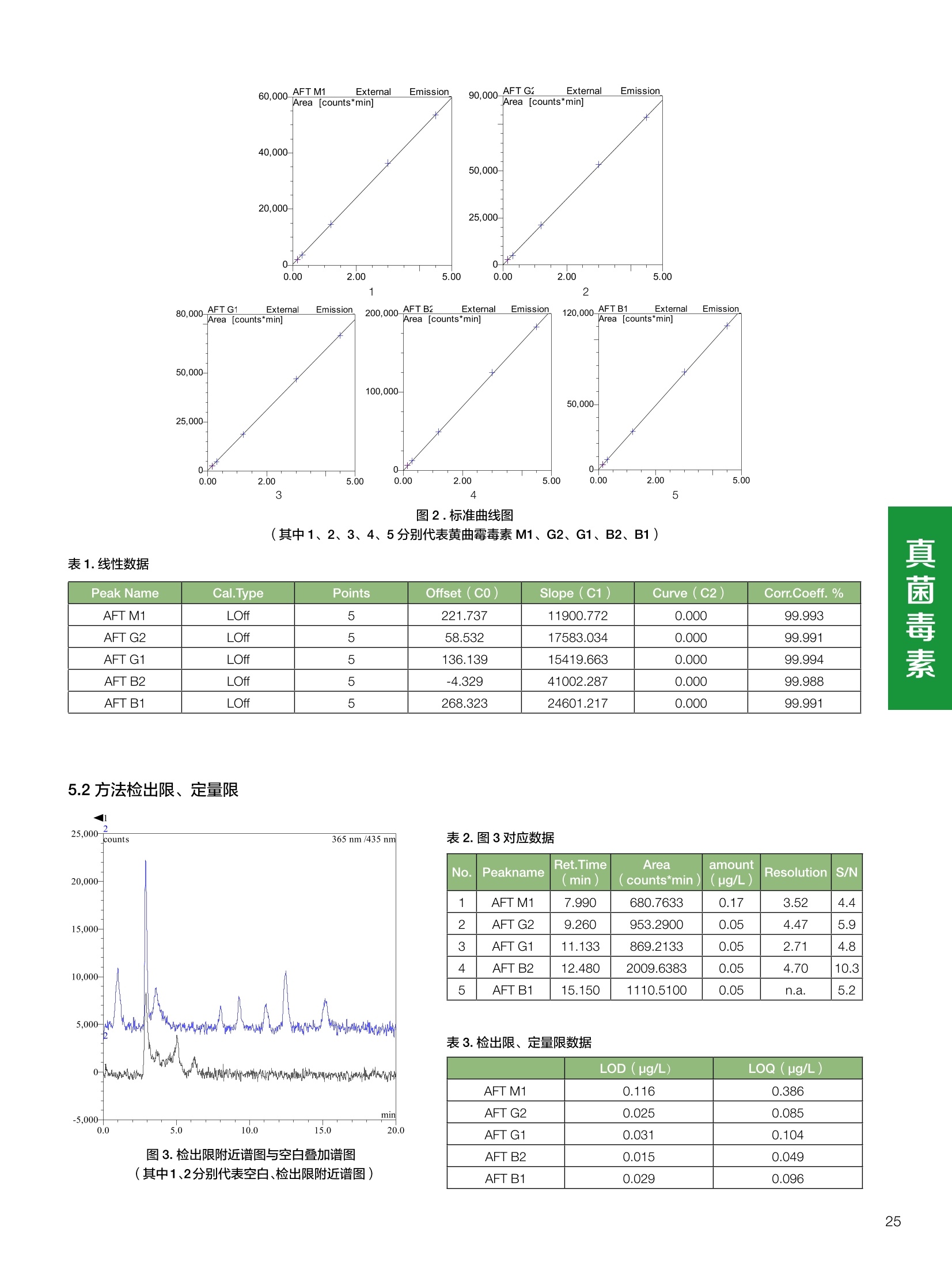
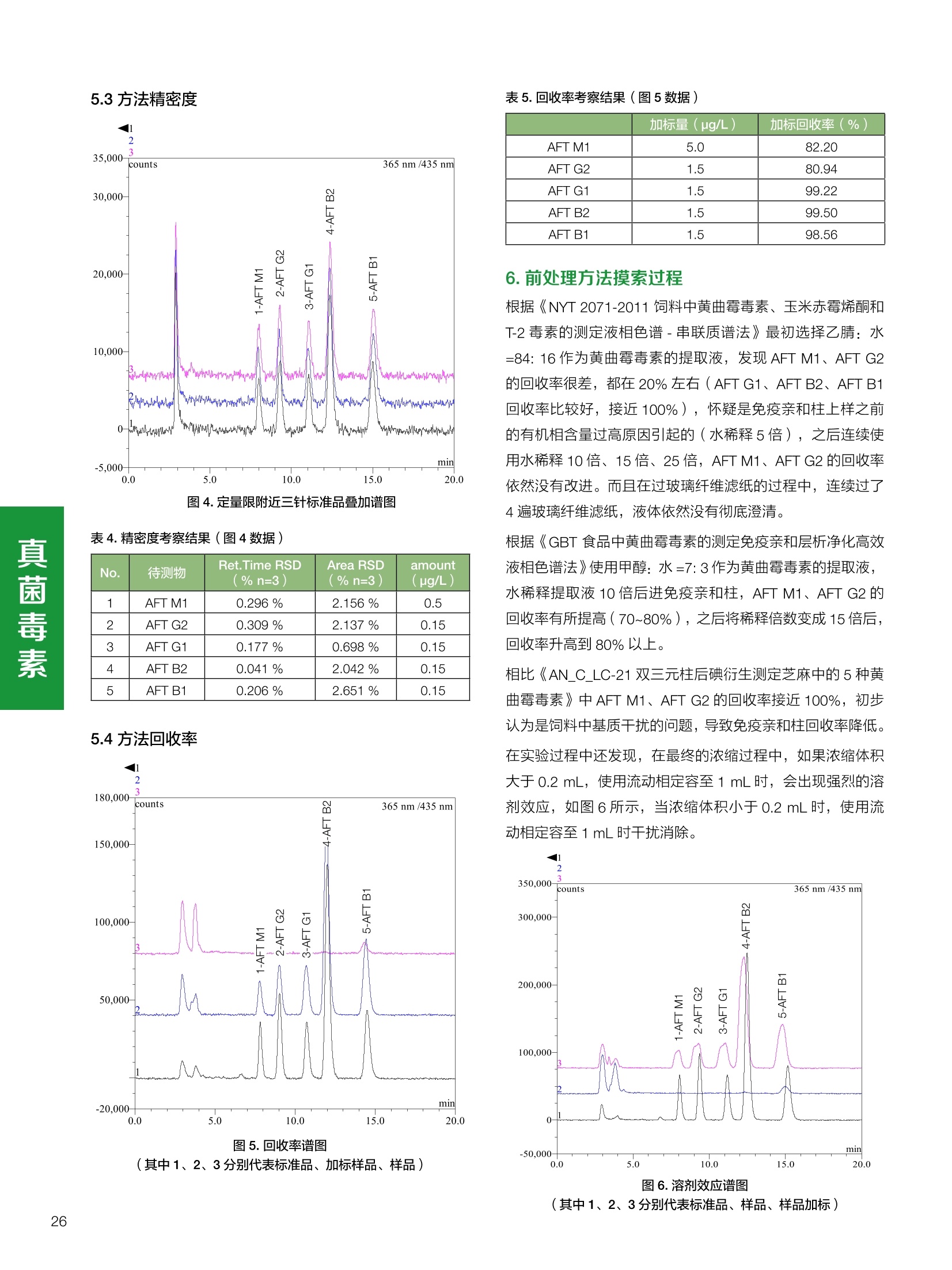
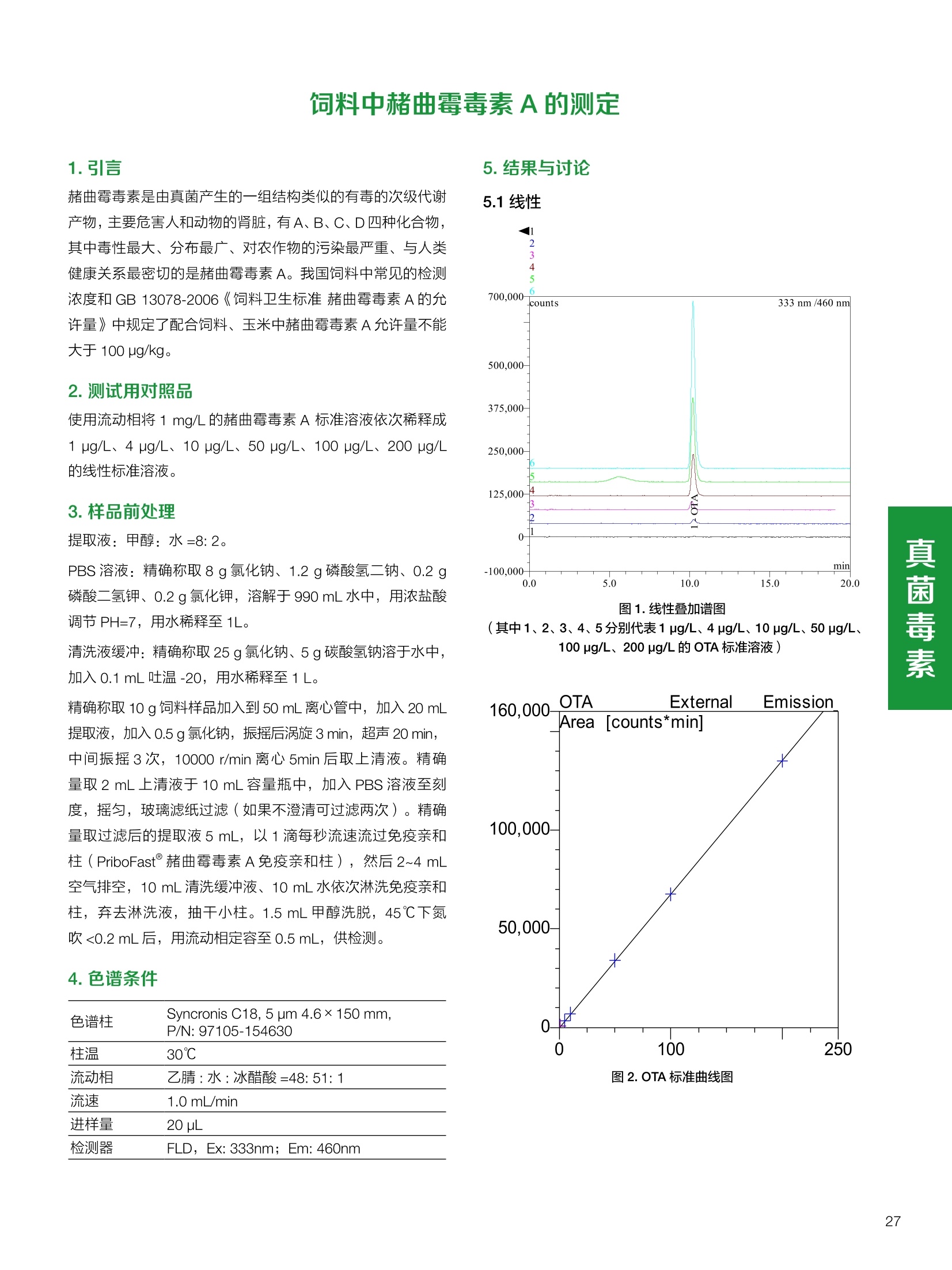
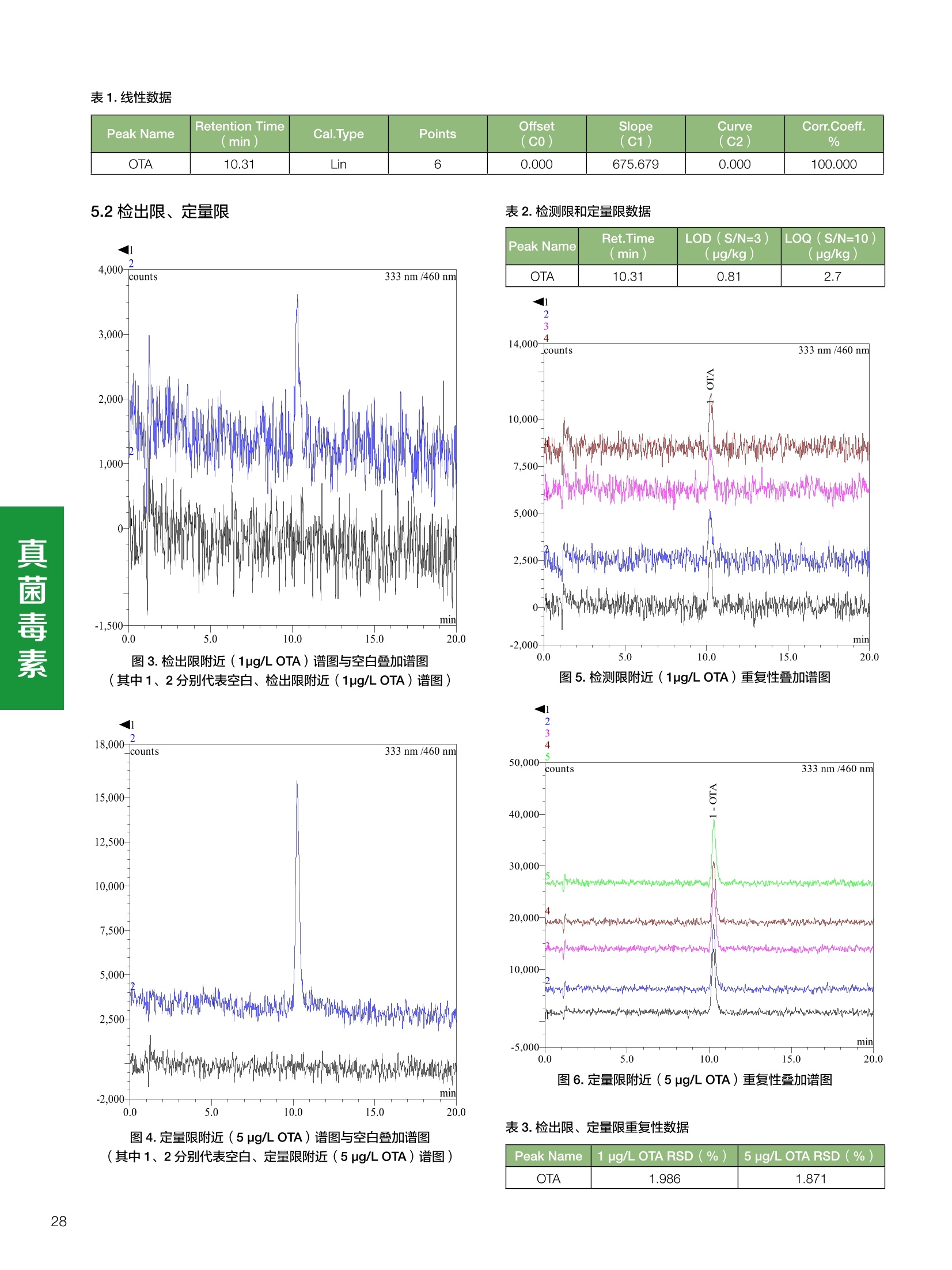
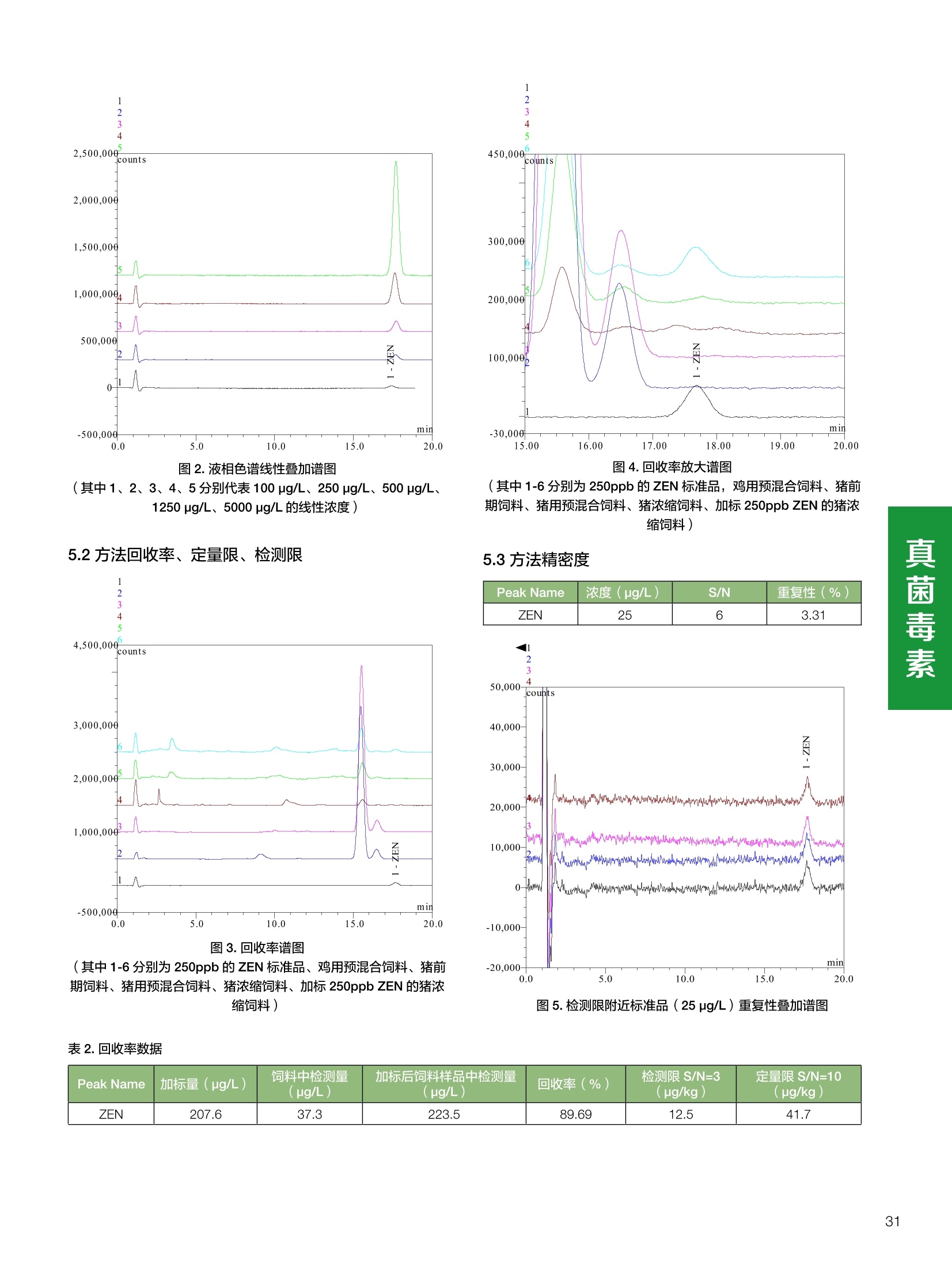
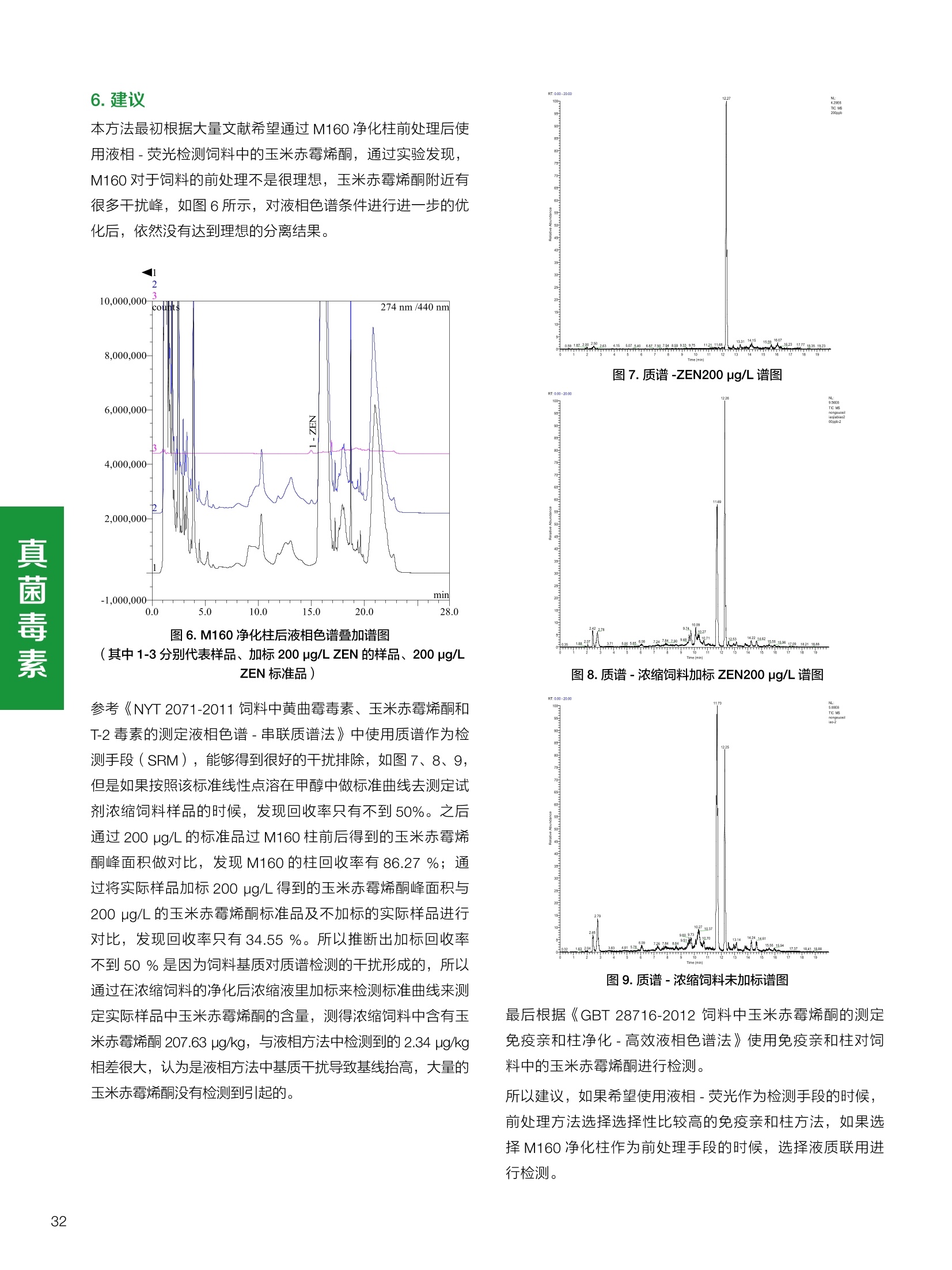
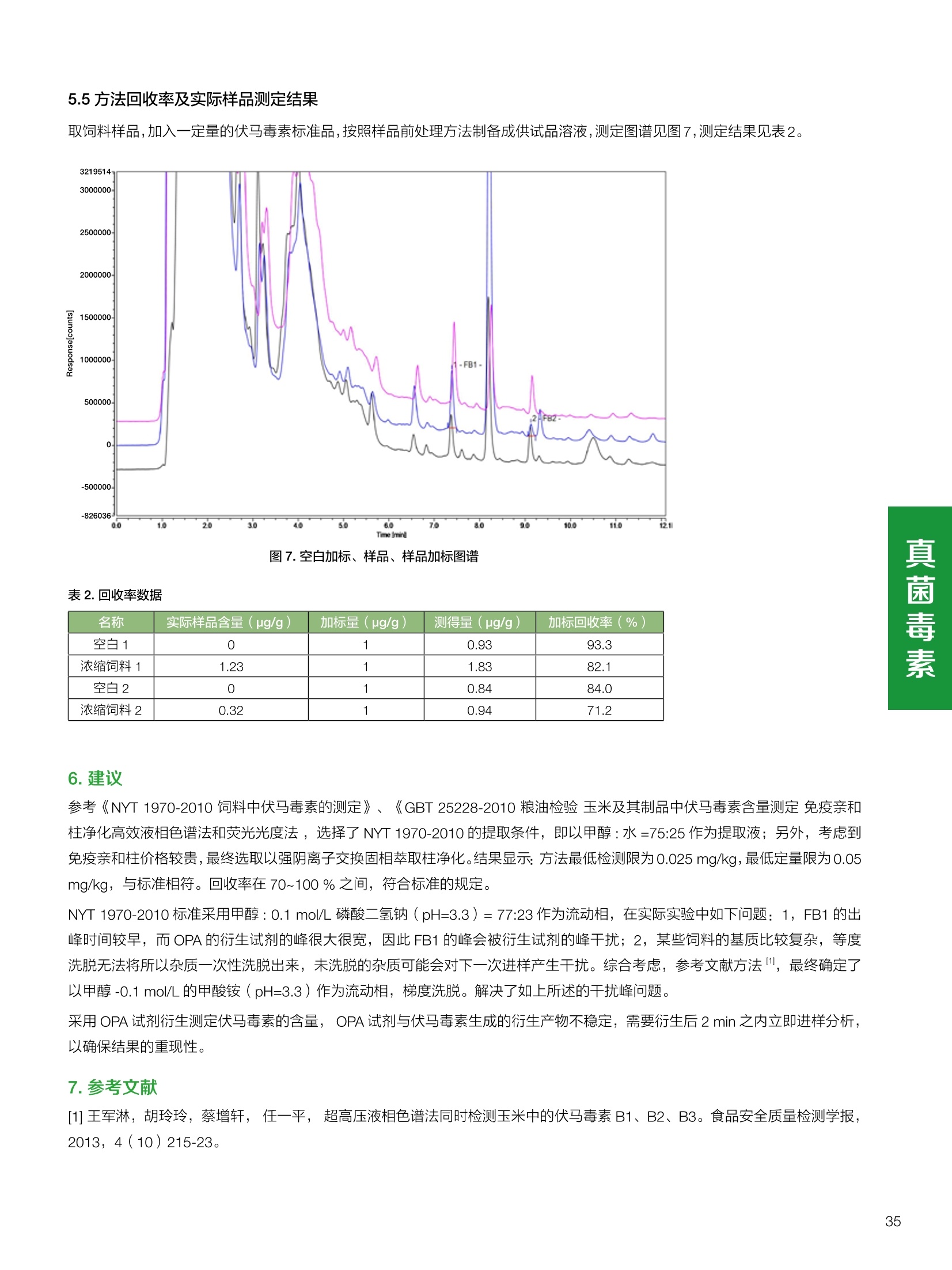
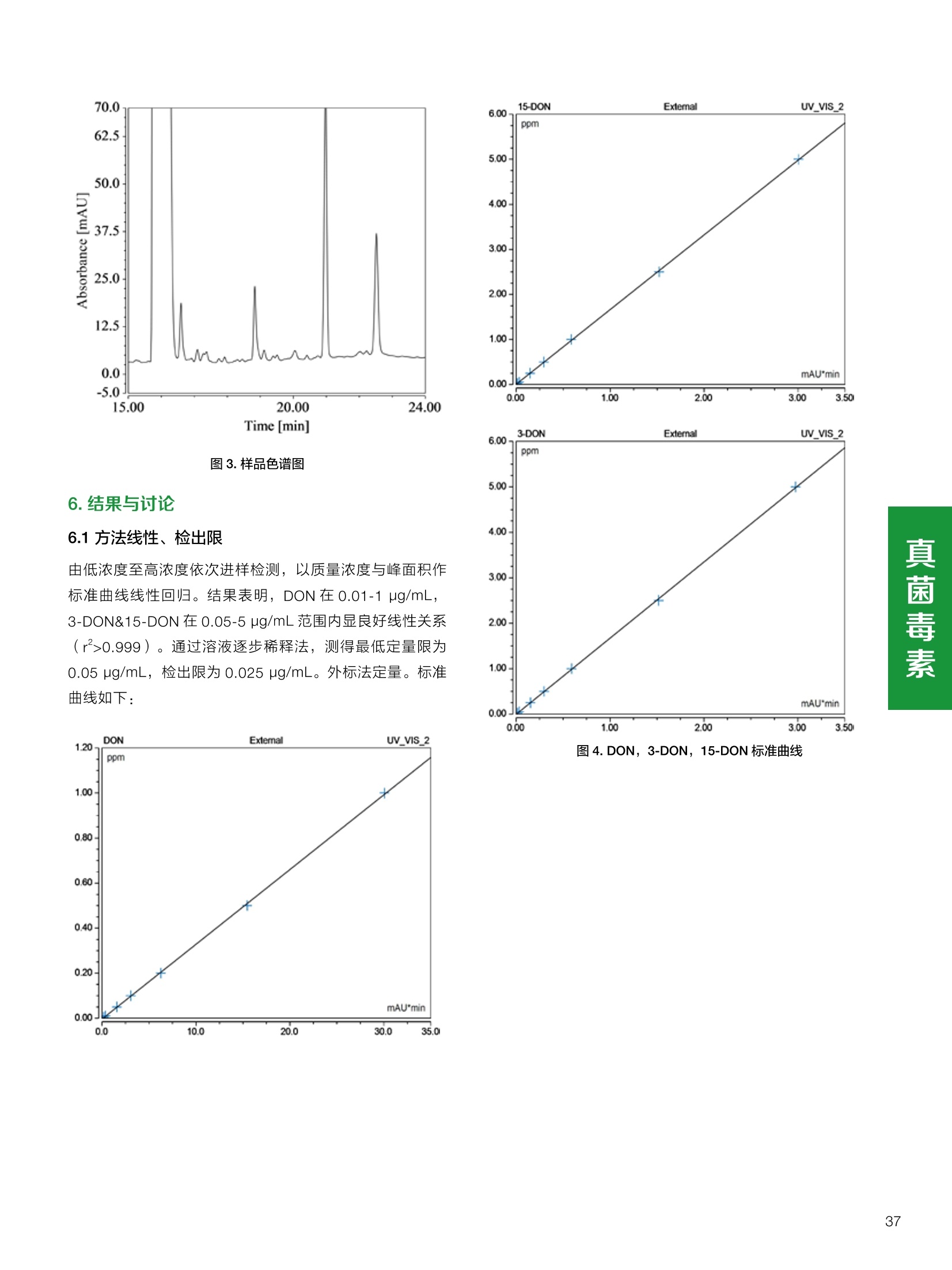
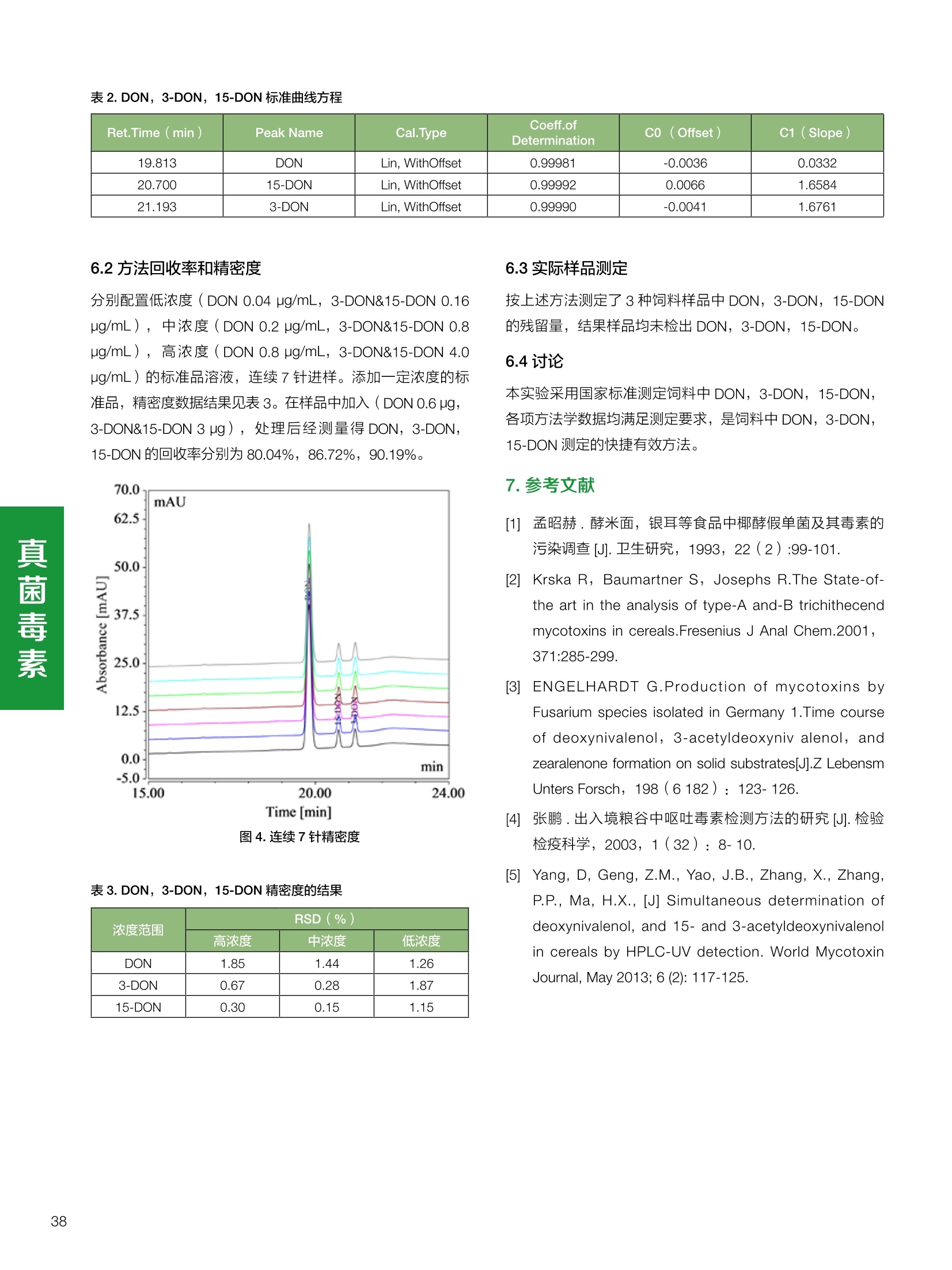
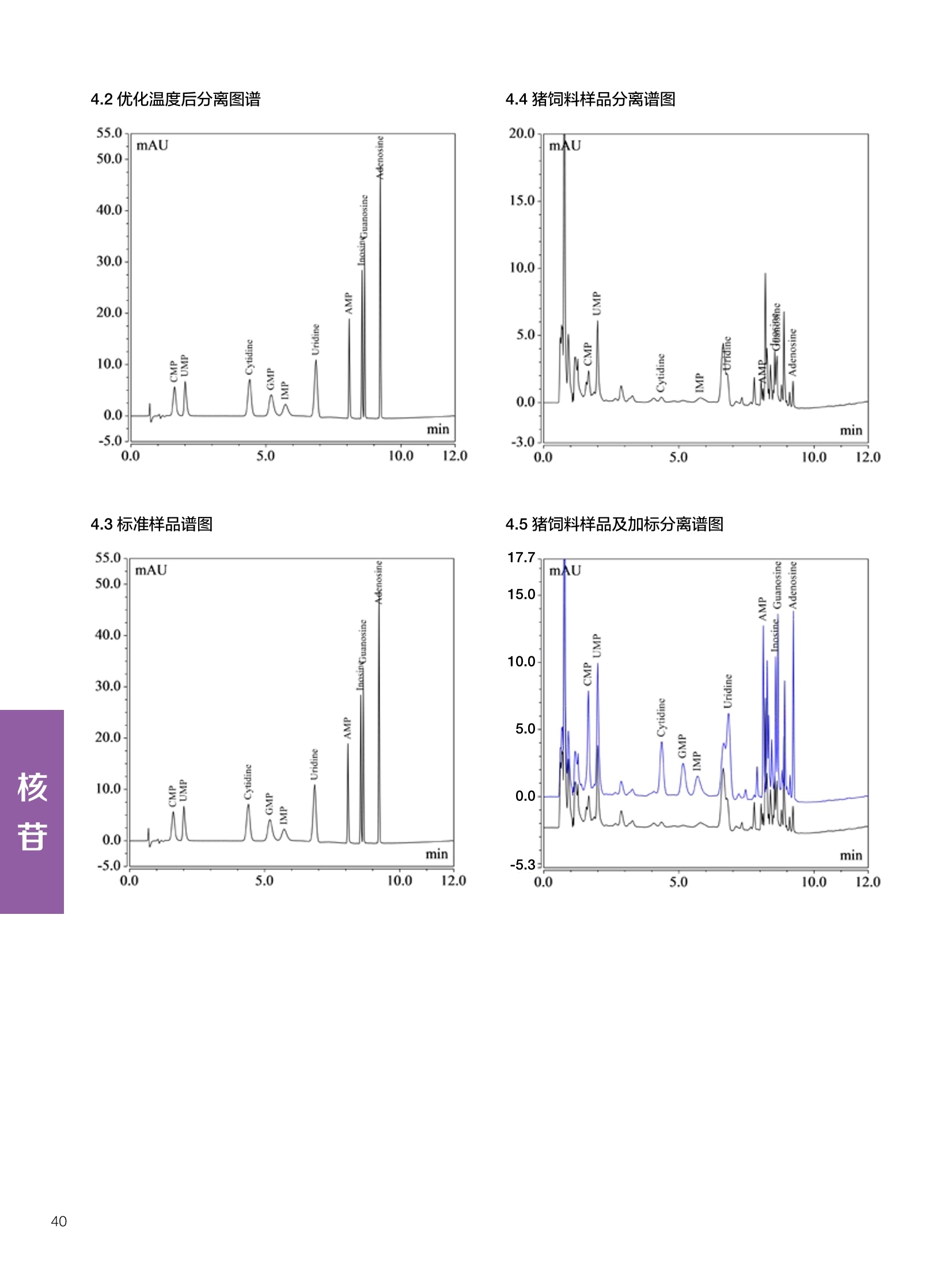
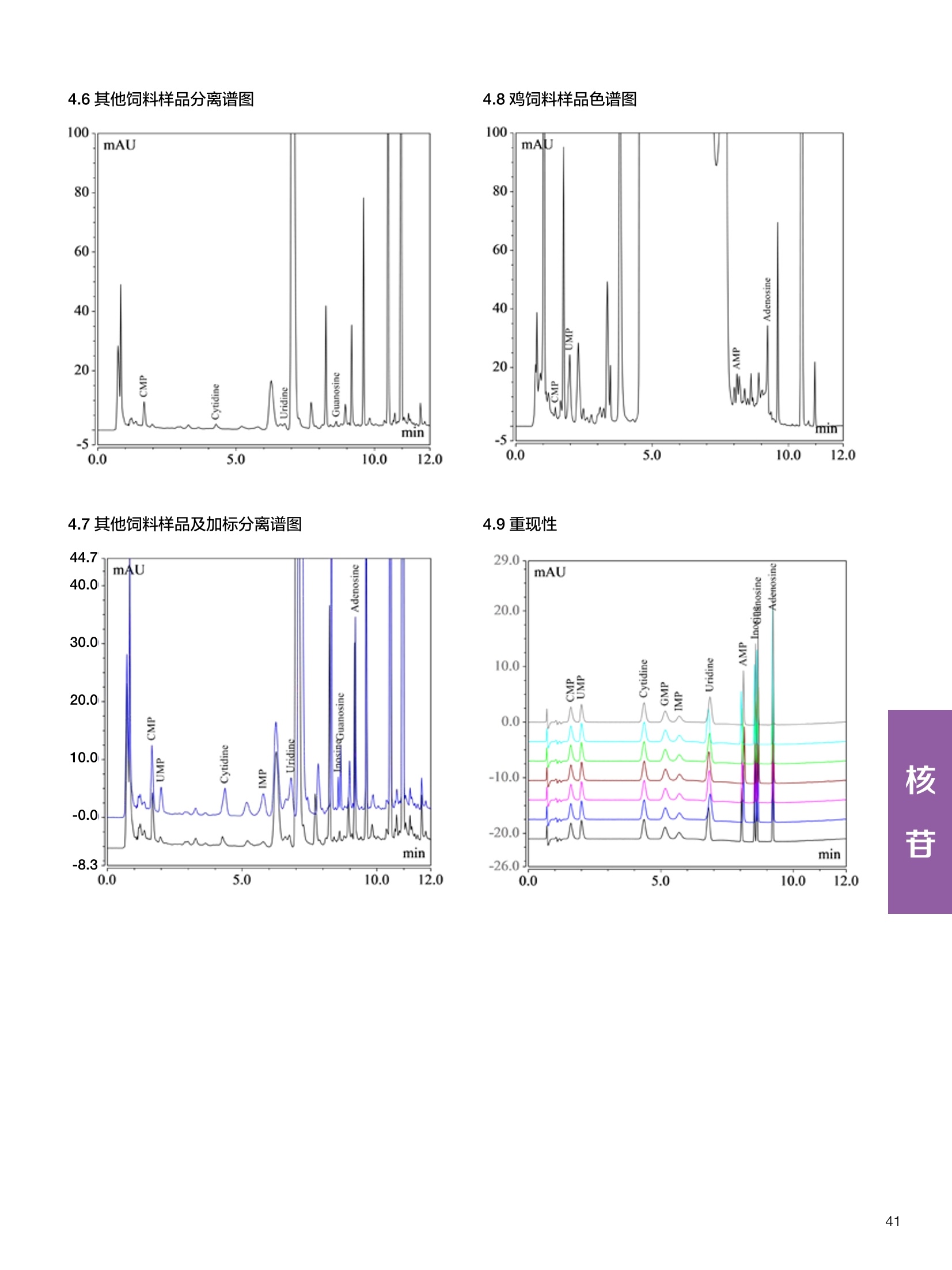
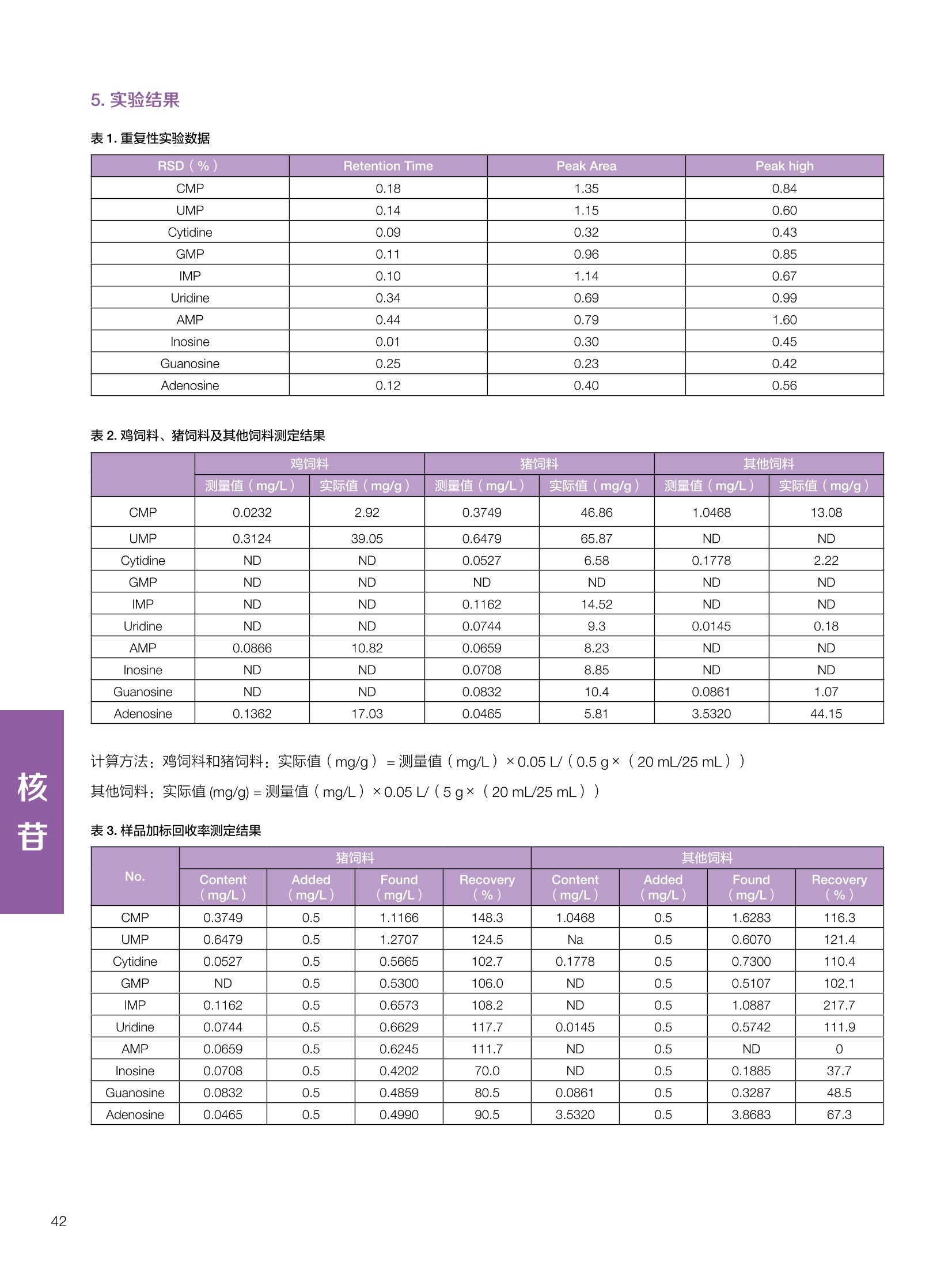
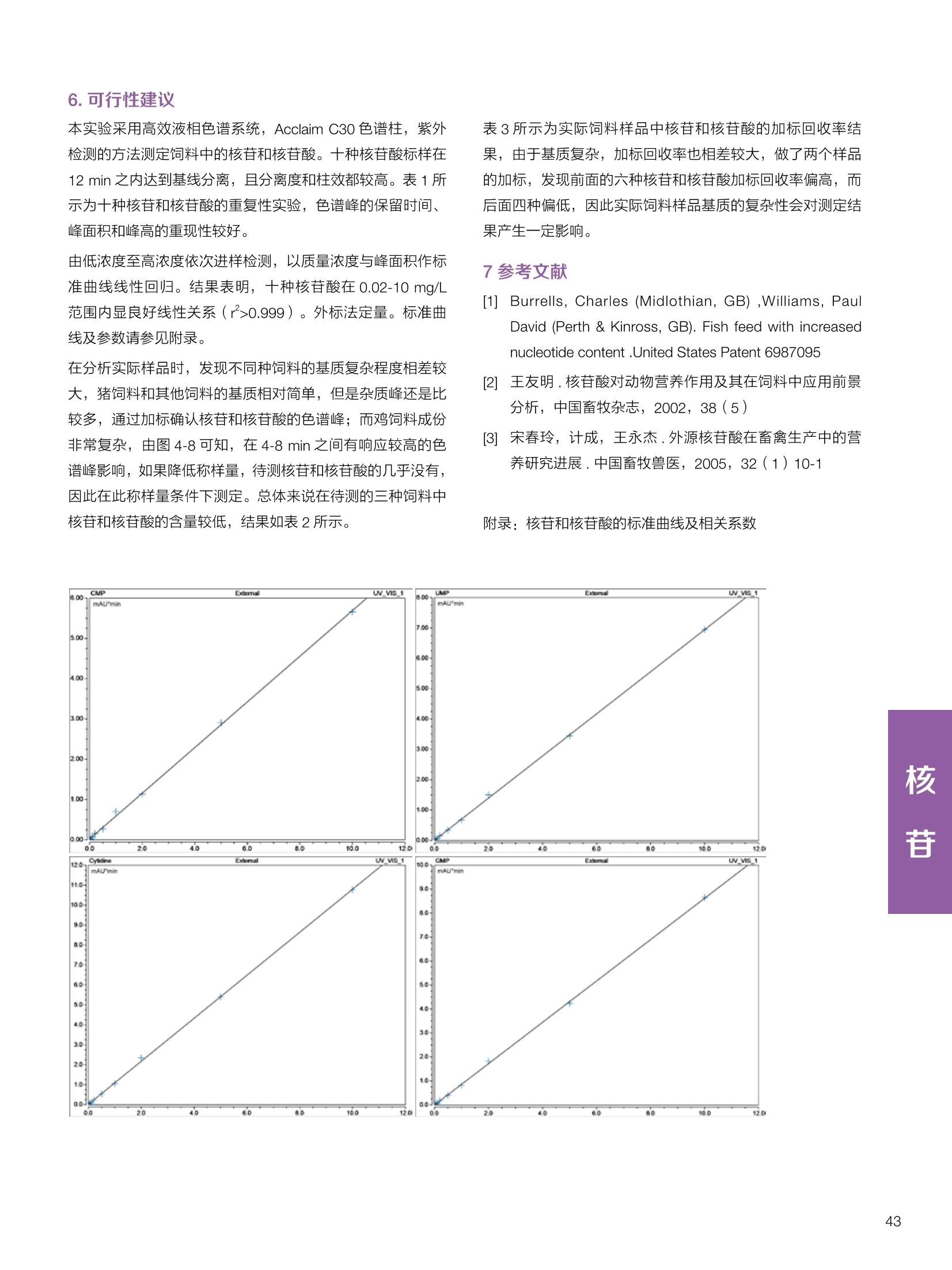
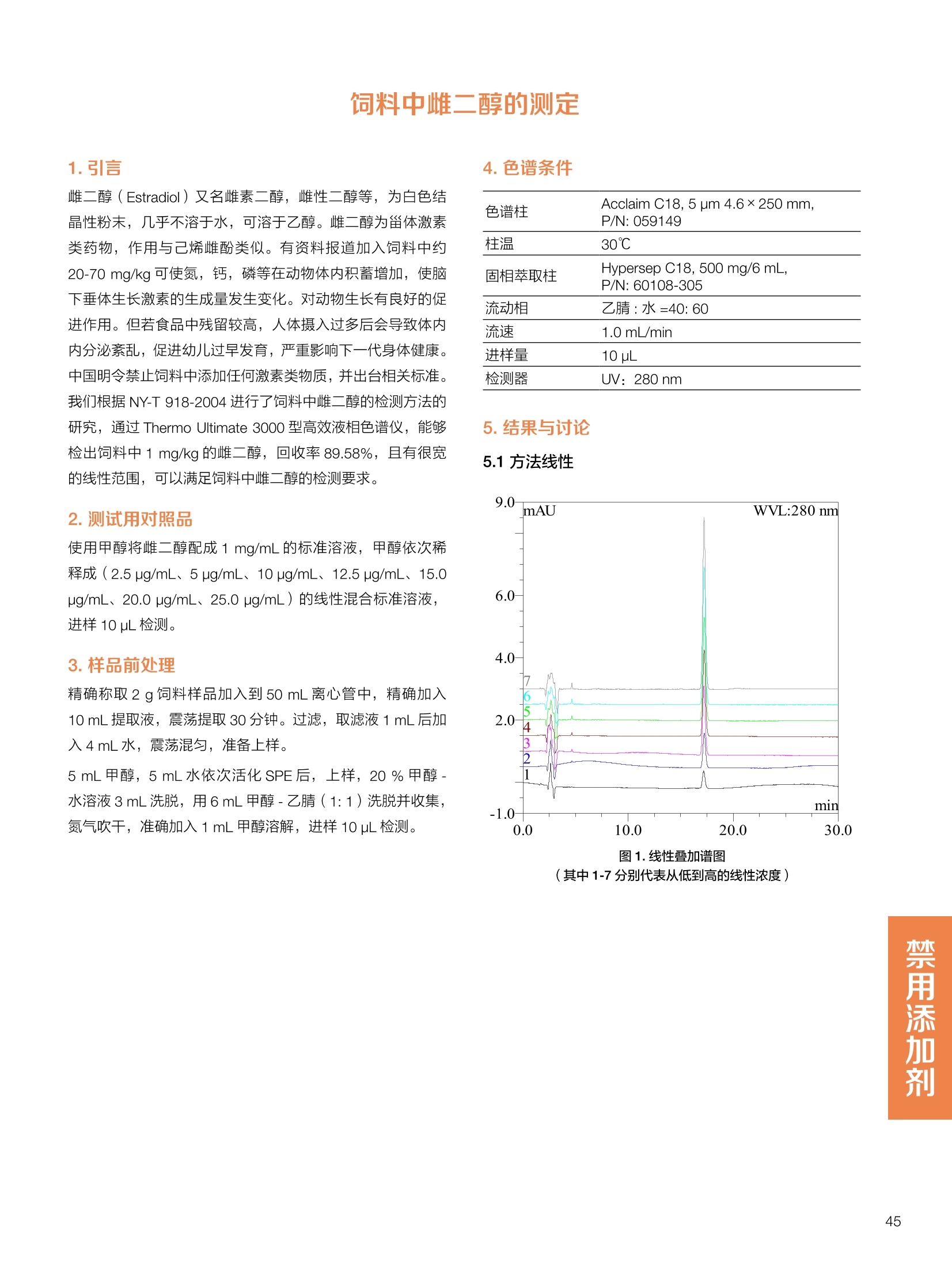
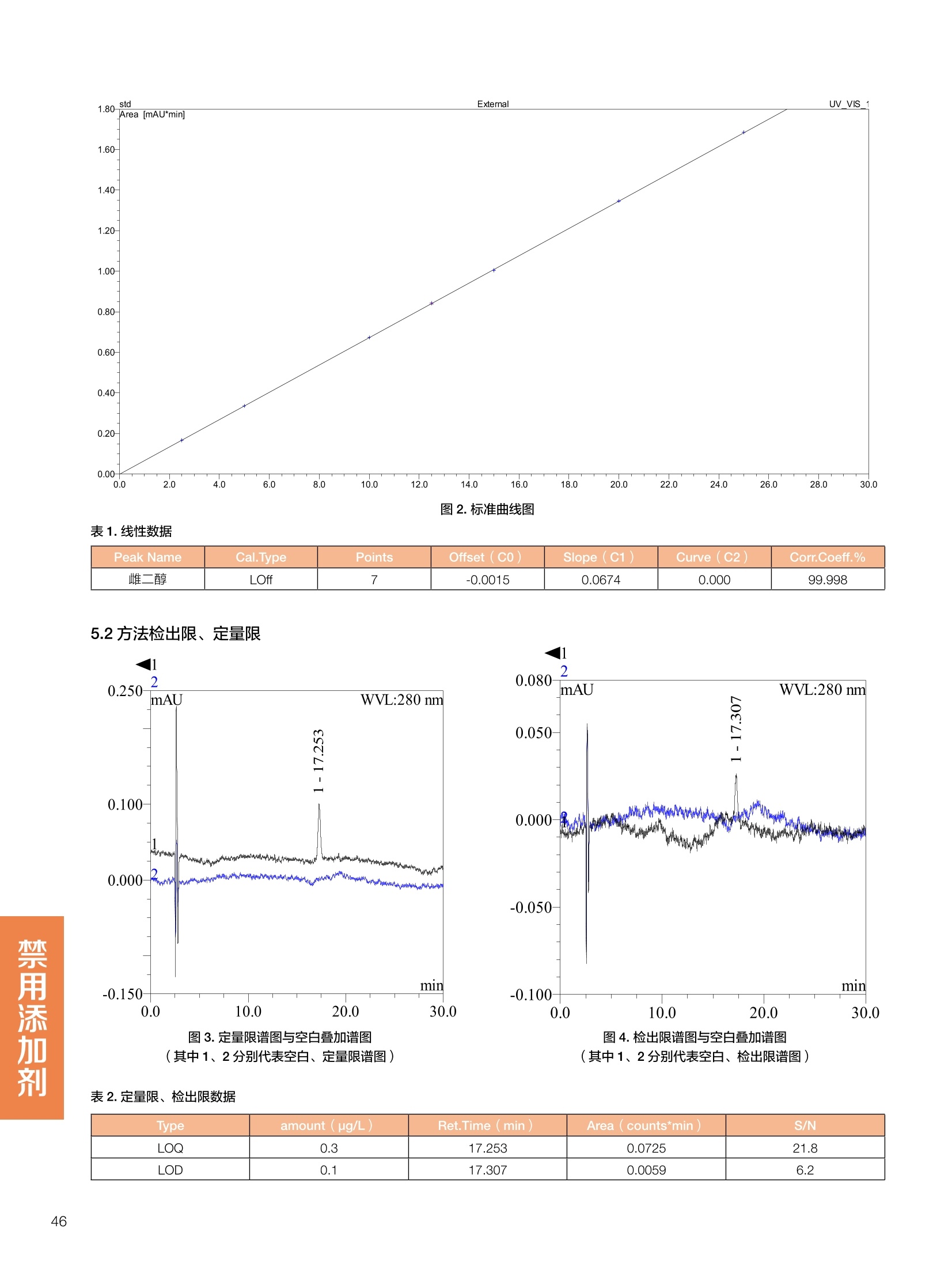
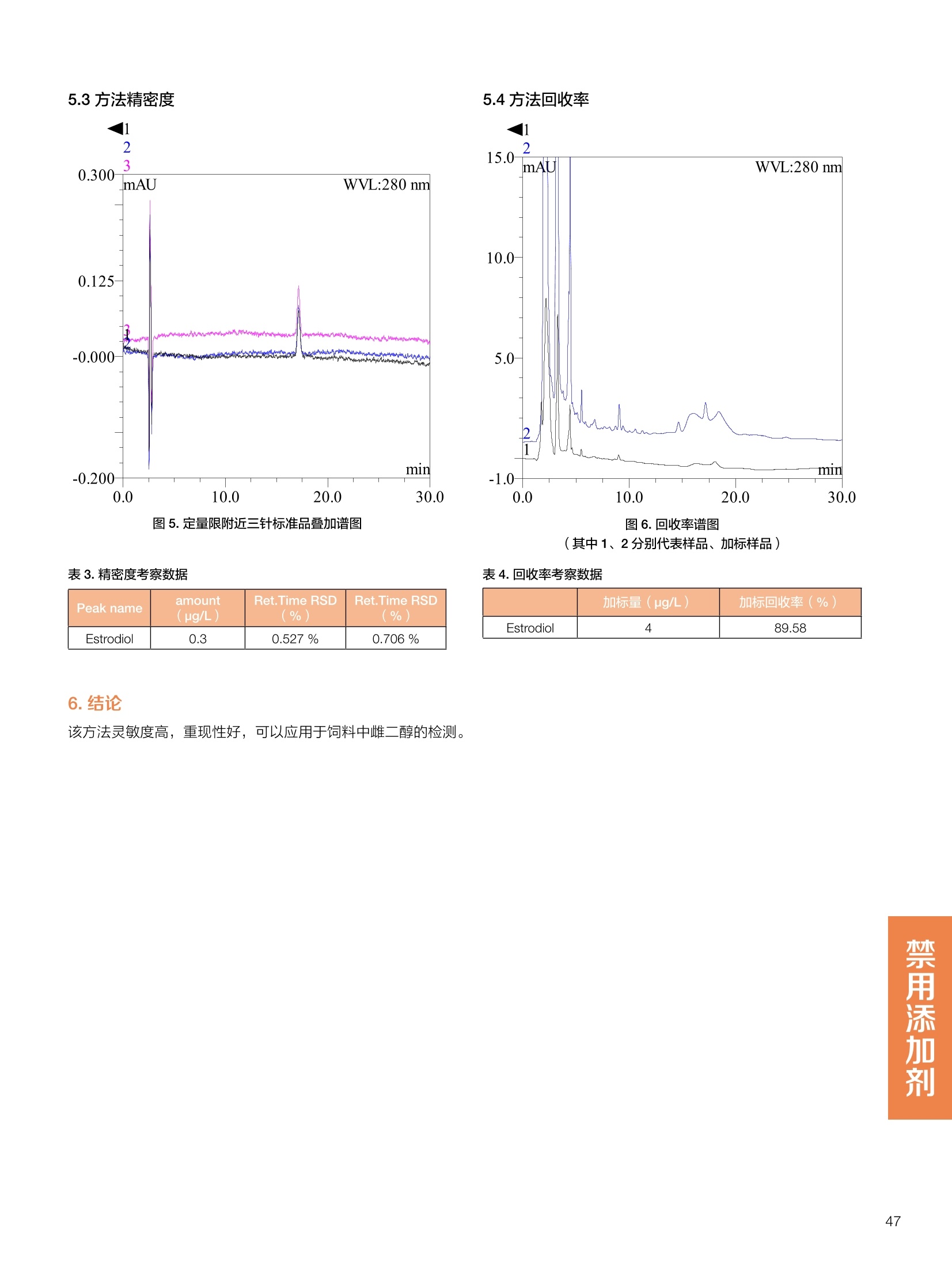
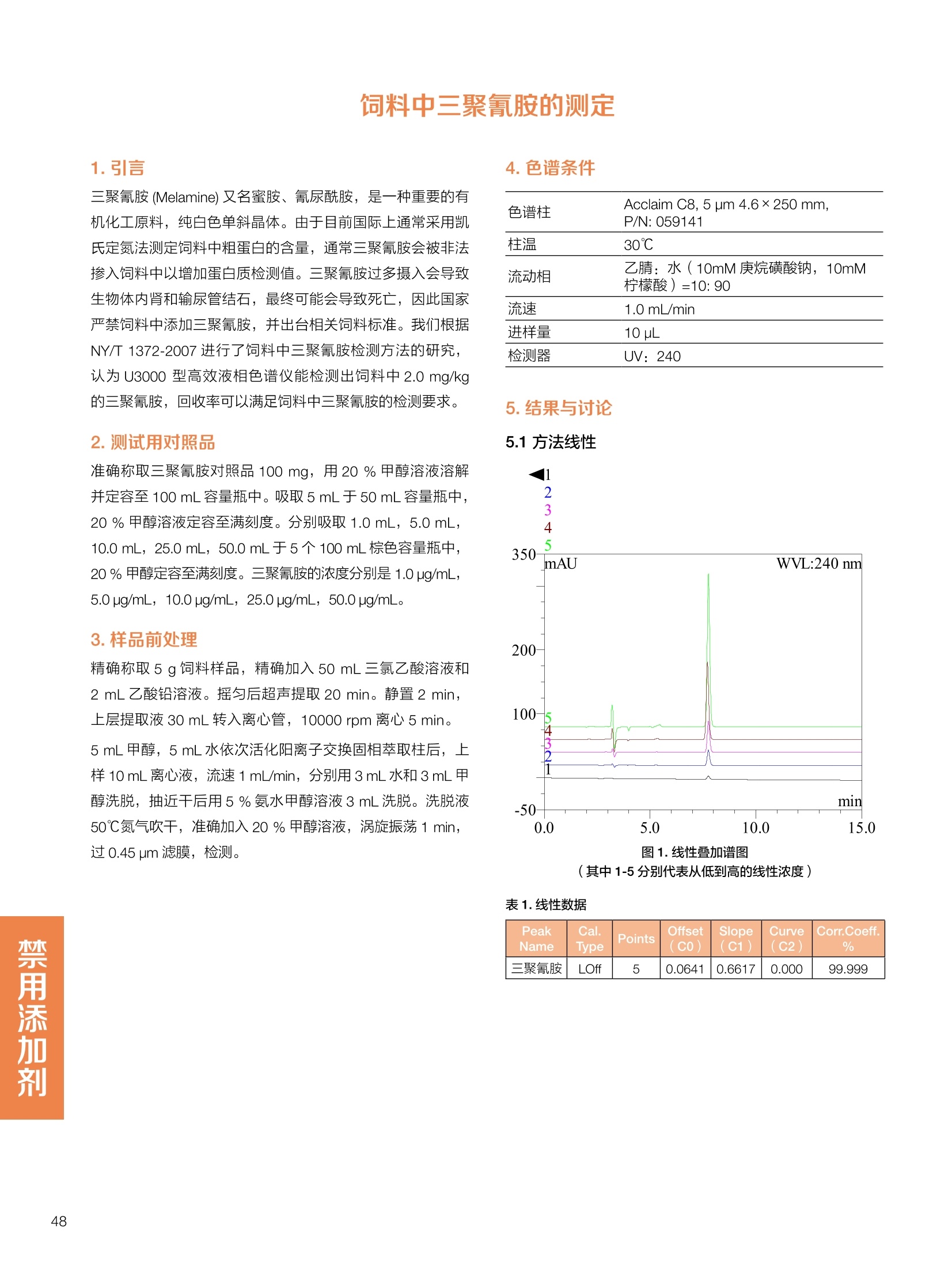
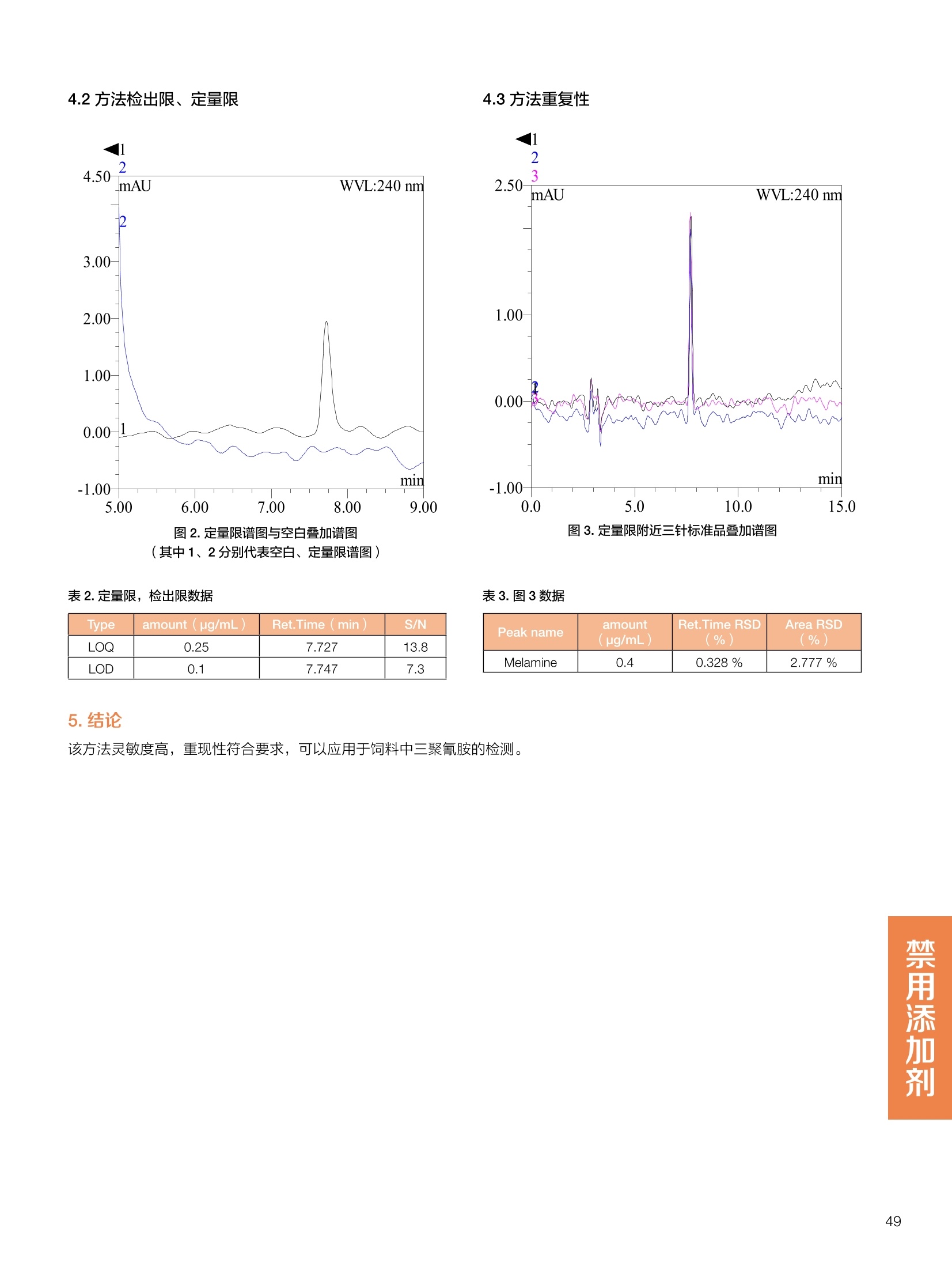
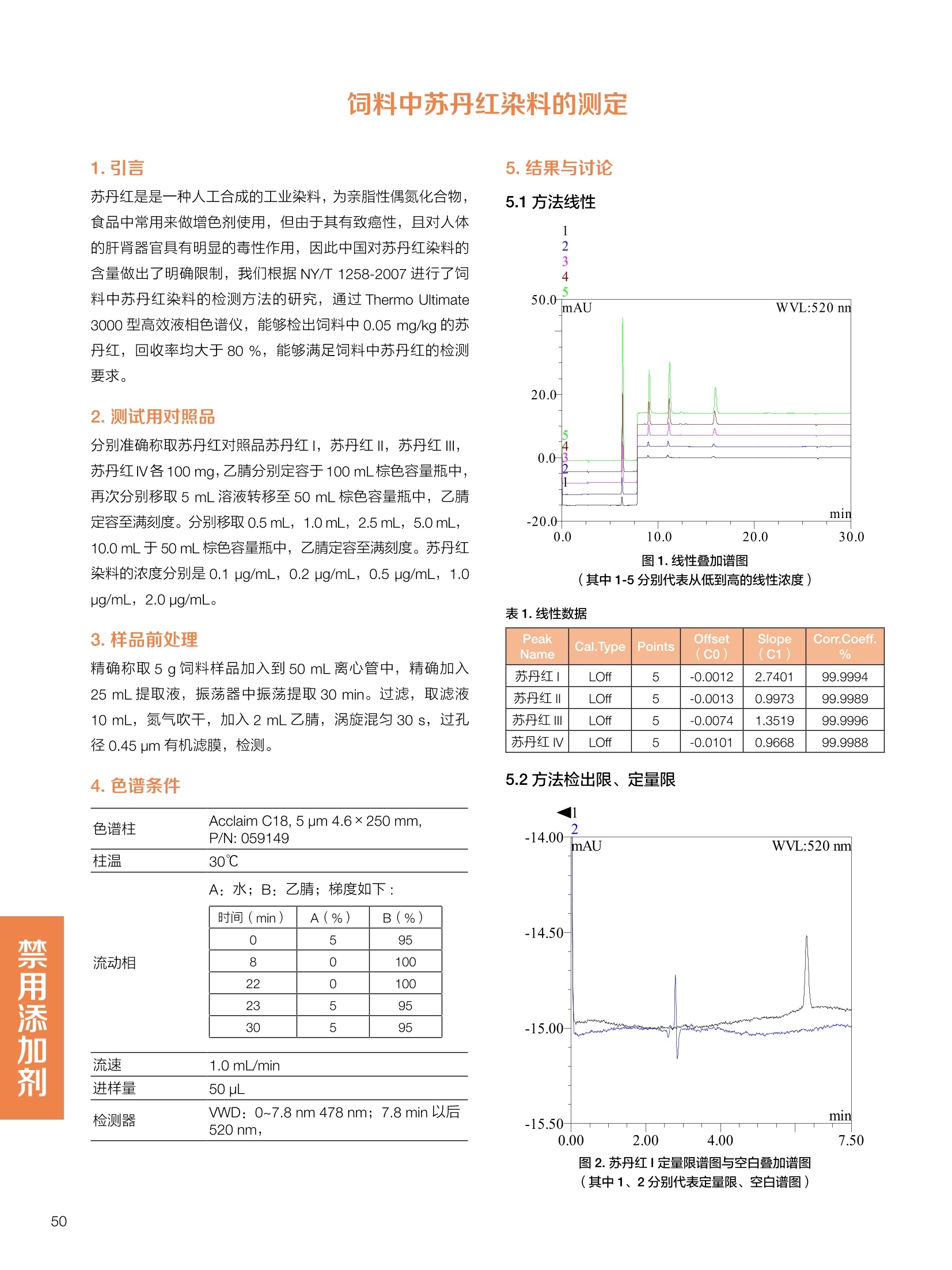
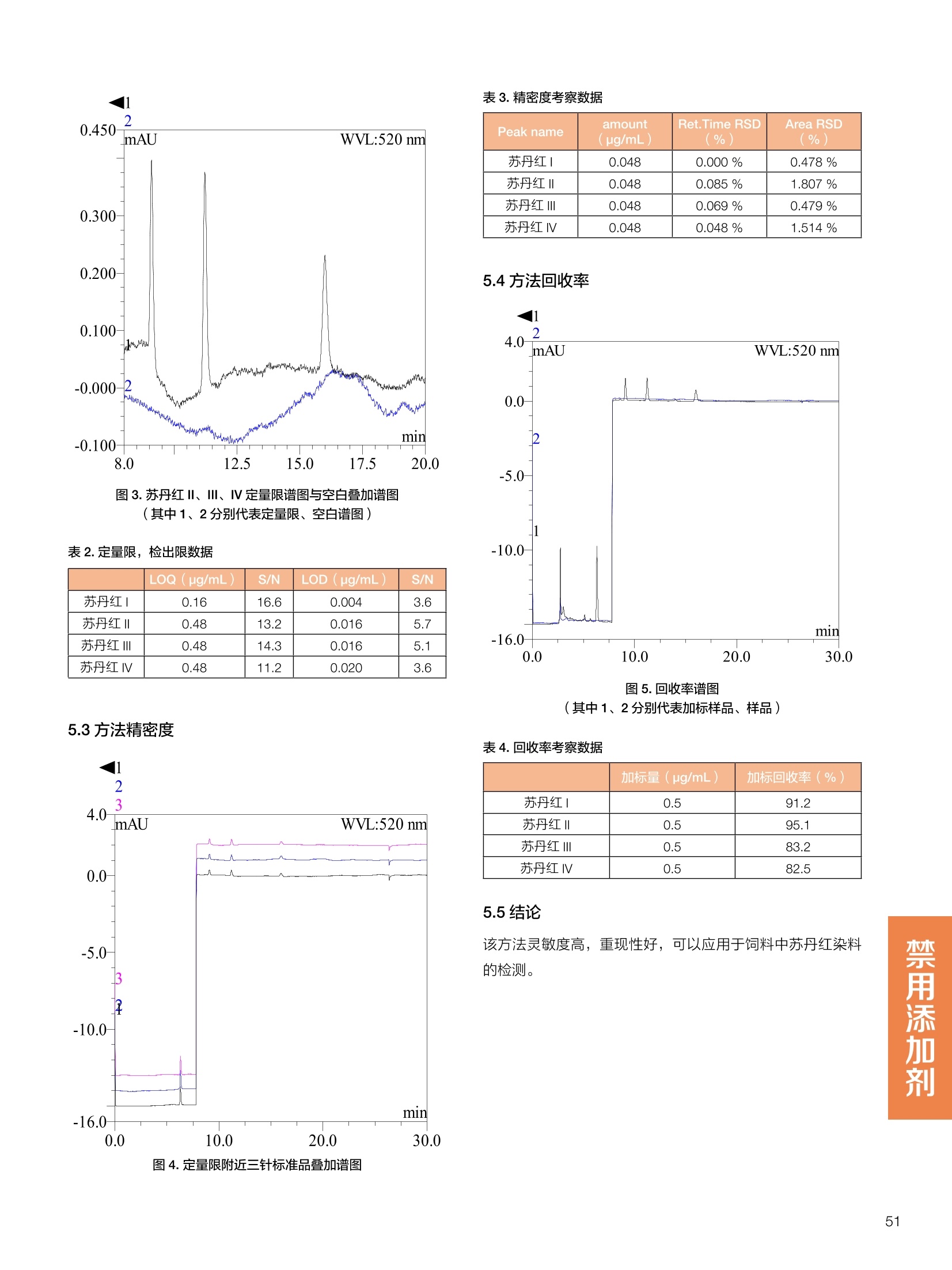
饲料中维生素K3的测定 饲料中维生素 B5的测定 液相色谱法 Ua 3000 1.300932- oom B-835.000 三 1050 254 饲料分析应用文集 目录 维生素 饲料中维生素 ADE 的同时测定(在线二维色谱) 4 饲料中维生素K3的测定.. 7 饲料中维生素B1、B2和 B6的测定.. .C 饲料中维生素 B5 的测定.. .112 饲料中维生素B12 的测定...... .114 饲料中D-生物素的测定.. ..116 饲料中L-抗坏血酸-2-磷酸酯的测定. .118 饲料中17种氨基酸的同时测定.. 20 真菌毒素 饲料中黄曲霉毒素的测定. 22 饲料中赭曲霉毒素A的测定 .饲料中玉米赤霉希酮的测定 .3 饲料中的伏马毒素B1和B2的测定 .3 饲料中呕吐毒素(DON), 3-DON,I,.115-DON 的测定. .336 核苷 饲料中核糖核苷、单磷酸核苷酸的测定. .339 禁用添加剂 饲料中雌二醇的测定 45 饲料中三聚氰胺的测定. 48 饲料中苏丹红染料的测定. .550 前言 饲料是能够提供给饲养动物所需养分,保证健康,促进生产,并且在合理使用下不产生有害物质的可饲物质。近30年来,我国畜牧养殖业发展迅速,我国的动物性食品如猪肉、禽肉、禽蛋及水产品供应已相当丰富。养殖业的迅猛发展,带动了饲料工业的发展,饲料添加剂的研究也得到了快速发展。同时随着养殖业的发展,人们对动物性产品的需求已经从刚开始的数量需求转向了对质量、安全性的需求。 饲料添加剂的广泛应用,对于提高动物的生产性能、增强抗病力、提高饲料利用效率、改善动物产品品质和提高经济效益等方面发挥着重要作用。合理使用饲料添加剂,对于促进养殖业及饲料工业的发展具有重要意义。饲料添加剂的种类很多,从广义上大致分为营养性添加剂和非营养性添加剂。营养性添加剂包括氨基酸添加剂、维生素添加剂和矿物质添加剂;非营养性添加剂包括药物添加剂(抗菌药物添加剂、抗寄生虫药物添加剂、中草药添加剂和镇静药物添加剂)、激素添加剂、酶制剂添加剂、微生物添加剂以及其其抗氧化剂、调味剂、防腐剂等。但是,近年来一些不法分子滥用饲料添加剂,导致屡屡发生动物性食品中毒事件,使饲料添加剂在人们心中蒙上了阴影。 除添加剂外,真菌毒素污染在动物饲料、饲料原料和人类食品中广泛存在。真菌毒素污染不仅可造成畜牧业经济损失,部分真菌毒素还具有致癌性或致畸性,且可由食物链进入人体。我国真菌毒素污染比较严重,配合饲料中真菌毒素的检出率高。动物采食被真菌毒素污染的饲料可引起免疫抑制、繁殖紊乱等。因此,消除真菌毒素,对保证动物健康,充分发挥动物的生产潜能有重大意义。 本文集针对于普遍关注的维生素、氨基酸等营养添加剂以及真菌毒素、非法添加等项目建立了相关液相色谱解决方案,这必将对饲料检测、饲料安全以及饲料工业发展产生重大意义。 赛默飞世尔科技(中国)应用中心 2020年5月 1.引言 维生素是维持机体正常活动必不可少的物质,适量的各种维生素作为饲料添加剂能促进禽畜生长,增强禽畜体质,产生显著的经济效益。GBT17817-2010、17818-2010和17812-2010采用HPLC法分别测定饲料中维生素A、D和E的含量,样品均需要经过皂化、乙醚萃取过程,由于维生素A和维生素E在样品中含量较高,受基质干扰较少,可直接进样分析;但维生素D含量较低,易受基质干扰,需要经过制备液相色谱的净化,收集含有维生素D的流出物后,再以RP或NP-HPLC进行分析,前处理过程极其繁琐。本实验拟采用在线二维中心切割方法,一次进样同时完成维生素 ADE 的测定。 2.样品前处理 精密称取饲料样品5g, 于150mL锥形瓶中,加入5 g/L的维生素C乙醇溶液100 mL, 再加入500 g/L的氢氧化钾溶液 25mL,在沸水浴回流30分钟,不时振荡,防止样品附着在瓶壁上,皂化结束分别用少量水自顶端冲洗其内部,取出锥形瓶并冷却至40℃。 将皂化液转移至500 mL分液漏斗中,以石油醚萃取3次,每次100 mL,合并萃取液,萃取液以水洗涤3~5次,至中性(pH试纸测试),收集石油醚层,经过无水硫酸钠脱水。低温减压回收石油醚,至1~2mL时转移至10mL棕色瓶中,氮气吹干,再以3~5mL甲醇使溶解并转移至10mL量瓶中,甲醇定容至刻度,摇匀,待用。未用完溶液放入4℃冰箱保存。 3.色谱条件 一维色谱柱 Acclaim 120A C18, 3 um 3.0×150 mm, PN: 063191 二维色谱柱 Acclaim PAIl, 3 um 4.6×150 mm, PN: 063691 柱温 30℃ 流动相A 甲醇 流动相B 一维:水;二维:乙腈 流动相C 二维:水 流速 一维:0.5mL/min 二维:0.8mL/min 检测器 UV: 264 nm, 280 nm, 325 nm 进样量 5pL 表1.一维分析泵及阀切换时间 时间(min) FlowmL/min A% B% 阀切 换时间 右阀位置 左阀位置 0.5 85 15 1-2 1-6 1.5 0.5 85 15 17 1-10 1-6 15 0.5 100 0 17.6 1-2 1-6 30 0.5 100 25.0 1-2 1-2 30.2 0.5 85 15 35.0 1-2 1-6 梯度及阀切换 表2.二维分析泵梯度 时间(min) A% B% C% 0 10 0 90 18.0 10 90 20.0 60 40 35.0 60 40 0 36.0 10 90 注:loop环体积500pL 4、结果 4.1混合标准品谱图 图1.混合标准品谱图(0~25min为第一维分离谱图;25~35min 为第二维分离谱图) 4.2样品分析普图 图2.混合标准品扣除空白溶剂后色谱图 图4.浓缩饲料样品分离谱图(264nm, 0~25min 为一维分离;25~35min 为二维分离) 图3.混合标准品在不同波长下叠加谱图 图5.浓缩饲料第一维和第二维分离中VD3色谱峰 UV扫描图(A为第一维;B为第二维) 维 图6.猪复合预混合饲料分离谱图(264nm, 0~25min 为一维分离;25~35min为二维分离) 图8.猪复合饲料样品分别在 326nm(1-黑色)和280nm(2-蓝色)的叠加谱图 4.3样品含量测定结果 表3.浓缩饲料含量测定结果(n=2) 取样量g 测得含量 mg/100g 维生素D3 10.1260 0.0825 维生素A 5.345 维生素E 72.706 表4.猪复合饲料含量测定结果(n=2) 取样量g 测得含量 mg/100g 维生素D3 10.0525 0.808 维生素A 1.102 维生素E 812.98 5.讨论 图7.猪复合饲料第一维和第二维分离中VD3色谱峰 UV 光谱扫描图(A为第一维;B为第二维) 本文利用双梯度液相色谱(DGLC)建立了在线二维柱切换法同时测定饲料中脂溶性维生素 ADE 含量的方法,与常规方法比较,本法简便、快速,简化了样品前处理过程,提高样品分析效率。较以往方法,本文做了以下改进:首先采用loop 环收集一维分离流出物,避免切换过程中由于色谱柱短暂串联而导致的压力骤然升高;二是连接方式做了调整,维先经过UV检测后,再根据目标物的保留时间,适时地调整切换时间,以准确并完整的将目标物整体切割至二维色谱中进行分离;三是本法可相对改善维生素D的检出限,在维生素D测定中采用乙腈+IPA作为流动相, UV背景吸收较高,而本法采用乙腈+甲醇,因此可适当改善 VD检出限。 1.引言 维生素K3,别名甲萘醌,是一种维生素营养补充剂。维生素K为肝脏合成原酶(因子B)的必需物质,并参与凝血因子Ⅷ,X和X的合成,维持动物的血液凝固生理过程。缺乏维生素K可致上述凝血因子合成障碍,影响凝血过程而引起出血。维生素K也为动物机体内(主要指存在于肝脏、骨骼、睾丸、皮肤和肾脏等组织器官)的维生素K依赖羧化作用体系所必需,是骨骼素(BGP)合成过程中不可缺少的因子。VK3也属于小品种维生素,其中60%以上用作饲料添加剂。在 GB/T18872-2002饲料中维生素K3的 HPLC方法采用常规色谱柱进行分析,本文采用表面多孔增强核技术的Accucore C18 色谱柱进行分析,获得了较好的分离结果。 2.样品前处理 取复合预混饲料2.0g, 置100mL具塞的锥形瓶中,准确加入50 mL的三氯甲烷,在振荡器上振荡两分钟,加入6mL25%的氢氧化铵,旋转振荡3 min, 再加入10 g硅藻土和无水硫酸钠的混合物(按照3:20混合),在旋转振荡器上振荡30 min,然后滤纸过滤或离心,取一定量上清液至蒸发瓶中, N2吹干,甲醇溶解并定容至10 mL量瓶中。进样分析。 3.色谱条件 色谱柱 Accucore C18, 2.6 pm4.6×150 mm, PN: 17126-154630 柱温 30℃ 流动相 A:甲醇;B:水 流速 0.8 mL/min 检测器 UV: 251nm 进样量 10pL 表 1.Gradient program 时间 (min) A% B% 0 63 37 6 63 37 10 100 0 15 100 0 4.结果 4.1标准品谱图 图1.Vitamin K3 标准品分离谱图(5 pg/mL) 4.2样品分析谱图 图2.猪维生素预混合饲料 4.3线性关系考察 精密量取浓度为 100 pg/mL 的标准品贮备液(甲醇溶液),分别加甲醇稀稀2、5、10、20、50倍,制成浓度分别为50、20、10、5和2 ug/mL的标准品溶液,以峰面积为纵坐标,浓度为横坐标,考察 VK3的线性。结果相关系数r>0.999,表明在2~ 50 pg/mL的范围内,线性相关关系较好。 图3.母猪用维生素预混合饲料 图5.各浓度标准品溶液叠加谱图 4.4样品含量测定结果 表3.浓缩饲料含量测定结果(n=2) 样品 标示量mg/Kg 测得含量 mg/Kg 猪维生素预混饲料 一 8382.5 母猪用维生素预混饲料 12000 12264 鸡饲料 15000 14826 图4.鸡维生素预混合饲料 5.寸论 本文建立了快速测定饲料中 Vitamin K3 的测定方法,与常规方法比较,采用Accucore 色谱柱柱效得到极大提高,系统压力290 bar, 使用常规HPLC系统可完全满足测定要求,实际有效分离时间仅5 min(5~ 20 min 为清洗和平衡时间),因此加快了分析效率,提高了检测灵敏度。由于样品基质十分复杂,建议分析柱前加保护柱,以延长色谱柱使用寿命。 饲料中维生素 B1、B2 和 B6的测定 1.引言 维生素B1又称硫胺素或抗神经炎维生素或抗脚气病维生素,维生素B1缺乏时,可引起多种神经炎症,如脚气病。维生素B1缺乏所引起的多发性神经炎,患者的周围神经末梢有发炎和退化现象,并伴有四肢麻木、肌肉萎缩、心力衰竭、下肢水肿等症状。维生素 B2又叫核黄素,微溶于水,在中性或酸性溶液中加热是稳定的。为体内黄酶类辅基的组成部分(黄酶在生物氧化还原中发挥递氢作用),当缺乏时,就影响机体的生物氧化,使代谢发生障碍。其病变多表现为为、眼和外生殖器部位的炎症,如口角炎、唇炎、舌炎、眼结膜炎和阴囊炎等,故本品可用于上述疾病的防治。维生素B6又称吡哆素,其包括吡哆醇、吡哆醛及吡哆胺,在体内以磷酸酯的形式存在,是一种水溶性维生素,遇光或碱易破坏,不耐高温。维生素B6在酵母菌、肝脏、谷粒、肉、鱼、蛋、豆类及花生中含量较多。维生素 B6为人体内某些辅酶的组成成分,参与多种代谢反应,尤其是和氨基酸代谢有密切关系。临床上应用维生素B6制剂防治妊娠呕吐和放射病呕吐。 本文参考《GBT 14700-2002饲料种维生素B1的测定》、《GBT 14701-2002饲料种维生素B2的测定》、、《GBT14702-2002饲料中维生素B6的测定高效液相色谱法》对预混合饲料中的维生素B1、B2、B6进行液相色谱分析,得到合理的结果。 2.样品前处理 2.1标准溶液的制备 VB1标准品溶液:25%乙醇超声溶解VB1制成浓度为500 pg/mL 的VB1标准储备液,流动相依次稀释成0.5、1.25、1.667、2、50 pg/mL 的标准品溶液。 VB2标准品溶液:精密称量10mgVB2 置于 200 mL容量瓶中,加入1mL冰醋酸在沸水浴(80~100℃)煮沸 30 min, 待冷却至室温后,超纯水定容至刻度,制成VB2 浓度为 50 pg/mL的标准储备液,用流动相依次稀释成 0.02、0.05、0.333、5、25、50 pg/mL的标准品溶液。 VB6标准品溶液:精密称量 0.05 g VB6于 100 mL棕色容量瓶中,加0.1 mol/L盐酸67 mL, 超声15 min, 全部溶解后,用0.1 mol/L盐酸定容至刻度,制成浓度为500 pg/mL的VB6标准储备液,用流动相依次稀释成0.02、0.05、0.333、2、16.67、50 pg/mL 的标准品溶液。 2.2样品前处理 参考中华人民共和国国家标准《GBT 14700-2002饲料种维生素B1的测定》、《《GBT 14701-2002饲料种维生素 B2的测定》、《GBT 14702-2002饲料中维生素B6的测定 高效液相色谱法》,精密称取维生素预混合饲料0.5g(精确至0.0001 g), 置于100 mL棕色容量瓶中,加入2/3体积的提取液,超声20 min(中间涡旋一次),待温度降至室温后用提取液定容至刻度,过滤,滤液过0.45 um滤膜, 待上机。 3.色谱条件 UV检测波长 化合物 VB: VB, VB。 0 检测波长(nm) 280 267 246 5 2 98 0.5 7 8 92 0.5 15 8 92 0.5 18 2 98 0.5 25 2 98 0.5 4.样品分析谱图 图1.VB1提取液及VB1标准品色谱图 图2.VB2提取液及VB2标准品色谱图(其中从下往上依次为提取液及标准品) 图3.VB6提取液及VB6标准品色谱图(其中从下往上依次为提取液及标准品) 5.测定结果 5.1线性、检出限及 RSD 由低浓度至高浓度依次进样检测,以质量浓度与峰面积作标准曲线线性回归。结果表明, VB1在0.5~50 pg/mL范围内显良好线性关系(r=0.99996),通过溶液逐步稀释法,测得最低定量限为0.3 pg/mL;-;VB2在0.02~ 50 ug/mL范围内显良好线性关系(r=0.99964),通过溶液逐步稀去法,测得最低定量限为 8 ng/mL;由低浓度至高浓度依次进样检测,以质量浓度与峰面积作标准曲线线性回归。结果表明, VB6在 0.02 ~50 pg/mL 范围内显良好线性关系(r=0.99971),通过溶液逐步稀释法,测得最低定量限为13 ng/mL。外标法定量。标准曲线如下: 图4.VB1 VB2 VB6标准曲线 表 2. VB1 VB2 VB6 标准曲线方程 Ret.Time (min) Peak Name Cal.Type Coeff.of Determination co (Offset) C1 (Slope) C2 ( Curve) 13.543 VB1 Lin, WithOffset 0.99996 0.0203 0.7510 0.0000 10.103 VB2 Lin, WithOffset 0.99964 -0.0283 0.6210 0.0000 6.327 VB6 Lin, WithOffset 0.99971 0.0443 0.5683 0.0000 5.2回收率,重现性及实际样品中含量 取浓度再检测限附近的标准品溶液测定重现性数据,结果见表3,回收率如表4. Time [min] 图5.VB1检测限(0.5pg/mL)附回收收率叠加谱图 图7.VB6检测限(0.5 pg/mL)附近回收率叠加谱图 (其中从下往上依次为未加标预混合饲料样品、加标0.5 pg/mL 的预混合饲料样品、0.5 pg/mL的VB1标准品) (其中从下往上依次为未加标预混合饲料样品、加标0.5 pg/mL 的预混合饲料样品、0.5 pg/mL 的VB6标准品) 表3. VB1 VB2 VB6 重生性的结果 维生素 接近检测限的浓度(ug/mL) 峰面积 RSD (n=6) VB. 0.5 6.72% VB, 0.02 3.58% VB。 0.02 4.47% 表4. VB1 VB2 VB6回收率的结果 维生素 加入量 (ug/mL) 回收量(ug/mL) 饲料样品中 测定量 回收率 (%) VB 2.5569 2.4603 n.a. 96.22 VB, 0.2283 0.2435 n.a. 106.66 VB, 7.4050 7.4369 0.0157 100.22 6.讨论 Time [min] 本实验采用国家标准测定预混合饲料中的 VB1 VB2 VB6,各项方法学数据均满足测定要求。 图6.VB2检测限(0.5pg/mL)附近回收率叠加谱图(其中从下往上依次为未加标预混合饲料样品、加标0.5 pg/mL 的 预混合饲料样品、0.5pg/mL 的VB2标准品) 1.引言 维生素B5又称泛酸,具制造抗体功能,在维护头发、皮肤及血液健康方面亦扮演重要角色,缺乏维生素B5会导致低血糖症、血液及皮肤异常、疲倦、忧郁、失眠、食欲不振、消化不良,易患十二指肠溃疡。 本文参考《GBT 18397-2001复合预混合饲料中泛酸的测定高效液相色谱法》对预混合饲料中的维生素 B5进行液相色谱分析,得到合理的结果。 2.样品制备 2.1标准溶液的制备 维生素 B5标准品溶液:精密0.02g维生素 B5溶于100 mL0.1%H。PO溶液,超纯水逐级稀释成0.4992、0.9984、9.984、31.2、156 pg/mL 的标准品溶液。 2.2样品前处理 参考中华人民共和国国家标准《GBT 18397-2001复合预混合饲料中泛酸的测定高效液相色谱法》,精密称取试样2g,精确至0.0001 g,置于100 mL棕色容量瓶中,加入60 mL水,摇匀,加入10 mL 1%乙二胺四乙酸二钠溶液(EDTA)混匀,超声提取15 min 后,超纯水定容至刻度,过滤或者离心,上清液经0.45 um 滤膜过滤。 3.色谱条件 分析柱 Acclaim PolarAdvantage Il C18, 4.3×10 mm, 5 pm(P/N: 063195) Acclaim PolarAdvantage l C18, 150×3mm, 3 um (P/N: 063705) 流动相精密称取 3.12g NaH,PO4.2H2O 溶于 1L 流动相 超纯水中,用 0.1mol/L 的 NaOH 调PH=5.5, 0.45 um 滤膜过滤 流速 1.0 mL/min 柱温 30℃ UV检则波长 200 nm 进样量 20pL 图1.VB5提取液样品色谱图 图2.VB5标准品色谱图 5.1线性、检出限 由低浓度至高浓度依次进样检测,以质量浓度与峰面积作标准曲线线性回归。结果表明,维生素 B5在0.5~156 pg/mL范围内显良好线性关系(r=0.99989),通过溶液逐步稀释法,测得最低定量限为100 ng/mL。外标法定量。标准曲线如下: 图3.VB5标准曲线 表1.VB5标准曲线方程 Ret.Time (min) Peak Name Cal.Type Coeff.of Determination C0 C1 Slope) ((Offset) 4.570 ·VB5 Lin 0.99989 0.0000 0.0007 5.2回收率,精密度,重现性及实际样品中含量 取接近定量限附近浓度的标准品,重现性数据结果见表2;取加标接近定量限附近浓度的实际饲料样品,精密度数据结果见表3;取加标接近定量限附近浓度的实际饲料样品,回收率如表4。 表2.重现性考察结果 394.46 ug/L 的 VB5标准品 峰面积(mAu*min) 1# 0.2773 2# 0.2847 3# 0.2865 平均值 0.2828 RSD 1.73% 表3.精密度考察结果 加标 394.46 pg/L 的饲料样品 峰面积(mAu*min) 1# 0.3217 2# 0.3330 3# 0.3189 average 0.3245 RSD 2.31% 表4.回收率考察结果 加入量(ug/mL) 回收量(ug/mL) 饲料样品中测定量 回收率 (%) 394.4613 452.6791 80.3890 94.38 6.讨论 本实验采用国家标准测定预混合饲料中的VB5,各项方法学数据均满足测定要求。 1.引言 VB12又称钴胺素,B族维生素之一,是一种水溶性维生素,也是唯一含有主要矿物质的维生素。维生素 B12以辅酶形式参与各种代谢过程,促进 DNA 和蛋白质的合成,促进细胞的成熟,维持神经组织的正常功能,缺乏维生素B12时会产生恶性贫血、神经系统的损害。目前,文献报道的维生素B12测定方法主要有微生物法、荧光法、高效液相色色法、凝胶色谱-高效液相色谱法等。 本方法参考《GBT 17819-1999 维生素预混料中维生素 B12的测定高效液相色谱法》对预混合饲料样品中的 VB12 进行检测,并得到合理结果。 2.样品制备 2.1标准溶液的制备 VB12标准储备液:精密称取VB12对照品10 mg, 于10mL容量瓶中,用25%乙醇溶解并稀释至刻度,配置成浓度为1 mg/mL的标准储备液。 VB12标准曲线:将VB12标准储备液,用25%乙醇稀释,配制成0.5,1,2,5,10,200, 500 pg/mL的系列标准溶液。 2.2样品前处理 选取市售的预混合饲料,参考中华人民共和国国家标准《GBT17819-1999维生素预混料中维生素 B12的测定高效液相色谱法》,称取试样2g(精确至0.0001 g)于100mL棕色容量瓶中,加入约60 mL超纯水,超声提取 10 min,超纯水定容至刻度;精确吸取1 mL 溶液于50 mL棕色容量瓶中,超纯水定容至刻度, 0.45 um 滤膜过滤备用。 3.色谱条件 分析柱 Hypersil GOLD Amino, 250×4.6 mm, 5 pm (P/N:25705-254630) 流动相 乙乙:3%磷酸水溶液 73:27 (v/v) 流速 1.7 mL/min 柱温 30℃ UV检测波长 361 nm 进样量 20 pL 图1.VB12标准溶液UV色谱图 图2.预混合饲料样品溶液 UV测定谱图 5.1线性、检出限 由低浓度至高浓度依次进样检测,以质量浓度与峰面积作标准曲线线性回归。结果表明,在0.5~ 500 pg/mL范围内显良好线性关系(r=0.9999)。通过溶液步步稀释法,则得最低定量限为0.3 pg/mL。外标法定量。标准曲线如下: 图3.VB12标准曲线 表1.VB12标准曲线方程 Ret.Time(min) Cal.Type Coeff.ofDetermination C0(Offset) C1(Slope) 6.075 Lin 0.99997 0.0000 0.0711 5.2回收率和重现性 取检测限附近浓度的标准品(0.5 pg/mL), 重现性数据结果见表2,如表3回收率为100.62%。 图4.定量限(2pg/mL)附近回收率叠加谱图 (其中从下往上依次为未加标预混合饲料样品、加标2 pg/mL的预混合饲料样品、2 pg/mL 的VB12标准品) 表2.重现性考察结果 序号 峰面积 (mAU*min) 第一针 0.0348 第二针 0.0356 第三针 0.0385 第四针 0.0360 第五针 0.0384 RSD% 4.63% 表3.回收率考察结果 加入量(ug/mL) 回收量(ug/mL) 回收率(%) 样品 2 2.0124 100.62 5.3实际样品测定 按上述方法测定了市售预混合饲料样品中 VB12的含量,测定结果见表4。 表4.预混合饲料样品中VB12的含量 样品 VB,2含量(ng/mL) 饲料样品 未检出 6.讨论 本实验采用国家标准测定预混合饲料中VB12,各项方法学数据均满足测定要求,是预混合饲料中VB12测定的快捷有效的方法。 1.引言 4.样品分析谱图 D-生物素也称维生素H,是一种水溶性维生素,在自然界普遍存在于动物组织内。D-生物素在生物代谢中起着重要的作用,缺乏D-生物素时会产生精神疲乏、恶心、呕吐、贫血、鳞状皮炎等症状。目前, D-生物素已广泛用在家禽家畜的饲料添加剂中。D-生物素的分析方法主要有酶免疫法、分光光度法、荧光分光光度法、微分脉冲极谱法、微生物测定法等。本文参考《GBT 17778-2005预混合饲料中D-生物素的测定》 对预混合饲料中的D-生物素进行分析,得到合理的结果。 2.样品前处理 2.1标准溶液的制备 D-生物素标准储备液:精密称取D-生物素对照品10 mg,于10mL容量瓶中,用超纯水超声加热溶解并稀释至刻度,配置成浓度为1 mg/mL 的标准储备液。 图1.D-生物素标准溶液 UV色谱图 D-生物素标准曲线:将D-生物素标准储备液,用超纯水稀释,配制成1,2,,:5, 10, 20 pg/mL 的系列标准溶液。 2.2样品前处理 参考中华人民共和国国家标准《GBT 17778-2005预混合饲料中D-生物素的测定》,精密称取预混合饲料约2g(精确至0.0001g), 置于100 mL棕色容量瓶中(若预混合饲料中含有矿物质,加入0.1 gDTPA),加入66mL超纯水,超声提取20 min, 冷却后用超纯水定容至刻度,滤液经0.45 pm滤膜过滤,备用。 3.色谱条件 分析柱 Syncronis C18, 250×4.6 mm,5 pm (P/N:97105-254630) 流动相 流动相A:水(0.05%三氟乙酸, 2.5M NaOH 调 PH=2.5);流动相B:乙腈 A:B=12:88 (v/v) 流速 1.0mL/min 柱温 30℃ UV检测波长 210nm 进样量 20 pL 图2.预混合饲料提取液 UV测定谱图 5.1线性、检出限 由低浓度至高浓度依次进样检测,以质量浓度与峰面积作标准曲线线性回归。结果表明,在1~20 pg/mL范围内显良好线性关系(r=1)。通过溶液逐步稀释法,测得最低定量限为 0.17 pg/mL。外标法定量。标准曲线如下: 图3.D-生物素标准曲线 表1.D-生物素标准曲线方程 Ret.Time (min) Cal.Type Coeff.of Determination CO (Offset) C1 (Slope) 22.53 Lin 100.00 0.000 0.116 5.2回收率和重现性 取接近定量限附近(1pg/mL)浓度的标准品,重现性数据结果见表2,如表3回收率为 101.07%。 表2.D-生物素重现性的结果 浓度范围 峰面积(mAU*min) 第一针 0.1131 第二针 0.1266 第三针 0.1112 RSD% 7.188% 图4.定量限(2pg/mL)附近回收率叠加谱图 (其中从下往上依次为未加标预混合饲料样品、加标 2 pg/mL 的预混合饲料样品、2 pg/mL的D-生物素标准品) 表3.D-生物素回收率的结果 加入量 ( ug/mL) 回收量 (ug/mL) 回收率(%) 样品 2 2.0214 101.07 5.3实际样品测定 按上述方法测定了市售预混合饲料样品中D-生物素的残留量,测定结果见表4。 表4.市售预混合饲料样品中D-生物素的含量 样品 D-生物素(ug/mL) 饲料样品 N.a. 6.讨论 本实验采用国家标准测定预混合饲料中的D-生物素,各项方法学数据均满足测定要求。 1.引言 L-抗坏血酸(维生素C)是动物生长发育、繁殖过程中必不可少的一种营养素,具有维持动物正常血脂代谢、造血功能及促进体内多种激素合成等作用。 由于L-抗坏血酸化学结构不稳定,将其转化为“L-抗坏血酸-2-磷酸酯”后,可提高对 pH、光、热的稳定性;当其被动物摄取后,可在体内磷酸酯酶作用下重新还原为L-抗坏血酸,发挥相应的生理活性。 GB/T23882-2009 采用 HPLC 法测定饲料中L-抗坏血酸-2-磷酸酯的含量,采用 pH3.0的磷酸盐缓冲液对粉碎后的饲料样品进行提取,离心过滤后直接进样分析,操作简单,方法基本可行。 2.样品前处理 参照 GB/T23882-2009规定,将试样按 GB/T20195 制备,磨碎,通过 0.45 mm 孔筛,混匀(避光低温保存备用),称取一定量的试样(含L-抗坏血酸-2-磷酸酯(以L-抗坏血酸计)约1 mg), 精确至0.1 mg, 置于 100mL容量瓶中,加入约70 mL 磷酸盐缓冲溶液(54g磷酸二氢钾溶于900 mL, 以磷酸调节 pH至3.0,加水稀释至1000mL), 在超声波水浴中超声处理15 min,用磷酸盐缓冲液定容至刻度,取适量溶液3500 r/min 离心5 min, 离心后上清液通过0.45 um 滤膜过滤,滤液用于高效液相色谱分析。 3.色谱条件 色谱柱 Acclaim 120A C18, 3 pm 4.6×250 mm,PN: 059149 柱温 40℃ 流动相 甲醇:50mM磷酸二氢钾(含0.05%四丁基硫酸 氢胺)(10:90) 流速 1.0 mL/min 检测器 UV: 250 nm 进样量 20 pL 4.结果 4.1标准品谱图 图1.L-抗坏血酸-2-磷酸酯标准品谱图(10 pg/mL,以L-抗坏血酸计,下同) 图2.L-抗坏血酸-2-磷酸酯定量限谱图(进样浓度0.04 pg/mL) 4.2样品分析谱图 图3.样品及加标样品分离谱图 (上:4#样品10mg/ml;下:1#样品50mg/ml;中:1#样品加标20ppm) 4.3方法学考察 4.3.1重复性试验 取1#样品5份,每份0.5g,分别加入10mL标准储备液(100ug/mL),照样品前处理方法制样后进样20 pL,结果L-抗坏血酸-2-磷酸酯保留时间 RSD 为0.10%, 峰面积 RSD 为0.37%;表明方法重复性较好。 4.3.2线性及检测限 对照品浓度在0.04~20.0 pg/mL范围,相关系数为 1.0000,表明线性较好。 当浓度为 0.04ug/mL 时, S/N为10(定量限),按S/N=3计,方法检测限约为 12 ng/mL。 4.3.3方法回收率 取1#样品开展回收率实验,平均回收率为90.7%,方法准确度较好。 表1.回收率测定结果 1#样品含量 加入量 (ppm) 测得值 (ppm) 回收率% 平均回收率% 未检出 20.0 18.07 90.4 90.7 未检出 20.0 18.17 90.9 未检出 20.0 18.20 91.0 未检出 20.0 18.17 90.9 未检出 20.0 18.06 90.3 4.4样品含量测定结果 表2.样品含量测定结果 样品 含量(mg/kg,以L-抗坏血酸计) 1#(生长猪用预混料) 未检出 2#(种鸡用预混料) 未检出 3#(孕猪用预混料) 未检出 4#(鱼饲料) 26.2 5.讨论 本文参照 GB/T23882-2009 采用 HPLC 法测定饲料中L-抗坏血酸-2-磷酸酯的含量,方法基本可行。 特别说明如下: (1)采用原标准默认色谱条件,主峰保留时间约为 18 min,为提高方法效率和稳定性,将柱温由室温提高为40℃(有利于离子对试剂在色谱柱内快速平衡),并将甲醇比例由7.5%提高为10%,主峰保留时间由此缩短为11min。 (2)本法采用的流动相中有机相含量较少,对样品中其他组份的洗脱能力较差,为避免样品间交叉污染,建议延长单个样品色谱采集时间在主峰保留时间4倍以上(视样品实际检出情况而定); (3)尝试采用梯度洗脱缩短样品分析时间,但效果不理想,原因是由于流动相中含有离子对试剂,后续平衡时间较长; (4)采用专属性更高的前处理方式进一步降低基质影响,或更改色谱分离模式,有望进一步提高色谱分离效率。 饲料中17种氨基酸的同时测定 蛋白质是生命过程的重要物质,是组成机体结构物质(细胞的组成)、体内代谢活性物质(激素、酶、免疫抗体)的主要成分,是组织更新、修补的原料。蛋白质占动物机体固形物总量的50%左右,肌肉、肝、脾、肾等实质器官的蛋白质含量可高达80%以上。由此可见,饲料中蛋白质的供应对畜禽生活和生产具有重要的作用,而蛋白质必须转化为氨基酸后才能为家畜和家禽等吸收利用。但目前少有对饲料中营养成分的研究报道。本研究采用酸性条件下水解饲料中蛋白质,柱前在线衍生与液相色谱紫外联用分析饲料中水解氨基酸。 7M盐酸:量取558ml盐酸,用水稀释至1000mL量瓶中,摇匀。 水解催化剂:称取1g苯酚置100 mL量瓶中,加入7M盐酸50mL使溶解,再加入10 mL三氟乙酸和20 mL硫代乙醇酸,用7M盐酸定容至刻度,摇匀,密封低温(4℃)保存。17种氨基酸混标溶液(胱氨酸浓度为1.25 umol/mL,其它氨基酸浓度为 2.5 umol/mL) 饲料样品由第三方动物疾病预防机构提供,为不同类型(预混合、浓缩饲料)的动物配方饲料,含有不同种类的蛋白或氨基酸。 水解:称取0.5g样品转移至真空水解管中,加入1.0mL水解催化剂,充氮保护3分钟,密塞水解管并置于沸水浴上恒温加热8小时,冷却至室温,用40%氢氧化钠溶液调节pH值2-3范围内,用0.1N盐酸溶液稀释并定容至10mL,摇匀并用微孔(0.22um) 滤膜过滤用于液相分析。 衍生程序:采用邻苯二甲醛和氯甲酸芴甲酯在碱性条件下分别与一级氨基酸和二级氨基酸发生反应,生成具有强烈紫外吸收的化合物。衍生过程在自动进样器中进行。 衍生试剂:硼酸缓冲液(0.4M,pH=10.5):称取2.48g硼酸和1.41g氢氧化钠,用水溶解并稀释至 100mL量瓶中。 邻苯二甲醛溶液(OPA): 50mg/mL(甲醇) ( OPA/MPA溶液:0.8mL硼酸缓冲液 -0.2mL OPA 溶液-20uL3-巯基丙酸 ) ( 氯甲酸芴甲酯(FMOC)溶液:2.5mg/mL(乙腈) ) 稀释液:流动相A 在线柱前衍生过程:0.4M硼酸缓冲液(5uL)+样品(1uL)+OPA/MPA 溶液(1uL) +FMOC 溶液(1uL)+稀释液(8uL) 色谱柱 Hypersil GOLD C18, 5 pm 4.6×150 mm, A(%) B(%) PN:25005-154630 95 5 柱温 35℃ 90 10 检测器 DAD: 380nm, 262nm, 70 30 3D: 190-400nm; 采集频率:5Hz 0 100 26 0 100 27 95 5 32 95 5 流速 1.0 mL/min 进样量 1uL,温度:30℃ 4.1方法专属性 取0.1N盐酸做为空白试剂考察方法专属性,结果见图1和2。 17AA S 图1.溶剂空白图谱 图2.标准品图谱 (1.Glu 2.Asp 3.Ser 4.His 5.Gly 6.Thr 7.Pro 8.Arg 9.Tyr10.Cys 11.Val 12.Met 13.Phe 14.lle 15.Leu 16.Lys 17.Ala) 4.2线性范围 取氨基酸混标溶液用1%盐酸(约0.1N)稀释成浓度为0.02、0.05、0.10、0.25、0.50 umol/mL的溶液,按照前述条件测定其响应值,并与浓度做线性回归,结果见表1。 表1.线性范围测试结果 编号 峰名称 校准类型 相关系数(%) 截距 斜率 1 Glu 线性,有截距 98.589 0.0056 4.146 2 Asp 线性,有截距 99.225 0.0068 4.095 3 Ser 线性,有截距 98.886 0.0052 4.305 4 His 线性,有截距 99.116 0.0054 2.257 5 Gly 线性,有截距 99.215 0.0072 2.879 6 Thr 线性,有截距 99.256 0.0025 3.989 7 Arg 线性,有截距 99.568 0.0038 4.051 8 Ala 线性,有截距 99.322 0.0095 4.153 9 Tyr 线性,有截距 99.112 0.0092 4.051 10 Cys-cys 线性,有截距 98.253 0.0765 1.371 11 Val 线性,有截距 99.236 0.0084 4.246 12 Met 线性,有截距 99.588 0.0053 4.181 13 Phe 线性,有截距 99.322 0.0085 4.088 14 lle 线性,有截距 99.259 0.0022 4.382 15 Leu 线性,有截距 99.865 0.0003 4.236 16 -yS 线性,有截距 99.982 0.0058 4.869 17 Pro 线性,有截距 98.526 0.0447 1.192 4.3方法精密度 4.4方法准确度 取对照品溶液,连续进样5针,结果见图3 按前述方法平行测定饲料样品与加标样品,计算其含量与加标回收率。结果见图4与表2。 图3.标准品重复进样图谱 图4.样品图谱(1.未加标样品2.加标样品) 1.Glu 2.Asp 3.Ser 4.His 5.Gly 6.Thr 7.Pro 8.Arg 9.Tyr 10.Cys 11.Val 12.Met 13.Phe 14.lle 15.Leu 16.Lys 17.Ala 1.Glu 2.Asp 3.Ser 4.His 5.Gly 6.Thr 7.Pro 8.Arg 9.Tyr10.Cys 11.Val 12.Met 13.Phe 14.lle 15.Leu 16.Lys 17.Ala 表2.加标回收率(样品名称:鸡浓缩饲料, n=3) 峰名称 含量(ug/mL) 加标量(ug/mL) 测定量(ug/mL) 平均回收率(%) Glu 0.22 0.25 0.478 103.2 Asp 0.35 0.25 0.603 101.4 Ser 0.12 0.25 0.372 100.6 His ND 0.25 0.251 100.2 Gly 0.25 0.25 0.503 100.4 Thr 0.12 0.25 0.375 102.6 Arg 0.12 0.25 0.372 105.2 Ala 0.08 0.25 0.329 98.6 Tyr ND 0.25 0.248 101.6 Cys ND 0.125 0.123 98.4 Val ND 0.25 0.246 96.4 Met ND 0.25 0.252 101.8 Phe ND 0.25 0.251 100.6 lle ND 0.25 0.248 99.2 Leu ND 0.25 0.247 98.6 Lys 0.11 0.25 0.362 101.4 Pro ND 0.25 0.255 102.8 4.5样品分析 按照2.2项下进行饲料样品处理并分析其中水解氨基酸的含量,结果见表3。 表3.样品分析结果 峰名称 浓缩饲料(ug/mL) 鸡预混合饲料(pg/mL) 猪预混合饲料(ug/mL) 猪前期浓缩饲料(ug/mL) Glu 0.22 0.16 0.18 0.12 Asp 0.35 0.22 0.18 0.13 Ser 0.12 ND ND ND His ND ND ND ND Gly 0.25 0.13 ND 0.12 Thr 0.12 ND ND ND Arg 0.12 0.21 0.36 ND Ala 0.08 ND ND ND Tyr ND ND ND ND Cys ND ND ND ND Val ND ND ND ND Met ND ND ND ND Phe ND ND ND ND lle ND ND ND ND Leu ND ND ND ND LYS 0.11 ND 0.12 ND Pro ND ND ND ND 5.说明 通过上述方法学考察结果分析,本方法具有线性范围宽、专属性强、结果准确,可用于饲料井测定氨基酸含量。 附录 氨基酸溶液响应值比较 来源一:贝因美实验室,17种氨基酸混合标准溶液(胱氨酸为1.25uM/mL, 其他氨基酸浓度为2.5uM/mL) 来源二:上海应用中心实验室,外购17种氨基酸混合标准溶液(标称值:氨酸为1.25 pM/mL,其他氨基酸浓度为2.5uM/mL) 按照正文中衍生方法及色谱条件进行测试峰面积(响应值),结果见下表4 表4.不同标液的氨基酸衍生物峰面积比较 峰名称 上海实验室 贝因美实验室 差异(%) Glu 9.2458 9.5745 3.56 Asp 9.7106 10.7935 11.15 Ser 11.5874 12.2666 5.86 His 8.1287 8.887 9.33 Gly 12.445 13.1737 5.86 Thr 9.5186 10.2456 7.64 Arg 11.0393 12.408 12.40 Ala 10.0249 11.294 12.66 Tyr 9.2907 10.0871 8.57 Cys 0.7822 0.8241 5.36 Val 9.1545 9.7012 5.97 Met 10.01 11.1409 11.30 Phe 9.6037 10.4405 8.71 lle 9.3926 10.2093 8.70 Leu 10.4085 11.8269 13.63 Lys 19.6506 22.2261 13.11 Pro 0.5674 0.5898 3.95 饲料中黄曲霉毒素的测定 1.引言 黄曲霉毒素(AFT)是一类化学结构类似的化合物,均为二氢呋喃香豆素的衍生物。黄曲霉毒素是主要由黄曲霉(aspergillus flavus) 寄生曲霉(a.parasiticus)产生的次生代谢产物,是目前饲料中毒性最大、波及面最广的真菌毒素之一。B1是二氢呋喃氧杂萘邻酮的衍生物,即含有一个双呋喃环和一个氧杂萘邻酮(香豆素),前者为基本毒性结构,后者与致癌有关。M1是黄曲霉毒素B1在体内经过羟化而衍生成的代谢产物,与致癌性有关。黄曲霉毒素的主要分子型式含B1、B2、G1、G2、M1等。 GB13078-2001饲料卫生标准中规定我国仔猪配合饲料及浓缩饲料黄曲霉毒素B1最高残留量值不得高于10 ug/kg、肉用仔鸡前期、雏鸡配合饲料及浓缩饲料黄曲霉毒素B1最高残留量值不得高于20 pg/kg、肉用仔鸡后期、成长鸡、产蛋鸡配合饲料及浓缩饲料黄曲霉毒素B1最高残留量值不得高于20 pg/kg、肉用仔鸭前期、雏鸭配合饲料及浓缩饲料黄曲霉毒素B1最高残留量值不得高于10 pg/kg、肉用仔鸭后期、生长鸭、产蛋鸭配合饲料及浓缩饲料黄曲霉毒素B1最高残留量值不得高于15 pg/kg、鹌鹑配合饲料及浓缩饲料黄曲霉毒素B1最高残留量值不得高于20 pg/kg、奶牛精料补充料黄曲霉毒素B1最高残留量值不得高于10 pg/kg、肉牛精料补充料黄曲霉毒素B1最高残留量值不得高于50 pg/kg。 2.测试用对照品 使用流动相将黄曲霉毒素 B1 150 pg/L、B2 150 pg/L、G1150 pg/L、G2 150 pg/L、M1 500 pg/L 混合标准溶液依次稀释成(0.15 pg/L、0.15 pg/L、0.15 pg/L、0.15 pg/L、0.5 pg/L)、(0.3 ug/L、0.3 pg/L、0.3 pg/L、0.3 pg/L、1.0 pg/L)、(1.2ug/L、1.2 ug/L、1.2 ug/L、1.2 pg/L、4ug/L)、、(3ug/L、3pg/L、3 ug/L、3 ug/L、10 pg/L)和(4.5pg/L、4.5 pg/L、4.5 pg/L、4.5 pg/L、15pg/L)的线性混合标准溶液。 3.样品前处理 提取液:甲醇:水=7:3 精确称取5g饲料样品加入到50mL离心管中,加入25mL提取液,加入1g氯化钠,振摇后涡旋 2 min, 超声 20 min, 中间振摇3次,滤纸过滤。精确量取10 mL提取液,加入6mL正己烷,充分振摇后,待分层,精确量取下层液体8mL,加 入112 mL超纯水,混匀,使用玻璃滤纸过滤至澄清。取该滤液75mL, 以1滴/s的速度过免疫亲和柱(AFT免疫亲和柱,美国 VICAM), 使用20 mL超纯水以1滴/s的速度清洗免疫亲和柱,2mL空气排空后,使用4mL甲醇洗脱并空气排空,收集洗脱液,60℃下氮吹至小于0.2mL, 使用流动相充分溶解样品并定容至1mL,制成样品溶液。 4.色谱条件 色谱柱 Thermofisher Syncronis C18, 5 um 4.6×150 mm, P/N: 97105-154630 柱温 室温 流动相 乙腈:甲醇:水=22:22:56 流速 0.8 mL/min 衍生条件 衍生泵:0.05%碘溶液(0.1g碘溶解于 20mL甲醇中,用水定量至200mL) 衍生泵流速:0.2mL/min 衍生化温度:70℃ 衍生反应管: Reaction Coil 750pL+ Reaction Coil 375pL 进样量 100 pL 检测器条件 FLD, Ex: 365nm; Em: 435nm 5.结果与讨论 5.1方法线性 1 图1.线性叠加谱图 (其中1、2、3、4、5分别代表从低到高的线性浓度) 图2.标准曲线图 (其中1、2、3、4、5分别代表黄曲霉毒素M1、G2、G1、B2、B1) 表1.线性数据 Peak Name Cal.Type Points Offset (C0) Slope (C1 ) Curve (C2) Corr.Coeff.% AFT M1 LOff 5 221.737 11900.772 0.000 99.993 AFT G2 LOff 5 58.532 17583.034 0.000 99.991 AFT G1 LOff 5 136.139 15419.663 0.000 99.994 AFT B2 LOff 5 -4.329 41002.287 0.000 99.988 AFT B1 LOff 5 268.323 24601.217 0.000 99.991 5.2方法检出限、定量限 1 表2.图3对应数据 No. Peakname Ret.Time(min) Area( counts*min) amount(pg/L) Resolution S/N 1 AFT M1 7.990 680.7633 0.17 3.52 4.4 2 AFT G2 9.260 953.2900 0.05 4.47 5.9 3 AFT G1 11.133 869.2133 0.05 2.71 4.8 4 AFT B2 12.480 2009.6383 0.05 4.70 10.3 5 AFT B1 15.150 1110.5100 0.05 n.a. 5.2 表3.检出限、定量限数据 图3.检出限附近谱图与空白叠加谱图 (其中1、2分别代表空白、检出限附近谱图) LOD (ug/L) LOQ(ug/L) AFT M1 0.116 0.386 AFT G2 0.025 0.085 AFT G1 0.031 0.104 AFT B2 0.015 0.049 AFT B1 0.029 0.096 图4.定量限附近三针标准品叠加谱图 表4.精密度考察结果(图4数据) No. 待测物 Ret.Time RSD(%n=3) Area RSD(%n=3) amount(pg/L) 1 AFT M1 0.296% 2.156% 0.5 2 AFT G2 0.309% 2.137% 0.15 3 AFT G1 0.177% 0.698% 0.15 4 AFT B2 0.041% 2.042% 0.15 5 AFT B1 0.206% 2.651% 0.15 5.4方法回收率 图5.回收率谱图 (其中1、2、3分别代表标准品、加标样品、样品) 表5.回收率考察结果(图5数据) 加标量(pg/L) 加标回收率(%) AFT M1 5.0 82.20 AFT G2 1.5 80.94 AFT G1 1.5 99.22 AFT B2 1.5 99.50 AFT B1 1.5 98.56 6.前处理方法摸索过程 根据《NYT2071-2011饲料中黄曲霉毒素、玉米赤霉烯酮和T-2毒素的测定液相色谱-串联质谱法》最初选择乙腈:水=84:16作为黄曲霉毒素的提取液,发现AFT M1、AFT G2的回收率很差,都在20%左右(AFT G1、AFT B2、AFT B1回收率比较好,接近100%),怀疑是免疫亲和柱上样之前的有机相含量过高原因引起的(水稀释5倍),之后连续使用水稀释10倍、15倍、25倍, AFTM1、AFT G2的回收率依然没有改进。而且在过玻璃纤维滤纸的过程中,连续过了4遍玻璃纤维滤纸,液体依然没有彻底澄清。 根据《GBT 食品中黄曲霉毒素的测定免疫亲和层析净化高效液相色谱法》使用甲醇:水=7:3作为黄曲霉毒素的提取液,水稀释提取液10倍后进免疫亲和柱, AFT M1、AFT G2 的回收率有所提高(70~80%),之后将稀释倍数变成15倍后,回收率升高到80%以上。 相比《AN_C_LC-21双三元柱后碘衍生测定芝麻中的5种黄曲霉毒素》中 AFT M1、AFT G2 的回收率接近100%,初步认为是饲料中基质干扰的问题,导致免疫亲和柱回收率降低。在实验过程中还发现,在最终的浓缩过程中,如果浓缩体积大于0.2 mL, 使用流动相定容至1mL时,会出现强烈的溶剂效应,如图6所示,当浓缩体积小于0.2mL时,使用流动相定容至1mL时干扰消除。 图6.溶剂效应谱图 (其中1、2、3分别代表标准品、样品、样品加标) 饲料中赭曲霉毒素A的测定 1.引言 赭曲霉毒素是由真菌产生的一组结构类似的有毒的次级代谢产物,主要危害人和动物的肾脏,有A、B、C、D四种化合物,其中毒性最大、分布最广、对农作物的污染最严重、与人类健康关系最密切的是赭曲霉毒素A。我国饲料中常见的检测浓度和 GB 13078-2006《饲料卫生标准赭曲霉毒素A的允许量》中规定了配合饲料、玉米中赭曲霉毒素A允许量不能大于100 pg/kg。 2.测试用对照品 使用流动相将1 mg/L的赭曲霉毒素A标准溶液依次稀释成1 pg/L、4 pg/L、10 pg/L、50 pg/L、100 pg/L、200 pg/L的线性标准溶液。 3.样品前处理 提取液:甲醇:水=8:2。 PBS溶液:精确称取8g氯化钠、1.2g磷酸氢二二、0.2g磷酸二氢钾、0.2g氯化钾,溶解于990mL水中,用浓盐酸调节PH=7,用水稀释至1L。 清洗液缓冲:精确称取25g氯化钠、5g碳酸氢钠溶于水中,加入0.1 mL 吐温-20,用水稀释至1L。 精确称取10g饲料样样加入到50mL离心管中,加入20 mL提取液,加入0.5g氯化钠,振摇后涡旋3min, 超声 20 min,中间振摇3次,10000 r/min 离心 5min 后取上清液。精确量取2 mL 上清液于10 mL容量瓶中,加入PBS溶液至刻度,摇匀,玻璃滤纸过滤(如果不澄清可过滤两次)。精确量取过滤后的提取液5mL,以1滴每秒流速流过免疫亲和柱(PriboFast赭曲霉毒素A免疫亲和柱),然后2~4mL空气排空,10 mL清洗缓冲液、10 mL 水依次淋洗免疫亲和柱,弃去淋洗液,抽干小柱。1.5mL甲醇洗脱,45℃下氮吹 <0.2mL后,用流动相定容至0.5mL,供检测。 4.色谱条件 色谱柱 Syncronis C18, 5 pm 4.6×150 mm, P/N: 97105-154630 柱温 30℃ 流动相 乙腈:水:冰醋酸=48:51:1 流速 1.0 mL/min 进样量 20 pL 检测器 FLD, Ex: 333nm; Em: 460nm 5.结果与讨论 5.1线性 图1.线性叠加谱图 (其中1、2、3、4、5分别代表1 pg/L、4 pg/L、10 pg/L、50 pg/L、100 pg/L、200 pg/L的OTA标准溶液) 图2.0TA 标准曲线图 Peak Name Retention Time(min) Cal.Type Points Offset(CO) Slope (C1) Curve(C2) Corr.Coeff.% OTA 10.31 Lin 6 0.000 675.679 0.000 100.000 5.2检出限、定量限 1 图3.检出限附近(1pg/LOTA) 谱图与空白叠加谱图 (其中1、2分别代表空白、检出限附近(1pg/LOTA)谱图) 图4.定量限附近(5pg/L OTA)谱图与空白叠加谱图 (其中1、2分别代表空白、定量限附近(5 pg/LOTA)谱图) 表2.检测限和定量限数据 Ret.Time LOD (S/N=3) LOQ(S/N=10) 图5.检测限附(1pg/LOTA) 重复性叠加普图 -1 图6.定量限附近(5pg/LOTA)重复性叠加谱图 表3.检出限、定量限重复性数据 Peak Name 1 ug/L OTA RSD (%) 5 ug/L OTA RSD (%) OTA 1.986 1.871 5.3各种饲料回收率 2 350,000 图7.鸡肉预混合饲料加标结果 图9.浓缩饲料加标结果 (其中1、2、3分别为 50 pg/L的 OTA 标准品、鸡肉预混合饲料样品加标50 pg/L的OTA、鸡肉预混合饲料样品) (其中1、2、3分别为 50 pg/L 的OTA标准品、浓缩饲料样品加标50 pg/L的OTA、浓缩饲料样品) <1 表4.回收率数据 名称 实际样品中OTA含量(ug/L) 加标量(ug/L) 加标后得到的OTA 含量(ug/L) 加标回收率%) 鸡预混合饲料 0 50 46.71 93.42 猪前期饲料 0 50 40.70 81.4 浓缩饲料 9.46 50 46.01 73.10 6.前处理方法摸索过程 图8.猪前期饲料加标结果 (其中1、2、3分别为50 pg/L 的OTA标准品、猪前期饲料样品加标50 pg/L 的 OTA、猪前期饲料样品) 参考《GB 13078.2-2006饲料卫生标准饲料中赭曲霉毒素A和玉米赤霉烯酮的允许量》、《GBT 23502-2009食品中赭曲霉毒素A的测定免疫亲和层析净化高效液相色谱法》及《GBT 25220-2010粮油检验粮食中赭曲霉毒素A的测定高效液相色谱法和荧光光度法》选择择醇:水=8:2作为提取液,北京泰乐琪的 PriboFast赭曲霉毒素A免疫亲和柱作为前处理柱进行液相荧光检测饲料中的赭曲霉毒素A含量,方法结果显示检测限达到0.81 pg/kg, 小于 GBT 25220-2010规定的1 pg/kg, 回收率也在 GBT 25220-2010规定的70~100%之内。本方法适合鸡用预混合饲料、猪前期饲料及浓缩饲料。 经过多次实验发现,对于猪预混合饲料,回收率只能达到52%左右,所以本方法不适用猪预混合饲料。 饲料中玉米赤霉烯酮的测定 1.引言 玉米赤霉烯酮是一种具有强烈致畸作用的生殖系统毒素,会导致家畜生长速度下降、免疫抑制、繁殖障碍等后果,从而给畜牧业带来严重威胁。由于玉米赤霉烯酮的危害性和污染普遍性, GB 13078.2-2006《饲料卫生标准饲料中赭曲霉毒素A和玉米赤霉烯酮》中已经规定了饲料中玉米赤霉烯酮的最高限量不得超过 0.5 mg/kg, 因此对玉米赤霉烯酮进行监测,对于畜牧业的健康发展具有非常重要的意义。 2.测试用对照品 液相-荧光方法:使用流动相将 100.4 pg/mL的玉米赤霉烯酮(ZEN)标准溶液依次稀释成 100 pg/L、250 pg/L、500ug/L、1250 pg/L、5000 pg/L 的 ZEN 线性标准溶液。 3.样品前处理 提取液:乙腈:水=80:20. PBS浓缩液:精确称取12g氯化钠,4.53g十二水合磷酸氢二钠,0.3g磷酸二氢钾及0.3g氯化钾,放置于200 mL的烧杯内,加入140 mL去离子水溶解,用氢氧化钠溶液或者盐酸溶液调节 PH值至7.0,用去离子水定容至150mL。 PBS溶液:用去离子水将 PBS 浓缩液按 1:9 体积进行稀释。 提取:精确称取40g样品, 加入10 g氯化钠及250mL提取液中,涡旋2 min 后高速匀质2 min,离心取上清液10 mL, 加入40 mL PBS溶液稀释,用玻璃纤维滤纸过滤至滤液澄清,备用。 净化:精确移取 18.75 mL上述提取液置于玉米赤霉烯酥免疫亲和柱上,重力过柱,然后使用10 mL PBS 溶液快速冲洗免疫亲和柱并抽干。使用0.5 mL 甲醇浸泡免疫亲和柱5 min 后,重力流出洗脱液,然后使用1mL甲醇浸泡免疫亲和和5 min后,重力流出洗脱液,合并两次洗脱液,0.22 pm 滤膜过滤后进样。 4.色谱条件 流动相 Time (min) 乙腈(%) 甲醇(%) 水(%) 0 37.5 6.5 56 30 37.5 6.5 56 5.结果与讨论 5.1方法线性 图1.液相色谱标准曲线图 表1.液相色普线性 Retention time(min) Cal. Range(ug/L) Points Cal. Corr.Coeff.% 17.71 100~5000 5 Y=108.3x 99.98 图2.液相色谱线性叠加谱图 图4.回收率放大谱图 (其中1、2、3、4、5分别代表 100 pg/L、250 pg/L、500 pg/L、1250 pg/L、5000 pg/L 的线性浓度) (其中1-6分别为250ppb 的 ZEN标准品, 鸡用预混合饲料、猪前期饲料、猪用预混合饲料、猪浓缩饲料、加标250ppb ZEN 的猪浓缩饲料) 5.2方法回收率、定量限、检测限 5.3方法精密度 Peak Name 重复性(%) 图3.回收率谱图 (其中1-6分别为 250ppb 的ZEN标准品、鸡用预混合饲料、猪前期饲料、猪用预混合饲料、猪浓缩饲料、加标250ppb ZEN 的猪浓缩饲料) 图5.检测限附近标准品(25pg/L)重复性叠加谱图 表2.回收率数据 Peak Name 加标量(ug/L) 饲料中检测量(ug/L) 加标后饲料样品中检测量(ug/L) 回收率(%) 检测限 S/N=3(ug/kg) 定量限 S/N=10(ug/kg) ZEN 207.6 37.3 223.5 89.69 12.5 41.7 6.建议 本方法最初根据大量文献希望通过 M160净化柱前处理后使用液相-荧光检测饲料中的玉米赤霉烯酮,通过实验发现,M160对于饲料的前处理不是很理想,玉米赤霉烯酮附近有很多干扰峰,如图6所示,对液相色谱条件进行进一步的优化后,依然没有达到理想的分离结果。 图6.M160净化柱后液相色谱叠加谱图 (其中1-3分别代表样品、加标200 pg/LZEN 的样品、200 pg/LZEN标准品) 参考《NYT 2071-2011饲料中黄曲霉毒素、玉米赤霉烯酮和T-2毒素的测定液相色谱-串联质谱法》中使用质谱作为检测手段(SRM),能够得到很好的干扰排除,如图7、8、9,但是如果按照该标准线性点溶在甲醇中做标准曲线去测定试剂浓缩饲料样品的时候,发现回收率只有不到50%。之后通过200 pg/L的标准品过 M160 柱前后得到的玉米赤霉烯酮峰面积做对比,发现M160的柱回收率有86.27%;通过将实际样品加标 200 pg/L得到的玉米赤霉烯酮峰面积与200 pg/L 的玉米赤霉烯酮标准品及不加标的实际样品进行对比,发现回收率只有34.55%。所以推断出加标回收率不到50%是因为饲料基质对质谱检测的干扰形成的,所以通过在浓缩饲料的净化后浓缩液里加标来检测标准曲线来测定实际样品中玉米赤霉烯酮的含量,测得浓缩饲料中含有玉米赤霉烯酮207.63 pg/kg, 与液相方法中检测到的2.34 pg/kg相差很大,认为是液相方法中基质干扰导致基线抬高,大量的玉米赤霉烯酮没有检测到引起的。 图7.质谱-ZEN200 pg/L谱普. 图8.质谱-浓缩饲料加标 ZEN200 pg/L谱图 图9.质谱-浓缩饲料未加标谱图 最后根据《GBT 28716-2012饲料中玉米赤霉烯酮的测定免疫亲和柱净化-高效液相色谱法》使用免疫亲和柱对饲料中的玉米赤霉烯酮进行检测。 所以建议,如果希望使用液相-荧光作为检测手段的时候,前处理方法选择选择性比较高的免疫亲和柱方法,如果选择M160 净化柱作为前处理手段的时候,选择液质联用进行检测。 饲料中的伏马毒素B1 和 B2的测定 伏马毒素 (Fumonisin FB) 是一类真菌毒素,是由串株镰孢、轮状孢、多育镰孢和其他一些镰孢菌种产生的次生代谢产物,是一类由不同的多氢醇和丙三羧酸组成的结构类似的双酯化合物,包括一个由20个碳组成的脂肪链及通过二个酯键连接的亲水性侧链。自1988年南非与美国的研究人员首次从霉变的玉米中分离出伏马毒素B1(FB1)以来, 到目前为止,已经鉴定到的伏马毒素类似物有28种,其中以FB1 为主。 伏马毒素普遍存在于玉米、小麦、大米等粮食作物中,对动物和人的健康有很大的潜在危害,已被世界卫生组织列为2B类致癌物。伏马毒素主要损害动物的肝功能,引起马脑白质软化症和猪肺水肿;对人体健康也构成潜在威胁,可能诱发食管癌、肝癌、胃癌等。 伏马毒素尤其是 FB1对饲料污染的情况在世界范围内普遍存在,其污染的饲料主要为以玉米为原料的饲料。目前,饲料中伏马毒素的的测主要有酶联免疫法(elisa)、高效液相色谱法,液相色谱联用质谱法等。 本文参考我国农业部标准 NY/T 1970-2010,采用超声提取,强阴离子交换柱净化,柱前OPA衍生,高效液相色谱法联用荧光检测器分析饲料中的 FB1和 FB2两种伏马毒素,取得良好的实验结果,具有一定的参考意义。 2.测试用对照品 使用75%甲醇溶液将50 mg /L的伏马毒素B1和B2的标准溶液依次稀释成 10 pg/L、20 ug/L、50 ug/L、100 pg/L、200 pg/L、500 ug/L、1000 pg/L的线性标准溶液。 3样品前处理 提取液:甲醇:水=75:25. OPA衍生剂:称取邻苯二甲醛40 mg, 溶于1mL甲醇,加入5 mL 50 mM四硼酸钠溶液(pH=9.5)稀释,再加入50 pL巯基乙酸, 混匀后备用,避光4℃保存一周。 提取:精确称取2g饲料样品加入到50 mL离心管中,加入10mL提取液,振摇后涡旋3 min, 超声提取5 min,以10000 r/min 离心5 min, 移取上清液后同样步骤提取一次,合并上清液,调节pH至6~7 净化:精确量取2mL上清液至已活化的固相萃取小柱中( Thermo Scientific HyperSep SAX,货号:60108-521, 500 mg/3 mL, 依次用甲醇3mL和75%甲醇3mL淋洗活化),依次用3mL 75%甲醇溶液、3mL甲醇淋洗小柱,抽至近干后用 10 mL1%乙酸甲醇洗脱,收集洗脱液于45℃下氮吹干,残留物用1mL 50%乙腈溶液溶解,待衍生检测。 OPA衍生:准确量取等体积的OPA衍生剂和样品溶液,混匀,涡旋震荡 30 s, 于2 min 内进液相色谱分析。 4.色谱条件 色谱柱 Thermofisher Syncronis C18, 2.1*100mm, 1.7pm, S/N: 0116014X6, P/N:97102- A(%) B(%) 102130 70 30 4.5 85 15 9.0 85 15 9.5 70 30 13.5 70 30 5结果与讨论 5.1标准品测试图谱 图1.标准品分析谱图(20pg/L) 5.2方法精密度 5.3方法线性 取混合标准品溶液,衍生后3 min 内进样分析,重复5次,计算峰积的RSD, 结果 FB1 和FB2 的RSD分别为 1.793,2.470。 取系列浓度标准准溶液,进样10 pL。以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,考察相关系数。结果见表1和图3、图4. 图3.各浓度标准品叠加谱图 图2.重复性谱图(n=5) 图4.标准曲线 表1.线性数据 No. Ret.Time(min) Peak Name Cal.Type Point Offset (C0) Slope (C1) Range (ug/mL) Corr.Coeff% 1 7.4 FB1 LOff 7 -1439 417811 (0.01~1) 99.98 2 9.1 FB2 LOff 7 -2017 379636 (0.01~1) 99.98 5.4方法检出限、定量限 以信噪比为10:1, 测得 FB1和 FB2的最低定量限检测浓度约为 0.01 pg/mL、以信噪比为 3:1, 测得 FB1和FB2的最低检测限浓度约为 0.005 ug/mL. 图5.定量限附近(0.01 pg/mL)谱图 图6.检出限附近(0.005pg/mL)谱图 5.5方法回收率及实际样品测定结果 取饲料样品,加入一定量的伏马毒素标准品,按照样品前处理方法制备成供试品溶液,测定图谱见图7,测定结果见表2。 图7.空白加标、样品、样品加标图谱 表2.回收率数据 名称 实际样品含量(ug/g) 加标量(ug/g) 测得量(ug/g) 加标回收率(%) 空白1 0 1 0.93 93.3 浓缩饲料1 1.23 1 1.83 82.1 空白2 0 1 0.84 84.0 浓缩饲料2 0.32 1 0.94 71.2 6.建议 参考《NYT 1970-2010 饲料中伏马毒素的测定》、《GBT 25228-2010粮油检验玉米及其制品中伏马毒素含量测定免疫亲和柱净化高效液相色谱法和荧光光度法,选择了 NYT 1970-2010的提取条件,即以甲醇:水=75:25作为提取液;另外,考虑到免疫亲和柱价格较贵,最终选取以强阴离子交换固相萃取柱净化。结果显示:方法最低检测限为0.025 mg/kg,最低定量限为0.05mg/kg, 与标准相符。回收率在70~100%之间,符合标准的规定。 NYT 1970-2010标准采用甲醇:0.1 mol/L 磷酸二氢钠(pH=3.3)= 77:23 作为流动相,在实际实验中如下问题:1,FB1的出峰时间较早,而OPA 的衍生试剂的峰很大很宽,因此FB1 的峰会被衍生试剂的峰干扰;2,某些饲料的基质比较复杂,等度洗脱无法将所以杂质一次性洗脱出来,未洗脱的杂质可能会对下一次进样产生干扰。综合考虑,参考文献方法,最终确定了以甲醇-0.1 mol/L 的甲酸铵(pH=3.3)作为流动弟,梯度洗脱。解决了如上所述的干扰峰问题。 ( 采用 OPA 试剂衍生测定伏马毒素的含量, OPA试剂与伏马毒素生成的衍生产物不稳定,需要衍生后2 min 之内立即进样分析,以确保结果的重现性。 ) ( 7.参考文献 ) ( [1]王军淋,胡玲玲,蔡增轩,任一平, 超 高压液相色谱法同时检测玉米中的伏马毒素B1、B2、B3。食品安全质量检测学报, 2013,4(10)215-23。 ) 1.引言 呕吐毒素(vomitoxin),又称脱氧雪腐镰刀菌烯醇(DON),化学名为3α,7α,15一三羟基草孢菌-9-烯-8-酮,属单端孢霉烯族化合物。由于它可以引起猪的呕吐而得名1.2。对人体有一定危害作用,欧盟分类标准为三级致癌物。欧盟要求呕吐毒素要小于 1.0 mg/kg;中国饲料要求低于 1 mg/kg 13-5。DON 的污染常出现于小麦、大麦、玉米和饲料中,因此绝大部分 DON 检测方法是针对这些物质,而分析谷物及饲料中的 DON 并非易事,许多因素必须给以良好控制。日常检测的3种毒素是脱氧雪腐镰刀菌烯醇(DON)、3-乙酰脱氧雪腐镰刀菌烯醇(3-DON)和15-脱氧雪腐镰刀菌菌醇(15-DON)。例如要从大量的原始材料中抽取适当的样品,适当的储备、处理以及恰当地从样品中抽小样。原始材料可能存在的不均一性和在储备、分装过程中可能出现的污染物使分析进一步复杂化;另一方面,分析过程中需要估计精确度、精密性、最低检出限以确保检测得出的数据能具有代表性,尽可能把分析错误减到最小。目前呕吐毒素的分析测定一般采用薄层色谱法(TLC)、酶联吸附免疫法(ELISA)和高效液相色谱法(HPLC)。其中TLC 法繁琐费时,且灵敏度、特异性较差,提取过程中所需有机溶剂品种多且量大,易污染环境,对人体有较大危害。而 ELISA 法测定结果受试剂盒差异、实验温度、仪器灵敏度等条件影响较大,重复性差,假阳性率高,难以达到相关技术要求。HPLC法检测灵敏度高、重复性好、操作简便、快速灵敏,目前已作为粮谷中呕吐毒素的最常用测定方法。 2.测试用对照品 DON, 3-DON, 15-DON标准曲线:移取 DON, 3-DON,15-DON标准溶液,用去离子水逐级稀释,0.05、0.25、0.5、1、2.5、5 pg/mL(3-DON&15-DON), 0.01、0.05、0.1、0.2、0.5、1 pg/mL(DON)的系列混合标准溶液。 3.样品前处理 选取市售的3种饲料做为样品,参考称取样品1 g, 于10mL离心管中,加水5mL振荡10 min,超声提取20 min,以12 000 r/min离心15min, 取上清液过 0.45 pm 滤膜过滤,取0.5 mL与0.5mL乙醇混合,置于4℃冰箱30 min,氮气吹干,2mL水复溶。1mL甲醇活化 SPE柱,上样2mL,1mL水洗脱,空气流干 10 min,1 mL乙酸乙酯洗脱,氮气吹干,1 mL 水复溶,过 0.45 um 滤膜过滤供测定。 4.色谱条件 分析柱 Syncronis 250×4.6 mm, 5 pm, PN 97105-254630 流动相 1mM磷酸水:乙腈(90:10) 流速 1.0 mL/min 柱温 30℃ 检测器 UV: 224 nm 进样量 20pL 图1.DON, 3-DON, 15-DON标准溶液 UV 色谱图 Time [min] 图3.样品色谱图 6.结果与讨论 6.1方法线性、检出限 由低浓度至高浓度依次进样检测,以质量浓度与峰面积作标准曲线线性回归。结果表明, DON 在0.01-1 pg/mL,3-DON&15-DON在0.05-5 pg/mL范围内显良好线性关系(r>0.999)。通过溶液逐步稀释法,测得最低定量限为0.05 pg/mL, 检出限为 0.025 pg/mL。外标法定量。标准曲线如下: 图4. DON, 3-DON, 15-DON标准曲线 Ret.Time (min) Peak Name Cal.Type Coeff.ofDetermination Co (Offset) C1 (Slope) 19.813 DON Lin, WithOffset 0.99981 -0.0036 0.0332 20.700 15-DON Lin, WithOffset 0.99992 0.0066 1.6584 21.193 3-DON Lin, WithOffset 0.99990 -0.0041 1.6761 6.2方法回收率和精密度 分别配置低浓度(DON 0.04 ug/mL, 3-DON&15-DON 0.16pg/mL),中浓度( DON 0.2 pg/mL, 3-DON&15-DON 0.8ug/mL),高浓度(DON 0.8 g/mL, 3-DON&15-DON 4.0pg/mL)的标准品溶液,连续7针进样。添加一定浓度的标准品,精密度数据结果见表3。在样品中加入(DON 0.6 pg,3-DON&15-DON3 pg), 处理后经测量得 DON, 3-DON,15-DON的回收率分别为 80.04%,86.72%,90.19%。 Time [min] 图4.连续7针精密度 表3.DON, 3-DON, 15-DON精密度的结果 浓度范围 RSD(%) 高浓度 中浓度 低浓度 DON 1.85 1.44 1.26 3-DON 0.67 0.28 1.87 15-DON 0.30 0.15 1.15 6.3实际样品测定 按上述方法测定了3种饲料样品中 DON, 3-DON, 15-DON的残留量,结果样品均未检出 DON, 3-DON, 15-DON。 6.4讨论 本实验采用国家标准测定饲料中 DON, 3-DON, 15-DON,各项方法学数据均满足测定要求,是饲料中DON, 3-DON,15-DON测定的快捷有效方法。 7.参考文献 ( [1 ] 孟昭赫.酵米面,银耳等食品中椰酵假单菌及其毒素的 污染调查[J].卫生研究,1993,22(2):99-101. ) ( [2 ]K rska R , B aumartner S, J o sephs R.The State-of-the art i n the analysis of type- A and-B trichithecendmycotoxins i n cereals.Fresenius J Anal Chem.2001, 371:285-299. ) ( [3] ENGELHARDT G.Production of mycotoxins by Fusarium s pecies isolated in Germany 1.T i me c o urseof deoxynivalenol, 3-acetyldeoxyniv alenol, andzearalenone formation on solid substrates[J].Z LebensmUnters Forsch,198(6182 ) :123-126. ) ( [4] 引 张鹏.出入境粮谷中呕吐毒素检测方法的研究[J].检验 检疫科学,2003,1 ( 32): 8-10. ) ( [5] Y Yang, D, Geng, Z.M., Yao, J.B., Zhang, X., Zhang,P.P. , Ma, H.X., [J] Simultaneous determination o fdeoxynivalenol, and 1 5- a nd 3-acetyldeoxynivalenolin cereals by HPLC-UV detection. World MycotoxinJournal, May 2013;6(2): 1 17-125. ) 饲料中核糖核苷、单磷酸核苷酸的测定 核苷酸是动物体内一类低分子化合物,它具有编码遗传信息、调节能量代谢和传递细胞信号、作为辅酶等重要的生理生化功能。由于动物机体能合成各种核苷酸,而且又没有特异性的缺乏症,所以长期以来大家一直认为核苷酸是非必需的营养素。近几年的研究表明,核苷酸作为一种无毒无害的安全新型功能饲料添加剂,在家畜、禽及水产动物的饲料中广泛应用。主要原因是当动物体内从头合成的核苷酸不能满足各种代谢旺盛的组织和细胞的需要,而平时饲料中又没有适当核苷酸补充就会削弱肝脏、心脏、肠道和免疫系统的功能,因此如果在饲料中添加适量的核苷酸,能够起到维持免疫系统正常功能,改善胃肠道发育,提高肝功能和脂肪代谢等重要的作用,特别是在畜牧生产中具有促进动物生长和改善肉质的明显作用,是一种半必需营养素,具有良好的发展前景[1-3]。 本文采用高效液相色谱的方法(HPLC-UV)测定了几种常见饲料中的核苷和核苷酸的含量,具有一定的参考意义。 2.样品前处理 2.1标准溶液配制 分别精密称量尿嘧啶核苷(U)、鸟嘌呤核苷(G)、腺嘌呤核苷(A)、肌苷(1)、胞嘧啶核苷(C)、单磷酸腺苷(AMP)、单磷酸鸟嘌呤核苷(GMP)、单磷酸次黄嘌呤核苷(IMP)、单磷酸尿嘧啶核苷(UMP)固体粉末标准品 5.0 mg分别溶解于1mL去离子水中,混匀,单磷酸胞嘧啶核苷(CMP)溶解于1mL的 NaOH碱溶液中,分别得到 5.0 mg/mL的十种标准溶液; 取十种标准溶液不同体积,稀释混匀得到一系列浓度的标准溶液(0.02、0.05、0.1、0.2、0.5、1、2、5、10 mg/L)。 2.2样品前处理 猪饲料/鸡饲料:准准确取0.5g固体样品,用25mL温水稀释混匀后放入超声波水浴中超声震荡20 min取出,量取20mL 转入50mL容量瓶中,加入1 mL 25%的乙酸沉淀蛋白,再用超纯水定容到50mL后混匀,离心取上清液,过 0.22 um滤膜,直接进样分析; 其他饲料:准确称取5.0g左右的样品,用25 mL温水溶解后放入超声波水浴中超声震荡 20 min 取出,量取20mL转入50mL容量瓶中,加入1mL 25%的乙酸沉淀蛋白,再用超纯水定容到50mL后混匀,离心取上清液,过0.22um滤膜,直接进样分析。 3.色谱条件 色谱柱 Acclaim C30, 3 pm 2.1 mmx 100 mm, B -5 P/N: 078665 20 0 柱温 10℃ 20 0 检测器 UV: 260nm: 20 5.9 70 20 10 9 42 20 38 11.9 42 20 38 12 80 20 0 15 80 20 0 4.测定谱图 4.1原色谱条件分离图谱 4.4猪饲料样品分离谱图 4.5猪饲料样品及加标分离谱图 4.2优化温度后分离图谱 4.3标准样品谱图 核苷 4.6其他饲料样品分离谱图 4.8鸡饲料样品色谱图 4.7其他饲料样品及加标分离谱图 4.9重现性 5.实验结果 表1.重复性实验数据 RSD(%) Retention Time Peak Area Peak high CMP 0.18 1.35 0.84 UMP 0.14 1.15 0.60 Cytidine 0.09 0.32 0.43 GMP 0.11 0.96 0.85 IMP 0.10 1.14 0.67 Uridine 0.34 0.69 0.99 AMP 0.44 0.79 1.60 Inosine 0.01 0.30 0.45 Guanosine 0.25 0.23 0.42 Adenosine 0.12 0.40 0.56 表2.鸡饲料、猪饲料及其他饲料测定结果 鸡饲料 猪饲料 其他饲料 测量值(mg/L) 实际值(mg/g) 测量值(mg/L) 实际值(mg/g) 测量值(rmg/L) 实际值(mg/g) CMP 0.0232 2.92 0.3749 46.86 1.0468 13.08 UMP 0.3124 39.05 0.6479 65.87 ND ND Cytidine ND ND 0.0527 6.58 0.1778 2.22 GMP ND ND ND ND ND ND IMP ND ND 0.1162 14.52 ND ND Uridine ND ND 0.0744 9.3 0.0145 0.18 AMP 0.0866 10.82 0.0659 8.23 ND ND Inosine ND ND 0.0708 8.85 ND ND Guanosine ND ND 0.0832 10.4 0.0861 1.07 Adenosine 0.1362 17.03 0.0465 5.81 3.5320 44.15 计算方法:鸡饲料和猪饲料:实际值(mg/g)=测量值(mg/L)x0.05L/(0.5g×(20mL/25mL))其他饲料:实际值(mg/g)=测量值(mg/L)x0.05L/(5gx(20 mL/25mL)) 表3.样品加标回收率测定结果 No. 猪饲料 其他饲料 Content(mg/L) Added(mg/L) Found(mg/L) Recovery((%) Content(mg/L) Added (mg/L) Found(mg/L) Recovery(%) CMP 0.3749 0.5 1.1166 148.3 1.0468 0.5 1.6283 116.3 UMP 0.6479 0.5 1.2707 124.5 Na 0.5 0.6070 121.4 Cytidine 0.0527 0.5 0.5665 102.7 0.1778 0.5 0.7300 110.4 GMP ND 0.5 0.5300 106.0 ND 0.5 0.5107 102.1 IMP 0.1162 0.5 0.6573 108.2 ND 0.5 1.0887 217.7 Uridine 0.0744 0.5 0.6629 117.7 0.0145 0.5 0.5742 111.9 AMP 0.0659 0.5 0.6245 111.7 ND 0.5 ND Inosine 0.0708 0.5 0.4202 70.0 ND 0.5 0.1885 37.7 Guanosine 0.0832 0.5 0.4859 80.5 0.0861 0.5 0.3287 48.5 Adenosine 0.0465 0.5 0.4990 90.5 3.5320 0.5 3.8683 67.3 6.可行性建议 本实验采用高效液相色谱系统, Acclaim C30 色谱柱,紫外检测的方法测定饲料中的核苷和核苷酸。十种核苷酸标样在12 min 之内达到基线分离,且分离度和柱效都较高。表1所示为十种核苷和核苷酸的重复性实验,色谱峰的保留时间、峰面积和峰高的重现性较好。 由低浓度至高浓度依次进样检测,以质量浓度与峰面积作标准曲线线性回归。结果表明,十种核苷酸在0.02-10 mg/L范围内显良好线性关系(r>0.999)。外标法定量。标准曲线及参数请参见附录。 在分析实际样品时,发现不同种饲料的基质复杂程度相差较大,猪饲料和其他饲料的基质相对简单,但是杂质峰还是比较多,通过加标确认核苷和核苷酸的色谱峰;而鸡饲料成份非常复杂,由图4-8可知,在4-8 min 之间有响应较高的色谱峰影响,如果降低称样量,待测核苷和核苷酸的几乎没有,因此在此称样量条件下测定。总体来说在待测的三种饲料中核苷和核苷酸的含量较低,结果如表2所示。 表3所示为实际饲料样品中核苷和核苷酸的加标回收率结果,由于基质复杂,加标回收率也相差较大,做了两个样品的加标,发现前面的六种核苷和核苷酸加标回收率偏高,而后面四种偏低,因此实际饲料样品基质的复杂性会对测定结果产生一定影响。 ( 7参 考 文 献 ) ( [1] Burrells, Charles (Midlothian, G B) , W illiams, P a ulDavid ( Perth & K inross, G B). F ish f eed with i ncreased nucleotide content .United States Patent 6987095 ) ( 2] 王友明.核苷酸对动物营养作用及其在饲料中应用前景分析,中国畜牧杂志,2002,38(5) ) ( 3] 3 ] 宋春玲,计成,王永杰.外源核苷酸在畜禽生产中的营 养研究进展.中国畜牧兽医,2005,32(1) 10-1 ) 核苷 表4.核苷和核苷酸的标准曲线 No. Ret.Time (min) Peak Name Cal.Type Offset (C0) Slope (C1) Range ((mmg/L) Corr.Coeff% 1 1.653 CMP LOff 0.1176 0.5645 0.02-10 0.9992 2 1.997 UMP LOff 0.0072 0.6943 0.02-10 0.9998 3 4.547 Cytidine LOff 0.0167 1.0783 0.02-10 0.9997 4 5.167 GMP LOff -0.0069 0.8634 0.02-10 0.9998 5 5.670 IMP LOff -0.0047 0.4833 0.02-10 0.9997 6 6.820 Uridine LOff 0.0015 1.5235 0.02-10 0.9997 7 8.057 AMP LOff 0.0050 0.8018 0.02-10 0.9997 8 8.543 Inosine LOff 0.0169 0.9932 0.02-10 0.9996 9 8.643 Guanosine LOff 0.0069 1.1770 0.02-10 0.9997 10 9.230 Adenosine LOff 0.0386 1.6492 0.02-10 0.9996 雌二醇(Estradiol) 又名雌素二醇,雌性二醇等,为白色结晶性粉末,几乎不溶于水,可溶于乙醇。雌二醇为甾体激素类药物,作用与己烯雌酚类似。有资料报道加入饲料中约20-70 mg/kg 可使氮,钙,磷等在动物体内积蓄增加,使脑下垂体生长激素的生成量发生变化。对动物生长有良好的促进作用。但若食品中残留较高,人体摄入过多后会导致体内内分泌紊乱,促进幼儿过早发育,严重影响下一代身体健康。中国明令禁止饲料中添加任何激素类物质,并出台相关标准。我们根据 NY-T 918-2004进行了饲料中雌二醇的检测方法的研究,通过 Thermo Ultimate 3000 型高效液相色谱仪,能够检出饲料中1mg/kg 的雌二醇,回收率89.58%,且有很宽的线性范围,可以满足饲料中雌二醇的检测要求。 2.测试用对照品 使用甲醇将雌二醇配成1 mg/mL的准准溶液,甲醇依次稀释成(2.5 pg/mL、5 pg/mL、10 pg/mL、12.5 pg/mL、15.0ug/mL、20.0 pg/mL、25.0 pg/mL) 的线性混合标准溶液,进样10pL检测。 3.样品前处理 精确称取2g饲料样品加入到50mL离心管中,精确加入10 mL提取液,震荡提取30分钟。过滤,取滤液1mL后加入4mL水,震荡混匀,准备上样。 5mL甲醇,5mL水依次活化SPE后,上样,20%甲醇-水溶液3mL洗脱,用6mL甲醇-乙腈(1:1)洗脱并收集,氮气吹干,准确加入1mL甲醇溶解,进样10 uL检测。 色谱柱 Acclaim C18, 5 um 4.6×250 mm, P/N: 059149 柱温 30℃ 固相萃取柱 Hypersep C18, 500 mg/6 mL, P/N: 60108-305 流动相 乙腈:水=40:60 流速 1.0 mL/min 进样量 10 pL 检测器 UV: 280nm 5.结果与讨论 5.1方法线性 图1.线性叠加谱图 (其中1-7分别代表从低到高的线性浓度) 1.80stdExternalArea [mAU*min] 图2.标准曲线图 表1.线性数据 Peak Name Cal.Type Points Offset ( C0 ) Slope (C1 ) Curve (C2 ) Corr.Coeff.% 雌二醇 LOff 7 -0.0015 0.0674 0.000 99.998 5.2方法检出限、定量限 1 1 图3.定量限谱图与空白叠加谱图 图4.检出限谱图与空白叠加谱图 (其中1、2分别代表空白、定量限谱图) (其中1、2分别代表空白、检出限谱图) 表2.定量限、检出限数据 Type amount(pg/L) Ret.Time (min ) Area ( counts*min ) S/N LOQ 0.3 17.253 0.0725 21.8 LOD 0.1 17.307 0.0059 6.2 5.3方法精密度 5.4方法回收率 图5.定量限附近三针标准品叠加谱图 图6.回收率谱图 (其中1、2分别代表样品、加标样品) 表3.精密度考察数据 表4.回收率考察数据 Peak name amount (ug/L) Ret.Time RSD(%) Ret.Time RSD(%) Estrodiol 0.3 0.527% 0.706% 加标量(ug/L) 加标回收率(%) Estrodiol 4 89.58 6.结论 该方法灵敏度高,重现性好,可以应用于饲料中雌二醇的检测。 饲料中三聚氰胺的测定 三聚氰胺 (Melamine) 又名蜜胺、氰尿酰胺,是一种重要的有机化工原料,纯白色单斜晶体。由于目前国际上通常采用凯氏定氮法测定饲料中粗蛋白的含量,通常三聚氰胺会被非法掺入饲料中以增加蛋白质检测值。三聚氰胺过多摄入会导致生物体内肾和输尿管结石,最终可能会导致死亡,因此国家严禁饲料中添加三聚氰胺,并出台相关饲料标准。我们根据NY/T 1372-2007 进行了饲料中三聚氰胺检测方法的研究,认为U3000型高效液相色谱仪能检测出饲料中2.0 mg/kg的三聚氰胺,回收率可以满足饲料中三聚氰胺的检测要求。 2.测试用对照品 准确称取三聚氰胺对照品100mg,用20%甲醇溶液溶解并定容至100mL容量瓶中。吸取5 mL于50 mL容量瓶中,20 %甲醇溶液定容至满刻度。分别吸取 1.0 mL, 5.0mL,10.0 mL, 25.0 mL, 50.0mL于5个100 mL棕色容量瓶中,20%甲醇定容至满刻度。三聚氰胺的浓度分别是 1.0 pg/mL,5.0 pg/mL, 10.0 pg/mL, 25.0 pg/mL, 50.0 pg/mL。 3.样品前处理 精确称取5g饲料样品,精确加入50 mL三氯乙酸溶液夜2mL乙酸铅溶液。摇匀后超声提取20 min。静置2 min,上层提取液 30 mL转入离心管,10000 rpm 离心5 min. 5mL甲醇,5mL水依次活化阳离子交换固相萃取柱后,上样10mL 离心液,流速1mL/min, 分别用3mL水和3mL甲醇洗脱,抽近干后用5%氨水甲醇溶液3mL洗脱。洗脱液50℃氮气吹干,准确加入20%甲醇溶液,涡旋振荡1 min,过0.45 um 滤膜,检测。 色谱柱 Acclaim C8, 5 um 4.6×250 mm, P/N: 059141 柱温 30℃ 流动相 乙腈:水(10mM庚烷磺酸钠, 10mM 柠檬酸)=10:90 流速 1.0 mL/min 进样量 10 uL 检测器 UV: 240 5.结果与讨论 5.1方法线性 1 图1.线性叠加谱图 (其中1-5分别代表从低到高的线性浓度) 表1.线性数据 Peak Name Cal. Type Points Offset (C0) Slope(C1) Curve (C2) Corr.Coeff. % 三聚氰胺 LOff 5 0.0641 0.6617 0.000 99.999 4.2方法检出限、定量限 4.3方法重复性 01 图2.定量限谱图与空白叠加谱图 图3.定量限附近三针标准品叠加谱图 (其中1、2分别代表空白、定量限谱图) 表2.定量限,检出限数据 表3.图3数据 Type amount(ug/mL) Ret.Time (min ) S/N LOQ 0.25 7.727 13.8 LOD 0.1 7.747 7.3 Peak name amount(ug/mL) Ret.Time RSD (%) Area RSD(%) Melamine 0.4 0.328% 2.777% 5.结论 该方法灵敏度高,重现性符合要求,可以应用于饲料中三聚氰胺的检测。 1.引言 苏丹红是是一种人工合成的工业染料,为亲脂性偶氮化合物,食品中常用来做增色剂使用,但由于其有致癌性,且对人体的肝肾器官具有明显的毒性作用,因此中国对苏丹红染料的含量做出了明确限制,我们根据 NY/T 1258-2007进行了饲料中苏丹红染料的检测方法的研究,通过 Thermo Ultimate3000型高效液相色谱仪,能够检出饲料中0.05 mg/kg 的苏丹红,回收率均大于80%,能够满足饲料中苏丹红的检测要求。 2.测试用对照品 分别准确称取苏丹红对照品苏丹红I,苏丹红Ⅱ,苏丹红Ⅲ,苏丹红Ⅳ各100 mg,乙腈分别定容于100mL棕色容量瓶中,再次分别移取5mL溶液转移至50 mL棕色容量瓶中,乙腈定容至满刻度。分别移取0.5 mL, 1.0 mL, 2.5 mL, 5.0mL,10.0mL于50 mL 棕色容量瓶中,乙腈定容至满刻度。苏丹红染料的浓度分别是0.1 ug/mL, 0.2 ug/mL, 0.5 pg/mL, 1.0pg/mL,2.0 pg/mL。 3.样品前处理 精确称取5g饲料样品加入到50mL离心管中,精确加入25mL是取液,振荡器中振荡提取30 min。过滤,取滤液10mL, 氮气吹干,加入2mL乙腈,涡旋混匀30s, 过孔径0.45 um 有机滤膜,检测。 4.色谱条件 色谱柱 P/N: 059149 1.0 mL/min B(%) 进样量 50pL 95 8 VWD:0~7.8 nm 478 nm;7.8 min 以后 100 检测器 0 100 23 520 nm, 95 30 5 95 5.结果与讨论 5.1方法线性 1 图1.线性叠加谱图 (其中1-5分别代表从低到高的线性浓度) 表1.线性数据 PeakName Cal.Type Points Offset(C0) Slope(C1) Corr.Coeff.% 苏丹红1 LOff 5 -0.0012 2.7401 99.9994 苏丹红Ⅱ LOff 5 -0.0013 0.9973 99.9989 苏丹红Ⅲ LOff 5 -0.0074 1.3519 99.9996 苏丹红Ⅳ LOff 5 -0.0101 0.9668 99.9988 5.2方法检出限、定量限 图2.苏丹红1定量限谱图与空白叠加谱图 (其中1、2分别代表定量限、空白谱图) 图3.苏丹红Ⅱ、Ⅲ、IV定量限谱图与空白叠加谱图(其中1、2分别代表定量限、空白谱图) 表2.定量限,检出限数居 LOQ (pg/mL ) S/N LOD (pg/mL) S/N 苏丹红| 0.16 16.6 0.004 3.6 苏丹红Ⅱ 0.48 13.2 0.016 5.7 苏丹红Ⅲ 0.48 14.3 0.016 5.1 苏丹红Ⅳ 0.48 11.2 0.020 3.6 5.3方法精密度 图4.定量限附近三针标准品叠加谱图 表3.精密度考察数据 Peak name amount(ug/mL) Ret.Time RSD (%) Area RSD(%) 苏丹红| 0.048 0.000% 0.478% 苏丹红Ⅱ 0.048 0.085% 1.807% 苏丹红Ⅲ 0.048 0.069% 0.479% 苏丹红Ⅳ 0.048 0.048% 1.514% 5.4方法回收率 1 图5.回收率谱图 (其中1、2分别代表加标样品、样品) 表4.回收率考察数据 加标量(ug/mL ) 加标回收率(%) 苏丹红1 0.5 91.2 苏丹红Ⅱ 0.5 95.1 苏丹红Ⅲ 0.5 83.2 苏丹红Ⅳ 0.5 82.5 5.5结论 该方法灵敏度高,重现性好,可以应用于饲料中苏丹红染料的检测。 赛默飞世尔科技 上海 南京 上海市浦东新区新金桥路27号3,6,7号楼 南京市中央路201号南京国际广场南楼1103室 邮编201206 邮编210000 电话021-68654588*2570 电话021-68654588*2901 生命科学产品和服务业务 上海市长宁区仙霞路99号21-22楼 邮编200051 西安 电话021-61453628/021-61453637 西安市高新区科技路38号林凯国际大厦 1006-08单元 邮编710075 北京 电话029-84500588*3801 北京市东城区北三环东路36号环球贸易 中心C座7层/8层 邮编100013 昆明 电话+86 10 8794 6888 成都成都市临江西路1号锦江国际大厦1406室邮编610041电话 028-65545388*5300沈阳沈阳市沈河区惠工街10号卓越大厦3109室邮编110013电话 024-31096388*3901武汉武汉市东湖高新技术开发区高新大道生物园路生物医药园C8栋5楼邮编430075电话027-59744988*5401 云南省昆明市五华区三市街6号柏联广场写字 楼908单元 邮编650021 电话0871-63118338*7001 广州 广州国际生物岛寰宇三路36、38号合景 星辉广场北塔204-206单元 邮编510000 电话 020-82401600 欲了解更多信息,请扫描二维码关注我们的微信公众账号 赛默飞世尔科技在全国有共21个办事处。本资料中的信息,说明和技术指标如有变更,恕不另行通知。 热线8008105118 赛默飞 赛默飞色谱 电话4006505118 官方微信 口 与质谱中国 www.thermofisher.com The world leader in serving science 本文利用双梯度液相色谱(DGLC)建立了在线二维柱切换 法同时测定饲料中脂溶性维生素 ADE 含量的方法,与常规 方法比较,本法简便、快速,简化了样品前处理过程,提高 样品分析效率。较以往方法,本文做了以下改进:首先采用 loop 环收集一维分离流出物,避免切换过程中由于色谱柱短 暂串联而导致的压力骤然升高;二是连接方式做了调整,一 维先经过 UV 检测后,再根据目标物的保留时间,适时地调 整切换时间,以准确并完整的将目标物整体切割至二维色谱 中进行分离;三是本法可相对改善维生素 D 的检出限,在维 生素 D 测定中采用乙腈 +IPA 作为流动相,UV 背景吸收较高, 而本法采用乙腈 + 甲醇,因此可适当改善 VD 检出限。
确定
















还剩50页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《饲料中维生素ADE检测方案(液相色谱仪)》,该方案主要用于饲料中理化分析检测,参考标准--,《饲料中维生素ADE检测方案(液相色谱仪)》用到的仪器有赛默飞Vanquish Flex液相色谱二元系统
推荐专场
相关方案
更多
该厂商其他方案
更多















