本文将LX50 UHPLC系统与QSight 420三重四极杆质谱仪联用,建立了一种快速灵敏的LC-MS/MS方法对人血清样品中三种天然存在的低浓度(pg/mL(ppt))雌激素进行分析。该方法具有较高的灵敏度,以及良好的线性度和精密度。该方法具有较高的准确度,已使用处理后血清样品对该方法进行了验证。
方案详情

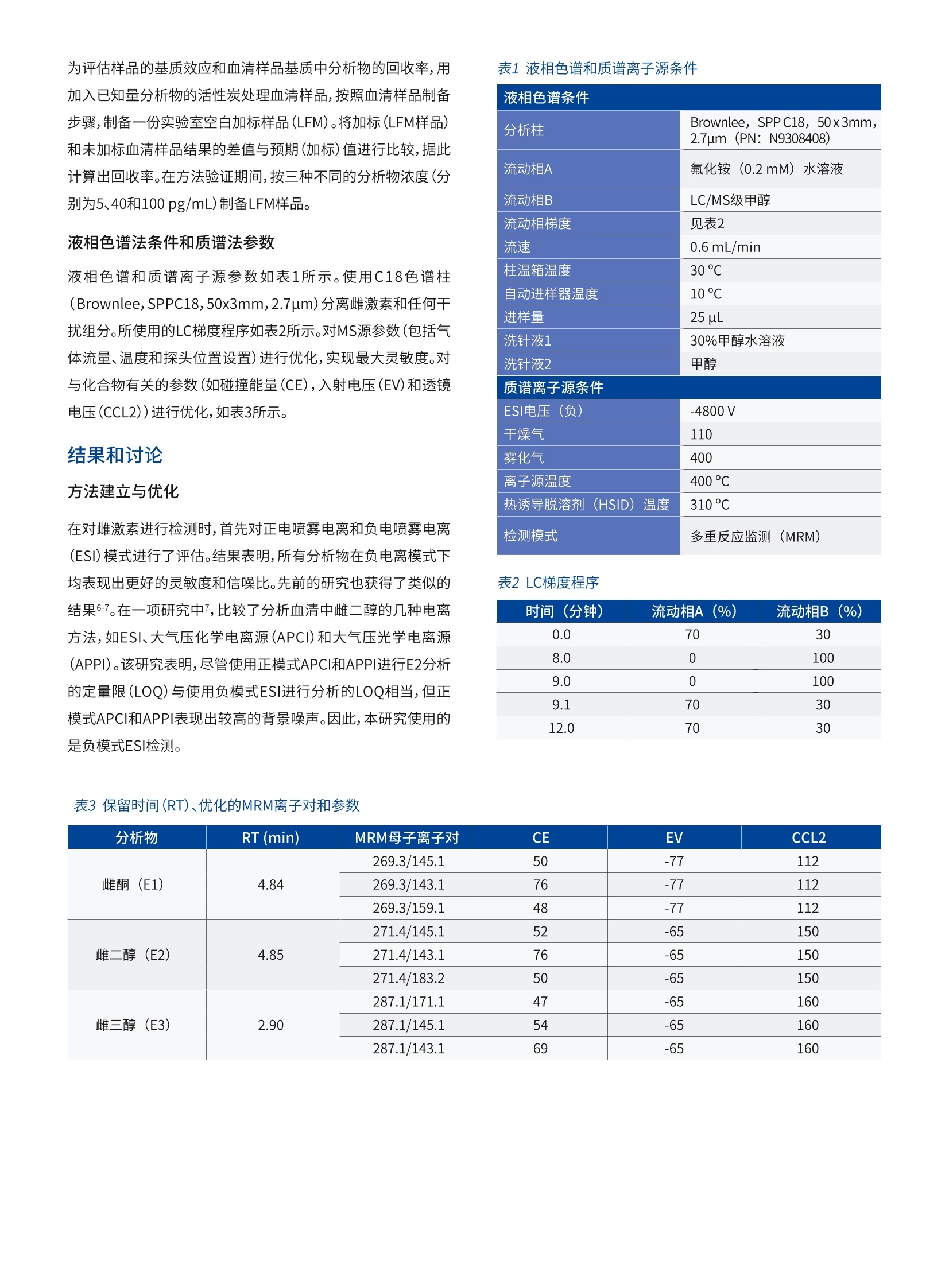
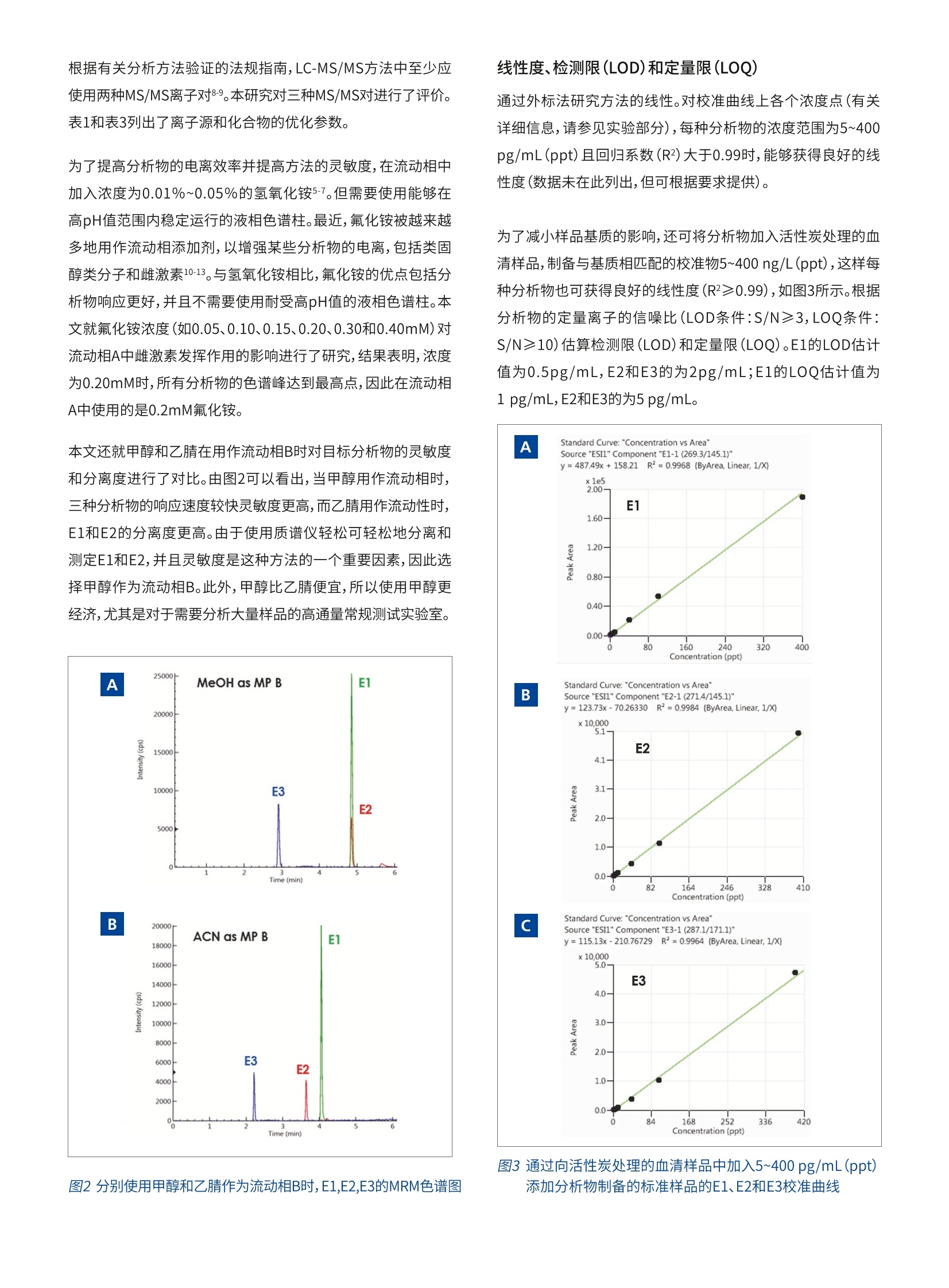
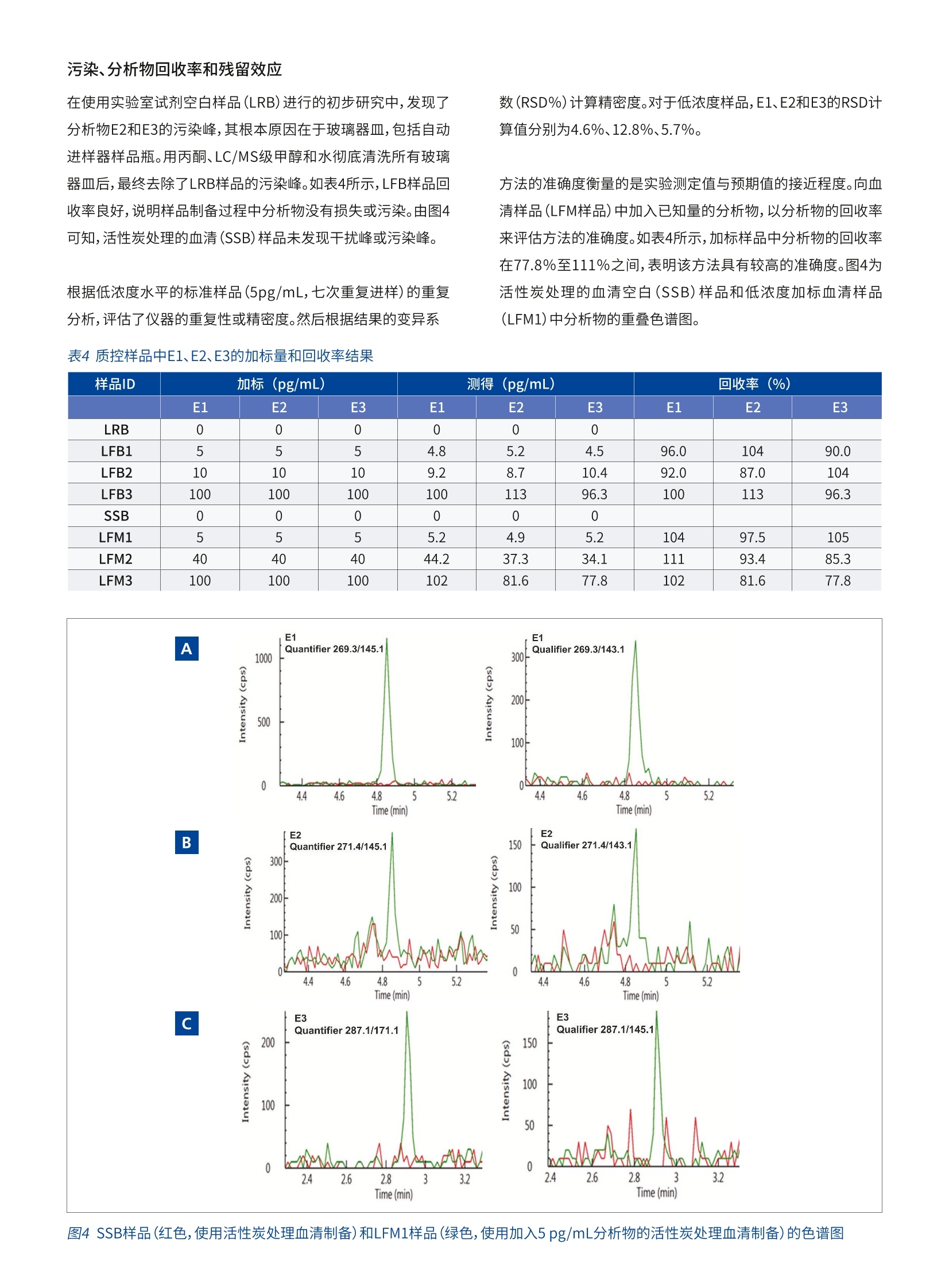
版权所有C2019, PerkinElmer, Inc. 保留所有权利。PerkinElmer 是PerkinElmer, Inc. 的注册商标。其它所有商标均为其各自持有者或所有者的财产。 雌激素是诱发人类乳腺癌的一个重要因素,并且具有临床意义,因此,临床和研究实验室越来越需要一种选择性、灵敏度和准确度都较高的方法来测量低浓度水平(<20pg/mL)的雌激素。自动免疫测定法能够以高样品通量快速完成分析,且制备样品耗费的时间最短,因而是当前使用最为广泛的方法。但这种方法存在一些缺点:分析物浓度较低时,准确度和精密度较差,且容易受到非特异性抗体与雌激素代谢物和其他外源代谢物之间相互作用的干扰。 近来,用于分析血清中雌激素的LC-MS/MS法正日益受到人们重视。由于类固醇极性较低,这类分析物的电离成为质谱分析的一大难题。为了提高分析物的电离效率并提高方法的灵敏度,在样品制备过程中,许多LC-MS/MS法会对分析物进行衍生化2.5。但是,衍生化不仅增加了制备样品所需的时间和成本,也引入了更多干扰。因此,衍生化不适用于常规临床实验室。本研究旨在建立一种灵敏度较高的方法,使用QSight 420LC-MS/MS系统在不进行衍生化的情况下分析血清中的雌激素。 仪器条件 使用PerkinElmer QSight@LX50超高效液相色谱(UHPLC)系统进行色谱分离,然后使用带有电喷雾电离(ESI)源的PerkinElmer QSight@ 420三重四极杆质谱仪在负离子条件下进行检测。所有仪器控制、数据采集和数据处理均使用SimplicityTM3Q软件进行。 方法 标准样品和化学品 雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)、氟化铵(纯度>99.9%)和甲基叔丁基醚(MTBE)标准样品均购自Sigma-Aldrich。LC/MS级甲醇(MeOH)和水购自MilliporeSigma。图1列出了三种雌激素的化学结构。 标准品制备 每种标准品准确称量10mg,分别溶于10mL甲醇中,制备成单独的沐准品储备溶液(1mg/mL)。稀释标准储备溶液,在甲醇中制备混合标准样品储备溶备(每种分析物的含量为10ug/mL)。用50:50的甲醇/水稀释液释释混合的储备溶液,制备几种低浓度(10、100、1,000和10,000pg/mL)的工作标准品溶液。 用适当的稀释剂稀释相应的工作液,制备两组校准标准样品(浓度分别为0、1、2、5、10、40、100和400pg/mL)。用30:70的甲醇/水稀释剂进行稀释,制备一组校准标准样品;用活性炭处理的血清作为稀释剂进行稀释,再制备一组校准标准样品,血清样品制备程序如下所述进行净化和浓缩。 血清样品的制备 用1mL甲基叔丁基醚(MTBE),按照液液萃取步骤萃取400pL血清样品或加标血清样品,然后涡旋混合2分钟。将样品以9,000rpm的转速离心10分钟,然后将上清液(有机相)转移到1.5mL的洁净微量离心管中,用氮气吹干,最后用100pL的30:70甲醇/水稀释剂进行复溶。 质控样品的制备 在收集、制备和分析样品过程中应避免污染样品,这是确保样品分析可靠的关键因素。为了避免检测试剂和玻璃器皿以及样品制备过程可能产生的干扰或污染,制备一份实验室试剂空白样品(LRB)。LRB的浓度应接近零,或至少小于该方法的定量限(LOQ)。否则,必须对污染源进行研究。按照血清样品制备步骤制备LRB样品,用30:70的甲醇/水稀释剂进行稀释后作为样品。 为了研究样品制备过程中可能产生的分析物损失或污染,制备一份实验室空白加标(LFB)样品。按照血清样品制备步骤制备LFB样品,用已加入已知量的分析物溶液的30:70甲醇/水稀希剂进行稀释。在方法验证期间,加入三种不同浓度水平(分别为5、10和100pg/mL)的分析物,制备LFB样品,并就每一相应浓度水平的LFB样品准备三份重复样品。 为研究活性炭处理的血清可能产生的干扰或污染,按照血清样品制备步骤骤备一份活性炭处理血清空白(SSB)。 为评估样品的基质效应和血清样品基质中分析物的回收率,用加入已知量分析物的活性炭处理血清样品,按照血清样品制备步骤,制备一份实验室空白加标样品(LFM)。将加标(LFM样品)和未加标血清样品结果的差值值预期(加标)值进行比较,据此计算出回收率。在方法验证期间,按三种不同的分析物浓度(分别为5、40和100 pg/mL)制备LFM样品。 液相色谱法条件和质谱法参数 液相色谱和质谱离子源参数数表1所示。使用C18色谱柱(Brownlee,SPPC18,50x3mm,2.7um)分离雌激素和任何干扰组分。所使用的LC梯度程序如表2所示。对MS源参数(包括气体流量、温度和探头位置设置)进行优化,实现最大灵敏度。对与化合物有关的参数(如碰撞能量(CE),入射电压(EV)和透镜电压(CCL2))进行优化,如表3所示。 方法建立与优化 在对雌激素进行检测时,首先对正电喷雾电离和负电喷雾电离(ESI)模式进行了评估。结果表明,所有分析物在负电离模式下均表现出更好的灵敏度和信噪比。先前的研究也获得了类似的结果6.7。在一项研究中7,比较了分析血清中雌二醇的几种电离方法,如ESI、大气压化学电离源(APCI)和大气压光学电离源(APPI)。该研究表明,尽管使用正模式APCI和APPI进行E2分析的定量限(LOQ)与使用负模式ESI进行分析的LOQ相当,但正模式APCI和APPI表现出较高的背景噪声。因此,本研究使用的是负模式ESI检测。 表3保留时间(RT)、优化的MRM离子对和参数 分析物 RT (min) MRM母子离子对 CE EV CCL2 雌酮(E1) 4.84 269.3/145.1 50 -77 112 269.3/143.1 76 -77 112 269.3/159.1 48 -77 112 雌二醇(E2) 4.85 271.4/145.1 52 -65 150 271.4/143.1 76 -65 150 271.4/183.2 50 -65 150 雌三醇(E3) 2.90 287.1/171.1 47 -65 160 287.1/145.1 54 -65 160 287.1/143.1 69 -65 160 表1液相色谱和质谱离子源条件 液相色谱条件 分析柱 Brownlee, SPPC18, 50x3mm,2.7um (PN: N9308408) 流动相A 氟化铵 (0.2mM)水溶液 流动相B LC/MS级甲醇 流动相梯度 见表2 流速 0.6 mL/min 柱温箱温度 30°℃ 自动进样器温度 10°C 进样量 25 pL 洗针液1 30%甲醇水溶液 洗针液2 甲醇 质谱离子源条件 ESI电压(负) -4800V 干燥气 110 雾化气 400 离子源温度 400°C 热诱导脱溶剂(HSID)温度 310°℃ 检测模式 多重反反监测 (MRM) 表2LC梯度程序 时间(分钟) 流动相A(%) 流动相B(%) 0.0 70 30 8.0 0 100 9.0 0 100 9.1 70 30 12.0 70 30 根据有关分析方法验证的法规指南,LC-MS/MS方法中至少应使用两种MS/MS离子对8.9。本研究对三种MS/MS对进行了评价。表1和表3列出了离子源和化合物的优化参数。 为了提高分析物的电离效率并提高方法的灵敏度,在流动相中加入浓度为0.01%~0.05%的氢氧化铵5-7。但需要使用能够在高pH值范围内稳定运行的液相色谱柱。最近,氟化铵被越来越多地用作流动相添加剂,以增强某些分析物的电离,包括类固醇类分子和雌激素10-13。与氢氧化铵相比,氟化铵的优点包括分析物响应更好,并且不需要使用耐受高pH值的液相色谱柱。本文就氟化铵浓度(如0.05、0.10、0.15、0.20、0.30和0.40mM)对流动相A中雌激素发挥作用的影响进行了研究,结果表明,浓度为0.20mM时,所有分析物的色谱峰达到最高点,因此在流动相A中使用的是0.2mM氟化铵。 本文还就甲醇和乙腈在用作流动相B时对目标分析物的灵敏度和分离度进行了对比。由图2可以看出,当甲醇用作流动相时,三种分析物的响应速度较快灵敏度更高,而乙乙用作流动性时,E1和E2的分离度更高。由于使用质谱仪轻松可轻松地分离和测定E1和E2,并且灵敏度是这种方法的一个重要因素,因此选择甲醇作为流动相B。此外,甲醇比乙腈便宜,所以使用甲醇更经济,尤其是对于需要分析大量样品的高通量常规测试实验室。 图2分别使用甲醇和乙腈作为流动相B时,E1,E2,E3的MRM色谱图 线性度、检测限(LOD)和定量限(LOQ) 通过外标法研究方法的线性。对校准曲线上各个浓度点(有关详细信息,请参见实验部分),每种分析物的浓度范围为5~400pg/mL (ppt)且回归系数(R2)大于0.99时,能够获得良好的线性度(数据未在此列出,但可根据要求提供)。 为了减小样品基质的影响,还可将分析物加入活性炭处理的血清样品,制备与基质相匹配的校准物5~400 ng/L (ppt),这样每种分析物也可获得良好的线性度(R2≥0.99),如图3所示。根据分析物的定量离子的信噪比(LOD条件:S/N≥3,LOQ条件:S/N≥10)估算检测限(LOD)和定量限(LOQ)。E1的LOD估计值为0.5pg/mL,E2和E3的为2pg/mL;E1的LOQ估计值为1 pg/mL,E2和E3的为5 pg/mL。 A B C 图3通过向活性炭处理的血清样品中加入5~400 pg/mL (ppt) 添加分析物制备的标准样品的E1、E2和E3校准曲线 污染、分析物回收率和残留效应 在使用实验室试剂空白样品(LRB)进行的初步研究中,发现了分析物E2和E3的污染峰,其根本原因在于玻璃器皿,包括自动进样器样品瓶。用丙酮、LC/MS级甲醇和水彻底清洗所有玻璃器皿后,最终去除了LRB样品的污染峰。如表4所示,LFB样品回收率良好,说明样品制备过程中分析物没有损失或污染。由图4可知,活性炭处理的血清(SSB)样品未发现干扰峰或污染峰。 根据低浓度水平的标准样品(5pg/mL,七次重复进样)的重复分析,评估了仪器的重复性或精密度。然后根据结果的变异系 数(RSD%)计算精密度。对于低浓度样品,E1、E2和E3的RSD计算值分别为4.6%、12.8%、5.7%。 方法的准确度衡量的是实验测定值与预期值的接近程度。向血清样品(LFM样品)中加入已知量的分析物,以分析物的回收率来评估方法的准确度。如表4所示,加标样品中分析物的回收率在77.8%至111%之间,表明该方法具有较高的准确度。图4为活性炭处理的血清空白(SSB)样品和低浓度加标血清样品(LFM1)中分析物的重叠色谱图。 样品ID 加标(pg/mL) 测得((pg/mL) 回收率(%) E1 E2 E3 E1 E2 E3 E1 E2 E3 LRB 0 0 0 0 0 0 LFB1 5 5 5 4.8 5.2 4.5 96.0 104 90.0 LFB2 10 10 10 9.2 8.7 10.4 92.0 87.0 104 LFB3 100 100 100 100 113 96.3 100 113 96.3 SSB 0 0 0 0 0 0 LFM1 5 5 5 5.2 4.9 5.2 104 97.5 105 LFM2 40 40 40 44.2 37.3 34.1 111 93.4 85.3 LFM3 100 100 100 102 81.6 77.8 102 81.6 77.8 图4 SSB样品(红色,使用活性炭处理血清制备)和LFM1样品(绿色,使用加入5 pg/mL分析物的活性炭处理血清制备)的色谱图 在研究残留效应时,首先注入最高浓度的校准标准样品(在这种情况下为400pg/mL),然后再注入空白血清(SSB)。结果表明,残留效应最小,或至少小于该方法的LOQ。 样品分析和样品基质效应 样品基质效应是LC-MS/MS方法建立和应用过程中面临的一大难题,复杂的生物样品基质更是如此。在本研究中,观察到明显的血清样品基质效应,主要是离子抑制。为消除基质效应,强烈建议在使用该方法进行分析的过程中加入稳定同位素标记的内标。此外,可能需要采用固相支持液液萃取(SLE)和固相萃取(SPE)等方法对样品进行纯化,以去除干扰组分11,14-15,和/或可能需要使用较长的液相色谱柱将样品的分析物峰与干扰组分的分离开来。 将LX50 UHPLC系统与QSight 420三重四极杆质谱仪联用,建立了一种快速灵敏的LC-MS/MS方法对人血清样品中三种天然存在的低浓度(pg/mL(ppt))雌激素进行分析。该方法具有较高的灵敏度,以及良好的线性度和精密度。该方法具有较高的准确度,已使用处理后血清样品对该方法进行了验证。 ( 1. C. J .Gruber, W. Tschuggue, C. Sc h neeberger, J. C . Huber.Production and actions of e strogens. N Engl JM e d. 2002;346:340.http://www.hormonebalance.org/images/documents/ Gruber%2002%20Production%20&%20Actions%20 Estrogen%20NEJM.pdf ) ( 2.N M.R. Anari, R. B a khtiar, B. Zhu, S. H uskey, R . B. Franklin, D. C .Evans. D erivatization of ethinylestradiol with dansyl chloride toenhance electrospray ionization: application in t race analysis ofethinylestradiol i n rhesu s monkey plasma. A nal Ch e m. 2002,74,4136. ) ( 3. 3P. K eski-Rahkonen, R. Desai, M . Jimenez, D. T. Ha r wood, D. J.Handelsman. Measurement of estradiol in human serum b y LC-MS/MS using a n o v el estrogenspecific derivatization reagent. Anal Chem. 2015,87, 7180. ) ( 4 . W. Z. Shou, X. Jiang, W. Naidong. Development a n d validationof a high-sensitivity liquid chromatography/tandem massspectrometry ( LC/MS/MS) m e thod wi t h ch e mical de r ivatization f or the determination o f ethinyl estradiol i n human plasma.Biomed Chromatogr. 2004, 1 8 ,414. ) 珀金埃尔默企业管理(上海)有限公司地址:上海张江高科技园区张衡路1670号邮编:201203电话:021-60645888传真:021-60645999 5. S. J. Soldin, O. P. Soldin. A mini-review on Steroid HormoneAnalysis by Tandem Mass Spectrometry, Clin. Chem. 2009,55,6,1061 6. TT.. Gou, J. Gu, O. P. Soldin, R. J. Singh, S. J.Soldin. Rapidmeasurement of estrogens and their metabolites in humanserum by liquid chromatography-tandem mass spectrometrywithout derivatization. Clin Biochem. 2008,41,736. 7. PP.Keski-Rahkonen, K. Huhtinen, R. Desai, D. T. Harwood, D. J.Handelsman, M. Poutanen, S. Auriola. LC-MS analysis ofestradiol in human serum and endometrial tissue: comparisonof electrospray ionization, atmospheric pressure chemicalionization and atmospheric pressure photoionization. J MassSpectrom. 2013,48,1050. 8.USA. FDA, Bioanalytical Method Validation Guidance forIndustry, 2018. https://www.fda.gov/downloads/drugs/quidances/ucm070107.Pdf. 9.EEuropean Commission, SANCO. 2015. Guidance documenton analytical quality control and method validation proceduresfor pesticides residues analysis in food and feed,SANTE/11945/2015 https://ec.europa.eu/food/sites/food/files/plant/docs/pesticides_mrl_guidelines_wrkdoc_11945.pdf 10. W. Wang, R. B. Cole. Enhanced collision-induceddecomposition efficiency and unraveling of fragmentationpathways for anionic adducts of brevetoxins in negative ionelectrospray mass spectrometry. Anal Chem. 2009,81, 8826. ( 11. T T . . Fiers , B . Casetta , B. Bernaert , E. Vandersypt , M. Debock, J.M. K aufman. D e velopment of a hi g hly sensitive m ethod f o rthe quantification o f estrone a nd estradiol i n serum by l i quidchromatography tandem mass spectrometry withoutderivatization. J . Chromatogr. B . Analyt. Technol. B iomed. L i fe Sci. 2012,893-894,57. ) ( 12. K .Takkis, R. Aro, L-T. K orgvee, H. Varendi, J. L a ss, K . H e rodes,K. Kipper. Signal Enhancement in th e HPLC-ESI-MS/MSanalysis of spironolactone a nd its metabolites using HFIP and NH4F as eluent additives. Anal. Bioanal. Chem. 2017. .409,3145. ) ( 13. J .J. Pesek, M. T. Matyska. Ammonium fluoride as a mobilephase a dditive in aqueous normal phase chromatography. J.Chromatogr. A. 2015, 1401, 6 9. ) ( 14 . L. J. Owen, F. C. Wu, B . G . K e evil. A rapid direct assay for theroutine measurement of oestradiol a n d oestrone by LC- M S/ MS. Ann. Clin. Biochem. 2014, 51,360. ) 15. J. Stone. A practical guide to sample preparation for liquidchromatography-tandem mass spectrometry in clinical researchand toxicology. SPECTROSCOPYEUROPE, 2018, 30 (6) 15.www.spectroscopyeurope.com ( 要获取全球办事处的完整列表,请访问http:/ / www.perkinelmer.com.cn/AboutUs/ContactUs/ContactUs ) 本文将LX50 UHPLC系统与QSight 420三重四极杆质谱仪联用,建立了一种快速灵敏的LC-MS/MS方法对人血清样品中三种天然存在的低浓度(pg/mL(ppt))雌激素进行分析。该方法具有较高的灵敏度,以及良好的线性度和精密度。该方法具有较高的准确度,已使用处理后血清样品对该方法进行了验证。
确定



还剩4页未读,是否继续阅读?
珀金埃尔默企业管理(上海)有限公司为您提供《血清中雌激素检测方案(液质联用仪)》,该方案主要用于全血/血清/血浆中生化检验检测,参考标准--,《血清中雌激素检测方案(液质联用仪)》用到的仪器有珀金埃尔默三重四极杆液质联用仪QSight 400
推荐专场
相关方案
更多
该厂商其他方案
更多














