方案详情
文
生物药物(如单克隆抗体 (mAb))的使用正在快速增加。生物药物为生物来源,因此即使经过多个纯化步骤,最终产品中仍然可能残留一些低浓度宿主细胞蛋白质 (HCP)。由于它们可能影响产品安全性和功效,因此根据法规要求必须对药品中的 HCP 浓度进行监测和控制。传统上,酶联免疫吸附测定法 (ELISA) 是定量分析蛋白质治疗药物中 HCP 的标准方法。然而,ELISA 的特异性和覆盖率不足以鉴定并定量分析各种 HCP。因此,LC/MS 技术成为 HCP 分析的选择之一。在 HCP 的 LC/MS 分析过程中,主要挑战在于低丰度 HCP 肽段与高丰度药品肽段的共洗脱。这要求 LC/MS 系统具有更出色的肽段分离度以及宽动态范围。
方案详情

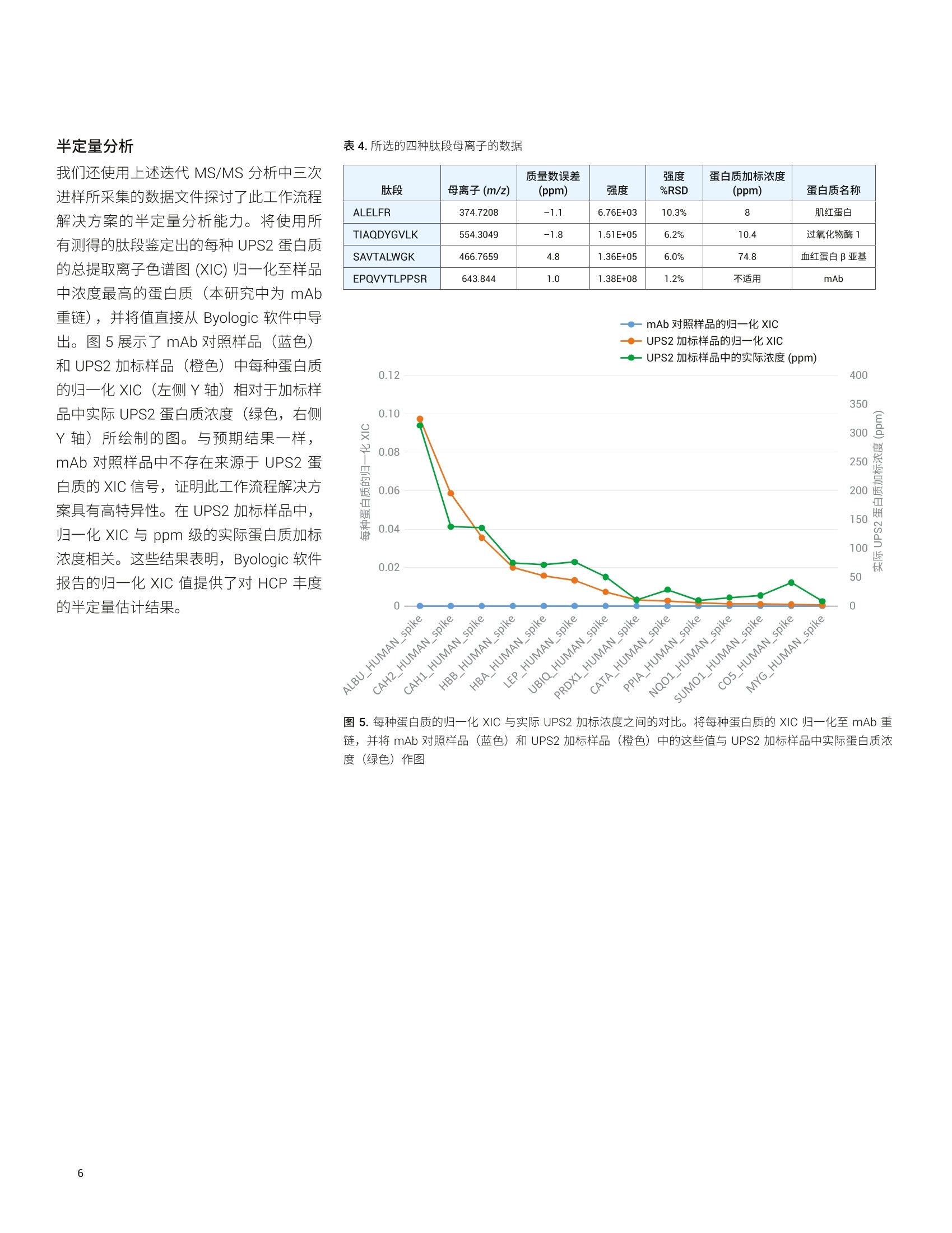
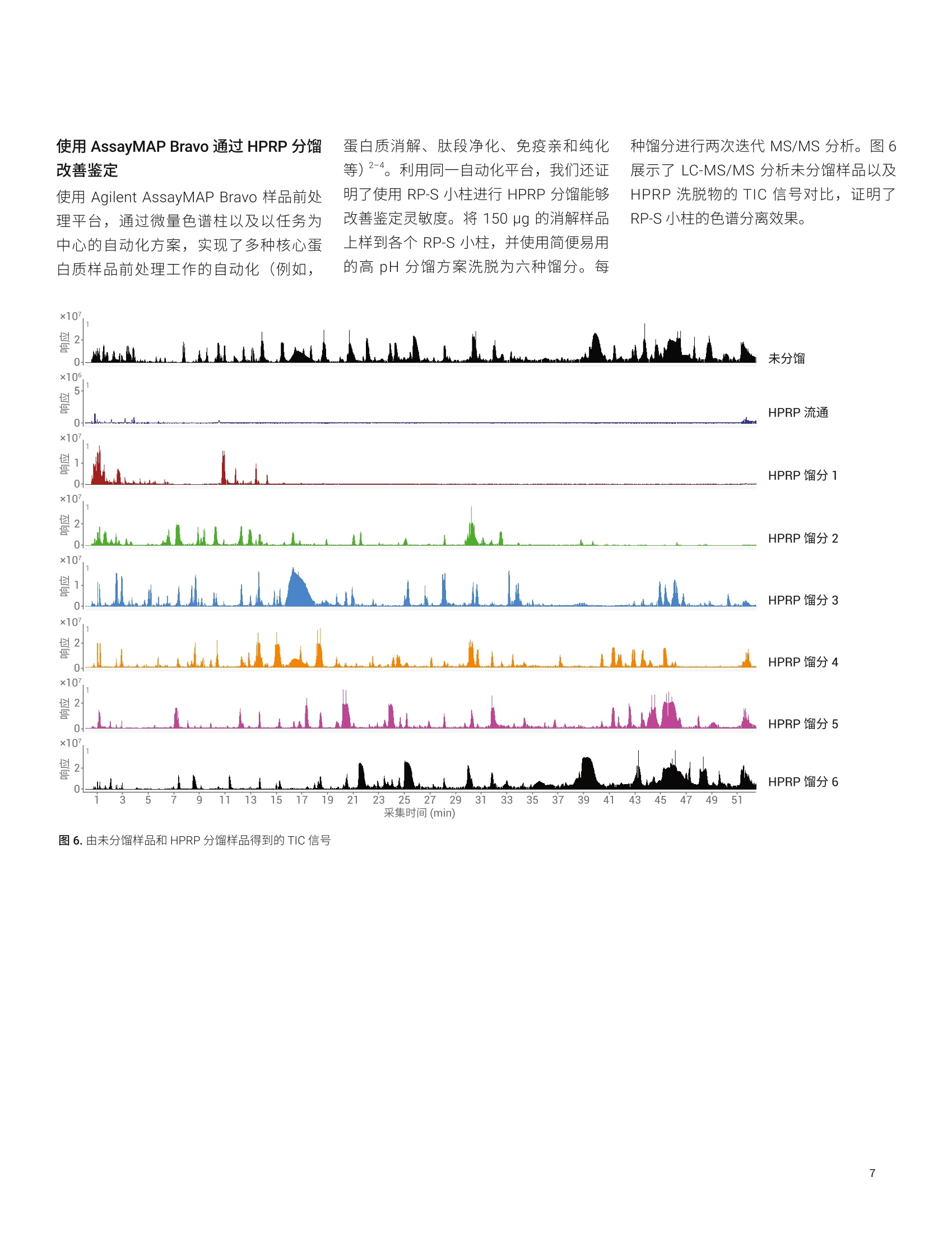
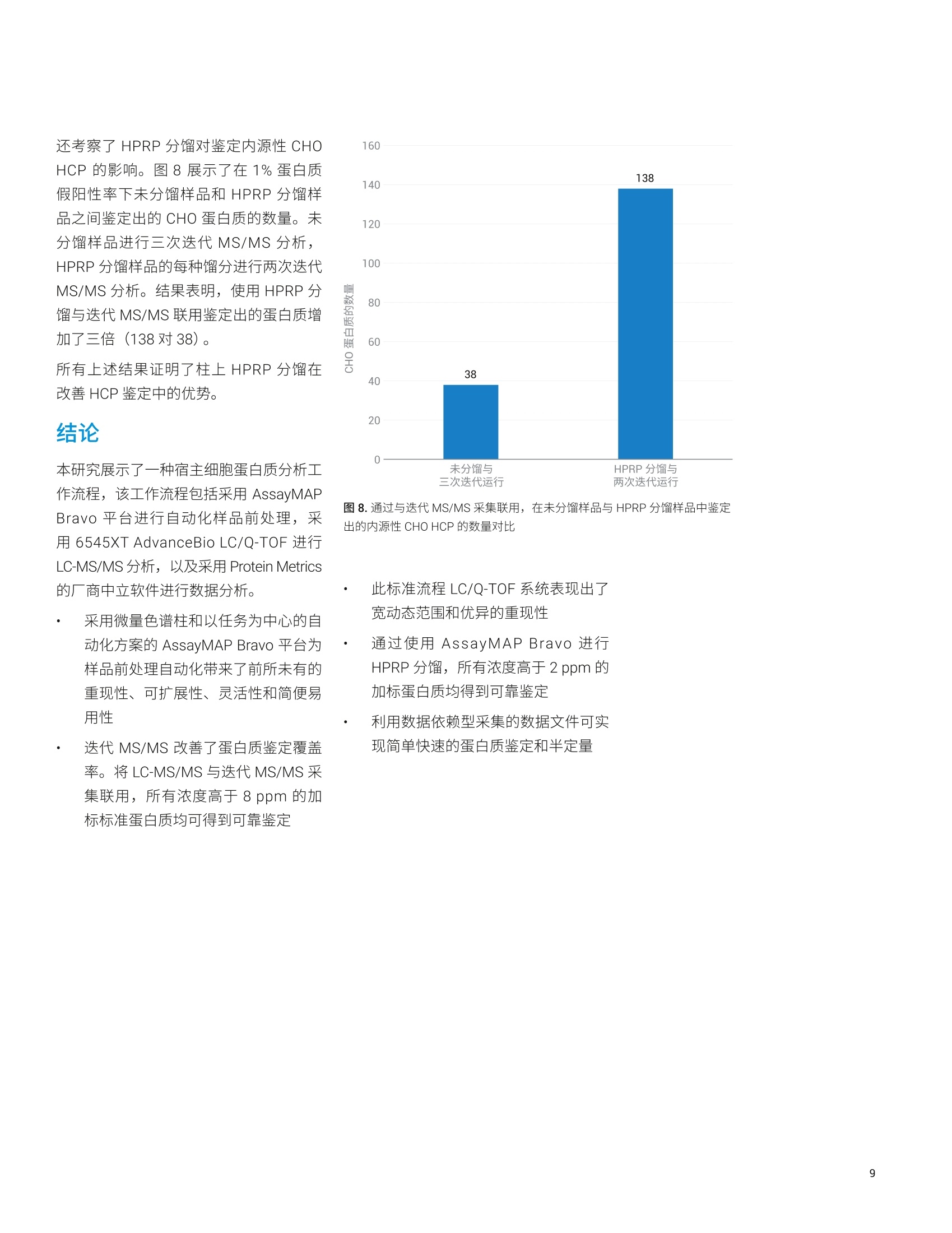
应用简报 Agilent生物治疗药物和Trusted Answers生物仿制药 使用 Agilent AssayMAP Bravo 和6545XT AdvanceBio LC/Q-TOF分析宿主细胞蛋白质 Linfeng Wu、Shuai Wu 和 Te-Wei Chu 安捷伦科技有限公司, 美国加利福尼亚州圣克拉拉市 生物药物(如单克隆抗体(mAb)) 的使用正在快速增加。生物药物为生物来源,因此即使经过多个纯化步骤,最终产品中仍然可能残留一些低浓度宿主细胞蛋白质(HCP)。由于它们可能影响产品安全性和功效,因此根据法规要求必须对药品中的 HCP 浓度进行监测和控制。传统上,酶联免疫吸附测定法(ELISA) 是定量分析蛋白质治疗药物中 HCP 的标准方法。然而, ELISA 的特异性和覆盖率不足以鉴定并定量分析各种 HCP。因此, LC/MS 技术成为 HCP 分析的选择之一。在 HCP 的LC/MS分析过程中,主要挑战在于低丰度 HCP 肽段与高丰度药品肽段的共洗脱。这要求 LC/MS系统具有更出色的肽段分离度以及宽动态范围。 本研究展示了一种 HCP分析工作流程,该工作流程包括采用 Agilent AssayMAPBravo 平台进行自动化样品前处理,采用 Agilent 6545XT AdvanceBio LC/Q-TOF进行LC-MS/MS分析,以及采用 ProteinMetrics 的厂商中立的软件进行数据分析(图1)。利用 AssayMAP Bravo 平台进行自动化样品前处理,包括蛋白质消解、脱盐、柱上高 pH 反相(HPRP)分馏。对经过或未经 HPRP分馏的消解样品进行 LC-MS/MS分析,以考察平台性能。结果表明,采用新型采集方法(即迭代 MS/MS) 能够善善蛋白质鉴定。此标准流程 LC/Q-TOF 系统表现出宽动态范围、优异的重现性和半定量能力。结果还表明,通过将柱上样品分馏与迭代MS/MS 联用,所有高于2 ppm 的 HCP均得到可靠鉴定。 图 1. 安捷伦 HCP 工作流程概述 实验部分 材料 人 IgG1 mAb (来自合作伙伴的一种研发产品)由中国仓鼠卵巢 (CHO)细胞产生,并经过 Protein A 纯化。蛋白质组学动态范围标样组(UPS2) 购自 Sigma-Aldrich。 仪器 ( Agilent AssayMAP Bravo 系统 ) ( Agilent 1290 Infinity Ⅱl液相色谱系 统,包括: ) ( · Agilent 1290 Infinity lI高速泵 G7120A ) ( · Agilent 1290 Infinity llMultisampler G7167B ) ( ·Agilent 1290 Infinity柱温箱 G7116B ) ( Agilent 6545XT AdvanceBioLC/Q-TOF ) ( 安捷伦双喷射流电喷雾离子源 ) 样品前处理 按 1:1000 的比例将 UPS2 加标至 mAb中。同时制备第二个样品(包含mAb,未加标UPS2)并作为阴性对照进行平行分析,!以确保鉴定出的UPS2 蛋白质不是来源于对照样品中存在的序列同源物。使用 AssayMAP Bravo 系统对两个样品进行还原、烷基化、胰蛋白酶消解和脱盐。然后将样品等分,-一份等分样品使用 Agilent 6545XT AdvanceBio LC/Q-TOF系统直接进行 LC-MS/MS分析,另一份等分样品在 AssayMAP Bravo 系统上使用HPRP方法进行分馏,然后进行LC-MS/MS 分析。 HPRP 分留 使用 AssayMAP Bravo上预配置的蛋白质样品前处理工作台 Fractionation 应用程序,在安捷伦反相(RP-S)小柱上将消解后的样品分馏得到六种馏分(图2)。首先用70%乙腈(ACN)、0.1%三氟乙酸 (TFA)灌注 RP-S柱,并用0.1%TFA平衡。然后,将150pg消解后的样品上样到每根小柱上,并使用 10 mmol/L 甲酸铵缓冲液((pH 10, 其中ACN 含量按10%、15%、20%、25%、30%和90%逐渐增加)洗脱得到六种馏分。 LC/MS分析 在 Agilent AdvanceBio Peptide Plus 色谱柱(2.1×150 mm, 2.7 um, 部件号675950-902) 1上采用60 min 液相色谱方法进行液相色谱分离,流速为 0.4 mL/min(表1)。每个样品在6545XT AdvanceBioLC/Q-TOF系统上使用传统的自动MS/MS 方法或迭代 MS/MS方法(如表2中所示)进行分析。 液相色谱参数 分析柱 AdvanceBio Peptide Plus, 2.1×150 mm, 2.7 pm(部件号675950-902) 流动相A H0, 0.1%甲酸 流动相B 90% ACN, 0.1%甲酸 流速 0.4 mL/min 梯度 1.0分钟时 B 为 3% 50.0分钟时B为21%53.0分钟时B为90%55.0分钟时B为 90%55.1分钟时B为3% 停止时间 60 分钟 柱温 60°C 表2.质谱参数 质谱参数 干燥气温度 290°℃ 干燥气流速 13 L/min 雾化器 35 psi 鞘气温度 275°C 鞘气流速 12 L/min 分离峰宽 窄(约1.3m/z) 运行内的动态排除 0.2分钟后发布1幅色谱图 MS质量数范围 250-1700m/z MS 采集速率 10 幅谱图/秒 MS/MS 质量数范围 50-1700m/z MS/MS采集速率 3幅谱图/秒 采集模式 如所示的迭代MS/MS 或自动MS/MS 迭代MS/MS 质量数误差范围:15 ppm保留时间排除范围:-0.2分钟至+0.4分钟 图2.采用默认设置的 Fractionation 应用程序用户界面 *The number of plates in a stack equals the Number of Fractions (0 to 6). 数据处理 使用来自 Protein Metrics Inc. 的软件对原始数据文件进行处理。采用 Preview 对一个原始数据文件进行搜索以生成 Byonic参数。所有原始数据文件均在 UniprotCHO K1 蛋白质数据库中进行搜索,该数据库使用 Byonic 与 mAb 和 UPS2 蛋白质序列相关联。搜索参数包括半特异性胰蛋白酶消解、最多两个未裂解肽段、20 ppm 母离子质量数容差、30 ppm碎片离子质量数容差、固定半胱氨酸 (C) 烷基化、可变甲硫氨酸(M)氧化、天冬酰胺(N)和谷氨酰胺(Q)脱酰胺基化以及Preview 分析所表明的其他可变修饰。将Byonic 结果文件导入 Byologic,对较小的蛋白质序列组进行进一步详细分析,并报告结果。在MS2搜索中,采用最低得分150对肽段进行筛选。 迭代 MS/MS 与自动 MS/MS的比较 Agilent 6545XT AdvanceBio Q-TOF 系统提供了一种全新的数据采集方法,即迭代 MS/MS, 该方法改善了对低丰度母离子的鉴定(图3)。使用这种方法,对蛋白质消解样品进行多次 LC-MS/MS 分析。第一次分析为传统的自动MS/MS 运行,使用数据依赖型采集。在随后的迭代LC-MS/MS分析中,采用自定义的质量数误差范围和保留时间排除范围自动循环排除此前选择进行 MS/MS碎裂的母离子。因此,通过 LC-MS/MS 自动审查了更多 母离子。 我们首先使用不包括任何离线分馏的LC/Q-TOF 系统对迭代 MS/MS 与自动MS/MS 进行比较,即利用两种方法对加标 UPS2 的纯化后的 mAb 进行分析。UPS2 是由 Sigma-Aldrich 生产的蛋白质组学动态范围标样,该标样是包含48种人类蛋白质的复杂蛋白质混合物,这些蛋白质有六种浓度水平,处于 500 amol 至 50 pmol 范围内。在消解之前按 1:1000的比例(w/w) 将 UPS2 加入 mAb 样品中,使蛋白质浓度在 0.0004 ppm 至313 ppm范围内,其中19种蛋白质的浓度高于1 ppm。此加标样品模拟治疗蛋白质中存在的 HCP 的宽动态范围。我们还可以使用此加标样品评估本研究所考察的不同方法的灵敏度和动态范围。 表3展示了通过各种采集方法鉴定出的mAb 和 UPS2 蛋白质的独特肽段序列的总数。将具有相同氨基酸序列但经过不同修饰的肽段视为一种独特肽段序列。每次进样的载样量为32 pg, 每种采集方法进行三次进样。总体而言,对于每个蛋白质,迭代 MS/MS 可在宽动态范围内鉴定出更多的独特肽段序列。所有浓度高于8 ppm 的加标蛋白质均得到可靠鉴定。本文展示的所有其他结果均通过迭代MS/MS 得到。 色谱重现性和动态范围 我们还使用上述迭代 MS/MS分析中三次进样所采集的数据集对色谱重现性和动态范围进行了评估。图4展示了由三次迭代 LC-MS/MS 运行得到的基峰色谱图(BPC) 的叠加谱图以及四种共洗脱母离子的提取离子色谱图。由于色谱柱上的载样量较高,因此 mAb 肽段产生的许多信号使质谱检测器饱和,在BPC中表现为平台段。有关这四种共洗脱肽段母离子的详细信息汇总于表4中。观察到共洗脱肽 表3.采用迭代 MS/MS 或自动 MS/MS 采集方法鉴定出的独特肽段序列的数量 蛋白质标识 分子量(kDa) 蛋白质加标浓度(ppm) 每种方法进样三次 迭代 MS/MS 自动 MS/MS mAb_HC 49.7 不适用 419 382 mAb_LC 24.0 不适用 201 186 ALBU_HUMAN_spike 66.4 313.0 46 43 CAH2_HUMAN_spike 29.1 137.3 19 15 CAH1_HUMAN_spike 28.7 135.6 9 9 LEP__HUMAN_spike 16.2 76.2 4 1 HBB_HUMAN_spike 15.9 74.8 12 10 HBA_HUMAN_spike 15.1 71.3 7 6 UBIQ_HUMAN_spike 10.6 50.0 6 6 CO5_HUMAN_spike 8.6 40.4 4 4 CATA_HUMAN_spike 59.6 28.1 2 2 SUMO1_HUMAN_spike 38.8 18.3 3 1 NQ01_HUMAN_spike 30.7 14.5 0 PRDX1_HUMAN_spike 22.0 10.4 3 0 PPIA_HUMAN_spike 20.2 9.5 4 4 MYG_HUMAN_spike 17.1 8.0 2 1 8ppm), RSD 值为 10.3%。这些数据表明6545XT AdvanceBio LC/Q-TOF 系统具有优异的谱图内动态范围和重现性。 半定量分析 我们还使用上述迭代 MS/MS 分析中三次进样所采集的数据文件探讨了此工作流程解决方案的半定量分析能力。将使用所有测得的肽段鉴定出的每种 UPS2 蛋白质的总提取离子色谱图 (XIC)归一化至样品中浓度最高的蛋白质(本研究中为 mAb重链),并将值直接从 Byologic 软件中导出。图5展示了 mAb 对照样品(蓝色)和 UPS2加标品品(橙色)中每种蛋白质的归一化XIC (左侧丫轴)相对于加标样品中实际UPS2 蛋白质浓度(绿色,右侧Y轴)所绘制的图。与预期结果一样,mAb 对照样品中不存在来源于 UPS2 蛋白质的XIC信号,证明此工作流程解决方案具有高特异性。在 UPS2加标样品中,归一化 XIC 与 ppm 级的实际蛋白质加标浓度相关。这些结果表明, Byologic 软件报告的归一化 XIC 值提供了对 HCP 丰度的半定量估计结果。 表4.所选的四种肽段母离子的数据 肽段 母离子(m/z) 质量数误差(ppm) 强度 强度%RSD 蛋白质加标浓度 (ppm) 蛋白质名称 ALELFR 374.7208 -1.1 6.76E+03 10.3% 8 肌红蛋白 TIAQDYGVLK 554.3049 -1.8 1.51E+05 6.2% 10.4 过氧化物酶1 SAVTALWGK 466.7659 4.8 1.36E+05 6.0% 74.8 血红蛋白β亚基 EPQVYTLPPSR 643.844 1.0 1.38E+08 1.2% 不适用 mAb 一1mAb对照样品的归一化 XIC UPS2 加标样品的归一化XIC 图5.每种蛋白质的归一化 XIC 与实际 UPS2 加标浓度之间的对比。将每种蛋白质的 XIC 归一化至 mAb 重链,并将 mAb 对照样品(蓝色)和 UPS2加标样品(橙色)中的这些值与 UPS2 加标样品中实际蛋白质质度(绿色)作图 使用 AssayMAP Bravo 通过 HPRP分留改善鉴定 使用 Agilent AssayMAP Bravo 样品前处理平台,通过微量色谱柱以及以任务为中心的自动化方案,实现了多种核心蛋白质样品前处理工作的自动化(例如, 蛋白质消解、肽段净化、免疫亲和纯化等)2-4。利用同一自动化平台,我们还证明了使用RP-S小柱进行 HPRP分馏能够改善鉴定灵敏度。将150 pg 的消解样品上样到各个 RP-S小柱,并使用简便易用的高pH分馏方案洗脱为六种馏分。每 种馏分进行两次迭代 MS/MS 分析。图6展示了 LC-MS/MS 分析未分馏样品以及HPRP 洗脱物的 TIC 信号对比,证明了RP-S小柱的色谱分离效果。 手动检查来自低丰度加标蛋白质的肽段的MS/MS 谱图,确保获得高谱图质量并且不存在来源于内源性CHO HCP 的同源物污染。所有浓度高于2 ppm 的加标蛋白质均得到可靠鉴定,证明使用 HPRP分馏能够提高鉴定灵敏度(表5,与表3比较)。图7展示了来自人 KCRM 蛋白质(加标浓度为2ppm) 的肽段 IEEIFK 的MS/MS 谱图。 表 5.将 AssayMAP HPRP 分馏与每种馏分运行两次迭代 MS/MS 联用来鉴定 UPS2加标蛋白质中的独特肽段序列 蛋白质标识 分子量 (kDa) 蛋白质加标浓度 (ppm) 独特肽段序列数量 ALBU_HUMAN_spike 66.4 313.0 79 CAH2_HUMAN_spike 29.1 137.3 32 CAH1_HUMAN_spike 28.7 135.6 15 LEP_HUMAN_spike 16.2 76.2 6 HBB_HUMAN_spike 15.9 74.8 22 HBA_HUMAN_spike 15.1 71.3 14 UBIQ_HUMAN_spike 10.6 50.0 9 CO5_HUMAN_spike 8.6 40.4 6 CATA_HUMAN_spike 59.6 28.1 14 SUM01_HUMAN_spike 38.8 18.3 11 NQ01_HUMAN_spike 30.7 14.5 8 PRDX1_HUMAN_spike 22.0 10.4 9 PPIA_HUMAN_spike 20.2 9.5 11 MYG_HUMAN_spike 17.1 8.0 2 CYB5_HUMAN_spike 16.0 7.6 2 EGR_HUMAN_spike 6.4 3.0 1 SYHC_HUMAN_spike 58.2 2.7 5 KCRM_HUMAN_spike 43.1 2.0 3 图7.来源于加标浓度为 2 ppm 的 KCRM 蛋白质的肽段 IEEIFK 的 MS/MS谱图 还考察了 HPRP 分馏对鉴定内源性 CHOHCP的影响。图8展示了在1%蛋白质假阳性率下未分馏样品和 HPRP 分留样品之间鉴定出的 CHO 蛋白质的数量。未分馏样品进行三次迭代 MS/MS分析,HPRP分馏样品的每种馏分进行两次迭代MS/MS分析。结果表明,使用HPRP分馏与迭代 MS/MS联用鉴定出的蛋白质增加了三倍(138对38)。 所有上述结果证明了柱上 HPRP分馏在改善 HCP 鉴定中的优势。 ( 本研究展示了一种宿主细胞蛋白质分析工 作流程,该工作流程包括采用 AssayMAPBravo 平台进行自动化样品前处理,采用 6 545XT AdvanceBio LC/Q-TO F 进行 LC-MS/MS分析,以及 采 用 Protein Metrics 的厂商中立软件进行数据分析。 ) ( 采用微量色谱柱和以任务为中心的自 动化方案的 AssayMAP Bravo 平台为 样品前处理自动化带来了前所未有的 重现性、可扩展性、灵活性和简便易 用性 ) ( 迭代 MS/MS 改善了蛋白质鉴定覆盖率。将 LC-MS/MS 与迭代 MS/MS 采 集联用,所有浓度高于8 ppm 的加 标标准蛋白质均可得到可靠鉴定 ) 图8.通过与迭代 MS/MS 采集联用,在未分馏样品与 HPRP分馏样品中鉴定出的内源性 CHO HCP 的数量对比 ( 此标准流程 LC/Q-TOF 系统表现出了 宽动态范围和优异的重现性 ) ( 通过使用 AssayMAP Bravo 进行HPRP分馏,所有浓度高于2 ppm的 加标蛋白质均得到可靠鉴定 ) ( 利用数据依赖型采集的数据文件可实现简单快速的蛋白质鉴定和半定量 ) ICH Q6B Specifications: TestProcedures and Acceptance Criteriafor Biotechnological/Biological Products 2. 自动化液质联用样品前处理:通过 Agilent AssayMAP Bravo 平台实现高 通量溶液内酶解和多肽纯化,安捷伦 科技公司,出版号 5991-2957CHCN 3. Automation of Sample Preparation for Accurate and Scalable Quantification and Characterization of Biotherapeutic Proteins Using theAgilent AssayMAP Bravo Platform(利用 Agilent AssayMAP Bravo 平台,通过自动化样品前处理实现生物治疗蛋白质准确而可扩展的定量和表 征分析),安捷伦科技公司,出版号 5991-4872EN 4. Agilent AssayMAP Bravo Technology Enables Reproducible Automated Phosphopeptide Enrichment from Complex Mixtures Using HighCapacity Fe(III)-NTA Cartridges(采用高容量 Fe(III)-NTA小柱通过 Agilent AssayMAP Bravo技术实现 复杂混合物中可重现的自动化磷酸 肽富集),安捷伦科技公司,出版号 5991-6073EN www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn 生物药物(如单克隆抗体 (mAb))的使用正在快速增加。生物药物为生物来源,因此即使经过多个纯化步骤,最终产品中仍然可能残留一些低浓度宿主细胞蛋白质 (HCP)。由于它们可能影响产品安全性和功效,因此根据法规要求必须对药品中的 HCP 浓度进行监测和控制。传统上,酶联免疫吸附测定法 (ELISA) 是定量分析蛋白质治疗药物中 HCP 的标准方法。然而,ELISA 的特异性和覆盖率不足以鉴定并定量分析各种 HCP。因此,LC/MS 技术成为 HCP 分析的选择之一。在 HCP 的 LC/MS 分析过程中,主要挑战在于低丰度 HCP 肽段与高丰度药品肽段的共洗脱。这要求 LC/MS 系统具有更出色的肽段分离度以及宽动态范围。
确定





还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《生物药物中宿主细胞蛋白质(HCP)检测方案(移液工作站)》,该方案主要用于生物药品药物研发中含量测定检测,参考标准--,《生物药物中宿主细胞蛋白质(HCP)检测方案(移液工作站)》用到的仪器有Agilent AssayMAP Bravo 蛋白质样品前处理平台、Agilent 1290 Infinity II 液相色谱系统、Agilent 6545XT Q-TOF 液质联用系统、OpenLAB 软件
推荐专场
相关方案
更多
该厂商其他方案
更多