方案详情
文
升高温度可诱导双链核酸分离为单链。在一定温度下,碱基对之间的氢键发生断裂。热熔实验利用了腺嘌呤-胸腺嘧啶 (A=T) 与鸟嘌呤-胞嘧啶 (GΞC) 核苷酸之间氢键数的差异。由于 GΞC 核苷酸含有三个氢键,解离所需热能大于 A=T 对所需的热能。这表示含有更多 GΞC 对的 DNA 要在更高的温度下才能熔解。熔解温度 (Tm) 可指示样品中的碱基组成(GΞC 与 A=T 的比例)。制造商和研究人员常将 Tm 用作 QC 校验指标。
使用紫外-可见分光光度法测定熔点,利用的是单链核酸在 260 nm 处的吸光度高于双链核酸的原理。图 1 显示了使用小干扰 RNA (siRNA) 样品的示例,与 25 °C 相比,85 °C 下 260 nm 处的吸光度明显更高。
方案详情

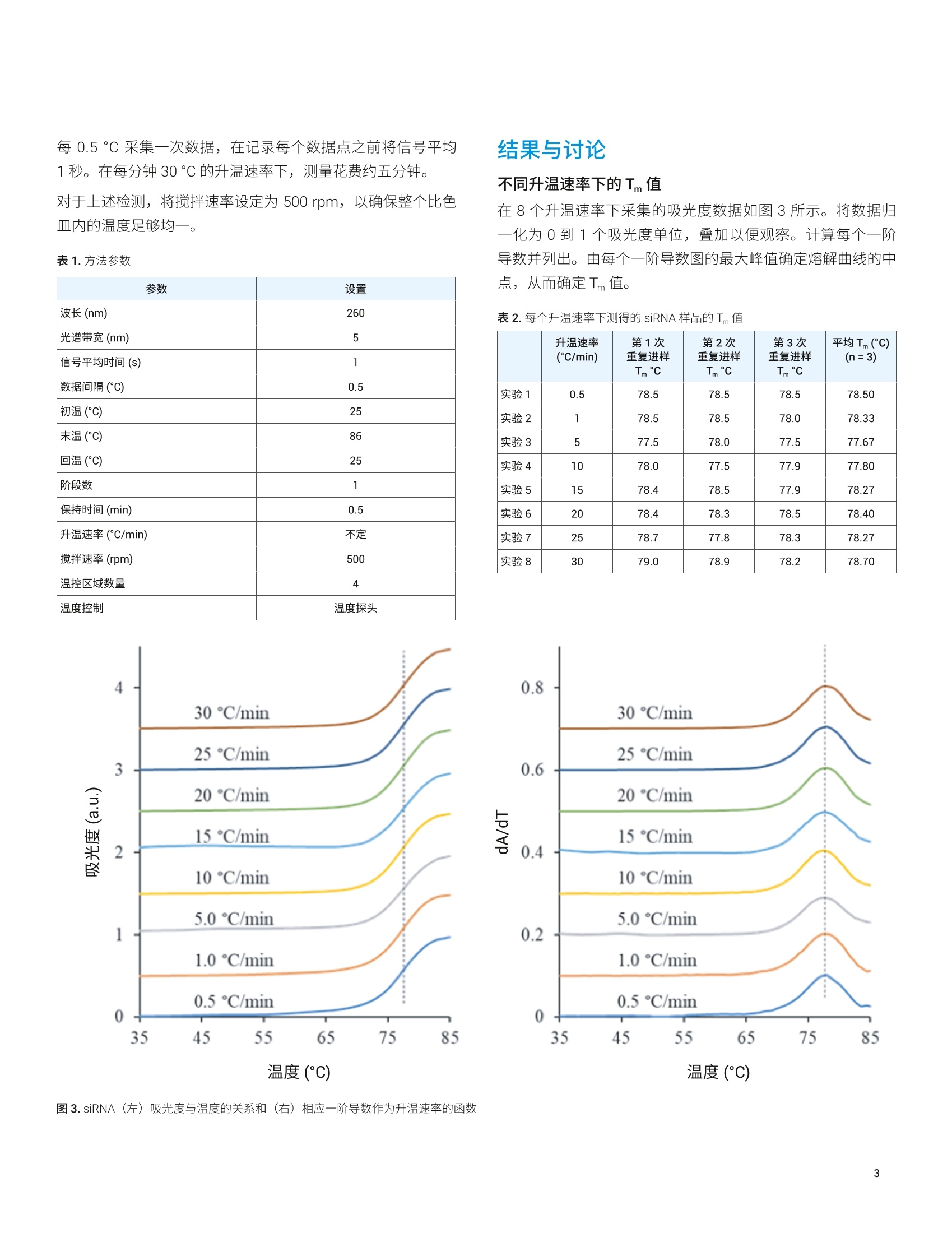
为热熔实验提供更快的升温速率 使用 Cary 3500紫外-分见分光光度计在任意升温速率下获得相同结果 作者 Kevin Grant 和 Matt Quinn安捷伦科技公司,澳大利亚 升高温度可诱导双链核酸分离为单链。在一定温度下,碱基对之间的氢氢发生断裂。热熔实验利用了腺嘌呤-胸腺嘧啶 (A=T) 与鸟嘌呤-胞嘧啶 (G三C)核苷酸之间氢键数的差异。由于 G三C核苷酸含有三个氢键,解离所需热能大于 A=T对所需的热能。这表示含有更多 G三C 对的 DNA 要在更高的温度下才能熔解。熔解温度(Tm)可指示样品中的碱基组成 (G三C 与 A=T的比例)。制造商和研究人员常将T 用作QC校验指标。 使用紫外-可见分光光度法测定熔点,利用的是单链核酸在260 nm 处的吸光度高于双链核酸的原理。图1显示了使用小干扰 RNA (siRNA) 样品的示例,与25℃相比,85℃下260 nm 处的吸光度明显更高。 图1. siRNA 样品在25℃(红色)和85℃(黑色)下的波长扫描 通常通过测定 260 nm 处的吸光度来进行热熔实验。然后在受控 pH 和离子强度条件下逐渐升高样品温度。通常以每分钟0.5℃的速率升温(1、2、3)。需要非常慢的升温速率才能确保准确且可重现的数据。然而,缓慢的升温速率也意味着实验需要很长时间。例如,以每分钟0.5C的速率将温度从20℃升至95°℃需要2.5小时。实验室通常需要重复这些测量以确保可重现的结果,因此完整的热熔实验可能十分耗时。 有很多方法可以缩短热熔测量所需时间。例如,一些仪器能够将实验分成几个阶段,每个阶段使用不同的升温速率。可以在开始和结束阶段使用快速升温速率,在样品变性的温度范围内使用较慢的升温速率。 分光光度仪器的最新进展大大缩短了热熔测量所需的时间,温度精度比以往更高。 Agilent Cary 3500 多区控温紫外-可见分光光度计使用集成的比色皿内温度探头,可在实验过程中准确控制溶液温度。多池支架内置于仪器中,使用无水风冷的帕尔帖系统,在0-110℃范围内控制样品温度。 本研究使用 Cary 3500 多区控温紫外-可见分光光度计评估升温速率对 siRNA 样品熔解温度(Tm)计算值的影响。 样品 siRNA 样品由安捷伦核酸解决方案事业部提供。使用含100 mmol/L NaCl、0.1 nmol/L EDTA 和 10 mmol/L 磷酸钠的缓冲溶液配制~0.3 mg/mL 的 siRNA 溶液,调节至 pH7.0。 使用标准3.5mL 体积、10 mm 光程的石英比色皿。使用纯磷酸盐缓冲液作为参比溶液。 仪器和方法 所有测量均采用 Cary 3500 多区控温紫外-可见分光光度计。方法参数如表1所示。 研究期间改变的唯一参数是升温速率。共使用了八个升温速率:0.5、1、5、10、15、20、25和30℃/min。 所有测量均使用至少三个平行样品在相同条件下同步进行测量。将每个样品比色皿与参比样配对放置在八位多池支架中。将比色皿内温度探头插入每个样品比色皿中(图2),该探头可用于控制实验温度。 图2.比色皿内温度探头,用于在测量期间控制实验温度 每0.5℃采集一次数据,在记录每个数据点之前将信号平均1秒。在每分钟30℃的升温速率下,测量花费约五分钟。对于上述检测,将搅拌速率设定为 500 rpm, 以确保整个比色皿内的温度足够均一。 不同升温速率下的T值 表1.方法参数 在8个升温速率下采集的吸光度数据如图3所示。将数据归一化为0到1个吸光度单位,叠加以便观察。计算每个一阶导数并列出。由每个一阶导数图的最大峰值确定熔解曲线的中点,从而确定T,值。 参数 设置 波长(nm) 260 光谱带宽(nm) 5 信号平均时间(s) 1 数据间隔(℃) 0.5 初温(℃) 25 末温(℃) 86 回温(℃) 25 阶段数 1 保持时间 (min) 0.5 升温速率(C/min) 不定 搅拌速率 (rpm) 500 温控区域数量 4 温度控制 温度探头 表2.每个升温速率下测得的 siRNA样品的Tm值 升温速率(C/min) 第1次重复进样 Tm ℃ 第2次重复进样 Tm ℃ 第3次重复进样 Tm°c 平均Tm(℃)(n=3) 实验1 0.5 78.5 78.5 78.5 78.50 实验2 1 78.5 78.5 78.0 78.33 实验3 5 77.5 78.0 77.5 77.67 实验4 10 78.0 77.5 77.9 77.80 实验5 15 78.4 78.5 77.9 78.27 实验6 20 78.4 78.3 78.5 78.40 实验7 25 78.7 77.8 78.3 78.27 实验8 30 79.0 78.9 78.2 78.70 温度(℃) 图 3. siRNA (左)吸光度与温度的关系和(右)相应一阶导数作为升温速率的函数 如图3和表2所示,对于实验中使用的八个升温速率, siRNA样品的测量T值误差均在±1℃之内。 采用 Cary 3500 多区控温紫外-可见分光光度计以八个不同的升温速率测量同一个 siRNA 样品的熔点。各个升温速率下测得的熔点误差均在±1°℃范围内,表示实验室可以使用比0.5 °℃/min 的常规方案更快的升温速率。使用更快的升温速率可以在不影响结果的前提下大大缩短实验时间。本研究表明,使用 Cary 3500可以在约5分钟内测定之前需要2.5小时才能完成的实验。至少同步进行三次重复测定同样能够大大节省分析时间。 使用较快的升温速率可扩展到其他紫外-可见吸光度随温度变化的测量,为进行控温实验的实验室提供了显著的分析效率优势。能够同步测量所有八个比色皿位置,进一步提升了致力于研究液体样品对温度变化响应的实验室的分析效率。 ( 参考文献 ) ( 1 . P.R. Chetana, Ramakrishna Rao, Mithun Roy, Ashis K. P atra,Inorganica Chimica Acta, 362, 2009, pp 4692-4698 ) ( 2. Ramakrishna Ra o , Ashis K. P a tra, P.R. C hetana, Polyhedron, 27,2008,pp1343-1352 ) ( 3. Tina M. Davis, Lori McFail-Isom , Elaine Keane,and LorenDean Williams, Biochemistry, 1998, 37, pp 6975-6978 ) 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价: www.agilent.com/chem/erfq-cn www.agilent.com/chem/cary3500uv-vis 本文中的信息、说明和指标如有变更,恕不另行通知。 ( 2018年11月1日,中国出版 ) 升高温度可诱导双链核酸分离为单链。在一定温度下,碱基对之间的氢键发生断裂。热熔实验利用了腺嘌呤-胸腺嘧啶 (A=T) 与鸟嘌呤-胞嘧啶 (GΞC) 核苷酸之间氢键数的差异。由于 GΞC 核苷酸含有三个氢键,解离所需热能大于 A=T 对所需的热能。这表示含有更多 GΞC 对的 DNA 要在更高的温度下才能熔解。熔解温度 (Tm) 可指示样品中的碱基组成(GΞC 与 A=T 的比例)。制造商和研究人员常将 Tm 用作 QC 校验指标。使用紫外-可见分光光度法测定熔点,利用的是单链核酸在 260 nm 处的吸光度高于双链核酸的原理。图 1 显示了使用小干扰 RNA (siRNA) 样品的示例,与 25 °C 相比,85 °C 下 260 nm 处的吸光度明显更高。
确定



还剩2页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《siRNA 样品中溶解温度检测方案(紫外分光光度)》,该方案主要用于其他中溶解温度检测,参考标准--,《siRNA 样品中溶解温度检测方案(紫外分光光度)》用到的仪器有Agilent Cary 3500 紫外可见分光光度计
推荐专场
相关方案
更多
该厂商其他方案
更多