
方案详情
文
结合毛细管液相色谱分离技术,Agilent 8800 串联四极杆 ICP-MS 在 MS/MS 质量 转移模式下可痕量测定磷酸肽中的磷与含硫多肽中的硫。使用 LC-ICP-MS 可获得前所未有的含硫和含磷物质的最低绝对检测限(分别为 11 fmol 和 6.6 fmol)。 硫的同位素比值测定结果与其理论值高度吻合,从而证明干扰得以有效消除。 所观测到的硫和磷的峰形和信噪比表现优异。测定结果表明串联四极杆capLCICP-MS 技术在使用非特殊标样测定含硫和含磷多肽的高灵敏度和同时绝对定量分析方面有巨大潜力。
方案详情

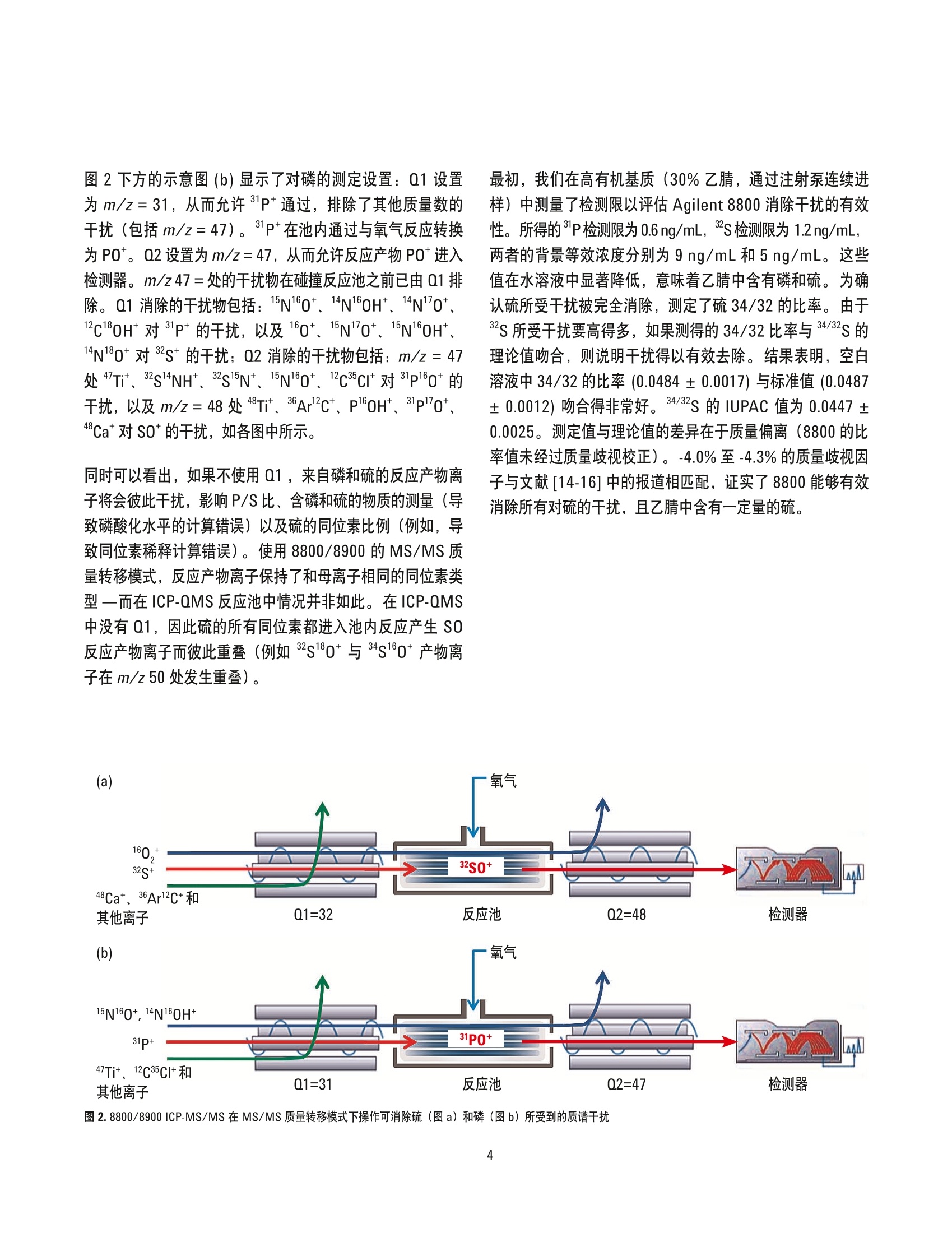
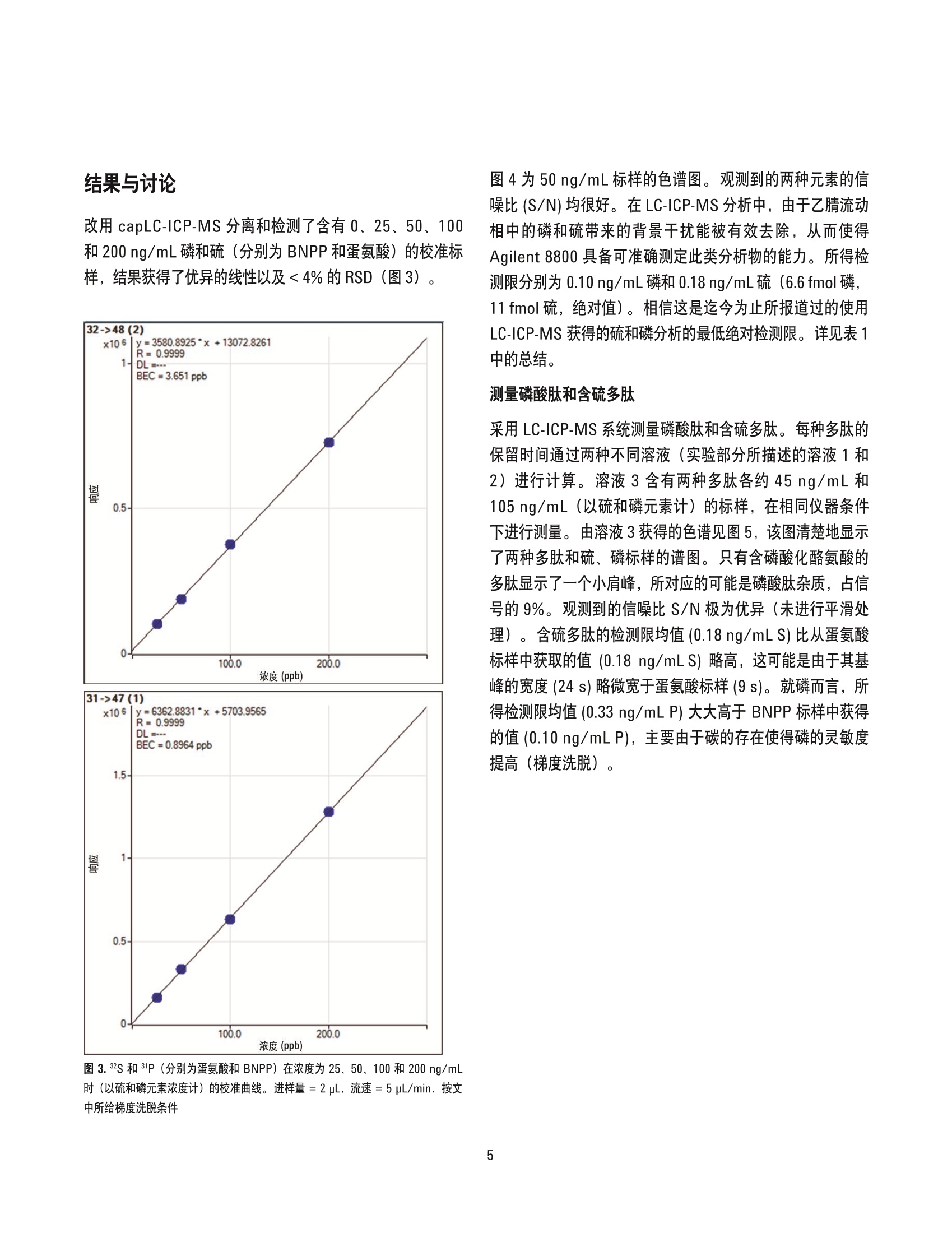
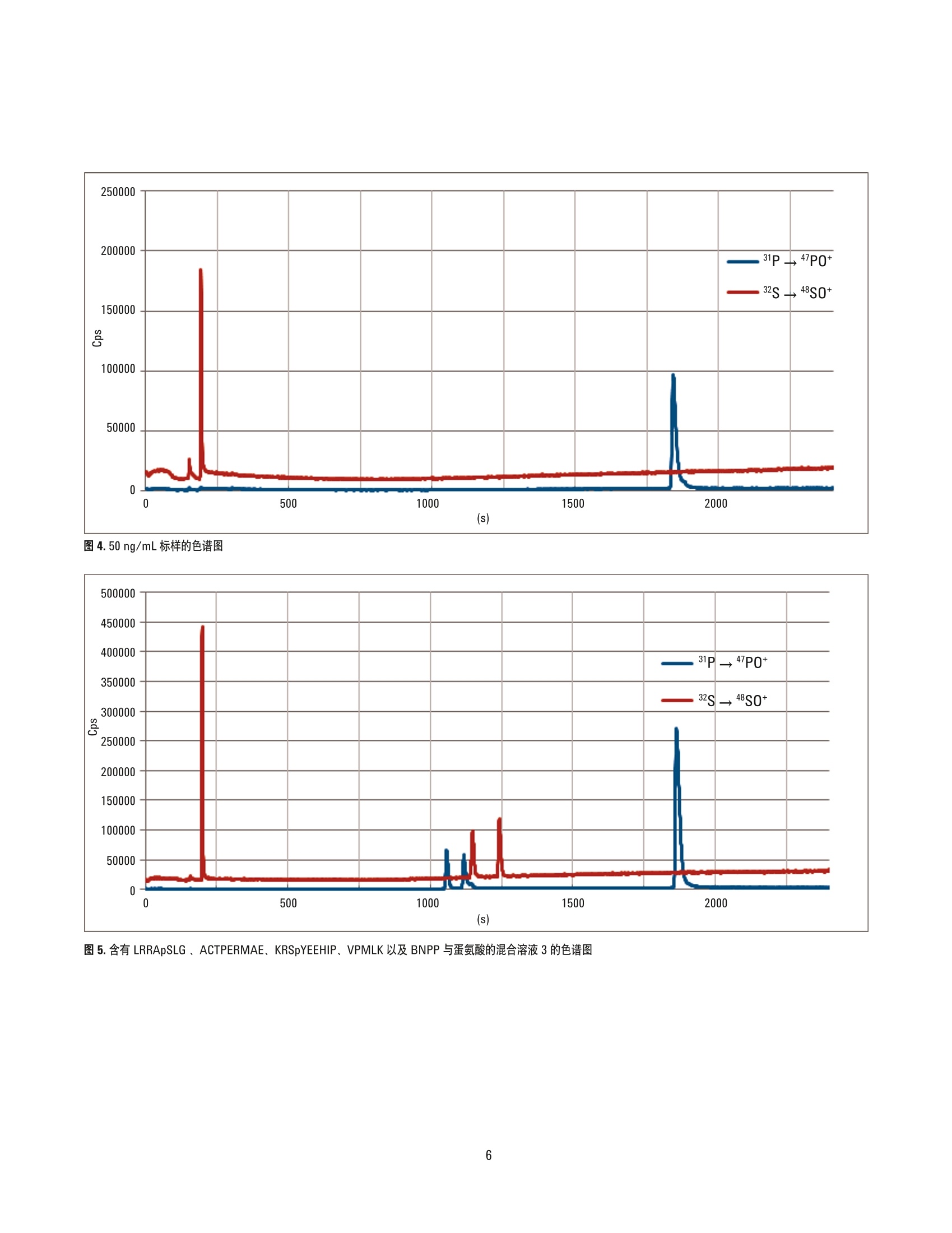
作者 Silvia Diez FernandezNaoki Sugiyama、Jorge Ruiz Encinar 和Alfredo SanzMedel' 奥维耶多大学物理与分析化学学院 Julian Claveria 8, 33006 Oviedo, Spain ’安捷伦科技公司,日本东京 采用 Agilent 8800/8900 串联四极杆ICP-MS 通过 capLC-ICP-MS同时测定多肽和磷酸肽 应用简报蛋白组学 摘要 结合毛细管液相色谱分离技术, Agilent 8800 串联四极杆ICP-MS 在 MS/MS质量转移模式下可痕量测定磷酸肽中的磷与含硫多肽中的多。使用 LC-ICP-MS 可获得前所未有的含硫和含磷物质的最低绝对检测限(分别为11 fmol 和 6.6 fmol)。硫的同位素比值测定结果与其理论值高度吻合,从而证明干扰得以有效消除。所观测到的硫和磷的峰形和信噪比表现优异。测定结果表明串联四极杆 capLC-ICP-MS 技术在使用非特殊标样测定含硫和含磷多太的高灵敏度和同时绝对定量分析方面有巨大潜力。 LC-MS/MS用于定量分析制药/生物制药和临床研究中的目标蛋白质。此方法常常使用同位素标记的合成蛋白质和多肽作为内标来定量分析相应的目标化合物。与之相反,LC-ICP-MS 通过测定目标化合物中含有的杂原子硫和磷对蛋白质和多肽进行非特异性定量分析。通过这种方式可以使用含有杂原子的不同化合物,并将单个含杂原子的非蛋白质化合物作为通用标样对其进行定量。不幸的是,硫和磷的检测限因其高电离能和传统四极杆 ICP-MS(ICP-QMS)的多原子干扰而大打折扣一即使使用了碰撞/反应池(CRC)。虽然扇形磁场高分辨 ICP-MS (HR-ICP-MS) 也被用于该类应用,但迄今为止仍没有任何 ICP-MS仪器能够达到已报道的ESI-MS/MS仪器使用同位素标记合成多肽时所具有的检测限(特别是对于硫)。表1列出了关于LC-ICP-MS 对于硫和磷检测限的已发表数据,包括所用的 ICP-MS技术术分离技术。在这项工作中,我们采用了 Agilent8800串联四极杆 ICP-MS (也简称为ICP-MS/MS) 通过对硫和磷杂原子进行绝对定量分析来测定蛋白质和多肽。 较之传统的仪器或 ICP-QMS, Agilent 8800/8900 在八极杆反应池 (ORS) 和四极杆质量过滤器(Q2)前方配备了额外的主四极杆质量过滤器(Q1)。在该串联质谱结构中,Q1作为单位质量过滤器仅允许目标分析物质量数的离子进入反应池,排除了所有其他离子。因为等离子体和基质中的离子被Q1 排除,确保了即使在复杂高基基样品中, ORS 中的反应过程也能得到精确控制从而实现准确测量,并且灵敏度也得到了极大的增强。色谱分离过程通过与8800 ICP-MS/MS联用的安捷伦 cap-LC 系统完成。 实验 试剂和材料 超纯水(Millipore,日本东京), HPLC和分析试剂级乙腈以及甲酸(和光纯药工业株式会社,日本大阪)。 ICP-MS标准品 (SPEX CertiPrep, Inc., 美国新泽西州梅塔钦)、对硝基苯酚磷酸二酯 (BNPP,纯度99%)和蛋氨酸(纯度≥99% 82) (Sigma Aldrich, 德国施泰因海姆)。磷酸肽标准品的氨基酸序列为 LRRApSLG 和KRSpYEEHIP, 含硫多肽标样为 ACTPERMAE 和VPMLK。所有多肽购自AnaSpec (美国加州费利蒙),纯度都≥95%。 磷 硫 仪器 分离技术 检测限(化合物) 参考文献 分离技术 检测限(化合物) 参考文献 ICP-QMS碰撞池(氦气) capLCLC 110 fmol0.97 pmol63 fmol19 fmol 1232 capLC CE ICP-QMS碰撞池(氙气) nanoLCCE 1.5 pmol2.6 pmol 6 7 ICP-QMSDRC (氧气) LC 2.2pmol 4 microLCmicroLCLC 2.7 pmol3.1 pmol2.3 pmol 8 94 HR-ICP-MS capLCcapLC 100 fmol50 fmol 510 microLCcapLCcapLC 9 pmol11 pmol 10 pmol 111213 ICP-MS/MS capLC 6.6 fmol 本文 capLC 11 fmol 本文 含硫和磷标样的制备 使用 BNPP 和蛋氨酸在1%流动液相B基质(液相色谱梯度的起始条件)中制备0、25、50、100和 200 ng/mL (以硫、磷元素浓度计)的含硫和磷的校准标样。 磷酸肽溶液的制备 分别配制三份溶液(100ng/mL,以磷元素浓度计)以确定每个多肽的保留时间和纯度。溶液1包含LRRApSLG和ACTPERMAE, 而溶液2包含 KRSpYEEHIP 和VPMLK。两种溶液中均包含大约 100 ng/mL BNPP 和蛋氨酸。将溶液1和2按重量1:1混合配制成溶液3。 仪器 capLC 系统 采用 Agilent Zorbax SB C18, 5 pm, 150 x 0.3 mm 反相毛细管色谱柱的 Agilent 1200 系列。流动相A和B分别包含水和乙腈。两种流动相都含有0.1%甲酸和10 ng/mL锗(作为ICP-MS内标使用)。进样量为1-2uL。液相色谱流速为5pL/min,液相色谱梯度淋洗条件如下:0-3分钟:1%B, 等度; 3-35分钟:1%-60%B,线性梯度。 Cap LC-ICP-MS 接口 使用安捷伦 capLC 接口 (Agilent G3680A 毛细柱液相色谱接口套件,图1)将 capLC 色谱柱连接到 ICP-MS, 此capLC 接口结构为一个小的石英雾化室内包含一个消耗型的雾化器。 ICP-MS 使用 Agilent 8800 串联四极杆ICP-MS, 以 80 mL/min 的流速从雾化气通道通入氧气(气:氧比例为 8:2)到雾化器气体中。池气体:氧气,流速为 0.35 mL/min。样品流速:5pL/min。31P、32S和3S的积分时间为150 ms(每个峰值一个点)。使用配于30%乙腈中的 100 ng/mL磷和硫的标样对 Agilen 8800进行优化,以满足最低的磷、硫检测限要求,流速为5pL/min, 采用注射泵进样。使用 AgilentICP-MS MassHunter 软件进行液相色谱操作和对色谱峰进行积分。 在MS/MS模式下使用 Agilent 8800/8900 消除对硫和磷的干扰 ICP-MS/MS 在 MS/MS 质量转移模式下操作以消除对硫和磷的干扰。在图2中,上方的示意图(a)将Q1设为m/z=32, 从而允许s*进入反应池,排除了其他质量数的干扰(包括质荷比为48的离子)。 S* 在池内通过与氧气反应转换为 SO*。Q2设置为m/z=48, 从而允许 SO*进入检测器,排除了 m/z=32的所有原始质量数干扰物。m/z=48的干扰物在碰撞反应池之前已由Q1排除。这是 MS/MS结构具有强大消干扰能力的关键所在一实现了在可控条件下进行准确无干扰的反应物离子测量。 图2下方的示意图(b)显示了对磷的测定设置:Q1设置为m/z=31,从而允许31P*通过,排除了其他质量数的干扰(包括m/z=47)。31P*在池内通过与氧气反应转换为 PO*。Q2设置为m/z=47, 从而允许反应产物 PO*进入检测器。m/z 47=处的干扰物在碰撞反应池之前已由Q1排除。Q1消除的干扰物包括:115N160*、14N160H*、14N0*、12C180H*对31P*的干扰,以及160*、15N"0*、15N160H*、14N180* 对3s*的干扰;Q2消除的干扰物包括: m/z=47处“7Tit、32s1NH*、32s15N*、15N10*、12C3cI*对 31p160*的干扰, 以及 m/z = 48处48Ti*、36Ar2C*、P*0H*、31P"0*、48Ca*对 SO*的干扰,如各图中所示。 同时可以看出,如果不使用Q1,来自磷和硫的反应产物离子将会彼此干扰,影响 P/S比、含磷和硫的物质的测量(导致磷酸化水平的计算错误)以及硫的同位素比例(例如,导致同位素稀释计算错误)。使用8800/8900 的 MS/MS质量转移模式,反应产物离子保持了和母离子相同的同位素类型一而在ICP-QMS 反应池中情况并非如此。在 ICP-QMS中没有Q1,因此硫的所有同位素都进入池内反应产生 SO反应产物离子而彼此重叠(例如2s180*与34s160*产物离子在 m/z 50 处发生重叠)。 最初,我们在高有机基质(30%乙腈,通过注射泵连续进样)中测量了检测限以评估 Agilent 8800 消除干扰的有效性。所得的P检测限为 0.6ng/mL, 2s检测限为 1.2 ng/mL,两者的背景等效浓度分别为9 ng/mL和5ng/mL。这些值在水溶液中显著降低,意味着乙腈中含有磷和硫。为确认硫所受干扰被完全消除,测定了硫34/32的比率。。由于S所受干扰要高得多,如果测得的34/32比率与34/32S的理论值吻合,则说明干扰得以有效去除。结果表明,空白溶液中34/32的比率(0.0484±0.0017)与标准值 (0.0487±0.0012)吻合得非常好。34/32S 的 IUPAC 值为 0.0447±0.0025。测定值与理论值的差异在于质量偏离(8800的比率值未经过质量歧视校正)。-4.0%至-4.3%的质量歧视因子与文献[14-16]中的报道相匹配,证实了8800能够有效消除所有对硫的干扰,且乙腈中含有一定量的硫。 图 2.8800/8900 ICP-MS/MS 在 MS/MS 质量转移模式下操作可消除硫(图a)和磷(图b)所受到的质谱干扰 结果与讨论 改用 capLC-ICP-MS 分离和检测了含有0、25、50、100和200 ng/mL 磷和硫(分别为 BNPP和蛋氨酸)的校准标样,结果获得了优异的线性以及<4%的RSD(图3)。 100.0 200.0 浓度(ppb) 图3.32S和31P (分别为蛋氨酸和 BNPP) 在浓度为 25、50、100和200 ng/mL时(以硫和磷元素浓度计)的校准曲线。进样量=2pL, 流速=5 pL/min, 按文中所给梯度洗脱条件 图4为50ng/mL标样的色谱图。观测到的两种元素的信噪比 (S/N)均很好。在 LC-ICP-MS分析中,由于乙腈流动相中的磷和硫带来的背景干扰能被有效去除,从而使得Agilent 8800 具备可准确测定此类分析物的能力。所得检测限分别为0.10 ng/mL 磷和0.18ng/mL 硫(6.6fmol磷,11 fmol硫,绝对值)。相信这是迄今为止所报道过的使用LC-ICP-MS 获得的硫和磷分析的最低绝对检测限。详见表 1中的总结。 测量磷酸肽和含硫多肽 采用LC-ICP-MS系统测量磷酸肽和含硫多肽。每种多肽的保留时间通过两种不同溶液(实验部分所描述的溶液1和2) 进行计算。溶液3含有两种多肽各约45ng/mL 和105 ng/mL(以硫和磷元素计)的标样,在相同仪器条件下进行测量。由溶液3获得的色谱见图5,该图清楚地显示了两种多肽和硫、磷标样的谱图。只有含磷酸化酪氨酸的多肽显示了一个小肩峰,所对应的可能是磷酸肽杂质,占信号的9%。观测到的信噪比S/N极为优异(未进行平滑处理)。含硫多肽的检测限均值(0.18 ng/mLS)比从蛋氨酸标样中获取的值(0.18 ng/mLS)略高,这可能是由于其基峰的宽度(24s)略微宽于蛋氨酸标样(9s)。就磷而言,所得检测限均值(0.33 ng/mL P) 大大高于 BNPP标样中获得的值(0.10ng/mLP),主要由于碳的存在使得磷的灵敏度提高(梯度洗脱)).o 图4.50 ng/mL标样的色谱图 图5.含有 LRRApSLG、ACTPERMAE、KRSpYEEHIP、VPMLK以及 BNPP与蛋氨酸的混合溶液3的色谱图 对蛋白质中天然存在的 ICP-MS可检测元素进行高灵敏度和无干扰的定量检测将扩展 LC-ICP-MS 方法在蛋白质组学中白应用。通过与 cap-LC 分离方法联用, Agilent 8800 串联四极杆 ICP-MS 利用 LC-ICP-MS分析含硫和磷物质时可获得前所未有的最低检测限(分别为 11 fmol 和 6.6 fmol)。利用 Agilent 8900 ICP-MS/MS #100 (高级应用配置)可显著降低硫分析的检测限,因为这款仪器全新设计怕氩气流路采用了低硫(和低硅)材料。此举有助于最大程度降低这两种元素的元素背景。 在 MS/MS 质量转移模式下操作时, Agilent 8800/8900 通过使分析物与氧气反应并测量产生的氧化物离子,从而有效消除了对磷和硫的干扰。硫的同位素比测量值与理论值吻合良好,证明硫干扰物得以有效消除,并且由于串联质谱模式能保留正确的同位素模式,可采用同位素稀释校准来校正因梯度稀释导致的硫灵敏度的变化。 所测得的含硫和磷物质及多肽的峰形和信噪比极佳。这也是首次将通用标样应用于多肽和磷酸肽的同步绝对定量分析。 这种全新的功能强大的硫磷(特别是硫)检测法将使LC-ICP-MS 在诸多领域中得到应用,如药物研究(药物和代谢物)、环境分析(农药)和纳米技术(工程纳米颗粒的表征)。 更多信息 ( 为详细了解该应用,请参看出版期刊: Triple Quad ICPMS (ICPQQQ) as a New Tool for Absolute Qua n titative Proteomics and P h osphoproteomics, Silvia DiezFernandez,NaokiSugiyama,JorgeRuizEncinar, AlfredoSanz-Medel,Anal.Chem., 2012,84 ( 14), pp5851-5857, Publication Date(Web): June18,2012 ) ( 参考文献 ) ( 1. Pereira Navaza, A.;Ruiz Encinar, J.: Sanz-Medel, A. Angew. Chem. I n t. Ed. 2007, 46,569-671 ) ( 2. Profrock, D.; Leonhard, P.; Prange, A. J. Anal. At.Spectrom. 2003, 18,708-713 ) ( 3. Profrock, D.;Leonard, P.; Ruck, W.; Prange, A. Anal. Bioanal. Chem. 2005.381, 1 94-204 ) ( 4. Smith, C . J.;Wilson, I. D.; Weidolf,L.; Abou-Shakra, F.; T homsen, M. Chromatographia. 2004,59, S165-S170 ) ( 5. Wind, M .; E dler, M.;Jakubowski, N.; L i nscheid, M.;Wesch, H.; Lehmann, W. D. Anal. Chem. 2001, 73, 29-35 ) ( 6. Schaumloffel, D.; Giusti, P.; Preud’Homme, H. ; Szpunar, J .; Lobinski, R. Anal . Chem. 2007,79,2859-2868 ) ( 7. Profrock, D.;Leonhard, P.; Prange A. Anal. B ioanal. Chem. 2003,377,132-139 ) ( 8. Hann, S.; Koellensperger, G . ; Obinger, C.; Furtmuller, P . G.; Stingeder, G. J. Anal. A t . Spectrom . 2004,19, 74-79 ) ( 9. Sturup, S.; Bendahl, L.; Gammelgaard, B. J. Anal. At . Spectrom. 2006,21, 201-203 ) ( 10. Zinn,N.; H ahn, B.; Pipkorn, R . ; Schwarzer, D.; Lehmann, W. D. J. Proteome Res. 2009,8,4870-4875 ) ( 1 1 .Hann, S.; Koellensperger, G.; Obinger, C.; Furtmuller, P. G.; Stingeder, G. J. Anal. At. Spectrom. 2004, 19, 74-79 ) ( 12. Zinn, N.; Kruger, R.; Leonhard, P. ; Bettmer, J. Anal. Bioanal. Chem. 2008,391,537-543 ) 13. Wind, M.; Wegener, A.; Eisenmenger, A.; Kelner,R.; Lehmann, W. D. Angew. Chem. Int. Ed. 2003,42,3425-3427 14. Clough, R.; Evans, P.; Catterick, T.; Evans, E. H. Anal.Chem. 2006, 78,6126-6132 15. Becker, J. S. J. Anal. At. Spectrom. 2002, 17,1172-1185 16. Mason, P. R. D.; Kosler, J.; de Hoog, J. C. M.;Sylvester, P.J.; Meffan-Main, S. Anal. At. Spectrom.2006,21,177-186 查找当地的安捷伦客户中心:www.agilent.com/chem/contactus-cn 免费专线: www.agilent.com 800-820-3278,400-820-3278(手机用户) 仅限研究使用。不可用于诊断目的。 联系我们: LSCA-China_800@agilent.com 本文中的信息如有变更,恕不另行通知。 在线询价: ◎安捷伦科技(中国)有限公司, 2016 2016年6月1日,中国出版 www.agilent.com/chem/erfq-cn 出版号:5991-1461CHCN Agilent Technologies Agilent Technologies 摘要结合毛细管液相色谱分离技术,Agilent 8800 串联四极杆 ICP-MS 在 MS/MS 质量转移模式下可痕量测定磷酸肽中的磷与含硫多肽中的硫。使用 LC-ICP-MS 可获得前所未有的含硫和含磷物质的最低绝对检测限(分别为 11 fmol 和 6.6 fmol)。硫的同位素比值测定结果与其理论值高度吻合,从而证明干扰得以有效消除。所观测到的硫和磷的峰形和信噪比表现优异。测定结果表明串联四极杆 capLCICP-MS 技术在使用非特殊标样测定含硫和含磷多肽的高灵敏度和同时绝对定量分析方面有巨大潜力。前言LC-MS/MS 用于定量分析制药/生物制药和临床研究中的目标蛋白质。此方法常常使用同位素标记的合成蛋白质和多肽作为内标来定量分析相应的目标化合物。与之相反,LC-ICP-MS 通过测定目标化合物中含有的杂原子硫和磷对蛋白质和多肽进行非特异性定量分析。通过这种方式可以使用含有杂原子的不同化合物,并将单个含杂原子的非蛋白质化合物作为通用标样对其进行定量。不幸的是,硫和磷的检测限因其高电离能和传统四极杆 ICP-MS (ICP-QMS)的多原子干扰而大打折扣 — 即使使用了碰撞/反应池 (CRC)。虽然扇形磁场高分辨 ICP-MS (HR-ICP-MS) 也被用于该类应用,但迄今为止仍没有任何 ICP-MS 仪器能够达到已报道的 ESI-MS/MS 仪器使用同位素标记合成多肽时所具有的检测限(特别是对于硫)。表 1 列出了关于 LCICP-MS 对于硫和磷检测限的已发表数据,包括所用的 ICPMS技术和分离技术。在这项工作中,我们采用了 Agilent8800 串联四极杆 ICP-MS(也简称为 ICP-MS/MS)通过对硫和磷杂原子进行绝对定量分析来测定蛋白质和多肽。结论对蛋白质中天然存在的 ICP-MS 可检测元素进行高灵敏度和无干扰的定量检测将扩展 LC-ICP-MS 方法在蛋白质组学中的应用。通过与 cap-LC 分离方法联用,Agilent 8800 串联四极杆 ICP-MS 利用 LC-ICP-MS 分析含硫和磷物质时可获得前所未有的最低检测限(分别为 11 fmol 和 6.6 fmol)。利用 Agilent 8900 ICP-MS/MS #100(高级应用配置)可显著降低硫分析的检测限,因为这款仪器全新设计的氩气流路采用了低硫(和低硅)材料。此举有助于最大程度降低这两种元素的元素背景。在 MS/MS 质量转移模式下操作时,Agilent 8800/8900 通过使分析物与氧气反应并测量产生的氧化物离子,从而有效消除了对磷和硫的干扰。硫的同位素比测量值与理论值吻合良好,证明硫干扰物得以有效消除,并且由于串联质谱模式能保留正确的同位素模式,可采用同位素稀释校准来校正因梯度稀释导致的硫灵敏度的变化。所测得的含硫和磷物质及多肽的峰形和信噪比极佳。这也是首次将通用标样应用于多肽和磷酸肽的同步绝对定量分析。这种全新的功能强大的硫磷(特别是硫)检测法将使 LCICP-MS 在诸多领域中得到应用,如药物研究(药物和代谢物)、环境分析(农药)和纳米技术(工程纳米颗粒的表征)。
确定





还剩6页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《多肽和磷酸肽中磷和硫检测方案(等离子体质谱)》,该方案主要用于其他中磷和硫检测,参考标准--,《多肽和磷酸肽中磷和硫检测方案(等离子体质谱)》用到的仪器有
相关方案
更多
该厂商其他方案
更多








