在本应用纪要中,我们展示了一种可快速标记游离N-糖的新型试剂-RapiFluor-MS的应用。RapiFluor-MS将游离N-糖样品制备的总时间缩短为仅30分钟,而且与传统的标记技术相比,可将荧光信号提高14倍,同时将MS信号提高1000倍。采用这种用时更短的样品制备方案,我们成功地对一种高分离度色谱方法进行了几何放大,使其总分析周期缩短为仅10分钟。最后,我们使用ACQUITY QDa质谱检测器,通过选择离子监测(SIR)模式来监测选定的游离寡糖,开发了一种特异性(即使发生共洗脱)监测的方法。我们将介绍RapiFluor-MS与ACQUITY QDa质谱检测器相结合,快速高效地获取有用数据的强大解决方案。
方案详情

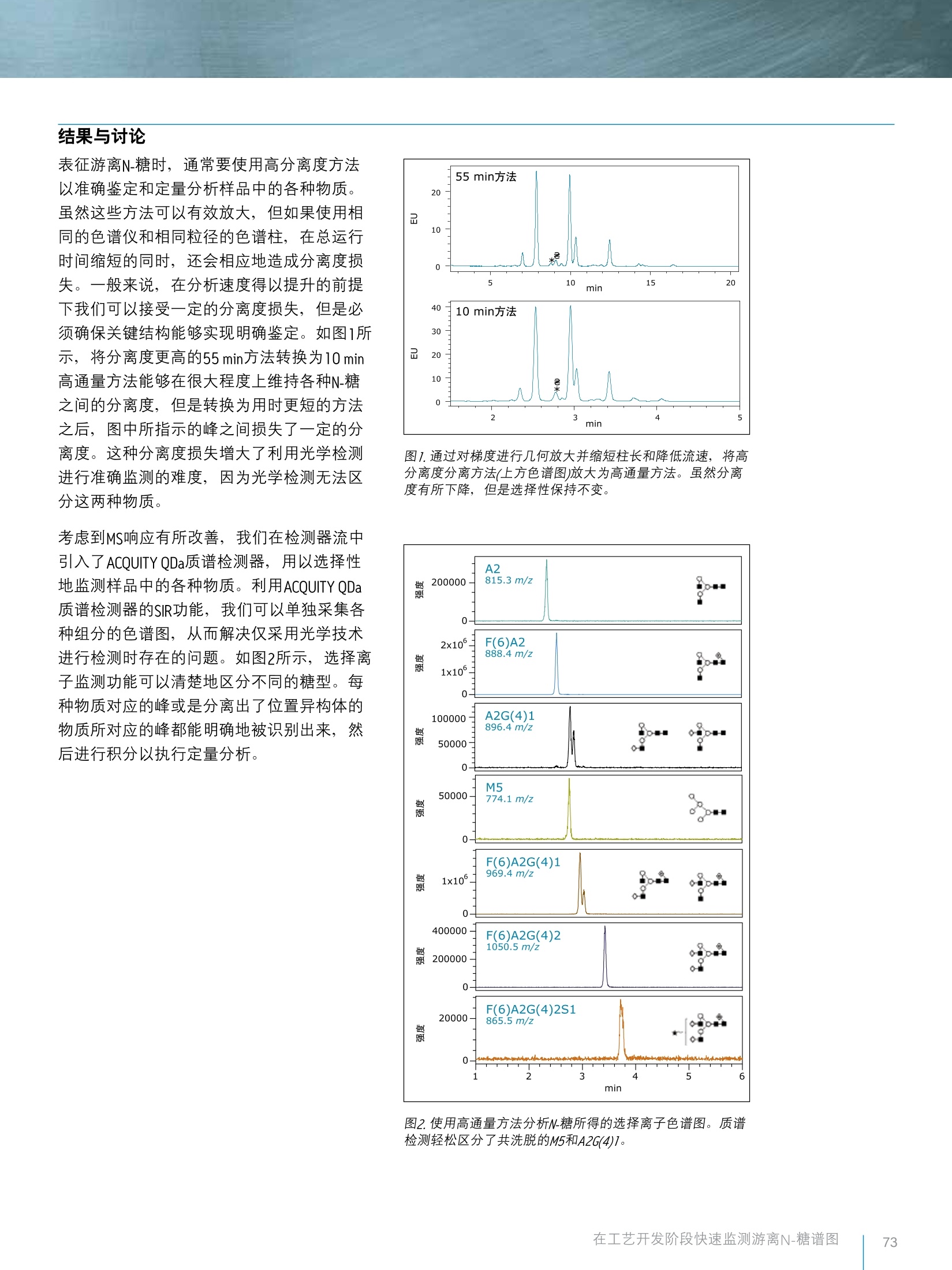
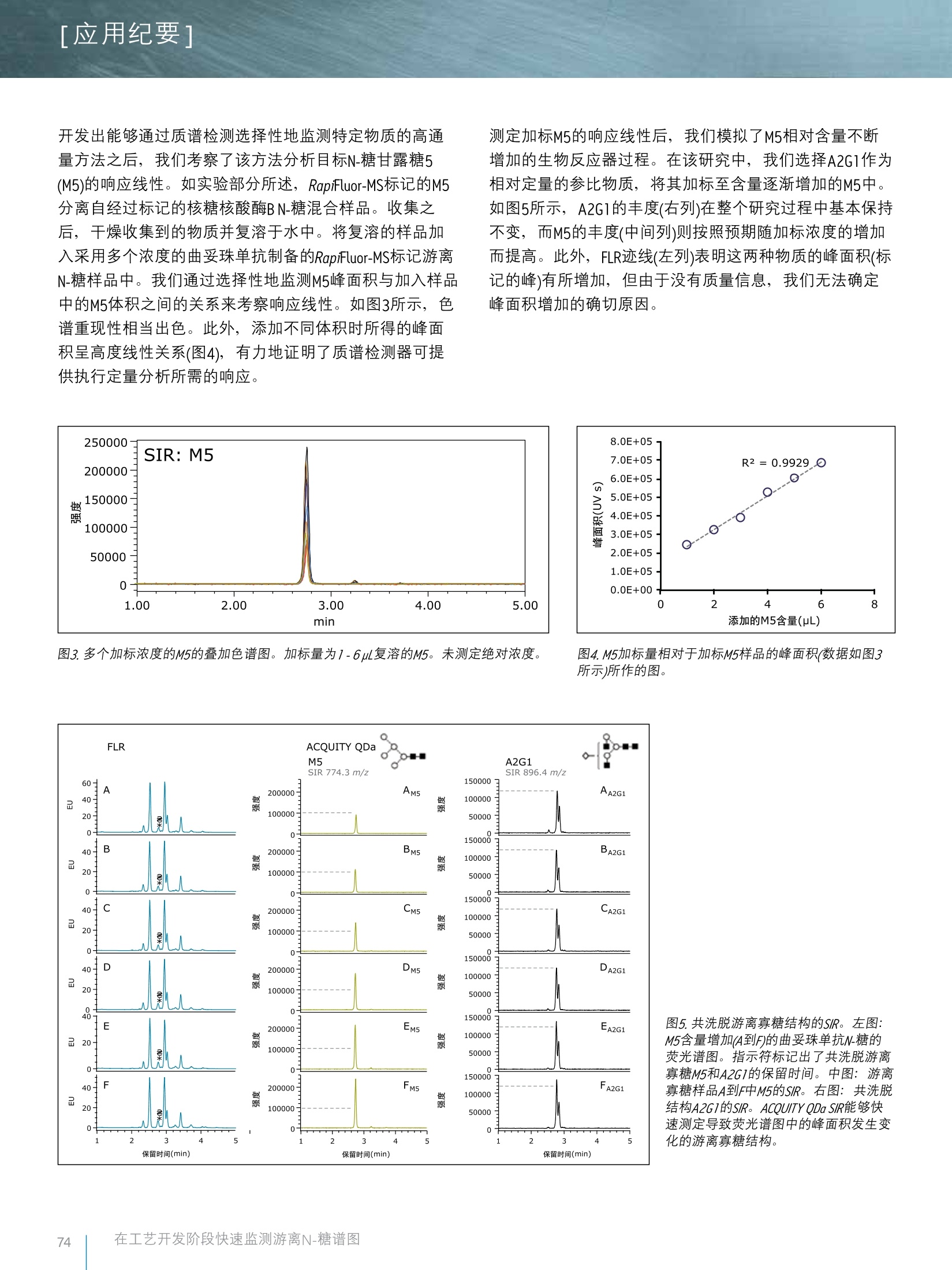
[应用纪要1THE SCIENCE OF WHAT'S POSSIBLE. 「应用纪要1 Waters 在工艺开发阶段利用RapiFluor-MS和ACQUITY QDa质谱检测器快速监测游离N-糖谱图 Eoin F.J. Cosgrave、Robert Birdsall和Sean M. McCarthy 沃特世公司(美国马萨诸塞州米尔福德) 应用优势 在生产过程中快速反馈糖基化分布以确保产品质量 缩短游离N-糖的样品制备时间 ■提高N-糖分析的通量 ■借助质谱检测提高N-糖分析的专属性 沃特世解决方案 RapiFluor-MSTM游离寡糖性能测试标准品(部件号186007983) ACQUITYODa°质谱检测器 ACQUITY UPLC H-Class Bio系统(FTN) ACQUITY UPLC荧光检测器(FLR) ACOUITY UPLC BEH Amide游离寡糖分析专 用柱 Empower3色谱数据软件 Waters分析型馏分管理器 关键词 游离寡糖,质谱检测, H-Class,ACQUITY, QDa, RapiFluor-MS, lgG 简介 在糖基化生物治疗药物开发流程的各个阶段,我们都需要对糖基化分布和各种N-糖进行表征。此外,随着新型治疗性蛋白质的开发过程向前推进,我们在工艺放大阶段必须仔细研究和评估生产条件,以确保药物安全性和疗效始终如一,为后续的临床研究和最终的商业化做好准备。作为该过程的一个环节,我们通常密切监测关键品质属性,目的是确保各批次产品达到规定的可接受标准,同时识别关键参数,这通常是质量源于设计(QbD)方法的一部分。特别地,由于游离寡糖对于蛋白质生物治疗药物的安全性和疗效而言具有重要意义,因此N-糖谱图通常也是需要密切监测的对象。 游离N-糖谱图监测以往需要进行费时费力的样品制备过程,通常耗时数小时甚至数天。因此,要想监测生产条件对N-糖谱图的影响,难度极大。此外,分析游离和标记的N-糖常常需要很长时间。当需要监测特定的结构时,用户通常依靠光学检测技术进行鉴定和定量。 在本应用纪要中,我们展示了一种可快速标记游离N-糖的新型试剂-RapiFluor-MS的应用。RapiFluor-MS将游离N-糖样品制备的总时间缩短为仅30分钟,而且与传统的标记技术相比,可将荧光信号提高14倍,同时将MS信号提高1000倍。采用这种用时更短的样品制备方案,我们成功地对一种高分离度色谱方法进行了几何放大,使其总分析周期缩短为仅10分钟。最后,我们使用ACQUITY QDa质谱检测器,通过选择离子监测(SIR)模式来监测选定的游离寡糖,开发了一种特异性(即使发生共洗脱)监测的方法。我们将介绍RapiFLuor-MS与ACQUITY QDa质谱检测器相结合,快速高效地获取有用数据的强大解决方案。 按照RapiFluor-MS样品制备试剂盒中提供的方案,采用市售曲妥珠单抗制备游离N-糖样品。加标研究中所用的高甘露糖物质是核糖核酸酶B经过糖基释放和RapiFluor-MS标记之后分离而得的。甘露糖物质经色谱分离后使用沃特世分析型馏分收集器进行收集。收集的样品用CentriVap进行干燥并复溶于水中。每次分析中,游离和标记N-糖的柱上载样量约为32pmol。LC-MS级乙腈和水购自Pierce。使用甲酸铵溶液-游离寡糖分析(部件号186007081)配制甲酸铵,具体方法是将该溶液的全部内容物倒入1L水中并混合。 LC条件 LC系统: ACQUITY UPLC H-Class Bio 检测器: ACQUITY UPLC FLR ACQUITY QDa 高分离度方法梯度表: 色谱柱: 高分离度方法: ACQUITY UPLC BEH Amide游离寡糖分析 专用柱,130A,1.7um, 2.1 mm × 150 流速 mm(部件号186004742) 高通量方法: ACQUITY UPLC BEH Amide游离寡糖分 析专用柱,130A, 1.7 pm, 2.1 mm ×50 mm(部件号186004740) 柱温: 60℃ 样品温度: 10℃ FLR设置 数据采集速率: 5 pts/s 采样速率: 5 pts/s 质量范围: 500-1250Da 锥孔电压: 15V 毛细管电压: 1.5kV 探头温度: 400℃ 模式: 正离子 流动相A: 乙腈(Pierce, LC-MS级) 流动相B: 50mM甲酸铵, pH 4.4 (LC-MS级,甲酸铵浓缩液) 流动相C: 乙乙(LC-MS级) 流动相D: 乙腈(LC-MS级) 高分离度方法梯度表: (mL/min) %A %B %C 0.400 75 25 0 0.400 54 46 0 36.5 0.200 0 100 0 0.200 0 100 0 42.5 0.200 75 25 0 47.4 0.400 75 25 0 55.0 0.400 75 25 0 高通量方法梯度表: (mL/min) %A %B %C %D 0.800 75 25 0 0.800 54 46 0 0.400 0 100 0 0.400 0 100 0 0.400 75 25 0 0.800 75 25 0 10.0 0.800 75 25 0 0 数据管理 结果与讨论 表征游离N-糖时,通常要使用高分离度方法以准确鉴定和定量分析样品中的各种物物。虽然这些方法可以有效放大,但如果使用相同的色谱仪和相同粒径的色谱柱,在总运行时间缩短的同时,还会相应地造成分离度损失。-一般来说,在分析速度得以提升的前提下我们可以接受一定的分离度损失,但是必须确保关键结构能够实现明确鉴定。如图1所示,将分离度更高的55 min方法转换为10 min高通量方法能够在很大程度上维持各种N-糖之间的分离度,但是转换为用时更短的方法之后,图中所指示的峰之间损失了一定的分离度。这种分离度损失增大了利用光学检测进行准确监测的难度,因为光学检测无法区分这两种物质。 考虑到MS响应有所改善,我们在检测器流中引入了ACQUITY QDa质谱检测器,用以选择性地监测样品中的各种物质。利用ACQUITY QDa质谱检测器的SIR功能,我们可以单独采集各种组分的色谱图,从而解决仅采用光学技术进行检测时存在的问题。如图2所示,选择离子监测功能可以清楚地区分不同的糖型。每种物质对应的峰或是分离出了位置异构体的物质所对应的峰都能明确地被识别出来,然后进行积分以执行定量分析。 图1.通过对梯度进行几何放大并缩短柱长和降低流速,将高分离度分离方法(上方色谱图)放大为高通量方法。虽然分离度有所下降,但是选择性保持不变。 图2.使用高通量方法分析N-糖所得的选择离子色谱图。质谱检测轻松区分了共洗脱的M5和A2G(4)1。 开发出能够通过质谱检测选择性地监测特定物质的高通量方法之后,我们门察了该方法分析目标N-糖甘露糖5(M5)的句应线性。如实验部分所述, RapiFluor-MS标记的M5分离自经过标记的核糖糖酸酶BN-糖混合样品。收集之后,干燥收集到的物质并复溶于水中。将复溶的样品加入采用多个浓度的曲妥珠单抗制备的RapiFluor-MS标记游离N-糖样品中。我们通过选择性地监测M5峰面积与加入样品中的M5体积之间的关系来考察响应线性。如图3所示,色谱重现性相当出色。此外,添加不同体积时所得的峰面积呈高度线性关系(图4),有力地证明了质谱检测器可提供执行定量分析所需的响应。 测定加标M5的响应线性后,我们模拟了M5相对含量不断增加的生物反应器过程。在该研究中,我们选择A2G1作为相对定量的参比物质,将其加标至含量逐渐增加的M5中。如图5所示, A2G1的丰度(右列)在整个研究过程中基本保持不变,而M5的丰度(中间列)则按照预期随加标浓度的增加而提高。此外, FLR迹线(左列)表明这两种物质的峰面积(标记的峰)有所增加,但由于没有质量信息,我们无法确定峰面积增加的确切原因。 图3.多个加标浓度的M5的叠加色谱图。加标量为1-6ul复溶的M5。未测定绝对浓度。 图4.M5加标量相对于加标M5样品的峰面积(数据如图3所示)所作的图。 图5.共洗脱游离寡糖结构的SIR。左图:M5含量增加(A到F)的曲妥珠单抗N-糖的荧光谱图。指示符标记出了共洗脱游离寡糖M5和A2G1的保留时间。中图:游离寡糖样品A到F中M5的SIR。右图:共洗脱结构A2G1的SIR。ACQUITY QDa SIR能够快速测定导致荧光谱图中的峰面积发生变化的游离寡糖结构。 RapiFluor-MS与ACQUITY UPLC H-Class Bio系统和ACQUITY QDa质谱检测器相结合,为准确监测游离N-糖提供了一种创新的方法,可实现高通量的常规分析。结合ACQUITY UPLC和ACQUITYQDa, 能够缩短制品制备时间并大幅提升MS响应,:有助于我们更加密切地监测游离N-糖谱图,而这是采用传统方法无法实现的。虽然本研究应用了FLR检测,但只需进行相对定量的高通量方法不一定要用到FLR,因为采用ACQUITY QDa质谱检测器即可监测各种物质。如本文所述,样样制备和分析的整个过程可在40分钟内完成。除了样品制备可重现之外,分离和定量分析也是可重现且可定量的,有助于研究人员快速制定有价值的决策。 ( 参考文献 ) ( 1 . L auber MA, Brousmiche DW, Hua Z, Koza SM, Gut h rie E, Magnelli P , T aron CH, and Fountain K J . R a pid Preparation of ReleasedN-Glycans f o r HILIC A nalysis Using a Novel Fluorescence andMS-Active L a beling R e agent. 2015, W aters App l ication Not e P/N 7 2 0005 27 5E N . ) THE SCIENCE OF WHAT'S POSSIBLE. Waters、 The Science of What’s Possible、ACQUITY、QDa、ACQUITY UPLC、UPLC和Empower是沃特世公司的注册商标。RapiFluor-MS是沃特世公司的商标。其它所有商标均归各自的拥有者所有。 沃特斯中国有限公司沃特世科技(上海)有限公司 上海:021-61562666 广州:020-28295999 香港:852-29641800 免费售后服务热线:800(400)820 2676www.waters.com 在工艺开发阶段快速监测游离N-糖谱图 在本应用纪要中,我们展示了一种可快速标记游离N-糖的新型试剂-RapiFluor-MS的应用。RapiFluor-MS将游离N-糖样品制备的总时间缩短为仅30分钟,而且与传统的标记技术相比,可将荧光信号提高14倍,同时将MS信号提高1000倍。采用这种用时更短的样品制备方案,我们成功地对一种高分离度色谱方法进行了几何放大,使其总分析周期缩短为仅10分钟。最后,我们使用ACQUITY QDa质谱检测器,通过选择离子监测(SIR)模式来监测选定的游离寡糖,开发了一种特异性(即使发生共洗脱)监测的方法。我们将介绍RapiFluor-MS与ACQUITY QDa质谱检测器相结合,快速高效地获取有用数据的强大解决方案。
确定


还剩3页未读,是否继续阅读?
沃特世科技(上海)有限公司(Waters)为您提供《曲妥珠单抗制备游离N-糖中结构特征检测方案(液质联用仪)》,该方案主要用于治疗类生物药品中结构特征检测,参考标准--,《曲妥珠单抗制备游离N-糖中结构特征检测方案(液质联用仪)》用到的仪器有ACQUITY QDa质谱检测器、Waters ACQUITY UPLC H-Class Bio 超高效液相色谱、Waters Empower 3 色谱数据软件
推荐专场
相关方案
更多
该厂商其他方案
更多