
方案详情
文
研究黄芩苷神经元跨膜转运的特点,部分阐释黄芩苷发挥神经系统保护作用的物质性基础。方法以PC12细胞为研究对象,使用高效液相色谱(HPLC)、质谱(MS)法检测黄芩苷孵育细胞内的物质含量及相关代谢产物。结果表明黄芩苷能够浓度依赖性的跨膜入胞,此过程受相关抑制剂影响,并产生代谢产物。
方案详情

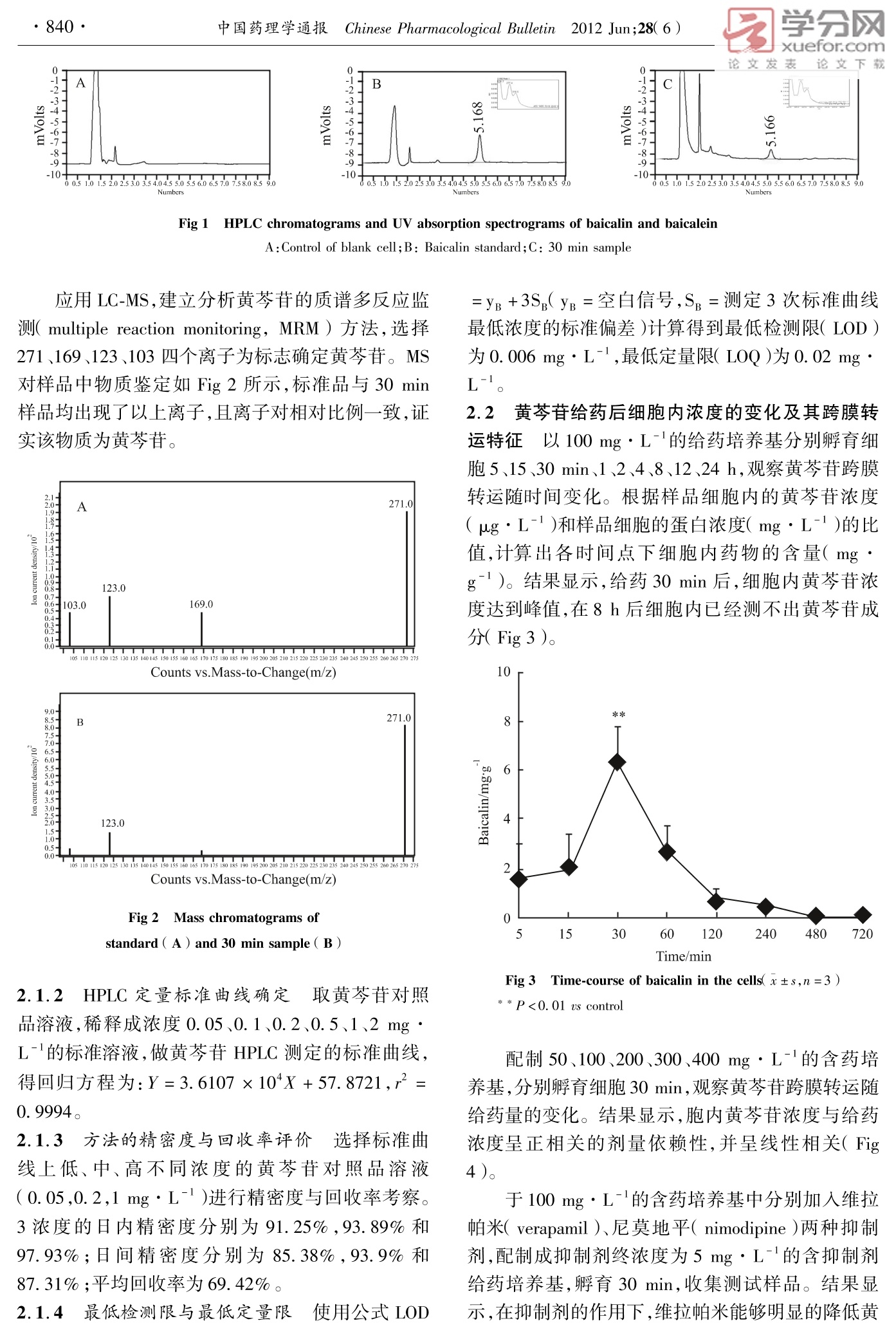
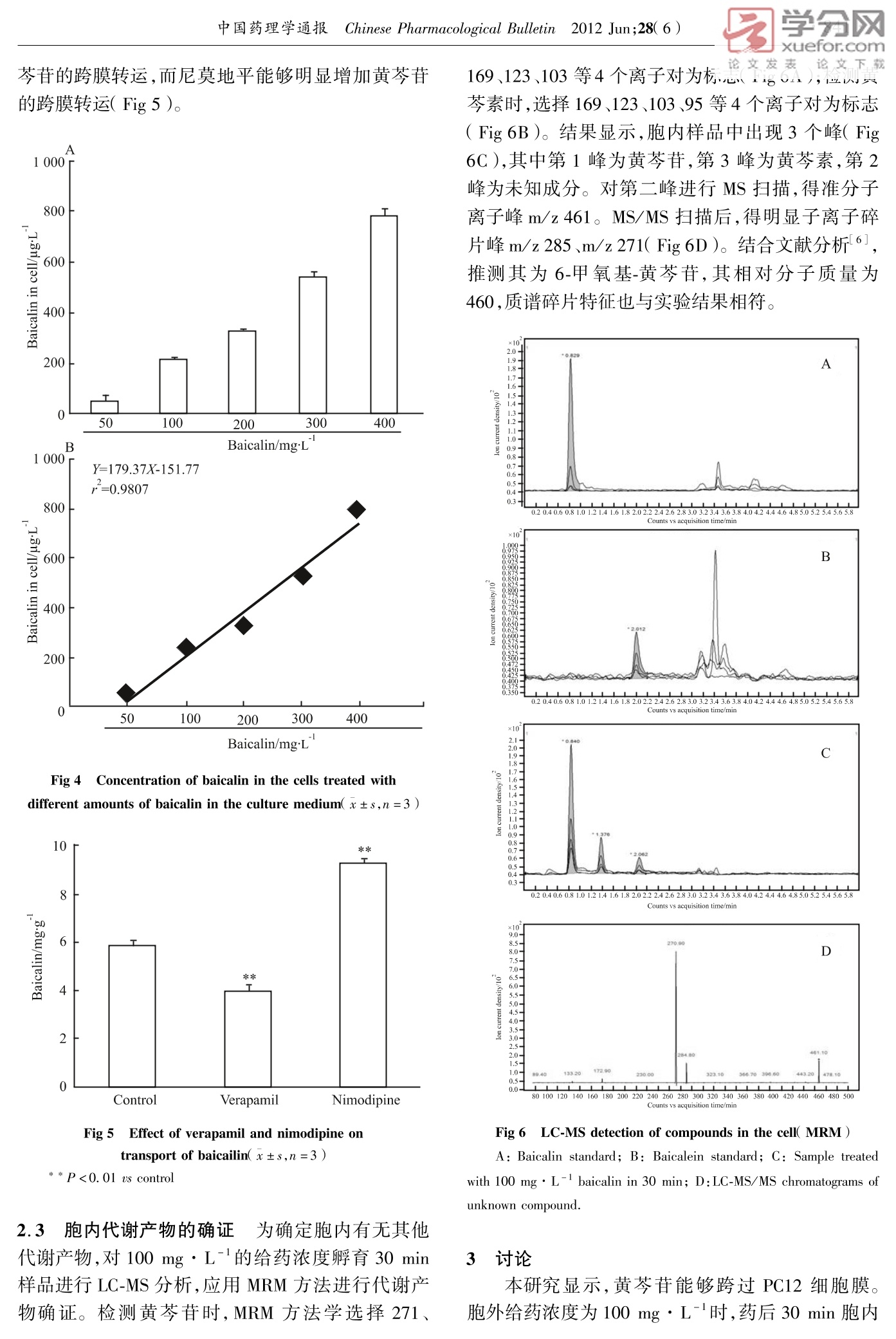
学分网xuefor.com论文下载中国药理学通报 Chinese Pharmacological Bulletin 2012 Jun;28(6):839~42 论文发表网络出版时间:2012-5-1114:04 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20120511.1404.2012 黄芩苷 PC12细胞跨膜转运的实验研究 赵 爽,雷 帆,李慧颖,王玉刚,柴玉爽,杜力军 (清华大学蛋白质科学教育部重点实验室,生命科学学院医学院药物药理学研究室,北京 100084) doi:10.3969/j. issn.1001-1978.2012.06.024 文献标志码:A文章编号:1001-1978(2012 )06-0839-04 中国图书分类号:R284.1;R287;R329.24;R977.6 摘要:目的 研究黄芩苷神经元跨膜转运的特点,部分阐释黄芩苷发挥神经系统保护作用的物质性基础。方法 以PC12细胞为研究对象,使用高效液相色谱( HPLC)、质谱(MS)法检测黄芩苷孵育细胞内的物质含量及相关代谢产物。结果 100 mg·L-黄芩苷给药30 min 后,胞内黄芩苷浓度达峰值,8h后胞内已测不出黄芩苷;在50~400mgL-1的给药浓度下,胞内黄芩苷含量与给药剂量呈正相关;抑制剂 Verapamil 与 Nimodipine 对黄芩苷转运有明显影响;同时胞内检测出黄芩素、6-甲氧基-黄芩苷两种结构类似物。结论 黄芩苷能够浓度依赖性的跨膜入胞,此过程受相关抑制剂影响,并产生代谢产物。 关键词:黄芩苷;跨膜转运; PC12细胞;黄芩素;6-甲氧基-黄芩苷; P-糖蛋白 现代药理研究表明,黄芩苷具有抗炎、抗菌、抗病毒、清除自由基及抗氧化、抗变态反应、抗肿瘤,神经系统保护等药理活性,其能够通过多种途径对缺血/再灌注损伤发挥神经元保护作用1-51。 黄芩苷在口服或静脉给药后,体内可以检测到多种代谢产物,例如异构体6-0-葡萄糖醛酸结合物、6-甲氧基-黄芩苷等161。同时,静脉给予大鼠黄芩苷后5~10 min,脑核团中即可检测出黄芩苷,说明其能很快的透过血脑屏障;在脑核团内,其有效地分布持续时间长达4~5h7-91。但目前尚未见黄芩苷跨神经元细胞膜的相关报道。而对此问题的探讨,将有助于从物质基础上进一步阐释黄芩苷对神经系统保护作用。为此,本文以 PC12细胞为研究对象,采用 HPLC、MS 对此进行了研究。 ( 收稿日期:2012-02-02,修回日期:2012-03-27 ) ( 基金项目:国家自然科学基金资助项目( No 3097 3 896, 30801523, 81073092),“重大新药创制”国家科技重大专项资助项目 ( No 2012ZX09102201-008,2012ZX09103201-041) ) ( 作者简介:赵 爽(1989-),男,硕士,研究方向:小分子跨膜转运, E-mail: steven. zhaoshuang@ gmail. com; 杜力军(1956-),男,博士,教授,通讯作者,研究方向:药 理学,Tel:010-62773630,E-mail:lijundu@ tsinghua. edu. cn ) 材料与方法 1.1 主要仪器 高效液相色谱系统( HPLC )( Wa-ters公司),含996 Photodiode Array Detector, 2410Refractive Index Detector, Empower2色谱工作站,Rheodyne 7725i 手动进样器,515 HPLC pump。 Agi-lent 1290/6460 液相色谱/三重四级杆质谱联用系统( LC-MS)(Agilent 公司)。 1.2 药品 黄芩苷(98.4%)由本室张陆军博士提供。黄芩苷对照品和黄芩素对照品均购自中国药品生物制剂鉴定所,批号分别为:020712和020713。 称取黄芩苷药品,溶解于无血清 RPMI1640 培养液中,无菌条件下滤菌后,配制得浓度为1000 mg ·L-l黄芩苷给药母液,pH值7.2~7.4,用于实验。 1.3 主要方法 1.3.1 细胞培养 取生长对数期的 PC12细胞置于6 cm 细胞培养皿,在37℃、含5% CO,90%湿度的环境中培养,培养基为含10%马血清,5%胎牛血清的 RPMI 1640。至细胞密度达80%以上时进行跨膜转运实验。 1.3.2 给药采样 以含不同浓度药物的无血清培养基孵育细胞后,吸取含药培养基,冷PBS(4℃)迅速洗涤细胞3遍。加入无水甲醇,使用细胞铲刮下细胞收集至 EP 管中。收集的细胞悬液使用超声破碎的方法获得胞内物质。 1.3.3 蛋白定量 吸取上述细胞裂解液使用 Brad-ford 法进行蛋白总量测定,不同浓度的牛血清白蛋白( BSA)溶液做标准曲线,计算每样品平均蛋白质浓度(mg·L-)。 1.3.4 含量测定 取上述细胞裂解液12000 r· min-离心,取上清置 EP 管中,室温干燥,每管加入100 ul甲醇定容,0.45 um 滤膜滤过后,进行 HPLC及 MS 测定。黄芩苷测定流动相为乙腈:水(磷酸调节 pH=3.0)=30:70(V/V),进样量10 ul,流速1.0 ml·min,测定波长277 nm,柱温为室温。 2结果 2.1相关方法学结果 2.1.1方法专属性评价 在上述流动相条件下,黄芩苷保留时间为 5.1 min,无干扰峰( Fig 1)。 123459 -10- 论文下载 Fig 1 HPLC chromatograms and UV absorption spectrograms of baicalin and baicalein A: Control of blank cell;B: Baicalin standard;C: 30 min sample 应用 LC-MS,建立分析黄芩苷的质谱多反应监测( multiple reaction monitoring, MRM)方法,选择271、169、123、103四个离子为标志确定黄芩苷。MS对样品中物质鉴定如 Fig 2 所示,标准品与30 min样品均出现了以上离子,且离子对相对比例一致,证实该物质为黄芩苷。 Fig 2 Mass chromatograms ofstandard ( A ) and 30 min sample(B) 2.1.2 HPLC 定量标准曲线确定 取黄芩苷对照品溶液,稀释成浓度0.05、0.1、0.2、0.5、1、2 mg·L-1的标准溶液,做黄芩苷 HPLC 测定的标准曲线,得回归方程为:Y=3.6107×10X+57.8721,r²=0.9994。 2.1.3 方法的精密度与回收率评价 选择标准曲线上低、中、高不同浓度的黄芩苷对照品溶液(0.05,0.2,1 mg·L-)进行精密度与回收率考察。3浓度的日内精密度分别为91.25%,93.89%和97.93%;日间精密度分别为85.38%,93.9%和87.31%;平均回收率为69.42%。 2.1.4 最低检测限与最低定量限 使用公式LOD =yB +3S,(yB=空白信号,Sp=测定3次标准曲线最低浓度的标准偏差)计算得到最低检测限(LOD)为 0.006 mg·L-,最低定量限( LOQ)为 0.02 mg·L-1 2.2 黄芩苷给药后细胞内浓度的变化及其跨膜转运特征 以100 mg·L-I的给药培养基分别孵育细胞5、15、30 min、1、2、4、8、12、24h,观察黄芩苷跨膜转运随时间变化。根据样品细胞内的黄芩苷浓度(ugL-1)和样品细胞的蛋白浓度(mg·L-)的比值,计算出各时间点下细胞内药物的含量(mg·g)。结果显示,给药30 min 后,细胞内黄芩苷浓度达到峰值,在8h后细胞内已经测不出黄芩苷成分(Fig 3) Fig 3 Time-course of baicalin in the cells(x±s,n=3)* * P<0.01 us control 配制50、100、200、300、400 mg·L-的含药培养基,分别孵育细胞30 min,观察黄芩苷跨膜转运随给药量的变化。结果显示,胞内黄芩苷浓度与给药浓度呈正相关的剂量依赖性,并呈线性相关( Fig4)。 于100 mg·L-的含药培养基中分别加入维拉帕米( verapamil)、尼莫地平( nimodipine )两种抑制剂,配制成抑制剂终浓度为5mg·L-的含抑制剂给药培养基,孵育30 min,收集测试样品。结果显示,在抑制剂的作用下,维拉帕米能够明显的降低黄 芩苷的跨膜转运,而尼莫地平能够明显增加黄芩苷的跨膜转运( Fig 5)。 Fig 4 Concentration of baicalin in the cells treated withdifferent amounts of baicalin in the culture medium(x±s,n=3) Fig 5 Effect of verapamil and nimodipine ontransport of baicailin(x±s,n=3) **P<0.01 us control 2.3 胞内代谢产物的确证 为确定胞内有无其他代谢产物,对100mg·L-的给药浓度孵育 30 min样品进行 LC-MS分析,应用MRM 方法进行代谢产物确证。检测黄芩苷时, MRM 方法学选择271、 论文发表 论文下载169、123、103等4个离子对为标志(八ig6A),业测黄芩素时,选择169、123、103、95等4个离子对为标志( Fig 6B )。结果显示,胞内样品中出现3个峰( Fig6C),其中第1峰为黄芩苷,第3峰为黄芩素,第2峰为未知成分。对第二峰进行 MS 扫描,得准分子离子峰 m/z 461。MS/MS 扫描后,得明显子离子碎片峰 m/z 285、m/z 271(Fig 6D)。结合文献分析61,推测其为6-甲氧基-黄芩苷,其相对分子质量为460,质谱碎片特征也与实验结果相符。 2.0- 1.9 .9- 1.8- A 0.5- 0.0 1IIIL IIILLILI 1 80100120140160180200220240260280300320340360380400420440460480500 Counts vs acquisition time/min Fig 6 LC-MS detection of compounds in the cell( MRM ) A: Baicalin standard; B: Baicalein standard; C: Sample treatedwith 100 mg·L- baicalin in 30 min; D:LC-MS/MS chromatograms ofunknown compound. 3 讨论 本研究显示,黄芩苷能够跨过 PC12细胞膜。胞外给药浓度为100 mg·L-时,药后30 min 胞内 黄芩苷浓度达到峰值,8h后胞内已测不出黄芩苷。其跨膜转运具有剂量依赖性。我室以前的工作表明,黄芩苷对 PC12 细胞存活率最大无毒浓度为1000 mg·L-115J。因此,本文选择400 mg·L-作为给药浓度上限。在50mg·L-到400 mg·L-浓度范围内,黄芩苷胞内药物农度与给药量成一定的线性相关。 在本实验中,P-糖蛋白抑制剂 verapamil 降低了黄芩苷在胞内的含量,提示 verapamil 对黄芩苷的转运有一定的影响,同时也表明黄芩苷与P-糖蛋白没有明显关系。钙离子通道拮抗剂 nimodipine 使黄芩苷胞内浓度明显升高,提示黄芩苷的转运与钙离子通道有一定的关系。 黄芩苷入胞后,出现两个代谢产物:黄芩素和6-甲氧基-黄芩苷。提示黄芩苷在细胞跨膜转运过程中涉及到葡萄糖醛酸酶及甲基化酶的作用。由于这两种酶主要存在于细胞内,因此黄芩苷的这种代谢可能发生在跨膜后转运入胞的过程,也提示以往文献中所报道的黄芩苷血中6-甲氧基-黄芩苷可能是组织细胞代谢外排入血的结果6。本工作将有助于对黄芩苷神经元保护作用机制的阐明。 ( 参考文献: ) ( [1] 陈 群,曾因明,王建国.黄芩苷的脑保护作用和对微管运动 蛋白免疫活性的影响[J].中国药理学通报,2001,17(1): 117-8. ) ( [ 1 ] Chen Q, Z e ng Y M, Wan g J G. Prot e ctive rol e of breviscarpin onbrain tissue and its effec t on immunoreactivity of microtubule motor protein [ J] . Chi n Pharmacol Bull, 2001 , 17(1 ) :1 1 7 -8. ) ( [ 2] 刘玉萍,Purusotam Basnet,小松办子,等.黄芩清除自由基活性与黄芩苷含量的相关性研究[J].中 国 中药杂志,2002,27 (8):97-100 ) ( 论文发表 论文下载 evaluation of root of scutellaria baical ens i s by . . scavenging _ J ] . Ch i n J Chin Materia Med, 2002,27 ( 8):97-100. ) ( [3] 王 霞,张璧涛,钟 乐.黄芩苷对 Neuro2A 细胞氧糖剥夺的 保护作用[J]. 中 国药理学通报,2005,21(10):1260-2. ) ( 3 Wang X , Z h ang B T , Zhong L. P ro t ective effects o f b a icalin o nNeuro2A cells u nder oxygen and g l ucose d e privation[J ] . Ch in Pharmacol Bull, 2005, 21 ( 10 ) : 1260-2. ) ( 4 汪丽娅,张占军,王 忠,等.黄芩苷对脑缺血大鼠的治疗作用 及对 caspase-3 的影响[J].天津中医药,2006,23(2): 143 - 5. ) ( 4T Wang L Y , Z hang Z J, Wa n g Z, et al. Eff e ct on therapy and ex- pression o f caspase-3 of baicalin i n r ats with cerebral ischemia[ J ] Tianjin J Tradit Chin Med, 2006, 23(2):143-5. ) ( 5 Li H Y, Hu J, Du L J , et a l. Comprehensive study of baicalin down-regulating N OD2 receptor expression of neurons wi t h ox y gen glucose d eprivation in vitro and cerebral ischemia-reperfusion in vivoJ ] . European J Pharmacol, 2010, 649: 92-9. ) ( 61 邢 杰.黄芩苷在动物体内的吸收和代谢研究[D].沈阳药 科大学,2005. ) ( 61 Xing J. Study o n the absorption and me t abolism of b acalin in a ni-mals D ]. S henyang Pharm Univer, 2005. ) ( 7 张陆军,邢东明,杜力军,等.静脉注射黄芩总苷后黄芩苷在大鼠血浆及大脑皮层的药物动力学比较[J].中国药理学通报, 2005,21(6):765-6. ) ( [7 ] Zhang L J, X ing D M, D u LJ, et al . C o mparative s t udy of t hepharmacokinetics of baicalin in rat p l asma an d cortex after intrave- nous administration o f total f lavonoids f rom Scutellariae Radix[ J ] .Chin Pharmacol Bull, 2005,21(6):765-6. ) ( [8 Jia Z Y , Bai ZZ,Jiang L G,et a l. O cula r pharmacokinetic s tudy on b aicalin i n lens of r a bbits following intragastric administration[ J]Graefes Archiv Cli n Exp Opthalmol, 2010, 248: 59-63. ) ( [9 ] C hen L,Zhang L G , D u L J, et al . Determination o f dopamine andits relativity of baicalin in rat nuclei a fter i ntravenous a d ministra- t ion o f flavonoids f rom s cutellariae r adix[ J ]. B iomed Ch r omatogr, 2007,21(1):84-8. ) Transport behavior of baicalin in PC12 cells ZHAO Shuang, LEI Fan, LI Hui-ying, WANG Yu-gang, CHAI Yu-shuang, DU Li-jun ( Protein Science Laboratory of the Ministry of Education, Laboratory of Pharmaceutical Sciences, School of Life Sciences and School ofMedicine, Tsinghua University, Beijing 100084, China) Abstract: AimTo investigate the transport behaviorof baicalin in PC12 cells and to explain the materialbasement of nervous system protection activity of baica-lin. Methods PC12 cells were used as for research.and HPLC and MS were applied to detect the transportbehavior of baicalin. ResultsWhen cells were trea-ted by baicalin of 0. 1 mg· L-, the concentration ofbaicalin in cells reached a peak when incubating for 30min and there was no baicalin left after 8 h; when thedosage of baicalin from 0. 05 mg ·L to 0.4mg·L was in administration, intracellular baicalin concentra-tion and administration dosage showed linear positivecorrelation; verapamil and nimodipine had effect ontransport; in addition, baicalein and 6-methoxy-baica-lin could be detected in the cells.ConclusionBaica-lin can transport into PC12 cells and can be affected bysome inhibitors,producing compounds. Key words: baicalin; transmembrane transport; PC12cells; baicalein; 6-methoxy-baicalin; P-glycoprotein
确定


还剩2页未读,是否继续阅读?
海德创业(北京)生物科技有限公司为您提供《中药中限度检查检测方案 》,该方案主要用于中药新药研发中临床前研究检测,参考标准--,《中药中限度检查检测方案 》用到的仪器有
相关方案
更多








