
方案详情
文
本研究采用标准双交叉方法 , 评价单次口服 20 mg 盐酸氟西汀分散片和胶囊后母体化合物氟西汀及其活性代谢产物去甲氟西汀的生物等效性。其中使用到了超声波清洗器、涡旋混合器等仪器。
方案详情

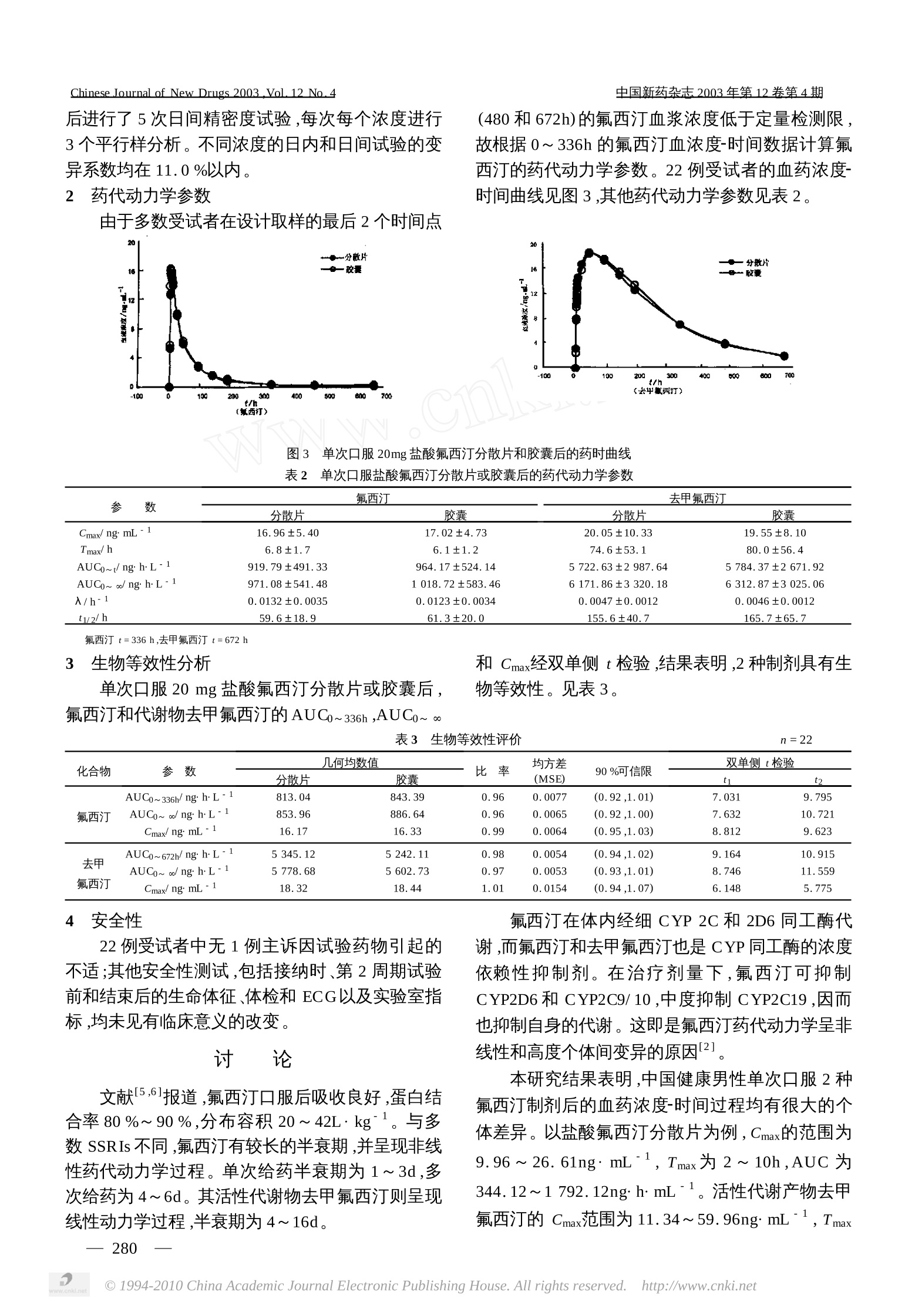
中国新药杂杂2003年第12卷第4期Chinese Journalof New Drugs 2003Vol. 12 No.4 中国新药杂志2003年第12卷第4期 临床药学 盐酸氟西汀分散片和胶囊的生物等效性研究 邵庆翔,李 Jj²,张美云,季周华,刘 平,韦 阳徐 方²,杜飞飞,崔 健,黄 彬 (1浙江省医学科学院,杭州310013;2中国科学院上海药物研究所,上海200031;3礼来(亚洲)公司,上海200001) [摘要飞 目的:研究盐酸氟西汀分散片和胶囊的生物等效性。方法:22例健康男性志愿者,随机分成2个序列。交叉单剂量口服20mg盐酸氟西汀分散片或胶囊,定时取血样,以液相-质谱联用法测定血浆样本中氟西汀及其代谢产物去甲氟西汀的浓度,并对2种制剂进行生物等效性评价。结果:口服盐酸氟西汀分散片或胶囊后,氟西汀的 Cmax 分别为(16.96 ±5.40)和(17.02±4.73)ng mL; Tmax分别为(6.8±1.7)和(6.1±1.2)h;AUC~以.分别为(971.08 ±541.48)和(1018.72±583.46)nghL;t1/2分别为(59.6±18.9)和(61.3±20.0)h。口服2种制剂后去甲氟西汀的 Cmax 分别为(20.05±10.33)和(19.55 ±8.10)ngmL; Tmax分别为(74.6±53.1)和(80.0±56.4)h;AUCo~ 分别(6171.86±3320.18)和(6312.87±3025.06)nghL;t1/2分别为(155.6±40.7)和(165.7±65.7)h。结论:20mg盐酸氟西汀分散片和20mg盐酸氟西汀胶囊为生物等效。 [关键词1 盐酸氟西汀;分散片;胶囊;液相-质谱联用;生物等效性 [中图分类号]R971.43 [文献标识码] A [文章编号]1003-3734(2003)04-0277-05 The bioequivalence study of fluoxetine HCl capsule and its dispersibletablets in healthy volunteers SHAO Qing-xiang',LI Chuan’,ZHANG Mei-yun' ,JI Zhou hua’,LIU Ping’,WEI Yang',XU Fang’,DU Fei-fei',CuIJian’,HUANGBin (1 Zhejiang Academy of Medical Sciences, Hangzhou 310013, China;2 ShanghaiInstitute of Materia Medica, Chinese Academy of Sciences, Shanghai 200031, China;3Eli Lilly Asia Inc, Shanghai 200001, China) Abstract] Objective : To evaluate the bioequivalence between fluoxetine HCl cap sule and its dis-persible tablets. Methods :In the study ,22 healthy male volunteers were randomized to receive a singleoral dose of 20mg fluoxetine HCl capsule or its dispersible tablets using cross-over design. Blood sampleswere taken according to design and the bioequivalence was evaluated by use of plasma concentrations offuoxetine and its metabolite determined by LC/MS/UV technique. Results : The data for fluoxetineHCl dispersible tablets and its capsule were expressed respectively as following : Cmax was (16.96 ±5.40) and (17.02 ±4.73) ng mL-1; Tmax was (6.8 ±1.7) and (6.1 ±1.2)h;AUCo~ owas (971.08 ±541.48) and (1 018.72 ±583.46)nghL; t/2 was (59.6 ±18.9) and (61.3 ±20.0) h. The dataof fluoxetine HCl metabolit (norfluoxzetine) in its dispersible tablets and cap sule were expressed respec-tively as following : Cmax was (20.05 ±10.33) and (19.55 ±8.10)ng mL1;Tmax was (74.6 ±53.1)and (80.0 ±56.4)h,AUCo~ cowas (6 171. 86 ±3320.18) and (6 312.87 ±3 025.06)ngh _; t1/2was (155. 6±40.7) and (165.7 ±65.7)h. Conclusion :The fluoxeting HCl capsule and its dispersibletablets are of bioequvalence. [Key words] fluoxetine HCl;dispersible tablet ;cap sule ;LC/MS/MS;bioequivalence 盐酸氟西汀,即(±)-N-甲基-3-苯基-3-[(2,2,2-三氟-P-甲苯基)-氧代]丙胺盐酸盐,为选择性5-羟色胺再摄取耳制剂(SSRI) ,通过提高突触间隙中5-羟色胺的浓度达到振奋情绪、改善抑郁的作用1,是全球使用最广泛的抗抑郁药。本品没有三环类抗抑郁剂常见的抗胆碱、心血管、镇静和体重增加等不良反应,健康人对其能良好耐受。口服后本品通过肝脏细胞色素 P450(CYP)2C和2D6 同工酶的首过效应,转化为去甲氟西汀,后者是氟西汀的主要活性代谢产物,具有与母体相似的药理学作用11,2]。本研究采用标准双交叉方法,评价单次口服 20mg盐酸氟西汀分散片和胶囊后母体化合物氟西汀及其活性代谢产物去甲氟西汀的生物等效性。 材料与方法 药品与试剂 盐酸氟西汀分散片(礼来公司,规格:每片20mg,批号:5333),盐酸氟西汀胶囊(礼来苏州制药有限公司分装,规格:每粒 20mg,批号:107131)。 盐酸氟西汀标准品(批号:001PD5,纯度99.8%)及盐酸去甲氟西汀标准品(批号:U096FK20,纯度98.4%)均由美国礼来公司提供。氘化氟西汀(纯度>99%)由中国科学院上海药物研究所提供。 乙腈、乙酸乙酯为美国 Tedia公司产 HPLC纯溶剂;甲酸铵(纯度>99.995%)为美国 Aldrich 公司产品;磷酸氢二钠(分析纯,纯度>99.0%)由中国医药(集团)上海化学试剂公司提供;氢氧化钠(分析纯,纯度>96.0%)由上海松凯实业有限公司生产。超纯水由上海药物研究所生产的去离子水经双重蒸馏制备而成。 2 仪器 液相-质谱联用(LC/MS/MS)分析系统:美国Agilent 公司1100系列四元泵、在线脱气机、自动进样器;美国AB公司 APF3000三级四极杆质谱检测器;系统工作软件为 Analyst。 HPLC/UV系统:美国 Agilent公司1100系列组合,包括:四元泵、在线脱气机、柱温箱、控温自动进样器和多波长紫外检测器; Zorbax SB - Ci;(50mm ×2.1mm)柱;系统工作软件为 ChemStation。 Techne 氮气吹干装置(美国);SpeedVac 离心真空蒸发仪(美国);Sorvall Biofuge pico 高速台式离心机(德国);Vibrax VXR小型摇床(德国);QL-901涡旋混合器(江苏);92-2定时恒温磁力搅拌器(上海);USC30221超声波清洗器(上海);SHB-3循环水 多用真空泵(河南)。 3 受试对象 22例健康男性志愿者,平均年龄(21.0±1.6)岁,平均体重(65.5±10.1)kg;平均体重指数(22.0±2.4)kg m2. 4 试验方案 采用随机、开放、双周期交叉对照设计。所有受试对象根据随机分组表先后服药2次,2次服药的间隔期为5周。 受试对象在上午7时左右以250mL 温开水送服盐酸氟西汀分散片1片或胶囊1粒。在服药前及服药后2,4,5,6,7,8,9,10,12,24,48,96,144,192,336,480,672h分别前臂静脉取血8mL置于肝素抗凝试管内并立即插入冰浴中,30min 内于4℃离心,分离血浆(约3~4mL),分装在2个5mL 聚丙烯管中,于-45℃冷冷冻保存。 在服药前(1h内)和服药后2,4,8,24h每次取血样时记录生命体征(坐位心率、血压,测血压前需静坐5min),并进行血常规、血液生化测定和尿常规分析,评价其安全性。整个研究过程中对各种不良事件作观测和记录。 5 分析方法13] 由于氟西汀在人体内经生物转化可产生活性代谢物去甲氟西汀,因此同时测定各时间点血浆中原药氟西汀及其代谢物去甲氟西汀的含量。 5.1 LC/MS/MS分析条件 5.1.1 液相色谱 柱温:室温(22℃);流动相:乙腈-水(274226,含0.02%的甲酸铵);等梯度洗脱;流速:0.2mL min;进样量:15uL;分析时间:5 min。 5.1.2 优化后的质谱 喷雾气:8;气帘气:10;碰撞气:5500.00;离子源电压:3kV;干燥气温度400℃;检测方法:MRM扫描;检测通道:310/44296/134,312/46 氟西汀、去甲氟西汀及化氟西汀3种化合物的二级质谱图见图1. 图1 氟西汀、去甲氟西汀及氘化氟西汀的二级质谱图 在以上条件下氟西汀和去甲氟西汀的色谱保留 时间(tR)分别为3.2和2.8 min ,氛化氟西汀作为内标物(I.S.),其 tp 为8.7 min。氟西汀、去甲氟西汀及氛化氟西汀未在服药前的血样中检出。3种化合物标准品溶液的MS/MS色谱图、空白血浆样品、标准血浆样品及服药后血浆样品的LC/MS/MS谱图见图2,血浆中其他组分对测定无明显干扰。 血浆中氟西汀及去甲氟西汀的LC/MS/MS色谱图 本研究所建立的方法对氟西汀和去甲氟西汀的最低检测限为0.28和0.27ngmL. 5.2 血浆样本的前处理方法 于200pL解冻后的人体血浆样品中加入10pL内标物溶液(氛化氟西汀,40ngmL)及 40pL 缓冲液[1 mol LKCl-1 mol LNaOH (25 :20.4),pH=12.5],混匀。用850pL 乙酸乙酯提取血样中氟西汀及去甲氟西汀:于1800rmin振摇10 min后,于13000r·min下离心5 min,取上清液700pL。再用700pL 乙酸乙酯第2次提取血样,提取方法同第1次),离心后取出上清液700uL。合并2次上清液,于40℃用氮气吹除溶剂(25 min)。将吹干后的提取残留物溶于 50uL乙腈-水(186:314,含0.02%甲酸铵,离心后,取15uL上清液用于LC/MS/MS分析。 5.3 标准曲线的制作 配制氟西汀浓度分别为25.0,8.33,2.78,0.93和0.309ng mL,以及浓度分别为21.9,7.30,2.43,0.81和0.270ngmL"的去甲氟西汀系列标准血浆溶液。迅速混摇2min,加 pH 12.5的 KCl-NaOH缓冲溶液(40uL)和内标物溶液(10pL),混和均匀后,按血浆处理方法处理测定。以被测化合物氟西汀或去甲氟西汀与内标物化氟西汀的峰面积之比对被测化合物的血药浓度进行线性回归,并以浓度的倒数(1/X)为加权系数,得到测定效应与浓度回归方程。 6 数据处理 取可检测到药物的最后4个时间点浓度C的自然对数值lnC对相应时间t进行线性回归,分别求得氟西汀和去甲氟西汀在人体内的末端相消除速率常数();用梯形法求算AUCo~t值;计算 AUC0~。=AUC~t+N/ tn, Cmax和 Tmax均为观测值。 为评价2种制剂的生物等效性,主要分析参数为经自然对数转换 AUC和 Cmax,采用适用于标准2×2交叉试验的方差分析方法。根据方差分析得出的均方差,参照分布计算均值比率的90%可信区间。AUC和 Cmax按 Schuirmann 标准双单侧检验程序.进行评价, Tmax采用非参数检验评价,统计软件为 SAS 8.1。 结 果 1 血药浓度测定方法的评价 在选定的条件下,氟西汀和去甲氟西汀的定量线性范围分别为0.31~25.0和0.27~21.9 ng·mL。氟西汀的工作曲线为 Y=0.473X-0.088(r=0.9995),去甲氟西汀的工作曲线为 Y=0.188X-0.022(r=0.9998)。在线性范围内,测定不同浓度氟西汀和去甲氟西汀的绝对回收率和变异系数,见表1。 表1 血浆样本的提取回收率 化合物 血药浓度/ngmL 回收率/% CV/% 氟西汀 0.28 58.9 +6.8 11.6 2.48 56.6 ±3.0 5.2 (n=5) 22.3 61.6±2.0 3.2 去甲氟西汀 0.27 47.6±8.0 16.8 2.43 39.8 ±1.9 4.8 (n=5) 21.9 40.3±2.4 6,0 化氟西汀 2.00 58.7 +2.8 4.8 (n=15) 以5种不同浓度的氟西汀和去甲氟西汀分别进行血样中化合物浓度测定的日内和日间精密度试验。分别在正式血样分析的开始、中间及结束时先 后进行了5次日间精密度试验,每次每个浓度进行3个平行样分析。不同浓度的日内和日间试验的变异系数均在11.0%以内。 2 药代动力学参数 由于多数受试者在设计取样的最后2个时间点 (480和672h)的氟西汀血浆浓度低于定量检测限,故根据0~336h的氟西汀血浓度-时间数据计算氟西汀的药代动力学参数。22例受试者的血药浓度-时间曲线见图3,其他药代动力学参数见表2. 图3 单次口服 20mg 盐酸氟西汀分散片和胶囊后的药时曲线 表2 单次口服盐酸氟西汀分散片或胶囊后的药代动力学参数 参 数 氟西汀 去甲氟西汀 分散片 胶囊 分散片 胶囊 Cmax/ng mL" 16.96 ±5.40 17.02±4.73 20.05±10.33 19.55 ±8.10 Tmax/h 6.8±1.7 6.1 ±1.2 74.6±53.1 80.0 ±56.4 AUCo~t/nghL 919.79 +491.33 964.17 +524.14 5722.63+2987.64 5784.37 ±2671.92 AUCo~ oonghL" 971.08+541.48 1018.72±583.46 6171.86 +3320.18 6 312.87 +3025.06 /h- 0.0132 ±0.0035 0.0123 ±0.0034 0.0047 ±0.0012 0.0046±0.0012 t1/2/h 59.6 ±18.9 61.3 ±20.0 155.6+40.7 165.7 +65.7 氟西汀 t=336h,去甲氟西汀 t=672h 生物等效性分析 和 Cmax经双单侧t检验,结果表明,2种制剂具有生物等效性。见表3。 单次口服20mg盐酸氟西汀分散片或胶囊后,氟西汀和代谢物去甲氟西汀的AUC0~336h,AUC0~。 表3 生物等效性评价 n=22 化合物 参数 几何均数值 比率 均方差 90%可信限 双单侧t检验 分散片 胶囊 (MSE) 11 12 AUC0~336h/nghL- 813.04 843.39 0.96 0.0077 (0.92,1.01) 7.031 9.795 氟西汀 AUC0~oonghL 853.96 886.64 0.96 0.0065 (0.92,1.00) 7.632 10.721 Cmax/ng mL 16.17 16.33 0.99 0.0064 (0.95,1.03) 8.812 9.623 去甲 AUC0~672h/nghL 5345.12 5 242.11 0.98 0.0054 (0.94,1.02) 9.164 10.915 AUCo~oonghL 5778.68 5602.73 0.97 0.0053 (0.93,1.01) 8.746 11.559 氟西汀 Cmax/ng mL- 18.32 18.44 1.01 0.0154 (0.94,1.07) 6.148 5.775 4 安全性 22例受试者中无1例主诉因试验药物引起的不适;其他安全性测试,包括接纳时、第2周期试验前和结束后的生命体征、体检和ECG以及实验室指标,均未见有临床意义的改变。 讨 论 文献15.6.报道,氟西汀口服后吸收良好,蛋白结合率80%~90%,分布容积20~42Lkgc。与多数SSRIs 不同,氟西汀有较长的半衰期,并呈现非线性药代动力学过程。单次给药半衰期为1~3d,多次给药为4~6d。其活性代谢物去甲氟西汀则呈现线性动力学过程,半衰期为4~16d。 氟西汀在体内经细 CYP 2C 和2D6 同工酶代谢,而氟西汀和去甲氟西汀也是 CYP 同工酶的浓度依赖性抑制剂。在治疗剂量下,氟西汀可抑制CYP2D6 和 CYP2C9/10,中度抑制 CYP2C19,因而也抑制自身的代谢。这即是氟西汀药代动力学呈非线性和高度个体间变异的原因21。 本研究结果表明,中国健康男性单次口服2种氟西汀制剂后的血药浓度-时间过程均有很大的个体差异。以盐酸氟西汀分散片为例, Cmax的范围为9.96~26.61ngmL,, T max 为2~10h,AUC为344.12~1 792.12nghmL。活性代谢产物去甲氟西汀的 Cmax范围为11.34~59.96ngmL,Tmax 从10~192h,AUC在3456.51~18 393.42ngh.L。代谢物的AUC明显高于母体,均值约为母体的6.4倍。 口服 20mg 氟西汀分散片和胶囊后,氟西汀AUC的90%可信限(0.92,1.00)和 Cmax的 90%可信限(0.95,1.03)分别落在0.80~1.25与0.7~1.43的等效范围内。其活性代谢产物去甲氟西汀的AUC, Cmax和 Tmax 在2种制剂之间均无明显差异。因此,可以认为口服盐酸氟西汀分散片和盐酸氟西汀胶囊为生物等效。 ( 「作者简介] 邵庆翔(1943-),女,研究员,主要从事临床药 理研究。联系电话:(0571)88883191。 ) ( 参 考 文 献 ) ( [ 1] C h eer SM,Goa KL. F luox e tine ,a review of its therapeutic poten- ) ( tial in the treatment of depression assoc :ated with physical illness [J].Drugs,2001 ,6 1 81 - 110. ) ( [2] Li C ,Ji Z,Nan F , e t a l . Liquid c hromatography/tandem ma s sspectrometry for t he d etermination of fluoxetine a nd its m ain a c-tive metabolite norfluoxetine in human p lasma with deuterated flu- oxetine as internal standard . Rapid Commun[J]. M a ss Sp e ctrom, 2002 ,16:1844- 1 850. ) ( [3] L iu J P,Chow SC . Design and analysis of bi o availability and b ioe-quivalence studies[A],1992,Marcel D ekker ,I N C. USA. ) ( [4] Moraes M O,Lerner FE,Corso G,et al. Fluoxetine bioequivalencestudy :quanification of fluoxetine and norfluoxetine b y liquid chro- m atography coupled to m ass s pectrometry[]. J Clin P harmacol, 1999 ,39 :1053 - 1061. ) ( [5] Baumann P. P harmacokinetic-pharmcodynamic relationship of th e selective serotonin reuptake inhibitors[J]. C lin Pharmacokinet ,1996.31444-469. ) 国产硫酸沙丁胺醇控释片的人体药代动力学与相对生物利用度 段京莉,黄 竞,吴 晨,严宝霞 (北京大学第三医院药剂科,北京100083) [摘要1 目的:研究国产硫酸沙丁胺醇渗透泵控释片与进口控释片的人体药代动力学与生物利用度。方法:男性健康受试者18例,单次及多次随机交叉口服7.2mg国产和8mg进口硫酸沙丁胺醇控释片2种制剂。用高效液相色谱荧光检测法测定血浆中沙丁胺醇浓度,并进行药代动力学和生物等效性研究。结果:单次给药后,2种制剂的 Cmax分别为(7.62±2.17)及(10.16 ±2.93)ug L; Tmax分别为(4.83±1.76)及(4.67 ±1.61)h;AUCo~t分别为(88.78±41.18)及(127.52 ±30.10)ug hL。国产硫酸沙丁胺醇控释片的相对生物利用度为(77.19±28.24)%。多次给药后,国产及进口硫酸沙丁胺醇控释片的 Cmax分别为(10.94±2.38)及(11.67 ±3.24)ug L; Tmax分别为(5.11±1.49)及(4.50±1.38) h;AUCss分别为(88.07±18.33)及(89.80±20.35)ughL;波动度DF分别为(76.69±43.89)%和(82.43±29.44)%。计算得硫酸沙丁胺醇控释片的相对生物利用度为(111.81±24.59)%。结论:试验制剂与参比制剂多次给药具有生物等效性。 「关键词1 硫酸沙丁胺醇;渗透泵控释片;生物利用度 [中图分类号] R974 [文献标识码]B [文章编号]1003-3734(2003)04-0281-04 Human pharmacokinetics and bioavailability of domestic salbuta molsulfate controlled release tablets DUAN Jing-li ,HUANGJing,WU Chen, YAN Bao-xia (Department of Pharmacy, Beijing University Third Hospital, Bejing 100083, China) Abstract Objective :To study the pharmacokinetics and bioavailability of domestic and import-ed salbutamol sulfate controlled release(CR) tablets. Methods :18 healthy male volunteers were receivedoral single-dose and multi-doses of 7.2mg domestic and 8mg improted salbutamol sulfate CR tablets byan open randomized 2 way crossover design. The plasma salbutamol sulfate concentrations were deter-mined by HPLC with fluorescence detection. Results :Data of single-dose for domestic and imported China Academic Journal Electronic Publishing House.All rights reserved. http://www.cnki.net
确定




还剩3页未读,是否继续阅读?
海德创业(北京)生物科技有限公司为您提供《化学药中生化特性检测方案 》,该方案主要用于化药新药研发中临床前研究检测,参考标准--,《化学药中生化特性检测方案 》用到的仪器有Branson超声波清洗机
推荐专场
相关方案
更多















