方案详情
文
本文参考《LS/T 6133-2018 粮油检验 主要谷物中16种真菌毒素的测定 液相色谱-串联质谱法》,采用岛津LCMS-8050建立了一种简单净化-液相色谱串联质谱联用同时检测谷物中16种真菌毒素的方法,该方法前处理快速、操作简单、重复性好、灵敏高,适合谷物中真菌毒素的高灵敏度检测。
方案详情

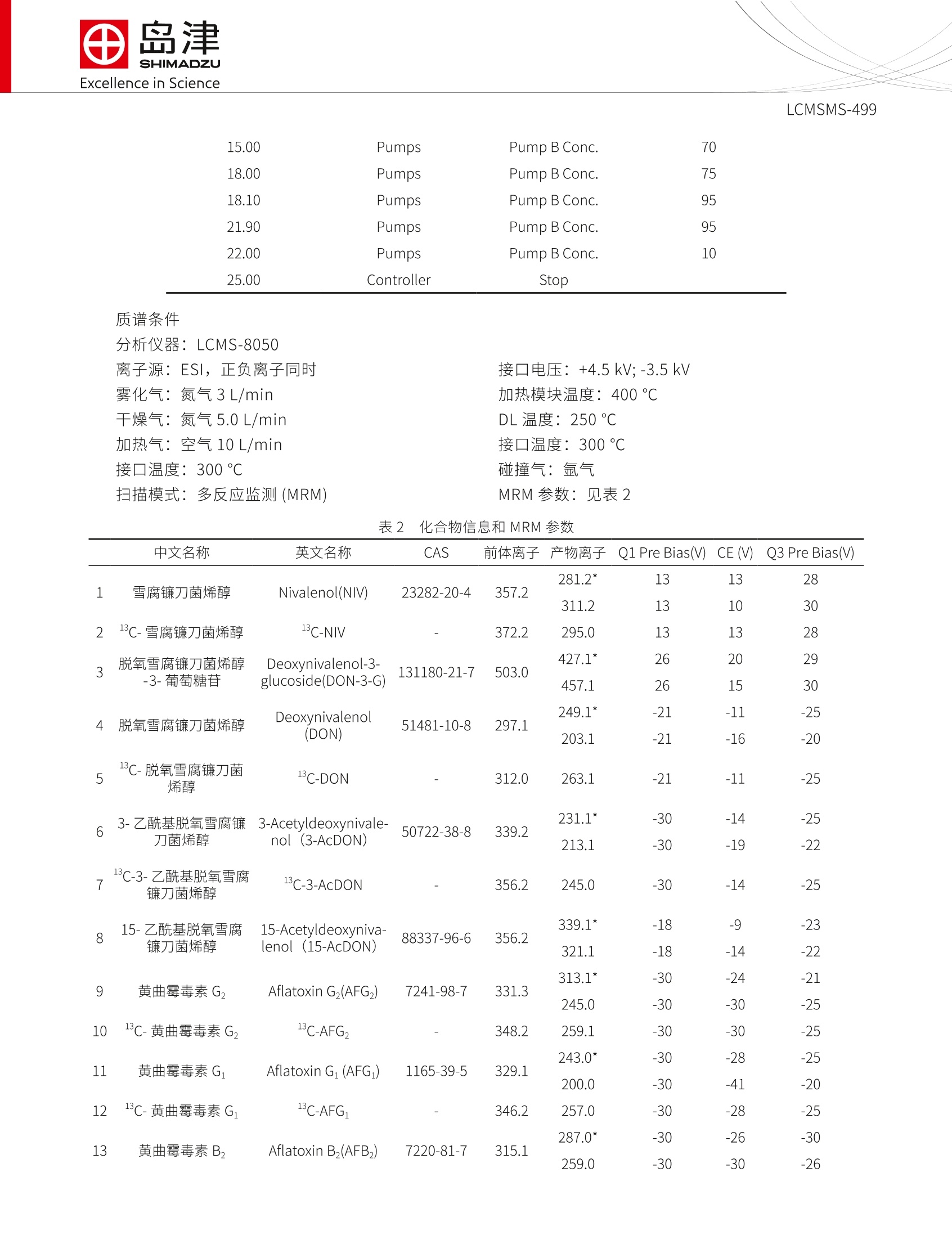
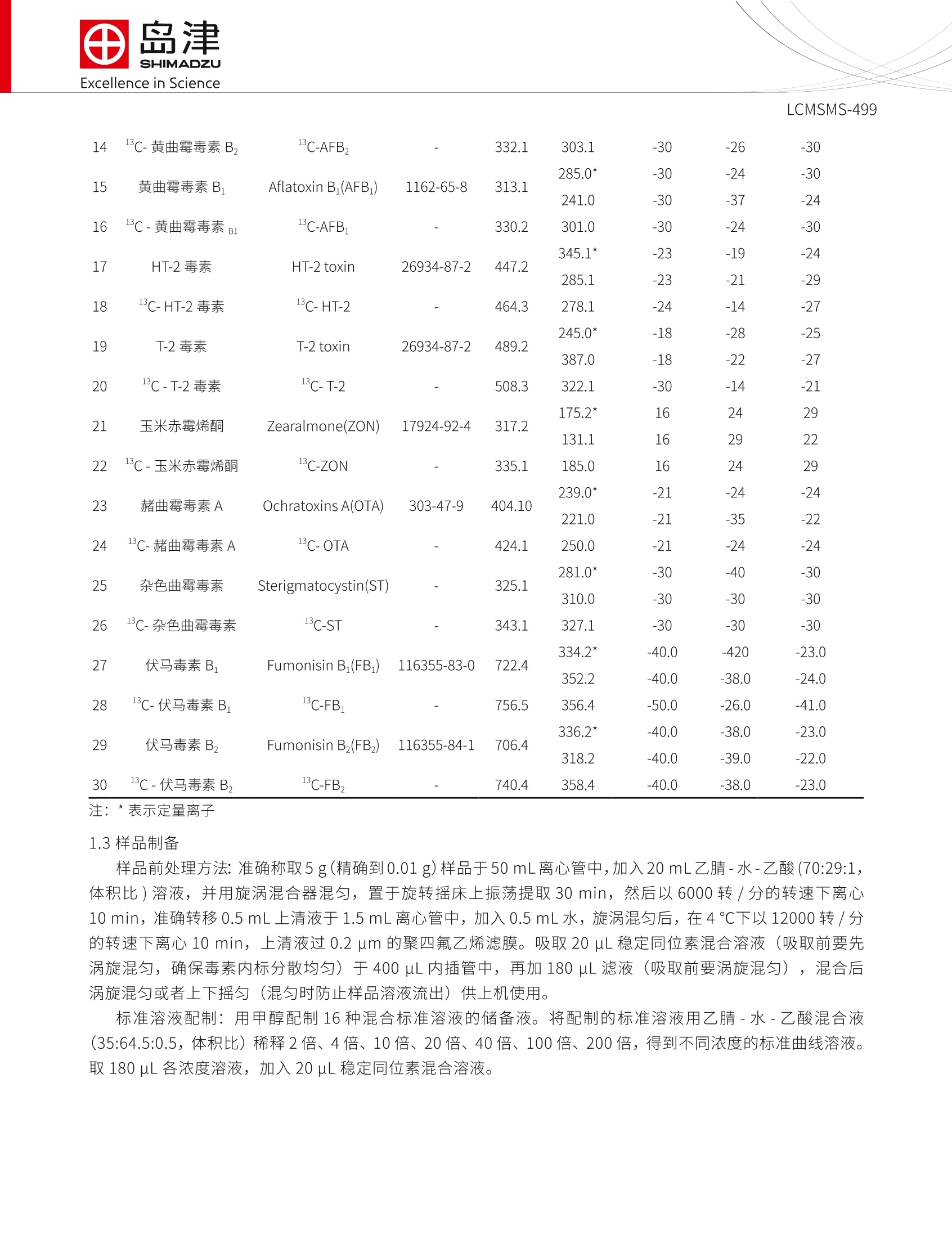
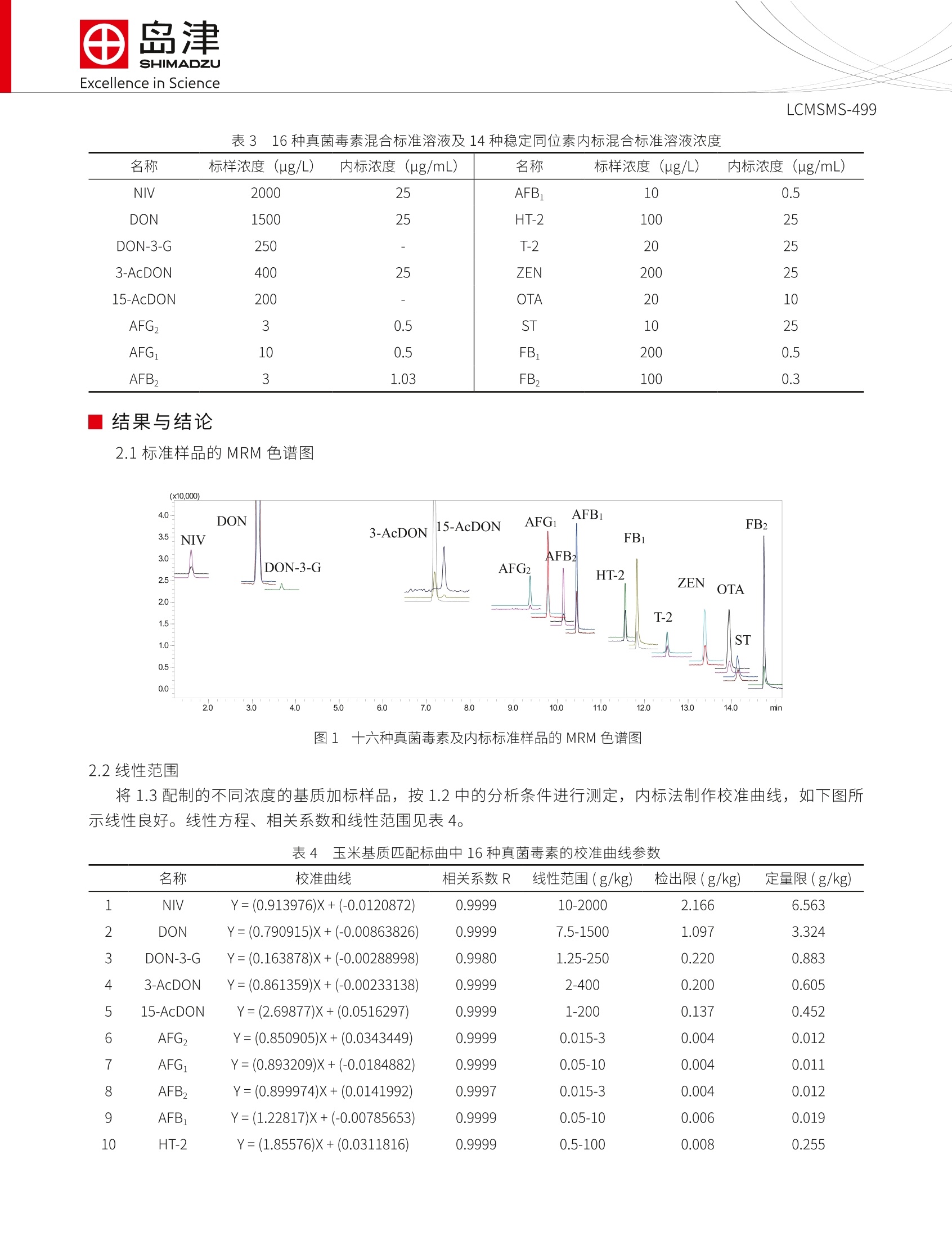
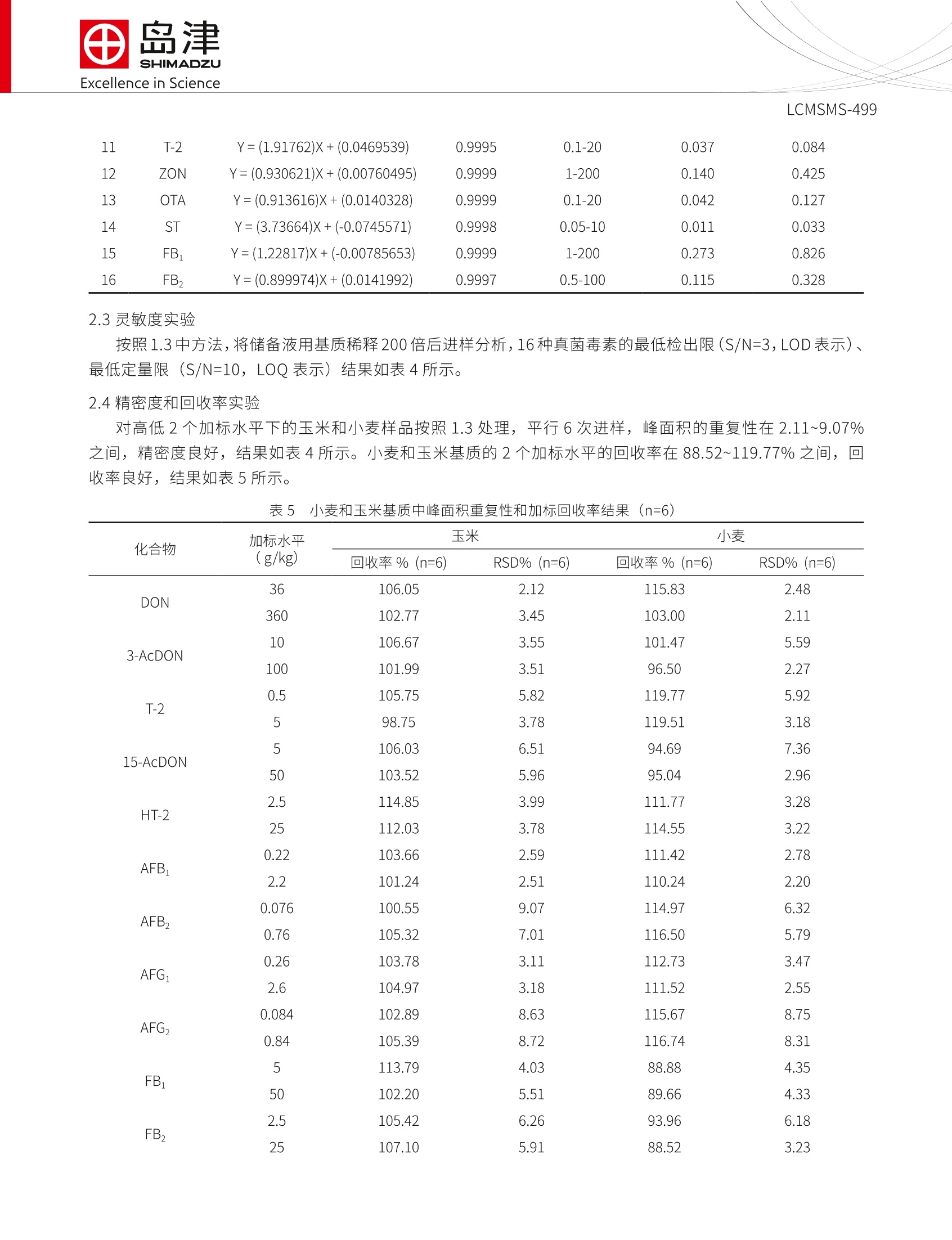
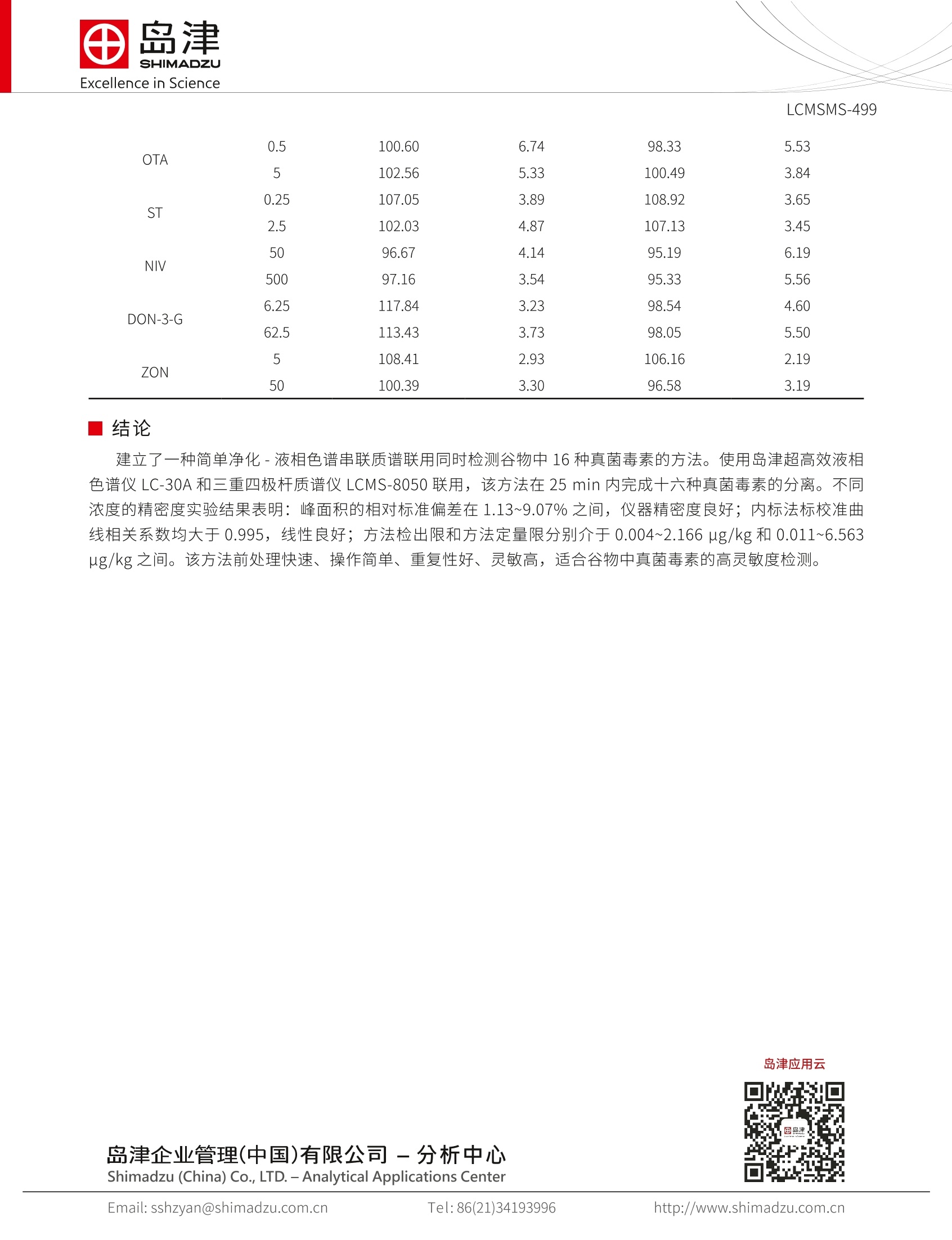
SSL-CA20-284Excellence in Science Excellence in ScienceLCMSMS-499 岛津企业管理(中国)有限公司-分析中心Shimadzu (China) Co., LTD.-Analytical Applications CenterEmail: sshzyan@shimadzu.com.cnTel:86(21)34193996http://www.shimadzu.com.cn LCMS-8050 测定谷物中的十六种真菌毒素 LCMSMS-499 摘要:本文建立了一种简单净化-稳定同位素稀释-液相色谱串联质谱联用同时检测谷物中16种真菌毒素的方法。该方法在25 min 内完成16种常见真菌毒素的分离,使用内标法定量分析。在小麦和玉米基质中内标法16种真菌毒素线性良好,校准曲线相关系数均大于0.995;峰面积的相对标准偏差在1.13~9.07%之间,仪器精密度良好;方法检出限和定量限分别介于0.004~2.166 ug/kg 和0.011~6.563 ug/kg 之间,能够满足日常分析要求。 关键词:高效液相色谱仪 三重四极杆质谱仪 粮食 真菌毒素 真菌毒素(Mycotoxins) 是产毒真菌在一定环境条件下产生的次级代谢产物,广泛污染农作物、食品及饲料等植物源性产品。可引起人类和动物急性或慢性中毒,部分已被证实具有致癌、致畸、致细胞突变的“三致”作用。。目前已知的真菌毒素有200多种,按其主要产毒菌种可分为曲霉菌毒素(如黄曲霉毒素、棕曲霉毒素等)、青霉菌毒素和镰刀菌毒素(如T-2毒素、HT-2毒素、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮 等)等几大类。我国、欧盟以及美国对粮食中各种毒素的限量和检测手段趋于严格。 本文参考粮油系统《LS/T 6133-2018粮油检验主要谷物中16种真菌毒素的测定液相色谱-串联质谱法》行标验证中的要求,使用岛津超高效液相色谱仪LC-30A和三重四极极质谱 LCMS-8050联用,建立了谷物中十六种常见真菌毒素的超高效液相色谱-三重四级杆串联质谱联用的分析方法,供相关人员参考。 实验部分 1.1仪器 岛津超高效液相色谱仪 LC-30A与三重四极杆质谱仪 LCMS-8050联用系统。具体配置为: LC-30AD×2输液泵, DGU-20A5 在线脱气机, SIL-30AC 自动进样器, CTO-30A柱温箱, CBM-20A系统控制器,LCMS-8050三重四极杆质谱仪, LabSolutions Ver. 5.91 色谱工作站。 1.2分析条件 液相色谱条件 分析仪器: LC-30A系统 色谱柱: UHPLC C18 2.1 mml.D.×100 mmL., 1.6 um 流动相:A相-水(含1%乙酸,5mM乙酸铵);B相-甲醇 流速:0.4mL/min 进样体积:1uL 柱温:35℃ 洗脱方式:梯度洗脱,B相初始浓度为10%,时间程序见表1。 表1 梯度洗脱时间程序 Time(min) Module Command Value 2.00 Pumps Pump B Conc. 10 3.00 Pumps Pump B Conc. 20 7.00 Pumps Pump B Conc. 24 10.50 Pumps Pump B Conc. 30 13.50 Pumps Pump B Conc. 60 15.00 Pumps Pump B Conc. 70 18.00 Pumps Pump B Conc. 75 18.10 Pumps Pump B Conc. 95 21.90 Pumps Pump B Conc. 95 22.00 Pumps Pump B Conc. 10 25.00 Controller Stop 质谱条件 分析仪器:LCMS-8050 离子源:ESI,正负离子同时 接口电压:+4.5kV;-3.5kV 雾化气:氮气3L/min 加热模块温度:400℃ 干燥气:氮气5.0L/min DL温度:250℃ 加热气:空气10 L/min接口温度:300℃ 接口温度:300℃ 碰撞气:氩气 扫描模式:多反应监测(MRM) MRM 参数:见表2 表 2化合物信息和MRM 参数 中文名称 英文名称 CAS 前体离子产物离子 Q1 Pre Bias(V) CE (V) Q3 Pre Bias(V) 雪腐镰刀菌烯醇 Nivalenol(NIV) 23282-20-4 357.2 281.2* 311.2 13 13 13 10 28 30 2 3 13c-雪腐镰刀菌烯醇 13C-NIV 372.2 295.0 13 13 28 脱氧雪腐镰刀菌烯醇 Deoxynivalenol-3- 131180-21-7 503.0 427.1* 26 20 29 -3-葡萄糖苷 glucoside(DON-3-G) 457.1 26 15 30 4 脱氧雪腐镰刀菌烯醇 Deoxynivalenol 51481-10-8 297.1 249.1" -21 -11 -25 (DON) 203.1 -21 -16 -20 5 13c-脱氧雪腐廉刀菌 烯醇 13C-DON 312.0 263.1 -21 -11 -25 6 7 13 8 3-乙酰基脱氧雪腐镰 3-Acetyldeoxynivale- 50722-38-8 339.2 231.1 -30 -14 -25 刀菌烯醇 nol (3-AcDON) 213.1 -30 -19 -22 C-3-乙酰基脱氧雪腐 镰刀菌烯醇 13C-3-AcDON 356.2 245.0 -30 -14 -25 15-Acetyldeoxyniva- lenol (15-AcDON) 88337-96-6 356.2 15-乙酰基脱氧雪腐 339.1 -9 -23 镰刀菌烯醇 321.1 -14 -22 9 黄曲霉毒素G, Aflatoxin G,(AFG,) 7241-98-7 331.3 313.1 245.0 -30 -24 -30 -21 10 1C-黄曲霉毒素G, 13C-AFG, 348.2 259.1 -30 11 黄曲霉毒素G, Aflatoxin G1(AFG1) 1165-39-5 329.1 243.0 -28 200.0 -30 -41 12 C-黄曲霉毒素 G 1C-AFG, 346.2 257.0 -30 -28 -25 287.0* -30 -26 -30 13 黄曲霉毒素B, Aflatoxin B,(AFB,) 7220-81-7 315.1 259.0 -30 -30 -26 LCMSMS-499 14 13C-黄曲霉毒素Bz 13C-AFB, 332.1 303.1 -30 15 黄曲霉毒素B Aflatoxin B(AFB) 1162-65-8 313.1 285.0 241.0 -30 -37 -30 -24 16 C-黄曲霉毒素, 13C-AFB, 330.2 301.0 -24 -30 345.1 -19 -24 17 HT-2毒素 HT-2 toxin 26934-87-2 447.2 285.1 -21 -29 18 1C-HT-2毒素 C-HT-2 464.3 278.1 -24 -14 -27 19 T-2毒素 T-2 toxin 26934-87-2 489.2 245.0* 387.0 -18 -28 -22 -25 -27 20 -C-T-2毒素 13C-T-2 508.3 322.1 -14 -21 175.2* 16 24 29 21 玉米赤霉烯酮 Zearalmone(ZON) 17924-92-4 317.2 131.1 16 29 22 22 C-玉米赤霉烯酮 C-ZON 335.1 185.0 16 24 29 239.0* -21 -24 -24 23 赭曲霉毒素A Ochratoxins A(OTA) 303-47-9 404.10 221.0 -21 -35 -22 24 C-赭曲霉毒素A 13C-OTA 424.1 250.0 -21 -24 -24 281.0* -40 -30 25 杂色曲霉毒素 Sterigmatocystin(ST) 325.1 310.0 -30 -30 26 1C-杂色曲霉毒素 13C-ST 343.1 327.1 -30 -30 -30 334.2 -40.0 -420 -23.0 27 伏马毒素B FumonisinB(FB) 116355-83-0 722.4 352.2 -40.0 -38.0 -24.0 28 C-伏马毒素 B 3C-FB, 756.5 356.4 -50.0 -26.0 -41.0 336.2* -40.0 -38.0 -23.0 29 伏马毒素B, Fumonisin B,(FB,) 116355-84-1 706.4 318.2 -40.0 -39.0 -22.0 30 1C-伏马毒素B, 13C-FB, 740.4 358.4 -40.0 -38.0 -23.0 注:*表示定量离子 1.3样品制备 样品前处理方法:准确称取5g(精确到0.01 g)样品于50mL离心管中,加入20mL乙腈-水-乙酸(70:29:1,体积比)溶液,并用旋涡混合器混匀,置于旋转摇床上振荡提取30 min, 然后以6000转/分的转速下离心10min, 准确转移0.5 mL 上清液于1.5 mL离心管中,加入0.5mL水, 旋涡混匀后,在4℃下以12000转/分的转速下离心10 min, 上清液过0.2 um 的聚四氟乙烯滤膜。吸取20 uL稳定同位素混合溶液(吸取前要先涡旋混匀,确保毒素内标分散均匀)于400 uL内插管中,再加180 uL滤液(吸取前要涡旋混匀),混合后涡旋混匀或者上下摇匀(混匀时防止样品溶液流出)供上机使用。 标准溶液配制:用甲醇配制16种混合标准溶液的储备液。将配制的标准溶液用乙腈-水-乙酸混合液(35:64.5:0.5,体积比)稀释2倍、4倍、10倍、20倍、40倍、100倍、200倍,得到不同浓度的标准曲线溶液。取 180 uL各浓度溶液,加入20 uL稳定同位素混合溶液。 表3 16种真菌毒素混合标准溶液及14种稳定同位素内标混合标准溶液浓度 名称 标样浓度((ug/L) 内标浓度 (ug/mL) 名称 标样浓度((ug/L) 内标浓度(ug/mL) NIV 2000 25 AFB 10 0.5 DON 1500 25 HT-2 100 25 DON-3-G 250 T-2 20 25 3-AcDON 400 25 ZEN 200 25 15-AcDON 200 OTA 20 10 AFG, 3 0.5 ST 10 25 AFG: 10 0.5 FB: 200 0.5 AFB, 3 1.03 FB, 100 0.3 纪结果与结论 2.1标准样品的 MRM 色谱图 图1-十六种真菌毒素及内标标准样品的 MRM 色谱图 2.2线性范围 将1.3配制的不同浓度的基质加标样品,按1.2中的分析条件进行测定,内标法制作校准曲线,如下图所示线性良好。线性方程、相关系数和线性范围见表4。 表4 玉米基质匹配标袖中16种真菌毒素的校准曲线参数 名称 校准曲线 相关系数R 线性范围(g/kg) 检出限(g/kg) 定量限(g/kg) 1 NIV Y=(0.913976)X+(-0.0120872) 0.9999 10-2000 2.166 6.563 2 DON Y=(0.790915)X+(-0.00863826) 0.9999 7.5-1500 1.097 3.324 3 DON-3-G Y=(0.163878)X+(-0.00288998) 0.9980 1.25-250 0.220 0.883 4 3-AcDON Y=(0.861359)X+(-0.00233138) 0.9999 2-400 0.200 0.605 5 15-AcDON Y=(2.69877)X+(0.0516297) 0.9999 1-200 0.137 0.452 6 AFG, Y=(0.850905)X+(0.0343449) 0.9999 0.015-3 0.004 0.012 7 AFG Y=(0.893209)X+(-0.0184882) 0.9999 0.05-10 0.004 0.011 8 AFB, Y=(0.899974)X+(0.0141992) 0.9997 0.015-3 0.004 0.012 9 AFB Y=(1.22817)X+(-0.00785653) 0.9999 0.05-10 0.006 0.019 10 HT-2 Y=(1.85576)X+(0.0311816) 0.9999 0.5-100 0.008 0.255 11 T-2 Y=(1.91762)X+(0.0469539) 0.9995 0.1-20 0.037 0.084 12 ZON Y=(0.930621)X+(0.00760495) 0.9999 1-200 0.140 0.425 13 OTA Y=(0.913616)X+(0.0140328) 0.9999 0.1-20 0.042 0.127 14 ST Y=(3.73664)X+(-0.0745571) 0.9998 0.05-10 0.011 0.033 15 FB Y=(1.22817)X+(-0.00785653) 0.9999 1-200 0.273 0.826 16 FB, Y=(0.899974)X+(0.0141992) 0.9997 0.5-100 0.115 0.328 2.3灵敏度实验 按照1.3中方法,将储备液用基质稀释200倍后进样分析,16种真菌毒素的最低检出限(S/N=3,LOD表示)、最低定量限 (S/N=10, LOQ表示)结果如表4所示。 2.4精密度和回收率实验 对高低2个加标水平下的玉米和小麦样品按照1.3处理,平行6次进样,峰面积的重复性在2.11~9.07%之间,精密度良好,结果如表4所示。小麦和玉米基质的2个加标水平的回收率在 88.52~119.77%之间,回收率良好,结果如表5所示。 表5 小麦和玉米基质中峰面积重复性和加标回收率结果(n=6) 化合物 加标水平 玉米 小麦 (g/kg) 回收率%(n=6) RSD% (n=6) 回收率%(n=6) RSD% (n=6) DON 36 106.05 2.12 115.83 2.48 360 102.77 3.45 103.00 2.11 3-AcDON 10 106.67 3.55 101.47 5.59 100 101.99 3.51 96.50 2.27 T-2 0.5 105.75 5.82 119.77 5.92 5 98.75 3.78 119.51 3.18 15-AcDON 5 106.03 6.51 94.69 7.36 50 103.52 5.96 95.04 2.96 HT-2 2.5 114.85 3.99 111.77 3.28 25 112.03 3.78 114.55 3.22 AFB 0.22 103.66 2.59 111.42 2.78 2.2 101.24 2.51 110.24 2.20 AFB, 0.076 100.55 9.07 114.97 6.32 0.76 105.32 7.01 116.50 5.79 AFG 0.26 103.78 3.11 112.73 3.47 2.6 104.97 3.18 111.52 2.55 AFG, 0.084 102.89 8.63 115.67 8.75 0.84 105.39 8.72 116.74 8.31 FB 5 113.79 4.03 88.88 4.35 50 102.20 5.51 89.66 4.33 FB, 2.5 105.42 6.26 93.96 6.18 25 107.10 5.91 88.52 3.23 LCMSMS-499 OTA 0.5 100.60 6.74 98.33 5.53 5 102.56 5.33 100.49 3.84 ST 0.25 107.05 3.89 108.92 3.65 2.5 102.03 4.87 107.13 3.45 NIV 50 96.67 4.14 95.19 6.19 500 97.16 3.54 95.33 5.56 DON-3-G 6.25 117.84 3.23 98.54 4.60 62.5 113.43 3.73 98.05 5.50 ZON 5 108.41 2.93 106.16 2.19 50 100.39 3.30 96.58 3.19 结论 建立了一种简单净化-液相色谱串联质谱联用同时检测谷物中16种真菌毒素的方法。使用岛津超高效液相色谱仪 LC-30A 和三重四极杆质谱仪 LCMS-8050联用,该方法在25 min 内完成十六种真菌毒素的分离。不同浓度的精密度实验结果表明:峰面积的相对标准偏差在1.13~9.07%之间,仪器精密度良好;内标法标校准曲线相关系数均大于 0.995,线性良好;方法检出限和方法定量限分别介于0.004~2.166 ug/kg 和 0.011~6.563ug/kg 之间。该方法前处理快速、操作简单、重复性好、灵敏高,适合谷物中真菌毒素的高灵敏度检测。 岛津应用云 建立了一种简单净化-液相色谱串联质谱联用同时检测谷物中16种真菌毒素的方法。使用岛津超高效液相色谱仪LC-30A和三重四极杆质谱仪LCMS-8050联用,该方法在25 min内完成十六种真菌毒素的分离。不同浓度的精密度实验结果表明:峰面积的相对标准偏差在1.13~9.07%之间,仪器精密度良好;内标法标校准曲线相关系数均大于0.995,线性良好;方法检出限和方法定量限分别介于0.004~2.166 μg/kg和0.011~6.563 μg/kg之间。该方法前处理快速、操作简单、重复性好、灵敏高,适合谷物中真菌毒素的高灵敏度检测。
确定

还剩4页未读,是否继续阅读?
岛津企业管理(中国)有限公司为您提供《谷物中十六种真菌毒素检测方案(液质联用仪)》,该方案主要用于其他粮食加工品中真菌毒素检测,参考标准--,《谷物中十六种真菌毒素检测方案(液质联用仪)》用到的仪器有岛津三重四极杆液质谱联用仪LCMS-8050
推荐专场
相关方案
更多
该厂商其他方案
更多
















