
方案详情
文
制备出效价高,特异性强,稳定性好的抗体是免疫学实验取得成功的基础,抗体质量的好坏直接影响着研究者研究的成败,不同的免疫学实验方法(如ELISA,IHC,IP,ICC,SDS-PAGE, WB等)对抗体的效价,浓度和纯度有不同的要求。我们知道,一般免疫血清中含有特异性抗体和非特异性抗体,血清蛋白以及其他各种杂蛋白等,在制备特异性抗体过程中当抗体的效价达到实验预期之后,我们所制备的抗体的纯度关键取决于所选择的纯化方法。
方案详情

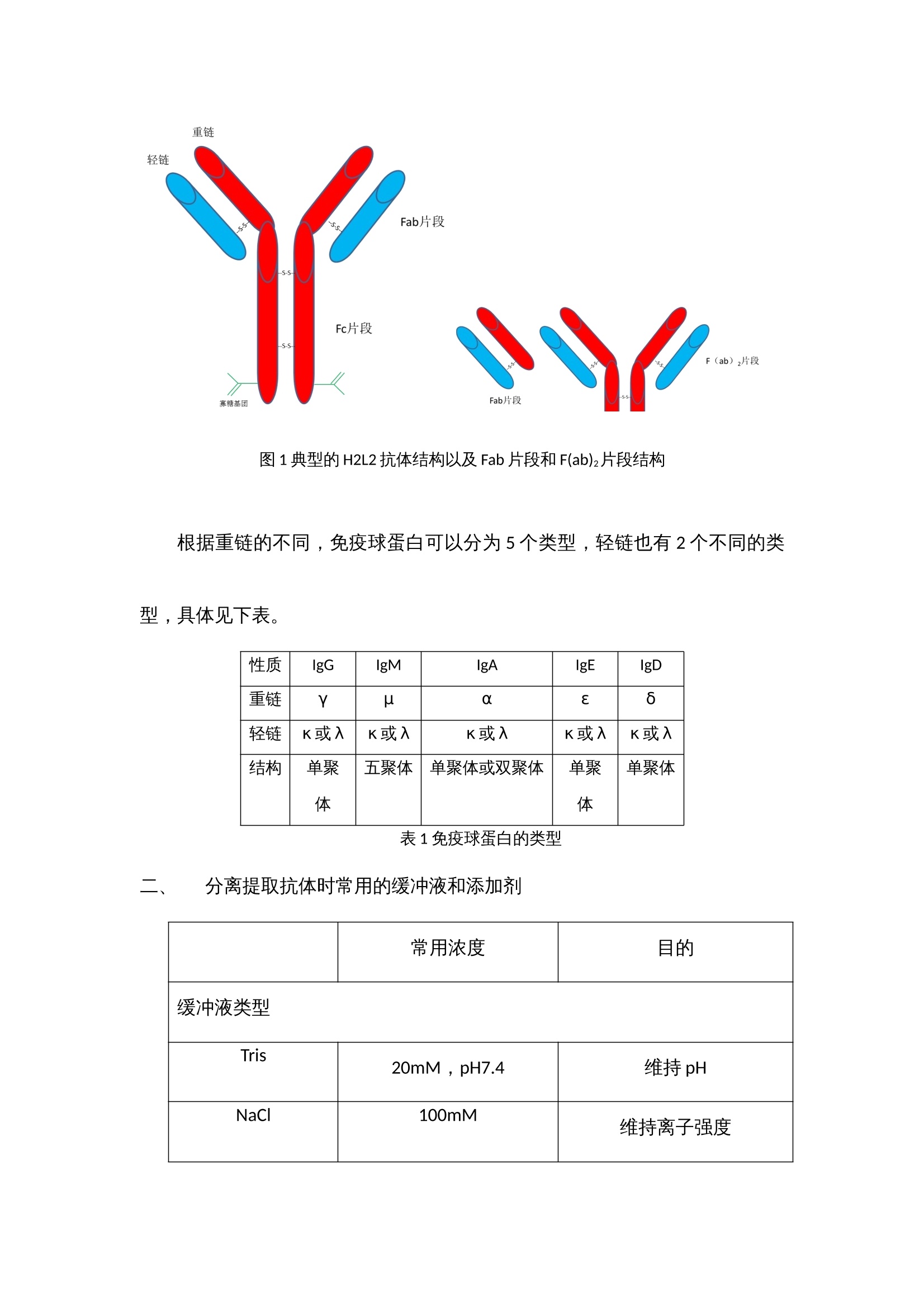
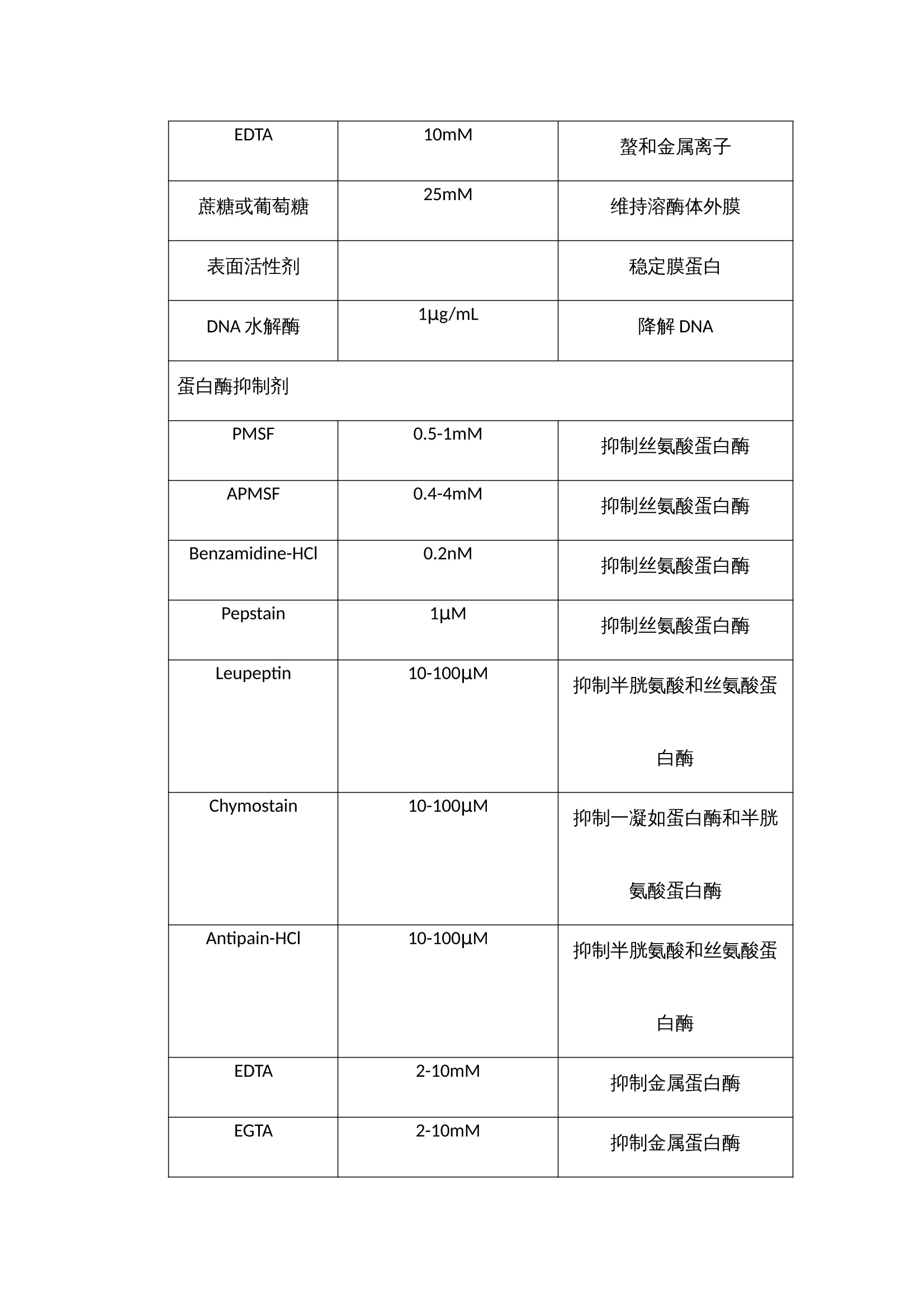
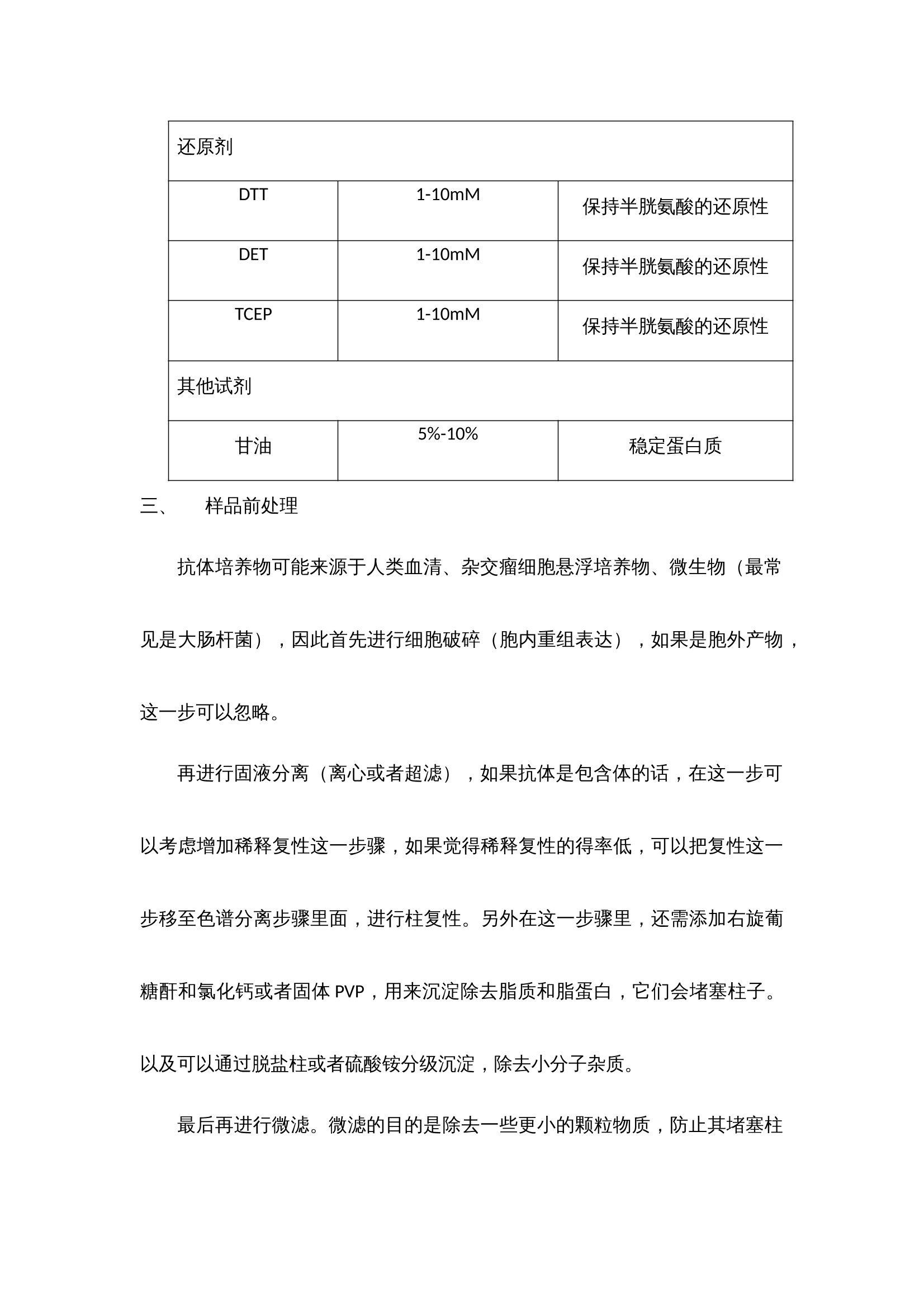
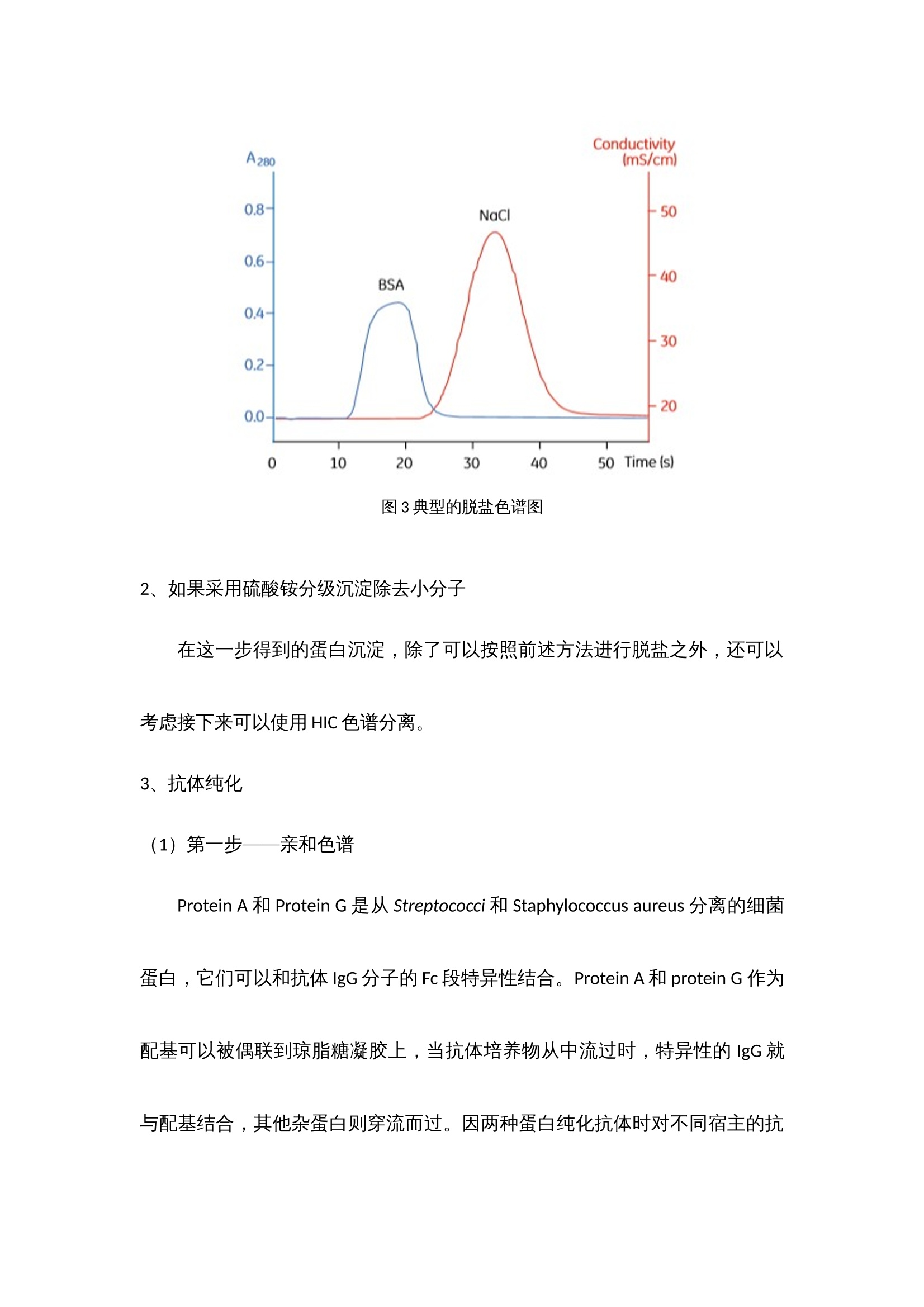
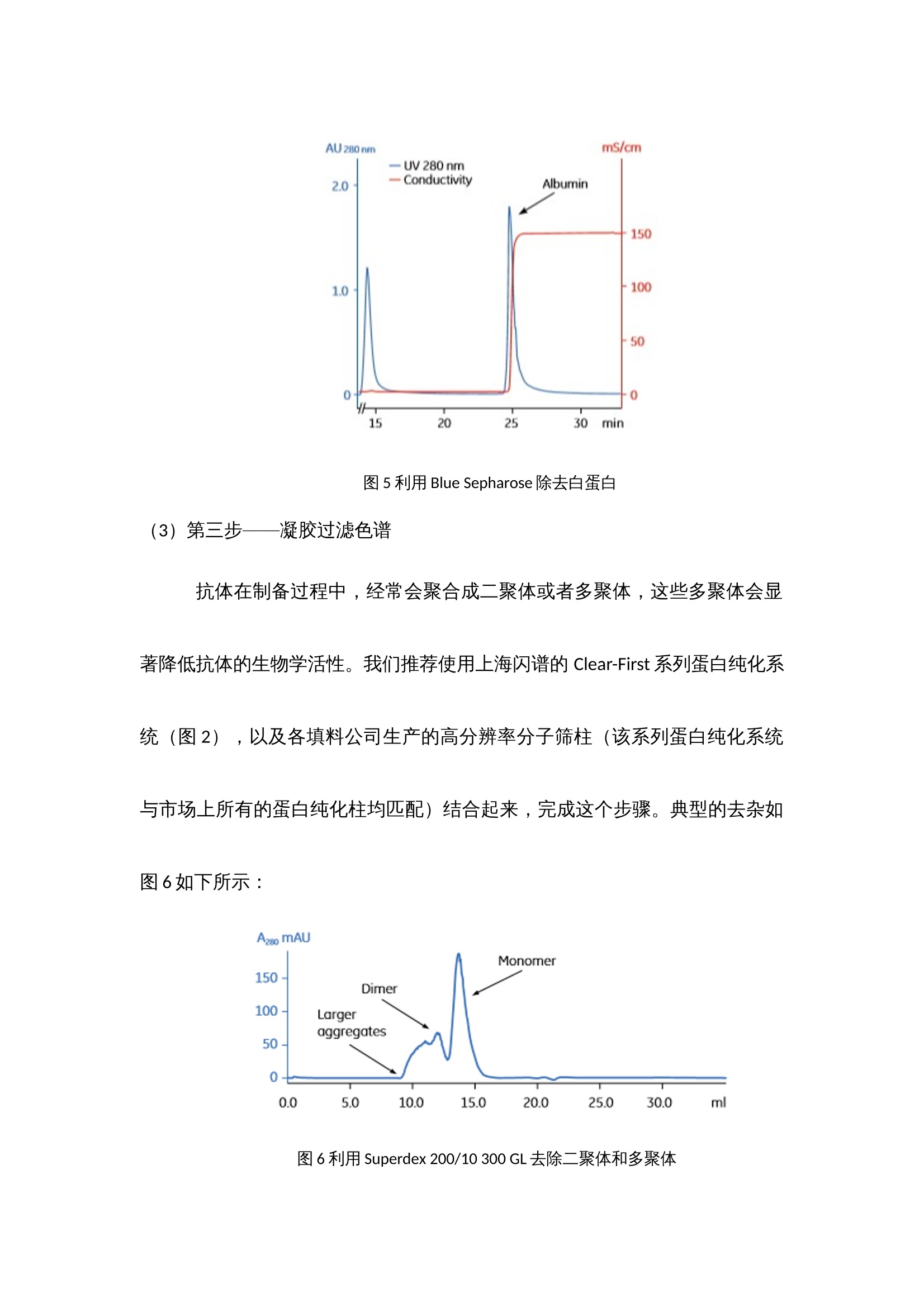
抗体纯化产品解决方案 蛋白纯化系统——酶标仪 制备出效价高,特异性强,稳定性好的抗体是免疫学实验取得成功的基础,抗体质量的好坏直接影响着研究者研究的成败,不同的免疫学实验方法(如ELISA,IHC,IP,ICC,SDS-PAGE, WB等)对抗体的效价,浓度和纯度有不同的要求。我们知道,一般免疫血清中含有特异性抗体和非特异性抗体,血清蛋白以及其他各种杂蛋白等,在制备特异性抗体过程中当抗体的效价达到实验预期之后,我们所制备的抗体的纯度关键取决于所选择的纯化方法。 抗体简介 抗体属于免疫球蛋白,免疫球蛋白都有一个共同的组成,既有两条类似重链和两条轻链,结构示意图见图1。 图1 典型的H2L2抗体结构以及Fab片段和F(ab)2片段结构 根据重链的不同,免疫球蛋白可以分为5个类型,轻链也有2个不同的类型,具体见下表。 性质 IgG IgM IgA IgE IgD 重链 γ μ α ε δ 轻链 κ或λ κ或λ κ或λ κ或λ κ或λ 结构 单聚体 五聚体 单聚体或双聚体 单聚体 单聚体 表1 免疫球蛋白的类型 分离提取抗体时常用的缓冲液和添加剂 常用浓度 目的 缓冲液类型 Tris 20mM,pH7.4 维持pH NaCl 100mM 维持离子强度 EDTA 10mM 螯和金属离子 蔗糖或葡萄糖 25mM 维持溶酶体外膜 表面活性剂 稳定膜蛋白 DNA水解酶 1μg/mL 降解DNA 蛋白酶抑制剂 PMSF 0.5-1mM 抑制丝氨酸蛋白酶 APMSF 0.4-4mM 抑制丝氨酸蛋白酶 Benzamidine-HCl 0.2nM 抑制丝氨酸蛋白酶 Pepstain 1μM 抑制丝氨酸蛋白酶 Leupeptin 10-100μM 抑制半胱氨酸和丝氨酸蛋白酶 Chymostain 10-100μM 抑制一凝如蛋白酶和半胱氨酸蛋白酶 Antipain-HCl 10-100μM 抑制半胱氨酸和丝氨酸蛋白酶 EDTA 2-10mM 抑制金属蛋白酶 EGTA 2-10mM 抑制金属蛋白酶 还原剂 DTT 1-10mM 保持半胱氨酸的还原性 DET 1-10mM 保持半胱氨酸的还原性 TCEP 1-10mM 保持半胱氨酸的还原性 其他试剂 甘油 5%-10% 稳定蛋白质 样品前处理 抗体培养物可能来源于人类血清、杂交瘤细胞悬浮培养物、微生物(最常见是大肠杆菌),因此首先进行细胞破碎(胞内重组表达),如果是胞外产物,这一步可以忽略。 再进行固液分离(离心或者超滤),如果抗体是包含体的话,在这一步可以考虑增加稀释复性这一步骤,如果觉得稀释复性的得率低,可以把复性这一步移至色谱分离步骤里面,进行柱复性。另外在这一步骤里,还需添加右旋葡糖酐和氯化钙或者固体PVP,用来沉淀除去脂质和脂蛋白,它们会堵塞柱子。以及可以通过脱盐柱或者硫酸铵分级沉淀,除去小分子杂质。 最后再进行微滤。微滤的目的是除去一些更小的颗粒物质,防止其堵塞柱子。 上海闪谱针对这一步骤中所需的仪器——如离心机、超声破碎仪等等正在紧张研制中,不久将陆续推向市场,与客户们见面。 四、纯化策略 1、如果采用脱盐除去小分子 我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的脱盐柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成脱盐这个步骤。典型的脱盐色谱图3如下所示: 图2 上海闪谱Clear-First系列蛋白纯化系统中的一款,Clear-First-2000型 图3 典型的脱盐色谱图 2、如果采用硫酸铵分级沉淀除去小分子 在这一步得到的蛋白沉淀,除了可以按照前述方法进行脱盐之外,还可以考虑接下来可以使用HIC色谱分离。 3、抗体纯化 (1)第一步——亲和色谱 Protein A和Protein G是从Streptococci和Staphylococcus aureus分离的细菌蛋白,它们可以和抗体IgG分子的Fc段特异性结合。Protein A和protein G 作为配基可以被偶联到琼脂糖凝胶上,当抗体培养物从中流过时,特异性的IgG就与配基结合,其他杂蛋白则穿流而过。因两种蛋白纯化抗体时对不同宿主的抗体的结合能力不同,我们需要具体情况具体对待,分别选择protein A 或者protein G,或者是protein A/protein G组合。一般推荐小鼠单抗IgG2a,IgG2b,IgG3,兔,人,猪的多克隆抗体用protein A纯化,而小鼠单抗IgG1, 大鼠单抗,小鼠,大鼠,山羊的多克隆抗体则选择用protein G纯化。 另外,蛋白质L对Igs的X轻链具有高亲和力,可纯化完整抗体和抗体的片段。因此,可用其对IgM和Fab及F(ab)2片段进行纯化。除了这些特性,我们还发现纯化结果不稳定,并且其半衰期短。但是,蛋白质L是一种替代型“广谱”抗体纯化基质。蛋白质L与免疫球蛋白的K轻链结合,这对于纯化抗体片段及完整的IgG、IgM和IgA很有用。 我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的G蛋白或A蛋白柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成亲和色谱这个步骤。典型的亲和色谱图4如下所示: 图4 利用蛋白G填料柱纯化Fab片段 (2)第二步——离子交换色谱、亲和色谱或疏水作用色谱(如果需要) 这一步主要目的是去除特异性杂蛋白,如白蛋白、铁传递蛋白等,我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的离子交换、亲和、疏水作用柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成这个步骤。典型的去杂如图5如下所示: 图5 利用Blue Sepharose除去白蛋白 (3)第三步——凝胶过滤色谱 抗体在制备过程中,经常会聚合成二聚体或者多聚体,这些多聚体会显著降低抗体的生物学活性。我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的高分辨率分子筛柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成这个步骤。典型的去杂如图6如下所示: 图6 利用Superdex 200/10 300 GL去除二聚体和多聚体 五、抗体的检测 根据蛋白纯化系统软件上的出峰位置,从自动收集架上有选择性的选取部分样品管进行SDS-PAGE(蛋白电泳)验证,考马斯亮蓝染色,观察条带的分子量大小与抗体分子是否吻合,观察是否还有其他的杂带,若有杂带,估测下所需蛋白的含量,一般超过90%就不需要进一步的纯化,只需要进行脱盐处理即可(有时可能还需要切掉标签蛋白部分)。若想对所得蛋白进行更进一步的验证,Western blot,将蛋白转至NC膜上,用标签抗体或该蛋白的特异性单抗进行孵育,清洗后,再孵育上带有HRP的二抗,再一次清洗后,就可以将NC膜放进化学发光成像系统中,再讲混合好的A、B液滴在膜上,就可以用化学发光成像系统进行拍摄,观察产生条带(斑点)位置,浓淡等,从而进一步验证蛋白的正确性。 得到纯的蛋白后,最后一般都要进行浓度的测定,现在最普及的是用BCA试剂盒测定,按操作说明加好孵育后,用酶标仪(上海闪谱生物,ReadMax 1900全波长光吸收酶标仪,见图7)在562 nm处读取OD值,在通过酶标仪上的结果处理,即可计算得出待测蛋白的浓度,无需人员通过EXCEL自己计算。这样就基本完成了蛋白分离纯化的整个过程。 最后酶免疫分析,如ELISA,是免疫分析的主要部分。理解了ELISA的实验原理,就可以理解其他以抗原-抗体反应为基础的实验原理。ELISA方法能检测任何给定抗体的特异性、亲和性、浓度及灵敏性。下面是一个进行直接或间接ELISA的典型的操作步骤。直接与间接ELISA的操作步骤基本是相同的。不同之处是与目标配体相结合的一抗是否是酶标抗体。在直接分析中,一抗是酶标抗体;在间接分析中,一抗不是酶标抗体,酶标记在识别一抗的二抗上。 图7上海闪谱生物ReadMax 1900全波长光吸收酶标仪 ELISA实验的典型操作步骤: (1) 在进行分析前,应首先建立酶标板每孔的加样策略。永远要设立空白孔作为阴性对照。例如,如果打算对血清或者培养上清进行抗体浓度滴定,我们常常是仅在奇数孔包被抗原,而如果是进行杂交瘤的阳性筛选,除了一个或者两个孔留作空白对照外,我们将整块板包被抗原。 (2) 进行分析前最好过夜包被酶标板。这样,目标配体便有足够的时间与孔结合。孔板的包被可以放置在4℃,最长时间可达2周。用包被缓冲液稀释配体至2〜5μg/mL。每个孔用0. 1ml的稀释配体进行包被。 (3) 进行分析时,从冰箱里拿出包被板。倒掉孔中的液体,用洗涤缓冲液洗整块孔板3次。每次洗涤后要在滤纸上扣干残留液体。 (4) 向所有孔中加 300 μL的封闭缓冲液。将孔板于室温静置至少30 min,然后用洗漆缓冲液洗孔板一次。 (5) 在封闭孔板的同时,用PBS稀释一抗。如果是筛选抗血清,我们通常进行 5 倍的倍比稀释,起始点为 1: 50或 1 : 100。如要检测培养上清,进行2倍的倍比稀释可能是适当的。如果是检测杂交瘤培养上清,不要做任何的稀释。 (6) 如果一抗是酶标抗体,可将其进行 1 : 100〜1 : 10000稀释。可对几个稀释度的抗体进行测定。 (7) 向孔中加人 100W稀释的抗体。对于系列稀释的抗体,最好每个稀释度加双份孔(一共4个孔)。37℃孵育孔板 30min。 (8) 孵育后,用洗涤缓冲液洗板 3 次。每次洗涤后要在滤纸上扣干残留液体。 (9) 如果向孔板加入的是酶标一抗,越过此步而直接进行步骤10。 间接分析中,向所有的孔中加人 100 μL稀释的酶标二抗。30℃ 孵育孔板30 min。 (10) 用洗涤缓冲液洗孔板 5次。每次洗涤后要在滤纸上扣干残留液体。 (11) 向所有的孔中加入100 μL的TMB底物。观察颜色的变化。让颜色反应到阴性对照显示轻微的颜色。这种现象未必会发生。如果不发生,5〜10 min后终止反应。 (12) 用 50:1 的终止液终止反应。 (13) 在酶标仪上以适当的吸光波长读取孔板颜色强度的数值。TMB底物自身的背景读数为450nmol/L。数值越大,抗体越多。 六、经济上的考虑: 除了上述方法,还有其他方法也可以用于抗体纯化,包括聚乙二醇(polyethylene glycol,PEG) 吸附、羟基磷灰石色谱法(hydroxyapatite chromatography) 和疏水作用色谱法(hydrophobic interaction chromatography)。 抗体的最终用途将决定其被纯化的方法。对于快速廉价的纯化,沉淀法是足够的。如果用于诊断,蛋白质A/G 纯化的抗体能提供好的检测结果的重复性。如果用于临床前期研究,蛋白质A/G 纯化的抗体再用IEC、SEC 或者疏水作用色谱法进一步纯化将得到高度纯化的抗体。对于任何临床前期和临床应用,抗体纯化必须在无菌和低内毒素的条件下进行,必须符合当地(如食品和药物管理部门)的法定操作程序。因此,对于每个实验室 ,每种抗体应该确定一种纯化策略。 抗体纯化产品解决方案蛋白纯化系统——酶标仪 制备出效价高,特异性强,稳定性好的抗体是免疫学实验取得成功的基础,抗体质量的好坏直接影响着研究者研究的成败,不同的免疫学实验方法(如ELISA,IHC,IP,ICC,SDS-PAGE, WB等)对抗体的效价,浓度和纯度有不同的要求。我们知道,一般免疫血清中含有特异性抗体和非特异性抗体,血清蛋白以及其他各种杂蛋白等,在制备特异性抗体过程中当抗体的效价达到实验预期之后,我们所制备的抗体的纯度关键取决于所选择的纯化方法。一、 抗体简介抗体属于免疫球蛋白,免疫球蛋白都有一个共同的组成,既有两条类似重链和两条轻链,结构示意图见图1。图1 典型的H2L2抗体结构以及Fab片段和F(ab)2片段结构根据重链的不同,免疫球蛋白可以分为5个类型,轻链也有2个不同的类型,具体见下表。性质IgGIgMIgAIgEIgD重链γμαεδ轻链κ或λκ或λκ或λκ或λκ或λ结构单聚体五聚体单聚体或双聚体单聚体单聚体表1 免疫球蛋白的类型二、 分离提取抗体时常用的缓冲液和添加剂常用浓度目的缓冲液类型Tris20mM,pH7.4维持pHNaCl100mM维持离子强度EDTA10mM螯和金属离子蔗糖或葡萄糖25mM维持溶酶体外膜表面活性剂稳定膜蛋白DNA水解酶1μg/mL降解DNA蛋白酶抑制剂PMSF0.5-1mM抑制丝氨酸蛋白酶APMSF0.4-4mM抑制丝氨酸蛋白酶Benzamidine-HCl0.2nM抑制丝氨酸蛋白酶Pepstain1μM抑制丝氨酸蛋白酶Leupeptin10-100μM抑制半胱氨酸和丝氨酸蛋白酶Chymostain10-100μM抑制一凝如蛋白酶和半胱氨酸蛋白酶Antipain-HCl10-100μM抑制半胱氨酸和丝氨酸蛋白酶EDTA2-10mM抑制金属蛋白酶EGTA2-10mM抑制金属蛋白酶还原剂DTT1-10mM保持半胱氨酸的还原性DET1-10mM保持半胱氨酸的还原性TCEP1-10mM保持半胱氨酸的还原性其他试剂甘油5%-10%稳定蛋白质三、 样品前处理抗体培养物可能来源于人类血清、杂交瘤细胞悬浮培养物、微生物(最常见是大肠杆菌),因此首先进行细胞破碎(胞内重组表达),如果是胞外产物,这一步可以忽略。再进行固液分离(离心或者超滤),如果抗体是包含体的话,在这一步可以考虑增加稀释复性这一步骤,如果觉得稀释复性的得率低,可以把复性这一步移至色谱分离步骤里面,进行柱复性。另外在这一步骤里,还需添加右旋葡糖酐和氯化钙或者固体PVP,用来沉淀除去脂质和脂蛋白,它们会堵塞柱子。以及可以通过脱盐柱或者硫酸铵分级沉淀,除去小分子杂质。最后再进行微滤。微滤的目的是除去一些更小的颗粒物质,防止其堵塞柱子。上海闪谱针对这一步骤中所需的仪器——如离心机、超声破碎仪等等正在紧张研制中,不久将陆续推向市场,与客户们见面。四、纯化策略1、如果采用脱盐除去小分子 我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的脱盐柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成脱盐这个步骤。典型的脱盐色谱图3如下所示:图2 上海闪谱Clear-First系列蛋白纯化系统中的一款,Clear-First-2000型图3 典型的脱盐色谱图2、如果采用硫酸铵分级沉淀除去小分子在这一步得到的蛋白沉淀,除了可以按照前述方法进行脱盐之外,还可以考虑接下来可以使用HIC色谱分离。3、抗体纯化(1)第一步——亲和色谱Protein A和Protein G是从Streptococci和Staphylococcus aureus分离的细菌蛋白,它们可以和抗体IgG分子的Fc段特异性结合。Protein A和protein G 作为配基可以被偶联到琼脂糖凝胶上,当抗体培养物从中流过时,特异性的IgG就与配基结合,其他杂蛋白则穿流而过。因两种蛋白纯化抗体时对不同宿主的抗体的结合能力不同,我们需要具体情况具体对待,分别选择protein A 或者protein G,或者是protein A/protein G组合。一般推荐小鼠单抗IgG2a,IgG2b,IgG3,兔,人,猪的多克隆抗体用protein A纯化,而小鼠单抗IgG1, 大鼠单抗,小鼠,大鼠,山羊的多克隆抗体则选择用protein G纯化。另外,蛋白质L对Igs的X轻链具有高亲和力,可纯化完整抗体和抗体的片段。因此,可用其对IgM和Fab及F(ab)2片段进行纯化。除了这些特性,我们还发现纯化结果不稳定,并且其半衰期短。但是,蛋白质L是一种替代型“广谱”抗体纯化基质。蛋白质L与免疫球蛋白的K轻链结合,这对于纯化抗体片段及完整的IgG、IgM和IgA很有用。我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的G蛋白或A蛋白柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成亲和色谱这个步骤。典型的亲和色谱图4如下所示:图4 利用蛋白G填料柱纯化Fab片段(2)第二步——离子交换色谱、亲和色谱或疏水作用色谱(如果需要)这一步主要目的是去除特异性杂蛋白,如白蛋白、铁传递蛋白等,我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的离子交换、亲和、疏水作用柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成这个步骤。典型的去杂如图5如下所示:图5 利用Blue Sepharose除去白蛋白(3)第三步——凝胶过滤色谱抗体在制备过程中,经常会聚合成二聚体或者多聚体,这些多聚体会显著降低抗体的生物学活性。我们推荐使用上海闪谱的Clear-First系列蛋白纯化系统(图2),以及各填料公司生产的高分辨率分子筛柱(该系列蛋白纯化系统与市场上所有的蛋白纯化柱均匹配)结合起来,完成这个步骤。典型的去杂如图6如下所示:图6 利用Superdex 200/10 300 GL去除二聚体和多聚体五、抗体的检测根据蛋白纯化系统软件上的出峰位置,从自动收集架上有选择性的选取部分样品管进行SDS-PAGE(蛋白电泳)验证,考马斯亮蓝染色,观察条带的分子量大小与抗体分子是否吻合,观察是否还有其他的杂带,若有杂带,估测下所需蛋白的含量,一般超过90%就不需要进一步的纯化,只需要进行脱盐处理即可(有时可能还需要切掉标签蛋白部分)。若想对所得蛋白进行更进一步的验证,Western blot,将蛋白转至NC膜上,用标签抗体或该蛋白的特异性单抗进行孵育,清洗后,再孵育上带有HRP的二抗,再一次清洗后,就可以将NC膜放进化学发光成像系统中,再讲混合好的A、B液滴在膜上,就可以用化学发光成像系统进行拍摄,观察产生条带(斑点)位置,浓淡等,从而进一步验证蛋白的正确性。得到纯的蛋白后,最后一般都要进行浓度的测定,现在最普及的是用BCA试剂盒测定,按操作说明加好孵育后,用酶标仪(上海闪谱生物,ReadMax 1900全波长光吸收酶标仪,见图7)在562 nm处读取OD值,在通过酶标仪上的结果处理,即可计算得出待测蛋白的浓度,无需人员通过EXCEL自己计算。这样就基本完成了蛋白分离纯化的整个过程。最后酶免疫分析,如ELISA,是免疫分析的主要部分。理解了ELISA的实验原理,就可以理解其他以抗原-抗体反应为基础的实验原理。ELISA方法能检测任何给定抗体的特异性、亲和性、浓度及灵敏性。下面是一个进行直接或间接ELISA的典型的操作步骤。直接与间接ELISA的操作步骤基本是相同的。不同之处是与目标配体相结合的一抗是否是酶标抗体。在直接分析中,一抗是酶标抗体;在间接分析中,一抗不是酶标抗体,酶标记在识别一抗的二抗上。图7上海闪谱生物ReadMax 1900全波长光吸收酶标仪ELISA实验的典型操作步骤:(1) 在进行分析前,应首先建立酶标板每孔的加样策略。永远要设立空白孔作为阴性对照。例如,如果打算对血清或者培养上清进行抗体浓度滴定,我们常常是仅在奇数孔包被抗原,而如果是进行杂交瘤的阳性筛选,除了一个或者两个孔留作空白对照外,我们将整块板包被抗原。(2) 进行分析前最好过夜包被酶标板。这样,目标配体便有足够的时间与孔结合。孔板的包被可以放置在4℃,最长时间可达2周。用包被缓冲液稀释配体至2〜5μg/mL。每个孔用0. 1ml的稀释配体进行包被。(3) 进行分析时,从冰箱里拿出包被板。倒掉孔中的液体,用洗涤缓冲液洗整块孔板3次。每次洗涤后要在滤纸上扣干残留液体。(4) 向所有孔中加 300 μL的封闭缓冲液。将孔板于室温静置至少30 min,然后用洗漆缓冲液洗孔板一次。(5) 在封闭孔板的同时,用PBS稀释一抗。如果是筛选抗血清,我们通常进行 5 倍的倍比稀释,起始点为 1: 50或 1 : 100。如要检测培养上清,进行2倍的倍比稀释可能是适当的。如果是检测杂交瘤培养上清,不要做任何的稀释。(6) 如果一抗是酶标抗体,可将其进行 1 : 100〜1 : 10000稀释。可对几个稀释度的抗体进行测定。(7) 向孔中加人 100W稀释的抗体。对于系列稀释的抗体,最好每个稀释度加双份孔(一共4个孔)。37℃孵育孔板 30min。(8) 孵育后,用洗涤缓冲液洗板 3 次。每次洗涤后要在滤纸上扣干残留液体。(9) 如果向孔板加入的是酶标一抗,越过此步而直接进行步骤10。 间接分析中,向所有的孔中加人 100 μL稀释的酶标二抗。30℃ 孵育孔板30 min。(10) 用洗涤缓冲液洗孔板 5次。每次洗涤后要在滤纸上扣干残留液体。(11) 向所有的孔中加入100 μL的TMB底物。观察颜色的变化。让颜色反应到阴性对照显示轻微的颜色。这种现象未必会发生。如果不发生,5〜10 min后终止反应。(12) 用 50:1 的终止液终止反应。(13) 在酶标仪上以适当的吸光波长读取孔板颜色强度的数值。TMB底物自身的背景读数为450nmol/L。数值越大,抗体越多。六、经济上的考虑:除了上述方法,还有其他方法也可以用于抗体纯化,包括聚乙二醇(polyethylene glycol,PEG) 吸附、羟基磷灰石色谱法(hydroxyapatite chromatography) 和疏水作用色谱法(hydrophobic interaction chromatography)。抗体的最终用途将决定其被纯化的方法。对于快速廉价的纯化,沉淀法是足够的。如果用于诊断,蛋白质A/G 纯化的抗体能提供好的检测结果的重复性。如果用于临床前期研究,蛋白质A/G 纯化的抗体再用IEC、SEC 或者疏水作用色谱法进一步纯化将得到高度纯化的抗体。对于任何临床前期和临床应用,抗体纯化必须在无菌和低内毒素的条件下进行,必须符合当地(如食品和药物管理部门)的法定操作程序。因此,对于每个实验室 ,每种抗体应该确定一种纯化策略。
确定









还剩12页未读,是否继续阅读?
上海闪谱生物科技公司为您提供《抗体中分离纯化检测方案(蛋白质纯化)》,该方案主要用于生物发酵中分离纯化检测,参考标准--,《抗体中分离纯化检测方案(蛋白质纯化)》用到的仪器有Clear First-3000型蛋白纯化系统、ReadMax 1900型光吸收全波长酶标仪
推荐专场
相关方案
更多
















